最新高考化学 工艺流程图 题型分类

化学工艺流程1
1. Li
4Ti
5
O
12
和LiFePO
4
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO
3
,还含
2
有少量MgO、SiO
2等杂质)来制备,工艺流程如下:
3
4
回答下列问题:
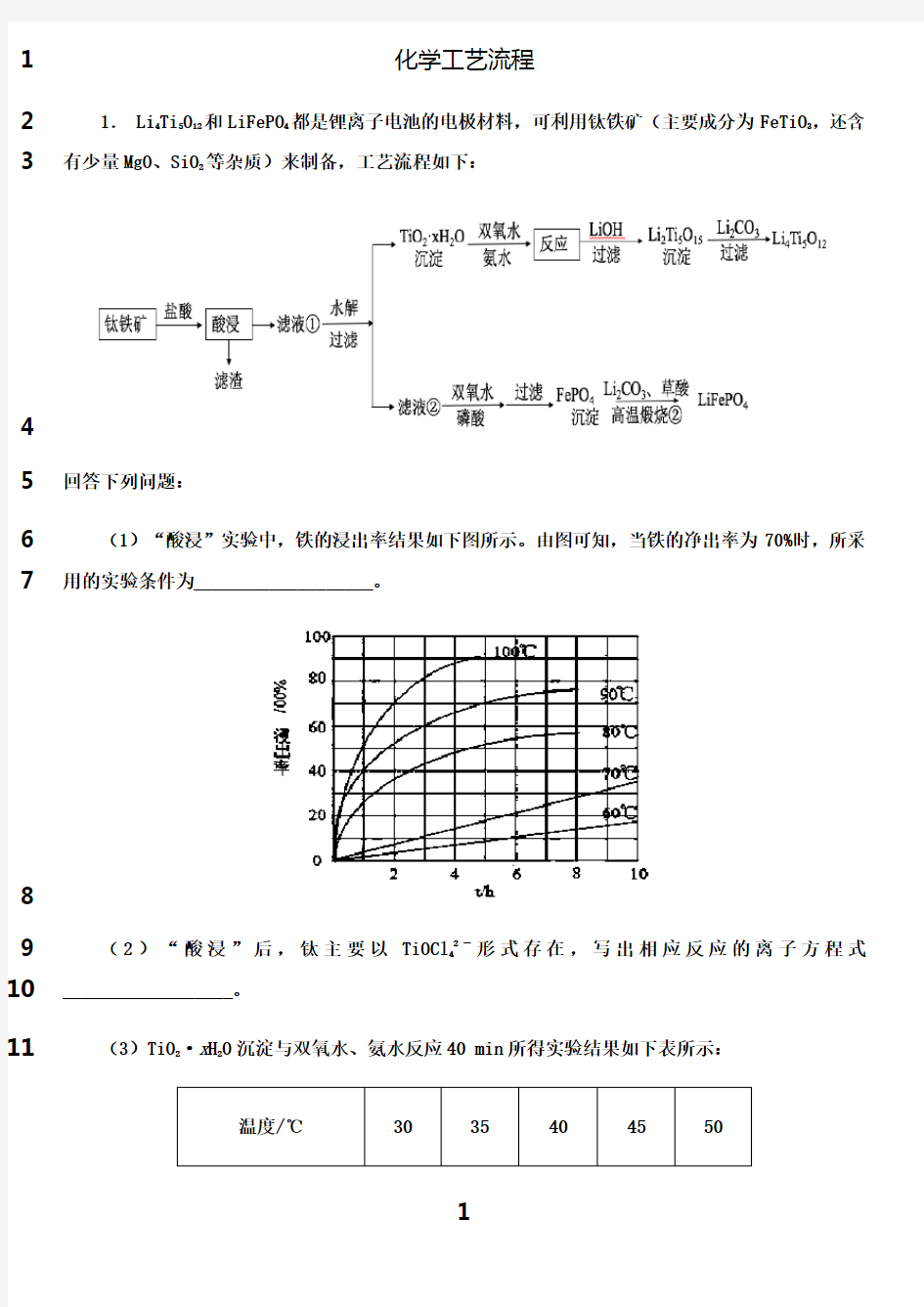
5
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采6
用的实验条件为___________________。
7
8
(2)“酸浸”后,钛主要以TiOCl
42-形式存在,写出相应反应的离子方程式
9
__________________。
10
(3)TiO
2·x H2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
11
温度/℃3035404550
分析40℃时TiO
2·x H2O转化率最高的原因__________________。
12
(4)Li
2Ti
5
O
15
中Ti的化合价为+4,其中过氧键的数目为__________________。
13
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+ 14
恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式15
计算)。
16
FePO
4、Mg
3
(PO
4
)
2
的K
sp
分别为1.3×10-22、1.0×10-24。
17
(6)写出“高温煅烧②”中由FePO
4制备LiFePO
4
的化学方程式。
18
【答案】(1)100℃、2h,90℃,5h 19
(2)FeTiO
3+ 4H++4Cl? = Fe2++ TiOCl
4
2? + 2H
2
O
20
(3)低于40℃,TiO
2·x H2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气
21
逸出导致TiO
2·x H2O转化反应速率下降
22
(4)4 23
(5)Fe3+恰好沉淀完全时,c(PO43-)=
22
5
1.310
1.010
-
-
?
?
mol·L?1=1.3×10-17mol·L?1,c3(Mg2+)×c2(PO43-)
24
=(0.01)3×(1.3×10-17)2=1.7×10-40<K sp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。
25
(6)2FePO
4 + Li
2
CO
3
+ H
2
C
2
O
4
高温
2LiFePO
4
+ H
2
O↑+ 3CO
2
↑
26
2.水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO
2,并含有一定量的铁、铝和镁等
27
金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:28
29
回答下列问题:
30
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝31
酸的目的是__________,还可使用___________代替硝酸。
32
(2)沉淀A 的主要成分是_________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程33
式为____________________________________。
34
(3)加氨水过程中加热的目的是___________。沉淀B 的主要成分为_____________、35
____________(填化学式)。
36
(4)草酸钙沉淀经稀H 2SO 4处理后,用KMnO 4标准溶液滴定,通过测定草酸的量可间接获知钙
37
的含量,滴定反应为:4MnO +H ++H 2C 2O 4→Mn 2++CO 2+H 2O 。实验中称取0.400 g 水泥样品,滴定时消耗
38
了0.0500 mol·L -1的KMnO 4溶液36.00 mL ,则该水泥样品中钙的质量分数为______________。
39 【答案】(1)将样品中可能存在的Fe 2+氧化为Fe 3+ ; 双氧水(H 2O 2) 40
(2) SiO 2 (或H 2SiO 3);SiO 2+4HF
SiF 4↑+2H 2O
41
(3)防止胶体生成,易沉淀分离;Fe(OH)3 、 (OH)3 42 (4)45.0%
43
3.重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr 2O 3,还44
含有硅、铝等杂质。制备流程如图所示:
45
46
回答下列问题:
47
(1)步骤①的主要反应为:48
FeO·Cr
2O
3
+Na
2
CO
3
+NaNO
3
???→
高温 Na2CrO4+ Fe2O3+CO2+ NaNO2
49
上述反应配平后FeO·Cr
2O
3
与NaNO
3
的系数比为__________。该步骤不能使用陶瓷容器,原因
50
是________________。
51
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是____________及含52
硅杂质。
53
(3)步骤④调滤液2的pH使之变____________________(填“大”或“小”),原因是54
_________(用离子方程式表示)。
55
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤56
得到K
2Cr
2
O
7
固体。冷却到___________________(填标号)得到的K
2
Cr
2
O
7
固体产品最多。
57
58
a.80℃
b.60℃
c.40℃
d.10℃
59
步骤⑤的反应类型是___________________。
60
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品m2 kg,产率为61
_____________。
62
【答案】(1)2:7 陶瓷在高温下会与Na
2CO
3
反应
63
(2)铁 Al(OH)3
64 (3)小 增大溶液中H +,促进平衡2CrO 42-+2H +
Cr 2O 72-+H 2O 正向移动
65 (4)d 复分解反应
66
(5)
2
1
190m 100%147m 67
4.高锰酸钾(KMnO 4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要68
成分为MnO 2)为原料生产高锰酸钾的工艺路线如下:
69
70
回答下列问题:
71
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其72
作用
73
是 。
74
(2)“平炉”中发生的化学方程式为 。 75
(3)“平炉”中需要加压,其目的是 。
76
(4)将K 2MnO 4转化为KMnO 4的生产有两种工艺。
77
① “2CO 歧化法”是传统工艺,即在K 2MnO 4溶液中通入CO 2气体,使体系呈中性或弱酸性,K 2MnO 4
78
发生歧化反应,反应中生成K 2MnO 4、MnO 2和 (写化学式)。
79
② “电解法”为现代工艺,即电解K 2MnO 4水溶液,电解槽中阳极发生的电极反应为 , 80
阴极逸出的气体是 。
81
③ “电解法”和“CO
2歧化法”中,K
2
MnO
4
的理论利用率之比为。
82
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取83
浓度为
84
0.2000 mol·L?1的H
2C
2
O
4
标准溶液20.00 mL,加入稀硫酸酸化,用KMnO
4
溶液平行滴定三次,
85
平均消耗的体积为24.48 mL,该样品的纯度为(列出计算式即可,已知86
2MnO
4-+5H
2
C
2
O
4
+6H+=2Mn2++10CO
2
↑+8H
2
O)。
87
【答案】(1)增大反应物接触面积,加快反应速率,提高原料利用率;
88
(2)2MnO
2+4KOH + O
2
2K
2
MnO
4
+2H
2
O;
89
(3)提高氧气的压强,加快反应速率,增加软锰矿转化率;
90
(4)①KHCO
3;②MnO
4
2??e?=MnO4?;H2;③3:2;
91
(5)
-3
2100
20.00100.2000158
524.48100%
1.0800
?????
?。
92
5.过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧93
化钙的实验方法。回答下列问题:
94
(一)碳酸钙的制备
95
96
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
97
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
98
99
a.漏斗末端颈尖未紧靠烧杯壁b.玻璃棒用作引流c.将滤纸湿润,使其紧贴漏斗壁
00
d.滤纸边缘高出漏斗e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
01
(二) 过氧化钙的制备
02
03
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填04
“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
05
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
06
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。07
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到08
过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
09
【答案】(1)调节溶液pH使Fe(OH)
3沉淀;过滤分离;(2)ade ;(3)酸;除去溶液中溶解的
10
CO
2;
11
(4)CaCl
2+2NH
3
·H
2
O+H
2
O
2
=CaO
2
↓+2NH
4
Cl+2H
2
O或CaCl
2
+2NH
3
·H
2
O+H
2
O
2
+
12
6H
2O=CaO
2
·8H
2
O↓+2NH
4
Cl;温度过高时过氧化氢分解;(5)去除结晶表面水分;(6)工艺简单、
13
操作方便;纯度较低。
14
6.天青石(主要含有SrSO
4和少量CaCO
3
杂质)是获取锶元素的各种化合物的主要原料。回答
15
下列问题(相关数据如下)16
