《化学工艺流程中的条件控制》)
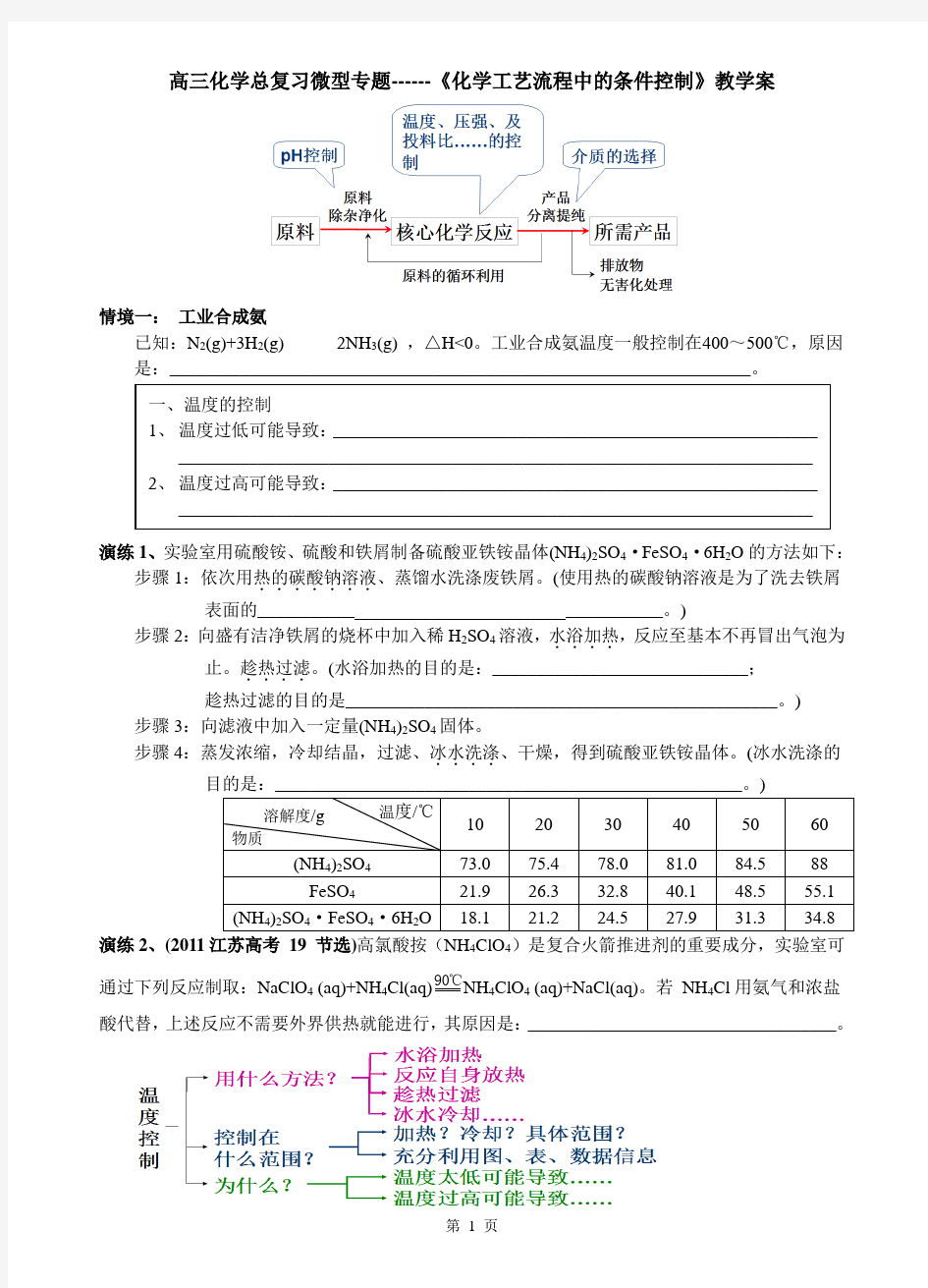

高三化学总复习微型专题------《化学工艺流程中的条件控制》教学案
情境一: 工业合成氨 已知:N 2(g)+3H 2(g) 2NH 3(g) ,△H<0。工业合成氨温度一般控制在400~500℃,原因是:__________________________________________________________________。
演练1、实验室用硫酸铵、硫酸和铁屑制备硫酸亚铁铵晶体(NH 4)2SO 4·FeSO 4
·6H 2O 的方法如下:
步骤1:依次用热的碳酸钠溶液.......
、蒸馏水洗涤废铁屑。(使用热的碳酸钠溶液是为了洗去铁屑表面的___________ ___________。) 步骤2:向盛有洁净铁屑的烧杯中加入稀H 2SO 4溶液,水浴加热....,反应至基本不再冒出气泡为止。趁.热过滤...
。(水浴加热的目的是:_____________________________; 趁热过滤的目的是_________________________________________________。)
步骤3:向滤液中加入一定量(NH 4)2SO 4固体。 步骤4:蒸发浓缩,冷却结晶,过滤、冰水洗涤....
、干燥,得到硫酸亚铁铵晶体。(冰水洗涤的演练2、(201144通过下列反应制取:NaClO 4 (aq)+NH 4Cl(aq)℃90NH 4ClO 4 (aq)+NaCl(aq)。若 NH 4Cl 用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是:___________________________________。
情境二:
用金属钴板(含少量Fe 、Ni )制备氯化钴的工艺流程如下:
金属钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
(1)“除镍”步骤中,加氨水调pH 的意图是________________________________________。 (2)“酸溶”步骤中,加盐酸调pH 的目的是________________________________________。 (3)“除铁”步骤中,加双氧水的目的是___________________________________________,
加纯碱的目的是_____________________________________________。
(4)“除铁”后,又用盐酸调pH 的作用是__________________________________________。
演练3:(2012江苏高考 19 节选)
已知:pH>11 时Zn(OH)2 能溶于NaOH 溶液。 实验中可选用的试剂: 30%H 2O 2;1. 0 mol·L -1
HNO 3; 1. 0 mol·L -1
NaOH 。
由含Fe 2+、Fe 3+、Zn 2+的溶液制备ZnO 的实验步骤依次为:
①______________________________________________________________________; ②______________________________________________________________________; ③过滤;④______________________________________________________________; ⑤过滤、洗涤、干燥;⑥900℃煅烧。
演练4:制革工业污泥中
Cr(Ⅲ)的处理工艺如下图所示:
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1) 酸浸时,为了提高浸取率可采取的措施有___________________________________。
(2) 氧化步骤中加H2O2可将滤液Ⅰ中的Cr3+转化为Cr2O72―,在碱性条件下,Cr2O72―可转化
为CrO42―。试分析加NaOH调节pH为8的目的是______________________。
但溶液的pH不能超过8,理由是_________________________________________。
情境三:(2012江苏高考节选)
1、判断该过程能否实现( )
2、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O =3I2+6OH-,
判断该离子方程式是否正确( )
3、镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将Mg、Al 单质在一定温
度下熔炼获得。熔炼过程中通入氩气的目的是:______________________________。
三、介质的选择
1、最常用的介质是什么?当然是空气和水
2、为何不在空气中进行?
空气可能带来的隐患:O2氧化、H2O水解
所选介质气体有什么好处:比如在HCl气流中加热FeCl3晶体可以得到无水FeCl3,是因为HCl可以抑制水解并带走水汽。
3、为何不在水中进行?
水可能带来的隐患:溶解、水解
所选溶剂可能带来的好处:比如用乙醇代替水对产品进行洗涤,不但可以减少溶解,还易于晾干。
综合演练:
1、Li2O2是制造热电偶的良好材料,其部分性质见资料卡,可
用一水氢氧化锂和过氧化氢为原料制取。
2LiOH·H2O(s)+2H2O2(l)→2LiOOH·H2O(s)+2H2O(l) △H<0
2LiOH·H2O(s)→Li2O2·H2O2·2H2O(s) △H>0
Li2O2·H2O2·2H2O Li2O2+H2O2+2H2O
以一定物质的量之比,将一水氢氧化锂溶解在65%~67%过
氧化氢溶液中,不断搅拌混合物,用冰冷却反应溶液。适量
加入O℃的乙醇,形成白色晶体,过滤出晶体,用无水乙醇洗涤。产物在l00~120℃,经过6h真空干燥,得到过氧化锂。
(1)用冰水冷却反应溶液的目的是______________________________________。
(2)用无水乙醇代替水洗涤产品的目的是__________________________________。
(3)
H2O2用量增加,分离获得的Li2O2量反而减少,其原因是_______________________。
(4)某合作学习小组的同学在实验室制取Li2O2时,将生成的Li2O2固体分离出来,并迅速移至
装有五氧化二磷的真空干燥器里,较长时间干燥。本实验采用常温真空脱水,其主要优点是_________________________________________________________________。
2、以铅片为阳极,镍铬钛不锈钢片为阴极,电解含Ni2+的溶液,在阴极得到镍粉。电解过程中电流效率与pH的关系如图,回答下列问题:
①pH较低时,电流效率低的原因可能是:____________。
②电解前需将溶液的pH调至合适的范围,你认为这个范
围是:______。理由是____________________________。
A.3.0~3.5 B.3.5~4.0
C.4.0~4.5 D.4.5~5.0
情境一
温度过低,反应速率减慢;温度过高,NH3的产率降低;此温度范围有利于提高催化剂的活性。演练1
1.洗去废铁屑表面的油污
2.加快Fe与H2SO4反应的速率, 防止溶液中的FeSO4析出
4.防止(NH4)2SO4·FeSO4·6H2O晶体溶解损失
演练2:NH3与HCl反应放出热量
情境二
1、使Co、Fe完全沉淀,Ni转变成[Ni(NH3)6]2+与沉淀分离。
2、使沉淀溶解,转变成离子。
3、将Fe2+氧化成Fe3+,调pH>3.7,使Fe3+沉淀完全。
4、抑制钴离子水解。
演练3
①向滤液中加入适量30% H2O2,使其充分反应;
②滴加1.0 mol·L-1NaOH,调节溶液pH到3.2~5.9之间,使Fe3+沉淀完全;③过滤
④向滤液中滴加1. 0 mol·L-1NaOH,调节溶液pH到8. 9~11,使Zn2+沉淀完全。
演练4:(1)加热、搅拌增大固体颗粒的表面积
(2)使Fe3+、Al3+沉淀完全pH>8会导致Al(OH)3溶解,产物纯度降低。
情境三
1.×
2. ×
3.防止Mg、Al 被空气氧化
综合演练
1.(1)有利于第一步反应的进行;减少H2O2的分解;减少产品的溶解。
(2)减少晶体的溶解,而且易于晾干
(3)H2O2的用量增大,同时水的用量也增加,产品因溶解造成的损失增大
(4)减少加热过程中Li2O2的分解,提高产品纯度。
2.①产生大量的H2。
②C, pH低于4时,电流效率太低;pH高于4.5时,用碱量增加,但电流效率提高不大。
