供应商质量体系审核表
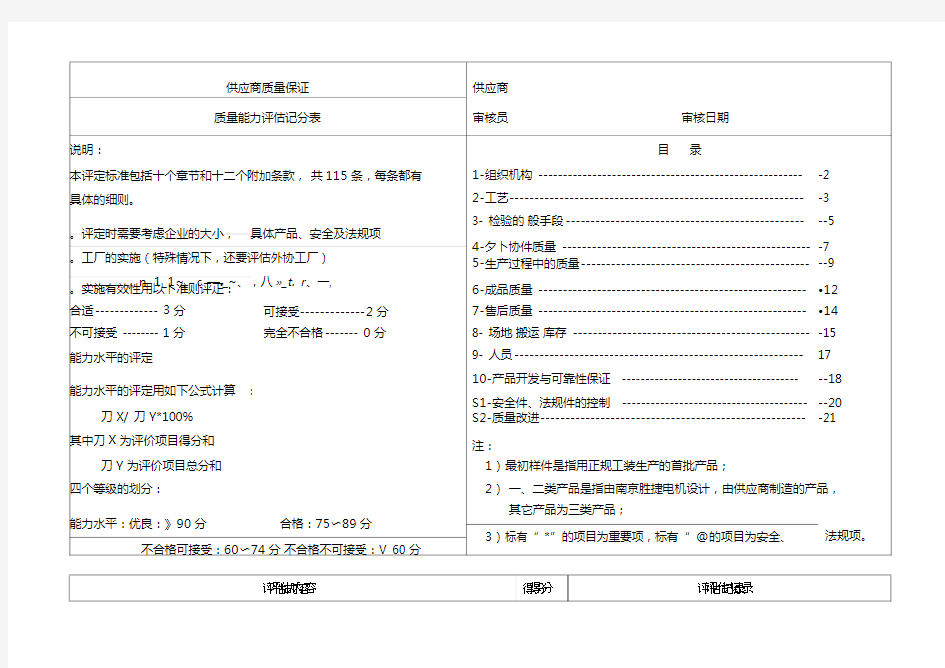
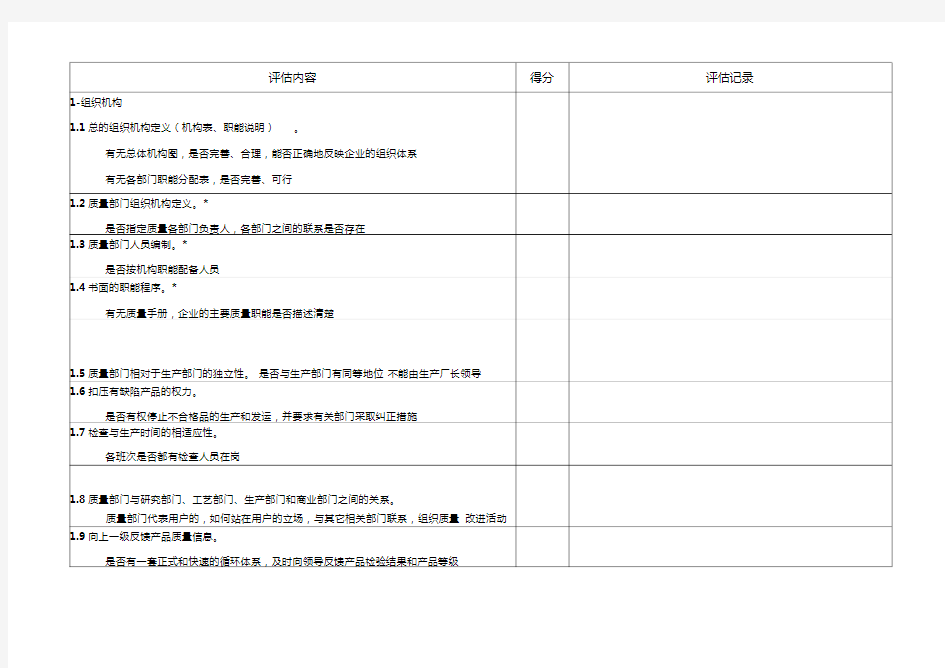
供应商审核管理制度
供应商审核管理制度 1 目的 对原辅材料、外购(协)件的供应商进行审核,并对其进行评价,确保所采购物品满足其产品生产的质量和相关法规要求。 2 范围 适用于本公司供应商的管理和控制。 3 职责 3.1 采购部负责本制度的具体实施并归口管理。 3.2质检部负责采购物资的验证。 4 内容 4.1 审核要求 4.1.1准入审核:采购部制定供应商准入要求,建立供应商档案。根据采购信息,包括采购物品类别、验收准则、规格型号、规程、图样等内容,对供应商经营状况、生产能力、质量管理体系、产品质量、供货期等相关内容进行审核,必要时开展现场审核,以确保采购物品符合要求。 4.1.2过程审核:技术部建立采购物品在使用过程中的审核要求,对采购物品的进货查验、生产使用、检验情况、不合格品处理等方面进行审核并保持记录,保证采购物品在使用过程中持续符合要求。 4.1.3评估管理:采购部建立评估要求,对供应商定期进行综合评价,回顾分析其供应的产品质量、技术水平、交货能力、产品合格率等。对结果为不满意的供应商,采取淘汰或改进措施。 采购物品的生产条件、规格型号、图样、生产工艺、质量标准和检验方法等可能影响质量的关键因素发生重大改变时,应当对供应商进行重新评估,必要时进行现场审核。 4.2审核要点 4.2.1文件审核 4.2.1.1供应商资质,包括企业营业执照、合法的生产经营证明文件等; 4.2.1.2供应商的质量管理体系文件; 4.2.1.3采购物品生产工艺说明; 4.2.1.4采购物品性能、规格、型号、安全性评估材料、企业自检报告或有资质检验机构出具的有效检验报告。 4.2.1.5、其他所需的文件和资料。 4.2.2 特殊采购物品的审核
供应商质量体系审核检查表.docx
供应商质量体系审核检查表 序号问题检查记录得分 一、质量管理及职责 1.1是否明确公司的质量管理机构和职责? A组织机构明确,部门的职能得到有效履 行; B有专职质量管理部门及质量检验人员; C质量管理负责人等职责分工明确; 1.2是否建立了质量分析会制度? A 定期召开公司内的质量会议,确认质量目 标值的达成情况; B领导把握质量状况,提出改善指示; C保存质量会议记录,确定需改进项目,且 他们的改进进度情况得到控制; D 改进效果得到验证,有彻底的反馈,其结 果令人满意 二、质量管理体系建设 2.1是否按计划进行有效的管理评审和内部审 核? A 应有完整的管理评审输入资料,支持状态 评审; B管理评审的输出应关注涉今世缘公司或 体系的重大改进,并有计划和措施支持; C内部审核覆盖所有部门和车间,并按重要 性安排,内外部审核发现的问题应采取措施 并跟踪验证。 2.2是否有质量方针? A有明确的方针且这些方针得到了积极的 实施; B主要的措施根据这些方针得以实施; C活动结果的进度情况根据这些方针得到 了控制。 2.3是否制定了质量目标?是否分解到各单位 及岗位? 有明确的目标,并且将目标按照管理层级进 行了分解; 2.4目标是否得到有效监控? A应对目标完成情况进行统计并分析; B应定期召开绩效评审会,针对适宜的绩效 指标所实施的持续改进活动计划应进行评 审。 三、文件和资料控制 3.1是否有文件化的控制体系? A有文件及各项必要的管理规定; B起草、审核、批准部门明确; C文件描述完备; D制定了员工培训文件的内容 3.2文件现场的使用状态? A根据需要,及时更新现场版本;
供应商管理体系
供应商管理体系 1 目的 为有效的对供应商生产、质量、管理及生产过程实施监控,发展维护稳定的供应商,确保供应商提供符合质量要求、价格适宜的产品,与供应商建立起长期稳固的供求关系,特制定本体系。 一、范围 本管理体系适用于为公司提供产品和服务的所有供应商。 职责 质管部 ●负责评估、审核、考评供应商。 ●对供应商产品质量实施检测和控制。 ●对供应商生产过程实施控制。 ●对供应商质量事故下达NCR报告,并跟踪整改。 ●对问题供应商预警并做出处理意见。 二、技术部 ●项目评审 ●负责新产品制造工艺工装方案审核 ●负责新供应商考察、评估 ●编制《技术要求》《质量控制卡片》 ●解决产品重大技术问题 财务部负责发货产品结算。 三、管理体系 1.供应商的选择 新供应商 根据新产品或产品结构调整等因素的需要选择适宜的新供应商。 选择原则:遵循质量稳定、低价格、管理好、具有质量管理体系资质、 诚信的原则,批量较大的产品尽量选择两家及以上的稳定供应商,以保 证稳定供货和技术创新。 2.选择程序 1)采购部根据公司安排和实际需求及选择要求向新供应商发出《供应商调查表》。 2)供应商填写《供应商调查表》完毕,附上以下证书复印件: ●营业执照 ●组织机构代码证 ●税务登记证 ●质量管理体系认证证书 3)质管部在接收到《供应商调查表》及证书复印件等信息后进行评审, 资料评审合格后依据产品关键程度确定是否需现场审核,若需现场审核 的由质管部组织考察审核小组两周内对新供应商进行现场审核并出具 审核报告。
4)经现场审核合格的供应商可直接引入。现场审核不合格的供应商可 以整改一次,整改仍不合格的取消引入资格,市场部需要重新开发新供 应商。 5)资料评审合格不需现场审核的可直接引入。资料审核不通过新供应商可整改一次,整改仍不合格的取消引入资格,市场部需要重新开 发新供应商。 6)选定供应商后需要签定《质量保证协议》、《保密协议》。 3.建立新供应商或潜在供应商档案,供应商档案内容如下: ●供应商的基本信息(设备、人员) ●组织机构是否健全 ●是否具有ISO9001质量管理体系 ●质保体系是否健全,质保能力如何 ●技术与研发能力如何 ●生产管控能力、产能和商务能力如何 ●成本控制及价格水平 ●诚信度 4. 老供应商 1) .老产品:根据供应商的产能、交期、价格、技术水平、质量水平等因素,确实满足不了客户对产品的需求,市场部需要向 公司提出申请,重新选择供应商。 2)供应商的管理 发货检验发现重大质量问题 ●一次抽检30%以上不合格 ●连续2次抽检10%~30%不合格 ●严重铸造工艺、加工工艺及工装错误 对释放CPAR报告供应商未得到有效整改的,均由质管部向供应 商释放《供应商质量信息联络单》,提出处理意见传递至采购部, 责任供应商需在5个工作日内排查、整改,并在10日内给予有 效具体的整改回复,没有发货产品的除外,待再次下达订单前 按此要求执行。 3)质管部于每月8日前将上月相关供应商质量数据汇总并进行分析。 4)供应商质量信息分析评价 质管部每月根据相关质量数据对合格供应商排名评价,评价结果 每月10日前审核公布。 5.考核结果预警机制 1)针对月度排名供应商建立三级预警机制(黄色、橙色、红色)。 a)黄色警告:检验尺寸超差或其它原因导致批量返工; b)橙色警告:一次检验30%以上不合格; c)红色警告:出现批次质量问题导致质量事故经整改无效;工厂审
供方质量体系调查表
供方质量体系调查表 调查时间:供方编号: 供方: 地址: 电话:传真: xxxx有限公司主导厂是: 此文件通常是供方根据xxxxx有限公司供货质量改进程序和此调查表提出的要点,进行工厂质量体系调查使用的。 此结果将被保密。 基本情况 完成自查的调查人员: 姓名:职务:电话:传真: 1、 2、 3、 工厂概况 1、列出工厂生产的主要产品:
2、列出向(或可能向)xxxxx有限公司供货的产品: 3、列出主要用户(占产量的10%以上): 4、总占地面积: 5、人员: 员工总数: 生产工人数:生产管理人员数: 质量检验工人数:质量管理人员数: 6、列出供方质量体系审核的历史情况: 审核日期:审核机构:审核文件号:有关日期: 一、质量管理 1、采用何种质量保证或质量控制体系来保证质量? □ A. 仅进行工序控制/操作工控制。 □ B. 成品检验。 □ C. 两者都进行。 2、工厂管理层确定何部门或机构对产品质量负有责任? 3、在质量保证和质量改进工作中,工厂最高管理层起何作用?
4、无论何部门,从事质量检查、控制的人员的一般技能/经验要求达到何种水平? 5、有什么试验或检验的设备用于对原材料和成品进行全面评价? A、化学成分 B、性能 6、工厂具有哪些质量工程功能? 是否 A、能力分析□□ B、统计抽样□□ C、工序控制□□ D、质量计划□□ E、质量检查□□ F、试验设计□□ G、控制图表□□ H、(产品)特性分类□□ I、质量成本分析□□ J、(质量信息系统)□□ K、失效模式与影响分析□□ 7、是否有产品通过某重要用户质量认证合格?(即用户对产品实行免检)
供应商质量管理体系调查表
χδεφ 供应商质量管理体系评审表 供应商名称:联系人 供应商地址:联系电话 主要产品:评审日期 序主要调查内容 A B C D 评 分 评审证据 1.1 是否建立ISO9000&QS9000&TS16949等质量管理 体系 10 8 4 2 1.2 建立的质量体系是否获得第三方认证机构认可1.3 是否设定质量目标并定期验证其达成情况 2 是否有完善的组织机构,品质部门是否有独立行使品 质放行的权力 10 8 4 2 2.1 是否有进料检验2.2 是否有过程检验2.3 是否有最终检验 2.4 是否使用MIL-STD-105E或GB2828-2003等抽样标准 2.5 用于检验、试验的量具是否充分 3 来料检验 10 8 4 2 3.1 是否有来料检验标准 3.2 检验人员是否按照标准检验
χδεφ 3.3 是否有详细的原始记录 4 过程检验 10 8 4 2 4.1 是否有过程检验标准 4.2 是否按照标准进行过程检验 4.3 过程检验是否有详细记录 5 成品检验 10 8 4 2 5.1 是否有成品检验标准 5.2 标准规定的AQL 值是否合理并满足顾客要求 5.3 是否执行成品检验 5.4 成品检验是否有详细记录 5.5 是否主动向客户提供品质保证报告 5.6 是否有详细的产品技术标准 5.7 对产品是否定期进行可靠性等型式试验 6 用于检验、试验用的量具是否进行有效管理并定期检定 5 4 2 1 7 过程检查 10 8 4 2 7.1 是否有用于指导操作的作业指导书 7.2 员工操作是否按照作业指导书的要求进行 7.3 员工是否对产品实施自检 7.4 是否有必要的工装夹具确保品质,对模具、夹具进行有效管理 7.5 是否有特殊过程并有相应的控制办法 8 产品标识及可追溯性 10 8 4 2
内部质量体系审核管理程序
内部质量体系审核管理 程序 Last revised by LE LE in 2021
1.目的通过实施内部体系审核,确定质量管理体系是否符合策划安排标准的要求。质量管理体系是否得到有效实施和保持,以便及时发现问题,采取改进措施。 2.适用范围 本程序适用于公司内部质量管理体系审核活动。 3.职责 3.1由管理者代表任命一名审核员任内部体系审核组组长具体负责。 3.2公司内部体系审核组负责审核全部与质量管理有关的部门和活动。3.3各有关部门负责配合做好审核工作,向审核组报告相关工作,对审核中发现的问题及时采取纠正措施。 3.4技术质量部负责内部体系审核资料的发放、保存。 4.相关文件 管理评审管理程序 PX/QS2-05-2004 记录的管理程序 PX/QS2-02-2004 5.工作描述 审核员的管理 本公司的内部体系审核员应经过培训有“内部审核员证书”,有一定质量管理和质量技术方面的经验,有策划、组织、交流和领导能力,具备如政治、诚实、有判断能力、分析能力以及容易接受新知识等的个人素质,并确保审核过程的客观性、公正性 (审核员不应审核自己部门) 。 编制年度内部体系审核计划
由技术质量部负责制定公司年度内部质量体系审核计划,并报总经理审批后发放相关部门。年度审核计划应包括:审核目的、范围和审核预定的日期、审核频次、依据的文件。 正常情况下每年不少于1次,间隔12个月。遇下列情况必须适当增加审核: (1)总经理根据工作需要认为有必要进行时; (2)出现其它必须安排审核的情况时; (3)顾客提出要求时; (4)内部/外部不符合时。 内部质量体系审核的准备 以及以往审核的结果,制定“内部审核工作计划”,审核工作计划应包括: a.审核的目的和范围、审核时间; b.依据的文件; c.审核部门的主要项目及时间安排; d.审核员分工; “内部审核工作计划”后,准备审核文件:编制审核检查表。 审核组长提前通知受审核部门,下发“内部审核工作计划”。 受审核部门依据“内部审核工作计划”做好必要的准备工作。若对审核时间安排或审核项目有异议,提前2天通知审核组,经协商后可以另行安排。 审核的实施 管理者代表讲明审核的主要意义,提出对被审核部门的要求。
内部质量体系审核程序
1 目的 制定并保持本程序,旨在审查质量管理体系中各要求事项之实施状况是否达到要求, 确保管理体系有效运行及持续改进。 2 适用范围 公司与质量管理体系有关规定事项与实施部门皆为审核范围。 3 职责和权限 3.1管理者代表:组织编制【年度内部审核计划】及审核结果之最终承认。 3.2审核组:依【内审实施计划】执行审核及并对不符合的纠正和预防实施之有效性、 适宜性进行跟踪验证。 3.3各相关部门:审核后不符合事项的纠正和预防处理。 4 工作程序 4.1管理者代表每年组织编制1份【年度内部审核计划】,报总经理审批,对质量体系全部 过程进行审核,且每年至少进行1次。特殊情况下,经总经理批准,可以增加审核次数。 审核方式一般采用集中式审核,需要时也可采用部门滚动式审核。 4.2审核人员 根据内审计划,可由管理者代表指定具体范围/项目的内审组长。审核组成员由本公司 内审员担任,内审组长及成员必须与所审核的活动无直接工作关系,且具备下述资 格: (1)必须经专业机构培训,取得内部质量体系审核员合格证书。 (2)对本公司产品有一定了解。 4.3审核实施 4.3.1在【年度内部审核计划】中规定审核实施前一周内,由管理者代表组织公司内部审核 人员成立该次的内部质量体系审核小组,并选出组长。 4.3.2组长负责制定该次【内审实施计划】,由管理者代表审核总经理批准后书面通知受审 核部门的负责人。 4.3.3审核实施前,内审员须编制【内审检查表】交审核组长确认,作为审核内容的样本。 4.3.4内审组长应召集内审员与被审核单位负责人举行首次会议,说明本次审核之范围、时
程及注意事项。审核组长负责审核小组与被审核单位之间的沟通工作。 4.3.5进行现场审核,寻找客观证据。 a)被审核单位负责人应亲自或指派有关人员陪同进行审核。 b)审核小组成员应参阅【内审检查表】作为审核指引, 不允许被审核单位人员参与审 核,但被审核单位有义务提供各项目之资料以利审核作业的顺利进行。 c)审核小组成员应于规定之审核期限内完成审核任务,如有在规定时间内完不成审核 项目时,需经审核组长确认后,审核员可与被审核部门协商确定继续审核的时间。4.4审核信息反馈 4.4.1审核后审核组应就审核所发现的不符合项进行分析、观察结果,确定不符合项,填写 【内审不符合报告】,并由被审核单位负责人确认,报审核组长批准,以确保该单位了解问题及采取适当的纠正措施。 4.4.2审核完成后,审核组长应召开审核组会议,根据【内审不符合报告】作出内审结论, 然后召集审核组成员与被审核单位负责人举行末次会议,宣布审核结果。 4.5不符合反馈及改善措施 4.5.1被审核单位针对审核发现的各个不符合项,于规定期限内提出纠正和预防措施,以改善 问题,并填写【内审不符合报告】后交回审核小组。 4.5.2纠正措施一般须在半个月内完成,特殊情况者由相关部门负责人提出书面申请交审核 组长,经管理者代表批准后方可延期。 4.6审核的追踪 4.6.1审核小组应要求被审核单位在规定期限内提出纠正和预防措施,并在收到被审核单位 反馈之纠正和预防措施后应追踪是否落实执行;是否已完全解决问题;审核追踪直到 该单位完全改善为止。 4.6.2审核小组应将追踪结果填入【内审不符合报告】。 4.7 每次审核活动由审核组长在审核结束两个星期内,将内部质量体系之审核结果及内容 汇整后编写【内部审核总结报告】。审核报告应讲述所审核范围的质量体系运行情况,并作出总的结论。 4.8 审核报告应交管理者代表审批,然后分发给受审核部门负责人。
内部质量管理体系审核报告
内部质量管理体系审核报 告 The latest revision on November 22, 2020
内部质量管理体系审核报告 一、审核时间: 二零一七年三月一日至二零一七年三月三日 二、审核目的: 1、验证本企业质量管理体系文件的符合性、适宜性; 2、评价质量管理体系的符合性、有效性。 三、审核依据: 1、GB/T19001-2016idtISO9001:2015标准 2、质量手册 3、程序文件 4、适用的法律法规 5、本企业的管理性文件 6、顾客要求 四、本次审核的体系过程和覆盖范围 1、本次审核的体系范围包括GB/T19001-2016标准全部过程。 2、本次审核覆盖产品:XXX的制造、五金冲压件和切削加工。 3、本次审核涉及公司管理层(包括管理者代表)人事部、技术部、生产 部(含车间/仓库)、业务部、品质部、采购部、设备管理部。 五、本次审核组的组成 审核组成员由XXXX二人组成,由XXXX单人本次审核组组长,两位内审 员均参加了GB/T19001-2016标准和内审员专业知识的培训,经考核合 格,具备质量管理体系内部审核的能力,为体现标准对“内审员不能审 核自己的工作”的规定,采取二人对自己所在部门互查的方式进行。 六、审核过程 1、本次审核实施计划于2017年2月24日编制,经总经理批转,并下发 各相关部门和人员。 2、内审检查表由内审组于2月28日编制完成。
3、3月1日上午按计划召开首次会议,公司领导和相关部门负责人参 加,审核组长XXX同志按程序宣布本次内审的目的和依据,宣读了内 审实施计划和时间安排(详见签到表和记录)。 4、3月1日上午准时按计划对各部门进行内审,审核员按内审检查表对 检查情况做记录。3月3日下午全部审核过程结束(详见内审检查 表)。 七、不合格项统计与分析 此次内审、由于安排准备时间长,计划下发后又组织各部门自查自纠,许多不足之处已在内审前由各部门自行消化了,因此,此次内部质量体系审核共发现不合格项1个: 1、生产部1项,编号SL-0069~SL-0081,共计13台设备,未按要求填写 《点检保养记录卡》,2017年1月3~4日未有保养记录。不符合 GB/T19001-2016标准7.5.3条款“基础设施”。 2、由于审核是采取抽样方式进行的,未查出问题的部门不代表自己的部 门没有问题,也许其他部门查出的问题在你那个部门也有,所以未开 不符合项的部门也应该根据其他部门出现的问题对自己部门进行自 查,确保能够按照要求操作。希望各部门加强自己部门所有人员的学 习,做到有效的上传下达,确保员工能够按照要求工作。希望各部门 尽快采取措施确保质量管理体系工作的顺利开展。 八、对质量管理体系的总体评价 通过此次内审,证实了我们的文件化体系是符合标准要求的,是可以同我公司现有的管理体系有机地融合,是切合实际的。 九、不合格项的整改和验证 本次审核的不合格项均由责任部门分析原因,制定纠正措施,并在规定时间内完成,必须于2017年3月15日前由审核员全部验证完毕。 内审组长:XXX 二零一七年三月三日
TS16949内部质量体系审核(中英文)
TS16949内部质量体系审核Internal Quality System Audit 文件更改历史记录 Amendment History
TS16949内部质量体系审核 Internal Quality System Audit 1.0目的 Purpose: 本程序规定了开展内部质量审核的策划,准备,实施,审核,报告,跟踪验证各阶段的控制要求和方法,以确定本公司的质量管理体系是否符合标准要求并得到有效地实施和保持。This procedure give the methods and control requirements of internal quality audit planning, preparing, implementing, auditing, reporting and following-up, to ensure that the quality management system is in compliance with requirements and is implemented and maintained effectively. 2.0范围Scope: 适用于本公司内部质量管理体系审核及质量体系涉及的所有部门或个人。 FP internal audit and all departments and persons related to quality management system 3.0定义Definitions: N/A 3.1IQAR:内部质量审核报告Internal Quality Audit Report 3.2NC:不符项(不符合ISO要求的项目)Non-conformance (item against ISO requirement.) a)Major严重不符合项: there are systematic problem, territorial problem, and the findings will cause the major result during the system run; 体 系运行出现系统性失效,体系运行出现区域性失效,出现影响产品或体系运行 的严重后果的不合格现象. b)Minor一般不合格项: aim at the systematic requirements, the finding is separate, occasional and isolated minor problem; 对不满足质量体系过程 或体系文件的要求而言,是个别的、偶然的、孤立的性质轻微的问题.
内部质量体系审核管理程序
内部质量体系审核管理程序 1.目的 通过实施内部体系审核,确定质量管理体系是否符合策划安排标准的要求。质量管理体系是否得到有效实施和保持,以便及时发现问题,采取改进措施。 2.适用范围 本程序适用于公司内部质量管理体系审核活动。 3.职责 3.1由管理者代表任命一名审核员任内部体系审核组组长具体负责。 3.2公司内部体系审核组负责审核全部与质量管理有关的部门和活动。 3.3各有关部门负责配合做好审核工作,向审核组报告相关工作,对审核中发现的问题及时采取纠正措施。3.4技术质量部负责内部体系审核资料的发放、保存。 4.相关文件 4.1管理评审管理程序PX/QS2-05-2004 4.2记录的管理程序PX/QS2-02-2004 5.工作描述 5.1 审核员的管理 本公司的内部体系审核员应经过培训有“内部审核员证书”,有一定质量管理和质量技术方面的经验,有策划、组织、交流和领导能力,具备如政治、诚实、有判断能力、分析能力以及容易接受新知识等的个人素质,并确保审核过程的客观性、公正性(审核员不应审核自己部门) 。 5.2编制年度内部体系审核计划 由技术质量部负责制定公司年度内部质量体系审核计划,并报总经理审批后发放相关部门。年度审核计划应包括:审核目的、范围和审核预定的日期、审核频次、依据的文件。 正常情况下每年不少于1次,间隔12个月。遇下列情况必须适当增加审核: (1)总经理根据工作需要认为有必要进行时; (2)出现其它必须安排审核的情况时; (3)顾客提出要求时; (4)内部/外部不符合时。 5.3 内部质量体系审核的准备 5.3.1由管理者代表任命具备内审员资格的人员担任审核组长。 5.3.2由管理者代表和审核组长讨论后,选派具备资格且于被审核区域无直接责任的内审员组成审核组,并根据情况进行分工,组长负责本次的具体组织工作。 5.3.3审核组长根据质量管理体系的过程和区域的情况、重要性以及以往审核的结果,制定“内部审核工作计划”,审核工作计划应包括: a.审核的目的和范围、审核时间; b.依据的文件; c.审核部门的主要项目及时间安排; d.审核员分工; 5.3.4审核员接到“内部审核工作计划”后,准备审核文件:编制审核检查表。 5.3.5 审核组长提前通知受审核部门,下发“内部审核工作计划”。 5.3.6 受审核部门依据“内部审核工作计划”做好必要的准备工作。若对审核时间安排或审核项目有异议,提前2天通知审核组,经协商后可以另行安排。 5.4 审核的实施 5.4.1首次会议:在审核组长主持下,召开全体受审核部门相关人员参加的首次会议,宣布审核的目的、方法、程序、日期安排及有关事项,做好记录到会人员签到。
内部质量体系审核程序
内部质量体系审核程序 Jenny was compiled in January 2021
1.目的 为验证管理体系是否持续符合CNAS-CL01:2006(ISO/IEC 17025:2005)《检测实验室能力认可准则》和管理体系文件的要求,能否得到有效实施、保持和改进,特制定本程序。 2.适用范围 适用于实验室管理体系所覆盖的所有区域和所有要素的内部审核。 3.职责 3.1最高管理者/最高管理者代表 a)批准“年度内部审核计划”; b)确保内部审核所需的资源。 3.2质量主管 a)全面负责策划和实施管理体系内部审核工作; b)制定“年度内部审核计划” c)确定内部审核组长和审核员; d)批准“管理体系内部审核报告”; e)向最高管理者报告内部审核结果。 f)负责维护本程序的有效性; 3.3办公室 a)协助质量主管编制和组织实施“年度内部审核计划”; b)负责内部审核资料、记录的保管。 3.4内部审核组长 a)编制、实施本次内部审核实施计划; b)编写管理体系内部审核报告。 3.5内审员:根据审核组长分配的任务开展内部审核工作。 3.6各部门和相关人员:积极配合内部审核组开展审核工作。 4.工作程序 4.1年度内部审核计划 4.1.1根据受审核区域及其活动的状况和重要程度,并根据以往审核结果和管理层的需要,质量主管策划实验室年度审核方案,编制“年度内部审核计划”,确定审核范围、频次和方法,报最高管理者审核批准。内部审核每年不少于一次,并要求覆盖实验室管理体系的所有要素和所有部门。 4.1.2出现以下情况时,由质量主管策划并上报最高管理者批准,及时组织附加内审: a)组织机构、管理体系发生重大变化; b)出现重大质量事故,或客户对某一环节连续投诉; c)发生严重不符合检测工作或偏离实验室的政策、程序时;法律、法规、技术 标准/规范/规程及其他外部要求的变化; d)在接受第二方、第三方审核之前;
内部质量体系审核记录.doc
内部质量管理体系审核记录 MC/QW03-2001 受审部门总经理、管理者代表共页,第1页 标准 现场审核清审核记判定ISO 单录 过程编 号 4.11.组织是否建立了文件化的质量 管理体系 1)QMS 过程的识别及其在 组织中的应用( 1。 2 删 减); 2)过程顺序和相互作用; 3)过程有效性运作和控制 所需的准则和方法; 4)支持过程运作和监视, 必要的资源和信息; 5)测量、监视和分析过程; 6)措施—持续改进—过程 及其策划结果。 2.外包过程—控制—识别 注:符合√不符合×审核员日期 内部质量管理体系审核记录
MC/QW03-2001 受审部门总经理、管理者代表 共页,第2页 标准 现场审核清审核记判定ISO 单录 过程编 号 5.15.2 1 最高管理者建立实施QMS 持续改进证据: 1 )向组织传达了满足顾 客和法律法规要求的 重要性 2 )制定质量方针 (签字承 诺、涵义) 3 )确保质量目标的制定 (行业水平) 4 )进行管理评审(主持) 5 )确保资源获得(必要资 源,如何确保) 公司的主要顾客有哪些有些什么要求 与产品要求和法律法规要求有关部门 的责任 最高管理者确保顾客要求确定并满足 要求 注:符合√不符合×审核员日期 内部质量管理体系审核记录 MC/QW03-2001
受审部门总经理、管理者代表共页,第3页 标准 现场审核清审核记判定ISO 过程编 号5.3 5.4.1 5.4.2 单录 质量方针是否与公司的宗旨相 适应 质量方针是否包括猤满足要求 和持续改进 QMS 有效性的承诺 方针为制定和评审质量目标提 供框架质量方针是否已传达到 各级人员 最高管理者是否评审质量方针 的持续适宜性 质量目标是否与质量方针保持 一致 在各相关职能和层次上建立质 量目标 质量目标包括满足产品要求所 需的内容 质量目标是否可测量 最高管理者如何确保对QMS 进 行策划,以满足质量目标及条款 4。 1 的要求 最高管理者如何确保在对QMS 的更改进行策划和实施时,保持 QMS 的完整性 质量策划是否形成文件保存在 何处 注:符合√不符合×审核员日期 内部质量管理体系审核记录
内部质量体系审核作业指导书
1 目的 监控及评价质量体系的符合性、有效性,为质量体系的改进提供依据,确保质量体系持续有效地运行。 2 范围 适用于本公司内部的质量体系审核工作。 3 定义 无 4 职责 4.1 总经理负责任命具有审核员资格的审核组长和审核员并规定其职责,管理者代表负责组织实施内部质量体系审核工作。 4.2 质检部是内部质量体系审核的主职部门,负责拟订年度审核工作计划以及审核记录的保存和管理。 4.3 内部质量体系审核计划经管理者代表批准,审核组组长组织实施。 4.4各部门负责配合审核工作的实施,并对质量体系审核中发现的不合格项,负责制订纠正措施并落实执行。 5 程序 5.1年度审核计划 ,覆盖质量体系全部要素、部门、产品。由质检部制定年度内部质量体系审核计划,报管理者代表批准后组织实施。 5.1.2 当遇到以下情况时,可实行追加审核。 ; 当公司的质量体系有重大变化时,如组织机构、产品、质量方针和目标、生产技术与装备及生产场所有较大变动时; 即将进行第二方、第三方审核;获得认证证书后,在例行复查前或证书即将到期又希望保持时。 5.2 审核准备 5.2.1 由总经理根据审核部门的工作内容,任命具有内部审核员资格的合适人选担任审核组长,由审核组长负责审核的具体组织工作。 5.2.2 审核组由2人或2人以上组成,由审核组长选派具有内部审核员资格且与被审核部门无直接责任者担任审核组成员,并根据计划适当的分工。
,制定审核专用文件: ,向受审部门发出本次《审核计划》。 ; ; ,如果对审核日期和审核的主要项目有异议,可在两天之内通知审核组,经过协商可以再行安排。 5.3审核实施 ,检查质量体系的运行情况。 ,由审核员在《质量体系审核检查表》中填写不符合项的内容,并经该项工作负责人(或操作者)确认,同时填写纠正措施,以保证不符合项能够完全被理解、被有效纠正。,报告审核结果。 5.4 审核报告 审核组长负责编制《质量体系审核报告》,对存在的缺陷应编写相应的《不符合项报告》,并及时反馈被审核部门,由被审核部门认可,然后将审核报告提交管理者代表进行审批后,再分发各有关部门。 5.5 纠正措施 被审核部门在接到内部质量审核报告后,应针对不符合项及时进行原因分析,并且按规定在《不符合项报告》上填写纠正措施计划,交管理者代表审批。 5.6 纠正措施的有效性 被审核部门根据纠正措施计划实施整改,审核人员应对具体执行情况进行跟踪,若发现纠正措施达不到预期效果,应及时向主管领导和管理者代表报告,以便得到有效解决。 5.7 审核资料的管理 内部质量体系审核中形成的所有资料,按照有关《质量记录控制程序》规定执行。 6 引用文件 6.1《质量记录控制程序》 7 质量记录 7.1 《年审核计划》 7.2 《审核计划》 7.3 《检查表》
最新质量管理体系内审检查表
内部审核检查表 过程审核内容审核发现(包括时间、地点、事实)结果 Q 理解组织及其所处的环境1.是否建立了确定内、外部环境因素的机制(文件)。 2.在策划管理体系时有无考虑内外部环境的影响。如:经营范围、财务表现、规模及设施、人力资源能力、技术优势、知识等(内部因素)及涉及法律法规和专利技术、市场占有率、主要合作伙伴及同行的影响、信息渠道等(外部因素)。 3.如何收集、识别、分析、评审内外部因素。 4.是否持续地识别、分析、评审内外部因素,动态更新。 注意:该条款宜结合条款风险的识别和应对一起审核。 Q 理解相关方的需求和期望1.是否建立了识别相关方及其需求的机制(文件)。 2.如何识别、评价相关方;所识别的相关方是否适宜。 3.是否收集并确定这些相关方的需求及期望。 4.是否对这些相关方及其要求的信息进行分析、监视和评审。注意:该条款宜结合条款风险的识别和应对一起审核。 Q 确定质量管理体系的范围1.质量管理体系是否规定了明确的边界和范围。 2.公司在确定体系范围时是否考虑了内外部环境所带来的风险及其应对相关方要求和公司产品服务等因素。 3.体系范围是否形成文件,在什么文件中进行明确。 4.若体系标准的某些要求不适用,公司是否进行了声明,声明是否适宜。
Q 质量管理体系及其过程1.公司是否确定体系的整个过程,包括:是否确定了这些过程所需的输入和期望的输出;是否确定了这些过程的顺序和相互作用;是否确定和应用所需的准则和方法(包括监视、测量和相关绩效指标);是否确定这些过程所需的资源;是否分配这些过程的职责和权限;是否按照的要求识别风险和机遇;是否有改进过程;是否对上述过程进行评价。 2.体系策划是否考虑了、条款的内容,是否包括了变更的策划。 3.形成了哪些质量管理体系文件以支持体系运行。形成了哪些记录以证明体系的正常运行。 Q 领导作用和承诺 Q 以顾客为关注焦点询问最高管理者: 1.是否清楚在质量管理体系中承担的职责。 2.如何组织公司质量方针和目标的制定;方针目标是否与公司战略方向、组织环境相适应;资源配置是否满足。 3.对管理体系融合业务过程是如何考虑的。 4.对过程方法和基于风险的思维是如何运用的;对相关事务有无跟踪、落实和考核。 5.如何体现满足顾客要求和法律法规要求的重要性。 6.如何理解以顾客为关注焦点,如何致力于顾客满意。 7.如何确保体系实现预期效果。 8.如何推动体系持续改进。 9.公司其他各级管理者在管理体系建设中的领导作用如何发挥。 Q 方针 1.现场抽查2—3人询问:公司质量方针是什么? 2.方针的制定、实施和保持情况如何;方针是否符合公司战略方向。 3.方针是否体现了公司的宗旨及承诺。 4.方针是否反映了顾客及相关方的期望与要求及法律法规的符合性。 5.方针有无形成文件;如何对员工进行宣贯、传达。
2017年中内部质量管理体系审核报告
2017年中内部质量管理体系审核报告 审核原因:企业变更了企业负责人, 审核目的:为确保公司符合医疗器械质量管理体系的要求,推进质量管理体系持续有效地运行,经公司研究决定,于二○一七年七月十五日对公司内部的质量管理体系进行全面的审核,现将审核情况报告如下: 一、检查与考核目的: 通过内部审核,评价本公司医疗器械质量管理体系的符合性、适宜性和有效性并对本公司医疗器械质量管理制度的执行情况做评价,找出不符合项,提出改进措施和防止不合格再发生的预防措施,不断完善质量管理。 二、审核范围: 全公司所有部门及岗位 三、审核依据: 1、《医疗器械经营监督管理办法》; 2、《医疗器械说明书和标签管理规定》; 3、《医疗器械经营质量管理规范》; 4、《食品药品监管总局关于印发国家重点监管医疗器械目录的通知》和相关法规、公司质量管理制度和相关文件; 5、公司现行的质量管理体系文件 五、审核组成员 六、内审时间安排 2017年7月15日一天 上午:对需现场检查的项目进行检查,包括岗位人员的实际操作,现场提
问等。 下午:对医疗器械的文件、制度、人员培训、购销存等记录进行检查。七、审核结论 在公司领导的重视下,在各部门的大力支持配合下,使我们能在预定的1天时间内,对公司的质量管理体系总的运行情况和现状进行全面的、深入的内部审核工作。通过查阅资料,检查相关记录及表格、现场观察、抽查提问等方式,逐项查对,得出如下结论: (一)对公司医疗器械质量管理运行情况进行全面的内部审核。我们的审核是按照医疗器械监督管理条例及公司有关制度等逐项进行抽样检查,得出以下结论:共56项经检查结果出现1项不合格。经审核组讨论并一致认为:公司目前的质量管理体系运转正常,是适宜有效的,符合医疗器械质量管理标准,具体如下: 1、管理职责: (1)公司严格按许可证核准的经营方式和经营范围从事产品经营活动,无发现超范围经营的情况。 (2)公司组织结构及岗位设置合理,各岗位人员职责清晰,责任明确,按照医疗器械质量管理标准要求和公司实施管理需要,建立了以总经理为首、质量负责人为辅的组织机构,下设质量管理部、储运部等,质量管理部能实施公司的质量方针,建立质量管理体系,保证质管人员行使职权,对各岗位的质量职责及职责权限也进行了明确的规定,从运行的效果来看,所有的岗位职责都得到了有效地落实,使之各司其职,各尽其责。 (3)公司的质量管理体系文件适宜,充分并有效,与国家有关产品管理法律法规相适应。公司领导非常重视对全体员进行文件的学习培训和操作指导,从运行的情况及这次内审的结果显示,文件全部得到贯彻落实并有效执行。
质量管理体系审核检查表
证据记录判定 4.2.3文件控制 是否符合质量管理体系要求的文件?●符合GB/T 19001-2008的质量 手册, 或质量手册 并附带转换矩阵表 ●文件控制清单或 等同物 是否建立了文件化的文件,确定下列所需的控制? a)在文件发布前得到批准,以确保适宜性? b)必要时,文件评估及更新并得到再次批准? c)确保识别文件的变更和现行修订状态? d)确保适用文件的相关版本在使用现场可得? e)确保文件保持清晰和易于识别? f)确保外来文件得到识别,并控制其分发? g)防止作废文件的非预期使用,如果它们因任何原因需要保留,则需加以适当的标识?●文件批准的授权●文件批准记录 ●不同场所文件的可得性 ●文件处所可知 ●文件可被理解 ●作废文件的贮存,处置 ●内外部文件通知/发放过程 ●修改文件的评审和批准 4.2.4记录控制 是否建立并维护质量记录,以证明符合要求和质量体系的有效运行? ●质量管理体系记录 ●记录维护体系,包括记录的处置
证据 记录 判定 记录是否清晰,易于识别和可恢复? ●质量管理体系记录的清晰度 ●质量管理体系记录的标识 ●环境和存放条件必须与文件的存储方法相协调(如:硬拷贝,软盘等) 是否建立书面程序,以明确记录的标识、贮存、保护、恢复、保存期限和处置所需的控制? ●依照GB/T 19001-2008的质量 手册 ●根据顾客/法规要求确定的保存期限 ●保存期满后记录的处理 ●包括作废文件的标识 ●残缺/过时文件的标识 是否把质量记录作为一种特殊类型的文件并根据问题4.2.7和4.2.8的要求进行控制? ●按照质量手册维护和控制质量记录 的证据 目标,包括那些为满足产品要求所需要目标? 质量目标是否可测量的,并与质量方针保持一致? ●质量成本指标和质量指标值 ●质量目标包括在/与业务计划的联系
供应商(生产企业)质量体系调查表
供货单位质量体系调查表 企业名称(公章)企业经济 性质 电话 传真 注册地址邮编仓库地址年销售额 生产许可证 证号有效 期至GMP证号 有效 期至 营业执照号经营方式批发 生产范围 片剂□硬胶囊剂□软胶囊剂□丸剂□颗粒剂□散剂□软膏剂□乳膏剂□ 凝胶剂□栓剂□酊剂□其它□:。 法定代表人姓名 质量负责人 姓名学历从业资格学历 企业负责人姓名 质管部负责人 姓名从业资格电话学历 企业质量体系情况员工情 况 质量管理部执业药师验收人员养护人员库房总面积㎡常温库㎡阴凉库㎡冷库㎡冷藏车或保温箱㎡ 1、库房设施设备是否满足药品储存要求:是□否□ 2、温湿度调控系统是否满足药品储存要求:是□否□ 3、是否有计算机管理系统并符合控制要求:是□否□ 4、是否有完全保障体系文件(防火、防盗、监控等)设施:是□否□ 5、质量管理体系文件(制度、规程、职责等)是否完善并符合要求:是□否□ 6、运输管理措施是否符合GSP要求:是□否□ 7、冷藏药品是否委托运输,承运单位质量保证能力是否符合要求:是□否□ 质量保证能力及信誉情 况1、近几年是否发生过重大质量事故是□否□ 2、是否有质量投诉及筹建不合格的情况是□否□ 3、企业是否承诺在经营行为中诚实守信是□否□ 4、企业经营行为中在法律上有无不良行为记录是□否□ 审核评价结论1、该单位资质是否齐全、有效:是□;否□ 2、该单位质量保证体系:健全□;基本健全□;不健全□;待完善□ 3、该单位质量信誉能力:好□;一般□;差□ 4、实地考察:需要□;不需要□ 5、审核意见:合格□;不合格□ 审核评价人签字:审核日期: 注:请按实际情况填写及在□处打“√”;最后一栏由购货方自己填写。
质量管理体系内部审核技巧与方法
企业质量体系内部审核员的审核方法和技巧 质量体系审核员 企业质量体系内部审核员的审核方法和审核技巧 欢迎参加2000版ISO 9000标准的网上培训,本次培训将结合新版标准介绍企业内部审核员应该掌握的基本审核方法和技巧。希望通过网上的学习,使质量管理工作者对审核有一个大概的了解,初步掌握一些方法,可以开展审核工作。如果需要更详细的资料,请按网站上的联系方式与我们联系。 第一讲审核 一基本概念 1 审核是指什么? 审核——为获得审核证据并对其进行客观的评价,以确定满足审核准则的程度所进行的系统的、独立的并形成文件的过程。 2 过程实是指什么? 企业在实施94版ISO9000标准时,是按逐个要素编制程序文件,2000版则分为五大过程,所有的工作都分解成各种过程。审核的过程是指――审核到现场发现证据对其进行评价,确定是否满足审核准则。 3 审核准则是指什么? 审核准则原称审核依据。(包括ISO9001标准,手册,程序文件,法律法规的有关要求或其它依据) 审核是按我们自己所承诺的一些文件结合我们现场做的过程是否符合这些文件的要求。 4 审核的目的是指什么? 审核的目的:是确保企业质量体系与ISO 9000质量标准的符合性和有效性。 符合性是指我们所做的过程和活动是否符合标准中所要求的内容,或是否符合对外承诺的标准,或者是对外承诺的活动。 5 审核员的工作是什么? 内审员的工作就是拿着编好的各种文件对照各个部门做的情况是否符合。 二新版9001与9004的区别 9001和9004是两个相关的标准,所有的标题号内容全部是一一对应的,只不过9001标准作为审核、作为企业、作为组织申请认证必须按照9001标准的要求检查我们的活动。但是如果编制质量手册或准备各种质量文件、策划各种活动的时候,就要按9004标准。要求一个组织在编制质量手册和程序文件的过程中,要把9001和9004两个标准对照起来。
供应商品质管理体系调查表(中英文)
Item No.Element Assessed Score Remarks 序号审核要素分数(0,1,2,NA)备注 -1.1*Is there a Quality System established, implemented and maintained? 质量体系是否有建立,实施和维护? 1.2*Are there Quality Policy and Quality Objectives?是否有制定品质方针和品质目标?1.3*Is there a Documented Quality Manual? 是否有形成文件的品质手册?1.4*Is there a written procedure for documentation review, approval,and release?是否有文件审核,发行的书面程序文件?1.5Are changes to documents reviewed and approved by the functional organization(s) that performed the original review and approval?文件变更是否有由原审核部门核准?1.6Are obsolete documents identified to prevent unintended use?作废文件是否有区分以防止误用? 1.7Are relevant documents available at the point of use? 相关文件在使用部门是否可用?1.8Is a Master List available showing the current revisions of all pertinent documents? 是否有文件清单记录所有相关文件的当前版本?1.9Are customer furnished drawings identified and controlled by supplier?客户提供的图纸是否有标识并受控?1.10*Is there a documented procedure defining the identification,storage, protection, retrieval, retention time and disposition quality records? 是否有书面程序规定品质纪录的识别,保存,防护,获取保存期限和处置?Percent 百分比 -2.1Are Quality Objectives explained to employees and measured at relevant functions?品质目标是否已向员工传达,并被各部门量2.2Do adequate resources exist to support and continuously improve the quality objectives?是否有充分的资源支持持续提高Is the Quality Dept. functionally separated from production and does it report independent of manufacturing/engineering to top 2.0 Management Responsibility 管理职责 1.0 Quality Management System 品质管理体系Subtotal 本部分分数合计 SUPPLIER SURVEY 供 应 商 调 查Quality Management System Survey 品质管理体系调查2.3management level? 品质部门是否从职能上与生产分开并独立报告给最高管理层?2.4*Is there a documented internal audit procedure? 是否有形成文件的内部审核程序?2.5Is the internal audit on schedule? 内部审核是否按计划执行?2.6Are there appropriate communication processes within the organization about quality performance and customer satisfaction? 供应商是否就品质绩效及客户满意度进行有效的内部沟通?2.7Does top management regularly review the quality management system for its continuing suitability, adequacy and effectiveness? 管理层是否定期对品质系统的持续适合性,充分性有效性进行评审?2.8Is there a method which employees can use to communicate to upper management, problems or suggestions to improve Quality? 是否建立员工与管理层就改善品质的问题和建议进行有效沟通的方法?2.9Is there business continual plan(Emergency plan)? 是否有业务持续计划(应急计划)?- 3.1Are the necessary competence identified for employee performing work affecting product quality? 对于执从事与产品质量相关工作的员工其必要的能力是否有识别?3.2Is there a documented training program? 是否有形成文件的培训程序?3.3Do employees receive job related training? 职员是否有受到工作相关的训练?3.4Have hazardous conditions within the work place been identified and applicable training provided for employees? 工作场所中的危险源是否有标识相关员工是否有培训?3.5Is the effectiveness of training evaluated? 培训的有效性是否有评估?3.6Do records exist that identify the training an employee has received?是否保存了相关的培训记录?3.7Are trainers appropriately qualified? 训练员是否有相关的资格?3.8Are there requirements for retraining/re-certification? 是否有重新培训和认证的要求?39Is there an equipment/tooling preventative maintenance Subtotal 本部分分数合计 Percent 百分比 3.0 Resource Management 资源管理 3.9program available?是否有设备/模具预防保养程序?PQ 4.007.000 Rev Q Page 8 of 27
