电穿孔法转化大肠杆菌TG1的条件优化

药 物 生 物 技 术
Pharmaceutical Biotechnology 2001,8(3):143~146
电穿孔法转化大肠杆菌TG1的条件优化Ξ
李 南,凌世淦2,吴梧桐1
(11中国药科大学生物制药学院,南京210009;21军事医学科学院基础医学研究所分子病毒学实验室,北京100850)
摘 要 研究了质粒pFab74X经电穿孔转化大肠杆菌TG1菌株的影响因素,并优化其转化条件。电场强度和脉冲时间的影响较为复杂,两者适当组合才可获得高转化效率。此外,采用对数生长早期的细菌,提高细菌浓度和降低筛选用氨苄青霉素的浓度均可提高转化效率。
关键词 电穿孔;转化效率;大肠杆菌TG1
中图分类号:Q68,Q936 文献标识码:A 文章编号:100528915(2001)0320143204
构建cDNA文库或基因文库时,转化效率高低是决定其多样性的关键因素之一。但常用的磷酸钙及原生质体等转化法转化效率均较低,批间差异较大,转化后再生时间长。电穿孔法(E lec2 troporation)则较好的解决了这个难题,它是利用瞬间高压电脉冲作用于受体细胞,使细胞表面产生暂时性的孔隙,从而将DNA、RNA、蛋白质等多种生物分子或颗粒导入胞内的方法,也称为电转化法。由于电穿孔是一个物理过程,适用范围广,转化效率高,特别是针对易受溶酶体消化的生物分子[1]及没有合适遗传转化系统或转化效率低的细胞,效果显著。目前,电穿孔法已经广泛应用于生物学、医药学、食品学等各个领域,成为转化细胞的常用方法。
电穿孔法最早是应用于真核细胞。1982年, W ong和Neumann成功的用电穿孔法转化小鼠成纤维细胞[2],但效率不高。现在,由于技术改进,操作简便快速,转化效率高,已广泛应用于原核细胞外源生物分子的导入。但影响转化效率的因素众多,不同的电穿孔体系[3]、受体细胞[4]、外源生物分子[5],其最佳转化条件均有一定差异。因此要获得高转化效率必须寻找这些因素的最佳组合。本文探讨了电场强度、脉冲时间、细菌浓度、细菌生长周期及转化子筛选过程氨苄青霉素浓度对TG1细菌转化效率的影响,并优化转化条件,以便利用TG1菌株建立高度多样性的基因文库,促进基因工程药物的发展。1 材料与方法
111 材料与仪器
E1coli TG1supE hsdΔ5thiΔ(lac2proAB)F’[traD36proAB+lacI q lacZΔM15]和质粒pFab74X (613kb,Ap r),由军事医学科学院基础医学研究所分子病毒学实验室保存;蛋白胨和酵母提取物为Ox oid公司产品,MOPS购自北京鼎国生物工程公司,氨苄青霉素(简称Ap)和其余试剂为进口或国产分析纯;S B培养基(3%蛋白胨,2%酵母提取物,1%MOPS,014%葡萄糖,10mm ol/L MgCl2, pH710),S OB培养基(2%蛋白胨,015%酵母提取物,0105%NaCl,215mm ol/L K Cl,10mm ol/L MgCl2, pH710),S OB2A培养基(含100mg/L Ap的S OB培养基),S OC培养基(S OB培养基,加20mm ol/L葡萄糖),S OC2A培养基(含100mg/L Ap的S OC培养基);I N2101型基因脉冲导入仪(天津理工学院), Lambda2UV/VIS型光谱分析仪(美国Perkin2 E lmer公司)。
112 菌株制备
将270℃冻存的TG1菌种分别于S OB和S OB2 A琼脂平板上划线培养,验证其为Ap s。从S OB 平板上挑取单菌落,37℃于S B培养基中培养至OD600约为110。取培养物按1∶100的比例重接于S B培养基中,37℃培养至OD600约为016。培养物冰浴中放置30min后,在4℃以4000r/min离心
341
Ξ收稿日期:2001203212
基金项目:北京市自然科学基金资助,N o.7002031
作者简介:李南(1976年生),男,江苏南京人,中国药科大学硕士生,分子生物学,E2mail:s outh-lee@etang1com
15min。用预冷的10%甘油溶液重复洗涤细菌3次,最后于4℃,3000r/min离心20min。弃上清后加少量10%甘油溶液将细菌悬浮,取样稀释测OD600值,计算细菌浓度并调整至2×1010/ml,每管200μl分装后-70℃冻存备用。
113 质粒制备
pFab74X在E1coli JM109中扩增,采用上海华舜生物工程公司质粒提取试剂盒提取,经琼脂糖电泳和紫外吸收法分析和鉴定产物纯度。用灭菌超纯水稀释至100mg/L,-20℃保存备用。
114 转化方案
-70℃保存的感受态细菌于冰浴中缓慢解冻,与2μl质粒溶液混匀后,加于预冷的样品杯内。电击后,迅速加入1ml预冷的S OC培养基,混匀后37℃缓慢振荡培养45min。培养物用S OC培养基有限稀释,分别铺于S OC和S OC2A平板上,培养过夜后计数,计算转化效率(转化子数/μg DNA)和存活率(转化后活菌数/转化前细菌总数)。
2 结 果
211 脉冲时间和电场强度对TG1菌株转化效率的影响
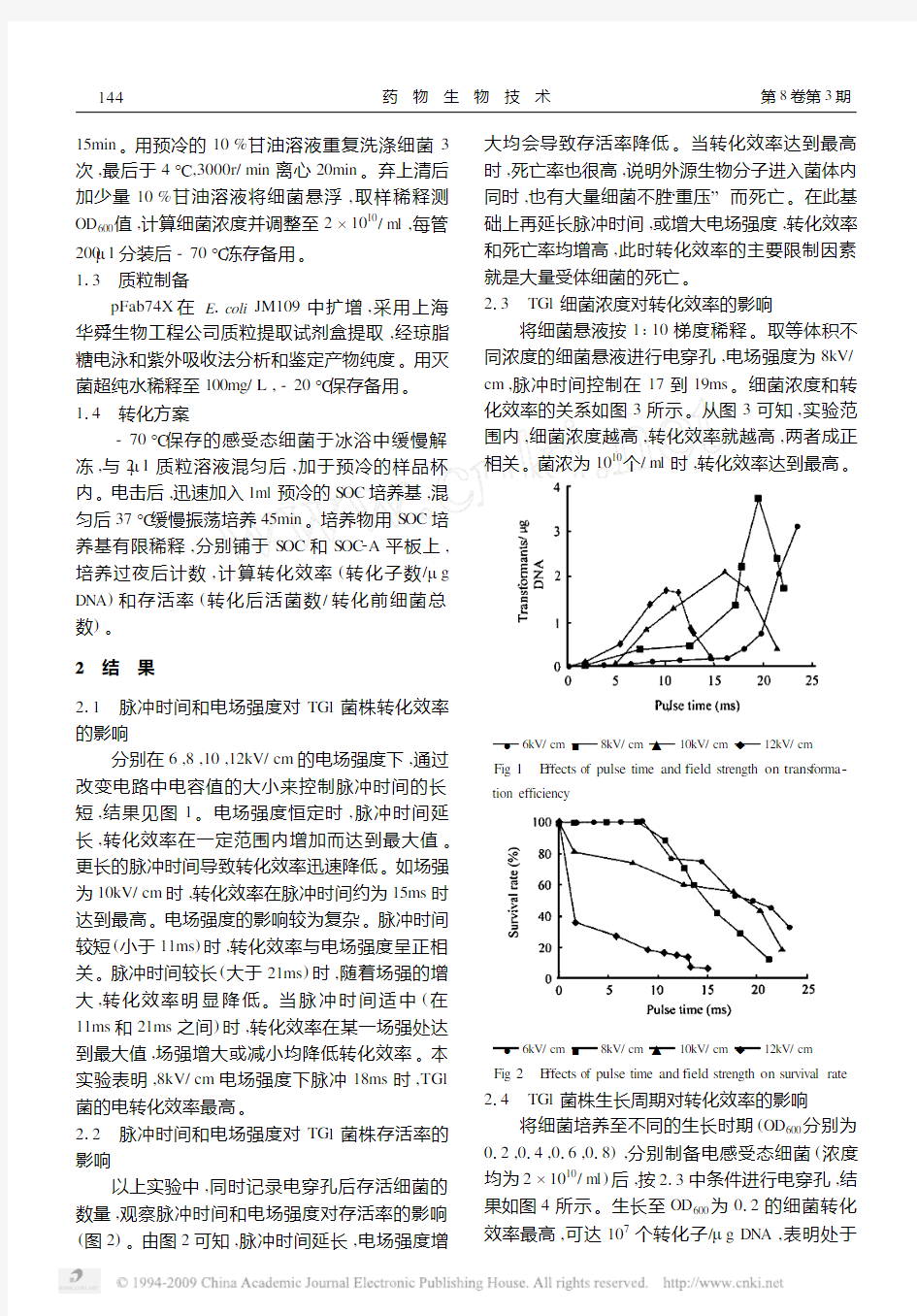
分别在6,8,10,12kV/cm的电场强度下,通过改变电路中电容值的大小来控制脉冲时间的长短,结果见图1。电场强度恒定时,脉冲时间延长,转化效率在一定范围内增加而达到最大值。更长的脉冲时间导致转化效率迅速降低。如场强为10kV/cm时,转化效率在脉冲时间约为15ms时达到最高。电场强度的影响较为复杂。脉冲时间较短(小于11ms)时,转化效率与电场强度呈正相关。脉冲时间较长(大于21ms)时,随着场强的增大,转化效率明显降低。当脉冲时间适中(在11ms和21ms之间)时,转化效率在某一场强处达到最大值,场强增大或减小均降低转化效率。本实验表明,8kV/cm电场强度下脉冲18ms时,TG1菌的电转化效率最高。
212 脉冲时间和电场强度对TG1菌株存活率的影响
以上实验中,同时记录电穿孔后存活细菌的数量,观察脉冲时间和电场强度对存活率的影响(图2)。由图2可知,脉冲时间延长,电场强度增大均会导致存活率降低。当转化效率达到最高时,死亡率也很高,说明外源生物分子进入菌体内同时,也有大量细菌不胜“重压”而死亡。在此基础上再延长脉冲时间,或增大电场强度,转化效率和死亡率均增高,此时转化效率的主要限制因素就是大量受体细菌的死亡。
213 TG1细菌浓度对转化效率的影响
将细菌悬液按1∶10梯度稀释。取等体积不同浓度的细菌悬液进行电穿孔,电场强度为8kV/ cm,脉冲时间控制在17到19ms。细菌浓度和转化效率的关系如图3所示。从图3可知,实验范围内,细菌浓度越高,转化效率就越高,两者成正
相关。菌浓为1010个/ml时,转化效率达到最高。
●6kV/cm ■8kV/cm ▲10kV/cm ◆12kV/cm
Fig1
E ffects of pulse time and field strength on trans forma2 tion efficiency
●6kV/cm ■8kV/cm ▲10kV/cm ◆12kV/cm
Fig2 E ffects of pulse time and field strength on survival rate 214 TG1菌株生长周期对转化效率的影响将细菌培养至不同的生长时期(OD600分别为012,014,016,018),分别制备电感受态细菌(浓度均为2×1010/ml)后,按213中条件进行电穿孔,结果如图4所示。生长至OD600为012的细菌转化效率最高,可达107个转化子/μg DNA,表明处于
441药物生物技术第8卷第3期
Fig3 E ffect of concentration of host cell on trans formation efficiency
对数生长早期的TG1菌株,其转化效率高于对数生长晚期和稳定期的细菌。
215 氨苄青霉素浓度对转化效率的影响
筛选转化子时Ap的浓度从100mg/L降至20 mg/L,测定转化效率,结果如图5所示。Ap的浓度从100mg/L降至20mg/L,转化效率却上升约5倍。在20mg/L Ap的平板上随机挑取10个单菌落,接种于S OB2A培养基中,振摇后均可生长,证明不是假阳性克隆。由于抗性筛选是在电穿孔过程之后进行,故Ap是通过电击后存活的转化子数来改变转化效率的。
3 讨 论
菌株大小、形状、细胞壁和细胞膜组成不同,则对相同强度的电脉冲敏感程度不一样,所以不同菌株的转化效率各异。我们观察了大肠杆菌TG1电穿孔转化的几个影响因素,结合电穿孔作用的机理对转化条件进行了优化。
电场强度和脉冲时间是影响转化效率的两个关键因素
。电穿孔过程中,外源分子进出的孔隙是在电场的作用下,细胞表面结构的两侧形成极化,产生高强度的跨膜电势
。当该电位差超过某一临界水平时,细胞表面被击穿而产生暂时性的孔道[6],这些过程在几到十几毫秒内完成[7]。因此,只要采用足够高的电场强度击穿细胞,并且用一定时间的电压维持这些孔道的存在就可以实现细胞的转化[8]。本研究结果表明,适当的场强和脉冲时间的组合可使转化效率达到最大值。其中之一改变时,达到最大转化效率时的另一参数也随之改变。这种现象可能是因为高场强下,细胞表面两侧电位差很高,瞬间击穿表面而形成孔道,所需时间短;低场强下,细胞表面极化所需时间较长,电荷积累到一定强度后,才能作用于细胞表面。
受体细胞也是影响转化效率的重要原因。细胞浓度高时,外源分子进入的几率增加,转化子数就会增多。处于对数生长早期的细菌生命力旺盛,表面结构致密度比稳定期的细菌差,转化效率高。另外据报道,培养基高压灭菌产生不利于细菌生长的化合物,采用洁净状况下新鲜配置的培养基不经高压灭菌培养细菌,转化效率可增加20%。电穿孔体系中甘油的作用是有利于保存细菌,但会影响细胞活性。有研究用超纯水反复洗涤细菌后,直接进行电穿孔,转化效率可进一步提高。
Fig4 E ffect of growth phase on trans formation efficiency
Fig5 E ffect of concentration of Am picillin on trans formation efficiency
电穿孔后受体细菌的恢复能力与转化效率也有关系。电穿孔是一种物理作用,故放电过程必然使细菌受到一定程度的损害。电穿孔过程中,有相当一部分细胞表面产生空隙,外源生物大分子进入细胞,但却不能承受一定时间的高场强而破裂死亡,产生无效转化。电穿孔后细菌修复能力越强,转化效率越高。本研究筛选时采用低浓度Ap以降低抗性压力,转化子数明显增多,表明电穿孔后的细胞虽经短时间的培养,仍然较脆弱,适当降低选择压力,使转化菌的抗性基因足够表达,可进一步提高转化效率。
541
李 南等:电穿孔法转化大肠杆菌TG1的条件优化
在电穿孔体系中,低离子强度是维持一定时间高场强的关键。如果电击液中电解质浓度高,导电能力强,放电两极之间形成低电阻通路,瞬间电流急剧增加,电场强度迅速减小,产生激烈的放电现象,对受体细胞形成无效放电或旁路放电,不能产生传输孔道。同时,瞬间强电流导致电击体系温度骤然升高,大量细菌死亡。由于细菌太小,通常需要用较高的场强(6~12kV/cm),为了避免产热又达到一定的脉冲时间,有必要在电击转化前采用超纯水充分洗涤细菌,同时降低电击时的温度。
另外,外源分子的大小、构型、纯度、浓度以及与受体细菌的比例均影响转化效率。最终,我们利用不经高压灭菌的培养基培养大肠杆菌TG1,生长至OD600为012,超纯水反复洗涤并浓缩至2×1010个/ml。用终浓度为10μg/L的质粒pFab74X 低温下电穿孔转化该细菌,电场强度和脉冲时间分别为8kV/cm和18ms。电击后适当延长保温时间,在含20mg/L Ap的平板上计数转化子,转化效率为5175×107个转化子/μg DNA,大大高于其它转化方法。
参考文献
〔1〕 杜权,贺福初,薛社普.X L12blue菌株电穿孔转化方案的条件优化[J]1军事医学科学院院刊,1998,22(2):1361
〔2〕 W ong TK,Neumann E.E lectric field mediated gene trans fer[J].
Biochem Biophys Res Commun,1982,107(2):5841
〔3〕 Na S,Shen T,X iao W,et al.The factors affecting trans formation efficiency of coryneform bacteria by electroporation[J].Chin J Biotechnol,1995,11(3):1931
〔4〕 Baum C,F orster P,Hegewisch2Becher S,et al1An optim ized electroporation protocol applicable to a wide range of cell lines[J].
Biotechniques,1994,17(6):10581
〔5〕 Sheng Y,M ancino V,Birren B.T rans formation of Escherichia coli with large DNA m olecules by electroporation[J]1Nucleic Acids Res,1995;23(11):9901
〔6〕 陈乃用.电穿孔法在细菌质粒转化中的应用[J].微生物学通报,1991,18(2):971
〔7〕 T ekle E,Astum ian RD,Chock P B.Selective and asymmetric m olecular transport across electroporated cell membranes[J].Proc Natl Acad Sci USA,1994,91(24):1151
〔8〕 丁志山,蒋承俊,吴根福.电穿孔法转化完整酵母的研究[J].生物技术,1995,5(4):91
Optimization of E lectroporation Protocol for Escherichia Coli Strain TG1
LI Nan1,LI NG Shi2gan2,WU Wu2tong1
(11School o f Biopharmaceutics,China Pharmaceutical Univer sity,Nanjing210009;21Laboratory o f Molecular Virology,Institute o f Basic Medical Sciences,Academy o f Military Medical Sciences,Bei2 jing100850)
Abstract E lectroporation was performed to trans fer plasmid DNA of pFab74X into E1coli strain TG1.A number of factors that effected trans formation efficiency were investigated.High trans formation efficiency was obtained with an appropriate combination of field strength and pulse time.T rans formation efficiency could als o be elevated by using hosted cells harvested in the early exponential growth phase,increasing the density of cells or decreasing the con2 centration of Am pcillin in the course of screening1
K ey w ords E lectroporation,T rans formation efficiency, E1coli strain TG1
?信息?
20012A261 人白细胞介素11的改造和制备 人白细胞介素11具有刺激巨核细胞增生、增加血小板数量、调节免疫功能和粘膜保护等功能,其重组产品已应用于临床治疗肿瘤病人化疗后引起的血小板减少症。本发明采用基因工程手段制备出改进的新型改进型重组人白介素11,经证明与天然人白介素11有相同的体内外生物功能,可望成为治疗血小板减少症的药物。
641药物生物技术第8卷第3期
大肠杆菌电转化感受态细胞制备.
大肠杆菌电转化感受态细胞制备 第一天: 1.将适合菌株(如XL1-Blue, DH5α置于LB或其他营养丰富的培养基上,在37°C 下过夜培养 2.高温灭菌大的离心瓶(250-500ml以备第二天摇瓶用 3.准备几瓶灭菌水(总量约1.5升,保存于冷冻室中以备第二天重悬浮细胞用 第二天: 4.转移0.2-1ml过夜培养物至装有500ml LB(或其他营养丰富的培养基的1-2升挡板摇瓶中 5. 37°C下剧烈振荡培养2-6小时 6. 定时监控O.D.600值(培养1小时后每半小时测定一次 7. 当O.D.600值达到0.5-1.0时,从摇床中取出摇瓶,置于冰上冷却至少15分钟(需要的话这种方式可以存放培养液数小时 8.细胞在4°C 5000g下离心15分钟,弃上清液(如需要,沉淀可在4°C的10%甘油中保存一两天 9.用灭菌的冰水重悬浮细胞。先用涡旋仪或吸液管重悬浮细胞于少量体积中(几毫升,然后加水稀释至离心管的2/3体积。 10.照上面步骤重复离心,小心弃去上清液 11.照上面步骤用灭菌的冰水重悬浮细胞 12.离心,弃上清液
13.用20ml灭菌的、冰冷后的10%甘油重悬浮细胞 14.照上面步骤离心,小心弃去上清液(沉淀可能会很松散 15.用10%甘油重悬浮细胞至最终体积为2-3ml 16. 将细胞按150μl等份装入微量离心管,于-80°C保存 转化方法: 1. 在冰上解冻电感受态细胞添加1-10μl DNA ,冰上培育约5分钟 2. 添加1-3μl DNA ,冰上培育约5分钟 3. 转移DNA/细胞混合物至冷却后的2mm电穿孔容器(无泡中 4. 加载P1000,准备好300μl LB 或2xYT 5. 对电穿孔容器进行脉冲(200 欧姆, 25μFd, 2.5 千伏(检查时间常数,应该在3以上 6. 立即添加300μl 的LB或2xYT至电穿孔容器中 7. 37°C下培养细胞40分钟至1小时以复原 8. 转移细胞至适当的选择培养基上培养 大肠杆菌感受态细胞制备及转化中的影响因素 1、感受态细胞的概念 重组DNA分子体外构建完成后,必须导入特定的宿主(受体细胞,使之无性繁殖并高效表达外源基因或直接改变其遗传性状,这个导入过程及操作统称为重组DNA 分子的转化。
微生物发酵培养基的优化方法
工业发酵进展
微生物发酵培养基的优化方法 对于微生物的生长及发酵,其培养基成份非常复杂,特别是有关微生物发酵的培养基,各营养物质和生长因子之间的配比,以及它们之间的相互作用是非常微妙的。面对特定的微生物,人们希望找到一种最适合其生长及发酵的培养基,在原来的基础上提高发酵产物的产量,以期达到生产最大发酵产物的目的。发酵培养基的优化在微生物产业化生产中举足轻重,是从实验室到工业生产的必要环节。能否设计出一个好的发酵培养基,是一个发酵产品工业化成功中非常重要的一步。以工业微生物为例,选育或构建一株优良菌株仅仅是一个开始,要使优良菌株的潜力充分发挥出来,还必须优化其发酵过程,以获得较高的产物浓度(便于下游处理),较高的底物转化率(降低原料成本)和较高的生产强度(缩短发酵周期)。设计发酵培养基时还应时刻把工 实验室最常用的优化方法是单次单因子法,这种方法是在假设因素间不存在交互作用的前提下,通过一次改变一个因素的水平而其他因素保持恒定水平,然后逐个因素进行考察的优化方法。但是由于考察的因素间经常存在交互作用,使得该方法并非总能获得最佳的优化条件。另外,当考察的因素较多时,需要太多的实验次数和较长的实验周期[3]。所以现在的培养基优化实验中一般不采用或不单独采用这种方法,而采用多因子试验。 2.多因子试验 多因子试验需要解决的两个问题: (1)哪些因子对响应具有最大(或最小)的效应,哪些因子间具有交互作用。 (2)感兴趣区域的因子组合情况,并对独立变量进行优化。
3.正交实验设计 正交实验设计是安排多因子的一种常用方法,通过合理的实验设计,可用少量的具有代表性的试验来代替全面试验,较快地取得实验结果。正交实验的实质就是选择适当的正交表,合理安排实验的分析实验结果的一种实验方法。具体可以分为下面四步: (1)根据问题的要求和客观的条件确定因子和水平,列出因子水平表; (2)根据因子和水平数选用合适的正交表,设计正交表头,并安排实验; (3)根据正交表给出的实验方案,进行实验; (4)对实验结果进行分析,选出较优的“试验”条件以及对结果有显著影响的因子。 正交试验设计注重如何科学合理地安排试验,可同时考虑几种因素,寻找最佳因 次 报道。CastroPML报道用此法设计20种培养基,做24次试验,把gamma干扰素的产量提高了45%。 6.部分因子设计法 部分因子设计法与P1ackett-Burman设计法一样是一种两水平的实验优化方法,能够用比全因子实验次数少得多的实验,从大量影响因子中筛选出重要的因子。根据实验数据拟合出一次多项式,并以此利用最陡爬坡法确定最大响应区域,以便利用响应面法进一步优化。部分因子设计法与Plaekett-Burman设计法相比实验次数稍多,如6因子的26-2部分因子设法需要进行20次实验,而Plackett-Burman设计法只需要7次实验。 7.响应面分析法
(完整版)大肠杆菌培养基配制及培养方法
大肠杆菌培养 一、菌种冻存液的制备 含有足量细菌的液体培养基离心后在沉淀中加入等量40%甘油,-80o C冻存。 二、培养基制备 LB培养基配方(胰化蛋白胨(Trypton):10 g/L;酵母提取物(Yeast Extract):5 g/L;NaCl:10 g/L;pH 7.4) 液体培养基 胰化蛋白胨 10.0g 酵母粉 5.0g 氯化钠 10.0g 水 1000ml pH 7.4 固体培养基在液体培养基的基础上再加入1.5%-2.0%的琼脂 三、平板的制备 1)称取胰化蛋白胨10.0g,酵母粉5.0g,NaCl 10.0g,加入800mL二次水溶解,并用玻璃棒搅拌均匀,用1mol/L的NaOH调pH至7.4左右,定容至1L,调pH 7.4(若溶液pH大于7.4,用1mol/L HCl回调)。 2)分装在锥形瓶中,每瓶量不宜太多,没过瓶底一指左右。如需固体培养基在分装后的液体培养基内加入约2%的琼脂(150mL液体培养基加入2.5g琼脂)。3)在锥形瓶口依次覆盖带滤纸通气小孔的塑料膜和硬质纸,用皮筋捆好。所有锥形瓶如上述操作。用记号笔注明培养基名称、配制日期。 4)高压蒸汽灭菌锅121 oC灭菌15min。 5)灭菌后的培养基取出置电热鼓风干燥器内60oC烘干,待锥形瓶的封口纸干燥后取出。液体培养基可直接保存或使用,此时加有琼脂的培养基不会凝固,可在预先紫外杀菌30min以上的无菌操作台上,将培养基倒入培养皿内,每个培养皿培养基约10-15mL(直径90mm),在培养皿中厚度大约4mm左右。将平皿叠放在无菌操作台上,放置10min左右,待琼脂基本凝固可涂平板。6)若平板不直接使用,灭菌后将培养基在锥形瓶中保存,待需制备平板时,微波炉中火加热约3min,使琼脂熔化,室温冷却20min至不烫手可制备平板。 四、接种大肠杆菌 1)取实验室储备的大肠杆菌BL21冻存液,管口用酒精灯灼烧,打开离心管。2)接种方法一:用灭菌枪头蘸取冻存液在平板边缘上划横条,每三道为一组,旋转平皿一圈,最后中间划之字;接种方法二:用移液枪吸取100uL溶液于平板上,用酒精灯灭菌厚的涂抹棒划十字,涂布平板。 3)因实验一般都要求挑取单菌落,故涂平板适应考虑冻存液内细菌数量,若菌量过大应适当稀释。一般方法一获得单菌落的可能性比较大。涂平板应在酒
大肠杆菌感受态细胞的制备和转化原理
大肠杆菌感受态细胞的制备和转化(原理) 感受态细胞的概念重组DNA分子体外构建完成后,必须导入特定的宿主(受体)细胞,使之无性繁殖并高效表达外源基因或直接改变其遗传性状,这个导入过程及操作统称为重组DNA分子的转化。在原核生物中,转化是一个较普遍的现象,在细胞间转化是否发生,一方面取决于供体菌与受体菌两者在进化过程中的亲缘关系,另一方面还与受体菌是否处于一种感受状态有着很大的关系。 1、感受态细胞的概念 所谓的感受态,即指受体(或者宿主)最易接受外源DNA片段并实现其转化的一种生理状态,它是由受体菌的遗传性状所决定的,同时也受菌龄、外界环境因子的影响。cAMP可以使感受态水平提高一万倍,而Ca2+也可大大促进转化的作用。细胞的感受态一般出现在对数生长期,新鲜幼嫩的细胞是制备感受态细胞和进行成功转化的关键。 制备出的感受态细胞暂时不用时,可加入占总体积15%的无菌甘油或-70℃保存(有效期6个月)。 2、转化的概念及原理 在基因克隆技术中,转化特指将质粒DNA或以其为载体构建的重组DNA导入细菌体内,使之获得新的遗传特性的一种方法。
它是微生物遗传、分子遗传、基因工程等研究领域的基本实验技术之一。 受体细胞经过一些特殊方法(如:电击法,CaCl2等化学试剂法)处理后,使细胞膜的通透性发生变化,成为能容许外源DNA分子通过的感受态细胞。进入细胞的DNA分子通过复制、表达实现遗传信息的转移,使受体细胞出现新的遗传性状。 大肠杆菌的转化常用化学法(CaCl2法),该法最先是由Cohen 于1972年发现的。其原理是细菌处于0℃,CaCl2的低渗溶液中,菌细胞膨胀成球形,转化混合物中的DNA形成抗DNase(DNA酶)的羟基--钙磷酸复合物粘附于细胞表面,经42℃短时间热冲击处理,促使细胞吸收DNA复合物,在丰富培养基上生长数小时后,球状细胞复原并分裂增值。被转化的细菌中,重组子中基因得到表达,在选择性培养基平板上,可选出所需的转化子。 Ca2+处理的感受态细胞,其转化率一般能达到5×106--2×107转化子/质粒DNA,可以满足一般的基因克隆试验。如在Ca2+的基础上,联合其它的二价金属离子(如Mn2+、Co2+)、DMSO或还原剂等物质处理细菌,则可使转化率提高100--1000倍。 化学法简单、快速、稳定、重复性好,菌株适用范围广,感受态细菌可以在-70℃保存,因此被广泛用于外源基因的转化。
最新大肠杆菌发酵经验总结
大肠杆菌发酵经验总结 首先,补料速率与比生长速率直接影响着乙酸的生成速率和积累量(主要是补料速率与比生长速率影响发酵液中的残糖量,进而影响),所以适当的控制补料速率和比生长速率,对于控制乙酸的量有很好的效果。 其次,必须要保证充足的溶氧,并严格控制pH值,而且补酸碱的速率尽量缓和,不能太快;温度对于蛋白的表达也有很重要的影响,较低的发酵温度下所生产出的蛋白大多是有活性的,而较高的发酵温度下产生的蛋白大多一包涵体形式存在。 第三,选取合理的诱导时间非常重要,一般的诱导时间选在指数生长后期,而且诱导时的比生长速率最好能控制在0.2之内,选在此时诱导,1.将菌体的快速生长期与蛋白合成期分开,使这两个阶段互不影响,有利于蛋白的高表达;2.已经得到了大量的菌体,而且菌体的生物量基本接近稳定,不论是从动力学角度,还是能耗,物料成本方面,都比较合理。 第四,补料过程中的碳氮比也很重要。若氮源过高,会使菌体生长过于旺盛,pH偏高,不利于代谢产物的积累,氮源不足,则菌体繁殖量少从而影响产量;碳源过多,则容易刑场较低的pH,抑制菌体生长,碳源不足,则容易引起菌体的衰老和自溶。另外,碳氮比不当还会引起菌体按比例的吸收营养物质,从而直接影响菌体的生长和产物的合成。 根据自己的经验,一般情况下,对于一个稳定的发酵工艺下,如果总是在固定的发酵时间段出现溶菌现象,而且能排除噬菌体和染菌的可能性后,那就可能是因为碳氮比不合理造成的。可以适当调整碳氮比。 大家讨论得较多的是关于代谢副产物乙酸对大肠杆菌发酵的影响,针对我们论坛所发的帖,我先总结以下几点,并作出相应解决措施。 一、代谢副产物-乙酸 乙酸是大肠杆菌发酵过程中的代谢副产物,在多大的浓度下产生抑制作用各种说法不一,一般认为在好气性条件下,5~10g/L 的乙酸浓度就能对滞后期、最大比生长速率、菌体浓度以及最后蛋白收率等都产生可观测到的抑制作用。当乙酸浓度大于10或20g/L 时,细胞将会停止生长,当培养液中乙酸浓度大于12g/L 后外源蛋白的表达完全被抑制。 预防乙酸产生的措施: 1、通过控制比生长速率来减少乙酸的产生: 比生长速率越高,乙酸产生越多,当比生长速率超过某个值时,乙酸开始产生。可以通过降低温度,调节酸碱度,控制补料等方法来降低比生长速率。 2、透析培养: 在大肠杆菌的培养过程中可以用透析技术除去发酵液中的有害物质,降低乙酸含量从而实现重组菌的高密度发酵和产物的表达。 3、控制葡萄糖的浓度: 葡萄糖是大肠杆菌发酵过程中重要的碳源之一,用其作碳源是要将其控制在一个较低的水平上,以减少乙酸的产生。 常用的控制方法主要有: 恒pH法:大肠杆菌会代谢葡萄等产生乙酸,使pH 值下降。因此可通过pH值的高低作为控制葡萄糖的指标,该法的缺点是pH 的变化不完全是由葡萄糖代谢的结果,容易造成补料体系出错。恒溶氧法:菌体代谢时会消耗氧,使溶氧下降,当葡萄糖浓度低到一定程度时菌体代谢下降,消耗氧能力下降,溶氧上升。因此,根据溶氧曲线补加葡萄糖,保持溶氧恒定,可以控制葡萄糖在一定的水平。 二、温度 大肠杆菌发酵最适温度是37 C,当温度最适菌体生长时,比增长速率将会增大。随温度上升细
大肠杆菌感受态细胞的制备实验具体步骤及说明
大肠杆菌感受态细胞的制备实验具体步骤及详细说明 带有外源DNA 的重组质粒,在体外构建后,导入宿主细胞,随着细胞的大量复制、繁殖,才能够有机会获得纯的重组质粒DNA,该过程称之为转化过程。受体细胞经过一些特殊方法(如:CaCl2,RuCl 等化学试剂)的处理后,细胞膜的通透性发生变化,能容许外源DNA 的载体分子通过。 带有外源DNA 的重组质粒,在体外构建后,导入宿主细胞,随着细胞的大量复制、繁殖,才能够有机会获得纯的重组质粒DNA,该过程称之为转化过程。受体细胞经过一些特殊方法(如:CaCl2,RuCl 等化学试剂)的处理后,细胞膜的通透性发生变化,能容许外源DNA 的载体分子通过。 具体步骤 1、从37℃培养16-20 h的平板中挑取一个单菌落(直径2-3 mm),转到一个含有100 ml LB或SOB培养基的1L烧瓶中。于37℃剧烈振摇培养3 h。一般经验,1 OD600约含有大肠杆菌DH5α 109个/mL。 2、将细菌转移到一个无菌、一次性使用的、用冰预冷的50 ml聚丙烯管中,在冰上放置10 min,使培养物冷却至0℃。 3、于4℃用Sorvall GS3特头(或与之相当的转头)以4 100 r/min离心10 min,以回收细胞。 4、倒出培养液,将管倒置1 min以使最后的痕量培养液流尽。
5、每50 ml初始培养液用30 ml预冷的0.1 mol/LCaCl2-MgCl2溶液(80 mmol/L MgCl2,20 mmol/L CaCl2)重悬每份细胞沉淀。 6、于4℃用Sorvall GS3转头(或与之相当的转头)以41 00 r/min离心10 min,以回收细胞。 7、倒出培养液,将管倒置1 min以使最后的痕量培养液流尽。 8、每50 ml初始培养物用2 ml用冰预冷的0.1 mol/L CaCl2(或TFB)重悬每份细胞沉淀。 9、此时,可以用新鲜制备的感受态细胞直接做转化实验,也可以将细胞冻存于- 70℃。 注意事项 1. 为达到高效转化,活细胞数务必少于108个细胞/mL,对于大多散大脑杆菌来说,这相当于OD值为0.4左右。为保证细菌培养物的生长密度不致过高,可每隔15-20 min测定OD600值来监测,用监测的时间及OD值列一个图表,以便预测培养物的OD600值到0.4的时间,当OD600值达到0.35时,收获细菌培养物。 2. 在菌株与菌株之间,OD值与每毫升中活细胞散间的关系变化很大,因此有必要通过漶量特定脑杆菌的生长培养物在生长周期的不同时相的OD600值,并
大肠杆菌电转化
大肠杆菌电转化感受态细胞制备实验步骤和转化方法 实验步骤: 1、将适合菌株(如XL1-Blue, DH5α)置于LB或其他营养丰富的培养基上,在37℃下过夜培养。 2、高温灭菌大的离心瓶(250-500ml)。准备几瓶灭菌水(总量约1.5升),保存于冷冻室中以备重悬浮细胞用。 3、转移0.2-1ml过夜培养物至装有500ml LB(或其他营养丰富的培养基)的1-2升挡板摇瓶中。 4、37℃下剧烈振荡培养2-6小时。 5、定时监控O.D.600值(培养1小时后每半小时测定一次),当O.D.600值达到0.5-1.0时,从摇床中取出摇瓶,置于冰上冷却至少15分钟(需要的话这种方式可以存放培养液数小时)。 6、细胞在4℃5000g下离心15分钟,弃上清液(如需要,沉淀可在4℃的10%甘油中保存一两天)。 7、用灭菌的冰水重悬浮细胞。先用涡旋仪或吸液管重悬浮细胞于少量体积中(几毫升),然后加水稀释至离心管的2/3体积。 8、照上面步骤重复离心,小心弃去上清液。 9、照上面步骤用灭菌的冰水重悬浮细胞。 10、离心,弃上清液。用20ml灭菌的、冰冷后的10%甘油重悬浮细胞14. 照上面步骤离心,小心弃去上清液(沉淀可能会很松散)。 11、用10%甘油重悬浮细胞至最终体积为2-3ml。 12、将细胞按150μl等份装入微量离心管,于-80℃保存。 转化方法: 1、在冰上解冻电感受态细胞添加1-10μl DNA ,冰上培育约5分钟。
2、添加1-3μl DNA ,冰上培育约5分钟。 3、转移DNA/细胞混合物至冷却后的2mm电穿孔容器(无泡)中。 4、加载P1000,准备好300μl LB 或2xYT 。 5、对电穿孔容器进行脉冲(200 欧姆, 25μFd, 2.5 千伏)(检查时间常数,应该在3以上)。 6、立即添加300μl 的LB或2xYT至电穿孔容器中。 7、37℃下培养细胞40分钟至1小时以复原。 8、转移细胞至适当的选择培养基上培养。
大肠杆菌实验
大肠杆菌感受态细胞制备与质粒DNA的转化 一、实验目的 1)掌握用CaCl2法制备感受态细胞的原理和方法。 2)学习和掌握质粒DNA的转化和筛选方法及操作步骤。 二、实验原理 本实验以E.coli DH 5α菌株为受体细胞,并用CaCl2处理,使其处于感受态,然后与pBS质粒共保温实现转化。由于所用pBS质粒带有长那霉素抗性基因。因此可以通过长那霉素抗性来筛选转化子。如果受体细胞没有转入pBS,则在含长那霉素的培养基上不能生长。能在长那霉素培养基上生长的受体细胞肯定已经导入了pBS。转化子扩增后,可将转化的质粒提取出,进行电泳酶切等进一步鉴定。 三、仪器及试剂 仪器:恒温摇床、CO2细胞培养箱、台式高速冷冻离心机、超净工作台、低温冰箱、恒温水浴锅、制冰机、分光光度计、移液枪、Eppendrof管。 试剂:LB培养基(在950mL水中加入10g胰蛋白胨、5g酵母提取物、10gNaCl、用1mol/L NaOH调制pH=7.2.加入至1L,121℃高压灭菌20min) 长那霉素储存液:100mg/mL 含长那霉素的LB固体培养基:(1L LB液体培养基中加入20g琼脂粉,将配好的LB固体培养基高压灭菌后,冷却至60℃左右,加入长那霉素储存液,使其终浓度为50μg/mL。摇匀后铺板,每皿倒15mL,室温放置过夜至冷凝水挥发干净) 1mol/L CaCl2储存液质粒DNA10ng/Μl 四、实验步骤 1 感受态细胞的制备 1)从LB平板上挑选新活化的E.coli DH 5α单菌株,接种于3~5mL LB液体培养基中,37℃下震荡过夜培养,12h左右,直至对数生长后期。
2)将该菌悬浮液以1:50的比例接种于5mL LB液体培养基中,37℃振荡培养2~3h至OD600为0.5左右。 3)将5mL培养液转入4个1.5mL离心管中,冰上放置10min,然后于4℃下,5000rpm离心5min。 4)弃去上清液,用预冷的1mL 0.1 mol/L CaCl2溶液轻轻悬浮细胞,冰上放置15~20min后,40℃下5000rpm离心5min。 2 铺平板 将配好灭菌的LB固体培养基加热融化,待冷却至60℃左右后,加入长那霉素储存液,使其终温度为50μg/mL,摇匀后铺板,每皿倒约15mL。室温放置过夜至冷凝水挥发干净。 3 感受态细胞的转化 1)取100μl感受态细胞悬浮液,加入5μLpBS质粒DNA溶液,轻轻摇匀,冰上放置30min。 2)42℃水浴热激70s,热激后迅速置于冰上冷却3~5min。 3)向管中加入400μl LB液体培养基(不含抗生素),混匀后37℃震荡培养1h。使细菌恢复到正常生长状态,并表达质粒编码的抗生素抗性基因。 4)将上述菌液摇匀,取200μl涂布于含长那霉素的筛选平板上,正面放置0.5h。待菌液完全被吸收后倒置培养皿,37℃培养16~24h, 5)对照实验: 对照组1:以同体积的无菌二次水代替DNA溶液,其他操作与上面相同。此组正常情况下在含抗生素的LB平板上应没有菌落出现。 对照组2:以同体积的无菌二次水代替DNA溶液,取5μl菌液,稀释100万倍,涂布于不含抗生素的LB平板上,此组正常情况下应产生大量菌落。 五、实验数据记录处理 转化后在含抗生素的平板上长出的菌落即为转化子,各培养皿中的菌落数如下表所示:
发酵工艺优化
发酵工艺优化 从摇瓶试验到中试发酵罐试验的不同之处 1、消毒方式不同,摇瓶是外流蒸汽静态加热(大部分是这样的),发酵罐是直接蒸汽动态加热,部分的是直接和蒸汽混合,会因此影响发酵培养基的质量,体积,PH,透光率等指标。扩大时摇考虑 2、接种方式不同,摇瓶是吸管加入,发酵罐是火焰直接接种(当然有其他的接种方式),要考虑接种时的菌株损失和菌种的适应性等。 3、空气的通气方式不同,摇瓶是表面直接接触。发酵罐是和空气混合接触,考虑二氧化碳的浓度和氧气的融解情况。 4、蒸发量不同,摇瓶的蒸发量不好控制,湿度控制好的话,蒸发量会少。发酵罐蒸发量大,但是可以通过补料解决的。 5、搅拌方式不同,摇瓶是摇转方式进行混合搅拌,对菌株的剪切力较小。发酵罐是直接机械搅拌,注意剪切力的影响和无菌的影响。 6、PH的控制,摇瓶一般通过碳酸钙和间断补料控制PH,发酵可以直接流加控制PH,比较方便。 7、温度控制,摇瓶是空气直接接触或者传热控制温度,但是发酵罐是蛇罐或者夹套水降温控制,注意降温和加热的影响。 8、注意染菌的控制方法不一样,发酵罐根据染菌的周期和染菌的类型等可以采取一些必要的措施减少损失。 9、发酵罐可以取样或者仪表时时检测,但是摇瓶因为量小不能方便的进行控制和检测。 10、原材料不一样,发酵所用原材料比较廉价而且粗旷,工艺控制和摇瓶区别很大等等 发酵工艺中补料的作用 补料分批培养(fed—batch culture简称FBC)是指在分批培养过程中、间歇或连续地补加一种或多种成分的新鲜培养基的培养方法、与传统的分批集中补料培养相比、它有以下优点: (1)可以避免在分批发酵中因—次投料过多造成发酵液环境突变,造成菌丝大量生长等问题,改善发酵液流变等性质,使得发酵过程泡沫得以控制,节省消泡剂,并提高了装罐系数。 (2)可以控制细胞质量,以提高芽抱的比例,并使pH得以稳定。 (3)可以解除底物抑制,产物反馈抑制和分解阻遏。 (4)可以使“放料和补料”方法得以实施。该方法在发酵后期、产生了一定数量代谢产物后,在发酵液体积测量监控下,放出一部分发酵液,同时连续补充——部分新鲜营养液,实现连续带放、既有利于提高产物产量.又可降低成本,使得发酵指数得以大幅度提高。 (5)利用FBC技术、可以使菌种保持最大的生产力状态.随着传感技术以及对发酵过程动力学理沦深入研究、用模拟复杂的数学模型使在线方式实最优控制成为可能。 连续补料控制目前采用有反馈控制和无反馈控制两种方式。有反馈控制:选择与过程直接关系的可检测参数作为控制指标,例如可以测量、控制发酵液PH、采用定量控制葡萄糖流加。稳定PH在次级代谢最旺盛水平。而无反馈控制FBC是指无固定的反馈参数,以经验和数学模型相结合的办法来操作最优化控制、从而使抗生素发酵产量得以大幅度提高。例如发酵过程中前体的补加。由此可见,要实现对发酵过程的有效控制,就先要解决补科的连续控制问题。 目前国外发酵生产过程连续补料采用:流量计(电磁流量计、液体质量流量计)、小型电动、气动隔膜调节阀和控制器来实现连续补料控制。菜发酵工厂在中试试验中还成功地运用了电子称加三阀控制的自动补科系统 至于装液量的问题,应该从以下几个方面考虑: 1、保持在你所需要的转速培养情况下(尤其是在后期,菌丝很多时,转速很高时),不能让发酵液把你的塞子湿掉,容易造成染菌。 2、装液量的体积在消毒过程中,不能因为沸腾把塞子湿掉,或者跑出三角瓶,装液量太多会出现这样的情况。很容易染菌。 3、根据你的菌种的情况和发酵液的粘度,需要的混匀程度等等方面也要考虑。 4、建议你做一个梯度试验(40-50-60-70-80等)就可以找到你所需要的装液量。 关于剩余空气的排除在灭菌完毕后(100度左右),立刻用盖子或者其他的用品把你的培养摇瓶盖好,有时候这么点空气根本对兼性厌氧发酵没有什么影响,如果你的菌种要求很严的话,最好用干冰加入已经灭菌的空摇瓶后,立刻用其他的样品培养基分装即可。当然也可以用氮气。最好是二氧化碳。 你可以再查查看是否有其他的方法,我说的也不完全。!!
大肠杆菌生化实验
细菌常用生理生化反应实验结果观察 一结果观察 1葡萄糖发酵实验 直接观察试管, 试管变黄者为葡萄糖发酵阳性菌,不变者为阴性菌. 左边为恶臭假单胞菌,有气泡并变为黄色;右边为大肠杆菌, 2V. P. 反应和甲基红试验: 将培养好的液体培养基分装于两个干净的小试管中,在一管中滴入2-3滴甲基红试剂, 溶液变红的为甲基红阳性菌,不变的为甲基红阴性菌. 在另一管中加入V. P. 试剂,在37℃保温15分钟, 变红者为阳性菌,不变者为阴性菌. VP,图为右边为大肠杆菌,溶液变红,为阳性菌。 3吲哚实验 在培养好的液体培养基中加入1厘米高的乙醚,振荡,静置分层,加入2-4滴吲哚试剂,在掖面交界出现红色者为吲哚反应阳性菌,不变者为阴性菌.
左边为大肠杆菌,出现红色阳性菌;右边为产气杆菌,颜色不变,阴 性菌。 4硝酸盐还原实验 在点滴板上滴入革里斯试剂A液和B液,如过溶液变红说明有亚硝酸盐,为硝酸盐还原阳性菌,如果不变色需要再倒出部分培养基在另外的小孔中再滴如耳苯胺试剂,如果变蓝,说明此菌为阴性菌;如果不变色,说明此菌为硝酸盐还原强阳性菌. 右下方恶臭假单胞菌,加入革里斯试剂A、B后不变色,再加入二苯 胺试剂后变蓝,为阴性菌;左上方大肠杆菌为红色。 5柠檬酸盐实验 直接观察斜面,斜面变兰色者为柠檬酸盐利用阳性菌,不变者为阴性菌.
左边产生蓝色,产气杆菌阳性;右边为大肠杆菌,阴性。 6明胶水解 向培养好的明胶培养基中加入酸性氯化汞或三氯乙酸溶液,并铺满平板,菌落周围出现透明圈的菌为明胶水解阳性菌,没有透明圈的菌为阴性菌. 左边为大肠杆菌,出现透明圈,阳性;右边为枯草杆菌,阴性菌。 7 淀粉水解实验 向培养好的淀粉培养基平板上加入碘液,并铺满平板,菌落周围出现透明圈的菌为淀粉水解阳性菌,没有透明圈的菌为阴性菌.
大肠杆菌发酵经验总结
大肠杆菌发酵经验总结-CAL-FENGHAI.-(YICAI)-Company One1
大肠杆菌发酵经验总结 大肠杆菌发酵经验总结 首先,补料速率与比生长速率直接影响着乙酸的生成速率和积累量(主要是补料速率与比生长速率影响发酵液中的残糖量,进而影响),所以适当的控制补料速率和比生长速率,对于控制乙酸的量有很好的效果。 其次,必须要保证充足的溶氧,并严格控制pH值,而且补酸碱的速率尽量缓和,不能太快;温度对于蛋白的表达也有很重要的影响,较低的发酵温度下所生产出的蛋白大多是有活性的,而较高的发酵温度下产生的蛋白大多一包涵体形式存在。 第三,选取合理的诱导时间非常重要,一般的诱导时间选在指数生长后期,而且诱导时的比生长速率最好能控制在之内,选在此时诱导,1.将菌体的快速生长期与蛋白合成期分开,使这两个阶段互不影响,有利于蛋白的高表达;2.已经得到了大量的菌体,而且菌体的生物量基本接近稳定,不论是从动力学角度,还是能耗,物料成本方面,都比较合理。 第四,补料过程中的碳氮比也很重要。若氮源过高,会使菌体生长过于旺盛,p H偏高,不利于代谢产物的积累,氮源不足,则菌体繁殖量少从而影响产量;碳源过多,则容易刑场较低的pH,抑制菌体生长,碳源不足,则容易引起菌体的衰老和自溶。另外,碳氮比不当还会引起菌体按比例的吸收营养物质,从而直接影响菌体的生长和产物的合成。 根据自己的经验,一般情况下,对于一个稳定的发酵工艺下,如果总是在固定的发酵时间段出现溶菌现象,而且能排除噬菌体和染菌的可能性后,那就可能是因为碳氮比不合理造成的。可以适当调整碳氮比。 大家讨论得较多的是关于代谢副产物乙酸对大肠杆菌发酵的影响,现总结以下几点,并作出相应解决措施。 一、代谢副产物-乙酸 乙酸是大肠杆菌发酵过程中的代谢副产物,在多大的浓度下产生抑制作用各种说法不一,一般认为在好气性条件下,5~10g/L 的乙酸浓度就能对滞后期、最大比生长速率、菌体浓度以及最后蛋白收率等都产生可观测到的抑制作用。当
实验三 大肠杆菌感受态细胞的制备(新)
实验三大肠杆菌感受态细胞的制备 【课前预习】 1、大肠杆菌感受态细胞的制备及转化的基本原理是什么? 2、大肠杆菌感受态细胞的制备可以采用哪些方法? 【目的要求】 1、了解感受态细胞生理特性及制备条件; 2、掌握大肠杆菌感受态细胞制备方法; 【基本原理】 所谓感受态,是指细菌生长过程中的某一阶段的培养物,只有某一生长阶段中的细菌才能作为转化的受体,能接受外源DNA而不将其降解的生理状态。它是由受体菌的遗传性状所决定的,同时也受菌龄、外界环境因子的影响。cAMP可以使感受态水平提高一万倍,而Ca2+也可大大促进转化的作用。细胞的感受态一般出现在对数生长期,新鲜幼嫩的细胞是制备感受态细胞和进行成功转化的关键。感受态形成后,细胞生理状态会发生改变,出现各种蛋白质和酶,负责供体DNA 的结合和加工等。细胞表面正电荷增加,通透性增加,形成能接受外来的DNA 分子的受体位点等。 基因工程技术中最常用的是氯化钙转化技术,虽然对其基本原理仍然不完全清楚,但是比较认同的看法是,细菌处干0℃、CaCl2低渗溶液中,细胞膨胀形成球状,转化混合物中的DNA形成抗DNase的羟基-钙磷酸复合物粘附与细胞表面,经42℃短时间热冲击处理,促进细胞吸收DNA复合物,之后细菌在富含营养的培养基上生长,球状细胞复原并分裂繁殖,重组质粒在转化的细菌中,表达目的基因,因而在选择性培养基平板中,可以选出阳性细菌转化子。Ca2+处理的感受态细胞,一般每微克DNA能转化105-106个细菌、环化的质粒DNA 愈小,转化率愈高。环化的DNA分子比线性DNA分子转化率高1000倍。CaCl2转化法的优点是:简单快速,重复性好,菌株适用范围广。 另外,电击法也可用于转化过程,电击法不需要预先诱导细菌的感受态,依赖短暂的电击,利用瞬时高压电流(数千伏特)处理细胞悬浮液,使微生物细胞膜在高压电作用下发生去极化,产生微孔,悬液中溶解的核酸即可通过细胞膜上的空洞进入细胞内部,转化率最高达109-1010转化子/μg闭环DNA。 制备出的感受态细胞暂时不用时,可加入占总体积15%的无菌甘油或-70℃保存(有效
大肠杆菌
大肠杆菌的培养和分离 ——基础知识和操作过程梳理一、大肠杆菌 细菌是单细胞的原核生物。细菌细胞的结构有细胞壁、细胞膜、细胞质等。细菌无成型的细胞核,细胞壁由肽聚糖组成。由于细菌细胞壁结构不同,细菌可分为革兰氏阳性菌和革兰氏阴性菌两类。革兰氏阳性菌细胞壁厚,无荚膜,多产生外毒素;革兰氏阴性菌细胞壁薄,有荚膜,多产生内毒素。革兰氏阳性菌对青霉素更为敏感。 大肠杆菌是革兰氏阴性、异养兼性厌氧型肠道杆菌。在肠道中一般对人无害,但任何大肠杆菌进入人的泌尿系统,都会对人体产生危害。大肠杆菌在基因工程技术中被广泛的应用,它的质粒是最常用的运载体,它也是基因工程中常用的受体细胞。 二、培养基配置 微生物生命活动过程中需要的化合物有碳源、氮源、生长因子、无机盐和水。有的化合物既是碳源又是氮源、能源。生长因子是微生物生长不可缺少的微量有机物,但不一定需要外界补充,有的微生物可以自身合成。在提供上述几种主要营养物质的基础上,培养基还需要满足微生物生长对pH、特殊营养物质以及氧气的要求。 我们一般用LB液体培养基来扩大培养大肠杆菌,培养后可在LB固体培养基上划线分离。以下为本实验中培养基配置步骤: 1.称量:准确称取各成分。蛋白胨0.5g,酵母提取物0.25g,氯化钠0.5g,加水50ml。配置LB固体培养基时还需加1g琼脂。 2.溶化:加热熔化,用蒸馏水定容到50mL。配置LB固体培养基时还需加琼脂,整个过程不断用玻棒搅拌,目的是防止琼脂糊底而导致烧杯破裂。 3.调pH:用1mol/L NaOH溶液调节pH至偏碱性。 4.灭菌:在两个250ml的三角瓶中分别装入50ml LB液体培养基和50ml LB固体培养基,加上棉塞。将培养皿用牛皮纸包好,放入灭菌锅内,1kg压力灭菌15min。
发酵工艺优化
发酵工艺优化---现代发酵工业调控策略 发布日期:2010-04-10 来源:[标签:来源] 作者:[标签:作者] 浏览次数:716 发酵是细胞大规模培养技术中最早被人们认识和利用的。发酵技术在医药、轻工、食品、农业、环保等领域的广泛应用,使这一技术在国民经济发展中发挥着越来越重要的作用。为了提高发酵生产水平,人们首先考虑的是菌种的选育或基因工程的构建。而实际上,发酵工艺的优化,包括生物反应器中的工程问题,也同样非常重要。发酵环境条件的优化发酵环境条件的优化是发酵过程中最基本的要求,也是最重要、最难掌握的技术指标。温度、pH值、溶氧、搅拌转速、氨离子、金属离子、营养物浓度等的优化控制,依据不同的发酵而有所不同。同时,微生物在 发酵是细胞大规模培养技术中最早被人们认识和利用的。发酵技术在医药、轻工、食品、农业、环保等领域的广泛应用,使这一技术在国民经济发展中发挥着越来越重要的作用。为了提高发酵生产水平,人们首先考虑的是菌种的选育或基因工程的构建。而实际上,发酵工艺的优化,包括生物反应器中的工程问题,也同样非常重要。发酵环境条件的优化发酵环境条件的优化是发酵过程中最基本的要求,也是最重要、最难掌握的技术指标。温度、pH 值、溶氧、搅拌转速、氨离子、金属离子、营养物浓度等的优化控制,依据不同的发酵而有所不同。同时,微生物在生长的不同阶段、生产目的代谢产物的不同时期,对环境条件可能会有不同的要求。因此,应该在生物反应器内,使温度、pH值、溶氧、搅拌转速等不断变换,始终为其提供最佳的环境条件,以提高目的产物的得率。在发酵放大实验中,一般都很注重寻找最佳的培养基配方和最佳的温度、pH值、溶氧等参数,但往往忽视了细胞代谢流的变化。例如:在溶解氧浓度的测量与控制时,关心的是最佳氧浓度或其临界值,而不注意细胞代谢时的摄氧率;用氨水调节pH值时,关心的是最佳pH值,却不注意添加氨水时的动态变化及其与其他发酵过程的参数的关系,而这些变化对细胞的生长代谢却非常重要。基于此,华东理工大学的张嗣良提出了“以细胞代谢流分析与控制为核心的发酵工程学”的观点。他认为,必须高度重视细胞代谢流分布变化的有关现象,研究细胞代谢物质流与生物
大肠杆菌电转和文库扩增
科隆生物医学有限公司·保密 大肠杆菌基因电转化(1) (制剂范围可以放大或缩小) 感应态菌制备 培养液和制剂: -无任何抗生素及含有氨苄青霉素/ carbnicillin或其他适当抗生素的LB平板 -2×LB或YT培养基500毫升 -SOC培养基 -冰冷的高压灭菌去离子水:1000毫升 -冰冷的高压灭菌10 %甘油(500毫升) -预冷却的50ml离心管,离心管和电转移杯。 方法: 1.从一个新鲜的琼脂平板上接种单个大肠杆菌单菌落到含有5ml的2 ×YT培养基的烧瓶中。孵育培养5小时或过夜,于37℃和250rpm旋转振荡器培养。 2 。用5ml过夜的细菌培养物接种到在2升烧瓶中500毫升预热的2 ×YT培养基中。于37℃搅拌下(250转的旋转振荡器)。一个小时以后,每20分钟测定OD600值。 3 。当培养物的OD 600达到0.2.5-0.3 ,迅速将烧瓶转移到冰水浴中15-30分钟。偶尔转动培养瓶以确保冷均匀。 4 。转移培养物至50ml冰冷的离心瓶。在4500rpm和在2 ℃下离心10分钟,收获细胞倒出上清液和重悬细胞沉淀在50毫升冰冷的纯水并在2 ℃下孵育3分钟。 5 。通过在2 ℃下离心10分钟收获细胞(4500rpm), 倒出上清液和重悬细胞沉淀在50毫升冰冷的纯水中并孵育3分钟。 6 。通过在2 ℃下离心15分钟收获细胞(4500rpm),倒出上清液和重悬细胞沉淀在25毫升冰冷的10%甘油中。 7 。通过在2 ℃下离心15分钟收获细胞(4500rpm),倒出上清液和重悬沉淀在10毫升冰冷的10 %甘油。 8 。通过在2 ℃下离心15分钟收获细胞(4500rpm),小心地倒出上清液,并使用巴斯德吸管残余水滴。合并和重悬沉淀于1毫升冰冷的10 %甘油。 9 。测量1:100稀释的细胞悬浮液的OD600值:用冰冷的10%甘油稀释细胞悬液,然后测定。浓度应是2× 1011到3× 1010个细胞/ ml ?OD = 800 -120 (1.0 OD 600 =约2.5× 108细胞/ ml)。 10 。转移40微升的悬浮于冰冷的电穿孔杯中(0.1厘米间隙)并放电施加是否发生电弧(请参阅下文第12到18步)。如果是这样,用冰冷的10%甘油洗涤的细胞悬浮液的剩余部分再次,以确保细菌悬浮液的导电率足够低(<5毫当量)。 11 。如无电弧发生,就进行存储,分配所述40微升细胞悬浮液等份放入无菌的,冰冷的0.5 - ml离心管,并立即转移到-80 ℃的冰箱中。 12 。加入10毫微克,容积不超1-3微升DNA 到每个离心管,并在冰上孵育管60秒或以上。包括所有适当的阳性和阴性对照。质粒量为细胞体积不能达到十分之一。 13 。设置电转仪提供的电容25μF ,2.5千伏和200欧姆电阻的电脉冲。 14 。转移DNA /细胞混合物倒入冷电比色皿,并确保细菌和DNA的悬浮坐在试管的底部。干燥凝结和湿气的反应杯的外侧。将试管中的电穿孔设备。 15 。在上面设置中,释放一个4-5毫秒脉冲电力。12.5千伏/厘米的探测或磁场强度的时间常数应该在屏幕上显示。 16 。尽可能快的脉冲后,取出电穿孔杯,在室温下, 加入0.5 ml SOC培养基。 17 。将细胞转移到一个含有0.5毫升SOC的17 ×150毫米的聚丙烯管中,于37℃下慢转动(250转)培养1小时. 18.涂0.5hml 培养液`于抗菌素LB板上,370C下隔夜培养, 检测转化效率.
大肠杆菌实验报告
大肠杆菌紫外线诱变及抗药性菌株筛选 0740063 阿噟兰 1.前言 抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。但某些细菌对抗生素表现出抗性,原因是其基因发生了改变,产生能抵抗抗生素的性状。在自然情况下,细菌的基因突变率很低,而且突变是不定向的,因此在自然条件下,想要获得有抗性的细菌是很困难的。当给与适当的物理条件时,其突变率会大大增加。如当用α射线、β射线、γ射线、Χ射线、中子和其他粒子、紫外线、微波等物理因素辐射时,能够促进遗传物质突变。DNA 对紫外线(UV)有强烈的吸收作用,尤其是碱基中的嘧啶,它比嘌呤更为敏感。紫外线引起DNA 结构变化的形式有DNA 链断裂、碱基破坏、胸腺嘧啶二聚体等。因此,紫外线通常作为诱变剂,用于微生物菌种选育。一般细胞分裂越旺盛,诱变剂量越大,突变率高,诱变最有效的波长253~265 nm。选择合适的诱变剂量对于获得较高突变率十分关键,过高或过低的辐射剂量会导致菌株死亡或诱变不充分而降低诱变效果。 在紫外线诱变下,菌株发生不定向的突变,想要得到需要的特向变异必须对诱变后的菌株做筛选。本实验想要得到的是能够抵抗抗生素的菌株,因此可以用抗生素培养基作为筛选培养基对菌种进行筛选。若菌株没有发生定向突变,则该菌株不能在抗性培养基上正常生长,只有发生了定向突变才可能在筛选培养基上正常生长。 紫外线对于菌株有诱变作用外,对菌株还有较强的致死作用,因为紫外线改变了菌株的基因结构导致菌株无法正常生长繁殖。 因此,通过本实验的操作,在合适的照射剂量的设置下,比较不同不同照射剂量下的致死效果和突变率,并初步分析两者的相关性。在分析死亡曲线和诱变率曲线的基础上,能了解诱变育种的机理和方法,为做进一步的诱变实验做准备。 2.材料和方法 实验材料、仪器和试剂 菌种:大肠杆菌 仪器:超净台、离心机、高压灭菌锅、培养箱、磁力搅拌器、培养皿、涂布器、移液管、移液器 试剂:牛肉膏蛋白胨培养基相关试剂、硫酸卡那霉素水溶液(50mg/ml)、生理盐水 实验方法 2.2.1制备培养基 普通培养基——牛肉膏蛋白胨培养基(400ml): 牛肉膏5g 蛋白胨10g Nacl 5g 琼脂20g 蒸馏水1000ml 按配方配制好培养基后置于灭菌锅中115℃15min,倒平板,4皿*15ml*5组+2皿*15ml=22皿*15ml=330ml 筛选培养基(200ml):含抗生素50mg/L。(卡那霉素属于氨基糖苷类抗生素,能结合细菌核糖体的30S亚基上的16SrRNA,阻断细菌蛋白质的合成。) 牛肉膏5g 蛋白胨10g Nacl 5g 琼脂20g 蒸馏水1000ml 硫酸卡那霉素水溶液(50mg/ml),按配方先不要加硫酸卡那霉素配制然后115℃15min灭菌,取出培养基后冷却至60℃时将硫酸卡那霉素加入培养基中,充分震荡混匀,倒平板,2皿*15ml*5组+2皿*15ml=12皿*15ml=180ml 2.2.2制备菌悬液(106 ~ 108个/mL) ①固体培养:大肠杆菌划线或涂布接种于固体培养基,37℃培养24-48h。 ②菌悬液:用适量生理盐水刮洗菌落,倒入一个无菌小三角瓶(或试管)中,充分振荡使菌
发酵工艺优化
发酵工艺优化 发酵工艺优化 从摇瓶试验到中试发酵罐试验的不同之处 1、消毒方式不同,摇瓶是外流蒸汽静态加热(大部分是这样的),发酵罐是直接蒸汽动态加热,部分的是直接和蒸汽混合,会因此影响发酵培养基的质量,体积,PH,透光率等指标。扩大时摇考虑 2、接种方式不同,摇瓶是吸管加入,发酵罐是火焰直接接种(当然有其他的接种方式),要考虑接种时的菌株损失和菌种的适应性等。 3、空气的通气方式不同,摇瓶是表面直接接触。发酵罐是和空气混合接触,考虑二氧化碳的浓度和氧气的融解情况。 4、蒸发量不同,摇瓶的蒸发量不好控制,湿度控制好的话,蒸发量会少。发酵罐蒸发量大,但是可以通过补料解决的。 5、搅拌方式不同,摇瓶是摇转方式进行混合搅拌,对菌株的剪切力较小。发酵罐是直接机械搅拌,注意剪切力的影响和无菌的影响。 6、PH的控制,摇瓶一般通过碳酸钙和间断补料控制PH,发酵可以直接流加控制PH,比较方便。 7、温度控制,摇瓶是空气直接接触或者传热控制温度,但是发酵罐是蛇罐或者夹套水降温控制,注意降温和加热的影响。 8、注意染菌的控制方法不一样,发酵罐根据染菌的周期和染菌的类型等可以采取一些必要的措施减少损失。 9、发酵罐可以取样或者仪表时时检测,但是摇瓶因为量小不能方便的进行控制和检测。 10、原材料不一样,发酵所用原材料比较廉价而且粗旷,工艺控制和摇瓶区别很大等等 发酵工艺中补料的作用 补料分批培养(fed—batch culture简称FBC)是指在分批培养过程中、间歇或连续地补加一种或多种成分的新鲜培养基的培养方法、与传统的分批集中补料培养相比、它有以下优点: (1)可以避免在分批发酵中因—次投料过多造成发酵液环境突变,造成菌丝大量生长等问题,改善发酵液流变等性质,使得发酵过程泡沫得以控制,节省消泡剂,并提高了装罐系数。 (2)可以控制细胞质量,以提高芽抱的比例,并使pH得以稳定。 (3)可以解除底物抑制,产物反馈抑制和分解阻遏。 (4)可以使“放料和补料”方法得以实施。该方法在发酵后期、产生了一定数量代谢产物后,在发酵液体积测量监控下,放出一部分发酵液,同时连续补充——部分新鲜营养液,实现连续带放、既有利于提高产物产量.又可降低成本,使得发酵指数得以大幅度提高。 (5)利用FBC技术、可以使菌种保持最大的生产力状态.随着传感技术以及对发酵过程动力学理沦深入研究、用模拟复杂的数学模型使在线方式实最优控制成为可能。 连续补料控制目前采用有反馈控制和无反馈控制两种方式。有反馈控制:选择与过程直接关系的可检测参数作为控制指标,例如可以测量、控制发酵液PH、采用定量控制葡萄糖流加。稳定PH在次级代谢最旺盛水平。而无反馈控制FBC是指无固定的反馈参数,以经验和数学模型相结合的办法来操作最优化控制、从而使抗生素发酵产量得以大幅度提高。例如发酵过程中前体的补加。由此可见,要实现对发酵过程的有效控制,就先要解决补科的连续控制问题。 目前国外发酵生产过程连续补料采用:流量计(电磁流量计、液体质量流量计)、小型电动、气动隔膜调节阀和控制器来实现连续补料控制。菜发酵工厂在中试试验中还成功地运用了电子称加三阀控制的自动补科系统
