细胞常见污染图片与鉴别

细胞常见污染图片与鉴别
赛默飞世尔科技(中国)有限公司
ThermoFisher Scientific
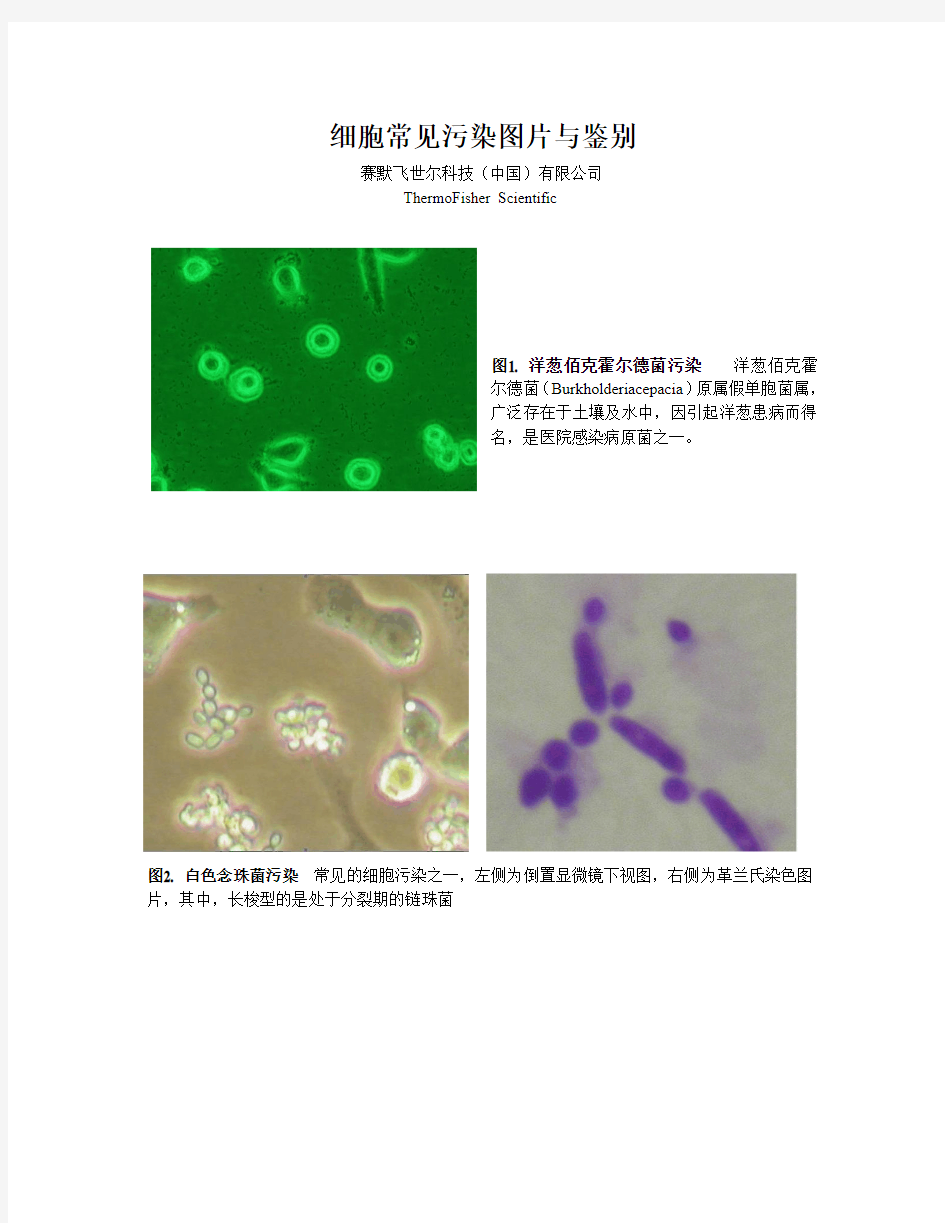
图1. 洋葱佰克霍尔德菌污染洋葱佰克霍
尔德菌(Burkholderiacepacia)原属假单胞菌属,
广泛存在于土壤及水中,因引起洋葱患病而得
名,是医院感染病原菌之一。
图2. 白色念珠菌污染常见的细胞污染之一,左侧为倒置显微镜下视图,右侧为革兰氏染色图片,其中,长梭型的是处于分裂期的链珠菌
图3.链球菌革兰氏染色
图4. 真菌感染
图5. 支原体污染煎蛋状和其他形状,左侧:电镜照片(×30k);右侧:电镜照片(×12k)
图6. 霉菌(丝霉)污染培养基呈淡紫色,或不变色,但会变得粘稠,一般是来自实验服,并且具有季节性,像现在这种长蘑菇的季节很容易污染这种菌类。
图7. 细菌污染倒置显微镜下无法看到细菌的结构(需油镜),污染晚期培养基呈黄色。
当快,源自小鼠毛发中。
源自小鼠的皮肤。
细胞培养中的几种污染
胞培养中的污染分为两类,化学污染和生物污染。 化学污染 化学污染是一些对细胞有毒性的或对细胞产生刺激的化学物质。这些污染一般来自于没有洗净的器皿、不纯的化学试剂和质量较差的蒸馏水等。 化学污染中比较引人注意的是细菌内毒素。它是革兰氏阴性细菌细胞死亡后解体释放出的疏水性的细胞壁组成物质,对塑料等疏水性强的物质有很强的吸附能力。细菌内毒素可刺激部分细胞产生一些激素或细胞因子,对细胞生长和实验结果产生影响。细菌内毒素是临床上的最主要的热原(即注射到动物体内会导致动物发热),所以通过细胞培养生产的疫苗、细胞因子等用在临床上的药品的生产过程中更是要避免细菌内毒素的污染。 生物污染 生物污染包括比较容易发现的细菌、霉菌和酵母的污染,和较难发现的病毒、支原体和其他细胞的污染。 细菌、霉菌和酵母到处存在,它们能在合适的环境中非常快速的生长。这些污染比较容易观察到,它们往往会使其污染的培养液产生可见的变化,或者通过显微镜观察就可以看见。 由于病毒有种属特异性,所以病毒污染的概率比较小。但是病毒污染难于发现,因为病毒颗粒特别微小,一般的实验室都没能力检查细胞培养中污染的病毒。由于病毒一般潜伏在细胞内,对整个细胞培养不是致死的,所以它可能会使研究人员长期得到受病毒影响的细胞的实验结果。 1956 年 Robinson 及其同事首次发现细胞培养中的支原体污染。90年代初美国的一个调查发现,在该国的细胞培养中,至少有15%被支原体污染。由于支原体没有细胞壁,在细胞培养液中几乎是透明的,同时对常用于细胞培养中的抗生素不敏感,不引起 pH 变化,不使培养液浑浊,所以支原体污染不容易被发现,但是其存在会影响实验的结果。 细胞的交叉污染在细胞培养中发生的严重程度大大超过人们的想象:1981 年对ATCC 细胞株的调查显示:超过 60 标记为其他细胞株的细胞居然是 HeLa 细胞。
细胞常见问题
1.血清中可能出现的沉淀物是什么? 基于多年的实验研究,用于细胞培养的胎牛血清以及其它血清中可能会存在以下种类的沉淀物::(1)纤维蛋白,它是经常出现的较大的沉淀物,可以达到1-2mm,可以用肉眼观察到。因为血清都是在低温下进行收集和快速处理的,一些纤维蛋白原(可溶性的形成絮状纤维蛋白的前体)在处理过程中仍然处于溶解状态,当经过最后的过滤分装后,就会在瓶中凝结出现纤维蛋白沉淀。(2)磷酸钙,它也是常见的一种沉淀物,通常会使血清出现浑浊,并且在37℃培养的时候会增加。这种沉淀物在倒置显微镜下观察像小黑点,这些小黑点由于布朗运动看上去可以活动,因此经常被误认为是微生物污染。(3)胆固醇、脂肪酸酯以及一些蛋白质。他们也是血清中出现沉淀物的常见原因。 2.血清中的沉淀物对细胞培养有什么影响? (1)细胞生长,我们的试验以及经验表明沉淀物不会影响细胞培养,我们的客户以及其它血清生产商也证明了这一点。(2)过滤,如果血清中出现大量的沉淀物,血清将很难过滤。一般说来,因为在血清生产时最后已经经过100nm或者40nm的过滤处理,并且经过了严格的无菌检测,因此不推荐再过滤用于细胞培养的血清。在实验室中没有必要再过滤处理血清,在大规模的细胞培养中往往将血清直接加到培养基中一起过滤。(3)污染,磷酸钙往往被误认为微生物污染而引起争端。研究者可能会在血清中观察到一些絮状的沉淀,因此就会比较警觉的去做无菌试验,将血清放在培养箱中培养几天,结果可能会观察到更多的絮状沉淀,因此就断定血清被污染了。并且当研究者将血清样品放在倒置显微镜下观察时往往可以看到一些可以运动的小黑点,因此就更加确认是血清被污染了。于是,研究者就会花费更多的时间和精力来和生产商确认,但最终确定血清没有被污染而只是沉淀。为了避免这些问题的发生,我们建议不要直接将血清放在培养箱中培养观察是否有菌,而是将血清加到琼脂板上进行培养以观察是否有细菌生长。另外,也可以进行革兰氏染色,在油镜下观察,以确认是否有污染。 3.如何避免血清中沉淀物的出现? 首先要注意正确的血清解冻步骤,而且溶解过程中一定要每隔一段时间均匀而缓慢的摇动血清。我们已经发现在下列情况下沉淀物可能增加,使用中应该尽量避免:(1)热灭活血清;(2)在37℃下培养血清;(3)反复冻融;(4)γ射线照射;(5)长期储存在2-8℃;(6)在室温下放置时间过长 4.如何去除血清中的沉淀? 如想去除这些絮状沉淀物,可以将血清分装到无菌离心管中,以400g离心,上清液即可直接加入到培养基内一起过滤。注意:不要以过滤的方式去除这些絮状沉淀物,因为这可能阻塞滤膜。 5.冷冻管应如何解冻? 取出冷冻管后,须立即放入37°C水槽中快速解冻,轻摇冷冻管使其在1分钟内全部融化,并注意水面不可超过冷冻管盖沿,否则易发生污染情形。另冷冻管由液氮桶中取出解冻时,必须注意安全,预防冷冻管之爆裂。 6.细胞冷冻管解冻培养时,是否应马上去除DMSO? 除少数特别注明对DMSO敏感之细胞外,绝大部分细胞株(包括悬浮性细胞),在解冻之后,应直接放入含有10-15ml新鲜培养基之培养角瓶中,待隔天再置换新鲜培养基以去除DMSO即可,如此可避免大部分解冻后细胞无法生长或贴附之问题。 7.一般客户拿到细胞后,应该注意什么?
细胞常见污染情况与分析
细胞培养常见污染的判别及应对措施 2011-01-02 10:19:04| 分类:实验| 标签:污染无菌细胞培养基灭菌|字号大中小订阅 一、避免细胞培养污染的措施: 污染是细胞培养中一个大敌,一旦污染,前功尽弃!决定要进行细胞培养,首先一定要有强烈的无菌意识!操作中要遵守严格的操作规程,不要怕麻烦,越细心越好!注意以下几点,大部份的污染是可以避免的: 1. 每次开始实验前,先用紫外照无菌台和实验室20分,用酒精擦手,台面和不消毒的器械(如移液枪等);实验中,如允许,尽量多过火,开起或盖盖都靠近火焰或在无菌台深处;使用无菌台后,再用酒精擦台面,紫外照20分! 2. 滴管不要接触瓶口,吸取废液及加入新鲜培养基时都要注意不要滴在瓶口上等等。 3. 凡是接触瓶口后都要用酒精灯烧烧。 4. 提取组织时,往往头会距离组织很近,所以带口罩很重要!还要换无菌衣(紫外照过的白大褂)。 5. 注意配制完全培养基时不要发生污染,在使用前一定要做无菌培养,因为一般应用污染后的培养基培养细胞后,很快就会发生特别严重的污染。 6. 操作时一定按照实验室的要求,切忌粗心大意。 7. 使用完的东西尽快移出无菌台!另外无菌台上的器械,试剂摆放,也尽量遵循一定的顺序!依污染可能程度依次向外摆。 二、常见的细胞培养污染: 下面是几种细胞培养过程中常见的污染: 1. 支原体污染: 传说中的黑焦虫,长得暴快。24小时就满视野都是了。污染源大多数情况下是培养用血清。
图1 支原体污染的光镜检测(圆圈所示,×10倍) 图2 支原体污染的光镜检测(×20倍)
图3 支原体污染的荧光检测
图4 支原体污染的电镜检测(×30k,煎蛋状和其他形状)
关于细胞培养中的污染
细胞培养中常见的污染情况总结如下:常见的污染如下: 1、细菌:细菌在普通倒置显微镜下为黑色细沙状,根据感染细菌的不同,可有不同的外形, 培养液一般会浑浊变黄,对细胞生长影响明显。仔细检查一下器皿的灭菌情况,是否在高压灭菌时放气时间足够,压力足够!尤其是和储存培养液接触的移液管等物品,连续两次污染的话有可能造成储存液污染,一定要注意!下次使用前检查一下培养液是否存在浑浊的现象!可在培养液中加相应的抗生素处理 2、霉菌:培养液是清亮的,倒置显微镜下无杂质,37度孵箱培养2-3天,仍清亮,但出现 絮状杂质,镜下可见呈细丝状的团状漂浮物,可看到明显的菌丝,细胞仍可生长,但时间长之后,细胞的活力状态变差,用硫酸铜溶液擦拭CO2孵箱内,再把水盘里也加上饱和量的硫酸铜。或者在培养箱的托盘加入饱和的消毒磷酸氢二钠高盐液体,可以防止霉菌污染。CO2孵箱被霉菌污染后,可把所有细胞暂时转移,采用过氧乙酸擦洗孵箱(包括隔板,箱壁)。并把过氧乙酸放置在孵箱内一个小时,使其蒸汽弥漫。待过氧乙酸的气味消散后,再移入细胞。孵箱应定期清洁(2月左右),尤其在多雨的季节。其它培养箱清洗方法是:用84液擦洗-清水擦洗-75%酒精擦洗-紫外灯照。预防霉菌污染,可在培养基里加3u/ml的两性霉素或制霉菌素或放线菌素D或双抗;但细胞一旦污染,很难挽救,制霉菌素或放线菌素D 或双抗都于事无补,建议舍弃该污染细胞。,将环境彻底消毒,如果所有细胞都污染,可能是系统污染,检查一下培养基和器材,如果只是个别污染,可能是操作问题,就要注意操作 3、支原体:黑色的,好象多为多形,培养液一般培养液一般会浑浊,原体感染,国内血清 很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。而且它不能用过滤的办法除去。支原体感染细胞以后,细胞病变不很明显,只是慢慢死去。用泰乐菌素,兽用支原体病的药,但可用于细胞培养,无任何不良反应。Sigma公司的使用时用50ug/ml Tylosin培养液培养6天或连续传两代即可清除支原体污染。如果作为常用的抗生素的话, 建议用8ug/ml的浓度。 4、黑蛟虫:可以穿透滤膜,也可以通过空气传播,低倍下为黑色点状,高倍下可看见黑色 的小虫游来游去,培养液也是不浑的,一般不会太影响,细胞还是可以用的。常常是细胞生长状态良好,且观测到的运动物无明显增多,且培养液颜色、透明度无明显变化,可在同一批号的血清养的细胞中发现类似现象。对细胞生长状态不会有明显影响,在细胞增殖旺盛之后会自然消失,除更换血清外无须特殊处理。建议如果细胞有可能是此种污染的话,可以增加细胞的种板密度,以提高细胞的生存率。 5、真菌:一般培养液清亮,不变色,镜下有丝状物,有些真菌开始很像死细胞碎片,只是 它很多很多的小块很清楚,象珊瑚状,不象细胞碎片分不清,慢慢的会长出很细的黑色丝状物。真菌生长的比较慢,不象细菌那么容易被发现,但是一旦发现有它的存在细胞就被污染了,也很难救活了。 6、原虫:培养液可轻微浑浊,显微镜下那些细小的点状物数量非常多,轻微活动,细胞虽 然可以生长但繁殖速度却明显减慢,而且细胞状态不好,边缘不清楚,细胞不透亮。他们与细胞可共生但会与细胞争夺营养。这种共生是非常普遍的,但他们的数量小,细胞站优势所以不会影响到细胞的正常生长,只有当他们到达一定的数量时就会影响到细胞的生长,最终
细胞培养中常见的污染的处理
细胞培养中常见的污染情况总结如下: 常见的污染如下: 1、细菌:细菌在普通倒置显微镜下为黑色细沙状,根据感染细菌的不同,可有不同的外形,培养液 一般会浑浊变黄,对细胞生长影响明显。 仔细检查一下器皿的灭菌情况,是否在高压灭菌时放气时间足够,压力足够!尤其是和储存培养液接触的移液管等物品,连续两次污染的话有可能造成储存液污染,一定要注意!下次使用前检查一下培养 液是否存在浑浊的现象! 可在培养液中加相应的抗生素处理 2、霉菌:培养液是清亮的,倒置显微镜下无杂质,37度孵箱培养2-3天,仍清亮,但出现絮状杂质,镜下可见呈细丝状的团状漂浮物,可看到明显的菌丝,细胞仍可生长,但时间长之后,细胞的活力状态变差,用硫酸铜溶液擦拭CO2孵箱内,再把水盘里也加上饱和量的硫酸铜。或者在培养箱的托盘加入饱和的 消毒磷酸氢二钠高盐液体,可以防止霉菌污染。 CO2孵箱被霉菌污染后,可把所有细胞暂时转移,采用过氧乙酸擦洗孵箱(包括隔板,箱壁)。并把过氧乙酸放置在孵箱内一个小时,使其蒸汽弥漫。待过氧乙酸的气味消散后,再移入细胞。孵箱应定期 清洁(2月左右),尤其在多雨的季节。 其它培养箱清洗方法是:用84液擦洗-清水擦洗-75%酒精擦洗-紫外灯照。 预防霉菌污染,可在培养基里加3u/ml的两性霉素或制霉菌素或放线菌素D或双抗;但细胞一旦污染,很难挽救,制霉菌素或放线菌素D或双抗都于事无补,建议舍弃该污染细胞。,将环境彻底消毒,如果所有细胞都污染,可能是系统污染,检查一下培养基和器材,如果只是个别污染,可能是操作问题,就 要注意操作 3、支原体:黑色的,好象多为多形,培养液一般培养液一般会浑浊,原体感染,国内血清很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。而且它不能用过滤的办法除去。支原体 感染细胞以后,细胞病变不很明显,只是慢慢死去。 用泰乐菌素,兽用支原体病的药,但可用于细胞培养,无任何不良反应。Sigma公司的使用时用50ug/ml Tylosin培养液培养6天或连续传两代即可清除支原体污染。如果作为常用的抗生素的话, 建议用 8ug/ml的浓度。 4、黑蛟虫:可以穿透滤膜,也可以通过空气传播,低倍下为黑色点状,高倍下可看见黑色的小虫游来游去,培养液也是不浑的,一般不会太影响,细胞还是可以用的。常常是细胞生长状态良好,且观测到的运动物无明显增多,且培养液颜色、透明度无明显变化,可在同一批号的血清养的细胞中发现类似现象。对细胞生长状态不会有明显影响,在细胞增殖旺盛之后会自然消失,除更换血清外无须特殊处理。建议如果细胞有可能是此种污染的话,可以增加细胞的种板密度,以提高细胞的生存率。 5、真菌:一般培养液清亮,不变色,镜下有丝状物,有些真菌开始很像死细胞碎片,只是它很多很多的小块很清楚,象珊瑚状,不象细胞碎片分不清,慢慢的会长出很细的黑色丝状物。真菌生长的比较慢,不象细菌那么容易被发现,但是一旦发现有它的存在细胞就被污染了,也很难救活了。 6、原虫:培养液可轻微浑浊,显微镜下那些细小的点状物数量非常多,轻微活动,细胞虽然可以生长但繁殖速度却明显减慢,而且细胞状态不好,边缘不清楚,细胞不透亮。他们与细胞可共生但会与细胞争夺营养。这种共生是非常普遍的,但他们的数量小,细胞站优势所以不会影响到细胞的正常生长,只有当他们到达一定的数量时就会影响到细胞的生长,最终形成恶性循环。
细胞培养中常见的污染
细胞培养中常见的污染情况总结如下: 1、细菌:细菌在普通倒置显微镜下为黑色细沙状,根据感染细菌的不同,可有不同的外形,培养液一般会浑浊变黄,对细胞生长影响明显。 仔细检查一下器皿的灭菌情况,是否在高压灭菌时放气时间足够,压力足够!尤其是和储存培养液接触的移液管等物品,连续两次污染的话有可能造成储存液污染,一定要注意!下次使用前检查一下培养液是否存在浑浊的现象!可在培养液中加相应的抗生素处理 2、霉菌:培养液是清亮的,倒置显微镜下无杂质,37度孵箱培养2-3天,仍清亮,但出现絮状杂质,镜下可见呈细丝状的团状漂浮物,可看到明显的菌丝,细胞仍可生长,但时间长之后,细胞的活力状态变差, 用硫酸铜溶液擦拭CO2孵箱内,再把水盘里也加上饱和量的硫酸铜。或者在培养箱的托盘加入饱和的消毒磷酸氢二钠高盐液体,可以防止霉菌污染。 CO2孵箱被霉菌污染后,可把所有细胞暂时转移,采用过氧乙酸擦洗孵箱(包括隔板,箱壁)。并把过氧乙酸放置在孵箱内一个小时,使其蒸汽弥漫。待过氧乙酸的气味消散后,再移入细胞。孵箱应定期清洁(2月左右),尤其在多雨的季节。 其它培养箱清洗方法是:用84液擦洗-清水擦洗-75%酒精擦洗-紫外灯照。 预防霉菌污染,可在培养基里加3u/ml的两性霉素或制霉菌素或放线菌素D或双抗;但细胞一旦污染,很难挽救,制霉菌素或放线菌素D或双抗都于事无补,建议舍弃该污染细胞。,将环境彻底消毒,如果所有细胞都污染,可能是系统污染,检查一下培养基和器材,如果只是个别污染,可能是操作问题,就要注意操作 3、支原体:黑色的,好象多为多形,培养液一般培养液一般会浑浊,原体感染,国内血清很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。而且它不能用过滤的办法除去。支原体感染细胞以后,细胞病变不很明显,只是慢慢死去。 用泰乐菌素,兽用支原体病的药,但可用于细胞培养,无任何不良反应。Sigma公司的使用时用50ug/ml Tylosin培养液培养6天或连续传两代即可清除支原体污染。如果作为常用的抗生素的话, 建议用8ug/ml的浓度。 4、黑蛟虫:可以穿透滤膜,也可以通过空气传播,低倍下为黑色点状,高倍下可看见黑色的小虫游来游去,培养液也是不浑的,一般不会太影响,细胞还是可以用的。常常是细胞生长状态良好,且观测到的运动物无明显增多,且培养液颜色、透明度无明显变化,可在同一批号的血清养的细胞中发现类似现象。对细胞生长状态不会有明显影响,在细胞增殖旺盛之后会自然消失,除更换血清外无须特殊处理。建议如果细胞有可能是此种污染的话,可以增加细胞的种板密度,以提高细胞的生存率。 5、真菌:一般培养液清亮,不变色,镜下有丝状物,有些真菌开始很像死细胞碎片,只是它很多很多的小块很清楚,象珊瑚状,不象细胞碎片分不清,慢慢的会长出很细的黑色丝状物。真菌生长的比较慢,不象细菌那么容易被发现,但是一旦发现有它的存在细胞就被污染了,也很难救活了。 6、原虫:培养液可轻微浑浊,显微镜下那些细小的点状物数量非常多,轻微活动,细胞虽然可以生长但繁殖速度却明显减慢,而且细胞状态不好,边缘不清楚,细胞不透亮。他们与细胞可共生但会与细胞争夺营养。这种共生是非常普遍的,但他们的数量小,细胞站优势所
细胞培养中常见的问题
细胞培养中常见的问题 2006-11-23 15:53 细胞中的颗粒到底是怎么回事? 我的细胞总有颗粒,开始是细胞中有,后来细胞之间也好像有许多颗粒。好像是细胞碎片一样。是什么东西啊?是支原体污染吗?这可是我刚买回来的细胞啊! 我们实验室也有这种情况,是不是黑的小碎片,有人说是细胞代谢产物,后来拿到高倍镜下看还会动,就怀疑是污染了,也想问问大家到底是什么 是黑色的小碎片。我没注意到它会动,只是觉得不像是活的微生物。我觉得是由于某种污染或外界因素导致的细胞状态变差,裂解出的东西。但是,是什么东西不清楚。 的确很常见 在以前帖子见到说是“黑焦虫”。长时间培养的很容易出现,我根据自己的经验估计是一种污染,因为随着黑点增多,本来生长旺盛的细胞逐渐停滞甚至死亡。而且我后来原代培养的几批细胞并没有发现,我怀疑有好多细胞系本身就是污染的。不过增加换液次数的情况下,好象一般不太娇气的细胞生长不是很受影响。 以前听很有经验的老师说黑焦虫是国产血清的问题,可以有条件换进口血清试试,或者离心一下也可能能解决问题。那么所谓的“黑焦虫”到底是什么东西啊?有谁知道? 我培养的细胞也出现过此中问题,放到高倍镜下看时有东西在动,但培养液不混浊,估计不是细菌污染,可能是血清问题,是支原体污染。 我培养的细胞也出现过这样的问题,我个人认为是一种支原体污染。国产血清是罪魁祸首,因为只要将细胞饥饿一下,不超过24小时,这种东西就会疯长 我培养的细胞也有出现这中情况。但是并不影响细胞生长。应该不是支原体污染 最近,我复苏细胞细胞的时候也发现过这样的东西,尽管我用的是GIBCO的FBS,后来,每天换液之前洗几遍后,就慢慢变少,现在没了 细胞培养的细菌污染 我们新建的细胞室。每周都会做清洁,用0。2%新洁尔灭消毒,照紫外。实验前也会照至少30分钟。培养基中加青霉素,链霉素。可是培养细胞时还是常有细菌污染,有时甚至分析不出原因。用培养瓶还好一点,用多孔板或平皿就更凄惨。我养的是哺乳动物细胞,不知各位有什么好的方法避免污染!谢谢! 很可能是超净台无效了,,或者培养基?其实严格操作箱污染都难 我们是新的超净台,不可能失效。而且用同一瓶培养基,一瓶传两瓶,原始的一
教你判断你的细胞是何种污染
教你判断你的细胞是何种污染 细胞培养中常见的生物污染类型有7种,分别是细菌污染、支原体污染、原虫污染、黑胶虫污染、真菌污染、病毒污染以及非细胞污染。他们在细胞培养中污染的特点如下: 1、细菌:细菌在普通倒置显微镜下为黑色细沙状,根据感染细菌的不同,可有不同的外形,培养液一般会浑浊变黄,对细胞生长影响明显。 2、支原体:黑色的,好象多为多形,培养液一般培养液一般会浑浊,原体感染,国内血清很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。而且它不能用过滤的办法除去。支原体感染细胞以后,细胞病变不很明显,只是慢慢死去。 3、黑胶虫:可以穿透滤膜,也可以通过空气传播,低倍下为黑色点状,高倍下可看见黑色的小虫游来游去,培养液也是不浑的,一般不会太影响,细胞还是可以用的。常常是细胞生长状态良好,且观测到的运动物无明显增多,且培养液颜色、透明度无明显变化,可在同一批号的血清养的细胞中发现类似现象。对细胞生长状态不会有明显影响,在细胞增殖旺盛之后会自然消失,除更换血清外无须特殊处理。 4、真菌:一般培养液清亮,不变色,镜下有丝状物,有些真菌开始很像死细胞碎片,只是它很多很多的小块很清楚,象珊瑚状,不象细胞碎片分不清,慢慢的会长出很细的黑色丝状物。真菌生长的比较慢,不象细菌那么容易被发现,但是一旦发现有它的存在细胞就被污染了,也很难救活了。 5、原虫:培养液可轻微浑浊,显微镜下那些细小的点状物数量非常多,轻微活动,细胞虽然可以生长但繁殖速度却明显减慢,而且细胞状态不好,边缘不清楚,细胞不透亮。他们与细胞可共生但会与细胞争夺营养。这种共生是非常普遍的,但他们的数量小,细胞站优势所以不会影响到细胞的正常生长,只有当他们到达一定的数量时就会影响到细胞的生长,最终形成恶性循环。 6. 病毒:组织细胞培养过程中,如果没有除去潜在的病毒,就会产生病毒污染。目前,从原代猴肾细胞的培养中已发现不少于20种血清性病毒。尽管病毒污染的细胞不影响原代培养,但生产疫苗是不安全的。因此,潜在病毒是细胞大量生产和疫苗、干扰素等生物制品制作中的难题 7、非同种细胞污染:即是细胞交叉污染,由于细胞培养操作时各细胞株所需的器材和溶液没有严格分开,往往会使一种细胞被另一种细胞污染。目前,世界上已有几十种细胞都被HeLa细胞所污染,致使许多实验宣告无效。非细胞培养物所造成的化学成分的污染也偶有发生,大多是由于细胞培养所需物品清洗消毒不彻底而带入一些有毒化学物质所致。
细胞污染原因和处理
养成良好的无菌操作的习惯拿70%酒精擦手,擦超净台,擦培养瓶,擦培养基瓶,各种瓶子的口多拿火焰烧灼。就不再会发生细菌污染。 决定要进行细胞培养,首先一定要有强烈的无菌意识!操作中要求自己遵守严格的操作规程,不要怕麻烦,越细心越好,越“罗嗦”越好! 我发现在提取需要组织时,往往头会距离组织很近,所以带口罩很重要!还要换无菌衣(紫外照过的白大褂) 另外,每次开始实验前,先用紫外照无菌台和实验室20分,用酒精擦手,台面,不消毒的器械(如移液枪,冰块等);实验中,如允许,尽量多过火,开起或盖盖都靠近火焰或在无菌台深处进行;使用无菌台后,再用酒精擦全台面,紫外照20分! 还有,做到绝对无菌,那不可能!但我们可以做到最大限度的减少含菌量! 使用完的东西尽快移出无菌台!另外无菌台上的器械,试剂摆放,也尽量遵循一定的顺序!依污染可能程度依次向外摆。 1.滴管不要接触瓶口,吸取废液及加入新鲜培养基时都要注意不要滴在瓶口上 等等。 2.凡是接触瓶口后都要用酒精灯烧烧。 3.初学者一般可以用培养瓶养细胞,个人认为瓶污染的机率要比皿小。 4.注意配制完全培养基时不要发生污染,在使用前一定要做无菌培养,因为 一般应用污染后的培养基培养细胞后,很快就会发生特别严重的污染。 2. 1.注意喷酒精装置的应用:制作很简单,用过的化妆品,理发店理发前往头 发上喷水的瓶子及其他一些有喷水功能的瓶子,经过处理装上百分之75的酒精就可以了(我不知道有没有实验专用喷洒酒精的瓶子,如果有那就更好了)。我用的是师姐留下来的一种护肤品的瓶子。常常往超净台台面,手上喷洒酒精,效果很好。 2。我进入细胞培养室就戴上PE手套(一次性塑料薄膜手套),当在超净台操作时戴上一次性橡胶手套。 3。培养箱内水盘里的水,用灭菌的超净水,每周更换一次(至少也要两周换一次)。换水前要用百分之75酒精消毒。水浴箱也要定期消毒(用百分之75酒精)换双蒸水。 4。从培养箱内取东西前手一定要喷酒精,动作要快,可以先看好了,要取的东西在那里,然后快取。显微镜下观看细胞时间也不要过久,否则会对细胞有不利影响。 5。很多人喜欢常规用抗生素,其实除于特殊筛选系统中外,一般正常培养状态下,培养基中不应添加任何抗生素。当在无血清培养基中添加抗生素时,降低至少在有血清培养基中所使用浓度的50%。血清蛋白会结合和灭活一些抗生素。在无血清培养条件下,抗生素不被灭活,可能对于细胞达到毒性水平。 6。液体培养基贮存于4℃冰箱,实验进行前放在37℃水槽中温热。温热前后注意酒精消毒。
细胞中常见的污染
一、常见的污染如下: 1. 细菌:细菌在普通倒置显微镜下为黑色细沙状,根据感染细菌的不同,可有不同的外形,培养液一般会浑浊变黄,对细胞生长影响明显。 仔细检查一下器皿的灭菌情况,是否在高压灭菌时放气时间足够,压力足够!尤其是和储存培养液接触的移液管等物品,连续两次污染的话有可能造成储存液污染,一定要注意!下次使用前检查一下培养液是否存在浑浊的现象!可在培养液中加相应的抗生素处理。 2. 霉菌:培养液是清亮的,倒置显微镜下无杂质,37度孵箱培养2-3天,仍清亮,但出现絮状杂质,镜下可见呈细丝状的团状漂浮物,可看到明显的菌丝,细胞仍可生长,但时间长之后,细胞的活力状态变差,用硫酸铜溶液擦拭CO2孵箱内,再把水盘里也加上饱和量的硫酸铜。或者在培养箱的托盘加入饱和的消毒磷酸氢二钠高盐液体,可以防止霉菌污染。 CO2孵箱被霉菌污染后,可把所有细胞暂时转移,采用过氧乙酸擦洗孵箱(包括隔板,箱壁)。并把过氧乙酸放置在孵箱内一个小时,使其蒸汽弥漫。待过氧乙酸的气味消散后,再移入细胞。孵箱应定期清洁(2月左右),尤其在多雨的季节。其它培养箱清洗方法是:用84液擦洗-清水擦洗-75%酒精擦洗-紫外灯照。预防霉菌污染,可在培养基里加3u/ml的两性霉素或制霉菌素或放线菌素D或双抗;但细胞一旦污染,很难挽救,制霉菌素或放线菌素D或双抗都于事无补,建议舍弃该污染细胞。,将环境彻底消毒,如果所有细胞都污染,可能是系统污染,检查一下培养基和器材,如果只是个别污染,可能是操作问题,就要注意操作。 3. 支原体:黑色的,好象多为多形,培养液一般会浑浊,原体感染,国内血清很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。而且它不能用过滤的办法除去。支原体感染细胞以后,细胞病变不很明显,只是慢慢死去。 用泰乐菌素,兽用支原体病的药,但可用于细胞培养,无任何不良反应。Sigma 公司的使用时用50ug/ml Tylosin培养液培养6天或连续传两代即可清除支原体污染。如果作为常用的抗生素的话, 建议用8ug/ml的浓度。 4. 黑蛟虫:可以穿透滤膜,也可以通过空气传播,低倍下为黑色点状,高倍下可看见黑色的小虫游来游去,培养液也是不浑的,一般不会太影响,细胞还是可以用的。常常是细胞生长状态良好,且观测到的运动物无明显增多,且培养液颜色、透明度无明显变化,可在同一批号的血清养的细胞中发现类似现象。对细胞生长状态不会有明显影响,在细胞增殖旺盛之后会自然消失,除更换血清外无须特殊处理。建议如果细胞有可能是此种污染的话,可以增加细胞的种板密度,以提高细胞的生存率。 5. 真菌:一般培养液清亮,不变色,镜下有丝状物,有些真菌开始很像死细胞碎片,只是它很多很多的小块很清楚,象珊瑚状,不象细胞碎片分不清,慢慢的会长出很细的黑色丝状物。真菌生长的比较慢,不象细菌那么容易被发现,但是一旦发现有它的存在细胞就被污染了,也很难救活了。 6. 原虫:培养液可轻微浑浊,显微镜下那些细小的点状物数量非常多,轻微活动,细胞虽然可以生长但繁殖速度却明显减慢,而且细胞状态不好,边缘不清楚,细胞不透亮。他们与细胞可共生但会与细胞争夺营养。这种共生是非常普遍的,但他们的数量小,细胞站优势所以不会影响到细胞的正常生长,只有当他们到达一定的数量时就会影响到细胞的生长,最终形成恶性循环。 污染的可能原因:可能原因很多。比如配液消毒问题、操作问题、环境问题等等。
细胞培养中常见污染
最近看到不少问有关细胞培养污染的事,正好我看到了一个有关这方面的总结,很全很好很强大,跟大家分享下细胞培养中常见的污染情况总结如下:常见的污染如下:1、细菌:细菌在普通倒置显微镜下为黑色细沙状,根据感染细菌的不同,可有不同的外形,培养液一般会浑浊变黄,对细胞生长影响明显。仔细检查一下器皿的灭菌情况,是否在高压灭菌时放气时间足够,压力足够!尤其是和储存培养液接触的移液管等物品,连续两次污染的话有可能造成储存液污染,一定要注意!下次使用前检查一下培养液是否存在浑浊的现象!可在培养液中加相应的抗生素处理2、霉菌:培养液是清亮的,倒置显微镜下无杂质,37度孵箱培养2-3天,仍清亮,但出现絮状杂质,镜下可见呈细丝状的团状漂浮物,可看到明显的菌丝,细胞仍可生长,但时间长之后,细胞的活力状态变差,用硫酸铜溶液擦拭CO2孵箱内,再把水盘里也加上饱和量的硫酸铜。或者在培养箱的托盘加入饱和的消毒磷酸氢二钠高盐液体,可以防止霉菌污染。CO2孵箱被霉菌污染后,可把所有细胞暂时转移,采用过氧乙酸擦洗孵箱(包括隔板,箱壁)。并把过氧乙酸放置在孵箱内一个小时,使其蒸汽弥漫。待过氧乙酸的气味消散后,再移入细胞。孵箱应定期清洁(2月左右),尤其在多雨的季节。其它培养箱清洗方法是:用84液擦洗-清水擦洗-75%酒精擦洗-紫外灯照。预防霉菌污染,可在培养基里加3u/ml的两性霉素或制霉菌素或放线菌素D或双抗;但细胞一旦污染,很难挽救,制霉菌素或放线菌素D或双抗都于事无补,建议舍弃该污染细胞。,将环境彻底消毒,如果所有细胞都污染,可能是系统污染,检查一下培养基和器材,如果只是个别污染,可能是操作问题,就要注意操作3、支原体:黑色的,好象多为多形,培养液一般会浑浊,原体感染,国内血清很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。而且它不能用过滤的办法除去。支原体感染细胞以后,细胞病变不很明显,只是慢慢死去。用泰乐菌素,兽用支原体病的药,但可用于细胞培养,无任何不良反应。Sigma公司的使用时用50ug/ml Tylosin培养液培养6天或连续传两代即可清除支原体污染。如果作为常用的抗生素的话, 建议用8ug/ml的浓度。4、黑蛟虫:可以穿透滤膜,也可以通过空气传播,低倍下为黑色点状,高倍下可看见黑色的小虫游来游去,培养液也是不浑的,一般不会太影响,细胞还是可以用的。常常是细胞生长状态良好,且观测到的运动物无明显增多,且培养液颜色、透明度无明显变化,可在同一批号的血清养的细胞中发现类似现象。对细胞生长状态不会有明显影响,在细胞增殖旺盛之后会自然消失,除更换血清外无须特殊处理。建议如果细胞有可能是此种污染的话,可以增加细胞的种板密度,以提高细胞的生存率。5、真菌:一般培养液清亮,不变色,镜下有丝状物,有些真菌开始很像死细胞碎片,只是它很多很多的小块很清楚,象珊瑚状,不象细胞碎片分不清,慢慢的会长出很细的黑色丝状物。真菌生长的比较慢,不象细菌那么容易被发现,但是一旦发现有它的存在细胞就被污染了,也很难救活了。6、原虫:培养液可轻微浑浊,显微镜下那些细小的点状物数量非常多,轻微活动,细胞虽然可以生长但繁殖速度却明显减慢,而且细胞状态不好,边缘不清楚,细胞不透亮。他们与
细胞培养中常见的污染情况、可能原因、解决方法
细胞培养中常见的污染情况、可能原因、解决方法 细胞培养中常见的污染情况总结如下: 常见的污染如下: 1、细菌:细菌在普通倒置显微镜下为黑色细沙状,根据感染细菌的不同,可有不同的外形,培养液一般会浑浊变黄,对细胞生长影响明显。 仔细检查一下器皿的灭菌情况,是否在高压灭菌时放气时间足够,压力足够!尤其是和储存培养液接触的移液管等物品,连续两次污染的话有可能造成储存液污染,一定要注意!下次使用前检查一下培养液是否存在浑浊的现象! 可在培养液中加相应的抗生素处理 2、霉菌:培养液是清亮的,倒置显微镜下无杂质,37度孵箱培养2-3天,仍清亮,但出现絮状杂质,镜下可见呈细丝状的团状漂浮物,可看到明显的菌丝,细胞仍可生长,但时间长之后,细胞的活力状态变差, 用硫酸铜溶液擦拭CO2孵箱内,再把水盘里也加上饱和量的硫酸铜。或者在培养箱的托盘加入饱和的消毒磷酸氢二钠高盐液体,可以防止霉菌污染。 CO2孵箱被霉菌污染后,可把所有细胞暂时转移,采用过氧乙酸擦洗孵箱(包括隔板,箱壁)。并把过氧乙酸放置在孵箱内一个小时,使其蒸汽弥漫。待过氧乙酸的气味消散后,再移入细胞。孵箱应定期清洁(2月左右),尤其在多雨的季节。 其它培养箱清洗方法是:用84液擦洗-清水擦洗-75%酒精擦洗-紫外灯照。 预防霉菌污染,可在培养基里加3u/ml的两性霉素或制霉菌素或放线菌素D或双抗;但细胞一旦污染,很难挽救,制霉菌素或放线菌素D或双抗都于事无补,建议舍弃该污染细胞。,将环境彻底消毒,如果所有细胞都污染,可能是系统污染,检查一下培养基和器材,如果只是个别污染,可能是操作问题,就要注意操作 3、支原体:黑色的,好象多为多形,培养液一般培养液一般会浑浊,原体感染,国内血清很多都没有做支原体阴性检测,而支原体是牛血清中最常见的微生物之一。而且它不能用过滤的办法除去。支原体感染细胞以后,细胞病变不很明显,只是慢慢死去。 用泰乐菌素,兽用支原体病的药,但可用于细胞培养,无任何不良反应。Sigma公司的使用时用50ug/ml Tylosin培养液培养6天或连续传两代即可清除支原体污染。如果作为常用的抗生素的话, 建议用8ug/ml的浓度。 4、黑蛟虫:可以穿透滤膜,也可以通过空气传播,低倍下为黑色点状,高倍下可看见黑色的小虫游来游去,培养液也是不浑的,一般不会太影响,细胞还是可以用的。常常是细胞生长状态良好,且观测到的运动物无明显增多,且培养液颜色、透明度无明显变化,可在同一批号的血清养的细胞中发现类似现象。对细胞生长状态不会有明显影响,在细胞增殖旺盛之后会自然消失,除更换血清外无须特殊处理。建议如果细胞有可能是此种污染的话,可以增加细胞的种板密度,以提高细胞的生存率。 5、真菌:一般培养液清亮,不变色,镜下有丝状物,有些真菌开始很像死细胞碎片,只是它很多很多的小块很清楚,象珊瑚状,不象细胞碎片分不清,慢慢的会长出很细的黑色丝状物。真菌生长的比较慢,不象细菌那么容易被发现,但是一旦发现有它的存在细胞就被污染了,也很难救活了。
细胞培养常见问题的原因及对策
细胞培养常见问题的原因及对策细胞培养中的注意事项 1 冷冻管应如何解冻? 取出冷冻管后,须立即放入37 C水槽中快速解冻,轻摇冷冻管使其在1分钟内全部融化,并注意水面不可超过冷冻管盖沿,否则易发生污染情形。另冷冻管由液氮桶中取出解冻时,必须注意安全,预防冷冻管之爆裂。 2 细胞冷冻管解冻培养时,是否应马上去除DMSO? 除少数特别注明对DMSO敏感之细胞外,绝大部分细胞株(包括悬浮性细胞),在解冻之后,应直接放入含有10-15ml新鲜培养基之培养角瓶中,待隔天再置换新鲜培养基以去除DMSO 即可,如此可避免大部分解冻后细胞无法生长或贴附之问题。 3 可否使用与原先培养条件不同之培养基? 不能。每一细胞株均有其特定使用且已适应之细胞培养基,若骤然使用和原先提供之培养条件不同之培养基,细胞大都无法立即适应,造成细胞无法存活。 4 可否使用与原先培养条件不同之血清种类? 不能。血清是细胞培养上一个极为重要的营养来源,所以血清的种类和品质对于细胞的生长会产生极大的影响。来自不同物种的血清,在一些物质或分子的量或内容物上都有所不同,血清使用错误常会造成细胞无法存活。 5 何谓FBS, FCS, CS, HS ? FBS (fetal bovine serum) 和FCS (fetal calf serum) 是相同的意思,两者都是指胎牛血清,FCS乃错误的使用字眼,请不要再使用。CS (calf serum) 则是指小牛血清。HS (horseserum) 则是指马血清。 6 培养细胞时应使用5 %或10% CO2?或根本没有影响? 一般培养基中大都使用HCO3-/CO32-/H+ 作为pH 的缓冲系统,而培养基中NaHCO3的含量将决定细胞培养时应使用的CO2浓度。当培养基中NaHCO3 含量为每公升3.7 g时,细胞培养时应使用10% CO2;当培养基中NaHCO3为每公升1.5 g时,则应使用5% CO2培养细胞。 7 何时须更换培养基? 视细胞生长密度而定,或遵照细胞株基本数据上之更换时间,按时更换培养基即可。 8 培养基中是否须添加抗生素? 除于特殊筛选系统中外,一般正常培养状态下,培养基中不应添加任何抗生素。 9 附着性细胞继代时所使用之trypsin-EDTA浓度?应如何处理? 一般使用之trypsin-EDTA 浓度为0.05% trypsin-0.53m MEDTA.4 Na。第一次开瓶后应立即少量分装于无菌试管中,保存于–20 C,避免反复冷冻解冻造成trypsin之活性降低,并可减少污染之机会。 10 悬浮性细胞应如何继代处理? 一般仅需持续加入新鲜培养基于原培养角瓶中,稀释细胞浓度即可,若培养液太多时,可将培养角瓶口端稍微抬高,直到无法容纳为止。分瓶时取出一部份含细胞之培养液至另一新的培养角瓶,加入新鲜培养基稀释至适当浓度,重复前述步骤即可。
细胞培养过程中的污染
细胞培养过程中的污染不仅仅指微生物,而且还包括所有混入培养环境中的、对细胞生存有害或造成细胞不纯的物质,包括生物和化学物质。 培养细胞受细菌污染后,会出现培养液变混浊,pH改变。也有的培养液肉眼观察无多少改变,只能在镜下发现菌体才知污染。所以,每天应仔细观察。污染后细胞发生病理改变,胞内颗粒增多、增粗,最后变圆脱落死亡,造成试验失败和细胞株(系)丢失。 培养细胞受真菌污染后,可见培养液中漂浮着白色或浅黄色的小点,有的散在生长,培养液一般不发生混浊;倒置显微镜下可见丝状、管状或树枝状的菌丝纵横交错在细胞之间或培养基中,有的呈链状排列。念珠菌和酵母菌呈卵圆形散在细胞周边和细胞之间。个体细小,有增多趋势。镜下看时,要将培养瓶用酒精棉球擦干净,以防止与瓶外尤其瓶底外面生长的菌丝相混淆。真菌污染后,细胞生长变慢,但最后由于营养耗尽及毒性作用而使细胞脱落死亡。 支原体是介于细菌与病毒之间能独立生活的最小微生物,最小直径0.2μm,一般过滤除菌无法去除它,光镜下难以看清它的形态结构。开始不易发现,能在偏碱条件(pH7.6~8.0)下生存,对青霉素有抗药性,多吸附于细胞表面或散在于细胞之间。电镜下可见其有三层结构,无细胞壁,中央有电子密度大的密集颗粒或丝状的中心囊。 培养细胞受支原体污染后,部分敏感细胞可见细胞生长增殖变慢,部分细胞变圆,从瓶壁脱落。但多数细胞污染后无明显变化,或略有变化,若不及时处理,还会产生交叉污染。 采用组织细胞培养法生产疫苗,如果没有除去潜在病毒的组织培养物,会产生病毒污染。目前,从原代猴肾细胞的培养中已发现不少于20种血清性病毒。尽管病毒污染的细胞不影响原代培养,但生产疫苗是不安全的。若二倍体细胞系有SV40或多发瘤病毒,B淋巴细胞含EB病毒,细胞和会发生变异、转化,形成异倍体的细胞系。因此,潜在病毒是细胞大量生产和疫苗、干扰素等生物制品制作中的难题。 五、非同种细胞污染 由于细胞培养操作时各细胞株所需的器材和溶液没有严格分开,操作不当,往往会使一种细胞被另一种细胞污染。如“灵长类”细胞系发现猴和鼠类细胞的混合物,ERK/KD细胞是从兔肾中分离出来的,而现在却认为是HeLa细胞。目前,世界上已有几十种细胞都被HeLa细胞所污染,致使许多实验宣告无效。 非细胞培养物所造成的化学成分的污染也偶有发生,大多是由于细胞培养所需物品清洗消毒不彻底而带入一些有毒化学物质所致。 第二节污染来源及鉴别 一、污染来源 细胞培养过程中污染的来源主要有以下几条途径。 1、不洁的动物组织标本 很多动物组织本该是无菌的(直接与外界相通的呼吸道和消化道、泌尿系统除外),但由于取材时不小心也会有污染的机会。组织本身含有细菌,如取材时不用浓的抗生素洗液洗涤浸泡,也会带菌,造成细胞污染。 2、空气 空气中含有大量的微生物,如果操作室与外界隔离不严或消毒不充分下,很容易造成污染。另外,净化工作台使用过久,滤板未定期更换或长久不更换,滤气受尘埃堵塞,工作时不带口罩或外界气流过强,污染空气进入操作区,也会导致污染。春夏季南方地区多雨,空气湿度大,含菌量多,工作不注意也易造成污染。 3、清洗消毒 培养用物品、材料洗刷不净,培养用液和器材灭菌不彻底也会引入微生物和有毒物质。 4、操作 来自操作者的污染主要有以下几方面: 器材和溶液使用前未仔细检查是否污染过,或者是否已经消毒灭菌处理过,或者虽经处理,时隔已久又末重新处理。 操作者未戴口罩、帽子,呼出气中排出细菌和支原体。
细胞培养常见问题、可能原因及解决方法
细胞培养常见问题、可能原因及解决方法问题1:培养液pH 值变化太快 可能原因 (1)CO2 张力不对 (2)培养瓶盖拧得太紧 (3)NaHCO3 缓冲系统缓冲力不足 (4)培养液中盐浓度不正确 (5)细菌、酵母或真菌污染 建议解决方法 (1)按培养液中NaHCO3 浓度增加或减少培养箱内CO2 浓度,2.0g/L 到3.7g/L 浓度NaHCO3 对应CO2 浓度为5%到10%。 (2)松开瓶盖1/4 圈。 (3)改用不依赖CO2 培养液。加HEPES 缓冲液至10 到25mM 终浓度。(4)在CO2 培养环境中改用基于Earle′s 盐配制的培养液,在大气培养环境中培养改用Hanks 盐配制的培养液。 (5)丢弃培养物,或用抗生素除菌。 问题2:培养液出现沉淀,但pH值不变 可能原因 (1)洗涤剂清洗后残留有磷酸盐,将培养基成分沉淀下来 (2)冰冻保存培养液 建议解决方法
(1)用去离子水反复冲洗玻璃器皿,然后灭菌。 (2)将培养液加热到37℃,摇动使其溶解如沉淀仍然存在,丢弃培养液。 问题3:培养液出现沉淀,同时pH 发生变化 可能原因 细菌或真菌污染 建议解决方法 丢弃培养物,或用抗生素除菌。 问题4:培养细胞不贴壁 可能原因 (1)胰蛋白酶消化过度 (2)支原体污染 (3)培养瓶瓶底不干净 (4)培养液pH值过碱(NaHCO3分解) (5)消化液或培养液配制错误、过期储存、储存不当 (6)细胞老化(如传代前细胞已汇合导致失去贴附性) (7)接种细胞起始浓度太低或太高 建议解决方法 (1)缩短胰蛋白酶消化时间或降低胰蛋白酶浓度。 (2)分离培养物,检测支原体。清洁支架和培养箱。如发现支原体污染,丢弃培养物。 (3)注意刷洗,或换用一次性塑料培养瓶
细胞培养常见问题分析
细胞培养常见问题分析细胞培养 1、冷冻管应如何解冻?取出冷冻管后,须立即放入37 ℃水槽中快速解冻,轻摇冷冻管使其在1 分钟内全部融化,并注意水面不可超过冷冻管盖沿,否则易发生污染情形。另冷冻管由液氮桶中取出解冻时,必须注意安全,预防冷冻管之爆裂。 2、细胞冷冻管解冻培养时,是否应马上去除DMSO?除少数特别注明对DMSO 敏感之细胞外,绝大部分细胞株(包括悬浮性细胞),在解冻之后,应直接放入含有10-15ml新鲜培养基之培养角瓶中,待隔天再置换新鲜培养基以去除DMSO 即可,如此可避免大部分解冻后细胞无法生长或贴附之问题。 3、可否使用与原先培养条件不同之培养基?不能。每一细胞株均有其特定使用且已适应之细胞培养基,若骤然使用和原先提供之培养条件不同之培养基,细胞大都无法立即适应,造成细胞无法存活。 4、可否使用与原先培养条件不同之血清种类?不能。血清是细胞培养上一个极为重要的营养来源,所以血清的种类和品质对于细胞的生长会产生极大的影响。来自不同物种的血清,在一些物质或分子的量或内容物上都有所不同,血清使用错误常会造成细胞无法存活。 5、何谓FBS, FCS, CS, HS ?FBS (fetal bovine serum)和FCS (fetal calf serum)是相同的意思,两者都是指胎牛血清,FCS 乃错误的使用字眼,请不要再使用。CS (calf serum)则是指小牛血清。HS (horseserum)则是指马血清。 6、培养细胞时应使用5 % 或10% CO2?或根本没有影响?一般培养基中大都使用HCO3-/CO32-/H+ 作为pH 的缓冲系统,而培养基中NaHCO3 的含量将决定细胞培养时应使用的CO2 浓度。当培养基中NaHCO3 含量为每公升3.7 g 时,细胞培养时应使用10 % CO2;当培养基中NaHCO3 为每公升1.5 g 时,则应使用5 % CO2 培养细胞。 7、何时须更换培养基?视细胞生长密度而定,或遵照细胞株基本数据上之更换时间,按时更换培养基即可。 8、培养基中是否须添加抗生素?除于特殊筛选系统中外,一般正常培养状态下,培养基中不应添加任何抗生素。 9、附着性细胞继代时所使用之trypsin-EDTA 浓度?应如何处理?一般使用之trypsin-EDTA 浓度为0.05% trypsin-0.53mMEDTA.4 Na。第一次开瓶后应立即少量分装于无菌试管中,保存于–20 ℃,避免反复冷冻解冻造成trypsin 之活性降低,并可减少污染之机会。
