大肠杆菌提取DNA凝胶电泳图
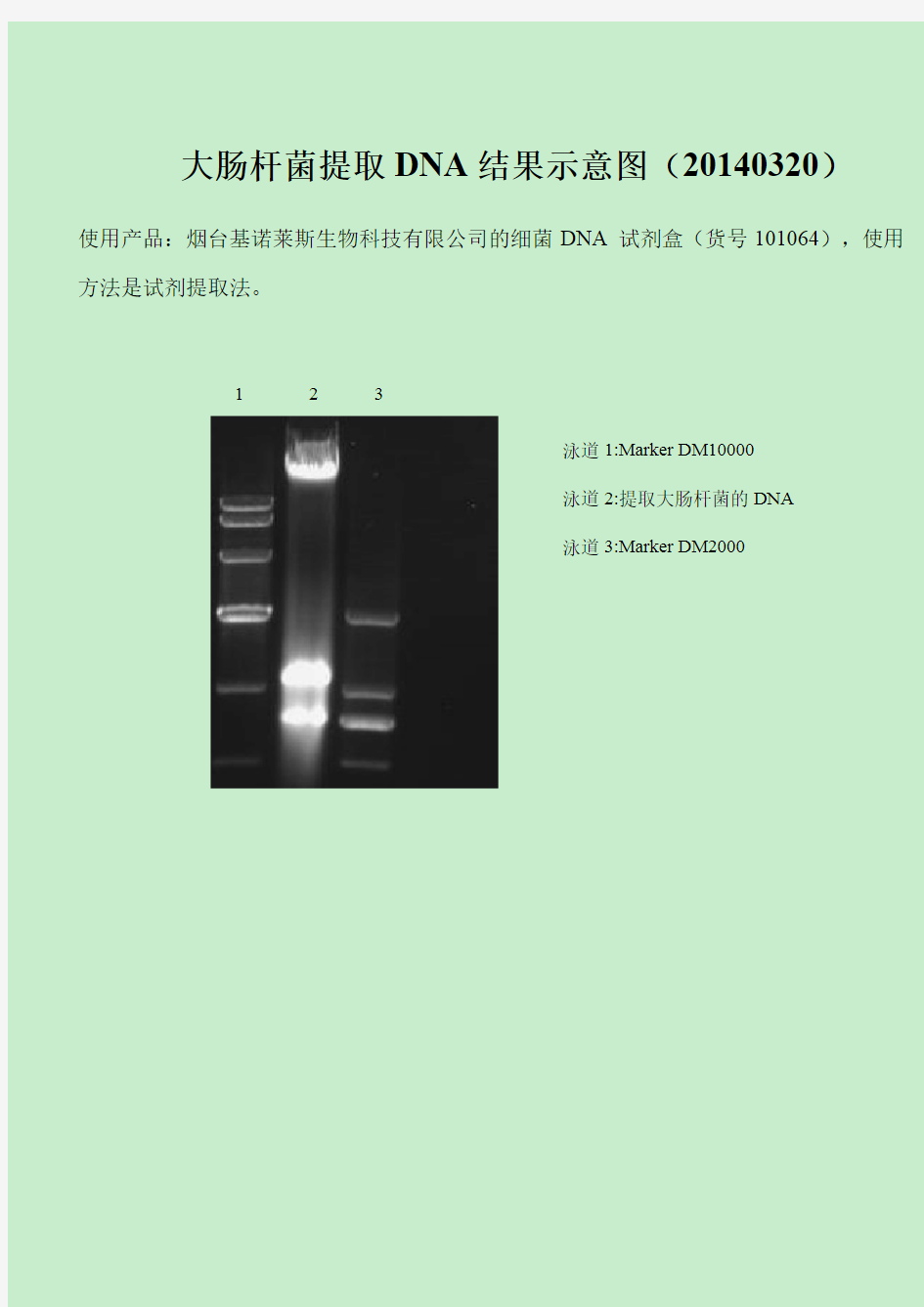
大肠杆菌提取DNA结果示意图(20140320)
使用产品:烟台基诺莱斯生物科技有限公司的细菌DNA试剂盒(货号101064),使用方法是试剂提取法。
123
泳道1:Marker DM10000
泳道2:提取大肠杆菌的DNA
泳道3:Marker DM2000
大肠杆菌基因组DNA的提取及荧光定量PCR试验设计
大肠杆菌基因组DNA得提取 一、传统法提取大肠杆菌基因组DNA。 1、实验原理 提取DNA得一般过程就是将分散好得组织细胞在含十二烷基硫酸钠(SDS)与蛋白酶K得溶液中消化分解蛋白质,再用酚与氯仿/异戊醇抽提分离蛋白质,得到得DNA溶液经乙醇沉淀使DNA从溶液中析出。 SDS得作用机理就是由于其能结合蛋白,中与蛋白得电性,使蛋白质得非共价键受到破坏,失去二级结构,从而变形失活,蛋白酶K或链霉蛋白酶E均为光谱蛋白酶,其重要特性就是能在SDS与EDTA(乙二胺四乙酸二钠)存在得情况下保持很高得活性。在匀浆后提取DNA得反应体系中,SDS可通过失活蛋白破坏细胞膜、核膜,并使组织蛋白与DNA分离;而蛋白酶K可将蛋白质降解成小肽或氨基酸,使DNA分子完整地分离出来。用酚、酚/氯仿抽提除去蛋白质,最后用无水乙醇沉淀DNA。为获得高纯度DNA,操作过程中常加入RNaseA除去RNA。CTAB(十六烷基三乙基溴化铵)就是一种去污剂,可溶解细胞膜,它能与核酸形成复合物,在高盐溶液中(0、7 mol/L NaCl)就是可溶得,当降低溶液盐浓度到一定得程度(0、3 mol/L NaCl)时,从溶液中沉淀,通过离心就可将CTAB核酸得复合物与蛋白,多糖物质分开。最后通过乙醇或异丙醇沉淀DNA,而CTAB溶于乙醇或异丙醇而除去。 2、实验试剂与仪器 1)实验材料:大肠杆菌 2)实验试剂: LB液体培养基,TE溶液,10%SDS,蛋白酶K,5mol/L NaCl, CTAB/NaCl溶液,酚/氯仿/异戊醇,异丙醇,70%乙醇 3)实验仪器:恒温摇床、低温离心机、微量移液器、水浴锅
3、溶液配制 1)LB液体培养基:细菌培养用胶化蛋白胨10 g/L,细菌培养用酵母提取物5 g/L,NaCl 10g/L,去离子水。 (搅拌溶解后,用5mol/LNaOH调pH至7、0、用去离子水定容100ml,用20/50ml 摇瓶分装5瓶,包扎好,在121℃,1、034×105 pa高压下蒸汽灭菌20min、) 2)TE缓冲液: 1M Tris 溶液(取Tris242、2g,加ddH2O至1600ml,加热溶解) 1M trisHCl pH8、0 溶液(取 1M Tris 溶液160ml用分析纯盐酸调至Ph=8、0(需浓盐酸约8、5ml),加ddH2O定容至200ml,高压灭菌备用) TE缓冲液(10 mM TrisHCl 1Mm EDTA pH=8、0,1M TrisHCl Buffer PH=8、0 5ml 0、5M EDTA PH =8、0 1ml向烧杯中加入约400mldd H2O均匀混合;将溶液 定容到500ml后,高温高压灭菌,室温保存) 3)蛋白酶K:(20mg蛋白酶K溶于1ml无菌双蒸水,20℃备用) 4)CTAB/NaCl溶液:(5% w/v,5gCTAB溶于100ml 0、5M NaCl溶液中,需加热到 65℃使之溶解,然后室温保存) 4、实验方法步骤 1、将大肠杆菌接种到灭菌好得LB培养基中,一级培养过夜,以10%得接种量进行二级培养,培养至对数期(46h)。 2、取菌液1、5ml置于离心管中,以5000rpm冷冻离心1min,弃上清液 3、加190 ul TE悬浮沉淀,并加10 ul 10%SDS,摇匀直至溶液变粘稠 4、加入1ul蛋白酶K(20mg/ml),混匀,37℃保温1小时。 5、加30ul 5 mol/L NaCl,混匀。 6、加30ul CTAB/NaCl溶液,混匀,65℃保温20min
大肠杆菌染色体基因组的结构和功能
大肠杆菌染色体基因组的结构和功能 大肠杆菌染色体基因组是研究最清楚的基因组。估计大肠杆菌基因组含有3500个基因,已被定位的有900个左右。在这900个基因中,有260个基因已查明具有操纵子结构,定位于75个操纵子中。在已知的基因中8%的序列具有调控作用。大肠杆菌染色体基因组中已知的基因多是编码一些酶类的基因,如氨基酸、嘌呤、嘧啶、脂肪酸和维生素合成代谢的一些酶类的基因,以及大多数碳、氮化合物分解代谢的酶类的基因。另外,核糖体大小亚基中50多种蛋白质的基因也已经鉴定了。 除了有些具有相关功能的基因在一个操纵子内由一个启动子转录外,大多数基因的相对位置可以说是随机分布的。如控制小分子合成和分解代谢的基因,大分子合成和组装的基因分布在大肠杆菌基因组的许多部位,而不是集中在一起。再如,有关糖酵解的酶类的基因分布在染色体基因组的各个部位。进一步发现,大肠杆菌和与其分类关系上相近的其他肠道菌如志贺氏杆菌属(Shigella)、沙门氏菌属(Salmonella)等具有相似的基因组结构。伤寒沙门氏杆菌(Salmonellatyphimurium)几乎与大肠杆菌的基因组结构相同,虽然有10%的基因组序列和大肠杆菌相比发生颠倒,但是其基因的功能仍正常。这更进一步说明染色体上的基因似乎没有固定的格局,相对位置的改变不会影响其功能。 在已知转录方向的50个操纵子中,27个操纵子按顺时针方向转录,23个操纵子按反时针方向转录,即DNA两条链作为模板指导mRNA合成的机率差不多相等。在大肠杆菌染色体基因组中,差不多所有的基因都是单拷贝基因,因为多拷贝基因在同一条染色体上很不稳定,极易通过同源重组的方式丢失重复的基因序列。另外,由于大肠杆菌细胞分裂极快,可以在20分钟内完成一次分裂,因此,携带多拷贝基因的大肠杆菌并不比单拷贝基因的大肠杆菌更为有利;相反,由于多拷贝基因的存在,使E.coli的整个基因组增大,复制时间延长,因而更为不利,除非在某种环境下,需要有多拷贝基因用来编码大量的基因产物,例如,在有极少量乳糖或乳糖衍生物的培养基上,乳糖操纵子的多拷贝化可以使大肠杆菌充分利用的乳糖分子。但是,一旦这种选择压力消失,如将大肠杆菌移到有丰富的乳糖培养基上,多拷贝的乳糖操纵子便没有存在的必要,相反,由于需要较长的复制时间,这种重复的多拷贝基因会重新丢失。 大肠杆菌染色体基因组中,大多数rRNA基因集中于基因组的复制起点oriC的位置附近。这种位置有利于rRNA基因在早期复制后马上作为模板进行rRNA的合成以便进行核糖体组装和蛋白质的合成。从这一点上看,大肠杆菌基因组上的各个基因的位置与其功能的重要性可能有一定的联系。
基因组DNA提取步骤
基因组DNA提取步骤 1.从无水乙醇中取出少许组织(约50mg)加入干净灭菌的EP管中, 剪碎; 2.加入400ul 1%的SDS,8ul(20mg/ml)的蛋白酶K,充分浸润, 入55℃摇床(100转/分),期间振荡助溶至澄清(5-6h); 3.取出消化液,加入6mol/L的NaCl300ul,氯仿200ul,轻柔正反 颠倒,使其充分乳化,4℃13000转/分离心30min; 4.取出上清(约400ul),加入等体积氯仿抽提一次,轻柔颠倒后, 4℃13000转/分离心10min; 5.上清加入5μl RNaseA(10μg/μl), 37℃10分钟, 除去RNA(RNA对DNA的操作、分析一 般无影响,可省略该步骤)。 6.取上清加入等体积异丙醇,轻柔混匀后-20℃沉淀10min; 7.4℃13000转/分离心15min,弃上清; 8.用75%乙醇洗涤1-2次(1000ul,11000转/分离心2min),弃上 清; 9.冰冻无水乙醇洗涤1-2次(1000ul,11000转/分离心4min)弃上 清,自然晾干或烘干,DDW溶解,30-50ul。 基因组DNA的提取通常用于构建基因组文库、Southern杂交(包括RFLP)及PCR分离基因等。利用基因组DNA较长的特性,可以将其与细胞器或质粒等小分子DNA分离。加入一定量的异丙醇或乙醇,
基因组的大分子DNA即沉淀形成纤维状絮团飘浮其中, 可用玻棒将其取出,而小分子DNA则只形成颗粒状沉淀附于壁上及底部, 从而达到提取的目的。在提取过程中,染色体会发生机械断裂,产生大小不同的片段,因此分离基因组DNA时应尽量在温和的条件下操作,如尽量减少酚/氯仿抽提、混匀过程要轻缓, 以保证得到较长的DNA。一般来说,构建基因组文库, 初始DNA长度必须在100kb以上,否则酶切后两边都带合适末端的有效片段很少。而进行RFLP和PCR分析, DNA长度可短至50kb, 在该长度以上,可保证酶切后产生RFLP片段(20kb以下),并可保证包含PCR所扩增的片段(一般2kb以下)。 不同生物(植物、动物、微生物)的基因组DNA的提取方法有所不同; 不同种类或同一种类的不同组织因其细胞结构及所含的成分不同,分离方法也有差异。在提取某种特殊组织的DNA时必须参照文献和经验建立相应的提取方法, 以获得可用的DNA大分子。尤其是组织中的多糖和酶类物质对随后的酶切、PCR反应等有较强的抑制作用,因此用富含这类物质的材料提取基因组DNA时, 应考虑除去多糖和酚类物质。 本实验以水稻幼苗(禾本科)、李(苹果)叶子、动物肌肉组织和大肠杆菌培养物为材料,学习基因组DNA提取的一般方法。 从植物组织提取基因组DNA 一、材料 水稻幼苗或其它禾本科植物,李(苹果)幼嫩叶子。 二、设备 移液器,冷冻高速离心机,台式高速离心机,水浴锅,陶瓷研钵,50ml离心管(有盖)及5ml和 1.5ml离心管,弯成钩状的小玻棒。 三、试剂 1、提取缓冲液Ⅰ:100mmol/L Tris·Cl, pH8.0, 20mmol/L EDTA, 500mmol/L NaCl, 1.5% SDS。 2、提取缓冲液Ⅱ:18.6g葡萄糖,6.9g二乙基二硫代碳酸钠,6.0gPVP,240ul巯基乙醇,加水至300ml。 3、80:4:16/氯仿:戊醇:乙醇 4、RnaseA母液:配方见第一章。 5、其它试剂:液氮、异丙醇、TE缓冲液,无水乙醇、70%乙醇、3mol/L NaAc。 四、操作步骤: (一)水稻幼苗或其它禾木科植物基因组DNA提取 1. 在50ml离心管中加入20ml提取缓冲液Ⅰ, 60℃水浴预热。 2. 水稻幼苗或叶子5-10g, 剪碎, 在研钵中加液氮磨成粉状后立即倒入预热的离心管中, 剧烈摇动混匀, 60℃水浴保温30-60分钟(时间长,DNA产量高), 不时摇动。 3. 加入20ml氯仿/戊醇/乙醇溶液, 颠倒混匀(需带手套, 防止损伤皮肤),室温下静置5-10分钟, 使水相和有机相分层(必要时可重新混匀)。 4. 室温下5000rpm离心5分钟。 5. 仔细移取上清液至另一50ml离心管,加入1倍体积异丙醇,混匀,室温下放置片刻即出现絮状DNA沉淀。 6. 在1.5ml eppendorf中加入1ml TE。用钩状玻璃棒捞出DNA絮团,在干净吸水纸上吸干,转
大肠杆菌质粒DNA的提取
一、大肠杆菌质粒DNA的提取 质粒DNA的提取是从事基因工程工作中的一项基本实验技术,但提取方法有很多种,以下介绍一种最常用的方法: 碱裂解法:此方法适用于小量质粒DNA的提取,提取的质粒DNA可直接用于酶切、PCR扩增、银染序列分析。方法如下: 1、接1%含质粒的大肠杆菌细胞于2ml LB培养基。 2、37℃振荡培养过夜。 3、取1.5ml菌体于Ep管,以4000rpm离心3min,弃上清液。 4、加0.lml溶液I(1%葡萄糖,50mM/L EDTA pH8.0,25mM/L Tris-HCl pH8.0)充分混合。 5、加入0.2ml溶液II(0.2 mM/L NaOH,1%SDS),轻轻翻转混匀,置于冰浴5 min 。 6、加入0.15m1预冷溶液III(5 mol/L KAc,pH4.8),轻轻翻转混匀,置于冰浴5 min 。 7、以10,000rpm离心20min,取上清液于另一新Ep管 8、加入等体积的异戊醇,混匀后于?0℃静置10min。 9、再以10,000rpm离心20min,弃上清。 10、用70%乙醇0.5ml洗涤一次,抽干所有液体。 11、待沉淀干燥后,溶于0.05mlTE缓冲液中 煮沸法 1、将1.5ml培养液倒入eppendorf管中,4℃下12000g离心30秒。 2、弃上清,将管倒置于卫生纸上几分钟,使液体流尽。 3、将菌体沉淀悬浮于120ml STET溶液中, 涡旋混匀。 4、加入10ml新配制的溶菌酶溶液(10mg/ml), 涡旋振荡3秒钟。 5、将eppendorf管放入沸水浴中,50秒后立即取出。 6、用微量离心机4℃下12000g离心10分钟。 7、用无菌牙签从eppendorf管中去除细菌碎片。 8、取20ml进行电泳检查。 [注意] 1. 对大肠杆菌可从固体培养基上挑取单个菌落直接进行煮沸法提取质粒DNA。 2. 煮沸法中添加溶菌酶有一定限度,浓度高时,细菌裂解效果反而不好。有时不同溶菌酶也能溶菌。 3. 提取的质粒DNA中会含有RNA,但RNA并不干扰进一步实验,如限制性内切酶消化,亚克隆及连接反应等。 质粒DNA的大量提取和纯化 在制作酶谱、测定序列、制备探针等实验中需要高纯度、高浓度的质粒DNA,为此需要大量提取质粒DNA。大量提取的质粒DNA一般需进一步纯化,常用柱层析法和氯化绝梯度离心法。 (一)、碱法 1、取培养至对数生长后期的含pBS质粒的细菌培养液250ml,4℃下5000g离心15分钟,弃上清,将离心管倒置使上清液全部流尽。 2、将细菌沉淀重新悬浮于50ml用冰预冷的STE中(此步可省略)。 3、同步骤1方法离心以收集细菌细胞。
实验1 试剂盒方法提取基因组DNA组和质粒DNA
实验一试剂盒方法提取基因组DNA和质粒DNA 黄华如 (生命科学学院,生技091,29号) 摘要:实验用试剂盒方法提取nchpzh008植物DNA组,本组可以在电泳图谱中清晰看到DNA条带,而在用不同引物组合来对DNA进行PCR,在聚丙烯凝胶电泳图谱中可以看到,引物组合me4em3、me5em2、me5em3对植物DNA使比较好的,这些引物组合可以用在不同物种的遗传特性分析。利用柱式试剂盒提取PUC18和500bp质粒DNA,其中1-3组提取PUC18,4-6组提取500bp质粒DNA。结果是提取PUC18质粒DNA的同学没能将质粒提取出来,而提取500bp的全部都可以提出来。说明了PUC18质粒没有成功转化大肠杆菌,而500bp则转进了大肠杆菌。 关键词:试剂盒;DNA基因组;PCR技术;质粒DNA 植物细胞通常有三套基因组,即染色体基因组、线粒体基因组和叶绿体基因组,其对应的DNA分别称为基因组DNA、线粒体DNA和叶绿体DNA。植物细胞的总DNA中95%以上是基因组DNA,而且在常规提取条件下,mtDNA和ctDNA因裸露存在,没有蛋白质的保护,会由于提取缓冲液中酸、碱的水解而丢失。 质粒是存在于细菌细胞中的染色体外小分子DNA,一般呈双链闭合环状,能自我复制和垂直遗传,并赋予宿主细胞一些新表性,但质粒的存在对细胞本身的存在并不是必需的。质粒本身或经过一定改造后的质粒常被用作基因载体,将外源基因带入受体细胞中复制和扩增,甚至表达。质粒有严谨型和松弛型之分,基因工程研究中所用的质粒主要是松弛型质粒,或是经过遗传修饰的人工质粒。 DNA提取是植物分子生物学研究的基础技术。目前,已经发展了多种方法,成功地从植物叶片、愈伤组织、组培苗、果实、韧皮部等组织器官中提取出DNA。但是有些情况下,不同植物甚至是同一种类植物组织材料的来源、部位、形态等外在性质的不同以及化学成分、组织结构等内在特点的差异,在提取基因组DNA时需要选择不同的方法或作一些特殊的处理。从富含多糖、多酚、单宁、色素及其他次生代谢物质的木本植物中提取的方法难度就相对大于大多数的禾谷类及蔬菜类植物。从这些植物中分离出的DNA由于多酚被氧化成棕褐色,多糖、单宁等物质与DNA会结合成粘稠的胶状物,获得的DNA常出现产量低,质量差、易降解,影响了DNA质量和纯度,不能被限制性内切酶酶切,严重的甚至不能作为模板进行PCR扩增。用试剂盒方法提取DNA组是一种比较方便和高效的方法。 1 材料与方法 1.1 试供材料 nchpfszh004、nchpfzh01101、nchpfzh01102、农场和平1号、nchpzh021、nchpzh008、大肠杆菌 1.2 试剂配制 氯仿、异丙醇、Tris、Hcl、EDTA、75%乙醇、灭菌水、TBE缓冲液、硼酸、PCR试剂盒、DNA提取试剂盒、琼脂糖等 1.3 实验设备及用具 高速冷冻离心机、液氮罐、恒温水浴锅、紫外分光光度计、制冰机、冰箱、移液枪、PH 计、冰盒、恒温培养箱、恒温振荡摇床、高压灭菌锅、恒温水浴锅等。 1.4 试剂盒方法提取DNA组步骤 1)65℃预热柱式植物DNAout溶液A,使其沉淀融化,充分混匀,取0.75ml加入到5ml
大肠杆菌基因组DNA的提取方式
大肠杆菌基因组DNA的提取方式 一、传统法提取大肠杆菌基因组DNA。 1、实验原理 提取DNA的一般过程是将分散好的组织细胞在含十二烷基硫酸钠(SDS)和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。 SDS的作用机理是由于其能结合蛋白,中和蛋白的电性,使蛋白质的非共价键受到破坏,失去二级结构,从而变形失活,蛋白酶K或链霉蛋白酶E均为光谱蛋白酶,其重要特性是能在SDS和EDTA(乙二胺四乙酸二钠)存在的情况下保持很高的活性。在匀浆后提取DNA的反应体系中,SDS可通过失活蛋 白破坏细胞膜、核膜,并使组织蛋白和DNA分离;而蛋白酶K可将蛋白质降 解成小肽或氨基酸,使DNA分子完整地分离出来。用酚、酚/氯仿抽提除去蛋白质,最后用无水乙醇沉淀DNA。为获得高纯度DNA,操作过程中常加入RNaseA除去RNA。CTAB(十六烷基三乙基溴化铵)是一种去污剂,可溶解 细胞膜,它能与核酸形成复合物,在高盐溶液中(0.7mol/LNaCl)是可溶的,当降低溶液盐浓度到一定的程度(0.3mol/LNaCl)时,从溶液中沉淀,通过离心就可将CTAB-核酸的复合物与蛋白,多糖物质分开。最后通过乙醇或异丙醇沉淀DNA,而CTAB溶于乙醇或异丙醇而除去。 2、实验试剂与仪器 1)实验材料:大肠杆菌
2)实验试剂: LB液体培养基,TE溶液,10%SDS,蛋白酶K,5mol/LNaCl,CTAB/NaCl 溶液,酚/氯仿/异戊醇,异丙醇,70%乙醇 3)实验仪器:恒温摇床、低温离心机、微量移液器、水浴锅 3、溶液配制 1)LB液体培养基:细菌培养用胶化蛋白胨10g/L,细菌培养用酵母提取物5g/L,NaCl10g/L,去离子水。 (搅拌溶解后,用5mol/LNaOH调pH至7.0.用去离子水定容100ml,用 20/50ml摇瓶分装5瓶,包扎好,在121℃,1.034×105pa高压下蒸汽灭菌20min.) 2)TE缓冲液: 1MTris溶液(取Tris242.2g,加ddH2O至1600ml,加热溶解) 1Mtris-HClpH8.0溶液(取1MTris溶液160ml用分析纯盐酸调至Ph=8.0(需浓盐酸约8.5ml),加ddH2O定容至200ml,高压灭菌备用) TE缓冲液(10mMTris-HCl1MmEDTApH=8.0,1MTris- HClBufferPH=8.05ml 0.5MEDTAPH=8.01ml向烧杯中加入约400mlddH2O均匀混合;将溶液定 容到500ml后,高温高压灭菌,室温保存) 3)蛋白酶K:(20mg蛋白酶K溶于1ml无菌双蒸水,-20℃备用)
大肠杆菌基因组DNA提取及荧光定量PCR试验设计
大肠杆菌基因组的提取 一、传统法提取大肠杆菌基因组。 1、实验原理 提取的一般过程是将分散好的组织细胞在含十二烷基硫酸钠()和蛋白酶 K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的溶 液经乙醇沉淀使从溶液中析出。 的作用机理是由于其能结合蛋白,中和蛋白的电性,使蛋白质的非共价键 受到破坏,失去二级结构,从而变形失活,蛋白酶K或链霉蛋白酶E均为光谱 蛋白酶,其重要特性是能在和(乙二胺四乙酸二钠)存在的情况下保持很高的 活性。在匀浆后提取的反应体系中,可通过失活蛋白破坏细胞膜、核膜,并使 组织蛋白和分离;而蛋白酶K可将蛋白质降解成小肽或氨基酸,使分子完整地 分离出来。用酚、酚/氯仿抽提除去蛋白质,最后用无水乙醇沉淀。为获得高纯度,操作过程中常加入除去。(十六烷基三乙基溴化铵)是一种去污剂,可溶 解细胞膜,它能与核酸形成复合物,在高盐溶液中(0.7 )是可溶的,当降低 溶液盐浓度到一定的程度(0.3 )时,从溶液中沉淀,通过离心就可将核酸的 复合物与蛋白,多糖物质分开。最后通过乙醇或异丙醇沉淀,而溶于乙醇或异 丙醇而除去。 2、实验试剂与仪器 1)实验材料:大肠杆菌 2)实验试剂: 液体培养基,溶液,10,蛋白酶K,5 ,溶液,酚/氯仿/异戊醇,异丙醇,70% 乙醇 3)实验仪器:恒温摇床、低温离心机、微量移液器、水浴锅 3、溶液配制 1)液体培养基:细菌培养用胶化蛋白胨10 ,细菌培养用酵母提取物5 ,10,去离子水。
(搅拌溶解后,用5调至7.0.用去离子水定容100,用20/50摇瓶分装5瓶,包扎好,在121℃,1.034×105 高压下蒸汽灭菌20.) 2)缓冲液: 1M 溶液(取242.2g,加2O至1600,加热溶解) 1M 8.0 溶液(取 1M 溶液160用分析纯盐酸调至8.0(需浓盐酸约8.5),加2O定容至200,高压灭菌备用) 缓冲液(10 1 8.0,1M 8.0 5 0.5M =8.0 1向烧杯中加入约400 H2O均匀混合;将溶液定容到500后,高 温高压灭菌,室温保存) 3)蛋白酶K:(20蛋白酶K溶于1无菌双蒸水,-20℃备用) 4)溶液:(5% ,5溶于100 0.5M 溶液中,需加热到65℃使之溶解,然后室温 保存) 4、实验方法步骤 1、将大肠杆菌接种到灭菌好的培养基中,一级培养过夜,以10%的接种量进行二级培养,培养至对数期(4-6h)。 2、取菌液1.5置于离心管中,以5000冷冻离心1,弃上清液 3、加190 悬浮沉淀,并加10 10,摇匀直至溶液变粘稠 4、加入1蛋白酶K(20),混匀,37℃保温1小时。 5、加30 5 ,混匀。 6、加30 溶液,混匀,65℃保温20 7、加入300酚/氯仿/异戊醇抽提(25:24:1),5000离心10 8、取上清液,加入300氯仿/异戊醇(24:1)抽提,5000离心10
大肠杆菌基因型及遗传符号说明
大肠杆菌基因型及遗传符号说明 前言:实验室的一般大肠杆菌拥有4288条基因,每条基因的长度约为950bp,基因间的平均间隔为118bp(基因Ⅷ)。E.coli基因组中还包含有许多插入序列,如λ-噬菌体片段和一些其他特殊组份的片段,这些插入的片段都是由基因的水平转移和基因重组而形成的,由此表明了基因组具有它的可塑造性。 利用大肠杆菌基因组的这种特性对其进行改造,使其中的某些基因发生突变或缺失,从而给大肠杆菌带来可以观察到的变化,这种能观察到的特征叫做大肠杆菌的表现型(Phenotype),把引起这种变化的基因构成叫做大肠杆菌的基因型(Genotype)。具有不同基因型的菌株表现出不同的特性。 分子克隆中常用的大肠杆菌及其遗传标记按Demerec等1966年提出的命名原则,采用的菌株所有的基因都假定处于野生型状态,除非在基因型上另外注明。 大肠杆菌基因型的表示方法(Demerec, et, al. 1966): 一、一般规则: 1、根据基因产物或其作用产物的英文名称的第一个字母缩写成3个小写斜体字母来表示。例如:DNA Adenine Methylase→dam。 2、不同的基因座,其中任何一个突变所产生的表型变化可能相同,其表示方法是在3个小写斜体字母后加上一个斜体大写字母来表示区别。例如:Recombination→recA、recB、recC。 3、突变位点应通过在突变基因符号后加不同数字表示。如supE44(sup基因座E的44位突变)。如果不知道几个等位基因中哪一/几个发生了功能性突变,则用连字符“-”代替大写字母,如trp-31。 4、细菌的基因型中应该包含关于其携带的质粒或附加体的的信息。这些符号包括菌株携带的质粒或附加体、质粒或附加体上的突变基因座和突变位点。其基因符号应与基因座的表示符号明显区别,符号的第一个字母大写、不斜体并位于括号内;质粒或附加体上的突变基因座和突变位点的基因符号的表示方法与染色体上突变基因座、突变位点的符号相同。 5、对于携带附加体的菌株的完整基因型描述应包括附加体的状态(游离或整合)。以F因子为例,F-:F因子缺失;F+:自主性F因子,不携带任何遗传可识别染色体片段;F’:携带有遗传可识别细菌染色体片段的自主性F因子;Hfr:整合到染色体上的F因子(high frequency of recombination)。当这些质粒或噬菌体片段变异或缺失时,用()”或“/”等以区别。例如:/F' [traD3 6、proAB、lac I q、lacZ M15] 6、某个基因或某个领域缺失时,在其基因型前面加上“ ”表示。例如:lac-proAB基因缺失时它的基因型表示为( lac-proAB)。 7、由于某种基因的变异导致大肠杆菌可以明显观察到特征变化,有时也用其表现型代替基因型进行表示。例如:某些抗药性的获得或丧失,用如下方式表示:Streptomycin抗性→Str
实验一 CTAB NaCl法细菌基因组DNA提取
实验一CTAB/NaCl 法细菌基因组DNA提取 一、培养基 A. LB培养基(1L) 胰蛋白胨10g、酵母粉5g、NaCl 10g pH调至7.0 二、菌种 大肠杆菌野生型 三、缓冲液 A. 1M Tris-HCl ( pH 8.0, 1L) 1.称量121.1 g Tris置于l L烧杯中,加入约800 ml的ddH2O,充分搅拌溶解,加浓HCl约42ml,将溶液定容至1 L。 C. TE缓冲液(pH 8.0) 10 mmol/L Tris-Cl (pH8.0),1mmol/L EDTA (pH8.0) D. 10% SDS溶液 10 gSDS,定容至100ml E. CTAB/NaCl缓冲液 CTAB 4g NaCl 16.364 g 1M Tris-HCl 20ml ( PH8.0) 0.5M EDTA 8ml 先用70ml ddH2O溶解, 再定容至200ml灭菌,冷却后0.2-1% β-巯基乙醇(400ul)。 F. 5mol/L NaCl溶液 292.5 gNaCl了,定容至1L G. 氯仿:异戊醇(24:1) 480ml氯仿+20ml异戊醇,混匀存放至棕色瓶备用。
H. 酚:氯仿:异戊醇(25:24:1) 250mlTris饱和酚+240ml氯仿+10ml异戊醇,混匀存放至棕色瓶备用。 I. 上样缓冲液(6×) 0.25%溴酚蓝,20%蔗糖 J. 电泳缓冲液(1×, 1L) Tris碱10.8g,硼酸5. 5g,0.5mol/L EDTA (pH8.0)4ml, 用ddH2O定容至1L。 K. 0.7%琼脂糖凝胶(100 ml) 0.7 g琼脂糖凝胶, 加入1×电泳缓冲液,微波炉加热至凝胶完全融化即可 三、实验具体步骤 1、接种一单菌落于5mlLB中, 30℃培养过夜, 2、取1ml种子培养液接入100ml LB中, 37℃、220r/min培养16小时; 3、5000r/min离心10分钟,弃去上清。 4、加入10mlTE离心洗涤后,用10mlTE溶解菌体,混匀。 5、取1.4ml菌悬液,加入73.6μl10%SDS,混匀,加入14.8μl10mg/ml蛋白酶K, 混匀, 37℃温育1小时 6、加入296μl 5mol/LNaCl, 再加入204.8μlCTAB/NaCl,混匀,65℃温育10分钟。(注:总体积约2ml) 7、加入等体积的氯仿/异戊醇,混匀,10000r/min离心5分钟,保留上清。 8、上清中加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),混匀,10000r/min离心5分钟,保留上清。 9、加入0.6倍体积的异丙醇,混匀,10000r/min离心5分钟,收集DNA沉淀,用70%乙醇离心洗涤DNA 沉淀,10000r/min离心5分钟,弃上清液,沉淀即总DNA。 10、用1mlTE溶解DNA,取5μl在琼脂糖电泳中上样检测。
实验一--大肠杆菌基因组提取
在实验开始,首先对实验的一些必须步骤(注:在几乎每一次小实验都会使用到的试验方法)做一定的解释。避免在写实验报告的过程中太过混乱!并且这些过程并不是每一位同学都参与了的,故在本实验报告的开篇写出。 (一)制备1%的琼脂糖凝胶 称取1g琼脂糖,放入锥形瓶中,加入100 mL的1 × TAE缓冲液,在微波炉中加热。完全融化后,取出摇匀。 (二)胶板的制备 1. 用橡皮膏将胶板的两端边缘封闭好。 2. 将胶板放在水平处,放好样品梳子。 3. 将冷却到60℃左右的琼脂糖凝胶缓慢倒入胶板中,注意不要产生气泡。胶的厚度在3-5mm之间。 4. 待胶凝固后,取出梳子,取下橡皮膏,放入电泳槽内(注意:梳子的方向靠近负极)。 5. 向电泳槽中加入1 × TAE缓冲液,缓冲液要浸没凝胶。 (三)加样 1. 在样品中加入适量的10 ×上样缓冲液,使缓冲液的终浓度为1×。 2. 用微量移液器将已加入缓冲液的样品加入上样孔中。记录加样的顺序和加样量。(注意:加样的过程中不要让样品溢出上样孔) (四)电泳 1. 接通电泳槽与电泳仪的电源(注意DNA片段是从负极向正极移动)。DNA的迁移速度与电压成正比。最高电压不超过5V/cm。 2. 当溴酚蓝染料移动到凝胶的2/3处时,停止电泳。
(五)染色 将电泳后的凝胶浸入溴化乙锭染色液中(带手套操作)。 (六)观察实验结果 在紫外灯(360 nm或254 nm)下观察染色后的凝胶,DNA处显出橘红色的荧光条带。 实验一大肠杆菌基因组提取 【实验目的】 1.学习并掌握细菌基因组的提取方法 【实验原理】 DNA是一个环形的大分子DNA,真核生物的DNA是以染色体的形式存在于细胞核内。不同种属的生物,以及不同形式的细胞(如菌类、培养细胞、植物组织,动物组织)基因组提取的方法是不同的,但其基本原则是类似的,即既要将DNA与蛋白质、脂类和糖类等分离,又要保持DNA分子的完整。提取DNA 的一般过程是将分散好的组织细胞在含十二烷基硫酸钠(SDS)和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。SDS的作用机理是由于其能结合蛋白,中和蛋白的电性,使蛋白质的非共价键受到破坏,失去二级结构,从而变形失活,蛋白酶K的重要特性是能在SDS和EDTA(乙二胺四乙酸二钠)存在的情况下保持很高的活性。在匀浆后提取DNA的反应体系中,SDS可通过失活蛋白破坏细胞膜、核膜,并使组织蛋白与DNA分离;而蛋白酶K可将蛋白质降解成小肽或氨基酸,使DNA分子完整地分离出来。CTAB(十六烷基三乙基溴化铵)是一种
大肠杆菌基因型及遗传符号说明系列一DXY
大肠杆菌基因型及遗传符号说明系列一 点击次数:982 作者:佚名发表于:2009-09-27 00:00转载请注明来自丁香园 来源:丁香园 实验室的一般大肠杆菌拥有4288条基因,每条基因的长度约为950bp,基因间的平均间隔为118bp (基因Ⅷ)。E.coli基因组中还包含有许多插入序列,如λ-噬菌体片段和一些其他特殊组份的片段,这些插入的片段都是由基因的水平转移和基因重组而形成的,由此表明了基因组具有它的可塑造性。 利用大肠杆菌基因组的这种特性对其进行改造,使其中的某些基因发生突变或缺失,从而给大肠杆菌带来可以观察到的变化,这种能观察到的特征叫做大肠杆菌的表现型(Phenotype),把引起这种变化的基因构成叫做大肠杆菌的基因型(Genotype)。具有不同基因型的菌株表现出不同的特性。 分子克隆中常用的大肠杆菌及其遗传标记按Demerec等1966年提出的命名原则,采用的菌株所有的基因都假定处于野生型状态,除非在基因型上另外注明。 大肠杆菌基因型的表示方法(Demerec, et, al. 1966): 一、一般规则: 1、根据基因产物或其作用产物的英文名称的第一个字母缩写成3个小写斜体字母来表示。例如:D NA Adenine Methylase→dam。 2、不同的基因座,其中任何一个突变所产生的表型变化可能相同,其表示方法是在3个小写斜体字母后加上一个斜体大写字母来表示区别。例如:Recombination→recA、recB、recC。 3、突变位点应通过在突变基因符号后加不同数字表示。如supE44(sup基因座E的44位突变)。
如果不知道几个等位基因中哪一/几个发生了功能性突变,则用连字符“ -”代替大写字母,如trp-31。 4、细菌的基因型中应该包含关于其携带的质粒或附加体的的信息。这些符号包括菌株携带的质粒或附加体、质粒或附加体上的突变基因座和突变位点。其基因符号应与基因座的表示符号明显区别,符号的第一个字母大写、不斜体并位于括号内;质粒或附加体上的突变基因座和突变位点的基因符号的表示方法与染色体上突变基因座、突变位点的符号相同。 5、对于携带附加体的菌株的完整基因型描述应包括附加体的状态(游离或整合)。以F因子为例,F-:F因子缺失;F+:自主性F因子,不携带任何遗传可识别染色体片段;F':携带有遗传可识别细菌染色体片段的自主性F因子;Hfr:整合到染色体上的F因子(high frequency of recombination)。当这些质粒或噬菌体片段变异或缺失时,用()“或”/“等以区别。例如:/F' [traD3 6、proAB、lac I q、lacZ. M 15] 6、某个基因或某个领域缺失时,在其基因型前面加上“ ”表示。例如:lac-proAB基因缺失时它的基因型表示为(lac-proAB)。 7、由于某种基因的变异导致大肠杆菌可以明显观察到特征变化,有时也用其表现型代替基因型进行表示。例如:某些抗药性的获得或丧失,用如下方式表示:Streptomycin抗性→Str +或Str r,Ampicilli n敏感性→ Amp-。(第一个字母要大写,“+”或“r”表示有抗性,“-”表示无抗性或敏感)。 8、根据某些特异性蛋白的变异及其导致的结果变化进行表示。例如:TH2菌株上有一种基因型表示如下:hsdS20 (rB-、mB-),其中S20代表特异性识别蛋白发生变异,()中的rB-、mB-表示由于 S20的变异而导致B株来源的hsdR和hsdM的功能缺失。 9、蛋白质的名称与对应的基因或等位基因相同,但不用斜体,且首字母大写,如,UvrA、UvrB。 二、基因符号和意义(见表1)
大肠杆菌基因组DNA的提取及荧光定量PCR试验设计
大肠杆菌基因组DNA的提取 一、传统法提取大肠杆菌基因组DNA。 1、实验原理 提取DNA的一般过程是将分散好的组织细胞在含十二烷基硫酸钠(SDS)和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。 SDS的作用机理是由于其能结合蛋白,中和蛋白的电性,使蛋白质的非共价键受到破坏,失去二级结构,从而变形失活,蛋白酶K或链霉蛋白酶E均为光谱蛋白酶,其重要特性是能在SDS和EDTA(乙二胺四乙酸二钠)存在的情况下保持很高的活性。在匀浆后提取DNA的反应体系中,SDS可通过失活蛋白破坏细胞膜、核膜,并使组织蛋白和DNA分离;而蛋白酶K可将蛋白质降解成小肽或氨基酸,使DNA分子完整地分离出来。用酚、酚/氯仿抽提除去蛋白质,最后用无水乙醇沉淀DNA。为获得高纯度DNA,操作过程中常加入RNaseA除去RNA。CTAB(十六烷基三乙基溴化铵)是一种去污剂,可溶解细胞膜,它能与核酸形成复合物,在高盐溶液中(0.7 mol/L NaCl)是可溶的,当降低溶液盐浓度到一定的程度(0.3 mol/L NaCl)时,从溶液中沉淀,通过离心就可将CTAB-核酸的复合物与蛋白,多糖物质分开。最后通过乙醇或异丙醇沉淀DNA,而CTAB溶于乙醇或异丙醇而除去。 2、实验试剂与仪器 1)实验材料:大肠杆菌 2)实验试剂: LB液体培养基,TE溶液,10%SDS,蛋白酶K,5mol/L NaCl, CTAB/NaCl溶液,酚/氯仿/异戊醇,异丙醇,70%乙醇 3)实验仪器:恒温摇床、低温离心机、微量移液器、水浴锅
3、溶液配制 1)LB液体培养基:细菌培养用胶化蛋白胨10 g/L,细菌培养用酵母提取物5 g/L,NaCl 10g/L,去离子水。 (搅拌溶解后,用5mol/LNaOH调pH至7.0.用去离子水定容100ml,用20/50ml 摇瓶分装5瓶,包扎好,在121℃,1.034×105 pa高压下蒸汽灭菌20min.) 2)TE缓冲液: 1M Tris 溶液(取Tris242.2g,加ddH2O至1600ml,加热溶解) 1M tris-HCl pH8.0 溶液(取 1M Tris 溶液160ml用分析纯盐酸调至Ph=8.0(需浓盐酸约8.5ml),加ddH2O定容至200ml,高压灭菌备用) TE缓冲液(10 mM Tris-HCl 1Mm EDTA pH=8.0,1M Tris-HCl Buffer PH=8.0 5ml 0.5M EDTA PH =8.0 1ml向烧杯中加入约400mldd H2O均匀混合;将溶液定 容到500ml后,高温高压灭菌,室温保存) 3)蛋白酶K:(20mg蛋白酶K溶于1ml无菌双蒸水,-20℃备用) 4)CTAB/NaCl溶液:(5% w/v,5gCTAB溶于100ml 0.5M NaCl溶液中,需加 热到65℃使之溶解,然后室温保存) 4、实验方法步骤 1、将大肠杆菌接种到灭菌好的LB培养基中,一级培养过夜,以10%的接种量进行二级培养,培养至对数期(4-6h)。 2、取菌液1.5ml置于离心管中,以5000rpm冷冻离心1min,弃上清液 3、加190 ul TE悬浮沉淀,并加10 ul 10%SDS,摇匀直至溶液变粘稠 4、加入1ul蛋白酶K(20mg/ml),混匀,37℃保温1小时。 5、加30ul 5 mol/L NaCl,混匀。 6、加30ul CTAB/NaCl溶液,混匀,65℃保温20min
