第十一章 酚和醌

(一) 酚
一.酚的分类和命名
根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。根据羟基的数目,酚类又可分为一元酚、二元酚和多元酚等。
酚的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代基。例如:
1-萘酚 或 α-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚
2,4,6-三硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯三酚 1,2,3-苯三酚 (苦味酸) (均苯三酚) (连苯三酚)
二.酚的物理性质
常温下,除了少数烷基酚为液体外,大多数酚为固体。由于分子间可以形成氢键,因此酚的沸点都很高。邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔合,它们的沸点低于其间位和对位异构体。
纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。酚在常温下微溶于水,加热则溶解度增加。随着羟基数目增多,酚在水中的溶解度增大。酚能溶于乙醇、乙醚、苯等有机溶剂。
三.酚的化学性质
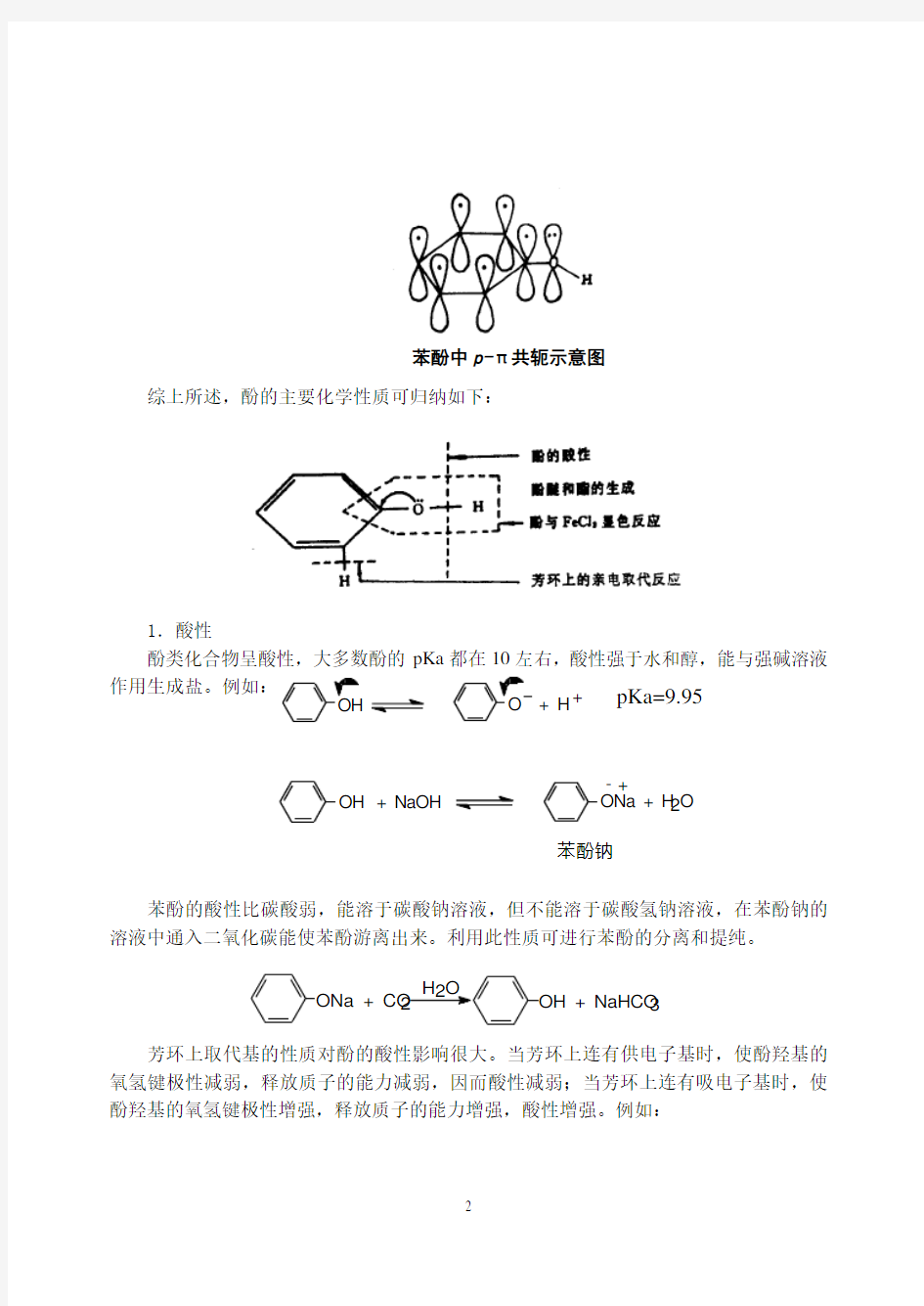
酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p 轨道与芳环的π轨道形成p —π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能像醇羟基那样发生亲核取代反应或消除反应。同时,酚羟基中氧原子的电子云密度降低致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。另外,由于酚羟基的给电子效应,使苯环上的电子云密度增加,芳环上的亲电取代反应更容易进行。
OH OH OH 2H 5
OH
Br
CH 3O
OH
OH
OH
NO 2
O 2N
2
SO 3H CH 3
HO
OH
HO
OH
苯酚中p-π共轭示意图
综上所述,酚的主要化学性质可归纳如下:
1.酸性
酚类化合物呈酸性,大多数酚的pKa 都在10左右,酸性强于水和醇,能与强碱溶液
苯酚的酸性比碳酸弱,能溶于碳酸钠溶液,但不能溶于碳酸氢钠溶液,在苯酚钠的溶液中通入二氧化碳能使苯酚游离出来。利用此性质可进行苯酚的分离和提纯。
芳环上取代基的性质对酚的酸性影响很大。当芳环上连有供电子基时,使酚羟基的氧氢键极性减弱,释放质子的能力减弱,因而酸性减弱;当芳环上连有吸电子基时,使酚羟基的氧氢键极性增强,释放质子的能力增强,酸性增强。例如:
OH + NaHCO 3
H 2O ONa + CO 2苯酚钠
+
-ONa + H 2O + NaOH
OH ++ H O OH
pKa=9.95
pKa 10.2 9.95 7.17 0.38
2.与三氯化铁的显色反应
酚与三氯化铁溶液作用生成有色的配合物:
6C 6H 5OH + FeCl 3 —→ [ Fe (C 6H 5O)6
] 3
+ 6H + + 3Cl ―
不同的酚与三氯化铁作用产生的颜色不同。除酚以外,凡具有稳定的烯醇式结构的化合物都可发生此反应。例如:
O OH COC 2H 5CH 3C = CH
由于分子内形成π-π共轭体系,且分子内以氢键连接成环,该烯醇式结构较为稳定,可与三氯化铁作用显色。因此,可利用此反应来鉴别酚类化合物和具有稳定烯醇式结构的化合物。
3.酚醚和酚酯的生成
由于酚羟基与苯环形成p-π共轭体系,酚不能直接进行分子间的脱水反应生成醚,也不能直接与羧酸反应生成酯。通常是用酚盐与卤代烃反应来制备醚,用酚与活性更高的酰卤或酸酐反应来制备酯。例如:
4.芳环上的取代反应
酚羟基对苯环既产生吸电子的诱导效应(―I ),又产生给电子的共轭效应(+C ),两者综合作用的结果使苯环上的电子云密度增加,使羟基的邻、对位活化,更容易发生芳环上的亲电取代反应。例如:
OH + (CH 32
O 3 + CH 3COOH
O O
ONa + C 2H 5
2CH 3 + Na I Cl Cl
ONa + Cl NO Cl Cl O NO 2 (除草醚)OH OH
OH
OH
NO 2
NO 2
2CH 3
O 2N
Br
Br
OH + 3Br 2()
2,4,6-三溴苯酚(白色)
苯酚与溴水的反应灵敏度高,一般溶液中苯酚含量达10mg/kg 即可检出,且反应是
定量的,所以常用于苯酚的定性和定量分析及饮用水的监测。
苯酚的硝化和磺化反应一般在室温下进行。例如:
2,4,6-三硝基苯酚(苦味酸)
33H
+ H 2SO 4 (浓OH
5.氧化反应 四.个别化合物 1.苯酚 2.甲苯酚 3.苯二酚 4.苯三酚
5.维生素E
*
第二节 醌
一.
醌的结构和命名
OH + HNO 3(稀)室温NO 2OH OH 2
+
OH + (浓) HNO 3 H SO (浓)OH NO 2
NO 2
2N
醌是一类特殊的环状不饱和二酮,分子中含有如下的醌型结构:
醌的结构中虽然存在碳碳双键和碳氧双键的π-π共轭体系。但不同于芳香环的环状闭合共轭体系,所以醌不属于芳香族化合物,也没有芳香性。
醌一般由芳香烃衍生物转变而来,命名时在“醌“字前加上芳基的名称,并标出羰基的位置。例如:
对苯醌(1,4-苯醌) 邻苯醌(1,2-苯醌) 1,4-萘醌 1,2-萘醌 黄色结晶 红色结晶 黄色结晶 橙黄色结晶
蒽醌 菲醌 淡黄色结晶 橙红色结晶
二.醌的物理性质
醌为结晶固体,都具有颜色,对位醌多呈黄色,邻位醌则常为红色或橙色。 对位醌具有刺激性气味,可随水蒸气汽化,邻位醌没有气味,不随水蒸气汽化。 三.醌的化学性质
醌分子中含有碳碳双键和碳氧双键的共轭体系,因此醌具有烯烃和羰基化合物的典型反应,能发生多种形式的加成反应。
1. 加成反应
(1)羰基的加成 醌分子中的羰基能与羰基试剂等加成。如对-苯醌和羟氨作用生成
单肟和二肟:
对苯醌单肟 对苯醌双肟
O O O
O
O O
O O
O
O
OH N OH
H N OH N OH OH
H 2N +O
(2)双键的加成 醌分子中的碳碳双键能和卤素、卤化氢等亲电试剂加成。如对-苯醌与氯气加成可得二氯或四氯化物。
2,3,5,6-四氯-1,4-环己二酮
(3)1,4-加成 由于碳-碳双键与碳-氧双键的共轭,所以醌可以发生1,4-加成
反应。如对苯醌与氯化氢加成后,生成对苯二酚的衍生物。
2. 还原反应
对苯醌容易被还原为对苯二酚(或称氢醌),这是对苯二酚氧化的逆反应。在电化学上,利用二者之间的氧化-还原性质可以制成氢醌电极,用来测定氢离子的浓度。
这一反应在生物化学过程中有重要的意义。生物体内进行的氧化还原作用常是以脱氢或加氢的方式进行的,在这一过程中,某些物质在酶的控制下所进行的氢的传递工作可通过酚醌氧化还原体系来实现。
四.自然界的醌
1.维生素K
*
2.泛醌*
第二节 醌
二. 醌的结构和命名
醌是一类特殊的环状不饱和二酮,分子中含有如下的醌型结构:
O
O HCl
重排OH OH Cl
O O OH OH 对苯醌
对苯二酚(氢醌)
O Cl Cl Cl Cl Cl 2O Cl Cl + Cl
O
醌的结构中虽然存在碳碳双键和碳氧双键的π-π共轭体系。但不同于芳香环的环状闭合共轭体系,所以醌不属于芳香族化合物,也没有芳香性。
醌一般由芳香烃衍生物转变而来,命名时在“醌“字前加上芳基的名称,并标出羰基的位置。例如:
对苯醌(1,4-苯醌) 邻苯醌(1,2-苯醌) 1,4-萘醌 1,2-萘醌 黄色结晶 红色结晶 黄色结晶 橙黄色结晶
蒽醌 菲醌 淡黄色结晶 橙红色结晶
二.醌的物理性质
醌为结晶固体,都具有颜色,对位醌多呈黄色,邻位醌则常为红色或橙色。 对位醌具有刺激性气味,可随水蒸气汽化,邻位醌没有气味,不随水蒸气汽化。 三.醌的化学性质
醌分子中含有碳碳双键和碳氧双键的共轭体系,因此醌具有烯烃和羰基化合物的典型反应,能发生多种形式的加成反应。
3. 加成反应
(1)羰基的加成 醌分子中的羰基能与羰基试剂等加成。如对-苯醌和羟氨作用生成
单肟和二肟:
对苯醌单肟 对苯醌双肟
(2)双键的加成 醌分子中的碳碳双键能和卤素、卤化氢等亲电试剂加成。如对-苯醌与氯气加成可得二氯或四氯化物。
O O O
O
O
O O
O O
O
O
OH N OH
H N OH N OH OH
H 2N +O
2,3,5,6-四氯-1,4-环己二酮
(3)1,4-加成 由于碳-碳双键与碳-氧双键的共轭,所以醌可以发生1,4-加成反应。如对苯醌与氯化氢加成后,生成对苯二酚的衍生物。
4. 还原反应
对苯醌容易被还原为对苯二酚(或称氢醌),这是对苯二酚氧化的逆反应。在电化学上,利用二者之间的氧化-还原性质可以制成氢醌电极,用来测定氢离子的浓度。
这一反应在生物化学过程中有重要的意义。生物体内进行的氧化还原作用常是以脱氢或加氢的方式进行的,在这一过程中,某些物质在酶的控制下所进行的氢的传递工作可通过酚醌氧化还原体系来实现。
四.自然界的醌
1.维生素K
*
2.泛醌*
三、醌
1.特征
① 凡醌类都具有颜色。 ② 醌式结构中不存在苯环。 2.性质
① 加成反应 a .羰基上的加成
O
O HCl
重排OH OH Cl O
O OH OH 对苯醌
对苯二酚(氢醌)
O
Cl Cl Cl Cl
Cl 2
O
Cl Cl + Cl O
b .烯键上的加成
c .双烯合成
d .1,4加成
② 还原
O O HO O NOH
NOH NOH
H 2O -H 2N-OH
H 2N-OH H O
-
单肟
二肟
O
O
O
O
Br 2
Br
2
O
O
Br Br
Br Br
-HBr
O
O
Br
O
O
Br
Br
-HBr
组成氧化还原偶对。
⒊制备:酚和苯胺的氧化。
O
O OH OH
第十一章 酚和醌
第十一章酚和醌一、用系统命名法命名下列化合物: 1.NO 2 OH CH3 OH 2 .3. OH CH3 CH3 4 . O2N OH 5 . C2H5 8 . OH 9 .HO OH OH10 . CH3 OH ) 11 . NO2 OH 12 .C C Cl O 5-硝基-1-萘酚2-氯-9,10-蒽醌 二、写出下列化合物的结构式:
1.对硝基苯酚 2,对氨基苯酚 3,2,4-二氯苯氧乙酸 Cl Cl NO 2OH NH 2 OH OCH 2COOH 4,2,4,6-三溴苯酚 5,邻羟基苯乙酮 6,邻羟基乙酰苯 OH OH Br Br Br COCH 3 OH COCH 3 7, 4-甲基-2,4- 8,1,4-萘醌- 9,2,6-蒽醌二磺酸 二叔丁基苯酚 -2-磺酸钠 OH CH 3 (CH 3)3C C(CH 3)3 O O O SO 3Na O SO 3H HSO 3 10.醌氢醌 11,2,2-(4,4‘ -二羟基 12,对苯醌单肟 苯基)丙烷 O O O H H OH C CH 3CH 3 HO O NOH 三、写出邻甲基苯酚与下列试剂作用的反应式:
4. CH 3 OH CH 3 O 2N OH 5.Na CH 3ONa 6. CH 3COCl CH 3 OCOCH 3 7.Cl 2 Cl OH CH 3 Cl 8. H 2SO 4 CH 3 OH 3H 9.(CH 3)2SO 4/NaOH CH 3 OCH 3 四、用化学方法区别下列化合物: O C H 3CH 3 OH CH 2OH
五、分离下列各组化合物: 1,苯和苯酚 解:加入氢氧化钠水溶液,分出苯,水相用盐酸酸化,分出苯酚2,环己醇中含有少量苯酚。 解:用氢氧化钠水溶液萃取,分出少量苯酚。 3,苯甲醚和对甲苯酚 解:用氢氧化钠水溶液处理,对甲苯酚溶于氢氧化钠水溶液,苯甲醚不溶分出,水相用盐酸酸化分出对甲苯酚。 4,β-萘酚和正辛醇 解:用氢氧化钠水溶液处理,β-萘酚溶于氢氧化钠水溶液,分出正辛醇,水相用盐酸酸化,分出β-萘酚。 六、比较下列各化合物的酸性强弱,并解释之。 OH OH OH NO2 NO2NO2 NO2 OH NO2 NO2 OH NO2 OH OH NO2 > > > 硝基是吸电子基团,具有-R,-I效应,但是硝基在间位吸电子的共轭效应不起作用。羟基上电子云密度越小,酸性越强。 七、如何能够证明邻羟基苯甲醇中含有一个酚羟基和一个醇羟基? 解:加入三氯化铁水溶液,有显色反应,说明具有酚羟基。加入三氯化磷能够发生反应,说明具有醇羟基。或者加入卢卡斯试剂,立即反应变浑,说明具有醇羟基。
有机化学课后答案第十一章 酚和醌
第十一章酚和醌 一、用系统命名法命名下列化合物: 间甲酚 4-乙基-1,3-苯二酚 2,3-二甲基苯酚 2,4,6-三硝基苯酚2-甲氧基苯酚 1-甲基-2-萘酚 4-羟基苯磺酸 9-蒽酚 1,2,3-苯三酚 5-甲基-2-异丙基苯酚 5-硝基-1-萘酚 2-氯-9,10-蒽醌 二、写出下列化合物的结构式: 1.对硝基苯酚 2,对氨基苯酚 3,2,4-二氯苯氧乙酸 4.2,4,6-三溴苯酚 5。邻羟基苯乙酮 6,邻羟基乙酰苯
7, 4-甲基-2,4- 8,1,4-萘醌- 9,2,6-蒽醌二磺酸二叔丁基苯酚-2-磺酸钠 10.醌氢醌 11,2,2-(4,4‘-二羟基 12,对苯醌单肟 苯基)丙烷 三、写出邻甲基苯酚与下列试剂作用的反应式:
四、用化学方法区别下列化合物: 五、分离下列各组化合物: 1,苯和苯酚 解:加入氢氧化钠水溶液,分出苯,水相用盐酸酸化,分出苯酚 2,环己醇中含有少量苯酚。 解:用氢氧化钠水溶液萃取,分出少量苯酚。 3,苯甲醚和对甲苯酚 解:用氢氧化钠水溶液处理,对甲苯酚溶于氢氧化钠水溶液,苯甲醚不溶分出,水相用盐酸酸化分出对甲苯酚。 4,β-萘酚和正辛醇 解:用氢氧化钠水溶液处理,β-萘酚溶于氢氧化钠水溶液,分出正辛醇,水相用盐酸酸化,分出β-萘酚。 六、比较下列各化合物的酸性强弱,并解释之。
硝基是吸电子基团,具有-R,-I效应,但是硝基的吸电子的效应对间位的影响比邻对位小。而羟基上电子云密度越小,酸性越强。七、如何能够证明邻羟基苯甲醇中含有一个酚羟基和一个醇羟基?解:加入三氯化铁水溶液,有显色反应,说明具有酚羟基。加入三氯化磷能够发生反应,说明具有醇羟基。或者加入卢卡斯试剂,立即反应变浑,说明具有醇羟基。 八、在下列化合物中,那些形成分子内氢键,那些形成分子间氢键? 1.对硝基苯酚 2.邻硝基苯酚 3.邻甲苯酚 4.邻氟苯酚 解:1.对硝基苯酚形成分子间氢键2.邻硝基苯酚形成分子内氢键3.邻甲苯酚形成分子间氢键 4.邻氟苯酚形成分子内氢键。 九、由苯或甲苯和必要的无机或有机试剂合成下列化合物: 1.间苯三酚 2.4-乙基-1-3-苯二酚 3.对亚硝基苯酚
酚和醌
第十一章 酚和醌 一、 用系统命名法命名下列化合物: 1. NO 2 OH CH 3 OH OH 2. 3. OH CH 3CH 3 4. O 2N OH NO 2 5. OH OCH 3 6. C 2H 5 CH 3 OH SO 3H HO 7. 8. OH 9. HO OH OH 10. CH 3 OH 3)2 11. NO 2 OH 12. C C Cl O 5-硝基-1-萘酚 2-氯-9,10-蒽醌 二、写出下列化合物的结构式: 1.对硝基苯酚 2,对氨基苯酚 3,2,4-二氯苯氧乙酸 Cl Cl NO 2OH NH 2 OH OCH 2COOH 4.2,4,6-三溴苯酚 5。邻羟基苯乙酮 6,邻羟基乙酰苯 OH OH Br Br Br COCH 3 OH COCH 3
7, 4-甲基-2,4- 8,1,4-萘醌- 9,2,6-蒽醌二磺酸 二叔丁基苯酚 -2-磺酸钠 OH CH 3 (CH 3)3C C(CH 3)3 O O O SO 3Na O SO 3H HSO 3 10.醌氢醌 11,2,2-(4,4‘ -二羟基 12,对苯醌单肟 苯基)丙烷 O O O H H OH CH 3CH 3 HO O NOH 三、写出邻甲基苯酚与下列试剂作用的反应式: 1. FeCl 3 CH 3 OH 6 + FeCl 3 Fe O (CH 3 )6] -3 2. Br 2aq OH Br Br CH 3 OH Br 2 CH 3 3.(CH 3CO)2O CH 3 OH (CH CO)O + OCOCH 3 CH 3 4.CH 3 OH CH 3 O 2N OH 5.Na CH 3ONa 6. CH 3COCl CH 3 OCOCH 3 7.Cl 2 Cl OH CH 3Cl 8. H 2SO 4 CH 3 OH 3H 9.(CH 3)2SO 4 /NaOH CH 3 OCH 3 稀硝酸
第十一章 酚和醌
(一) 酚 一.酚的分类和命名 根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。根据羟基的数目,酚类又可分为一元酚、二元酚和多元酚等。 酚的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代基。例如: 1-萘酚 或 α-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚 2,4,6-三硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯三酚 1,2,3-苯三酚 (苦味酸) (均苯三酚) (连苯三酚) 二.酚的物理性质 常温下,除了少数烷基酚为液体外,大多数酚为固体。由于分子间可以形成氢键,因此酚的沸点都很高。邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔合,它们的沸点低于其间位和对位异构体。 纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。酚在常温下微溶于水,加热则溶解度增加。随着羟基数目增多,酚在水中的溶解度增大。酚能溶于乙醇、乙醚、苯等有机溶剂。 三.酚的化学性质 酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p 轨道与芳环的π轨道形成p —π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能像醇羟基那样发生亲核取代反应或消除反应。同时,酚羟基中氧原子的电子云密度降低致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。另外,由于酚羟基的给电子效应,使苯环上的电子云密度增加,芳环上的亲电取代反应更容易进行。 OH OH OH 2H 5 OH Br CH 3O OH OH OH NO 2 O 2N 2 SO 3H CH 3 HO OH HO OH
第十一章
第十一章 微生物的进化、系统发育和分类鉴定 大约46亿年前,地球形成; 大约35亿年前,通过“前生命的化学进化”过程 地球上开始出现生命,主要是些类似简单杆状细菌的原始生物。 系统发育(phylogeny):各类生物进化的历史。 分类(classification):根据生物特性的特征的相似程度将其分群归类。 地球上的物种估计大约有150万,其中微生物超过10万种,而且其数目还在不断增加。 生物分类的二个基本原则: a ) 根据表型(phenetic)特征的相似程度分群归类,这种表型分类重在应用,不涉及生物进化 或不以反映生物亲缘关系为目标; b ) 按照生物系统发育相关性水平来分群归类,其目标是探寻各种生物之间的进化关系,建 立反映生物系统发育的分类系统。从进化论诞生以来,这一原则已经成生物学家普遍接受的分类原则 生物系统学(systematics)。 第一节 进化的测量指征 一、对生物类群间的亲缘关系进行判断的主要依据 七十年代以前:表型特征(形态结构、生理生化、行为习性等等)和少量的化石资料。 a )由于微生物可利用的形态特征少,很难把所有生物放在同一水平上进行比较; b )形态特征在不同类群中进化速度差异很大,仅根据形态推断进化关系往往不准确; 微生物的特点:形态小、结构简单、缺少有性繁殖,化石资料少。 七十年代后:蛋白质、DNA 和RNA 的结构特征 分子计时器(molecular chronometers) 进化钟(evolutionary clock) 进化(evolution):生物在与其生存环境相互作用过程中, 其遗传系统随时间发生一系列不可逆的改变,在大多 数情况下,导致生物表型改变和对生存环境的相对适应。
第十章 酚和醌_1
第10章 酚和醌 第一节 酚 一、 酚的结构及命名 1.结构 酚是羟基直接与芳环相连的化合物(羟基与芳环侧链的化合物为芳醇)。 2.命名 酚的命名一般是在酚字的前面加上芳环的名称作为母体,再加上其它取代基的名称和位次。特殊情况下也可以按次序规则把羟基看作取代基来命名。 二、 酚的物理性质和光谱性质(略) 三、酚的化学性质 羟基即是醇的官能团也是酚的官能团,因此酚与醇具有共性。但由于酚羟基连在苯环上,苯环与羟基的互相影响又赋予酚一些特有性质,所以酚与醇在性质上又存在着较大的差别。 1.酚羟基的反应 (1)酸性 O H O + H P K a 10≈(不能使石蕊试纸变色) 酚的酸性比醇强,但比碳酸弱。 P K a 17 C H 3CH 2O H H 2CO 3O H 10 6.5 故酚可溶于NaOH 但不溶于NaHCO 3,不能与Na 2CO 3、NaHCO 3作用放出CO 2,反之羟基通CO 2于酚钠水溶液中,酚即游离出来。
O H O N a O H O H + N aO H N aH C O 3N aC l ++ C O + H O O H N a 2C O 3 +X 利用醇、酚与NaOH 和NaHCO 3反应性的不同,可鉴别和分离酚和醇。 当苯环上连有吸电子基团时,酚的酸性增强;连有供电子基团时,酚的酸性减弱。 (2)与FeCl 3的显色反应 酚能与FeCl 3溶液发生显色反应,大多数酚能起此反应,故此反应可用来鉴定酚。 6A rO H + FeCl 3 [ Fe(O A r)6 ] 3-+ 6H + + 3Cl - 蓝紫色 棕红色 不同的酚与FeCl 3作用产生的颜色不同。与FeCl 3的显色反应并不限于酚,具有烯醇式结构的脂肪族化合物也有此反应。 (3)酚醚的生成 醚不能分子间脱水成醚,一般是由醚在碱性溶液中与烃基化剂作用生成。 O H O N a O C H 2R O C H 3O C H 2C H =C H 2+ N aB r + N aB r + N aB r 苯甲醚茴香醚苯基烯丙基醚 ( ) 在有机合成上常利用生成酚醚的方法来保护酚羟基。 (4)酚酯的生成 酚也可以生成酯,但比醇困难。 O H + C H 3C O O H +
11第十一章习题解答
第十一章 酚和醌 一、用系统命名法命名下列化合物: 1. 5 . 8. 11. NO 2 OH 12. C C Cl O O 5-硝基-1-萘酚 2-氯-9,10-蒽醌
二、写出下列化合物的结构式: 1.对硝基苯酚 2,对氨基苯酚 3,2,4-二氯苯氧乙酸 Cl Cl NO 2OH NH 2 OH OCH 2COOH 4.2,4,6-三溴苯酚 5。邻羟基苯乙酮 6,邻羟基乙酰苯 OH OH Br Br Br COCH 3 OH COCH 3 7, 4-甲基-2,4- 8,1,4-萘醌- 9,2,6-蒽醌二磺酸 二叔丁基苯酚 -2-磺酸钠 OH CH 3 (CH 3)3C C(CH 3)3 O O O SO 3Na O SO 3H HSO 3 10.醌氢醌 11,2,2-(4,4‘ -二羟基 12,对苯醌单肟 苯基)丙烷 O O O H H OH C CH 3CH 3 HO O NOH 三、写出邻甲基苯酚与下列试剂作用的反应式:
1.FeCl3CH 3 OH 6+FeCl3 Fe O ( CH3 )6]-3 2.Br 2 aq OH Br Br CH3 OH Br2 CH3 3.(CH 3 CO)2O CH3 OH (CH CO)O + OCOCH3 CH3 4. 3 CH3 O2N OH 5.Na CH3 ONa 6 .CH 3 COCl CH3 OCOCH3 7 .Cl 2 Cl OH CH3 Cl 8. H2SO4 CH3 OH SO3H 9 .(CH 3 )2SO4/NaOH CH3 OCH3 四、用化学方法区别下列化合物:
第十一章 酚和醌
第十一章 酚和醌 1. 比较下列化合物的酸性大小:( ) OH NO 2 OH NO 2 NO 2 NO 2 OH a b c OH d 解答:d>c>a>b 。苯酚具有弱酸性,当苯酚邻对位上有强吸电子基-NO 2时,由于硝基的 吸电子共轭效应,酚羟基的氢更易离解,其酸性增强;吸电子基越多,酸性越强;当-NO 2在间位时,只有吸电子诱导效应,所以a 的酸性弱于c 。 2. 解释下列现象: (1)酚中的C-O 键长比醇中的C-O 键长短。 (2) O H O H (104℃) 熔点比OH (172℃)的小许多。 解答:(1)酚中的氧原子直接连在sp 2杂化C 上,氧的杂化状态也为sp 2杂化,为平面 结构,因此氧上的孤对电子就能与苯环Π电子发生p -Π共轭,使C-O 键具有部分双键特性。另外sp 2杂化的氧s 电子云成分比sp 3要高,所以sp 2电子云距原子核更近。而醇中的C-O 键的形成是由C-sp 3杂化轨道与O-sp 3杂化轨道头对头重叠而成,所以形成σ单键键长比C sp 2—O sp 2键长要长些。 此题关键是要了解氧原子与不同杂化碳成键时氧的杂化状态也不同,由此引起不同的电子效应,使得分子中化学键的性质亦有所不同。结构决定化合物的性质。弄清化合物结构能帮助了解化合物的性质。 (2)分别形成分子内氢键、分子间氢键 3. 用简便化学法分离 A :α-萘酚和B :α-甲基萘的混合物。 解答:酚有弱酸性,可溶于氢氧化钠,利用此性质将二者分离 22-甲基萘) 减压 减压蒸馏 A B B A 4. 一个学生试图从邻甲基苯酚按下面路线合成邻甲氧基苯甲醇,但几乎没有收率,这条路线错在哪里? OH CH 3 OH COOH OCH 3 COOCH 3 OCH 3CH 2OH Na CrO 222+, 解答:错误在第一步。由于酚在强氧化剂作用下也非常容易被氧化。将反应路线稍加改 进,即可得预计产物。先保护酚羟基成醚,因为醚键对氧化剂、还原剂、碱有特
