2018高考一轮复习离子反应与离子共存导学案

非电解质 大多数有机化合物:甲烷CH 4、蔗糖C 12H 22O 11、酒精C 2H 5OH 、
甲醇CH 3OH 等 其它:CO 、CO 2、SO 2、SO 3、NH 3等
2018高考一轮复习 离子反应与离子方程式
一、电解质和非电解质
1.电解质:在水溶液里或熔融状态下能够 。
注意:
(1) 电解质是化合物,化合物本身含有离子或在水中能够电离出离子,这是电解质导电的内因,溶于水或熔化
是导电的外因。通电后离子定向移动,在电极上发生氧化还原反应是导电的过程和实质。
(2) 对于一些难溶物(如BaSO 4)由于溶解度太小,很难测出溶液的导电性,但将BaSO 4熔化成液态时,能电离
出自由移动的离子(Ba 2+
、SO 42-
),所以能导电,它们是难溶的电解质。
(3) 离子型氧化物,如Na 2O 、CaO 等,虽然它们溶于水后电离出离子不是自身电离的,但熔化时,它们可自身
电离且能导电,故属于电解质。
(4) 电解质是化合物,而电解质溶液是混合物。HCl 是电解质,而盐酸是电解质溶液;NH 3·H 2O 是电解质,NH 3
是非电解质,而氨水是电解质溶液。
●思考1:Fe 、Cu 等金属以及石墨能导电,它们是电解质吗
2.非电解质:在水溶液里和熔融状态下
。
注意:
(1) 非电解质也是化合物,但化合物本身不含离子且不能电离出离子
(2) 有些物质其水溶液虽能导电,但它们并非电解质。如SO 2、SO 3、NH 3溶于水均能导电,但并非它们本身能电
离出自由离子,而是它们与水反应的生成物H 2SO 3、H 2SO 4、NH 3·H 2O 能电离出里离子而导电,所以SO 2、SO 3、NH 3不是电解质。同时,上述物质在熔融状态时也不能导电,故SO 2、SO 3、NH 3为非电解质,而H 2SO 3、H 2SO 4、NH 3·H 2O 是电解质。
●思考2:O 2、Cl 2、H 2、N 2是不是非电解质
结论:单质(Fe 、Cu 、O 2、Cl 2等)既
电解质,也 非电解质。
电解质 酸:HCl 、HNO 3、H 2SO 4、H 2CO 3、H 2SO 3、CH 3COOH 等 碱:NaOH 、KOH 、、NH 3·H 2O 、Cu(OH)2等 盐:NaCl 、、CaCO 3、BaSO 4、AgCl 等
活泼金属的氧化物:Na 2O 、CaO 、MgO 、Al 2O 3等
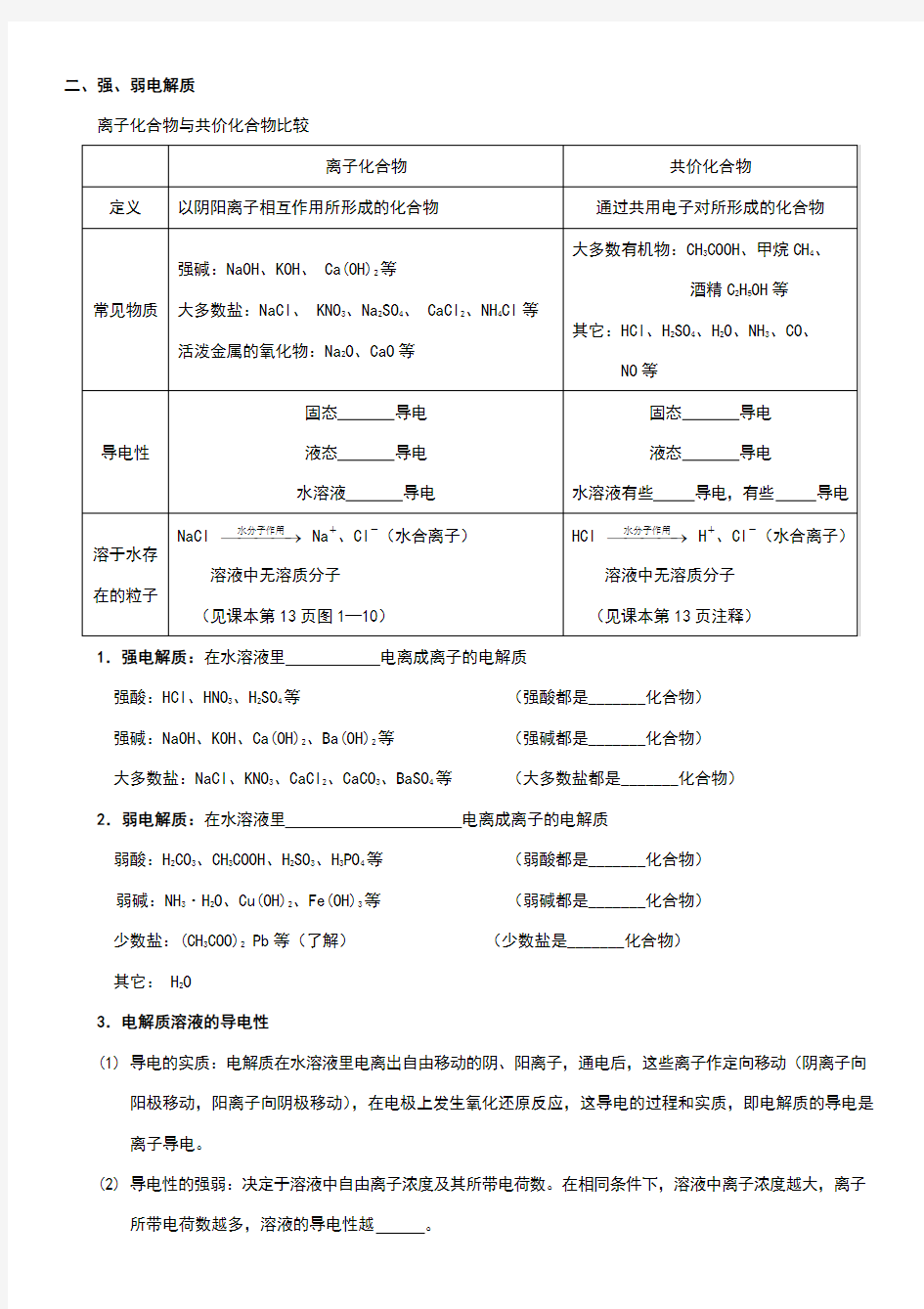
二、强、弱电解质
离子化合物与共价化合物比较
1.强电解质:在水溶液里电离成离子的电解质
强酸:HCl、HNO3、H2SO4等(强酸都是_______化合物)
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2等(强碱都是_______化合物)
大多数盐:NaCl、KNO3、CaCl2、CaCO3、BaSO4等(大多数盐都是_______化合物)
2.弱电解质:在水溶液里电离成离子的电解质
弱酸:H2CO3、CH3COOH、H2SO3、H3PO4等(弱酸都是_______化合物)
弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等(弱碱都是_______化合物)
少数盐:(CH3COO)2 Pb等(了解)(少数盐是_______化合物)
其它: H2O
3.电解质溶液的导电性
(1) 导电的实质:电解质在水溶液里电离出自由移动的阴、阳离子,通电后,这些离子作定向移动(阴离子向
阳极移动,阳离子向阴极移动),在电极上发生氧化还原反应,这导电的过程和实质,即电解质的导电是离子导电。
(2) 导电性的强弱:决定于溶液中自由离子浓度及其所带电荷数。在相同条件下,溶液中离子浓度越大,离子
所带电荷数越多,溶液的导电性越。
I.浓度对导电性的影响:同一种电解质溶液,浓度越大,其导电性。
II.电荷数对导电性影响:不同的强电解质溶液浓度相同时,离子所带电荷数越高,其导电性__________。
电荷浓度=离子浓度×离子所带电荷数
练习:(2)下列说法正确的是。
①导电性强的溶液不一定是强电解质溶液
②导电性弱的溶液一定是弱电解质溶液
③强电解质溶液的导电性一定强
④在相同条件下(相同温度和浓度),强电解质溶液的导电性一定比弱电解质溶液强
结论:溶液导电性强弱与电解质强弱必然联系(填“有”或“没有”)。
(3) 电荷守恒:在电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数相等,电性相反,故电解质
溶液显电中性,称电荷守恒。
某溶液中只含有Al3+、Na+、Cl-、SO42-四种离子,已知Al3+、Na+、Cl-的个数之比为3:2:1。则溶液中Al3+和SO42-离子的个数比为。
三、电解质的电离方程式
1.强电解质(可溶性)
电离方程式的书写原则:
(1)强电解质在水中全部电离,用符号“=”表示
(2)强电解质拆成阳离子和阴离子,原子团不能拆,在符号右上角标明电荷数n+、n–
(3)遵循电荷守恒、质量守恒
HCl = H++ Cl-HNO3 = H++ NO3-
H2SO4 = 2H++ SO42-NaOH = Na++ OH-
Ba(OH)2 =Ba2++ 2OH-KNO3 = K++ NO3-
CaCl2 = Ca2++ 2Cl-Fe2(SO4)3 = 2Fe3++ 3SO42-
2.弱电解质
电离方程式的书写原则:
(1)弱电解质在水中部分电离(难电离),用可逆符号“?”表示
(2)弱电解质拆成阳离子和阴离子部分,原子团不能拆,在符号右上标明电荷数n+、n–
(3)遵循电荷守恒、质量守恒
(4)多元弱酸应分步写
CH3COOH?CH3COO-+ H+NH3·H2O?NH4++ OH-
H2CO3?H++ HCO3-(第一步电离)HCO3-?H++ CO32-(第二步电离)例3写出下列物质在水溶液中的电离方程式
①KOH——②Na2SO4——
③Al2(SO4)3——④NaHSO4——
⑤NaHCO3——
四、离子反应和离子方程式
1.离子反应:有离子参加或生成的反应。
由于电解质溶于水后电离成离子,所以,电解质在溶液里所起的反应实质上是离子之间的反应。
编号I II III
实验
现象
没有明显变化,溶液仍为
蓝色有白色沉淀生成,滤液为
蓝色
有白色沉淀生成,滴加稀
硝酸,沉淀不溶解
化学方程式
实质
2.离子方程式
(1)定义:用实际参加反应的离子符号表示离子反应的式子。
课堂强化练习1:
正误判断,正确的打“√”,错误的打“×”
(1)NH3、SO2的水溶液均导电,所以NH3、SO2均属于电解质( )
(2)强电解质饱和溶液一定比弱电解质饱和溶液的导电性强( )
(3)NaCl溶液能导电,故NaCl溶液为电解质( )
(4)Fe、Cu、Ag熔化能导电,故Fe、Cu、Ag为电解质( )
(5)H2S溶于水的电离方程式为H2S H++HS-,HS-H++S2-( )
(6)硫酸氢钠溶于水的电离方程式为NaHSO4Na++H++SO2-4( )
课堂强化练习2:
完成下列化学方程式,并改写成离子方程式。 ① CuSO 4 + Ba(OH)2——
② CH 3COOH + KOH ——
③ HCl + Ba(OH)2——
④ CO 2 + NaOH ——
⑤ Fe+ CuSO 4——
⑥ 3Cu +8HNO 3==3 Cu(NO 3)2+2 NO ↑+4H 2O
* ⑦ NaOH + NH 4Cl ——
* ⑧ NaHCO 3 + HNO 3——
* ⑨ NaHCO 3 + NaOH ——
* ⑩ KOH + KHSO 4—— 总结:
3242232423334232323223343223HCl HNO H SO NaOH KOH Ba(OH)Ca(OH)NaCl KNO K SO Na CO CH COOH H PO H CO H SO H S HF NH H O Cu(OH)Fe(OH)CaCO BaSO AgCl BaCO CO SO SO CuO M ???
????g 强酸:、、等拆成离子强碱:、、、等
可溶性盐:、、、等
弱酸:、、、、、等弱碱:、、等
难溶盐:、、、等写化学式氧化物:、、、、2322232222gO Fe O Na O CO SO NH Cl Fe Al Br I H O ??
??
???
??
??
????、、等
气体: 、、等单质:、、、、等其它:
课堂强化练习3:
1.写出教材中常考的下列10个反应的离子方程式
(1)钠与水反应:________________________________。
(2)氯气通入水中:______________________________。
(3)实验室用MnO2与浓盐酸制取Cl2:_____________。
(4)向氢氧化钠溶液中通入少量CO2:______________。
(5)铝片投入氢氧化钠溶液:______________________。
(6)氯化铝溶液中加足量碳酸氢钠溶液:____________。
(7)碳酸钙中滴入醋酸溶液:______________________。
(8)NO2溶于水:________________________________。
(9)将铜加入稀硝酸溶液中:______________________。
(10)FeCl3溶液与Cu反应:_______________________。
课堂强化练习4:
2.写出高考题中下列10个高频离子方程式
(1)硫酸氢钠加入到Ba(OH)2溶液中至溶液呈中性:____________________________。
(2)碳酸氢钠溶液与少量石灰水反应:_______________。
(3)用氨水吸收足量的SO2:______________________。
(4)向明矾溶液中滴加Ba(OH)2溶液,使SO2-4全部沉淀,____________________。
(5)Ca(HCO3)2溶液与少量NaOH溶液反应:______________________________________________。
(6) mol·L-1 NH4Al(SO4)2溶液与 mol·L-1 Ba(OH)2溶液等体积混合:_____________________。
(7)稀硝酸中加入过量铁粉并加热:____________。
(8)向NaAlO2溶液中通入过量CO2:_____________。
(9)NH4HCO3溶于过量的NaOH溶液中并加热:_______。
(10)向一定量的FeBr2溶液中通入①少量Cl2,②过量Cl2,③等量Cl2,分别写出反应的离子方程式。
①_____________________________________________。
②_____________________________________________。
③____________________________________________
课堂强化练习5:
请订正下面的错误。
(1)硫在足量氧气中燃烧:2S +3O 2===2SO 3。____________________________________。
(2)AlCl 3溶液呈酸性的原因:Al 3+
+3H 2O===Al(OH)3↓+3H +
。__________________________________。 (3)NaOH 溶液与稀硫酸反应的离子方程式:2H +
+2OH -
===2H 2O 。_____________________________________。 (4)工业合成氨反应:N 2+3H 2――→高温
2NH 3。________________________________________________。 (5)工业上用氧化铝为原料制备金属铝:2Al 2O 3=====高温冰晶石4Al +3O 2↑。 (6)NH 4Cl 溶液和NaOH 溶液加热反应:NH +
4+OH
-NH 3·H 2O 。_______________________________________。
(7)钢铁吸氧腐蚀,正极的电极反应:O 2+2H 2O===4OH -
+4e -
。____________________________________。 (8)实验室制取氯气的离子方程式:MnO 2+4HCl===MnCl 2+Cl 2↑+2H 2O 。_______________________________。
(9)铜与浓硝酸反应:Cu +4HNO 3=====△
Cu(NO 3)2+2NO 2↑+2H 2O 。_____________________________________。 (10)1 g 肼气体燃烧生成氮气和水蒸气,放出热量 kJ 。热化学方程式:N 2H 4+O 2===N 2+2H 2O ΔH =+ kJ 。 (11)用惰性电极电解硫酸铜溶液的离子方程式:2Cu 2+
+4OH -
===2Cu +O 2↑+2H 2O 。 (12)Ba(OH)2溶液与稀硫酸反应的离子方程式:Ba 2+
+OH -
+H +
+SO 2-
4===BaSO 4↓+H 2O 。 (13)铝—海水电池的负极反应式:Al -3e -
+4OH -
===AlO -
2+2H 2O 。 (14)碳酸氢钠在水中电离:NaHCO 3Na ++H ++CO 2-
3。 (15)HCO -
3的水解方程式:HCO -
3+H 2O
H 3O +
+CO 2-
3。
(16)NaHSO 4熔化时电离方程式:NaHSO 4===Na +
+H +
+SO 2-
4 (17)NH 4Cl 溶液呈酸性的原因:NH +
4+H 2O
NH 4OH +H +
。
(18)铜与浓硫酸反应:Cu +2H 2SO 4=====△
CuSO 4+SO 2↑+2H 2O 。
(19)NH 4Cl 固体和消石灰加热制NH 3:2NH 4Cl +Ca(OH)2=====△
CaCl 2+2NH 3↑+H 2O 。 (20)实验室制Cl 2:4HCl(浓)+MnO 2===MnCl 2+Cl 2↑+2H 2O 。
3.离子方程式的意义
不仅表示一定物质间的某个反应,而且表示所有 的离子反应 酸碱中和反应
化学方程式
离子方程式
酸碱中
和反应 HCl + NaOH ——
HNO 3 + Ba(OH)2——
●思考7: H2SO4与Ba(OH)2反应能否用H++ OH-= H2O表示为什么
(1)Ag++ Cl-=AgCl↓可表示AgNO3溶液与盐酸、可溶性盐酸盐反应的离子反应,
(2)Ba2++ SO42-= BaSO4↓可表示,
(3)Ca2++ CO32-= CaCO3↓可表示。
五、离子反应类型及其反应条件
1.复分解型的离子反应(离子互换反应)
发生的条件:有①(以沉淀形式析出)或②(以气体形式逸出)或③(主要以弱电解质分子形式存于溶液中)生成。
发生的实质:离子互换反应是一场“离子争夺战”,这类反应的特点就是向着降低某些离子浓度或数目的方向进行,生成沉淀或气体或难电离物。
(1)生成难溶物
Fe2(SO4)3 + NaOH——
AgNO3 + HCl——
CaCl2 + Na2CO3——
CuSO4 + Ba(OH)2——
(2)生成易挥发性物质(CO2、SO2、H2S、NH3)
CaCO3 + HCl——
NaHCO3 + HCl——
NH4Cl + NaOH——
(3)生成难电离的物质
H 2SO 4 + NaOH ——
CH 3COONa + H 2SO 4——
NH 4Cl + NaOH ——
反应条件:强氧化性离子跟强还原性离子间易发生反应(强→弱) 反应实质:氧化还原的离子反应是一场“电子争夺战” +3+
2234222Fe +H H S +Fe SO MnO SO +Cl +H O ??
???????--原子与离子(——)分子与离子(——)
电子转移发生离子与离子(+?—)分子与分子(——)
(1)Zn + H 2SO 4=ZnSO 4+ H 2↑ (2)Cu +2 AgNO 3=Cu(NO 3) 2+2 Ag
(3)MnO 2 + 4HCl(浓)
MnCl 2+ Cl 2↑+2 H 2O
(4)Cl 2 + 2NaOH = NaCl + NaClO + H 2O (5)2FeCl 3 + H 2S = 2FeCl 2 + S ↓+ 2HCl
六.书写离子方程式的注意事项(将化学方程式改写成离子方程式)
1.离子反应一般是在水溶液中进行的,因此,凡不是在水溶液中进行的反应一般不能写成离子方程式。
2NH 4Cl(固) + Ca(OH)2(固)CaCl 2 + 2NH 3↑+ 2H 2O
2. 酸式根离子
(1)弱酸酸式盐中的酸式根离子在离子方程式不能折开写,如NaHCO 3。
NaHCO 3 + HCl = NaCl + CO 2↑+ H 2O
△
△
(2)强酸酸式盐中的酸式根离子在离子方程式中须拆开写,如NaHSO4。
KOH + KHSO4 = K2SO4 + H2O _______________________________ NaHCO3 + NaHSO4 = Na2SO4 + CO2↑+ H2O
3.对生成物为易溶于水的氨气(NH3)
(1)反应物浓度大,且加热,产物写NH3。
NH4Cl+ NaOH NaCl + NH3↑+ H2O
△
(2)反应物浓度小,不加热,产物写NH3·H2O。
NH4Cl + NaOH = NaCl + NH3·H2O
4.微溶物处理有三种情况
(1)生成物中有微溶物析出时,微溶物仍用化学式表示。
Na2SO4 + 2AgNO3 = Ag2SO4↓+ NaNO3
CaCl2 + 2NaOH = Cu(OH)2↓+ 2NaCl
(2)当反应物中的微溶物处于溶液状态(稀溶液),微溶物拆成离子形式。
在澄清石灰水中通入CO2气体:
CO2 + Ca(OH)2 = CaCO3↓+ H2O
澄清石灰水与硝酸反应:
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
(3)当反应物中的微溶物处于浊液或固体时,微溶物须写成化学式。
在石灰乳(悬浊液)中加入纯碱溶液以制备烧碱:
Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH 5.反应物的用量不同(先写化学反应方程式,然后再改写成离子方程式)
(1)CO2与碱溶液反应。
在NaOH溶液中通入少量CO2
,
在NaOH溶液中通入过量CO2
,
(2)酸式盐与碱的反应。
①在NaHCO3溶液中加入少量Ca(OH)2溶液
,
在NaHCO3溶液中加入过量Ca(OH)2溶液
,
③在Ca(HCO3)2溶液中加入少量NaOH溶液
,
在Ca(HCO3)2溶液中加入过量NaOH溶液
,
④向NaHSO4溶液中滴入Ba(OH)2溶液至中性(H+与OH-恰好反应)
,
向NaHSO4溶液中滴入Ba(OH)2溶液至恰好沉淀完全(SO42-与Ba2+恰好沉淀完全)
,
七、离子反应方程式正误判断
1.看离子反应是否符合客观事实
Cu + HCl——(×)Cu + 2H+= Cu2++ H2↑(×)
Fe + HCl——2Fe + 6H+= 2Fe3++ 3H2↑(×)2.看物质化学式的拆分是否正确
CH3COOH + NaHCO3——H++ HCO3-= CO2↑+ H2O (×)
CaCO3 + HCl——CO32-+ 2H+= CO2↑+ H2O (×)3.看是否遵循守恒(质量、电荷守恒)
Cu + AgNO3——Cu + Ag+= Cu2++ Ag (×)
FeCl3 + Fe——Fe3++ Fe = 2Fe2+(×)
4.看是否漏掉离子
(NH4)2SO4 + Ba(OH)2——SO42-+ Ba2+= BaSO4↓(×)
5.看是否遵循定组成原理
H2SO4 + Ba(OH)2—— H++ SO42-+ Ba2++ OH-= BaSO4↓+ H2O(×)
6.遵循得失电子守恒
H2S + Fe3+——H2S + Fe3+ = Fe2+ + S↓+ 2H+(×)
7.看是否忽略隐含条件
NaOH + CO2(过量)——2OH- + CO2 = CO32- + H2O(×)
八、离子共存
NH 4+以及除K +、Ba 2+、Na +
以外的金属离子
弱酸酸式根离子:HCO 3-
、HSO 32-
、HS -
、H 2PO 4-
、HPO 42-
等 H +
大量共存:离子之间不发生任何反应,这些离子在同一溶液中可大量共存 不能大量共存:离子之间能发生反应,这些离子在同一溶液中不能大量共存 1.看离子间能否发生复分解反应
(1)离子生成难溶物(沉淀)——不能大量共存 (2)生成易挥发性物质(气体)——不能大量共存
(3)生成难电离物质(弱酸、弱碱、H 2O )——不能大量共存 2.看离子间能否发生氧化还原反应(现在只作了解)
一般地说典型的氧化性离子(MnO 42-
、Fe 3+
、ClO -
等)和典型还原性离子(如Fe 2+
、S 2-
、I -
、SO 32-
)在同一溶液(特别是酸性溶液)中易发生氧化还原反应而不能大量共存。
MnO 4-
+ 5Fe 2+
+ 8H +
= Mn 2+
+ 5Fe 3+
+ 4H 2O 3.附加隐蔽条件的离子共存问题
(1)溶液无色透明时,则溶液中肯定没有有色离子。
Cu 2+
(蓝色)、Fe 3+
(黄色)、Fe 2+
(浅绿)、MnO 4-
(紫红) (2)在强酸性(如:pH = 1)溶液中,肯定不存在与H +
起反应的离子
H +
与
(3)在强碱性(如:pH =13)溶液中,肯定不存在与OH -
起反应的离子
OH -
与
结论:弱酸酸式根离子HCO 3-
、HSO 3-
、HS -
、H 2PO 4-
、HPO 42-
与OH -
或H +
都不能大量共存。
在强酸性无色透明的溶液中,能大量共存的离子组_____________。 A .Cu 2+
、Na +
、NO 3-
、Cl -
B .Al 3+、Ba 2+、Cl -
、NO 3-
C .Na +
、K +
、HCO 3-
、Cl -
D .K +
、Na +
、SO 42-
、MnO 4
-
E .NH 4+
、Na +
、NO 3-
、CH 3COO -
F .K +
、Ba 2+
、OH -
、SO 42-
G .Fe 3+
、Zn 2+
、SO 42-
、NO 3-
H .Mg 2+
、K +
、SO 42-
、Cl -
I .Na +
、Ba 2+
、CO 32-
、NO 3
-
常见离子共存情况剖析
弱酸根离子:CO 32-、SO 32-、S 2-、F -、ClO -、NO 2-、PO 43-、CH 3COO -
等
弱酸酸式根离子:HCO 3-
、HSO 3-
、HS -
、H 2PO 4-
、HPO 42-
等
OH -
3.指出下列离子方程式错误的原因
4.完成下列离子方程式:
(1)钠与水反应:_________________________________________________________________。
(2)氯气通入水中:_______________________________________________________________。
(3)向氢氧化钠溶液中通入少量CO2:_________________________________________。
(4)碳酸钙中滴入醋酸溶液:_______________________________________________________。
(5)铝片投入氢氧化钠溶液:______________________________________________________。
(6)氯化铝溶液中加足量碳酸氢钠溶液:____________________________________________。
(7)FeCl3溶液与Cu反应:_______________________________________________________。
(8)酸性硫酸亚铁溶液中加入过氧化氢溶液:___________________________________。
(9)实验室用MnO2与浓盐酸制取Cl2:____________________________________________。
(10)NO2溶于水:_______________________________________________________________。
高考题型离子反应的条件——离子共存的判断1.(2015·广东理综,8)水溶液中能大量共存的一组离子是( )
A.NH+4、Ba2+、Br-、CO2-3 B.Cl-、SO2-3、Fe2+、H+
C. K+、Na+、SO2-4、MnO-4 D.Na+、H+、NO-3、HCO-3
2.(高考选项组合题)下列有关的叙述正确的是( )
A.NaClO和NaCl混合溶液中,H+、NH+4、SO2-4、Br-可以大量共存(2015·安徽理综,10A) B.NaClO和NaCl混合溶液中,Ag+、K+、NO-3、CH3CHO可以大量共存(2015·安徽理综,10B) C.CuSO4溶液中Na+、NH+4、NO-3、Mg2+可以大量共存(2015·四川理综,2A)
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO2-4(2014·山东理综,12D) 3.(2015·江苏,6)常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO2-4、Cl-
=1×10-13 mol·L-1的溶液中:NH+4、Ca2+、Cl-、NO-3
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO-3、SO2-4
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO-2、CO2-3
1.下列离子能在溶液中大量共存的是( )
A.Na+、NH+4、Br-、HCO-3 B.Fe2+、H+、NO-3、Cl-
C.Al3+、Ca2+、HCO-3、SO2-4 D.Fe3+、Cu2+、NO-3、OH-
2.水溶液中能大量共存的一组离子是( )
A.Fe3+、Cl-、I-、Na+B.NH+4、Al3+、NO-3、Cl-
C.Ca2+、K+、Cl-、CO2-3D.K+、H+、F-、SO2-4
3.常温下,下列各组离子能大量共存的是( )
A.Pb2+、K+、NO-3、SO2-4 B.Fe3+、NH+4、S2-、NO-3
C.Fe2+、Na+、Cl-、NO-3 D.H+、Cl-、SO2-4、AlO-2
考向2 有限制条件的离子共存判断
4.已知某强酸性溶液中存在较多的Ba2+、NO-3,则该溶液中还可能大量存在的离子组是( ) A.K+、NH+4、HCO-3B.Fe2+、Ca2+、Cl-
C.Cu2+、Mg2+、SO2-4D.Na+、Cu2+、Cl-
5.下列离子在指定的溶液中能大量共存的一组是( )
A.加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO-3
B.pH=12的无色透明溶液中:Mg2+、SO2-4、NO-3、K+
C.无色透明溶液中:SO2-4、NO-3、Na+、Fe3+
D.澄清透明溶液中:Cu2+、SO2-4、K+、Br-
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.高锰酸钾溶液:H+、Na+、SO2-4、葡萄糖分子
B. mol·L-1 NaOH溶液:K+、Na+、S2-、SO2-3
C. mol·L-1 Na2CO3溶液:K+、Ba2+、NO-3、Cl-
D. mol·L-1 Na2S溶液:SO2-4、K+、Cl-、Cu2+
7.常温下,下列各组离子或分子在指定溶液中可能大量共存的是( ) A.pH=7的溶液:Fe3+、NH+4、Cl-、NO-3
B.水电离出的c(H+)=K w的溶液中:Na+、SO2-4、CO2-3、K+
C.由水电离出的c(OH-)=×10-2 mol·L-1的溶液:Cl-、CH3COO-、K+、AlO-2=1012的溶液中,NH+4、Al3+、NO-3、Cl-
高考化学专题复习离子共存习题以及答案
高考化学专题复习:离子共存 1.某无色透明 ....的溶液,在pH=0和pH=14的条件下都能大量共存的是() A.Fe2+、K+、SO42-、NO3-B.Mg2+、NH4+、SO42-、Cl- C.Na+、K+、SO42-、NO3-D.Ba2+、Na+、MnO4-、SO42- 2.下列澄清 ..的溶液中,可能大量共存的离子组是 ..透明 A.[Ag(NH3)2]+、K+、OH-、NO3-B.Fe3+、NH4+、Cl-、I- C.H+、Al3+、SO42-、F-D.NH4+、Na+、Cu2+、Cl- 3.下列离子在溶液中因发生氧化还原反应而不能大量共存的是() A.H3O+、NO3-、Fe2+、Na+B.Ag+、NO3-、Cl-、K+ C.K+、Ba2+、OH-、SO42-D.Cu2+、NH4+、Br-、OH- 4.某溶液中加入铝粉有氢气产生,该溶液中一定可以大量共存的离子组是() A.Na+、NO3-、Cl-、SO42-B.Na+、K+、Ba2+、HCO3- C.Fe3+、H+、SO42-、Cl-D.Na+、K+、Cl-、SO42- 5.常温下,由水电离生成的c(H+)=10-12 mol·L-1的某溶液中,一定不能大量共存的离子组是()A.Na+、Fe3+、NO3-、SO42-B.K+、AlO2-、CO32-、Cl- C.Na+、K+、Cl-、HSO3-D.Na+、CH3COO-、C6H5O-、OH- 6.在室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为 A.HCO3-、Al3+、Na+、SO42-B.I-、NO3-、K+、NH4+ C.Cu2+、Cl-、SO42-、K+D.SiO32-、SO32-、Na+、Cl- 7.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是 A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、SO32-、S2- C.K+、Na+、AlO2-、SO42-D.Ba2+、Fe2+、NO3-、Br- 8.下列各组离子在碱性条件下可以大量共存,而在强酸性条件下不能大量其存的是A.Ca2+、Fe3+、NO3-、Cl-B.K+、Mg2+、HCO3-、SO42- C.Na+、K+、S2-、SO32-D.Ba2+、Na+、I一、NO3- 9.下列各组离子一定能大量共存的是() A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN— B.在强碱溶液中:Na+、K+、AlO2—、CO32— C.在c(H+)=10—13 mol/L的溶液中:NH4+、Al3+、SO42—、NO3— D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
(完整)高中化学离子共存
高中化学离子共存及除杂 一、离子共存知识梳理: (一)判断原理:物质与物质之间若能发生氧化还原反应、复分解反应(常见为酸碱盐的反应)或者络合反应都不能共存。 (二)常见酸和酸根:首先了解高中阶段常见强酸:HCl、HNO3、H2SO4、HBr、HI、HClO4、HIO3其他的大多为弱酸,要特别注意有机酸和酚类大多为弱酸,例如甲酸,乙酸,草酸等。 多元弱酸的酸式盐所对应的阴离子 如HCO3-、HSO3-、H2PO4-、HPO42-等 这些离子都是与氢离子反应成酸,与碱反应成正盐。 弱酸的酸根:即弱酸的阴离子或对应正盐阴离子 如:CO32-、SO32-、PO43-、CH3COO-等都容易与氢离子反应。 (三)氧化还原 常见氧化剂强弱顺序:F2>Cl2>Br2>Fe3+>I2>SO2>S 高锰酸钾溶液的酸性越强,氧化性越强。 常见还原性强弱顺序:S2->SO3(2-)>I->Fe2+>Br->Cl->F- 常见的氧化剂有:活泼的金属单质,如X2(卤素)、O2、O3、S等 高价金属阳离子,如Cu2+,Fe3+等或H+ 高价过较高价含氧化合物,如MnO2、KMnO4、K2Cr2O7、HNO3、H2SO4(浓)、KClO3、HClO等4过氧化物,如Na2O2、H2O2等 常见的还原剂有 活泼或较活泼的的金属,如K,Na,Mg,Al,Zn,Fe等 低价金属阳离子,如Fe3+,Sn2+等 非金属阳离子,如Cl-,B-,I-,S2-等 某些非金属单质,如H2,C,Si 在含可变化合价的化合物中,具有中间价态元素的物质(单质或化合物)即可作氧化剂,又可做还原剂,例如 Cl2,H2O2,Fe2+,H2SO3等既具有氧化性,又具有还原性。
2014年高考化学必备专题复习——离子反应与离子共存
2014高考化学必备专题——离子反应、离子共存、离子方程式 【考纲解读】 1.能正确判断电解质、非电解质、强电解质、弱电解质;能正确书写电离方程式;正确判断电解质溶液的导电能力强弱。 2.理解离子反应的本质;能正确书写离子方程式,分析离子共存的先决条件,正确判断溶液中的离子共存。 本专题高考分值约为10-20分。 【高考预测】离子方程式的书写及正误判断、溶液中的离子共存都是高考的热点,属于每年高考必考的内容。在高考试题中,既可以以选择、填空的形式独立命题,直接考查离子方程式的书写、溶液中的离子共存,也可以穿插到工业流程题、实验题之中,以社会生活中的热点问题为切入点,以新知识介绍为载体,考查学生对离子反应、离子方程式的掌握程度,考查学生用离子反应、离子方程式的知识去分析、解释、处理新问题的能力。在复习中,要注意通过对比、归纳的方法,熟练掌握相应的知识规律,要注意提高运用知识分析处理新情景下问题的能力。 一、电解质的有关概念 1.电解质导电的原因及影响因素 根据,可以判断是否为电解质。 (1)离子化合物在熔化状态时都能导电,因此都是电解质。有些离子化合物因难溶于水而使其水溶液难导电,如BaSO4、AgCl等。 (2)共价化合物在水溶液中可电离的为电解质,相反为非电解质。如HCl、H2SO4、HNO3等,在液态时虽不导电,但水溶液能导电,是电解质。 (3)有些化合物如SO2、SO3、NH3、PCl3等,其水溶液也可导电,但它们却是非电解质,原因是它们在水溶液中并不能电离出离子,只是与水发生反应产生电解质而引起导电。 (4)氯水、铁、石墨等尽管能导电,但既不是电解质,又不非电解质。 2.强电解质和弱电解质 强电解质是指。 弱电解质是指。 强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4 HClO3…………… 强电解质强碱:NaOH、KOH、Ba(OH)2 Ca(OH)2……………… 大多数盐(含难溶盐):NaCl、CaSO4、KNO3、BaSO4、AgCl ………… 弱酸:HF、HClO、H2SO3、H2CO3、H3PO4、CH3COOH、…… 弱电解质弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3、……………… 少数盐:Pb(CH3COO)2 Hg2Cl2………… 水是一种极弱的电解质。 特别提醒:1.判断电解质注意点 电解质与非电解质的相同点是研究的对象都是化合物,二者的主要不同是在水溶液里或熔融状态下能否导电。要注意: ①电解质不一定导电,如固态NaCl、液态HCl等;导电物质不一定是电解质,如铁、铝等金属单质。 ②非电解质不导电,但不导电的物质不一定是非电解质,如金刚石、单质硫等一些非金属单质。 ③电解质必须是化合物本身电离出的离子导电,否则不属于电解质。如CO2、NH3、Cl2等物质的水溶液虽能导电,但它们并不是电解质,因为它们是与水反应后生成了电解质,才使溶液导电的。
高三化学一轮复习离子共存教学案
离子共存 【专题目标】 掌握不同条件下在水溶液中不同的离子能(或不能)大量(或少量)共存的规律 【经典题型】 题型1:离子间因发生复分解反应(离子互换反应)而不能大量共存。 例1、下列各组离子在水溶液中能大量共存的是(AC) (A)K+ HCO3— CO32— Br— (B)CO32— HCO3— OH— K+ (C)Fe3+ Cu2+ NO3- SO42- (D)H+ Cl- Na+ SO32- 解析:分析所给选项B中:HCO3—+ OH—= CO32—+H2O;而D中:2H+ + SO32-= H2SO3 题型2:在酸性(或碱性)溶液中不能大量共存。 例2、下列各组离子,在强碱性溶液中可以大量共存的是(AC) (A)I- AlO2- Cl- S2- (B)Na+ K+ NH4+ Ba2+ (C)Br- S2- Cl- HCO3- (D)SO32- NO3- SO42- HCO3- 解析:分析所给选项B中:NH4+ C中: HCO3- 在强碱性溶液中均不能大量存在。 例3、室温时某溶液的pH为1,该溶液中可能大量共存的离子组是(AD) (A)Zn2+ Cl- Ba2+ NO3- (B)Na+ NO3- K+ CO32- (C)K+ SO42- Na+ AlO2- (D)Cu2+ NO3- Al3+ SO42- 解析:分析所给选项B中CO32-和C中AlO2-均不能在酸性溶液中大量存在 题型3:离子间因发生氧化还原反应而不能大量共存。 例4下列离子在溶液中因发生氧化还原反应而不能大量共存的是(A) (A)H3O+、 NO3-、 Fe2+、 Na+ (B)Ag+、 NO3-、Cl-、 K+ (C)K+、Ba2+、OH-、 SO42- (D)Cu2+、NH4+、Br-、OH- 解析:所给四个选项中各组离子均不能大量共存,只有A中的 H3O+、NO3-、Fe2+三种离子因发生氧化还原反应符合题意。 点拨:抓住不能共存的条件——发生氧化还原反应。 强强反应规律及常见强氧化剂、强还原剂的识记,是解决氧化还原应用问题(特别是隐含氧化还原反应问题)的关键,例如检验SO42-时不能用硝酸酸化,就是因为HNO3会使SO32-氧化为SO42-,而干扰检验。 题型4:在无色透明的溶液中离子间能够大量共存。 例5下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是(BD) (A)K+ MnO4- Cl- SO42- (B)Na+ AlO2- NO3- CO32- (C)Na+ H+ NO3- SO42-
高考化学_【五年高考真题】专题3:离子共存
专题03 离子共存 (满分60分时间25分钟) 姓名:班级:得分: 1.【2016年高考江苏卷】制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是 A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- B.加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- 【答案】D 2.【2015广东理综化学】水溶液中能大量共存的一组离子是() A.NH4+、Ba2+、Br-、CO32-B.Cl-、SO32-、Fe2+、H+ C.K+、Na+、SO42-、MnO4-D.Na+、H+、NO3-、HCO3- 【答案】C 【解析】 试题分析:Ba2+和CO32-反应生成BaCO3沉淀,不能大量共存,A错;SO32-和H+反应生成SO2,不能大量共存,B错;C中四种离子不反应,可以大量共存,
C对;H+和HCO3-会反应生成CO2、H2O,不能大量共存,D错。 考点:本题考查了离子间的常见反应和离子的性质,主要涉及复分解反应发生的条件,有关的离子有、Ba2+、CO32-,SO32-、H+,H+、、HCO3-。 3.【2015江苏化学】常温下,下列各组离子一定能在指定溶液中大量共存的是() A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- B.=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3- C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32- 【答案】B 考点:考查限制条件下的离子共存问题、元素及其化合物的性等知识。4.【2014年高考山东卷第12题】下列有关溶液组成的描述合理的是()A.无色溶液中可能大量存在Al3+、NH4+、Cl ̄、S2 ̄ B.酸性溶液中可能大量存在Na+、ClO ̄、SO42 ̄、I ̄ C.弱碱性溶液中可能大量存在Na+、K+、Cl ̄、HCO3 ̄ D.中性溶液中可能大量存在Fe3+、K+、Cl ̄、SO42 ̄ 【答案】C 【解析】 试题分析:A、Al3+与S2 ̄发生双水解反应,不能大量共存;B、酸性溶液中ClO ̄可氧化I ̄,不能大量共存;C、弱碱性溶液中Na+、K+、Cl ̄、HCO3 ̄不发生反应,可以大量共存;D、中性溶液中,Fe3+发生水解反应,转化为Fe(OH)3沉淀,不能大量共存。解答时应注意选项的条件,如无色溶液,溶液的酸碱性等前提条件,
高三化学 离子共存_离子反应练习题及详细答案
离子共存 离子反应练习题 1.(09安徽卷10)在溶液中能大量共存的一组离子或分子是A.+4NH 、+H 、-3NO 、-3HCO B.K + 、Al 3+、-24SO 、NH 3·H 2O C.Na +、K +、-23SO 、Cl 2 D.Na + 、CH 3COO -、-23CO 、OH - 2.(09全国卷Ⅰ6)下列各组离子,在溶液中能大量共存、加入NaOH 溶液后加热既有气体放出又有沉淀生成的一组是 A.Ba 2+ 、3NO -、4NH +、Cl - B. 2Ca +、3HCO -、4NH +、2AlO - C.K +、Ba 2+、Cl -、3HSO - D. 2Mg + 、4NH +、24SO -、K + 3.(09天津卷4)下列叙述正确的是 A.0.1 mol/LC 6H 5ONa 溶液中:c(Na +)>c(C 6H 5O -)>c(H +)>c(OH -) B.Na 2CO 3溶液加水稀释后,恢复至原温度,pH 和K w 均减小 C.pH=5的CH 3COOH 溶液和PH =5的NH 4Cl 溶液中,c(H +)不相等 D.在Na 2S 溶液中加入AgCl 固体,溶液中c(S 2-)下降 4.(09江苏卷7)在下列各溶液中,离子一定能大量共存的是 A .强碱性溶液中:+K 、3+Al 、-Cl 、2-4SO B. 含有0.1 mol·L -1 3+Fe 的溶液中:+K 、2+Mg 、-I 、-3NO C. 含有0.1 mol·L -12+Ca 溶液在中:+Na 、+K 、2-3CO 、-Cl D. 室温下,pH=1的溶液中:+Na 、3+Fe 、-3NO 、2-4SO 5.(09江苏卷11) 下列离子方程式与所述事实相符且正确的是 A .漂白粉溶液在空气中失效:--223ClO +CO +H O=HClO+HCO B .用浓盐酸与2MnO 反应制取少量氯气:+-2+ 222MnO +2H +2Cl Δ Mn +Cl +2H O ↑ C .向2NaAlO 溶液中通入过量2CO 制()3Al OH : ()--22233AlO +CO +2H O=Al OH +HCO ↓ D .在强碱溶液中次氯酸钠与()3Fe OH 反应生成24Na FeO : ()-2--+ 4233ClO +2Fe OH =2FeO +3Cl +H O+4H
高考化学离子共存选择题60道+详细解答
精品题库试题离子共存 化学 1.(2014江苏单科, 3,2分)25 ℃时,下列各组离子在指定溶液中一定能大量共存的是() A.pH=1的溶液中: Na+、K+、Mn、C B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、S、N C.0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、N、Cl- D.0.1 mol·L-1 FeCl3溶液中:Fe2+、N、SCN-、S [解析] 1.pH=1的溶液中C不能大量存在,A项错误;c(H+)=1×10-13 mol/L为强碱性溶液,Cu2+、Mg2+不能大量存在,B项错误;Fe3+和SCN-不共存,D项错误。 2.(2014广东理综, 8,4分) 水溶液中能大量共存的一组离子是() A.Na+、Ca2+、Cl-、S B.Fe2+、H+、S、ClO- C.Mg2+、N、Cl-、S D.K+、Fe3+、N、SCN- [解析] 2.A项,CaSO4微溶,Ca2+和S不能大量共存。B项,Fe2+、ClO-会发生氧化还原反应,H+、S、ClO-不能大量共存。C项,可以共存。D项,Fe3+和SCN-会形成配合物Fe(SCN)3,不能大量共存。 3.(2014安徽理综, 8,6分) 下列有关Fe2(SO4)3溶液的叙述正确的是() A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 B.和KI溶液反应的离子方程式:Fe3++2I-Fe2++I2 C.和Ba(OH)2溶液反应的离子方程式:Fe3++S+Ba2++3OH-Fe(OH)3↓+BaSO4↓ D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe [解析] 3.Fe3+与C6H5OH因发生配合反应而不能大量共存,A项错误;B项,此离子方程式电荷不守恒,正确的 应为2Fe3++2I-2Fe2++I2;C项,离子配比错误,正确的写法为2Fe3++3S+3Ba2++6OH- 2Fe(OH)3↓+3BaSO4↓;D项,足量的Zn将0.1 mol Fe2(SO4)3还原生成0.2 mol Fe,质量为11.2 g,正确。
高三化学《离子共存问题》知识点总结
高三化学《离子共存问题》知识点总结高三化学《离子共存问题》知识点总结 一.“无色透明”条件型 若题目限定溶液“无色”,则不含有色离子,即 Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。如Ag+与Cl-、Br-、 I-、SO42-;Ca2+与CO32-、SO42-;Ba2+与CO32-、SO32-、SO42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。 例1.某无色透明的溶液中,下列各组离子能大量共存的是 A.H+、Cl-、Ba2+、CO32- B.Ag+、I-、K+、NO3-+、OH-、Cl-、Na+ D.Fe3+、Cl-、NO3-、Na+ 解析:正确选项应满足无色透明和能大量共存两个条件。答案为C项。 二.“酸性”条件型 常见的叙述有强酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液等。 1文档来源为:从网络收集整理.word版本可编辑.
若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、 S2-、F-、ClO-、CH3COO-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。 例2.在pH=1的溶液中,可以大量共存的离子是 A.K+、Na+、SO42-、SO32- B.NH4+、Mg2+、SO42-、Cl- C.Na+、K+、HCO3-、Cl- D.K+、Na+、AlO2-、NO3- 解析:正确选项应满足pH=1(有大量H+存在)和可以大量共存两个条件。答案为B项。 三.“碱性”条件型 常见的叙述有强碱性溶液、PH=14的溶液、能使PH 试纸变蓝的溶液、红色石蕊试纸变蓝的溶液、酚酞呈红色的溶液、甲基橙呈黄色的溶液、加入铝粉反应后生成 AlO2-的溶液、既能溶解Al(OH)3又能溶解H2SiO3的溶液等。 若题目中限定溶液呈碱性,则溶液中有OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Cu2+、Fe2+、Fe3+等)以及弱酸的酸式根离子(如 2文档来源为:从网络收集整理.word版本可编辑.
高考化学复习离子共存问题知识点
2019高考化学复习离子共存问题知识点 所谓离子共存,实质上就是看离子间是否发生反应的问题,以下是离子共存问题知识点,请考生学习。 一.无色透明条件型 若题目限定溶液无色,则不含有色离子,即Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。若透明,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。如Ag+与Cl-、Br-、 I-、SO42-;Ca2+与CO32-、SO42-;Ba2+与CO32-、SO32-、SO42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。例1.某无色透明的溶液中,下列各组离子能大量共存的是 A.H+、Cl-、Ba2+、CO32- B.Ag+、I-、K+、NO3- C.K+、OH-、Cl-、Na+ D.Fe3+、Cl-、NO3-、Na+ 解析:正确选项应满足无色透明和能大量共存两个条件。答案为C 项。 二.酸性条件型 常见的叙述有强酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液等。 若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、
S2-、F-、ClO-、CH3COO-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。 例2.在pH=1的溶液中,可以大量共存的离子是 A.K+、Na+、SO42-、SO32- B.NH4+、Mg2+、SO42-、Cl- C.Na+、K+、HCO3-、Cl- D.K+、Na+、AlO2-、NO3- 解析:正确选项应满足pH=1(有大量H+存在)和可以大量共存两个条件。答案为B项。 三.碱性条件型 常见的叙述有强碱性溶液、PH=14的溶液、能使PH试纸变蓝的溶液、红色石蕊试纸变蓝的溶液、酚酞呈红色的溶液、甲基橙呈黄色的溶液、加入铝粉反应后生成AlO2-的溶液、既能溶解Al(OH)3又能溶解 H2SiO3的溶液等。 若题目中限定溶液呈碱性,则溶液中有OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Cu2+、Fe2+、Fe3+等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。 例3.某溶液既能溶解Al(OH)3又能溶解H2SiO3的溶液,在该溶液中可以大量共存的离子组是 A.K+、Na+、HCO3-、NO3- B.Na+、SO42-、Cl-、ClO-
高中化学离子共存知识点总结
高中化学离子共存知识点总结 1.由于发生复分解反应,离子不能大量共存。 (1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。 (2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、 Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与i-不能大量共存。 (3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、 C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。 (4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如 Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如
3AlO2-+3Al3++6H2O=4Al(OH)3↓等。 2.由于发生氧化还原反应,离子不能大量共存。 (1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、i-和Fe3+不能大量共存。 (2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、 HSO3-、i-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。 3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。 例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。 4.溶液中能发生络合反应的离子不能大量共存。 如Fe2+、Fe3+与SCN-不能大量共存;Fe3+与不能大量共存。 5、审题时应注意题中给出的附加条件。 ①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放
高三化学离子共存问题知识点总结
高三化学《离子共存问题》知识点总 结 一.“无色透明”条件型 若题目限定溶液“无色”,则不含有色离子,即Fe2+、Fe3+、cu2+、mno4-等离子。若“透明”,则溶液不形成混浊或沉淀。如Ag+与cl-、Br-、I-、So42-;ca2+与co32-、So42-;Ba2+与co32-、So32-、So42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。 例1.某无色透明的溶液中,下列各组离子能大量共存的是 A.H+、cl-、Ba2+、co32- B.Ag+、I-、k+、No3- c.k+、oH-、cl-、Na+ D.Fe3+、cl-、No3-、Na+ 解析:正确选项应满足无色透明和能大量共存两个条件。答案为c项。 二.“酸性”条件型 常见的叙述有强酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液等。
若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有oH-、弱酸根离子以及弱酸的酸式根离子。 例2.在pH=1的溶液中,可以大量共存的离子是 A.k+、Na+、So42-、So32- B.NH4+、mg2+、So42-、cl- c.Na+、k+、Hco3-、cl- D.k+、Na+、Alo2-、No3- 解析:正确选项应满足pH=1和可以大量共存两个条件。答案为B项。 三.“碱性”条件型 常见的叙述有强碱性溶液、PH=14的溶液、能使PH试纸变蓝的溶液、红色石蕊试纸变蓝的溶液、酚酞呈红色的溶液、甲基橙呈黄色的溶液、加入铝粉反应后生成Alo2-的溶液、既能溶解Al3又能溶解H2Sio3的溶液等。 若题目中限定溶液呈碱性,则溶液中有oH-存在,其中不能大量含有H+、弱碱的阳离子以及弱酸的酸式根离子。 例3.某溶液既能溶解Al3又能溶解H2Sio3的溶液,在该溶液中可以大量共存的离子组是
高一化学第一学期离子共存
高考热点选择题——02离子共存 1、(90)下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是 A K+、MnO4-、Cl–、SO42- B Na+、AlO2-、NO3-、CO32- C Na+、、H+、NO3-、SO42- D Na+、SO42-、S2-、Cl- 2、(91)在某无色透明的酸性溶液中,能共存的离子组是 A NH4+、NO3-、Al3+、Cl- B Na+、AlO2–、K+、NO3- C MnO4-、K+、SO42-、Na+ D K+、SO42-、HCO3-、Na+ 3、(92)若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是 A SO42- B S2- C CO32- D Cl- 4、(93)下列各组离子:(1)I-、ClO-、NO3-、H+(2)K+、NH+4、HCO3-、OH-(3)SO32-、SO42-、Cl-、OH-(4)Fe3+、Cu2+、SO42-、Cl- (5)H+、K+、AlO2-、HSO3-(6)Ca2+、Na+、SO42-、CO32- 在水溶液中能大量共存的是: A(1)和(6)B(3)和(4)C(2)和(5)D(1)和(4) 5、(94)在pH=1的无色透明溶液中不能大量共存的离子组是 A Al3+、Ag+、NO3-、Cl- B Mg2+、NH4+、NO3-、Cl- C Ba2+、K+、S2-、Cl- D Zn2+、Na+、NO3-、SO42- 6.(95)在pH=1的溶液中,可以大量共存的离子组是 A Na+、K+、S2-、Cl- B Al3+、Mg2+、SO42-、Cl- C K+、Na+、AlO2-、NO3- D K+、Na+、SO42-、S2O32- 7、(96)下列各组离子,在强碱性溶液中可以大量共存的是 A K+、Na+、HSO3-、Cl- B Na+、Ba2+、AlO2-、NO3- C NH4+、K+、Cl-、NO3- D K+、Na+、ClO-、S2- 8(97)下列各组离子,在强碱溶液中可以大量共存的是 A I-AlO2-Cl-CO32- B Na+K+NH4+Ba2+ C Br-S2-Cl-CO32- D SO32-NO3-SO42-HCO3- 9、(99)下列各组离于在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是 A Na+Ba2+Cl-SO42- B K+AlO2-NO3-OH- C H+NH+4Al3+SO42- D H+Cl-CH3COO-NO3- 10、()下列各组离子,在强碱性溶液中可以大量共存的是 A I-、AlO2-、Cl-、S2- B Na+、K+、NH4+、Ba2+ C Br-、S2-、Cl-、CO32- D SO32-、NO3-、SO42-、HCO3- 11、(单科)若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 A Al3+Na+NO3-Cl- B K+Na+Cl-NO3- C K+Na+Cl-AlO2- D K+NH+4SO42-NO3- 12、(大综)在强酸溶液中,下列各组离子能够大量共存的是 A Mg2+、Ca2+、HCO3-、Cl- B Na+、AlO2-、Cl-、SO42- C K+、Fe2+、SO42-、Br- D Fe2+、Ca2+、Cl-、N O3- 13、(甘肃、青海理综)在某溶液中酚酞呈粉红色。下列离子在该溶液中不能 ..大量存在的是 A K+ B Na+ C Ba2+ D Al3+ 14、(山东10)在pH=1的溶液中,可以大量共存的离子是() A.K+、Na+、SO42—、S2O32—B.NH4+、Mg2+、SO42—、Cl—
2011高考化学试题分类汇编-离子共存离子反应
2011高考化学试题分类汇编-离子共存离子反应 1.(2011江苏高考4)常温下,下列各组离子在指定溶液中一定能大量共存的是 A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- C.pH=12的溶液:K+、Na+、CH3COO-、Br- D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- 解析:本题以溶液中离子共存的方式考查学生对硝酸的氧化性、亚铁离子还原性、甲基橙呈红色水溶液的呈酸性、酸性溶液AlO2-不能在其中共存、与铝反应产生大量氢气有强酸碱性两种可能等相关知识的理解程度,考查学生综合运用所学化学知识解决相关化学问题的能力。 答案:C 2.(2011安徽高考8)室温下,下列各组离子在指定溶液中能大量共存的是 A.饱和氯水中Cl-、NO3-、Na+、SO32- B.c(H+)=1.0×10-13mol/L溶液中C6H5O-、K+、SO42-、Br- C.Na2S溶液中SO42-、K+、Cl-、Cu2+ D.pH=12的溶液中NO3-、I-、Na+、Al3+ 解析:饱和氯水具有强氧化性,能将SO32-氧化成SO42-,A中不能大量共存;c(H+)=1.0×10-13mol/L溶液,说明该溶液显碱性,因此可以大量共存;S2-和Cu2+可以结合生成难溶性CuS沉淀,所以不能大量共存;pH=12的溶液,说明该溶液显碱性,而Al3+与碱不能大量共存。所以正确的答案是B。 答案:B 3. (2011广东高考8)能在水溶液中大量共存的一组离子是 A. H+、I―、NO3―、SiO32- B. Ag+、Fe3+、Cl―、SO42― C.K+、SO42-、Cu2+、NO3― D.NH4+、OH-、Cl-、HCO3- 解析:本题考察离子共存问题。SiO32-属于弱酸硅酸的酸根与酸不能大量共存,同时在酸性溶液中,NO3―具有氧化性能氧化I―生成单质碘,A不正确;Ag+与Cl―和SO42―均可生成难溶性物质AgCl和Ag2SO4,B不正确;在碱性溶液中NH4+和HCO3-均与OH-结合分别形成氨水和CO32-,因此D也不正确,所以答案是C。 答案:C
2020年高考化学二轮专题复习资料汇总离子共存
2020年高考化学二轮专题复习资料汇总离子共存【专题目标】 把握不同条件下在水溶液中不同的离子能〔或不能〕大量〔或少量〕共存的规律 【经典题型】 题型1:离子间因发生复分解反应〔离子互换反应〕而不能大量共存。 例1、(1988年全国高考题)以下各组离子在水溶液中能大量共存的是(AC) 〔A〕K+ HCO3— CO32— Br— 〔B〕CO32— HCO3— OH— K+ 〔C〕Fe3+ Cu2+ NO3- SO42- 〔D〕H+ Cl- Na+ SO32- 解析:分析所给选项B中:HCO3—+ OH—= CO32—+H2O;而D中:2H+ + SO32-= H2SO3 题型2:在酸性〔或碱性〕溶液中不能大量共存。 例2、(1997年高考题)以下各组离子,在强碱性溶液中能够大量共存的是(AC) 〔A〕I- AlO2- Cl- S2- 〔B〕Na+ K+ NH4+ Ba2+ 〔C〕Br- S2- Cl- HCO3- 〔D〕SO32- NO3- SO42- HCO3- 解析:分析所给选项B中:NH4+ C中: HCO3- 在强碱性溶液中均不能大量存在。 例3、(1997年高考试测题)室温时某溶液的pH为1,该溶液中可能大量共存的离子组是(AD) 〔A〕Zn2+ Cl- Ba2+ NO3- 〔B〕Na+ NO3- K+ CO32- 〔C〕K+ SO42- Na+ AlO2- 〔D〕Cu2+ NO3- Al3+ SO42- 解析:分析所给选项B中CO32-和C中AlO2-均不能在酸性溶液中大量存在 题型3:离子间因发生氧化还原反应而不能大量共存。 例4〔2001年上海市高考题〕以下离子在溶液中因发生氧化还原反应而不能大量共存的是〔A〕 (A)H3O+、 NO3-、 Fe2+、 Na+ (B)Ag+、 NO3-、Cl-、 K+ (C)K+、Ba2+、OH-、 SO42- (D)Cu2+、NH4+、Br-、OH- 解析:所给四个选项中各组离子均不能大量共存,只有A中的 H3O+、NO3-、Fe2+三种离子因发生氧化还原反应符合题意。 点拨:抓住不能共存的条件——发生氧化还原反应。
高考化学专题离子共存
专题8-1 离子共存 【专题目标】 掌握不同条件下在水溶液中不同的离子能(或不能)大量(或少量)共存的规律 【经典题型】 题型1:离子间因发生复分解反应(离子互换反应)而不能大量共存。 例1、(1988年全国高考题)下列各组离子在水溶液中能大量共存的是(AC) (A)K+ HCO3— CO32— Br— (B)CO32— HCO3— OH— K+ (C)Fe3+ Cu2+ NO3- SO42- (D)H+ Cl- Na+ SO32- 解析:分析所给选项B中:HCO3—+ OH—= CO32—+H2O;而D中:2H+ + SO32-= H2SO3 题型2:在酸性(或碱性)溶液中不能大量共存。 例2、(1997年高考题)下列各组离子,在强碱性溶液中可以大量共存的是(AC) (A)I- AlO2- Cl- S2- (B)Na+ K+ NH4+ Ba2+ (C)Br- S2- Cl- HCO3- (D)SO32- NO3- SO42- HCO3- 解析:分析所给选项B中:NH4+ C中: HCO3- 在强碱性溶液中均不能大量存在。 例3、(1997年高考试测题)室温时某溶液的pH为1,该溶液中可能大量共存的离子组是(AD) (A)Zn2+ Cl- Ba2+ NO3- (B)Na+ NO3- K+ CO32- (C)K+ SO42- Na+ AlO2- (D)Cu2+ NO3- Al3+ SO42- 解析:分析所给选项B中CO32-和C中AlO2-均不能在酸性溶液中大量存在 题型3:离子间因发生氧化还原反应而不能大量共存。 例4(2001年上海市高考题)下列离子在溶液中因发生氧化还原反应而不能大量共存的是(A) (A)H3O+、 NO3-、 Fe2+、 Na+ (B)Ag+、 NO3-、Cl-、 K+ (C)K+、Ba2+、OH-、 SO42- (D)Cu2+、NH4+、Br-、OH- 解析:所给四个选项中各组离子均不能大量共存,只有A中的 H3O+、NO3-、Fe2+三种离子因发生氧化还原反应符合题意。 点拨:抓住不能共存的条件——发生氧化还原反应。
2020年高考化学一轮必刷好题专题5:离子共存
2020年高考化学一轮必刷好题专题05:离子共存 4.(2019江苏)室温下,下列各组离子在指定溶液中能大量共存的是 A .0.1 mol·L ?1NaOH 溶液:Na +、K +、23CO - 、2AlO - B .0.1 mol·L ?1FeCl 2溶液:K +、Mg 2+、24SO -、4MnO - C .0.1 mol·L ?1K 2CO 3溶液:Na +、Ba 2+、Cl ?、OH ? D .0.1 mol·L ?1H 2SO 4溶液:K +、4NH +、3NO -、3HSO - 【答案】A 【解析】A 项,0.1 mol·L ?1NaOH 溶液中,K +、23CO - 、2AlO - 可以大量共存,正确;B 项,MnO 4-可以氧化Fe 2+,不能大量共存;C 项,CO 32-和Ba 2+生成BaCO 3沉淀,不能大量共存;D 项,H +的HSO 3-反应生成SO 2、酸性条件下NO 3-还可以氧化HSO 3-,不能大量共存。 4. (2018江苏)室温下,下列各组离子在指定溶液中能大量共存的是 A. 0. 1 mol· L ?1KI 溶液:Na +、K +、ClO ? 、OH ? B. 0. 1 mol· L ?1Fe 2(SO 4)3溶液:Cu 2+、NH 4+ 、NO 3?、SO 42? C. 0. 1 mol· L ?1HCl 溶液:Ba 2+、K +、CH 3COO ?、NO 3? D. 0. 1 mol·L ?1NaOH 溶液:Mg 2+、Na +、SO 42?、HCO 3? 【答案】B 【解析】A 项,I -具有强还原性,ClO -具有强氧化性,I -与ClO -发生氧化还原反应,I -与ClO -不能大量共存;B 项,在Fe 2(SO 4)3溶液中离子相互间不反应,能大量共存;C 项,CH 3COO -能与H +反应生成CH 3COOH ,在HCl 溶液中CH 3COO -不能大量存在;D 项,Mg 2+、HCO 3-都能与OH -反应,Mg 2+、HCO 3-与OH -不能大量共存。 锁定考点 基础练习 1.某溶液中大量存在Ba 2+、H +、Cl -,该溶液中还可能大量存在的离子是 A .Ag + B .SO 42- C .CH 3COO - D .Mg 2+ 【答案】D 【解析】A .Ag +与Cl -能够反应生成沉淀,不能大量共存,故A 错误;B .SO 42-与Ba 2+能够反应生成沉淀,不能大量共存,故B 错误;C .CH 3COO -与H +能够反应生成弱电解质醋酸,不能大量共存,故C 错误;D .Mg 2+与Ba 2+、H +、Cl -都不反应,可大量共存,故D 正确。 2.以下各组离子能在指定溶液中大量共存的是
高考化学离子共存专题
离子共存问题 一、基本原理 1.一色 “无色透明”条件型 若题目限定溶液“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(棕黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子,也不含Fe(SCN)2+、Fe(C6H5O) 等有色离子。 若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。如Ag+与Cl-、Br-、I-、SO42-;Ca2+与CO32-、SO32-;Ba2+与CO32-、SO32-、SO42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。 2.二性 指碱性、酸性。 若是酸性溶液,所有弱酸根离子和OH-不能大量共存。 常见的叙述有酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液、c(OH-)=1×10-14mol·L-1的溶液等。 若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、S2-、F-、ClO-、CH3COO-、C6H5O-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。在中学化学中不能在酸性溶液中共存的离子有:OH-、AlO2-、CO32-、HCO3-、SiO32-、SO32-、HSO3-、S2O32-、S2-、HS-、ClO-、F-、PO43-、H2PO4-、 C6H5O-、CH3COO-、-OOC-COO-、C6H5COO-、CH3CH2O-、SCN-、H2N-CH2-COO-等; 若是碱性溶液,则所有弱碱阳离子及H+均不能大量共存。 在中学化学中不能在碱性溶液中大量共存的是:H+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+、Mg2+、Al3+、NH4+、HCO3-、HPO42-、H2PO4-、HSO3-、HS-、HOOC- COO-等。 “酸性或碱性”条件型 常见的叙述有能使Al反应放出H2的溶液、水电离出的c(H+)或c(OH-)<1×10-7 mol·L-1的溶液等。 若题目中出现这样的条件,则溶液中可能有H+存在,也可能有OH-存在,分析时要注意题目要求回答的是一定能大量共存(满足无论是与H+还是与OH-都不会反应)还是可能大量共存(只要满足与H+、OH-中的一种不会反应)。3.四反应 若离子间能发生下列四种反应中的任一种,则均不能共存。 (1)发生复分解反应 离子相互直接结合生成难溶物(如AgCl、AgBr、BaSO4等)、气体(如NH3、CO2等)或弱电解质(如H2O、HF、H2S等)均不能大量共存于同一溶液中。 ①有气体产生。如HCO3-、CO32-、S2-、HS-、SO32-、HSO3-等易挥发性弱酸的酸根离子与H+不能大量共存,因为能发生如下反应:CO32-+2H+=CO2↑+H2O、HCO3-+H+=CO2↑+H2O ②有沉淀生成。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-、SO32-、SiO32-、PO43-、HPO42-等大量共存,因为Ba2++CO32-==CaCO3↓、Ca2++SO42-=CaSO4(微溶);Cu2+、Fe3+、Mg2+、Zn2+、Fe2+、Pb2+、Ag+不能与OH-大量共存,是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-==Fe(OH)3↓等。 ③有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-等与H+不能大量共存,因为OH-+H+ H2O、CH3COO-+H+ CH3COOH,会生成弱电解质;一些酸式弱酸根不能与OH-大量共存,是因为发生了下列反应:HCO3-+OH-CO32-+H2O、HPO42-+OH-PO43-+H2O、NH4++OH-NH3·H2O等。 (2)发生氧化还原反应 若题目中出现因发生氧化还原反应而不能大量共存这样的条件时,要考虑各离子组中是否存在强氧化性和强还原性的离子。如Fe3+与S2-、SO32-、HSO3-、I-;H+与S2O32-; SO32-(H+)与S2-;MnO4-(H+)与Cl-;MnO4-(H+)、NO3-(H+)与Fe2+、S2-、HS-、SO32-、HSO3-、Br-、I-等不能大量共存。两离子相遇若发生氧化还原反应,则不能共存。如Fe3+与S2-、Fe3+与I-、Fe2+与NO3- (H+)等;MnO4-、NO3- (H+)、ClO-(H+)、Cr2O72-与S2-、I-、SO32-、Fe2+不共存;酸性条件下SO32-与S2-不共存。 ①具有较强还原性的离子不能与具有较强氧化性的离子大量共存。Fe3+与S2-、SO32-、I-;常见的强氧化剂MnO4-、ClO-、Cr2O72-、NO3-(H+)分别与常见的还原剂S2-、I-、SO32-、Fe2+等因为发生氧化还原反应而不能大量共存,但Fe3+与Fe2+能大量共存。如I-和Fe3+不能大量共存是由于2I-+2Fe3+=I2+2Fe2+。
