临床科室药品质量检查记录表
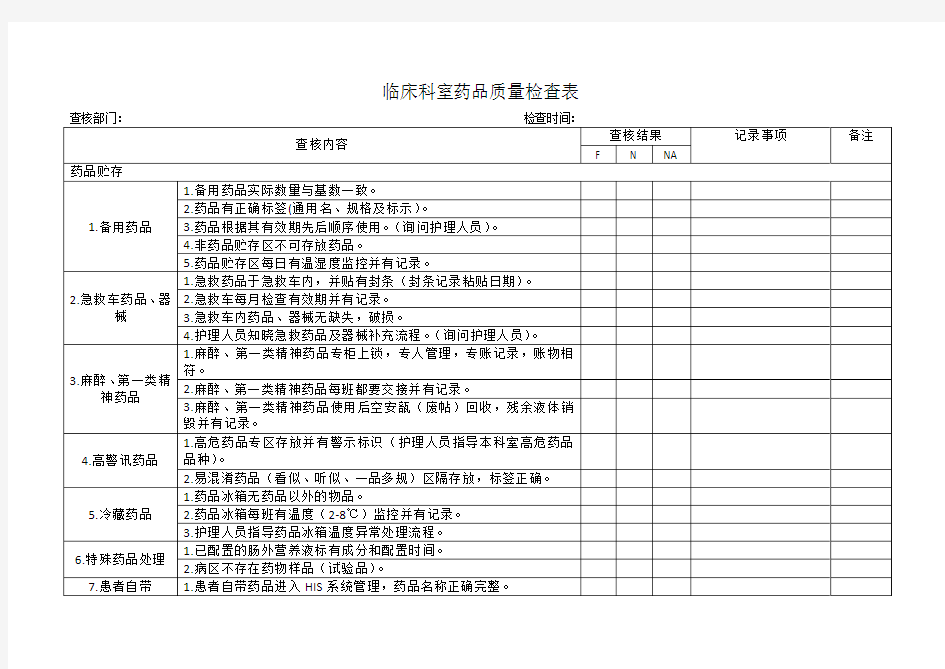
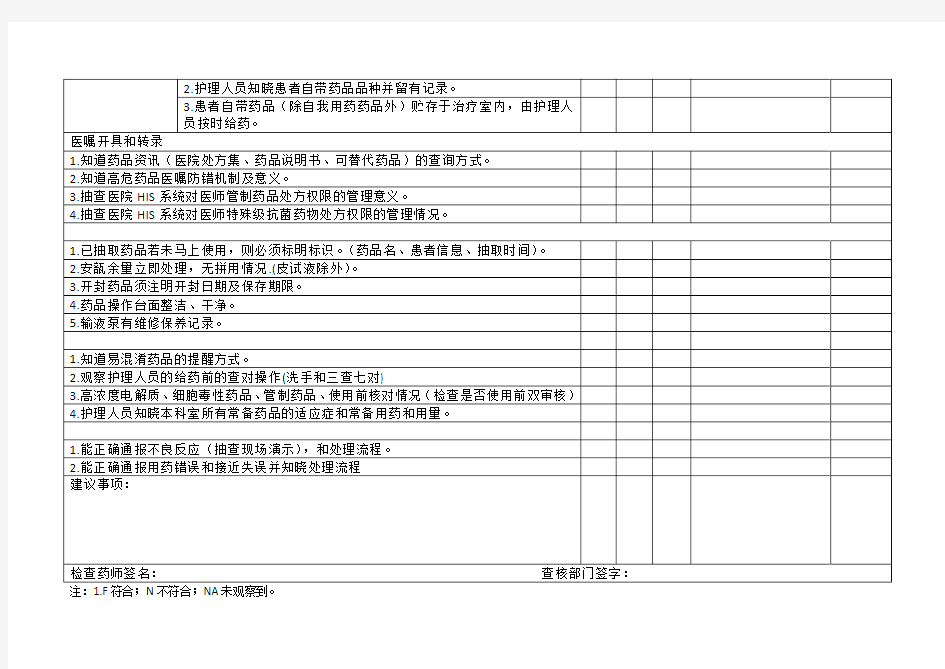
临床科室药品质量检查表
药品质量管理制度检查考核表
药品质量管理制度检查考核表 制度名称检查考核内容及评分标准 执行情况 检查评定符合一般较差 药品购进管理规定1、必须从具有合法资格的生产、经营企业购进药品。 2、购货合同或质量保证协议中必须有明确的质量条款,内容填写齐全, 盖有供需双方的红色公章。 3、 4、按采购规程进行采购。 药品验收入库管理规定1、 2、购进药品必须由验收员验收,验收员在来货凭证上签字。 3、 4、验收时按购进票据与实物对照、核对,做到票货相符。 5、 6、验收后的药品外观质量和包装质量都要符合规定要求。验收记录要按 要求填写,并亲笔签字或盖章不得缺项或漏项。 7、验收记录保存至超过药品有效期一年。 药品养护管理规定1、 2、按药品规定储存要求进行储存、养护。 3、重点品种应每月进行养护,并做好养护检查记录。 4、对中药材和中药饮片按其特性采取相应措施进行养护并做好记录。 5、温湿度按规定进行记录,温湿度超出范围时采取相应的措施。 6、养护中发现质量问题应及时采取措施,并尽快通知质量管理员。 7、对检查中发现的质量有问题的药品及时下架并按有关规定处理。不合 格药品的处理应有真实完整的记录台帐。 药品陈列管理规定1、包装不符合要求的药品不得陈列。 2、陈列药品做到与非药品、内服药与外用药、包装和品名易混淆的药品、 中药材中药饮片与一般药品分开陈列。
3、药品陈列分类标识清晰,摆放准确。 4、药品陈列环境和陈列条件应按规定按期检查并做好记录。考核人:时间: 制度名称检查考核内容及评分标准 执行情况 检查评定符合一般较差 药品效期管理规定1、对有效期在6个月以内的近效期药品应及时销售。临近效期时限应下 架停售,并按不合格药品予以处理。 2、近效期药品为重点养护检查品种,应每月养护检查并有记录。 不合格药品管理规定1、验收中发现的不合格药品应单独存放在不合格区标志明显。 2、在陈列药品检查发现的不合格药品,应立即停止销售,做销毁处理。 3、不合格药品的销毁应符合有关规定,在质量管理员和有关人员的监督 下执行。 4、不合格药品的处理,报损和销毁登记真实、完整,妥善保管。 中药材、中药饮片购销 存管理规定1、中药材、中药饮片应向具有药品经营合法资质的企业购进。 2、所购进中药材、中药饮片外包装应符合要求。严格按规定程序调配中 药处方。 3、中药材和中药饮片不得有虫蛀、霉变、变质等质量不合格现象。 4、中药材、中药饮片装斗前应做质量复核,不得错斗和串斗。 药品拆零管理规定1、质量可疑或外观性状不合格的药品不得拆零。 2、拆零药品集中存放在拆零专柜。 3、拆零药品应在包装袋上写明品名、规格、用法、用量、有效期等内容。 4、药品拆零记录真实完整。 人员健康、培训管理 规定1、对直接接触药品的人员应每年体检,新上岗职工进行上岗前体检。 2、凡发现有传染病、皮肤病、精神病等,应立即调离直接接触药品岗位。 3、定期对从事药品管理的人员进行培训,有培训记录,学习笔记。 药品不良反应报告规定1、概念清晰,职责明确,程序规范,发现药品不良反应及时上报。 2、记录完整、准确、规范。
医院医疗质量检查情况记录单
xx院医疗质量检查情况记录单 检查日期: 检查科室:临床(门诊、病房) 检查内容: 临床:门诊病历、处方、门诊登记、病案质量、医生交接班记录、抢救记录、核心制度、各种记录本、医疗安全(投诉、医疗争议、医疗事故)。其他。 检查中存在问题: 1. 2. 3. 4. 5. 被查科室签名: 检查人签名: xx卫生院 xx卫生院医疗质量检查情况记录单 检查日期: 检查科室:护理 检查内容:
病案质量、护士长日志、各种护理文书、交接班本、差错事故登记本、入院宣教记录、业务学习记录、医疗安全(投诉、医疗争议、医疗事故)、核心制度、其他。 检查中存在问题: 1. 2. 3. 4. 5. 被查科室签名: 检查人签名: xx中心卫生院xx卫生院医疗质量检查情况记录单 检查日期: 检查科室:特检科(放射科、B超室、心电图室) 检查内容: 科主任台帐、检查登记本、报告审签制度、仪器维护记录、诊断报告符合率、急诊备班实行24小时负责制、核心制度、医疗安全(投诉、医疗争议、医疗事故)、其他。 检查中存在问题: 1. 2.
3. 4. 5. 被查科室签名: 检查人签名: xx中心卫生院xx卫生院医疗质量检查情况记录单 检查日期: 检查科室:检验科 检查内容: 科主任台帐、随访登记、室内质控、报告准确性、急诊报告及时性、标本管理、核心制度、医疗安全(投诉、医疗争议、医疗事故)、其他 检查中存在问题: 1. 2. 3. 4. 5. 被查科室签名: 检查人签名: xx中心卫生院
xx卫生院医疗质量检查情况记录单 检查日期: 检查科室:药剂科 检查内容: 科主任台帐、处方划价准确率、差错事故登记本、毒麻药品管理与使用、药品入出库单、效期药品登记本、医疗安全(投诉、医疗争议、医疗事故)、其他 检查中存在问题: 1. 2. 3. 4. 5. 被查科室签名: 检查人签名: xx中心卫生院
公司质量管理制度执行情况检查考核表
*********公司质量管理制度执行情况检查考核表2014 年度检查人:检查日期:年月日制度名称考核内容得分存在问题改进措施实施人签名 1.根据质量方针,每年制定质量目标并逐层分解。 4分无无质量方针2.每半年开展一次“质量方针目标检查”,分析并小结目标完3分无无目标管理成情况,指出未完成目标及问题点,提出整 改措施。制度 3.每年进行质量目标管理与实施效果的检查评分、考核与奖罚。无无 3分1.质量管理体系的审核工作,由公司主要负责人组织质量管理无无 4分质量管理领导小 组进行。体系内部2.每年对质量管理体系进行一次全面的审核、评价和完善。无无 4分 审核制度 3.对审核中发现的问题应下达纠正和预防措施通知书,并予以无无 4分实施。 1.明确本部门、岗位的质量责任。有关部无无 4分门、组织 2.对本部门、岗位的质量责 任了解、熟悉,并认真执行。和人员的无无 4分质量责任 1.质量管理部在进货和销售等 经营活动中行使质量否决权。 4分无无质量否决2.质量否决权是以药品质量标准与质量 责任为依据,实行药品4分无无管理制度质量问题确认与处理的决定权。 1.质量管理部为质量信息管理部门。 3分无无 2.质量信息管理内容明确,符合企业实际。 3分无无 质量信息3.各种质量信息及时、规范记录于《质量信息记录表》。 3分无无管理制度 4. 质量信息根据分级分类及时传递,反馈和使用。 3分无无 5.重要的质量信息及时上报总 经理。 3分无无定期采用前瞻或者回顾的方式,对药品流通过程中的质量风险2分对质量风险管理工作的认知度不质量管理等相关人员加强对质质量风险进行评估、控制、沟通和审核。够,如何有效开展工作的经验缺乏。量风险管理相关知识的学习,不管理制度 断改进工作。 1.质量管理部负责首营企业和首营品种的审核。 4分无无 2.不得从未经首 营审核的企业购进药品,不得购进未经首营审供货单位4分无无批的品种。资格审核3.采购开单部按规定填报首营企业、首营品种审批表,并提交制度 4分无无合格的资料。 第1页共 8页
药品质量信息收集分析记录表
药品质量信息收集分析记录表 编号: 信息名称 或主题 对于少儿补钙类药品信息页数共 1 页 信息来源好大夫医药网 收集时间2014-07-1 收集人李亚轩 信息摘要: 0-6岁是宝宝生长发育的黄金阶段,只有这个时期打好基础,才能有利于宝宝茁壮成长。钙是促进宝宝骨骼和智力发育的重要因素,0-6岁阶段适当补钙,对宝宝成长有重要帮助。可是怎样补钙才科学,宝宝在每个不同年龄阶段需要补多少钙,却不是每个家长都清楚的。 0-6岁宝宝每日钙需求量 初生0-5个月的宝宝,每日钙需求量为300毫克。 7-12个月的宝宝,每日钙需求量约为400-600毫克。这个阶段的婴儿已经开始添加的辅食,可以从辅食中摄入了一部分钙。但此阶段婴儿生长发育特别快,对钙的需要量也增加了,故仍需要继续补充钙剂,建议每天额外补钙100-200毫克。 1-3岁的宝宝,每日钙需求量约为600-800毫克。这个阶段的幼儿乳牙萌出,至2岁半出齐,饮食也渐由奶类逐渐过度到以谷类为主。虽然一般食物都可以摄入一定量钙,不过奶制品包括酸奶、奶油等还是唯一可靠的钙质来源。因此,每天最好还是继续喝牛奶400毫升左右,同时注意安排奶制品、骨头汤、小虾皮、鱼类等富钙食物。此外,建议每天额外补钙100-200毫克。 4-6岁的儿童,每日钙摄入量要保证800-1200毫克。除了食物中的摄取外,每日最好补钙剂400毫克。 0-6岁宝宝身体成长离不开钙。如果缺钙,就会直接影响儿童的骨骼与牙齿的健康。0-6岁宝宝智力发育也离不开钙。研究表明,神经细胞代谢及神经肌肉活动均与钙有着密切的联系。在神经细胞代谢过程中,肌体能量和蛋白质等代谢所需的多种酶和激素均需要在钙离子的激活下才有生物活性,因此钙离子对大脑和整个肌体代谢起到重要的调节作用。补充足够的钙会增强神经组织的传导能力和收缩性,孩子学习时能精神高度集中提高效率,休息和睡眠时能彻底放松,保持旺盛的精力和良好的情绪。由此可见,要使孩子有聪明的头脑,首先要使大脑发育具有足够的营养,钙是其中的重要营养素之一。此外,补钙还可以排解铅毒。由于钙和铅在肠道吸收过程中有竞争拮抗作用,都能与小肠粘膜上的蛋白基团结合而入血。因此低钙饮食会增加体内铅积蓄,而当增加局部钙离子浓度时,就可有效抑制铅的吸收过程,抵抗铅中毒。如今汽车废气排放造成的铅污染,已经成为影响儿童(尤其是5岁以上的儿童)脑发育的重要因素。儿童长期服用钙剂,可以最大程度地减轻或消除铅毒性的不良影响,
药品质量档案管理规程(含表格)
药品质量档案管理规程 (ISO9001-2015/GMP) 1.0总则 1.1目的:本文件规定了产品质量档案建档要求,为质量管理和检验工作提供服务。 1.2范围:适用于本公司所有正式批准文号的产品。 1.3责任:本文件由化验室负责起草,化验室主任负责审核,生产负责人负责批准;化验室主任负责实施。 2.0档案建立要求: 2.1.凡有正式批准文号的产品均要建立产品质量档案。 2.2.档案管理员负责建立整理、编集产品质量档案,每年汇总归档。 2.3.每一份档案要按规定编目成册,存放保存。 2.4质量档案内容: 2.4.1.产品简介 产品名称、产品特点(性状、规格、有效期等)、类型等。 2.4.2.工艺流程 简易工艺流程图 2.4. 3.批件 生产批准文号批件复印件,包括:证书、批件和批准的质量标准等。 2.4.4.工艺规程 工艺规程及变更情况。 2.4.5.质量标准
原料、辅料、中间产品、成品质量标准及变更情况,包括:有关试验资料等。 2.4.6.质量情况 历年质量情况及与同类产品对比情况,如年度质量回顾报告。 2.4.7.稳定性考察 产品持续稳定性考察试验资料,每年均要有数据或书面总结。 2.4.8.质量事故 重大质量事故与质量事故报告全套资料。 2.4.10.产品投诉 用户访问、用户投诉情况。 2.4.11.退货与回收 产品回收,退货等情况每年汇总归档。 2.4.12.检验方法变更 变更申请报告、对比试验资料。 2.4.1 3.质量工作总结 提高产品质量工作总结、数据资料、方法和效果、质量改进文字资料。 2.4.14.包装材料质量标准及变更 变更说明,变更后备案情况。历次印刷性包装材料标准样张样本。 2.4.15.空白记录 全套检验记录、现场监控记录、取样单、请验单、取样记录等空白记录,及变更情况。 2.4.16.质量抽检 产品抽检情况,包括:抽检质量情况统计、抽检报告书等。
药剂科药品质量抽检记录表模版
2017年月药剂科中心药房药品质量抽检记录表 序号药品规格数量批号效期厂家 1 盐酸氨溴索口服溶液100ml/瓶30 201909 扬州市三药制药有限公司 2 头孢丙烯分散片6片/盒30 20190 3 广州白云山医药集团股份有限公司 3 尿清舒颗粒12袋/盒30 05317011 201908 广州一品红制药有限公司 4 头孢克肟片6片/盒30 170302 201809 山东海山药业有限公司 5 缬沙坦胶囊7粒/盒30 X2150 202002 瑞士诺华有限公司 6 乳果糖口服溶液6袋/盒30 352185 201910 Abbott Healthcare Products B.V. 7 阿莫西林克拉维酸钾片21片/盒30 161006 201809 湘北威尔曼制药股份有限公司 8 布洛芬缓释胶囊20粒/盒30 中美天津史克制药有限公司 9 硫糖铝口服混悬液120ml/瓶30 161202 广东华南药业集团有限公司 10 布洛芬混悬液100ml/瓶30 201912 扬州市三药制药有限公司 11 盘龙七片36片/盒30 202001 陕西盘龙药业集团股份有限公司 12 瑞舒伐他汀钙片7片/盒30 131548 201905 阿斯利康药业(中国)有限公司 13 胃苏颗粒9袋/盒30 202003 扬子江药业集团 14 氯化钾缓释片24片/盒30 201902 广州迈特兴华制药厂有限公司 15 伤科接骨片60片/瓶30 大连美罗中药厂有限公司 16 产复康颗粒18袋/盒30 170315 201902 深圳三顺制药有限公司 17 桂枝茯苓胶囊100粒/盒30 170425 202003 江苏康缘药业有限公司 18 罗红霉素胶囊12粒/盒30 202003 扬子江药业集团有限公司 19 枸橼酸氢钾钠颗粒100G/罐30 B1403554 201907 德国马博士大药厂 20 盐酸曲美他嗪片30盒30 2010815 施维雅(天津)制药有限公司 21 苯磺酸左旋氨氯地平片7片/盒30 170524 202004 施慧达药业集团(吉林)有限公司 22 酒石酸美托洛尔片20片30 1703A29 202002 阿斯利康制药有限公司 23 阿托伐他汀钙片7片/盒30 S36959 201912 辉瑞制药有限公司 24 厄贝沙坦片7片/盒30 6A408 201910 赛诺菲(杭州)制药有限公司 25 琥珀酸美托洛尔缓释片7片/盒30 1705027 201912 阿斯利康制药有限公司 26 厄贝沙坦氢氯噻嗪片30片/盒30 2010730 赛诺菲(杭州)制药有限公司 27 培哚普利叔丁胺片7片/盒30 1702095 201908 施维雅(天津)制药有限公司 28 复方甲氧那明胶囊60粒/盒30 SS056AA 202001 第一三共制药(上海)有限公司 29 稳心颗粒9袋/盒30 1705072 201810 山东步长制药有限公司 30 甘露醇注射液250ml/瓶30 201901 四川科伦药业股份有限公司 抽检合格率
药品批发公司新gps质量管理制度执行情况检查考核记录表(全)1.doc
药品批发公司新gps质量管理制度执行情况 检查考核记录表(全)1 四川宜宾福星药业有限责任公司新特药分公司药品质量管理制度执行情况检查考核记录表规章制度名称退货药品管理制度检查考核日期制度执行部门参与检查考核人员检查或考核方式资料查看、现场询问检查或考核内容:1、退货药品应有专人管理、并存放于退货区;2、销后退回药品应查核原销售记录,逐一核对退回药品的名称、生产批号、数量及生产厂家与原发货是否相符;3、销后退回的药品,经质量验收合格的药品入合格品库区;4、销后退回的药品经质量验收确认为不合格药品,则应按不合格药品制度执行。检查或考核情况:检查或考核发现问题及解决办法:检查或考核负责人(签字):部门负责人(签字):1 药品质量管理制度执行情况检查考核记录表规章制度名称药品质量验收管理制度检查考核日期制度执行部门参与检查考核人员检查或考核方式现场操作、资料查阅、现场询问检查或考核内容:1、职责 明确,责任到人;2、按规定逐批验收,方法正确,结论明确;3、严格把关、手续齐全,资料归档管理规范;4、验收用设施、设备齐全、地点符合要求。检查或考核情况:检查或考核发现问题及解决办法:检查或考核负责人(签字):部门负责人(签字): 2
药品质量管理制度执行情况检查考核记录表规章制度名称质量投诉管理制度检查考核日期制度执行部门参与检查考核人员检查或考核方式现场提问、查阅资料检查或考核内容:1、接到质量投诉后,应做好相关记录;2、接到投诉后,应暂停批号药品的销售;3、接到投诉后,应积极调查、并联系该生产厂家换货。检查或考核情况:检查或考核发现问题及解决办法:检查或考核负责人(签字):部门负责人(签字) 3 药品质量管理制度执行情况检查考核记录表规章制度名称进口药品管理制度 检查考核日期制度执行部门参与检查考核人员检查或考核方式查进品药品品种、查阅资料检查或考核内容:1、进口药品的采购,确保购进药品的质量,盖有该单位红色印章的证照复印件。2、所有进口药品必须用中文标明产品名称,主要成份以及注册号,并有中文说明书。3、销售进口药品质时,应将加盖本公司质量管理部原印章的进口药品有关证明随货一并发往购货方。检查或考核情况:检查或考核发现问题及解决办法:检查或考核负责人(签字):部门负责人(签字)4 药品质量管理制度执行情况检查考核记录表规章制度名称有效期药品管理制度检查考核日期制度执行部门参与检查考核人员检查或考核方式资料查阅、看现场检查或考核内容:1、药品按批号、效期集中堆放,实行按批号管理。2、已过效药严格控制,及时移入不合格品库。3、已过效期药品的处理、报损和销毁按不合格品规定执行,手续齐全,记录完整。检查或考
