2020届高考化学微专题六化学平衡图像教案(含解析)

化学平衡图像
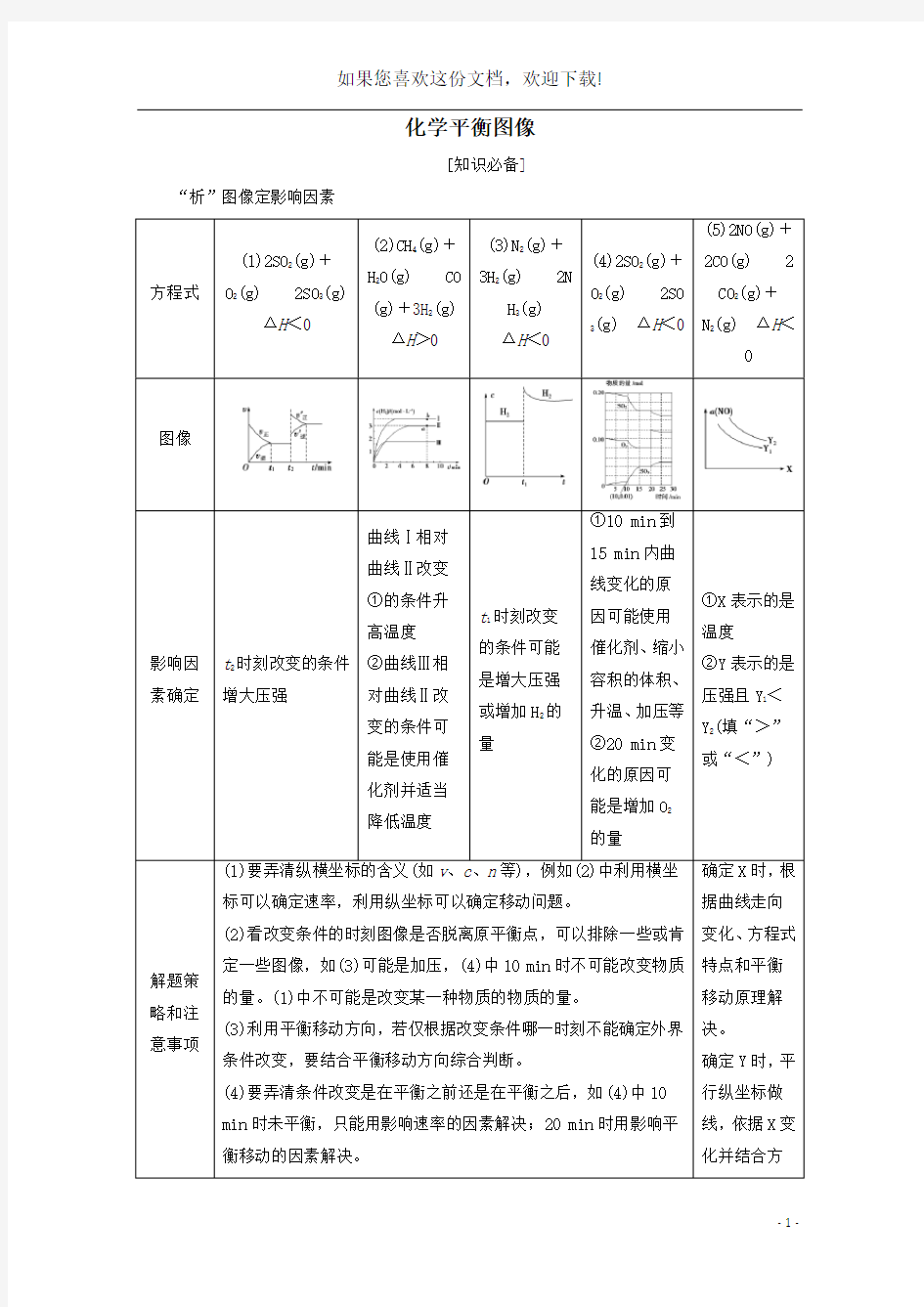
[知识必备] “析”图像定影响因素
方程式
(1)2SO2(g)+
O2(g)2SO3(g)
ΔH<0
(2)CH4(g)+
H2O(g)CO
(g)+3H2(g)
ΔH>0
(3)N2(g)+
3H2(g)2N
H3(g)
ΔH<0
(4)2SO2(g)+
O2(g)2SO
3(g) Δ
H<0
(5)2NO(g)+
2CO(g)2
CO2(g)+
N2(g) ΔH<
图像
影响因素确定t2时刻改变的条件
增大压强
曲线Ⅰ相对
曲线Ⅱ改变
①的条件升
高温度
②曲线Ⅲ相
对曲线Ⅱ改
变的条件可
能是使用催
化剂并适当
降低温度
t1时刻改变
的条件可能
是增大压强
或增加H2的
量
①10 min到
15 min内曲
线变化的原
因可能使用
催化剂、缩小
容积的体积、
升温、加压等
②20 min变
化的原因可
能是增加O2
的量
①X表示的是
温度
②Y表示的是
压强且Y1<
Y2(填“>”
或“<”)
解题策略和注意事项(1)要弄清纵横坐标的含义(如v、c、n等),例如(2)中利用横坐
标可以确定速率,利用纵坐标可以确定移动问题。
(2)看改变条件的时刻图像是否脱离原平衡点,可以排除一些或肯
定一些图像,如(3)可能是加压,(4)中10 min时不可能改变物质
的量。(1)中不可能是改变某一种物质的物质的量。
(3)利用平衡移动方向,若仅根据改变条件哪一时刻不能确定外界
条件改变,要结合平衡移动方向综合判断。
(4)要弄清条件改变是在平衡之前还是在平衡之后,如(4)中10
min时未平衡,只能用影响速率的因素解决;20 min时用影响平
衡移动的因素解决。
确定X时,根
据曲线走向
变化、方程式
特点和平衡
移动原理解
决。
确定Y时,平
行纵坐标做
线,依据X变
化并结合方
程式特点和平衡移动原理推测。
1.(全国Ⅱ)丙烯腈(CH 2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH 2=CHCHO)和乙腈(CH 3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C 3H 3N)和副产物丙烯醛(C 3H 4O)的热化学方程式如下:
①C 3H 6(g)+NH 3(g)+32O 2(g)===C 3H 3N(g)+3H 2O(g) ΔH = -515 kJ·mol -1
②C 3H 6(g)+O 2(g)===C 3H 4O(g)+H 2O(g) ΔH = -353 kJ·mol -1
两个反应在热力学上趋势均很大,其原因是_______________________________ ________________________________________________________________________; 有利于提高丙烯腈平衡产率的反应条件是________________________________;提高丙烯腈反应选择性的关键因素是________________________________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是________________________________________________________________________;
高于460 ℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。 A .催化剂活性降低 B .平衡常数变大 C .副反应增多 D .反应活化能增大
(3)丙烯腈和丙烯醛的产率与n (氨)/n (丙烯)的关系如图(b)所示。由图可知,最佳
n (氨)/n (丙烯)约为________,理由是________________________。进料气氨、空气、丙烯的
理
论
体
积
比
约
为
________________________________________________________________________
________________________________________________________________________。 解析:(1)因为两个反应均为放热量大的反应,所以热力学趋势大;该反应为气体体积增
大的放热反应,所以降低温度、降低压强有利于提高丙烯腈的平衡产率;由图b可知,提高丙烯腈反应选择性的关键因素是催化剂。
(2)因为该反应为放热反应,平衡产率应随温度升高而降低,反应刚开始进行,尚未达到平衡状态,460℃以前是建立平衡的过程,所以低于460℃时,丙烯腈的产率不是对应温度下的平衡产率;高于460℃时,丙烯腈产率降低,A.催化剂在一定温度范围内活性较高,若温度过高,活性降低,正确;B.平衡常数的大小不影响产率,错误;C.根据题意,副产物有丙烯醛,副反应增多导致产率下降,正确;D.反应活化能的大小不影响平衡移动,错误;答案选AC。
(3)根据图像可知,当n(氨)/n(丙烯)约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低;根据化学反应C3H6(g)+NH3(g)+ 3/2O2(g)===C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1∶1.5∶1的体积比加入反应达到最佳状态,而空气中氧气约占20%,所以进料氨、空气、丙烯的理论体积约为1∶7.5∶1。
答案:(1)两个反应均为放热量大的反应降低温度、降低压强催化剂
(2)不是该反应为放热反应,平衡产率应随温度升高而降低AC
(3)1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低1∶7.5∶1
2.在四个恒容密闭容器中按下表相应量充入气体,发生反应2N2O(g)2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图所示。下列说法正确的是( )
容器容积/L
起始物质的量/mol N2O N2O2
ⅠV10.1 0 0
Ⅱ 1.0 0.1 0 0
ⅢV30.1 0 0
Ⅳ 1.0 0.06 0.06 0.04
A.该反应的正反应放热
B.相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C.容器Ⅳ在470 ℃进行反应时,起始速率:v正(N2O)<v逆(N2O)
D.图中A、B、C三点处容器内总压强:p A(Ⅰ)<p B(Ⅱ)<p C(Ⅲ)
解析:D [根据图像,温度越高,N2O的平衡转化率越大,即平衡正向移动,说明该反应的正反应吸热,A错误。容器Ⅰ和容器Ⅱ在相同温度下,容器Ⅰ的转化率大,由反应是体积增
大的反应,容器Ⅰ的体积大于容器Ⅱ,相同温度下反应时间相同时,浓度大的反应速率小,故得v (Ⅰ)<v (Ⅱ),B 错误。470 ℃时,容器Ⅱ中N 2O 的平衡转化率为60%,平衡时的浓度c (N 2O)=0.04 mol·L -1
,c (N 2)=0.06 mol·L -1
,c (O 2)=0.03 mol·L -1
,平衡常数K =0.062
×0.030.04
2
=0.067 5,此时容器Ⅳ中Q c =0.062
×0.04
0.06
2
=0.04<0.067 5,故反应正向进行,起始反应速率;v 正(N 2O)>v 逆(N 2O),C 错误。三个恒容容器中N 2O 的起始物质的量相等,相同温度下,容器Ⅲ
中N 2O 的平衡转化率最小,因该反应气体体积增大,故容器Ⅲ的压强最大、体积最小,所以
V (Ⅰ)>1.0 L >V (Ⅲ),图中A 、B 、C 三点处N 2O 的平衡转化率相同,则温度越高压强越大,
故容器内总压强:p A (Ⅰ)<p B (Ⅱ)<p C (Ⅲ),D 正确。]
3.顺1,2二甲基环丙烷(g)和反1,2二甲基环丙烷(g)可发生如下转化:
该反应的速率方程可表示为v 正=k 正·c 顺和v 逆=k 逆·c 反,k 正和k 逆在一定温度时为常数,分别称作正、逆反应速率常数。T 1温度下,k 正=0.006,k 逆=0.002。下列说法错误的是( )
A .T 1温度下,反应的平衡常数K 1=3
B .该反应的活化能E a (正)小于E a (逆)
C .T 2温度下,图中表示顺式异构体的质量分数随时间变化的曲线为3号曲线
D .由图中信息可以确定此时的温度T 2低于T 1
解析:D [当反应达到平衡时,v 正=v 逆,即k 正·c 顺=k 逆·c 反,所以
c 反c 顺=k 正
k 逆
=3=K 1,A 正确;由于正反应是放热反应,所以正反应的活化能小于逆反应的活化能,B 正确;随着反应的不断进行,顺式异构体不断消耗,质量分数逐渐减小直至达到平衡状态,且顺式异构体质量分数的减小速率不断变小,C 正确;设顺式异构体的起始浓度为x mol·L -1
,则T 2温度下达平衡时,顺式异构体的浓度是0.3x mol·L -1
,反式异构体的浓度是0.7x mol·L -1
,则此时平衡常数K 2=7
3
<K 1,因正反应ΔH <0,所以T 2>T 1,D 错误。]
4.在某2 L 恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应: 2X(g)+Y(g)
3Z(g),反应过程中持续升高温度,测得混合体系中X 的体积分数与温
度的关系如图所示。下列推断正确的是( )
A.M点时,Y的转化率最大
B.升高温度,平衡常数减小
C.平衡后充入Z,达到新平衡时Z的体积分数增大
D.W、M两点Y的正反应速率相等
解析:B [由图可知,Q点φ(X)最小,此后升高温度,φ(X)逐渐增大,说明升高温度,平衡逆向移动,则ΔH<0,故Q点Y的转化率最大,A错误;升高温度,平衡逆向移动,平衡常数K值减小,B正确;平衡后充入Z,与保持n(Z)不变,缩小容器的容积是等效平衡,而该反应为反应前后气体分子总数不变的反应,缩小容积、增大压强时,平衡不移动,故达到新平衡时Z的体积分数不变,C错误;温度越高,反应速率越大,由于温度:M>W,则正反应速率:M>W,D错误。]
5.一定条件下合成乙烯:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。下列说法中正确的是( )
A.M点的正反应速率v正大于N点的逆反应速率v逆
B.若投料比n(H2):n(CO2)=4∶1,则图中M点乙烯的体积分数为5.88%
C.250 ℃时,催化剂对CO2平衡转化率的影响最大
D.当温度高于250 ℃,升高温度,平衡逆向移动导致催化剂的催化效率降低
解析:B [M点温度低于N点,M点的正反应速率v正小于N点的逆反应速率v逆,A错误;投料比n(H2):n(CO2)=4∶1,设起始时n(H2)=4 mol,n(CO2)=1 mol,M点CO2的平衡转化率为50%,列三段式:
6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)
起始/mol 4 1 0 0
转化/mol 1.5 0.5 0.25 1
平衡/mol 2.5 0.5 0.25 1
M点乙烯的体积分数=0.25
2.5+0.5+0.25+1
×100%≈5.88%,B正确;催化剂只影响反应速率,不影响化学平衡移动,C错误;催化剂的催化效率与平衡移动无关,250 ℃时催化剂活性
最高,催化效率最高,D错误。]
6.在容积均为1.0 L的两个恒容密闭容器中加入足量的相同质量的固体B,再分别加入0.1 mol A和0.2 mol A,在不同温度下反应A(g)+B(s)2C(g)达到平衡,平衡时A的物质的量浓度c(A)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
A.反应A(g)+B(s)2C(g) ΔS>0、ΔH<0
B.A的转化率:α(Ⅱ)>α(Ⅲ)
C.体系中c(C):c(Ⅱ)>c(Ⅲ)
D.化学平衡常数:K(Ⅰ)=K(Ⅲ)>K(Ⅱ)
解析:C [反应A(g)+B(s)2C(g)的正反应是气体分子总数增加的反应,则有ΔS>0;由图可知,起始反应物的量一定时,平衡时A的物质的量浓度c(A)随温度的升高而降低,说明升高温度,平衡正向移动,则有ΔH>0,A错误。温度一定时,增加A(g)的量,平衡正向移动,由于该反应为气体分子数增大的反应,其转化率降低,则A的转化率:α(Ⅱ)<α(Ⅲ),B错误。增加A(g)的量,反应正向进行,体系中c(C)增大,故体系中c(C):c(Ⅱ)>c(Ⅲ),C正确。平衡常数只与温度有关,温度升高,平衡正向移动,则平衡常数增大,故化学平衡常数:K(Ⅰ)<K(Ⅲ)=K(Ⅱ),D错误。]
7.某温度下,向1 L固定容积的容器中充入2 mol A和4 mol B,发生如下反应:A(g)+2B(g)C(g)+x D(g) ΔH=-a kJ·mol-1(a>0)。反应过程中测得气体B的物质的量浓度变化如图所示。已知,反应进行到8 min时达到平衡状态,若平衡后再降低温度,混合气体的平均相对分子质量将增大,则:
(1)0~8 min内的化学反应速率v(A)=___________________________________。
(2)该反应中,化学计量数x=________(x为正整数)。
(3)下列说法中表明该反应达到平衡状态的是________(填字母)。
A .v (A)∶v (B)=1∶2
B .容器内压强保持不变
C .v 正(B)=2v 逆(C)
D .混合气体的密度不再改变
(4)若在10 min 时,将容器扩大到2 L ,则气体B 的变化曲线为________(填小写字母)。 (5)若10 min 时,保持温度不变,往该平衡体系中再加入A 、B 、C 、D 各1 mol ,则此时该反应的v 正(A)________(填“>”“<”或“=”)v 逆(A)。
解析:(1)由图可知,0~8 min 内c (B)由4 mol·L -1
降低到2 mol·L -1
,则有v (B)=4-2 mol·L -1
8 min =0.25 mol·L -1·min -1
,化学反应速率之比等于化学计量数之比,则v (A)
=12v (B)=12
×0.25 mol·L -1·min -1=0.125 mol·L -1·min -1
。 (2)正反应为放热反应,8 min 时达到平衡状态,平衡后再降低温度,平衡正向移动,混合气体的平均相对分子质量增大,说明该反应的正反应是气体总分子数减少的反应,则有1+2>1+x ,又知x 为正整数,故x =1。
(3)题目未指明v (A)、v (B)代表的反应方向,仅根据v (A)∶v (B)=1∶2不能判断反应是否达到平衡状态,A 错误;未达到平衡时,反应过程中气体总物质的量及压强不断变化,当容器内压强不变时,说明反应达到平衡状态,B 正确;v 正(B)代表正反应速率,v 逆(C)代表逆反应速率,当v 正(B)=2v 逆(C)时,说明反应达到平衡状态,C 正确;反应中容器容积不变,气体总质量不变,则气体的密度始终不变,故不能根据密度判断反应是否达到平衡状态,D 错误。
(4)10 min 时,将容器扩大到2 L ,容器内各气体的浓度瞬间均减小到原来的一半,显然曲线a 、b 错误;容器的容积扩大,压强减小,平衡向气体分子数增大方向即逆向移动,则c (B)逐渐增大,故曲线c 符合题意。
(5)根据8 min 平衡时各物质的浓度计算平衡常数:
A(g)+2B(g)
C(g)+D(g)
起始浓度/(mol·L -1
) 2 4 0 0 转化浓度/(mol·L -1
) 1 2 1 1 平衡浓度/(mol·L -1) 1 2 1 1 则该温度下反应的平衡常数K =
c C ·c D c A ·c 2
B =1×122×1=1
4
。 10 min 时在平衡体系中再加入A 、B 、C 、D 各1 mol ,此时浓度商Q c =c C ·c D
c A ·c 2B
=
2×232
×2=29<K =1
4
,则平衡正向移动,故有v 正(A)>v 逆(A)。 答案:(1)0.125 mol·L -1
·min -1
(2)1 (3)BC (4)c (5)>
