胰腺肿瘤分类

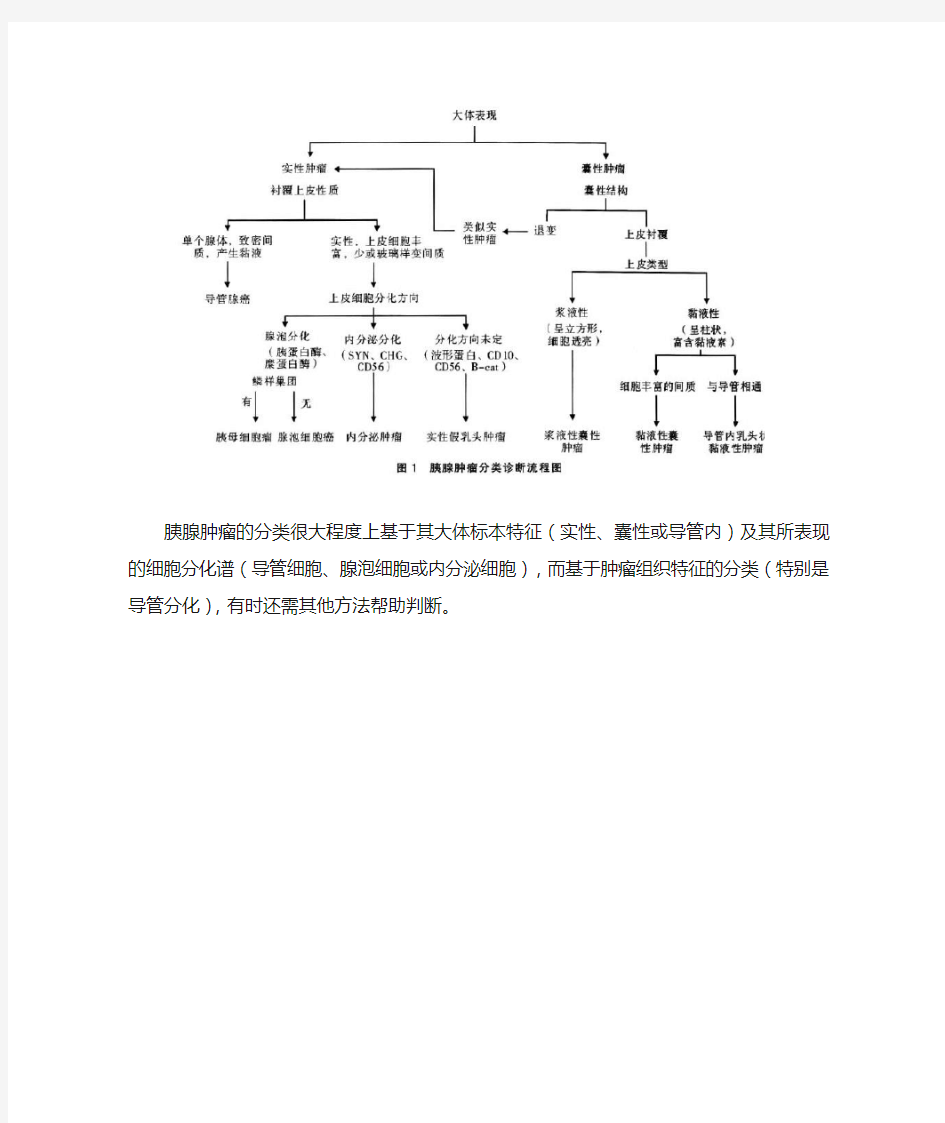
胰腺肿瘤的分类很大程度上基于其大体标本特征(实性、囊性或导管内)及其所表现的细胞分化谱(导管细胞、腺泡细胞或内分泌细胞),而基于肿瘤组织特征的分类(特别是导管分化),有时还需其他方法帮助判断。
NCCN胰腺癌指南2016.2版
NCCN胰腺癌指南2016.2版 编译者:黄志锋
目录 ?临床怀疑胰腺癌或存在胰管和或胆管扩张(PANC-1) ?体格检查和影像检查未发现转移(PANC-2) ?可手术切除,检查、治疗(PANC-3) ?交界性切除、无转移,计划新辅助治疗(PANC-4) ?交界性切除、无转移,计划切除(PANC-5) ?术后辅助治疗(PANC-6) ?局部进展、不可切除,检查(PANC-7) ?局部进展、不可切除,一线、二线治疗(PANC-8) ?转移性病变(PANC-9) ?切除后复发(PANC-10) ?诊断,影像检查和分期原则(PANC-A) ?胰腺癌放射检查报告模板(PANC-A,5/8) ?可切除的标准定义(PANC-B) ?外科手术原则(PANC-C) ?病理分析:样本取材,组织切片和报告(PANC-D) ?姑息治疗和支持治疗原则(PANC-E) ?放射治疗原则(PANC-F) ?化疗原则(PANC-G) ?美国癌症联合委员会(AJCC)胰腺癌TNM分期(2010)(ST-1)
临床怀疑胰腺癌或存在胰管和或胆管扩张(PANC-1) 注解: a.对于年轻、有癌症家族史的患者,如果诊断为胰腺癌,建议行遗传咨询。 b.理想的多学科评估应该包括影像科、介入内镜科、肿瘤科、放疗科、外科和病理科的专家。 c.如果临床有指征,行超声内镜引导下细针穿刺吸取活检术(EUS-FNA)。 体格检查和影像检查未发现转移(PANC-2) 注解: d CA19-9升高不一定表示癌症或进展性疾病。CA19-9可由于胆道感染(胆管炎),炎症或阻塞,良性或恶性疾病而升高。此外,在Lewis抗原阴性个体中可能检测不到CA19-9。 e见诊断,影像检查和分期原则(PANC-A)。 f见可切除的标准定义(PANC-B)。 g见手术原则(PANC-C)和病理分析:样本取材,组织切片和报告(PANC-D)。 h自体膨胀金属支架用于临床有合并症患者或外科手术可能被推迟的患者。 可手术切除,检查、治疗(PANC-3) 注解: i对于肿瘤明显可切除并且不具有高风险特征的肿瘤患者,仅在临床试验中推荐新辅助治疗。对于具有高风险特征的患者(即,非常高度升高的CA19-9,大的原发性肿瘤,大的局部淋巴结,过度的体重减轻,极度疼痛),可以考虑新辅助化疗,新辅助化疗前需要活检明确诊断是腺癌(参见PANC-4)。可接受的新辅助方案包括FOLFIRINOX或吉西他滨+白蛋白-结合型紫杉醇。有时后续还可能需要放化疗。大多数NCCN成员机构推荐新辅助治疗。
2020版胰腺癌新辅助治疗指南
2020版胰腺癌新辅助治疗指南 胰腺癌是病死率较高的消化系统肿瘤之一,外科手术技术的进步并未带来患者预后的明显改善。《中国胰腺癌新辅助治疗指南(2020版)》南基于GRADE 系统,针对胰腺癌新辅助治疗的应用指征、方案选择、疗效评估及其相关病理学诊断、手术策略等热点问题展开讨论,对现有临床研究的证据等级量化评估并提出推荐意见,以指导并促进胰腺癌新辅助治疗的临床实践。 主要推荐意见 推荐意见1:拟行新辅助治疗的胰腺癌患者常规进行多学科综合治疗协作组(MDT)讨论,MDT模式应贯穿新辅助治疗全程(证据等级:低;推荐程度:强) 推荐意见2:新辅助治疗能否提高可切除胰腺癌(RPC)患者的R0切除率及总体生存率仍有争议,提倡开展高质量临床研究(证据等级:高;推荐程度:强)。 推荐意见3:对于、临界可切除胰腺癌(BRPC)患者,新辅助治疗有助于提高R0切除率,改善患者预后(证据等级:高;推荐程度:强)。
推荐意见4:新辅助治疗能够使部分局部进展期胰腺癌(LAPC)患者肿瘤降期,获得手术切除机会,进而改善预后(证据等级:中;推荐程度:强) 推荐意见5:胰腺癌新辅助治疗前应经细胞学或组织学明确诊断(证据等级:低;推荐强度:强)。 推荐意见6:合并胆道梗阻的患者应在新辅助治疗前进行胆道引流,可选择自膨胀金属覆膜胆道支架,但对于切除可能性较大、术前等待时间较短的患者优先选择塑料胆道支架(证据等级:中;推荐强度:强)。 推荐意见7:不推荐对所有RPC患者常规开展新辅助治疗,合并高危因素的RPC患者可行新辅助治疗(证据等级:中;推荐强度:弱)。 推荐意见8:RPC患者可接受2~4周期的新辅助治疗,美国东部肿瘤协作组(ECOG)评分≤1分的患者可采用联合治疗方案,ECOG评分≤2分的患者可采用以吉西他滨为基础的单药化放疗方案(证据等级:低;推荐强度:弱)。 推荐意见9:对于ECOG评分≤2分的BRPC患者,均应接受新辅助治疗(证据等级:强;推荐程度:强)。
NCCN胰腺癌外科治疗指南解读_百替生物
NCCN胰腺癌外科治疗指南解读 张太平,肖剑春,赵玉沛 (中国医学科学院北京协和医院外科,北京100730) 胰腺癌是一种恶性程度极高的消化系统肿瘤,其发病率在全球范围内逐年上升。2009年美国胰腺癌新发病例数42470例,死亡病例数35240例,在恶性肿瘤死亡率中居第四位,5年生存率<5%[1]。我国胰腺癌发病率也有逐年增长的趋势。根治性手术切除是胰腺癌综合治疗的核心,也是胰腺癌患者获得长期生存的唯一希望,目前胰腺癌根治术后5年生存率可达15%~25%。近年来大的医疗中心胰头十二指肠切除术的死亡率已经<5%[2],胰腺癌的外科治疗取得了一定的进展,本文结合最新的NCCN指南,就其外科治疗的关键问题加以讨论,以期进一步规范胰腺癌的外科治疗。 1根治性手术可切除性标准 根治性手术切除是延长胰腺癌患者生存时间的最有效治疗方式,然而胰腺癌发病隐蔽、进展快、恶性度高、早期诊断率低,80%以上的患者在诊断时已经无法接受根治性手术[3]。因此术前评估肿瘤范围及可切除性极为重要,近来有meta分析指出多排螺旋三维重建CT预测肿瘤可切除性的准确率在52%~96%,不可切除的准确率为90%~100%,是评估胰腺癌术前可切除性的最佳方法[4],除此之外超声内镜、PET、腹腔镜、腹腔镜超声等也是胰腺癌可切除性评估的重要方法。2009年胰腺癌NCCN 指南中定义可切除性胰腺癌为:肿瘤无远处转移;与腹腔干和肠系膜上动脉(SMA)周围有清晰的脂肪层;且肠系膜上静脉(SMV)/门静脉清晰可见。将不可切除的胰腺癌分别定义为:1胰头癌:肿瘤有远处转移、围绕SMA大于180度、侵犯腹腔干(任何度数)、SMV/门静脉闭塞且无法重建或者肿瘤侵犯围绕腹主动脉;2胰体癌:肿瘤有远处转移、围绕SMA或腹腔干大于180度、SMV/门静脉闭塞且无法重建或者侵犯腹主动脉;3胰尾癌:肿瘤有远处或者转移围绕SMA或腹腔干大于180度;4淋巴结状态:淋巴结转移范围超出手术所能切除范围。[5]国内在2007版胰腺癌诊治指南中对胰腺癌可切除性标准也有相应定义。[6]然而目前并无一致公认的胰腺癌可切除标准,在实际工作中上述判断还受其它因素如影像学检查的准确率、术者的经验及手术团队的专业性等影响,尽管如此能否获得R0切除应是胰腺癌可切除性评估的重点。 2可能切除性胰腺癌 在可切除和不可切除胰腺癌之间存在“灰色地带”即可能切除性胰腺癌。[7]2009年胰腺癌NCCN 指南定义可能切除性胰腺癌为:严重的单侧或双侧的SMV/门静脉侵犯;肿瘤围绕SMA小于180度;肿瘤围绕或包裹肝动脉,但可以重建;SMV闭塞,但受累部分很短可以重建。[5]可能切除性胰腺癌成功进行R0切除风险较大,因此术前应先接受包括全身化疗和放化疗的新辅助治疗后再评估其可切除性,决定患者下一步治疗方案。M.D.Anderson癌症中心回顾分析了该中心1999年至2006年中160例诊断为可能切除的胰腺癌患者,其中125例进行了新辅助治疗。经过可切除性再评估,66例进行了根治性手术其中62例患者获得了R0切除。手术患者中位生存期40月,非手术患者中位生存期13月两者具有统计学差异(P<0.001)。[8]该中心还通过非随机Ⅱ期临床实验发现新辅助治疗增加了胰腺癌的R0切除率[9]。有meta分析(总结1966-2009年111项临床研究共4394例患者)显示经新辅助治疗大约1/3可能切除患者可以获得根治性手术切除,术后患者生存时间和可切除患者无差异。[10]由此可见血管受累并非胰腺癌手术的绝对禁忌症,临床中应重视可能切除的胰腺癌患者,积极进行新辅助治疗以期获得R0切除。然而目前新辅助治疗的具体疗程和方案还并未统一[11-13]因此还期待更多临床研究。 3是否术前胆道引流 大约70%胰头癌患者以梗阻性黄疸为首发症状[19],有研究认为黄疸增加了手术的并发症因此建议术前经皮穿刺或者内镜下进行胆道引流。[14-16]然而这一观点备受争论,有meta分析认为术前减黄反而增加了手术并发症并且延长了患者住院时间增加了住院费用。[17-18]但限于这些分析所基于的临床研究严谨性有待提高,所以结果的可信度受到置疑。近来新英格兰杂志发表了一篇多中心前瞻性随
【免费下载】胰腺癌诊疗指南
胰腺癌诊治指南(2009版) 胰腺癌诊治指南 复旦大学附属肿瘤医院 肝、胆、胰综合治疗组 1、诊断和诊断流程 病史和体格检查 首先应详细询问病史,包括家族史、饮食史,慢性胰腺炎、糖尿病史等。 对于表现为阻塞性黄疸、难以解释的体重减轻(超过正常体重的10%)、不明原因上腹痛或腰背痛、近期出现不能解释的消化不良而胃肠道常规检查正常、突发糖尿病而又无肥胖及糖尿病家族史者、突发无法解释的腹泻、自发性的胰腺炎发作等表现者要警惕胰腺癌的可能。 实验室检查 主要是检测血清肿瘤标志物CA19-9和CA242,CA19-9在诊断胰腺癌的灵敏度较高,CA242的特异性优于CA19-9。 必须检查项目:CEA、CA19-9、CA50、CA242。 特殊检查 B超是胰腺癌的首选无创性检查。 对于B超发现有异常者或者显示不清者应进一步进行CT或MRI检查,可进一步显示胰腺肿块的位置、大小、密度以及有无胰管和(或)胆管扩张、病灶的局部浸润、淋巴结转移情况以及是否伴有肝转移。对于CT/MRI诊断不能明确的可考虑行ERCP。 病理学诊断 主要包括 (1)US、CT引导的细针穿刺活检; (2)EUS; (3)腹腔镜及术中活检; (4)胰液及十二指肠引流液; (5)腹腔冲洗液及腹水。 不可切除的胰腺癌在放化疗前必须取得病理学诊断
胰腺癌诊治指南(2009版) 诊断流程图 诊断流程图2、临床分期 采用TNM 分期(AJCC ,2002)原发肿瘤(T ) 胰腺癌TNM 分期(AJCC ,2002) 原发肿瘤(T )Tx 原发肿瘤不能确定;T0 无原发肿瘤证据; Tis 原位癌。 T1 肿瘤局限于胰腺内,最大径≤2cm T2 肿瘤局限于胰腺内,最大径>2cm T3 肿瘤超出胰腺,未累及腹腔轴或肠系膜上动脉 B 超 、CA242 检测 随访 病理诊断成立 病理诊断不成立 再次取病检 随访
胰腺癌综合诊治指南(最新知识点)
胰腺癌综合诊治指南胰腺癌综合诊治指南(2018 版) 中国抗癌协会胰腺癌专业委员会胰腺癌发病呈快速上升趋势.2017年美国癌症协会发布的数据显示,美国胰腺癌新发病例数男性列第11位、女性列第8位,居恶性肿瘤死亡率第4位.中国国家癌症中心最新统计数据也显示,胰腺癌位列中国城市男性恶性肿瘤发病率的第8位,居大城市(北京、上海)人群恶性肿瘤死亡率的第5位. ...感谢聆听... 胰腺癌的诊治现状不容乐观,但在肿瘤学新理念的推动下临床诊疗水平近年取得明显进步: (1)多学科协作诊疗模式(Multidisciplina ry Team,MDT)得到普及,由多学科专家根据肿瘤临床及分子生物学特征,结合病人体能状况制定出个体化治疗方案,贯穿诊疗全程. (2)高通量测序技术联合系统生物学分析对胰腺癌进行分子分型,同时结合皮下或原位移植瘤动物模型(Patient—Derived Xenograft Mod
el,PDX模型)开展药物敏感性的临床前研究,为胰腺癌“个体化诊疗"提供线索。 (3)临床试验的开展和多中心跨区域合作为胰腺癌新药研发和治疗方案的优化提供了高级别循证医学证据,为改善病人预后提供参考。 为此,中国抗癌协会胰腺癌专业委员会结合中国国情制定了《胰腺癌综合诊治指南(2018版)》,以期规范和提高我国胰腺癌诊治水平。 1.胰腺癌的诊断: 胰腺癌起病隐匿,早期症状不典型,常表现为上腹部不适、腰背部痛、消化不良或腹泻等,易与其他消化系统疾病相混淆。病人食欲减退,体重下降,出现症状时大多已属中晚期. 1.1胰腺癌危险因素的筛选: (1)长期吸烟、高脂饮食、体重指数超标、过量饮酒、伴发糖尿病或慢性胰腺炎等是胰腺癌发病的危险因素。 (2)CDKN2A、BRCA1/2、PALB2等基因突变被证实与家族性胰腺癌发病密切相关。 1。2实验室检查: (1)糖类抗原CA19-9是目前最常用的胰腺癌诊断标记,具有以下临床特征:
胰腺癌临床实践指南2010
胰腺癌 一诊断和分期原则 1 关于诊断性治疗和肿瘤可切除性的判断应该由多学科医生共同决定,并参照合理的影像检查来判断肿瘤的范围。胰腺癌切除术应该由每年至少能进行15~20例胰腺切除术的治疗机构进行。 2 影像学检查应包括胰腺CT扫描。应依据规定的胰腺专用规程进行扫描,比如三期断层成像加薄层扫描。 3 如果CT结果模棱两可,可考虑PET扫描。 4 在分期方面,内镜超声检查(EUS)可作为CT的补充手段。 5 对于肿瘤可切除的患者,EUS引导下的细针穿刺(FNA)活检优于CT引导下的FNA,因为EUS-FNA相当于经皮方式活检的腹膜播种风险更低。当临床高度怀疑胰腺癌时,手术前并不一定需要获得恶性的活检结果而且非诊断性的活检也不应该延误手术时机。 6 在一些治疗机构中,诊断性分期腹腔镜手术被常规在术前或花放疗前用于排除放射学检查无法发现的转移灶(尤其是胰体和胰尾的病灶),或是在一些有更高肿瘤播散风险的患者(肿瘤有可能切除、显著增高的CA19-9或原发肿瘤较大)中选择性地使用。 7 剖腹手术或腹腔镜手术中腹腔冲洗液的细胞学阳性结果等同于M1。如果患者已经接受了切除手术,应该按照M1肿瘤进行治疗。 8 重视胰腺癌高危人群的筛查工作,建立胰腺癌诊治绿色通道,优化诊治流程。 二胰腺癌可切除的判定标准 可切除 胰头/胰体/胰尾 无远处转移 腹腔干和肠系膜上动脉周围有清晰的脂肪层 肠系膜上静脉/门静脉通畅
有可能切除 胰头/胰体 严重的单侧或双侧肠系膜上静脉/门静脉侵犯 肿瘤围绕腹腔干小于180o(适用于胰体) 肿瘤围绕肠系膜上动脉小于180o 肿瘤围绕或包裹肝动脉,但可以重建 肠系膜上静脉闭塞,但仅一小段受累,而且可以重建 胰尾 肿瘤围绕肠系膜上动脉或腹腔干小于180o 无法切除 胰头 有远处转移 肿瘤围绕肠系膜上动脉大于180o,或侵犯腹腔干(任何度数)肠系膜上静脉/门静脉闭塞且无法重建 肿瘤侵犯或围绕腹主动脉 胰体 有远处转移 肿瘤围绕肠系膜上动脉或腹腔干大于180o 肠系膜上静脉/门静脉闭塞且无法重建 肿瘤侵犯腹主动脉 胰尾 有远处转移 肿瘤围绕肠系膜上动脉或腹腔干大于180o 淋巴结状态 淋巴结转移范围超出手术所能切除范围视作不可切除 三姑息和支持治疗原则 治疗目的:预防并缓解痛苦,同时保证获得理想的生活质量
胰腺癌诊断治疗标准
胰腺癌规范化诊治指南 (试行) 一、范围 本标准规定了胰腺癌的诊断依据、诊断、鉴别诊断、治疗原则和治疗方案。 本指南适用于具备相应资质的市、县级常见肿瘤规范化诊疗试点医院及其医务人员对胰腺癌的诊断和治疗。 二、术语和定义 下列术语和定义适用于本标准。 胰腺癌pancreatic cancer:癌症发生于胰腺组织者,称为胰腺癌 胰头癌:发生于肠系膜上静脉与门静脉交汇处右侧的胰腺癌,为胰头癌。钩突是胰头的一部分。 胰体癌:发生于肠系膜上静脉与门静脉交汇处与腹主动脉之间的胰腺癌,为胰体癌。 胰尾癌:发生于腹主动脉与脾门之间的胰腺癌,为胰尾癌。 全胰癌:肿瘤部位超过2个区域的胰腺癌,为全胰癌。 三、缩略语 下列缩略语适用于本标准。
CEA(carcino-embryonic antigen) :癌胚抗原,是大肠癌组织产生的一种糖蛋白,作为抗原引起患者的免疫反应。CEA 可广泛存在于内胚叶起源的消化系统癌,也存在于正常胚胎的消化管组织中,在正常人血清中也可有微量存在。对大肠癌、乳腺癌、胰腺癌和肺癌的疗效判断、病情发展、监测和预后估计是一个较好的肿瘤标志物,但其特异性不强,灵敏度不高,对肿瘤早期诊断作用不明显。 CA19-9 (carbohydrate antigen 19-9) :是一种粘蛋白型的糖类蛋白肿瘤标志物,为细胞膜上的糖脂质,因由鼠单克隆抗体116NS19-9识别而命名,是迄今报道的对胰腺癌敏感性最高的标志物。在血清中它以唾液粘蛋白形式存在,分布于正常胎儿胰腺、胆囊、肝、肠和正常成年人胰腺、胆管上皮等处,是存在于血液循环的胃肠道肿瘤相关抗原。 CA24-2:是一种唾液酸化的粘蛋白型糖类抗原,人体正常组织中含量很少,甚至没有。发生恶性肿瘤时,肿瘤组织和血清中其含量可升高,胰腺癌和结直肠癌时尤为明显。作为一种新的肿瘤标志物,CA242的优点主要在于其特异性较高,即在恶性肿瘤时升高明显,而良性疾病时一般不升高,且具有独立预示价值,可作为胰腺癌和结肠癌校好的肿瘤标志物,其灵敏度与CA19-9相仿,有报道其特异性、诊断效率则优于CA19-9。 四、诊治流程
胰腺癌综合诊治指南2018版
胰腺癌综合诊治指南(2018版) 中国抗癌协会胰腺癌专业委员会 胰腺癌发病呈快速上升趋势。2017年美国癌症协会发布的数据显示,美国胰腺癌新发病例数男性列第11位、女性列第8位,居恶性肿瘤死亡率第4位。中国国家癌症中心最新统计数据也显示,胰腺癌位列中国城市男性恶性肿瘤发病率的第8位,居大城市(北京、上海)人群恶性肿瘤死亡率的第5位。 胰腺癌的诊治现状不容乐观,但在肿瘤学新理念的推动下临床诊疗水平近年取得明显进步: (1)多学科协作诊疗模式(Multidisciplinary Team,MDT)得到普及,由多学科专家根据肿瘤临床及分子生物学特征,结合病人体能状况制定出个体化治疗方案,贯穿诊疗全程。(2)高通量测序技术联合系统生物学分析对胰腺癌进行分子分型,同时结合皮下或原位移植瘤动物模型(Patient-Derived Xenograft Model,PDX模型)开展药物敏感性的临床前研究,为胰腺癌“个体化诊疗”提供线索。 (3)临床试验的开展和多中心跨区域合作为胰腺癌新药研发和治疗方案的优化提供了高级别循证医学证据,为改善病人预后提供参考。 为此,中国抗癌协会胰腺癌专业委员会结合中国国情制定了《胰腺癌综合诊治指南(2018版)》,以期规范和提高我国胰腺癌诊治水平。 1.胰腺癌的诊断: 胰腺癌起病隐匿,早期症状不典型,常表现为上腹部不适、腰背部痛、消化不良或腹泻等,易与其他消化系统疾病相混淆。病人食欲减退,体重下降,出现症状时大多已属中晚期。 1.1胰腺癌危险因素的筛选: (1)长期吸烟、高脂饮食、体重指数超标、过量饮酒、伴发糖尿病或慢性胰腺炎等是胰腺
癌发病的危险因素。 (2)CDKN2A、BRCA1/2、PALB2等基因突变被证实与家族性胰腺癌发病密切相关。 1.2实验室检查: (1)糖类抗原CA19-9是目前最常用的胰腺癌诊断标记,具有以下临床特征: ① 血清CA19-9 > 37 U/ml作为阳性指标,诊断胰腺癌的灵敏度和特异度分别达到78.2%和82.8%9。 ② 约10%胰腺癌病人呈Lewis抗原阴性,CA19-9不升高,此时需结合其他肿瘤标记物如CA125和/或癌胚抗原(CEA)等协助诊断。 ③ 发现CA19-9升高者,排除胆道梗阻或胆系感染等因素后则高度怀疑胰腺癌。 (2)血糖变化也与胰腺癌发病或进展有关: ① 老年、低体重指数、无糖尿病家族史的新发糖尿病者,应警惕胰腺癌的发生。 ② 既往长期罹患糖尿病,短期出现血糖波动且难以控制者,亦应警惕胰腺癌的发生。 ③ 前瞻性研究显示空腹血糖每升高0.56 mmol/L,胰腺癌发病风险增加14%。 (3)其它诸多生物靶标如外周血内microRNA、ctDNA、外泌体内Glypican-1等也具有潜在临床应用前景,尚待高级别循证医学证据的证实。 1.3影像学检查: 影像学技术诊断胰腺癌的基本原则为:①完整(显示整个胰腺);②精细(层厚1~3 mm 的薄层扫描) ;③动态(动态增强、定期随访) ;④立体(多轴面重建,全面了解毗邻关系)。(1)增强三维动态CT薄层扫描是目前诊断胰腺癌最常用的手段,能清晰显示肿瘤大小、位置、密度及血供情况,并依此判断肿瘤与血管(必要时采用计算机断层血管成像,Computed Tomography Angiography,CTA)、邻近器官的毗邻关系,指导术前肿瘤的可切除性及新辅助化疗疗效评估。
《胰腺癌诊治指南》解读
《胰腺癌诊治指南》解读 六安市人民医院普外科徐皓 前言 随着普通外科的发展,胰腺癌的外科治疗越来越被重视,胰十二指肠切除术已在各级医院得到开展,然而疗效并不满意,手术方式、围手术期的治疗尚无统一标准。为规范手术方式,提高胰腺癌病人的疗效,便于交流和总结,中华医学会外科学会胰腺外科学组,于2007年7月制定了《中国胰腺癌诊治指南》,希望为我国胰腺癌治疗的整体水平做出贡献。 阅读《胰腺癌的指南》 NCCN共识分类 1类:基于高水平的证据,NCCN达成共识,认为该建议是合适的。 2A类:基于包括临床经验在内的低水平证据,NCCN达成共识,认为该建议是合适的。 2B类:基于包括临床经验在内的低水平证据,NCCN在该建议的适宜性意见不一致,但无较大分歧。 3类:NCCN对该建议的适宜性存在较大分歧,除非特别指出,NCCN对所有建议均达成2A共识。 一、概述 胰腺癌是一种恶性程度极高的消化系统肿瘤,其发病率在全球范围内逐年上升。2009年,美国胰腺癌新发病例数为42470例,死亡病例数为35240例,在恶性肿瘤死亡率中居第四位,五年生存率小于5%。我国胰腺癌发病率也呈逐年增长趋势。2003年北京协和陆星华报告1991年-2000年全国疾病监测点人群大规模流行病学调查报告,结果提示胰腺癌的死亡率由1991年的1.83%增至2000年2.26%,呈逐年上升性趋势,其在肿瘤死因中的位次波动于第7-8位,地区分布差异明显,东北和华北高于其他地区,城市高于农村,这是我们比较完整的胰腺癌大规模流行病学调查。 根治性手术切除是胰腺癌综合治疗的核心,也是胰腺癌患者获得长期生存的唯一希望,目前胰腺癌根治术后五年生存率可达15%~25%。近年来,大医疗中心接受胰头十二指肠切除术患者的死亡率已<5%,胰腺癌的外科治疗取得了一定进展。 二、诊断和鉴别诊断 Ⅰ.高危人群 (1)年龄大于40岁,有上腹部非特异性不适。Elli等报告早期症状体重下降79%, 腹痛56%,厌食28%,黄疸25%,乏力23%。 (2)有胰腺癌家族史。 (3)突发糖尿病,年龄>60岁,无肥胖及糖尿病家族史。 (4)慢性胰腺炎患者,特别是慢性家族性胰腺炎和慢性钙化性胰腺炎。 (5)导管内乳头状粘液瘤,属癌前病变。 (6)患有家族性腺瘤息肉病者。 (7)良性病变行远端胃大部切除术,特别是术后20年以上的人群。 (8)胰腺癌的高危因素为长期吸烟、酗酒以及长期接触有害化学物质等。 Ⅱ.现有诊断方法的选择 胰腺癌的主要症状包括消化不良、恶心、体重减轻、黄疸、脂肪泻、疼痛、
胰腺癌诊治指南-复旦大学附属肿瘤医院
胰腺癌诊治指南 复旦大学附属肿瘤医院 肝、胆、胰综合治疗组 1、诊断和诊断流程 病史和体格检查 首先应详细询问病史,包括家族史、饮食史,慢性胰腺炎、糖尿病史等。 对于表现为阻塞性黄疸、难以解释的体重减轻(超过正常体重的10%)、不明原因上腹痛或腰背痛、近期出现不能解释的消化不良而胃肠道常规检查正常、突发糖尿病而又无肥胖及糖尿病家族史者、突发无法解释的腹泻、自发性的胰腺炎发作等表现者要警惕胰腺癌的可能。 实验室检查 主要是检测血清肿瘤标志物CA19-9和CA242,CA19-9在诊断胰腺癌的灵敏度较高,CA242的特异性优于CA19-9。 必须检查项目:CEA、CA19-9、CA50、CA242。 特殊检查 B超是胰腺癌的首选无创性检查。 对于B超发现有异常者或者显示不清者应进一步进行CT或MRI检查,可进一步显示胰腺肿块的位置、大小、密度以及有无胰管和(或)胆管扩张、病灶的局部浸润、淋巴结转移情况以及是否伴有肝转移。对于CT/MRI诊断不能明确的可考虑行ERCP。 病理学诊断 主要包括 (1)US、CT引导的细针穿刺活检; (2)EUS; (3)腹腔镜及术中活检; (4)胰液及十二指肠引流液; (5)腹腔冲洗液及腹水。 不可切除的胰腺癌在放化疗前必须取得病理学诊断
诊断流程图 诊断流程图 上腹痛、黄疸、体重减轻 B超+CA19-9、CA242检测 CT/MRI 异常无异常 胰腺癌初步确立随访 穿刺/术中取组织 病理诊断成立病理诊断不成立 再次取病检随访 2、临床分期 采用TNM分期(AJCC,2002) 原发肿瘤(T) 胰腺癌TNM分期(AJCC,2002) 原发肿瘤(T) Tx 原发肿瘤不能确定;T0 无原发肿瘤证据;Tis 原位癌。 T1 肿瘤局限于胰腺内,最大径≤2cm T2 肿瘤局限于胰腺内,最大径>2cm T3 肿瘤超出胰腺,未累及腹腔轴或肠系膜上动脉
2020版:《中国胰腺癌新辅助治疗指南》解读
2020版:《中国胰腺癌新辅助治疗指南》解读 经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第6期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。 2020年,美国癌症协会发布的癌症统计数据显示,胰腺癌居肿瘤相关死亡原因第四位,5年生存率仅9%[1]。在过去数十年中,胰腺外科手术技术及安全性的提升并未明显改善胰腺癌患者预后。随着胰腺癌综合治疗理念及多学科协作组(multiple disciplinary team,MDT)模式的普及,新辅助治疗在胰腺癌中的作用逐渐凸显。然而,目前国内未发布针对胰腺癌新辅助治疗的指南与共识,新辅助治疗在适应证把握、方案选择、疗效评估等方面尚未规范与统一。为此,中华医学会外科学分会胰腺外科学组、中国研究型医院学会胰腺疾病专业委员会组织胰腺外科、肿瘤内科、消化内科等相关领域百余位专家,在总结胰腺癌新辅助治疗现有研究证据、参考国内外相关指南内容并充分考虑我国实际国情的基础上,通过四次修订,最终完成了我国首部《中国胰腺癌新辅助治疗指南》[2](以下简称“指南”),从而进一步规范了我国胰腺癌新辅助治疗的临床实践。我们对指南关键内容进行解读,并进一步探讨胰腺癌新辅助治疗存在的争议。 一、新辅助治疗前病理学诊断的获取
病理学诊断是开展化疗的重要依据,国内外指南均建议应在新辅助治疗前获得细胞学或组织学诊断。但胰腺位置深在,且肿瘤组织中间质成分较多,部分患者存在反复穿刺结果阴性的情况。对此,2019年中国临床肿瘤学会制定的胰腺癌诊疗指南中指出,可以通过MDT讨论慎重做出临床诊断。而NCCN指南则指出,患者在穿刺阴性的情况下应重复穿刺,多次穿刺阴性可考虑其他活检方式[3]。考虑病理学诊断的必要性及国内医疗环境现状,该指南坚持认为新辅助治疗前应获得病理学诊断,对于反复穿刺阴性的患者可采用其他方式。尽管超声内镜引导下的细针穿刺活检(endoscopic ultrasound-guided fine needle aspiration,EUS-FNA)在胰腺癌的诊断中有较高的安全性及准确性[4],但受操作者水平影响较大,且部分中心无条件开展此项技术。因此,该指南未将EUS-FNA作为活检的唯一方式,并提出腹腔镜下探查活检也是新辅助治疗前获取病理学诊断的重要手段之一[5],在获得较确切的活检结果的同时避免了反复穿刺给患者带来的痛苦和经济负担。 二、治疗前减黄方式的选择 胰头癌患者多合并胆道梗阻,影响患者肝功能及诱发胆管炎,给新辅助治疗带来一定的困难。因此,新辅助治疗前应对合并胆道梗阻的患者进行胆道引流[6]。目前,NCCN指南推荐胰腺癌新辅助治疗前应首选自膨胀金属胆道支架进行减黄。相关回顾性及前瞻性研究结果亦证实,自膨胀金属胆道支架相比于塑料支架有更好的引流效果,但自膨胀金属覆膜胆道支架与自膨胀金属裸支架的引流效果无明显差异[7-9]。然而,这些研究结果均以支架的引流效果作为主要研究目标,并未充分考虑支架对二
中国胰腺癌多学科综合治疗模式专家共识(2020版)
中国胰腺癌多学科综合治疗模式专家共识(2020版) 6. 胰腺癌MDT应特别关注 (1)现行TNM分期的局限性; (2)组织细胞学证据的必要性; (3)MDT资料管理的重要性; (4)参与MDT人员的专业性; (5)MDT患者选择的科学性与合理性; (6)MDT医学伦理的重要性。 7. 胰腺癌的临床和基础研究 胰腺癌治疗难度极大,尤其是晚期胰腺癌,多种治疗方法尚处于临床试验阶段。为尽可能寻找胰腺癌的有效治疗方法,对于现有治疗途径均不能获得满意效果的患者,可根据具体要求安排参加临床研究,这也符合目前国内外指南和国际惯例。胰腺癌的发病率虽处于上升阶段,但其仍属于低发病率肿瘤。对胰腺癌的流行病学和病因学研究,需要大样本数据和资料的支持。因此,应注意积累每例胰腺癌患者的资料,为未来的科研奠定基础。必要时邀请基础学科研究者参与MDT活动。 8. 胰腺癌多中心MDT模式探索
目前,大型医疗机构在发展中已形成各自的特色和技术优势,但同时也会存在一定的技术缺陷和不足。对于病情复杂的患者,单一的医疗中心存在难以独立完成诊治的情况,因此,可根据患者的病情,邀请不同医疗机构的相关专家进行会诊和协商,制订治疗计划,必要时可转院治疗。多中心MDT模式将可以避免患者因病情复杂而辗转于多家医院,造成诊治延误。在当前的国内医疗条件下,多中心MDT模式尚处于探索阶段,需要进一步完善。 9. 胰腺癌互联网+MDT(eMDT)模式探索 eMDT要以现行完善的MDT模式作为基础,结合互联网、5G、AI技术和大数据等打造病历数据采集、影像、检验、病理、远程会诊、手术演示和远程学习等为一体的互联网医联体云平台,提供远程会诊、联合门诊、移动查房和教学培训等远程服务;融入便捷的移动医疗,使云平台成为能够支持多人、多终端(PC、手机、PAD等)融合和多场景应用的远程医疗平台;可前移到诊室、患者床前、移动手机端的在线会诊、多人多学科会诊和随时随地移动会诊,方便不同医疗机构间会诊业务的开展。 (1)eMDT可分为3种形式。①医院内形式:同一医院内eMDT,既由线下转为线上,初期探索阶段可作为线下MDT的补充。②大医院间的联合:主要关注复杂、疑难病例的诊疗,规范与共识的制订、临床研究的开展、新技术的实施和评价等。③不同层级医院间的联合:主要解决分级诊疗、避免疑难复杂病例转诊、规范化诊治的推广、教学和梯队建设等;主要目的是服务基层医院,优质医疗资源共享、从根本上解决基层看病难等问题。
《中国胰腺癌新辅助治疗指南(2020版)》要点
《中国胰腺癌新辅助治疗指南(2020版)》要点 胰腺癌是病死率较高的消化系统肿瘤之一,外科手术技术的进步并未带来患者预后的明显改善。近年来,新辅助治疗在改善胰腺癌患者预后中的作用日益受到重视。然而由于缺乏高质量研究证据,新辅助治疗在胰腺癌中的开展和应用与其他消化道肿瘤比较,仍不够规范和普及,在应用指征、方案选择、疗效评估、手术时机等方面仍有较大争议。 一、检索策略 二、证据等级及推荐强度 三、可切除性评估标准 (一)胰腺癌新辅助治疗应以多学科综合治疗协作组(MDT)为诊疗模式【推荐意见1】:拟行新辅助治疗的胰腺癌患者常规进行MDT讨论,MDT 模式应贯穿新辅助治疗全程(证据等级:低;推荐程度:强)。 (二)新辅助治疗的意义 【推荐意见2】:新辅助治疗能否提高可切除 胰腺癌(RPC)患者的R0切除率及总体生存率仍有争议,提倡开展高质量临床研究(证据等级:高;推荐程度:强)。 【推荐意见3】:对于临界可切除胰腺癌(BRPC)患者,新辅助治疗有助于提高R0切除率,改善患者预后(证据等级:高;推荐程度:强)。 【推荐意见4】:新辅助治疗能够使部分局部进展期胰腺癌(LAPC)患者肿瘤降期,获得手术切除机会,进而改善预后(证据等级:中;推荐程度:强)。
(三)新辅助治疗前需病理学检查明确诊断 【推荐意见5】:胰腺癌新辅助治疗前应经细胞学或组织学明确诊断(证据等级:低;推荐强度:强)。 (四)新辅助治疗前应缓解胆道梗阻 【推荐意见6】:合并胆道梗阻的患者应在新辅助治疗前进行胆道引流,可选择自膨胀金属覆膜胆道支架,但对于切除可能性较大、术前等待时间较短的患者优先选择塑料胆道支架(证据等级:中;推荐强度:强)。 (五)RPC的新辅助治疗策略 【推荐意见7】:不推荐对所有RPC患者常规开展新辅助治疗,合并高危因素的RPC患者可行新辅助治疗(证据等级:中;推荐强度:弱)。 【推荐意见8】: RPC患者可接受2~4周期的新辅助治疗,美国东部肿瘤协作组(ECOG)评分≤1分的患者可采用联合治疗方案,ECOG评分≤2分的患者可采用以吉西他滨为基础的单药化放疗方案(证据等级:低;推荐强度:弱)。 (六)BRPC的新辅助治疗策略 【推荐意见9】:对于 ECOG评分≤2分的BRPC患者,均应接受新辅助治疗(证据等级:强;推荐程度:强)。 【推荐意见10】: ECOG评分≤1分的BRPC患者可接受FOLFIRINOX或改良 FOLFIRINOX、吉西他滨+白蛋白紫杉醇或吉西他滨+替吉奥的新辅助治疗方案,ECOG评分≤2分的患者可以吉西他滨或氟尿嘧啶类单药为基础开展新辅助治疗,一般推荐2~4周期(证据等级:低;推荐程度:弱)。【推荐意见11】:新辅助治疗后因肿瘤进展无法手术切除的BRPC患者应
