常用化合物溶度积常数表
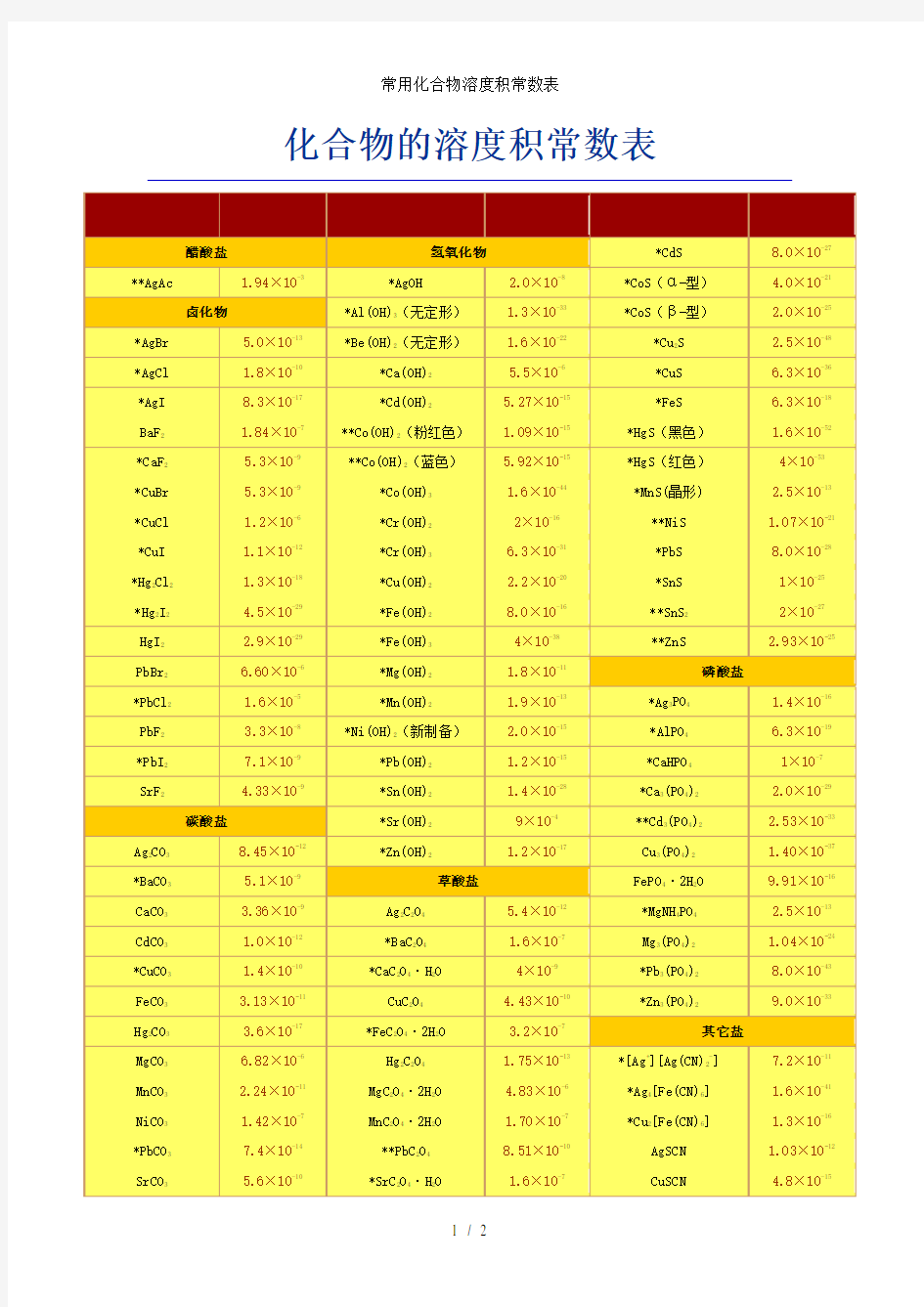

常用化合物溶度积常数表
化合物的溶度积常数表
1 / 2
常用物理常数表
常用物理常数表 光速 101099792458.2?=c cm sec -1 万有引力常数 81067259.6-?=G dyn cm -2 g -2 普朗克常数 27106260.6-?=h erg sec 271005457266.12/-?==πh η erg sec 玻尔兹曼常数 1610380662.1-?=k erg deg –1 里德堡常量 312.109737/2342==∞ch e m R e π cm -1 斯特藩—玻尔兹曼常数 51066956.5-?=σ erg cm -2 deg -4 sec -1 电子电量 101080325.4-?=e esu 1910602192.1-?= coulomb 电子质量 281010956.9-?=e m g 原子质量单位 2410660531.1-?=amu g 精细结构常数 0360.1372//12==e hc πα 第一玻尔轨道半径 82220105291775.04/-?==e m h a e π cm 经典电子半径 1322108179380.2/-?==c m e r e e cm 质子质量 2410672661.1-?=p m g 007276470.1= amu 中子质量 241067492.1-?=n m g 00866.1= amu 电子静止能量 5110034.02=c m e meV 常用天文常数表 地球质量 2710976.5?=⊕M g 地球赤道半径 164.6378=⊕R km 地球表面重力 665.980=⊕g cm sec -2 天文单位 810495979.1?=AU km 1光年 ly = 9.460×1012 km 1秒差距 pc= 3.084×1013 km=3.262ly 千秒差距 kpc=1000pc 地月距离 3.8×105 km 太阳到冥王星的平均距离 5.91×109km 最近的恒星(除太阳)的距离 4×1013km =1.31pc= 4.3ly
2019届高三化学一轮复习溶度积常数及其应用
一、考纲要求: 了解难溶电解质的沉淀溶解平衡。理解溶度积(K sp)的含义,能进行相关的计算。 二、考点归纳 1.沉淀溶解平衡常数——溶度积 (1)溶度积(K sp): 在一定温度下,难溶电解质的饱和溶液中,离子浓度幂的乘积。 (2)表达式: 对于沉淀溶解平衡:M m N n(s) m M n+(aq)+n N m-(aq),K sp=c m(M n+)·c n(N m-)。 (3)意义: 反映了难溶电解质在水中的溶解能力。 (4)影响因素: 在一定的温度下,它是一个常数,只受影响,不受溶液中物质浓度的影响。 2.溶度积规则 (1)离子积(Q c): 难溶电解质溶液中离子浓度幂的乘积,如Mg(OH)2溶液中Q c=。 (2)溶度积规则: Q c K sp——溶液不饱和,无沉淀析出。 Q c K sp——溶液饱和,沉淀与溶解处于平衡状态。 Q c K sp——溶液过饱和,有沉淀析出。 三、考点练: 【高考回顾一】 1.【2015新课标1卷28题节选】 (2)上述浓缩液中主要含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl 开始沉淀时,溶液中c I- c Cl- 为________________。已知K sp(AgCl)=×10-10,K sp(AgI)=×10-17。2.【2016新课标1卷27题节选】 (3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于×10-5mol·L-1)时,溶液中c(Ag+)为mol·L-1,此时溶液中c(CrO42-)等于mol·L-1。(已知Ag2CrO4、AgCl的K sp分别为×10-12和×10-10) 3.【2017新课标1卷27题节选】
高考难点:溶度积常数及其应用
高考难点:溶度积常数 及其应用 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
高考难点:溶度积常数及其应用 一、沉淀溶解平衡中的常数(K sp)——溶度积 1. 定义:在一定温度下,难溶电解质(S<0.01g)的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数(或溶度积) 2. 表示方法:以M m A n(s) mM n+(aq) + nA m-(aq)为例(固体物质不列入平衡常数), K sp=[c(M n+)]m·[c(A m-)] n,如AgCl(s)Ag+(aq) + Cl-(aq),K sp=c(Ag+)·c(Cl -)。 3. 影响溶度积(K sp)的因素:K sp只与难容电解质的性质、温度有关,而与沉淀的量无关,并且溶液中的离子浓度的变化只能使平衡移动,并不改变溶度积。 4. 意义:①K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,K sp数值越大的难溶电解质在水中的溶解能力相对越强;②可以用K sp来计算饱和溶液中某种离子的浓度。 二、判断沉淀生成与否的原则——溶度积规则 通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Q c)的相对大小,可以判断难溶电解质在给的条件下沉淀能否生成或溶解: 1.Q c>K sp,溶液过饱和,既有沉淀析出,直到溶液饱和,达到新的平衡; 2.Q c=K sp,溶液饱和,沉淀与溶解处于平衡状态; 3.Q c<K sp,溶液未饱和无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。 三、对溶度积的理解 1. 溶度积和溶解度都可以用来表示物质的溶解能力,只与温度有关,而与难溶电解质的质量无关。 2. 用溶度积直接比较不同物质的溶解性时,物质的类型应相同。对于化学 的大小来确定式中阴、阳离子个数比不同的难溶电解质,不能通过直接比较K sp 其溶解能力的大小(要分析溶解时所需最小浓度决定)。 3. 溶液中的各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积。 4. 当表达式中的浓度是表示平衡时的浓度时,要用[]符号表示,且此时的溶液为饱和溶液。 5.当溶液中存在多种离子时且加入沉淀剂均可产生沉淀,沉淀生成的先后顺序按离子积大于溶度积的先后顺序,此时为分步沉淀,一般认为沉淀离子浓度小于10-5mol/L时,离子沉淀完全。 【例题1】下列对沉淀溶解平衡的描述正确的是 A. 反应开始时溶液中个离子浓度相等 B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D. 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 解析:A项反应开始时,各离子的浓度没有必然的关系,因此错误;B项正确;C项沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等;D项沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动。
初中物理基本单位、基本公式、基本常数大全
初中物理公式 物理量计算公式备注 速度v= s / t 1m / s = 3.6 Km / h 声速v= 340m / 光速C = 3×10^8 m /s 密度ρ= m / V 1 g / cm^3 = 103 Kg / m 合力 F = F1 - F2 (F1、F2在同一直线线上且方向相反) F = F1 + F2 (F1、F2在同一直线线上且方向相同 ) 压强 p = F / S 适用于固、液、气 p =ρg h 适用于竖直固体柱和液体 浮力①F浮= G – F ②漂浮、悬浮:F浮= G ③F浮= G排=ρ液g V排 物体浮沉条件 ①F浮>G(ρ液>ρ物)上浮至漂 浮 ②F浮=G(ρ液=ρ物)悬浮 ③F浮<G(ρ液<ρ物)下沉杠杆平衡条件F1 *L1 = F2 *L 2 杠杆平衡条件也叫杠杆原理 滑轮组 F = G / n ( 理想滑轮组) F =(G动+ G物)/ n (忽略轮轴间的摩擦) η=G/ nF(实际情况n:作用在动滑轮上绳子股数) 功W = F S = P t 1J = 1N?m = 1W?s 功率P = W / t = Fv 1KW = 10^3 W,1MW = 10^3KW 有用功W有用= G h(竖直提升)= F S(水平移动)= W总– W额=ηW总额外功W额= W总– W有= G动h(忽略轮轴间摩擦)= f L(斜面) 总功W总= W有用+ W额= F S = W有用/ η 机械效率η= W有用/ W总 热量Q=cm(t-t°) 电流I=U/R 电功W=UIt =Pt 电功率P=W/t=UI =I2R=U2/R 串联电路I=I1=I2 电流处处相等 U = U 1+ U 2 干路电压等于各支路电压之和 R=R1+R2 总电阻等于的电阻之和
高考难点:溶度积常数及其应用
高考难点:溶度积常数及其应用 一、沉淀溶解平衡中的常数(K sp)——溶度积 1. 定义:在一定温度下,难溶电解质(S<)的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数(或溶度积) 2. 表示方法:以M m A n(s) mM n+(aq) + nA m-(aq)为例(固体物质不列入平衡常数), K sp=[c(M n+)]m·[c(A m-)] n,如AgCl(s)Ag+(aq) + Cl-(aq),K sp=c(Ag+)·c(Cl-)。 3. 影响溶度积(K sp)的因素:K sp只与难容电解质的性质、温度有关,而与沉淀的量无关,并且溶液中的离子浓度的变化只能使平衡移动,并不改变溶度积。 4. 意义:①K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,K sp数值越大的难溶电解质在水中的溶解能力相对越强;②可以用K sp来计算饱和溶液中某种离子的浓度。 二、判断沉淀生成与否的原则——溶度积规则 通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Q c)的相对大小,可以判断难溶电解质在给的条件下沉淀能否生成或溶解: >K sp,溶液过饱和,既有沉淀析出,直到溶液饱和,达到新的平衡; =K sp,溶液饱和,沉淀与溶解处于平衡状态; <K sp,溶液未饱和无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。 三、对溶度积的理解 1. 溶度积和溶解度都可以用来表示物质的溶解能力,只与温度有关,而与难溶电解质的质量无关。 2. 用溶度积直接比较不同物质的溶解性时,物质的类型应相同。对于化学式中阴、阳离子个数比不同的难溶电解质,不能通过直接比较K sp的大小来确定其溶解能力的大小(要分析溶解时所需最小浓度决定)。 3. 溶液中的各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积。 4. 当表达式中的浓度是表示平衡时的浓度时,要用[]符号表示,且此时的溶液为饱和溶液。 5.当溶液中存在多种离子时且加入沉淀剂均可产生沉淀,沉淀生成的先后顺序按离子积大于溶度积的先后顺序,此时为分步沉淀,一般认为沉淀离子浓度小于10-5mol/L时,离子沉淀完全。 【例题1】下列对沉淀溶解平衡的描述正确的是 A. 反应开始时溶液中个离子浓度相等 B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D. 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 解析:A项反应开始时,各离子的浓度没有必然的关系,因此错误;B项正确;C项沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等;D项沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动。 答案:B 点拨:沉淀平衡是化学平衡中的一种,在学习这部分知识时要注意化学平衡移动原理的应用。 四、影响沉淀平衡的因素 1. 内因:难溶电解质本身的性质。
基础物理常数全表PDF
Fundamental Physical Constants—Complete Listing Relative std. Quantity Symbol Value Unit uncert.u r UNIVERSAL speed of light in vacuum c,c029*******m s?1(exact) magnetic constantμ04π×10?7N A?2 =12.566370614...×10?7N A?2(exact) electric constant1/μ0c2ε08.854187817...×10?12F m?1(exact) characteristic impedance of vacuum μ0/ 0=μ0c Z0376.730313461...?(exact) Newtonian constant of gravitation G6.673(10)×10?11m3kg?1s?21.5×10?3 G/ˉh c6.707(10)×10?39(GeV/c2)?21.5×10?3 Planck constant h6.62606876(52)×10?34J s7.8×10?8 in eV s4.13566727(16)×10?15eV s3.9×10?8 h/2πˉh1.054571596(82)×10?34J s7.8×10?8 in eV s6.58211889(26)×10?16eV s3.9×10?8 Planck mass(ˉh c/G)1/2m P2.1767(16)×10?8kg7.5×10?4 Planck lengthˉh/m P c=(ˉh G/c3)1/2l P1.6160(12)×10?35m7.5×10?4 Planck time l P/c=(ˉh G/c5)1/2t P5.3906(40)×10?44s7.5×10?4 ELECTROMAGNETIC elementary charge e1.602176462(63)×10?19C3.9×10?8 e/h2.417989491(95)×1014A J?13.9×10?8 magnetic?ux quantum h/2eΦ02.067833636(81)×10?15Wb3.9×10?8 conductance quantum2e2/h G07.748091696(28)×10?5S3.7×10?9 inverse of conductance quantum G?1012906.403786(47)?3.7×10?9 Josephson constant a2e/h K J483597.898(19)×109Hz V?13.9×10?8 von Klitzing constant b h/e2=μ0c/2αR K25812.807572(95)?3.7×10?9 Bohr magneton eˉh/2m eμB927.400899(37)×10?26J T?14.0×10?8 in eV T?15.788381749(43)×10?5eV T?17.3×10?9 μB/h13.99624624(56)×109Hz T?14.0×10?8 μB/hc46.6864521(19)m?1T?14.0×10?8 μB/k0.6717131(12)K T?11.7×10?6 nuclear magneton eˉh/2m pμN5.05078317(20)×10?27J T?14.0×10?8 in eV T?13.152451238(24)×10?8eV T?17.6×10?9 μN/h7.62259396(31)MHz T?14.0×10?8 μN/hc2.54262366(10)×10?2m?1T?14.0×10?8 μN/k3.6582638(64)×10?4K T?11.7×10?6 ATOMIC AND NUCLEAR General ?ne-structure constant e2/4π 0ˉh cα7.297352533(27)×10?33.7×10?9 inverse?ne-structure constantα?1137.03599976(50)3.7×10?9
溶度积常数及其应用
溶度积常数及其应用 制作:审核: 【学习目标】 1、巩固溶度积的概念,熟练掌握难溶电解质溶解平衡表达式和溶度积常数的意义 2、会运用溶度积常数进行相关计算 【学习过程】 一、溶度积常数Ksp(或溶度积) 1、表达式: 难溶固体在溶液中达到沉淀溶解平衡状态时,离子浓度保持不变(或一定)。各离子浓度幂的乘积是一个常数,这个常数称之为溶度积常数简称为溶度积,用符号Ksp表示。 即:AmBn(s)mA n+(aq)+nB m-(aq)Ksp = 例如:常温下沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq), Ksp(AgCl)= 常温下沉淀溶解平衡:Ag2CrO4(s)2Ag+(aq)+CrO42-(aq), Ksp(Ag2CrO4)= 2、溶度积K SP的性质 (1)溶度积K SP的大小和平衡常数一样,它与难溶电解质的性质和温度有关,与浓度无关,离子浓度的改变可使溶解平衡发生移动,而不能改变溶度积K SP的大小。 (2)溶度积K SP反映了难溶电解质在水中的溶解能力的大小。相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶于水;反之Ksp越大,溶解度越大。 如:Ksp(AgCl)= 1.8×10-10;Ksp(AgBr) = 5.0×10-13;Ksp(AgI) = 8.3×10-17. 溶解度: 。 不同类型的难溶电解质,不能简单地根据Ksp大小,判断难溶电解质溶解度的大小。 例1:Ksp[Mg(OH)2]= 4×10-12,Ksp(AgCl) =1×10-10,请比较cMg2+、cAg+的大小。 3、溶度积规则 某难溶电解质的溶液中任一情况下离子积Qc和溶度积Ksp的关系: ①Qc > Ksp时,析出沉淀。 ②Qc=Ksp时,饱和溶液,沉淀溶解平衡状态。 ③Qc < Ksp时,溶液未饱和。沉淀的生成和溶解这两个相反的过程,它们相互转化的条件是离子浓度的大小,控制离子浓度的大小,可以使反应向所需要的方向转化。 4、溶度积的应用 (1)已知溶度积求离子浓度 例2:25 ℃,Ksp(AgBr)=4.9×10-9, Ksp(Mg(OH)2) =4×10-12,分别求以上饱和溶液中:c(Ag+)、c(Br-)、 c(Mg2+)、c(OH-) 。 例3:常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)除去,溶液的pH应调至多少? 【练习】1、如果溶液中Fe3+和Mg2+的浓度均为0.10 mol L-1,使Fe3+定量沉淀而使Mg2+不沉淀的pH条件是什么? 已知K sp(Fe(OH)3)=1.0×10-38,K sp((Mg(OH)2)=1×10-11 2、向硫酸钡沉淀中加入碳酸钠溶液,沉淀发生转化,计算所需碳酸钠的最小浓度。 Ksp(BaCO3)=5.1×10-9,Ksp(BaSO4)=1.0×10-10 (2)已知离子浓度求溶度积 例4:25℃,AgCl的溶解度是1.435×10-3g/L,求它的溶度积。(AgCl的摩尔质量143.5g/mol) (3)利用溶度积判断离子共存 例5:在含有0.01mol·L-1[I-]和0.01mol·L-1[Cl-]的溶液中,滴加AgNO3溶液时,哪种离子最先沉淀?当第二种离子刚开始沉淀时,溶液中的第一种离子浓度为多少?(忽略溶液体积的变化)。Ksp(AgCl)= 1.8×10-10;Ksp(AgI) = 7.2×10-17. 例6:某温度时,AgCl (s)Ag+(aq)+Cl-(aq)在水中的沉淀 溶解平衡曲线如图所示。下列说法正确的是 A.加入AgNO3可以使溶液由c点变到d点 B.加入固体NaCl则AgCl的溶解度减小,Ksp也减小 C.c点对应的Ksp小于a点对应的Ksp D.d点有AgCl沉淀生成
物理最常用常数
常用物理常数表 光速 101099792458.2×=c cm sec -1 万有引力常数 81067259.6?×=G dyn cm -2 g -2 普朗克常数 27106260.6?×=h erg sec 271005457266.12/?×==πh erg sec 玻尔兹曼常数 1610380662.1?×=k erg deg –1 里德堡常量 312.109737/2342==∞ch e m R e π cm -1 斯特藩—玻尔兹曼常数 51066956.5?×=σ erg cm -2 deg -4 sec -1 电子电量 101080325.4?×=e esu 1910602192.1?×= coulomb 电子质量 281010956.9?×=e m g 原子质量单位 2410660531.1?×=amu g 精细结构常数 0360.1372//12==e hc πα 第一玻尔轨道半径 82220105291775.04/?×==e m h a e π cm 经典电子半径 1322108179380.2/?×==c m e r e e cm 质子质量 2410672661.1?×=p m g 007276470.1= amu 中子质量 24 1067492.1?×=n m g 00866.1= amu 电子静止能量 5110034.02=c m e meV 常用天文常数表 地球质量 27 10976.5×=⊕M g 地球赤道半径 164.6378=⊕R km 地球表面重力 665.980=⊕g cm sec -2 天文单位 810495979.1×=AU km 1光年 ly = 9.460×1012 km 1秒差距 pc= 3.084×1013 km=3.262ly 千秒差距 kpc=1000pc 地月距离 3.8×105 km 太阳到冥王星的平均距离 5.91×109km 最近的恒星(除太阳)的距离 4×1013km =1.31pc= 4.3ly 太阳到银心的距离 2.4×1017km=8kpc 太阳质量 M ⊙ 3310989.1×= g 太阳半径 R ⊙10109599.6×=cm 太阳光度 L ⊙33 10826.3×= erg sec -1
溶度积表
溶度积表 溶度积表 化合物化学式温度K sp 来源 无水氢氧化铝Al(OH) 3 20°C 1.9×10–33L 无水氢氧化铝Al(OH) 325°C3×10–34w 1 三水合氢氧化铝Al(OH) 3 20°C4×10–13C 三水合氧化铝Al(OH) 3 25°C 3.7×10–13C 磷酸铝AlPO 425°C9.84×10–21w 1 溴酸钡Ba(BrO 3) 2 25°C 2.43×10–4w 1 碳酸钡BaCO 3 16°C7×10–9C,L 碳酸钡BaCO 3 25°C8.1×10–9C,L 铬酸钡BaCrO 4 28°C 2.4×10–10C,L 氟化钡BaF 2 25.8°C 1.73×10–6C,L 二水合碘酸钡Ba(IO 3) 2 25°C 6.5×10–10C,L 二水合草酸钡BaC 2O 4 18°C 1.2×10–7C,L 硫酸钡BaSO 4 18°C0.87×10–10C,L 硫酸钡BaSO 4 25°C 1.08×10–10C,L 硫酸钡BaSO 4 50°C 1.98×10–10C,L 氢氧化铍Be(OH) 225°C 6.92×10–22w 1 碳酸镉CdCO 325°C 1.0×10–12w 1 氢氧化镉Cd(OH) 225°C7.2×10–15w 1 三水合草酸镉CdC 2O 4 18°C 1.53×10–8C,L 磷酸镉Cd 3(PO 4 )225°C 2.53×10–33w 1 硫化镉CdS18°C 3.6×10–29C,L 碳酸钙(方解石)CaCO 3 15°C0.99×10–8C,L 碳酸钙(方解石)CaCO 3 25°C0.87×10–8C,L 碳酸钙(方解石)CaCO 3 18-25°C 4.8×10–9P 铬酸钙CaCrO 4 18°C 2.3×10–2L 氟化钙CaF 2 18°C 3.4×10–11C,L 氟化钙CaF 2 25°C 3.95×10–11C,L 氢氧化钙Ca(OH) 2 18°C-25°C8×10–6P 氢氧化钙Ca(OH) 225°C 5.02×10–6w 1
化合物的溶度积常数表(超全).doc
化合物的溶度积常数表化合物 醋酸盐 **AgAc *AgBr *AgCl *AgI BaF2*CaF2*CuBr *CuCl *CuI *Hg 2Cl2*Hg 2I2HgI2PbBr2*PbCl2PbF2*PbI2SrF2Ag 2CO3*BaCO3CaCO3CdCO3*CuCO3FeCO3Hg 2CO3MgCO3MnCO3NiCO3*PbCO 31.94 × 10-3 卤化物 1.8 × 10-10 8.3 × 10-17 1.84 × 10-7 溶度积化合物
氢氧化物 *AgOH 2.0 × 10-8 *Al(OH) 3(无定形) 1.3 × 10-33 *Ca(OH)2*Cd(OH) 25.5 × 10-6 5.27 × 10-15 溶度积化合物 *CdS *CoS(α-型) *CoS(β-型) *Cu 2S *CuS *FeS *HgS(黑色) *HgS(红色) *MnS(晶形 )**NiS *PbS *SnS **SnS2**ZnS 磷酸盐 *Ag 3PO4*AlPO4*CaHPO4*Ca
3(PO 4)2**Cd 3(PO 4)2Cu 3(PO 4)2FePO 4·2H 2O 5.4 × 10-12 1.6 × 10-7 4× 10-9 4.43 × 10-10 3.2 × 10-7 4.83 × 10 1.70 × 10-7 8.51 × 10-10-溶6度积8.0 × 10-27 4.0 × 10-21 2.0 × 10-25 2.5 × 10-48 6.3 × 10-36
6.3 × 10-18 1.6 × 10-524 × 10-53 2.5 × 10-13 1.07 × 10-21 8.0 × 10-281 × 10-252 × 10-27 2.93 × 10-25 1.4 × 10-16 6.3 × 10-191 × 10-7 2.0 × 10-29 2.53 × 10-33 1.40 × 10-37 9.91 × 10-16 2.5 × 10-13 1.04 × 10-24 8.0 × 10-43 9.0 × 10-33 7.2 × 10-11 1.6 × 10 1.3 × 10-16 1.03 × 10-12-41 5.0 × 10-13*Be(OH)
几个基本常数弹性模量-泊松比-应力应变曲线
几个基本常数弹性模量-泊松比-应力应变曲线
全应力-应变曲线 测量岩石的应力应变曲线一般可以有两中试验机:一种是,柔性试验机,使用这种试验机测量时,容易发发生“岩爆”现象,导致试验中不能得到峰值以后的应力应变信息。另种是,刚性试验机,这种试验机刚度比较高,有“让压”的特点,就不会有“岩爆”现象发生,可以得到全应力-应变曲线用以研究岩石破裂的性质。 刚度矩阵的物理意义: 单元刚度矩阵的物理意义,一句话概括说来就是各个节点在广义力的作用下节点的位移变化量。 强度是零件的抗应力程度,反映的是什么时候断裂,破损等 刚度反映的是变形大小,就是零件受力后的变形。 刚度矩阵和柔度矩阵的物理意义: 一般将刚度矩阵记为[D],柔度矩阵为[C],二者互为逆矩阵。 [C]矩阵中任一元素Cij的物理意义为:当微小单元体上仅作用有j方向的单位应力增加,而其他方向无应力增量时,i方向的应变增量分量就等于Cij。 [D]矩阵中任一元素Dij的物理意义为:要使微小单元体只在j方向发生单位应变,而其他方向不允许发生应变,则必须造成某种应力组合,在这种应力组合中,i方向应力分量为Dij。 对于各向异性材料,[D]和[C]都是非对称矩阵,从机理上来说是合理的,然而它给数学模型带来复杂性,也增加了有限元计算的困难。从工程实用的角度来考虑,往往忽略这种非对称性,而处理为对称矩阵。 物理概念:杨氏模量和泊松比 在弹性范围内大多数材料服从虎克定律,即变形与受力成正比。纵向应力与纵向应变的比例常数就是材料的弹性模量E,也叫杨氏模量。而横向应变与
纵向应变之比值称为泊松比μ,也叫横向变性系数,它是反映材料横向变形的弹性常数。 杨氏模量(Young's modulus)是表征在弹性限度内物质材料抗拉或抗压的物理量,它是沿纵向的弹性模量。1807年因英国医生兼物理学家托马斯·杨(Thomas Young, 1773-1829) 所得到的结果而命名。根据胡克定律,在物体的弹性限度内,应力与应变成正比,比值被称为材料的杨氏模量,它是表征材料性质的一个物理量,仅取决于材料本身的物理性质。杨氏模量的大小标志了材料的刚性,杨氏模量越大,越不容易发生形变。 FL/EA=△L,其中F是力,L是长度,E是弹性模量,A是截面积,△L 是长度变化量,也就是形变。弹性模量可视为衡量材料产生弹性变形难易程度的指标,其值越大,使材料发生一定弹性变形的应力也越大,即材料刚度越大,亦即在一定应力作用下,发生弹性变形越小。弹性模量E是指材料在外力作用下产生单位弹性变形所需要的应力。它是反映材料抵抗弹性变形能力的指标,相当于普通弹簧中的刚度。力学里没有弹性系数这个物理量。 杨氏弹性模量是选定机械零件材料的依据之一是工程技术设计中常用的参数。杨氏模量的测定对研究金属材料、光纤材料、半导体、纳米材料、聚合物、陶瓷、橡胶等各种材料的力学性质有着重要意义,还可用于机械零部件设计、生物力学、地质等领域。 测量杨氏模量的方法一般有拉伸法、梁弯曲法、振动法、内耗法等,还出现了利用光纤位移传感器、莫尔条纹、电涡流传感器和波动传递技术(微波或超声波)等实验技术和方法测量杨氏模量。 胡克定律和杨氏弹性模量 固体在外力作用下将发生形变,如果外力撤去后相应的形变消失,这种形变称为弹性形变。如果外力后仍有残余形变,这种形变称为范性形变。 应力(σ)单位面积上所受到的力(F/S)。 应变(ε ):是指在外力作用下的相对形变(相对伸长DL/L)它反映了物体形变的大小。 胡克定律:在物体的弹性限度内,应力与应变成正比,其比例系数称为杨氏模量(记为Y)。用公式表达为: Y=(F·L)/(S·△L) Y在数值上等于产生单位应变时的应力。它的单位是与胁力的单位相同。杨氏弹性模量是材料的属性,与外力及物体的形状无关。 杨氏模数(Young's modulus )是材料力学中的名词,弹性材料承受正向应力时会产生正向应变,定义为正向应力与正向应变的比值。公式记为 E = σ / ε 其中,E 表示杨氏模数,σ 表示正向应力,ε 表示正向应变。 杨氏模量大,说明压缩或拉伸该材料,材料的形变小。 一般的如楼上所说但是有些是各向异性的及各个方向的弹性模量不同用矩阵表示 弹性模量 英文名称:Elastic Modulus,又称Young 's Modulus(杨氏模量) 定义:材料在弹性变形阶段,其应力和应变成正比例关系(即符合胡克
常用物理基本常数表
常用物理基本常数表 物理常数符号最佳实验值供计算用值真空中光速 c 299792458±1.2m·s-1 3.00×108m·s-1 引力常数G0(6.6720±0.0041)×10-11m3·s-2 6.67×10-11m3·s-2阿伏加德罗(Avogadro)常 数 N0(6.022045±0.000031) ×1023mol-1 6.02×1023mol-1 普适气体常数R (8.31441±0.00026)J·mol-1·K-18.31 J·mol-1·K-1 玻尔兹曼(Boltzmann)常 数 k (1.380662±0.000041) ×10-23J·K-1 1.38×10-23J·K-1理想气体摩尔体积V m(22.41383±0.00070) ×10-322.4×10-3m3·mol-1基本电荷(元电荷) e (1.6021892±0.0000046) ×10-19 C 1.602×10-19 C 原子质量单位u (1.6605655±0.0000086)×10-27kg 1.66×10-27kg 电子静止质量m e(9.109534±0.000047)×10-31kg 9.11×10-31kg 电子荷质比e/m e (1.7588047±0.0000049)×10-11C· kg -2 1.76×10-11C· kg-2 质子静止质量m p(1.6726485±0.0000086)×10-27kg 1.673×10-27kg 中子静止质量m n(1.6749543±0.0000086)×10-27kg 1.675×10-27kg 法拉第常数 F (9.648456±0.000027 )C·mol-196500 C·mol-1 真空电容率ε0(8.854187818±0.000000071)×10-12 F·m-2 8.85×10-12F·m-2 真空磁导率μ012.5663706144±10-7H·m-14πH·m-1 电子磁矩μe(9.284832±0.000036)×10-24J·T-1 9.28×10-24J·T-1 质子磁矩μp (1.4106171±0.0000055)×10-23J·T- 1 1.41×10-23J·T-1 玻尔(Bohr)半径α0(5.2917706±0.0000044)×10-11m 5.29×10-11m 玻尔(Bohr)磁子μB(9.274078±0.000036)×10-24J·T-1 9.27×10-24J·T-1核磁子μN(5.059824±0.000020)×10-27J·T-1 5.05×10-27J·T-1普朗克( Planck)常数h (6.626176±0.000036)×10-34J·s 6.63×10-34J·s精细结构常数 a 7.2973506(60)×10-3 里德伯(Rydberg)常数R 1.097373177(83)×107m-1 电子康普顿(Compton)波长 2.4263089(40)×10-12m 质子康普顿(Compton)波长 1.3214099(22)×10-15m 质子电子质量比m p/m e1836.1515
难点辅导:溶度积常数及应用
难点辅导:溶度积常数及其应用
一、沉淀溶解平衡中的常数(Ksp)——溶度积 1. 定义:在一定温度下,难溶电解质的饱和溶液中,存在沉淀溶解平衡,其平衡常 数叫做溶度积常数(或溶度积) 2. 表示方法: 以 MmAn(s)
-
mMn+(aq) + nAm (aq)为例 (固体物质不列入平衡常数) , Ag+(aq) + Cl (aq),Ksp=c(Ag+)·c(Cl )。
- -
-
Ksp=[c(Mn+)]m·[c(Am )] n,如 AgCl(s)
3.影响溶度积(Ksp)的因素:Ksp 只与难容电解质的性质、温度有关,而与沉淀的量 无关,并且溶液中的离子浓度的变化只能使平衡移动,并不改变溶度积。 4.意义:①Ksp 反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子 个数比相同时,Ksp 数值越大的难溶电解质在水中的溶解能力相对越强;②可以用 Ksp 来计 算饱和溶液中某种离子的浓度。 二、判断沉淀生成与否的原则——溶度积规则 通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Qc)的相对大小,可以 判断难溶电解质在给的条件下沉淀能否生成或溶解: 1.Qc>Ksp,溶液过饱和,既有沉淀析出,直到溶液饱和,达到新的平衡; 2.Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状态; 3.Qc<Ksp,溶液未饱和无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至 溶液饱和。 三、对溶度积的理解 1.溶度积和溶解度都可以用来表示物质的溶解能力。 2.用溶度积直接比较不同物质的溶解性时,物质的类型应相同。对于化学式中阴、 阳离子个数比不同的难溶电解质, 不能通过直接比较 Ksp 的大小来确定其溶解能力的大小。 3.溶液中的各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积。 【例题 1】下列对沉淀溶解平衡的描述正确的是 A. 反应开始时溶液中个离子浓度相等 B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D. 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
1
溶度积常数及应用
难点辅导:溶度积常数及其应用 一、沉淀溶解平衡中的常数(K sp)——溶度积 1. 定义:在一定温度下,难溶电解质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数(或溶度积) 2. 表示方法:以M m A n (s) mM n+(aq) + nA m-(aq)为例(固体物质不列入平衡常数), K sp =[c(M n+)]m·[c(A m-)] n,如AgCl(s)Ag+(aq) + Cl-(aq),K sp =c(Ag+)·c(Cl-)。 3. 影响溶度积(K sp )的因素:K sp只与难容电解质的性质、温度有关,而与沉淀的量无关,并且溶液中的离子浓度的变化只能使平衡移动,并不改变溶度积。 4. 意义:①K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时, K sp 数值越大的难溶电解质在水中的溶解能力相对越强;②可以用K sp来计算饱和溶液中某种离子的浓度。 二、判断沉淀生成与否的原则——溶度积规则 通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Q c )的相对大小,可以判断难溶电解质在给的条件下沉淀能否生成或溶解: 1.Q c >K sp,溶液过饱和,既有沉淀析出,直到溶液饱和,达到新的平衡; 2.Q c =K sp,溶液饱和,沉淀与溶解处于平衡状态; 3.Q c <K sp,溶液未饱和无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。 三、对溶度积的理解 1. 溶度积和溶解度都可以用来表示物质的溶解能力。 2. 用溶度积直接比较不同物质的溶解性时,物质的类型应相同。对于化学式中阴、阳离子个数比 不同的难溶电解质,不能通过直接比较K sp 的大小来确定其溶解能力的大小。 3. 溶液中的各离子浓度的变化只能使沉淀溶解平衡移动,并不改变溶度积。 【例题1】下列对沉淀溶解平衡的描述正确的是 A. 反应开始时溶液中个离子浓度相等 B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D. 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 解析:A项反应开始时,各离子的浓度没有必然的关系,因此错误;B项正确;C项沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等;D项沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动。 答案:B 点拨:沉淀平衡是化学平衡中的一种,在学习这部分知识时要注意化学平衡移动原理的应用。 四、影响沉淀平衡的因素 1. 内因:难溶电解质本身的性质。 2. 外因:①浓度,加水稀释沉淀平衡向溶解的方向移动,但K sp不变。②温度,升高温度沉淀溶解平衡向吸热的方向移动,同时K sp随温度的变化而变化。③同离子效应,向沉淀平衡体系中加入相同的离子,使平衡向沉淀方向移动,但K sp不变。④向沉淀平衡体系中加入可与体系中某些离子反应生成更难溶物质或气体的分子,使平衡体向溶解的方向移动,但K sp不变。 五、沉淀的生成与溶解 1. 沉淀生成的方法有:①加沉淀剂法:如以Na 2S、H 2 S等作沉淀剂,可使某些金属离子如Cu2+、Hg2+ 等生成极难溶的硫化物CuS、HgS等沉淀,也是分离除去杂质的常用方法;②调节pH法:如在工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使Fe3+ 转变为Fe(OH) 3 沉淀而除去。 2. 沉淀溶解的方法有:①酸碱溶解法,如难溶于水的CaCO 3 沉淀可以溶于盐酸中;②盐溶解法,如 Mg(OH) 2可溶于NH 4 Cl溶液中:Mg(OH) 2 (s)Mg2+(aq) + 2OH-(aq)、 NH 4+ +H 2 O NH 3 ·H 2 O+ H+、H+ + OH- === H 2 O。 【例题2】(2011浙江高考)海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
2019届高三化学一轮复习溶度积常数(Ksp)及其应用.doc
溶度积常数(K P)及其应用 ?、考纲要求: 了解难溶电解质的沉淀溶解平衡。理解溶度积( Kp)的含义,能进行相关的计算。 二、考点归纳 1. 沉淀溶解平衡常数一一溶度积 (1) 溶度积(Ks P): 在一定温度下,难溶电解质的饱和溶液中,离子浓度幕的乘积。 (2) 表达式: 对于沉淀溶解平衡:MmNn(s) n+(aq)+nNm m(M n(n(N m- (aq), Ksp= c )c )o (3) 意义: 反映了难溶电解质在水中的溶解能力。 (4) 影响因素:------ 在一定的温度下,它是一个常数,只受影响,不受溶液中物质浓度的影响。 2. 溶度积规则 (1) 离子积(Qc):__________________ 难溶电解质溶液中离子浓度幕的乘积,女口Mg(OH) 2溶液中Qc= (2) 溶度业则: Qc—Ksp——溶液不饱和,无沉淀析出。 Qc Ksp——溶液饱和,沉淀与溶解处于平衡状态。 Qc Ksp——溶液过饱和,有沉淀析出。
三、 考点练: 【高考回顾一】 1. [2015新课标1卷28题节选】 c CI 2. [2016新课标1卷27题节选】 -) 开始沉淀时,溶液中'I -为 I 、CI 等离子,取一定量的浓缩液,向其中滴加 AgNCH 溶液, — 10 。已知 Ksp(AgCI) =1.8x 10 , K sp (Agl) =8.5x 当 AgCI -17 10 o ⑶ 右?化学分析中米用 K2CQ4为指不剂,以AgNO3标f 隹浴液滴定洛液中 CI 利用 Ag "与 CrO 红色沉淀,指示到达滴定终点。当溶液中 c(Ag +)为 mol L-1,此时溶液中 Cl 恰好沉淀完全(浓度等于 c(CrO £等于 4 -5 1.0x 10 mol-L 2- 4 生成砖 /)时,溶液中 mol 丄 o (已知 Ag 2CrO 4> AgCI 的 K P (2)上述浓缩液中弓
溶度积常数
溶度积常数
————————————————————————————————作者:————————————————————————————————日期:
溶度积表 化合物化学式温度K sp 无水氢氧化铝Al(OH)320°C 1.9×10–33无水氢氧化铝Al(OH)325°C3×10–34 三水合氢氧化铝Al(OH)320°C4×10–13 三水合氧化铝Al(OH)325°C 3.7×10–13磷酸铝AlPO425°C9.84×10–21溴酸钡Ba(BrO3)225°C2.43×10–4碳酸钡BaCO316°C7×10–9 碳酸钡BaCO325°C8.1×10–9铬酸钡BaCrO428°C 2.4×10–10 氟化钡BaF225.8°C1.73×10–6二水合碘酸钡Ba(IO3)225°C6.5×10–10二水合草酸钡BaC2O418°C1.2×10–7硫酸钡BaSO418°C0.87×10–10硫酸钡BaSO425°C1.08×10–10硫酸钡BaSO450°C1.98×10–10氢氧化铍Be(OH)225°C 6.92×10–22
碳酸镉CdCO325°C1.0×10–12氢氧化镉Cd(OH)225°C7.2×10–15三水合草酸镉CdC2O418°C 1.53×10–8磷酸镉Cd3(PO4)225°C 2.53×10–33 硫化镉CdS 18°C3.6×10–29碳酸钙(方解石) CaCO315°C0.99×10–8碳酸钙(方解石) CaCO325°C0.87×10–8碳酸钙(方解石) CaCO318-25°C 4.8×10–9铬酸钙CaCrO418°C 2.3×10–2 氟化钙CaF218°C 3.4×10–11氟化钙CaF225°C3.95×10–11氢氧化钙Ca(OH)218°C-25°C8×10–6 氢氧化钙Ca(OH)225°C5.02×10–6 Ca(IO3) 六水合碘酸钙 18°C 6.44×10–7 2 一水合草酸钙CaC2O418°C1.78×10–9一水合草酸钙CaC2O425°C 2.57×10–9磷酸钙Ca3(PO4)225°C2.07×10–33硫酸钙CaSO410°C6.1×10–5
