阿莫西林杂质列表-杂质对照品

阿莫西林杂质列表-杂质对照品
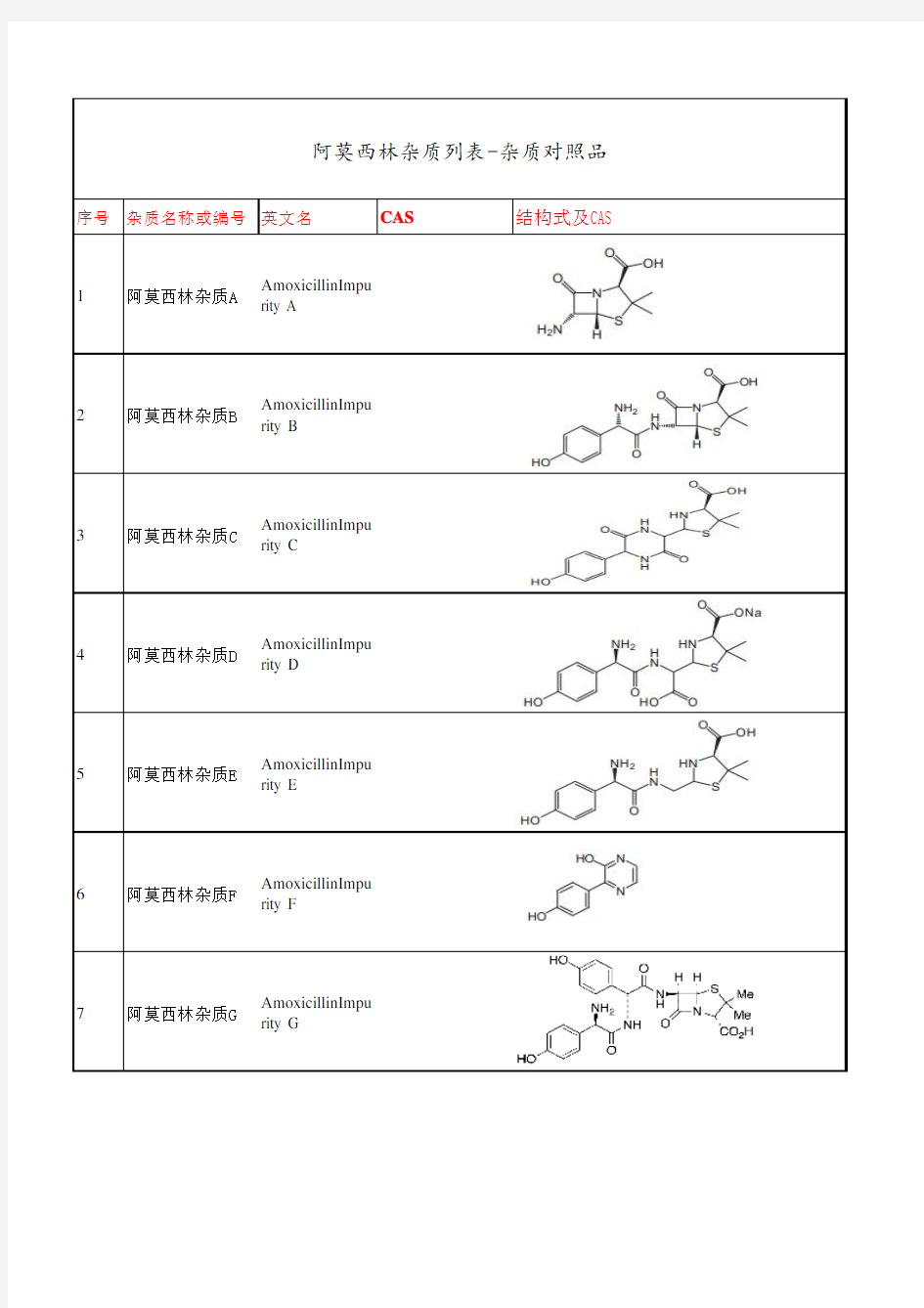
序号杂质名称或编号英文名CAS 结构式及CAS
1阿莫西林杂质A AmoxicillinImpu
rity A
2阿莫西林杂质B AmoxicillinImpu
rity B
3阿莫西林杂质C AmoxicillinImpu
rity C
4阿莫西林杂质D AmoxicillinImpu
rity D
5阿莫西林杂质E AmoxicillinImpu
rity E
6阿莫西林杂质F AmoxicillinImpu
rity F
7阿莫西林杂质G AmoxicillinImpu rity G
8阿莫西林杂质H AmoxicillinImpu rity H
9阿莫西林杂质I AmoxicillinImpu rity I
相关杂质1、阿考替胺杂质2、维格列汀杂质3、厄洛替尼杂质4、利伐沙班杂质5、索拉非尼杂质
6、阿伐那非杂质
7、替卡格雷杂质
8、阿哌沙班杂质
9、米格列奈杂质10、普拉克索杂质11、氨氯地平杂质12、非不司他杂质13、托法替尼杂质14、达比加群酯杂质15、埃索美拉唑钠杂质16、盐酸氨溴索杂质 17、卡格列净杂质 18 索菲布韦杂质 19、依托考昔杂质
及代理其他品牌杂质标准品(EP、USP、LGC、TRC、TLC、MC、SINCO)等。
联系电话:0755- 89483656
深圳菲斯—专注标准品
HPLC法测定盐酸左氧氟沙星片的含量
HPLC法测定盐酸左氧氟沙星片的含量 摘要:目的:对HPLC及UV测定盐酸左氧氟沙星片的含量进行比较。方法:高效液相色谱法选择色谱柱为Agilent C18 (150 mm×4.6 mm,5 μm),流动相为醋酸铵高氯酸钠溶液(pH=2.2)-乙腈(85:15),流速为1.0mL·min-1,检测波长为294nm;紫外分光光度法选择294nm波长测定含量.结果:HPLC法中盐酸左氧氟沙星片在2.05ug·mL-1 ~51.15ug·mL-1范围内线性关系良好.回归方程Y =523247X-23331(r=0.9995),加样回收率平均值为100.36%,RSD 1.8%。结论:HPLC法及紫外分光光度法均准确性、重复性高、精密度好,可考虑将紫外分光光度法作为盐酸左氧氟沙星含量测定的替代方法使用。 关键词:高效液相法;紫外分光光度法;盐酸左氧氟沙星 左氧氟沙星是氧氟沙星的L-型光学活性异构体,因其抗菌谱广、抗菌作用强、不良反应率较低,而被广泛使用[1]。2015版药典推荐高效液相法来分析本品及其相关剂型,考虑到基层药物监测机构尚不能完全普及高效液相设备[2],本文对比分析高效液相法及紫外分光光度法测定盐酸左氧氟沙星含量。 1 材料 1.1 仪器与试药 岛津LC-20A (改为LC-2010CHT)型高效液相色谱仪;岛津UV-2501(改为UV-2450)型紫外分光光度计;超声波清洗器;乙腈由国药集团化学试剂有限公司提供(改为霍尼韦尔贸易(上海)有限公司提供),为色谱醇;磷酸、醋酸铵、高氯酸钠均为分析纯;盐酸左氧氟沙星对照品(美国西格玛公司,批号:160122)(中国食品药品检定研究院,批号:130455-20116);盐酸左氧氟沙星片(四川科伦药业股份有限公司)。 2 方法 2.1 高效液相法 2.1.1 色谱条件[2] 色谱柱选择Agilent C18 (150 mm×4.6 mm,5 μm),,流动相:醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH值至2.2)-乙腈(85:15),检测波长:294 nm, 进样量10μl,1.0 mL/min流速,柱温为室温(25℃)。 2.1.2 溶液的制备 2.1.2.1 供试品溶液的制备 精密称取20片盐酸左氧氟沙星,研细后混合均匀,精密称取上述供试品50mg置于50ml 容量瓶中,加入0.1mol/l盐酸溶解适量并定量稀释至刻度,经微孔滤膜(0.45um)过滤,取续滤液待用。 2.1.2.2 对照品溶液的制备 精密称取盐酸左氧氟沙星对照品10.23mg于100ml容量瓶中,用适量0.1mol/l盐酸稀释至刻度,摇匀即得。 2.1.3 方法学考察 2.1. 3.1 精密度试验 在“2.1.1”项色谱条件下,对照品溶液过0.45um滤膜后重复进样6次,每次10ul,分别测定峰面积,并计算6组数据所得的相对标准偏差RSD,结果为1.7%<2.0%,符合药典规定,提示,本组方法精密度良好。 2.1. 3.2 重复性试验 选择同批号盐酸左氧氟沙星片6份,精密称定后,根据供试品“2.1.2.1”项操作制备供试品溶液,采用“2.1.1”项色谱条件,进样10ul,采集6份样品的色谱图,计算溶液的相对标准偏差RSD = 1.3% (小于2.0%),符合标准规定,提示本组方法具有较好的重复性。 2.1. 3.3 稳定性试验
阿莫西林含量及有关物质检验方法学的确认
阿莫西林含量及有关物质检验方法学的确认 发表时间:2018-10-01T20:19:45.567Z 来源:《世界复合医学》2018年第07期作者:周磊[导读] 本文主要阐述阿莫西林中国药典检验方法含量及有关物质的确认程序,通过这些程序的执行,可以证明阿莫西林含量、有关物质的检验方法在本实验室可行。。哈药集团制药总厂黑龙江哈尔滨 150086 摘要: 确认是对本身性能的认定,内涵属于性能检验, 中华人民共和国药典2015版二部正文品种对阿莫西林检验标准有法定的规范。针对剂型的特点所规定的基本技术要求;通用的检测方法进行相同检查项目的检测时所应采用的统一的设备、程序、方法及限度等,需要在不同 的实验室进行相应的方法学确认,而满足相应的检测要求,本文主要阐述阿莫西林中国药典检验方法含量及有关物质的确认程序,通过这些程序的执行,可以证明阿莫西林含量、有关物质的检验方法在本实验室可行。。关键词:性能检验程序方法限度检测要求1.实验部分 1.1高效液相色谱仪的性能确认 确认高效液相色谱仪能够持续有效的给出准确、可靠的数据。在确认之前,确保确认的人员经过培训;仪器仪表经过校准,且都在校准的有效期内。高效液相色谱仪进行安装确认后,首先进行检测器灯强度测试、波长准确度测试、通过后进行流速准确度及精确度测试、噪声和漂移确认、进样交叉污染测试、柱温箱温度及稳定性确认、需要进行梯度洗脱方法的需进行梯度准确性确认,自动进样器有温控系统的需进行样品温度准确的确认,定性重复性和定量重复性测试。 1.2前期准备:选择符合检验项目要求的高效液相色谱仪,准备检验用试剂,对照品(阿莫西林对照品、阿莫西林系统适用性试验对照品),准备所用的用具(分析天平,感量0.00001g、超声波清洗仪、容量瓶、移液管、量筒、烧杯、抽滤装置等),准备三批样品。 1.3含量测定方法的确认证明阿莫西林含量的检验方法在本实验室可行按中国药典2015版阿莫西林含量测定项下的检验标准,照高效液相色谱法,由两名不同的人员用一套高效液相色谱仪或同一人用两套高效液相色谱仪进行测试。配制系统适用性试验溶液,取20μl注入液相色谱仪,记录的色谱图应与标准图谱一致。符合规定后,分别称取阿莫西林对照品2份和3批阿莫西林各2份的样品按照规定制备对照品溶液和样品溶液,取对照品1连续进样五次,记录色谱图,以峰面积计算相对标准偏差应不大于 2.0%,取对照品2连续进样两次,供试品每份进样两次,记录色谱图。可接受标准,每批样品两台仪器或两个操作者的结果相对偏差应不大于2.0%。表一:同一操作者两台不同的液相色谱仪3批含量检验结果表二:含量测定系统适用性试验典型图谱1.4有关物质测定的确认证明阿莫西林有关物质测定检验方法在本实验室可行 按照药品质量标准中有关物质项下的规定配制流动相A、B,设定色谱条件,按照系统适用性试验要求进行线性梯度洗脱,取阿莫西林系统适用性对照溶液注入液相色谱仪,记录的色谱图应与标准图谱一致。由两名不同的人员用同一套色谱系统或同一人用两套液相色谱仪进行测试。待系统适用性试验均符合规定后,分别称取双份的对照品和单份的样品,按规定制备对照溶液和样品溶液,对照品每份进样两次,样品进样一次,收集色谱图。计算每批样品两台仪器上或两个操作者检验结果的RD。可接受标准:RD应不大于10%。经两套液相色谱仪测试,三批样品中有关物质单个杂峰及杂峰总和均符合要求。表三:有关物质系统适用性试验典型图谱表四:有关物质典型图谱 2.结果讨论 阿莫西林属于β内酰胺类抗生素,需遮光,密封保存。在含量与有关物质的检验方法学确认的过程中,样品使用带有低温自动进样器的高效液相色谱仪进行含量和有关物质的方法学确认,能够有效地预防含量及有关物质的降解,在有关物质的方法学确认时,需要注入空白溶液,如果空白溶液有干扰,可进行背景扣除。流动相需要新鲜配制,避免磷酸盐缓冲液干扰检验结果的判定。通过对阿莫西林含量及有关物质的方法学确认,证明了该方法在本试验室相应的检验设备上,检验结果可靠,数据准确,通过了药典相应的检验方法的确认。参考文献: 中国药典分析检测技术指南 中华人民共和国药典2015版二部
药物分析题第十七到二十一章
第十七章合成抗菌药物的分析 (一)最佳选择题 1.下列能作为测定左氧氟沙星中光学异构体的HPLC流动相添加剂使用的金属离子是()A. Cu2+ B. Fe3+ C. Co2+ D. Na+ E. Au3+ 2.《中国药典》(2010年版)鉴别诺氟沙星采用的方法是() A.紫外分光光度法B.气相色谱法C.高效液相色谱法 D.化学反应鉴别法E.红外分光光度法 3.具有丙二酸呈色反应的药物是() A.诺氟沙垦B.磺胺嘧啶C.磺胺甲嗯唑D.司可巴比妥E.盐酸氯丙嗪 4.《中国药典》(2010年版)氧氟沙星中“有关物质”检查采用的方法是() A.紫外分光光度法B.薄层色谱法C.高效液相色谱法D.气相色谱法E.毛细管电泳法5.《中国药典》(2010年版)对于盐酸洛美沙星片的含量测定采用的方法是() A.紫外分光光度法B.非水溶液滴定法C.离子对高效液相色谱法 D.气相色谱法E.荧光分光光度法 6.左氧氟沙星原料药的含量测定,《中国药典》(2010年版)采用的是离子对高效液相色谱法,其中所用的离子对试剂是() A.高氯酸钠B.乙二胺C.磷酸二氢钠D.庚烷磺酸钠盐E.氢氧化四丁基铵 7.复方磺胺甲嗯唑中所包含的有效成分是() A.磺胺甲嗯唑和磺胺嘧啶B.磺胺嘧啶和对氨基苯磺酸C.磺胺异嗯唑和磺胺甲嗯唑D.磺胺甲嗯唑和甲氧苄啶E.磺胺和对氨基苯磺酸 8.下列含量测定方法中,磺胺类药物未采用的方法是() A.沉淀滴定法B.溴酸钾法C.紫外分光光度法D.非水溶液滴定洼E.亚硝酸钠滴定法9.用亚硝酸钠滴定法测定磺胺甲噁唑含量时,ChP2010选用的指示剂或指示终点的方法是() A.永停法B.外指示剂法C.内指示剂法D.淀粉E.碘化钾-淀粉 10.复方磺胺甲嚼唑注射液中磺胺、对氨基苯磺酸以及甲氧苄啶降解产物的检查.ChP2010采用的方法是() A.薄层色谱法B.紫外分光光度法C.高效液相色谱法D.比色法E.高效毛细管电泳法(二)配伍选择题 [11—12] A.吸光度B.甲醇与乙醇C.光学异构体D.乙醚、乙醇与丙酮E.防腐剂 11.除去吸光度外,诺氟沙星滴眼液应检查的是() 12.左氧氟沙星应检查的是() [13—15] A.重氮化反应B.与生物碱沉淀剂反应C.铜盐反应 D.A与B两项均有E.以上各项均没有 13.利用磺胺类药物结构中的磺酰胺基进行鉴别的反应有() 14.利用磺胺类药物结构中N1上具有嘧啶类取代基的分解产物,而进行鉴剔的反应有() 15.利用磺胺类药物结构中N1上的含氮杂环取代基进行鉴别的反应有() [16—19] A.紫外分光光度法B.双波长分光光度法C.非水酸量法 D.两步滴定法E.高效液相色谱法 16. ChP2010复方磺胺嘧啶片中的甲氧苄啶含量测定采用() 17. ChP2005复方磺胺甲嚼唑片中的甲氧苄啶含量测定采用()
阿莫西林聚合物测定原理和几点注意事项
阿莫西林聚合物测定原理和几点注意事项 浙江省食品药品检验所 抗生素中的高分子聚合物杂质是引发抗生素药物过敏反应的真正过敏原,因此严格控制抗生素药物中高分子聚合物的含量有着重要的意义。近日监督抽样中发现,阿莫西林胶囊聚合物含量超限问题较严重,因此我们以阿莫西林胶囊为例,对阿莫西林高分子聚合物测定的原理和测定过程中需要注意的问题进行了研究,现总结如下: 一、测定原理 和其他β-内酰胺类抗生素的聚合物测定方法一样,阿莫西林胶囊采用Sephadex G-10凝胶色谱系统测定。Sephadex G-10的排阻分子量为700d,因此除部分寡聚物外,阿莫西林胶囊聚合物在色谱过程中均不保留,即所有的高分子杂质表现为单一的色谱峰,阿莫西林主成分表现为另一色谱峰。由于高分子聚合物的对照品难以制备,而此利用药品自身对照品在水溶剂及纯水流动相中主成分缔合物作对照,取代高分子杂质对照品对阿莫西林胶囊聚合物进行检测,较好的解决了这一难题;而在缓冲液作为溶剂及流动相的情况下,阿莫西林
相对不易聚合,因而在此条件下测定样品中聚合物的含量。 二、几个注意点 1、对照品。进口药品注册标准(JX20000355)和中国药典2005年版二部采用不同的对照品,结果按照进口药品注册标准检测得聚合物含量约为按药典方法的2倍。差别如此大的主要原因是进口药品注册标准以阿莫西林为对照品,中国药典2005年版二部选用青霉素作为对照品,两种对照品紫外响应不同,因而作为外标计算同一样品中聚合物含量所得结果也不同。 2、溶解方法。样品溶解可采用加2%Na2CO3溶液助溶和超声溶解两种方法,两种方法所得结果基本上没有差异。需要注意的是超声溶解时间不宜过长,超声用水不宜过热,否则容易使聚合物含量上升。b)样品溶解至进样放置时间不宜过长。C)阿莫西林对照溶液不稳定,在进样过程中峰面积越来越小,峰面积逐渐降低,峰宽逐渐增宽,造成连续进样的峰面积相对标准偏差较大,因此对照品溶解后要马上连续进样,有条件的要使用低温进样保温器。 3、Sephadex G-10色谱柱的活化。色谱柱对样品有一定吸附
阿莫西林原料药质量标准USP-36版
C16H19N3O5S,3H2O 419.45 4-硫代-1-氮杂双环[3.2.0]-庚烷-2-羧酸,6-[[氨基(4-羟苯基)乙酰基]氨基]-3,3-二甲基-7-氧-,三水合[3S-[2α,5α,6β(S*)]]-;(2S,5R,6R)-6-[(R)-(-)-2-氨基-2-(p-羟苯基)-乙胺基]-3,3-二甲基-7-4-硫代-1-氮杂双环[3.2.0]-庚烷-2-羧酸水合物 无水物365.41 定义:每mg阿莫西林包含C16H19N3O5S不少于900ug不多于1050ug,由无水物计算。 鉴别:红外吸收【197k】 含量: 步骤: 溶剂:用水配置6.8g/l的磷酸二氢钾溶液。用45%氢氧化钾溶液调节pH至5.0±0.1。 流动相:乙腈和稀释液(1:24) 标准溶液:用溶剂溶解阿莫西林标准品(USP)1.2mg/ml(注意:在6h之内使用) 试样溶液:用溶剂溶解阿莫西林1.2mg/ml[注意:在6h之内使用] 色谱系统:(见液相色谱(621),系统适应性) 模式:LC 检测器:UV 230nm
柱:4mm×25cm;填充物L1 流速:1.5ml/min 进样量:10ul 系统适应性: 样品:标准溶液 适应性需求: 拖尾因子:不大于2.5 相对标准偏差:不大于2.0% 分析: 试样:标准溶液和样品溶液计算C16H19N3O5S,3H2含量ug/mg用以下公式结果=(ru/rs)×(Cs/Cu)×P ru=样品溶液中得出的峰面积 rs=标准品中得出的峰面积 Cs=标准品阿莫西林溶液的浓度 Cu=样品溶液的浓度 P=阿莫西林标准品的效价(ug/mg) 验收标准:每mg无水化合物中900~1050ug C16H19N3O5S 杂质: 有机杂质: 步骤:溶液A:2.72g/l磷酸二氢钾。用1N氢氧化钾或20%磷酸调节pH到5.0±0.1
静脉输注药物的正确使用_(1)
临床应用的给药途径中以静脉给药为最普遍 静脉输液是临床用药、治疗疾病、补充营养的重要手段 静脉药物配置质量的优劣,直接关系到临床治疗效果和患者用药安全 风险性较大的一种给药方式 简称输液反应,系输液引起或与输液相关不良反应的总称。 “热原反应”只是输液不良反应的一个部分。 临床最常见的输液反应是热原反应和类热原样反应 所致的发热、寒战、呕吐等,其他尚有菌(细菌、芽 胞、真菌)污染反应,过敏反应等。 在输液后15分钟至1小时内,发生冷感、寒战,发热 38℃以上,可伴有恶心、呕吐、头痛,腰部及四肢关节剧 痛,皮肤苍白、湿冷、血压下降,休克甚至死亡,于停止 输液后数小时内体温恢复正常。 静脉炎 当患者静脉输液的疗程较长,输入药物的刺激性较强,或因反复穿刺 致机械性损伤,以及患者的特殊体质,操作时消毒不严格等都会导致静 脉炎。主要表现为沿静脉走向呈条索状红线,局部组织发红、肿胀、灼 热、疼痛,有时伴有畏寒、发热等全身症状。 急性心衰 多因患者本身患有冠心病且输液量大,输液 滴速太快所致。 热原:微生物的代谢产物(药剂学) 微粒异物:橡胶微粒、不溶性无机盐、活性炭微粒、纤维、配伍用药 过程中产生的微粒 病菌或灰尘:没经滤过的空气携带进入输液 输液器具 操作因素 药物因素 病人因素 明确溶媒pH值,药物特性,对静脉输液的稳定性十分重要 青霉素水溶液在pH 6.0-6.5 稳定 如选用葡萄糖作为溶媒,加速青霉素的β-内酰胺环水解,效价降低 青霉素类及其酶抑制剂(除苯唑西林等异噁唑青霉有耐酸性质),在 葡糖注射液中有一定程度的分解。 氨苄西林、阿莫西林在葡萄糖注射液中不仅被葡萄糖催化水解,还能产生聚合物,增加过敏反应。 头孢类的β-内酰胺环较青霉素类稳定,可与葡萄糖配伍,但实验也证明头孢类与 0.9%的氯化钠>5%GS>10%GS. 依托泊苷注射液在葡萄糖溶液中不稳定,可形成细微沉淀,应该用0.9%氯化钠注射液稀释。 盐酸吡柔比星只能用5%葡萄糖注射液或注射用水溶解,以免pH的原因影响效价。 奥沙利铂不能与碱性药物或介质、氯化物、碱性制剂等一起使用,用5%葡萄糖
阿莫西林
阿莫西林的波谱分析 阿莫西林(Amoxicillin),又名安莫西林或安默西林,是一种最常用的青霉素类广谱β-内酰胺类抗生素,为一种白色粉末,半衰期约为61.3分钟。在酸性条件下稳定,胃肠道吸收率达90。阿莫西林杀菌作用强,穿透细胞膜的能力也强。是目前应用较为广泛的口服青霉素之一,其制剂有胶囊、片剂、颗粒剂、分散片等等。青霉素过敏及青霉素皮肤试验阳性患者禁用。 阿莫西林分子式 采用近红外漫反射光谱分析技术对阿莫西林胶囊进行定量和定性分析。方法:按阿莫西林胶囊配方组成配制含主药阿莫西林浓度范围从5.91%~84.13%的32个实验室样品,并收集来源于九个厂家的41批工业样品,采集其近红外光谱。分别采用偏最小二乘回归和判别分析法建立定量和定性分析模型,将其用于对未知样品含量进行预测分析,并对定量分析方法的重现性和加样回收率进行考察。结果:定量分析模型对24个未知样品的的预测均方差RMSEP为1.22%,预测值与真值的相关系数R为0.9983,加样平均回收率为99.75%,系统精密度RSD为0.3%,方法精密度RSD为0.6%;定性分析模型对18个预测样品的判错率为0%。结论:用近红外光谱分析技术对阿莫西林胶囊进行定量和定性分析结果准确可靠,方法简便快速,不需预处理,可推广用于此类样品工业现场的原位和在线检测。
阿莫西林药物分析: 方法名称:阿莫西林原料药-阿莫西林-高效液相色谱法 应用范围:本方法采用高效液相色谱法测定阿莫西林原料药中阿莫西林的含量。 本方法适用于阿莫西林原料药。 方法原理:供试品经流动相溶解并定量稀释,进入高效液相色谱仪进行色谱分离,用紫外吸收检测器,于波长254nm处检测阿莫西林的峰面积,计算出其含量。 试剂: 1. 乙腈 2. 磷酸二氢钾溶(0.05mol/L) 3. 氢氧化钾溶液(2mol/L) 仪器设备: 1. 仪器 1.1 高效液相色谱仪 1.2 色谱柱 十八烷基硅烷键合硅胶为填充剂,理论塔板数按阿莫西林峰计算应不低于2000。 1.3紫外吸收检测器 2. 色谱条件 2.1 流动相:0.05mol/L磷酸二氢钾溶液(用2mol/L氢氧化钾溶液调节pH值至5.0)乙腈=97.5 2.5 2.2 检测波长:254nm 2.3 柱温:室温 .2.4 流速:1mL/min 试样制备: 1. 对照品溶液的制备 精密称取阿莫西林对照品约25mg,置50mL量瓶中,加流动相溶解并定量稀释至刻度,摇匀,即为对照品溶液。 2. 供试品溶液的制备 精密称取供试品约25mg,置50mL量瓶中,加流动相溶解并定量稀释至刻度,摇匀,即为供试品溶液。 注:“精密称取”系指称取重量应准确至所称取重量的千分之一。“精密量取”系指量取体 积的准确度应符合国家标准中对该体积移液管的精度要求。 操作步骤:分别精密吸取对照品溶液和供试品溶液各20mL,注入高效液相色谱仪,用紫外吸 收检测器于波长254nm处测定阿莫西林(C16H19N3O5S)的峰面积,计算出其含量。
HPLC法测定盐酸左氧氟沙星片的含量
H P L C法测定盐酸左氧氟 沙星片的含量 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
HPLC法测定盐酸左氧氟沙星片的含量 摘要:目的:对HPLC及UV测定盐酸左氧氟沙星片的含量进行比较。方法:高效液相色谱法选择色谱柱为AgilentC18(150 mm×4.6 mm,5μm),流动相为醋酸铵高氯酸钠溶液(pH=-乙腈(85:15),流速为·min-1,检测波长为294nm;紫外分光光度法选择294nm波长测定含量.结果:HPLC法中盐酸左氧氟沙星片在·mL-1~·mL-1范围内线性关系良好.回归方程Y=523247X-23331(r=),加样回收率平均值为%,%。结论:HPLC法及紫外分光光度法均准确性、重复性高、精密度好,可考虑将紫外分光光度法作为盐酸左氧氟沙星含量测定的替代方法使用。 关键词:高效液相法;紫外分光光度法;盐酸左氧氟沙星 左氧氟沙星是氧氟沙星的L-型光学活性异构体,因其抗菌谱广、抗菌作用强、不良反应率较低,而被广泛使用[1]。2015版药典推荐高效液相法来分析本品及其相关剂型,考虑到基层药物监测机构尚不能完全普及高效液相设备[2],本文对比分析高效液相法及紫外分光光度法测定盐酸左氧氟沙星含量。 1材料 仪器与试药 岛津LC-20A(改为LC-2010CHT)型高效液相色谱仪;岛津UV-2501(改为UV-2450)型紫外分光光度计;超声波清洗器;乙腈由国药集团化学试剂有限公司提供(改为霍尼韦尔贸易(上海)有限公司提供),为色谱醇;磷酸、醋酸铵、高氯酸钠均为分析纯;盐酸左氧氟沙星对照品(美国西格玛公司,批号:
阿莫西林可溶性粉说明书
兽 用 阿莫西林可溶性粉使用说明书 【兽药名称】 通用名:阿莫西林可溶性粉 商品名: 英文名:AmoxicillinSolublePowder 汉语拼音:AmoxilinKerongxingfen 本品主要成分及化学名称:阿莫西林,(2S,5R,6R)-3,3- 二甲基-6-[R-(-)-2-氨基-2-(4-羟基苯基)乙酰氨基]-7-氧代-4- 硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸三水合物 结构式: 分子式:C16H19N3O5S·3H2O分子量:419.46 【性状】本品为白色或类白色粉末。 【药理作用】 药效学:本品穿透细胞壁的能力较强,能抑制细菌细胞壁的 合成,使细菌迅速成为球形体而破裂溶解,故对 多种细菌的杀菌作用较氨苄西林迅速而强。但对 志贺氏菌属的作用较弱。细菌对本品有完全的交 叉耐药性。 药动学:阿莫西林在胃酸中较稳定,单胃动物内服后约 72%~92%被吸收。食物能降低其吸收速率,但不 影响吸收量。同等剂量内服后阿莫西林的血清浓 度一般比氨苄西林大1.5~3倍。阿莫西林在肝、 肺、前列腺、肌肉、胆汁和腹水、胸水、关节液 等组织和体液中广泛分布。药物在房水中浓度极 低,在乳汁、泪液、汗液和唾液中存在微量。亦 能透过胎盘进入胎儿循环内。可与血浆蛋白结 合,主要通过肾小管排泌,在尿中排泄。 【适应症】主要用于对氨苄西林敏感的革兰氏阳性球菌和革兰氏 阴性菌感染,如巴氏杆菌病、大肠杆菌病、白痢、 沙门氏菌病,葡萄球菌、链球菌感染等。 【注意事项】1、对青霉素耐药的革兰氏阳性菌感染不宜应用。 2、现配现用。 【用法与用量】以阿莫西林计。混饮:每1L水,鸡60mg,连用3-5日。 【不良反应】标准暂无。 【休药期】鸡7日,蛋鸡产蛋期禁用。 【规格】50g:5g 【包装】100g或250g或500g或1kg或5kg/袋 【贮藏】遮光,密封保存。 【有效期】一年 【批准文号】 【生产企业】
设计方案(左氧氟沙星)
盐酸左氧氟沙星片 人体相对生物利用度及生物等效性试验 临床研究方案 华中科技大学同济医学院临床药理研究所 华中科技大学同济医学院国家药品临床研究基地 2004年3月
前言 左氧氟沙星(Levofloxacin)又称可乐必妥、利复星、左氧沙星、Cravit、CVFX,由日本Daiichi(第一制药株式会社)公司开发研制;1993年1月在日本首次上市。国内首次注册时间是1995年,注册号为:X950251。 【药理作用】左氧氟沙星是消旋氧氟沙星的左旋体,其抗菌活性是氧氟沙星的2倍。本品作用于细菌的DNA旋转酶(拓扑异构酶II),通过抑制DNA旋转酶的活性来阻碍DNA复制,从而杀灭细菌;它还可以溶解细菌的部分结构。本品对包括厌氧菌在内的革兰氏阳性菌和阴性菌具有广谱抗菌作用,对葡萄球菌、肺炎球菌、淋球菌、化脓性链球菌、溶血性链球菌、肠球菌、大肠杆菌、克雷白氏杆菌、绿脓杆菌、变形杆菌等显示有较强的抗菌活性。另外,本品对衣原体、支原体也有抗菌作用。 【体内过程】左氧氟沙星口服吸收迅速、完全,生物利用度接近100%,同服食物不影响吸收。口服后能迅速有效地渗透到全身,在组织或体液中地药物浓度高于血浆浓度。健康成人单剂量口服本品50、100、200mg后,血浆药物浓度达峰时间为0.9~2.4h,峰浓度分别为0.6、1.2、2.0μg/ml,表观分布容积为1.09~1.26L/kg。本品在体内几乎不代谢,血浆半衰期为4.3~6.0h,在口服24h内,用药剂量的80%~85%以原形从尿液中排泄。 【用法用量】(1)口服:每次0.1~0.2g,每日2~3次,疗程为3~7天。用于淋病治疗时,可单剂量顿服0.4~0.6g。(2)静脉滴注:每次0.2~0.3g,每日2次。 【不良反应】本品的不良反应与氧氟沙星相同,但比较轻。主要
阿莫西林中残留溶媒测定方法验证方案
1 (1) 2 (1) 3 (1) 4 (1) 5 (1) 6 (2) 7 (3) 8 (5) 8.1 (5) 8.2 (5) 8.3 (6) 8.4 (6) 8.5 / (7) 8.6 (8) 8.7 (8) 9 (9) 10 (9) 11 (17) 12 (17) 13 // (17)
1 2010 2 3 4 ICH Q2a CHP 2010 5 5 1 /QC /QC /QC /QC /QC /QC
5 2 6 6.1 XS205 Q2238C 2009.05.15 2010.05.14 CP225D Q2223B 2009.05.15 2010.05.14 7890A Q2283A 2009.08.14 2011.08.13 7890A Q2283B 2009.08.14 2011.08.13 GC-2010 Q2235A 2009.03.18 2011.03.17 DB-624 G-87 -- -- DB-624 G-69 -- -- SPB-624 G-20 -- -- 6.2 N,N- 5002002 LS001-005 LS002-002
7 7.1 5000ppm 600ppm 7.2 7.2.1 N,N- 7.2.2 250mg 30mg 50ml 5.0ml 100ml 5.0ml 20ml 7.2.3 250mg 20ml 5.0ml 7.3 6% 94% 30m× 0.53mm×3.0um) 5.0ml/min 1.0ml 300 10 1 80 30min FID 250 40 4min 30 /min 200 6min 7.4 30min 1.0ml 6 R 1.5 N 5000 2 8 RF RSD 15.0
HPLC法测定阿莫西林胶囊中阿莫西林的含量
HPLC法测定阿莫西林胶囊中阿莫西林的含量 【摘要】阿莫西林又名安莫西林或安默西林,分子式为C16H19N3O5S,是一种最常用的青霉素类广谱β-内酰胺类抗生素。固定相为:依利特hypersil BDSC18色谱柱(4.6*250*5u ),乙腈-甲醇-0.1mol/L的磷酸二氢钾溶液-冰醋酸(10∶10:80:0.1)为流动相,检测波长为254nm;阿莫西林在100~350μg·mL-1范围内呈良好的线性关系。阿莫西林的平均回收率为99.5%。本法简便、重现性好、回收率高,可用于阿莫西林胶囊中阿莫西林的含量测定。 【关键词】阿莫西林胶囊;阿莫西林;测定 阿莫西林又名安莫西林或安默西林,分子式为C16H19N3O5S,是一种最常用的青霉素类广谱β-内酰胺类抗生素。阿莫西林杀菌作用强,穿透细胞壁的能力也强,是目前应用较为广泛的口服青霉素之一。阿莫西林适用于溶血链球菌、肺炎链球菌、葡萄球菌或流感嗜血杆菌所致中耳炎、鼻窦炎、咽炎、扁桃体炎等上呼吸道感染、溶血链球菌、葡萄球菌或大肠埃希菌所致的皮肤软组织感染、急性单纯性淋病、溶血链球菌或葡萄球菌或流感嗜血杆菌所致急性支气管炎、治疗伤寒、伤寒带菌者及钩端螺旋体病等。本文用高效液相法对阿莫西林胶囊中的阿莫西林的进行了含量测定。 1.仪器与试药 KHW-D-1LC精密拉伸水浴锅(上海科恒实业发展有限公司);UPLC 超高效液相色谱系统(沃特世科技(上海)有限公司);R-1001-VN旋转蒸发仪(郑州长城科工贸有限公司)TU-1901 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);QT3120K脱气可调型超声波清洗器(天津市瑞普电子仪器公司);TGL-18C高速台式离心机(上海楚柏实验室设备有限公司);XYG-H帕恩特痕量分析级超纯水机(北京湘顺源科技有限公司);DOA-P504-BN无油隔膜真空泵(上海洽姆仪器科技有限公司);瑞士梅特勒-托利多MS精密天平(梅特勒-托利多中国公司)。甲醇(深圳市中原化工科技有限公司)、冰乙酸(衡阳市迅源化学试剂有限公司)、乙腈(盖州市鹏圣化工有限公司)、磷酸(南京盛庆和化工有限公司)、醋酸(山东高密高源化工有限公司)、磷酸二氢铵(深圳市中原化工科技有限公司)、盐酸(深圳市中原化工科技有限公司)。 2.含量测定 2.1色谱条件 依据查阅文献及考查的结果,确定色谱条件如下[1-11]。色谱柱为依利特hypersil BDSC18色谱柱(4.6*250*5u );乙腈-甲醇-0.1mol/L的磷酸二氢钾溶液-冰醋酸(10∶10:80:0.1)为流动相;检测波长为254nm;流速1.0mL·min-1;柱温:30℃。理论板数按阿莫西林峰计算应不得低于2000。
14五药物分析复习题
药物分析 一、选择题 1、《中国药典》规定用银量法测定巴比妥类药物的含量,采用的终点指示方法是( ) A:永停滴定法B:内指示剂法C:外指示剂法D:电位滴定法E:观察形成不溶性的二银盐 2、在碱性条件下与AgNO3反应生成不溶性二银盐的药物是() A:咖啡因B:尼可刹米C:安定D:巴比妥类E:维生素E 3、巴比妥类药物与AgNO3作用下生成二银盐沉淀的反应,是基于结构中含有( ) A:R取代基B:酰肼基C::芳香伯氨基D:酰亚胺基E:以上都不对 4.巴比妥类药物的基本母核() A:水杨酸B:对氨基苯甲酸C:环状丙二酰脲D:对氨基苯磺酰胺E:吡啶环 5.丙二酰脲类鉴别反应是下列哪类药物的一般鉴别试验() A:芳酸及其酯类B:生物碱类药物C:巴比妥类药物D:磺胺类药物E:杂环类药物 6.取某药物供试品约0.2g,加氢氧化钠试液5ml与醋酸铅试液2ml,生成白色沉淀后;加热后沉淀变为黑色,该药物是()A:苯巴比妥B:硫喷妥钠C:异戊巴比妥钠D:司可巴比妥钠E:苯巴比妥钠 7、在碱性条件下加热水解产生氨气使红色石蕊试纸变蓝的药物是() A:乙酰水杨酸B:异烟肼C:对乙酰氨基酚D:盐酸氯丙嗪E:巴比妥类 8、与碘试液反应发生加成反应,使碘试液颜色消失的巴比妥类药物是() A:苯巴比妥B:司可巴比妥C:巴比妥D:戊巴比妥E:硫喷妥钠 9、下列哪种方法可以用来鉴别司可巴比妥?() A:与溴试液反应,溴试液褪色B:与亚硝酸钠-硫酸反应,生成桔黄色产物C:与铜盐反应,生成绿色沉淀D:与三氯化铁反应,生成紫色化合物 10、硫喷妥钠与铜盐的鉴别反应产物为()A:紫色B:蓝色C:绿色D:黄色E:棕黄色 15.需检查游离水杨酸的药物是()A:苯甲酸B:阿司匹林C:布洛芬D:羟苯乙酯E:对乙酰氨基酚 16.阿司匹林与三氯化铁试液反应生成紫堇色,是因为阿司匹林结构中具有() A:羧基B:酚羟基C:氨基D:苯环E:酯键,水解后可产生酚羟基 17.可用直接酸碱滴定法测定阿司匹林含量,是因为阿司匹林结构中具有()A: 羧基B:酚羟基C:氨基D:苯环E:酯键17.现行版《中国药典》规定,肾上腺素应检查酮体,其检查的方法是() A: 比色法B:紫外可见光光度法C:旋光法D:薄层层析法E:红外光谱法 18、阿司匹林中特殊杂质检查包括溶液的澄清度和游离水杨酸的检查。其中溶液的澄清度检查是利用() A:药物与杂质的溶解行为的差异B:药物与杂质旋光性的差异C:药物与杂质颜色的差异D:药物与杂质嗅味及挥发性的差异E:药物与杂志对光吸收性质的差异 19、药物结构中与FeCl3发生显色反应的活性集团是() A:甲酮基B:酚羟基C:芳伯氨基D:乙酰基E:烯醇基 支富寶狂发十亿红包!长按复制此消息,打开最新版支付宝就能领取!利C淼灿V佳领迈静衡4觉广() A:防止滴定时阿司匹林水解B:使溶液的pH 值等于7 C:使反应速度加快D:防止在滴定时吸收CO2E:防止被氧化 21.凡是分子结构中具有芳香第一胺的药物均可() A:与硝酸银反应鉴别B:用甲醛-硫酸反应鉴别C:用重氮化-偶合反应鉴别D:用硫酸反应鉴别 22.磺胺甲噁唑与硫酸铜反应生成()沉淀 A:黄绿色B:蓝绿色C:淡棕色D:紫色E:草绿色 23、下列哪个药物不能用重氮化反应()A:盐酸普鲁卡因B:对乙酰氨基酚C:对氨基苯甲酸D:乙酰水杨酸E:对氨基水杨酸钠
高效液相色谱-串联质谱法对动物源食品中阿莫西林药物残留的检测
高效液相色谱-串联质谱法对动物源食品中阿莫西林药物残留的检测 摘要:本文通过对前处理以及仪器方法的研究和优化,建立了动物源食品中阿莫西林残留的液相色谱-串联质谱(LC-MS/MS)检测方法。样品经过磷酸盐缓冲溶液提取,乙酸锌沉淀蛋白,HLB固相萃取柱净化,乙腈/0.005%甲酸洗脱后,直接上机检测。采用乙腈-10 mmol/L乙酸铵(0.35%甲酸)为流动相,经Waters XBridgeTM HILIC(2.0 mm× 150 mm i.d., 3 μm)分离后,电喷雾串联质谱测定。在加标水平100~300 ng/g范围内,加标回收率为75.42%~90.22%,相对标准偏差小于10%,方法定量限为0.06 μg/kg。该方法灵敏度高,重现性好,适于猪肉、猪肉成品、鸡肉和鸡肉成品中阿莫西林残留的测定。 关键词:阿莫西林;动物源食品;残留检测;液相色谱-串联质谱法;HILIC色谱柱 Determination of the residue of Amoxicillin in animal origin food stuffs by LC-MS/MS Abstract:A high performance liquid chromatography-tandem mass spectrometric (LC-MS/MS) method has been established for determination of amoxicillin in animal origin food stuffs by optimization analysis. The samples were extracted with phosphate buffer, precipitated the proteins with zinc acetate, and purified by HLB solid phase extraction column, then eluted with acetonitrile-0.005% formic and directly analyzed by LC-MS/MS. The separation was carried out on a Waters XBridge TM HILIC (2.0 mm×150 mm i.d., 3 μm), using acetonitrile and 10 mmol/L ammonium acetate(0.35% formic) as mobile phases. The analysis used ESI as ion source, confirmed and quantified by MS/MS. The average recovery was 75.42~90.22% and the RSD was less than 10% when the concentrations are in the range of 100~300 ng/g. The limit of quantification of this method was 0.06μg/kg. This method was sensitive, reproducible, and was suitable for determination of amoxicillin in animal origin food stuffs. Key words:amoxicillin; animal origin food stuffs; residues determination; liquid chromatography-tandem mass spectrometry; HILIC column 中图分类号:TS251.7 文献标志码: A 文章编号: 阿莫西林(Amoxicillin),又名安莫西林或安默西林,学名称为羟氨苄青霉素,属于青霉素类β-内酰胺抗生素,为半合成的耐酸广谱青霉素类抗菌素,对金黄色葡萄球菌、炭疽杆菌、胸膜炎放线杆菌等几种常见的重要致病菌都具有较强的抗菌活性,目前广泛应用于兽医临床[1]。阿莫西林的不当或过量使用都会造成其在动物性食品中的残留,食用后会导致人体内白血球降低,影响内脏功能,发生脏器损害等,对老人、儿童,特别是胎儿的影响更大,严重者会导致胎儿病变、畸形、流产、死亡[2]。2012年底我国出现的速成鸡事件中,使用的兽药中就包括阿莫西林,因此很多国家和地区都对阿莫西林残留量有严格的要求,是欧盟和北美等国家对进口动物性食品的必检项目之一。欧盟要求在动物的肌肉、肝、肾、脂肪中的阿莫西林的最高限量为0.05 mg/kg;美国要求0.01 mg/kg;日本要求0.02 mg/kg。 目前报道的阿莫西林残留分析的方法主要有液相色谱法[3]、免疫分析法[4]、和微生物测定法[5]、液相色谱-串联质谱法[6]。近年来,随着液相色谱-串联质谱(LC-MS/MS)技术的发展,其不仅具有液相色谱的高分离性能,而且能提供药物结构方面的信息,可以进行确证检测,在药物残留分析领域得以广泛应用,因此本实验选择用液相色谱-串联质谱法分析阿莫西林残留。 目前关于阿莫西林样品前处理方法报道很多,但是在实际应用方面存在很多缺点,从一些企业内部的检测中心和第三方检测机构了解到,目前报道的关于鸡肉产品中阿莫西林的检测方法不能在实际中使用。比如有报道方法[2,7],采用75mg/L的三氯乙酸进行除蛋白;中国国标方法[8]直接用磷酸盐缓冲液提取,不进行除蛋白,直接进行SPE净化。但是现在养殖场都是大规模饲养,鸡的出栏周期很短,肌肉纤维少,
盐酸地左氧氟沙星片
盐酸左氧氟沙星片 Levofloxacin Hydrochloride Tablets 一、参比试剂的选择 1、国内上市情况 目前国内盐酸左氧氟沙星片有93个文号,规格有为100mg、200mg、250mg、500mg。 山东华信制药集团股份有限公司规格:100mg。 盐酸左氧氟沙星片国内无进口。 2、国外上市情况 左氧氟沙星由赛诺菲-安万特公司开发,商品名为“Tavanic”,美国市场授权给强生公司,美国上市规格为250mg、500mg、750mg。1993年赛诺菲将欧洲、亚洲、非洲、中东和南美等地区的生产和销售权授予给第一三共株式会社。 盐酸左氧氟沙星片未在EMEA上市。 左氧氟沙星片在日本上市,规格为100mg、250mg、500mg。其中第一三共株式会社上市规格为250mg、500mg。 3、参比制剂 左氧氟沙星片原研厂家为JANSSEN PHARMS,其于1996年12月20日获得FDA批准在美国上市,规格为250mg、500mg、750mg。规格与华信制药集团差别大且需要一次性进口。 左氧氟沙星片由第一三共株式会社在国内生产,规格分别为0.1g和0.5g,分别于2000年和2004年获得生产批件,批准文号分别为国药准字H20000655和国药准字H20040091。 盐酸左氧氟沙星在国内无进口制剂,也无进口本地化制剂上市。氧氟沙星片由第一三共株式会社生产,规格为0.1g和0.5g。第一三共株式会社在亚洲的生产和销售权为原研公司赛诺菲授予,因此第一三共株式会社的左氧氟沙星片既是原研制剂,可作为国内一致性评价的参比制剂。 二、体外溶出曲线 1、左氧氟沙星片FDA溶出方法
CGMP文件 工作对照品杂质对照品的接收处理保管标准程序SOP
1.0目的Purpose: 描述工作对照品/对照品/杂质对照品的接收、处理和保管的标准程序 To lay down a procedure for receipt, handling and maintenance of working standard/ reference standard and impurities. 2.0范围 Scope: 本程序适用于工作对照品/对照品/杂质对照品的接收、处理和保管。这些对照品来自研发部门和外部原料药生产商。 This procedure is applicable for receipt, handling and maintenance of working standard/reference standard and impurities received from R&D & External API vendor. 3.0定义 Definitions: 无 Nil 4.0责任 Responsibility: 所有的QC人员有责任在他们的岗位上遵循此标准操作程序的操作。 All QC personal are responsible for following this SOP as per their respective roles. 5.0程序 Procedure 5.1接收Receipt: 5.1.1在接收的时候,检查是否有检验报告单(COA)和支持性数据。若没有, 则向厂家索取。检查容器是否完好无损,对比COA和标签的内容。 At the time of receipt, check the availability of Certificate of Analysis (COA) and supporting data. If not, then ask the source to provide them. Check the intactness of containers and compare the contents of COA and label. 5.1.2 如果发现不符合之处,跟生产商联系来更正它。 If any discrepancy is observed, then contact supplier to correct them. 5.1.3 按照附录-I的要求记录每个工作对照品/对照品/杂质对照品的接收细节。 Record the receipt details of each working standard/reference standard and impurities as per Annexure-I. 5.1.4 接收的序号应被视为工作对照品/对照品/杂质对照品的内部编码。
