高中化学第一章第四节维生素和微量元素练习新人教版选修

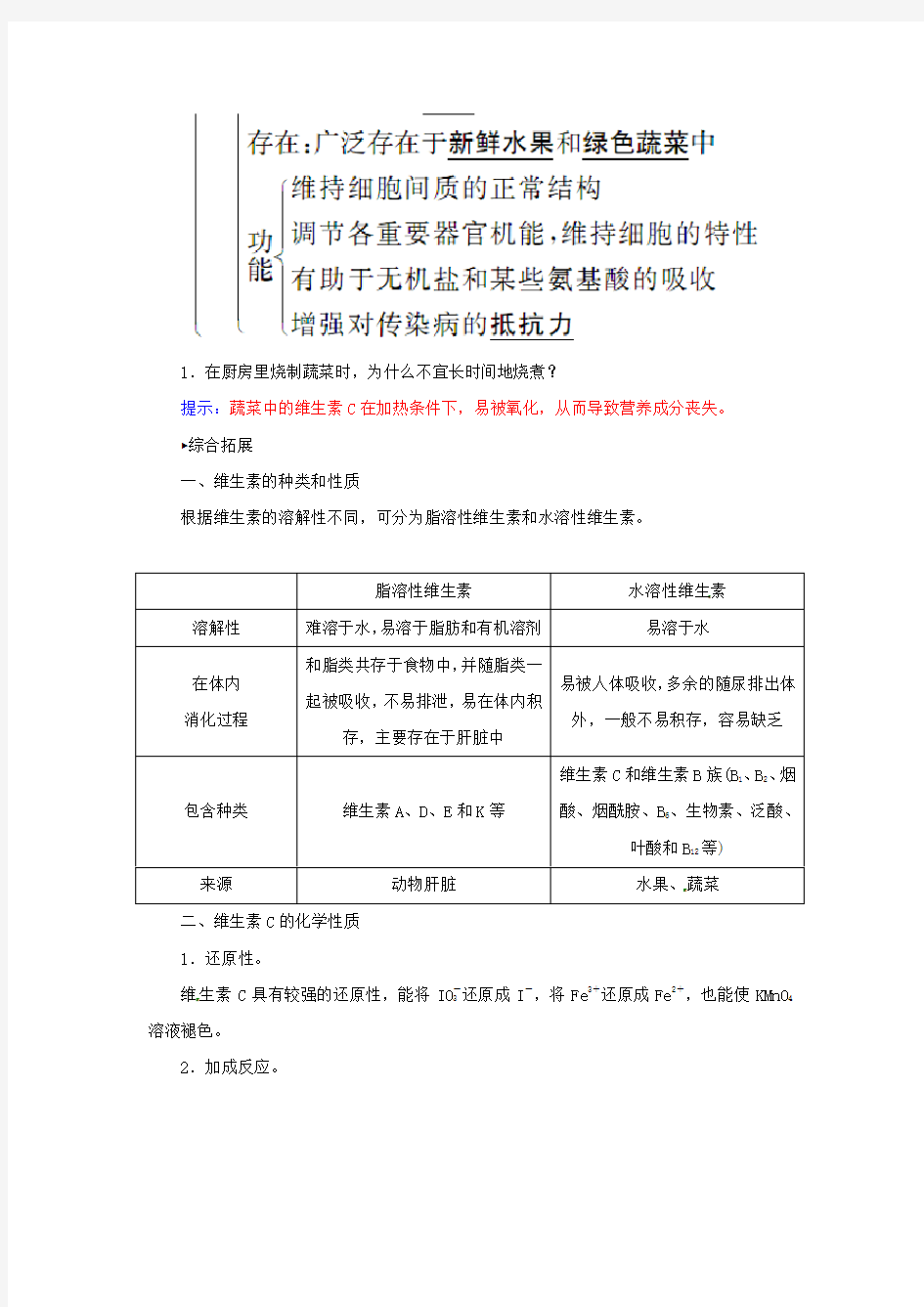
第四节维生素和微量元素
1.在厨房里烧制蔬菜时,为什么不宜长时间地烧煮?
提示:蔬菜中的维生素C在加热条件下,易被氧化,从而导致营养成分丧失。?综合拓展
一、维生素的种类和性质
根据维生素的溶解性不同,可分为脂溶性维生素和水溶性维生素。
脂溶性维生素水溶性维生素溶解性难溶于水,易溶于脂肪和有机溶剂易溶于水
在体内消化过程和脂类共存于食物中,并随脂类一
起被吸收,不易排泄,易在体内积
存,主要存在于肝脏中
易被人体吸收,多余的随尿排出体
外,一般不易积存,容易缺乏
包含种类维生素A、D、E和K等维生素C和维生素B族(B1、B2、烟酸、烟酰胺、B6、生物素、泛酸、
叶酸和B12等)
来源动物肝脏水果、蔬菜
二、维生素C的化学性质
1.还原性。
维生素C具有较强的还原性,能将IO-3还原成I-,将Fe3+还原成Fe2+,也能使KMnO4溶液褪色。
2.加成反应。
维生素C含有碳碳双键( ),能与H2发生加成反应。
3.酯化反应。
维生素C具有多个醇羟基(—OH),在一定条件下能与羧酸发生酯化反应。
?尝试应用
1.(双选题)下列关于维生素C的说法中不正确的是(CD)
A.易溶于水,水溶液显酸性
B.受热易分解
C.在水溶液中容易被还原
D.新鲜的水果和蔬菜中含有大量维生素C
解析:维生素C是一种较强的还原剂,在水溶液中容易被氧化,C项错误;维生素C广泛存在于新鲜的水果和蔬菜中,但含量并不多,D项错误。
微量元素
地球上的生命起源于海洋,构成生物体的所有元素在自然界中都能找到,并且与地球表层元素的含量大致相当。
微量元素
错误!
2.食用碘盐应注意哪些问题?
提示:食用碘盐,存放时注意密封、防潮和防晒。菜炒熟出锅时再放碘盐以防分解。加醋会降低碘的利用率,使用植物油则可提高碘的利用率。
?水平测试
1.人体内必需的下列元素中,因摄入不足而导致骨质疏松的是(B)
A.K B.Ca C.Na D.Fe
2.中国有句名言:药补不如食补。碘是人体必需的微量元素,有“智力元素”之称。下列食物中含有碘较多的是(D)
A.鸡蛋 B.橙汁 C.葡萄 D.海带
解析:海带等海产品都含有较多碘。
3.下列化学元素中属于组成生物体的微量元素的是(C)
A.K B.P C.B D.Ca
解析:组成生物体的化学元素分为常量元素和微量元素两大类,其中C、H、O、N、P、S、K、Ca、Mg等属于常量元素;Fe、Mn、Zn、Cu、B、Mo等属于微量元素。
4.下列说法不正确是(B)
A.“食盐加碘”是指在食盐中加入碘酸钾
B.“酱油加铁”是指在酱油中加入铁单质
C.高碘对人有害,不要随意服用补碘药片
D.动物性食物中的铁容易被人吸收,一般蔬菜中铁的含量较少,吸收也低
解析:“酱油加铁”是指在酱油中加入铁强化剂,不是铁单质。
5.下列说法,不正确的是(C)
A.人体缺碘,可通过食用加碘盐补碘
B.缺铁性贫血,可通过食用铁强化酱油预防
C.为了防止龋齿,人人都要使用含氟牙膏
D.儿童缺锌可导致生长发育不良
解析:只有因缺氟引起的龋齿,才适宜使用含氟牙膏。
6.下列关于一些微量元素对人体作用的说法中不正确的是(B)
A.锌元素能影响人体发育,缺锌会引起食欲不振,生长迟缓,发育不良
B.硒有防癌、抗癌作用,可大量服用含硒药剂
C.氟能防治龋齿,过量则会引起氟斑牙和氟骨病
D.适量地补铜对白癜风的治疗和扩散有抑制作用
解析:硒有防癌、抗癌作用,缺硒可能引起表皮角质化和癌症,但摄入量过高会使人中毒。
7.(双选题)下列关于维生素的说法正确的是(CD)
A.所有维生素都是水溶性的
B.人体所需要的维生素都可以由自身合成
C.人体内缺乏维生素A易患夜盲症
D.因为维生素C受热易分解,所以富含维生素C的食物可以生食的应尽量生食
8.微量元素是指在人体内总含量不到万分之一,质量总和不到人体质量的千分之一的二十多种元素,这些元素对人体正常代谢和健康有重要作用。下列元素不是微量元素的是(B)
A.I B.C C.Zn D.Fe
解析:人体所必需的微量元素常见的有铁、锌、氟、硒、碘等。
9.下列哪些操作,不适宜保存蔬菜中的维生素(B)
A.洗菜:要先洗后切
B.浸泡:切好的菜浸泡半天,以除去残留农药
C.切菜:要随切随炒,切忌切好后久置
D.烹饪:烹调蔬菜时适当加点醋,可以减少维生素C的损失
解析:切好的菜浸泡半天,蔬菜中的水溶性维生素会流失。
?能力提升
10.钙是人体必需的常量元素。下列补钙的途径不正确的是(B)
A.经常晒太阳
B.经常饮用钙离子含量高的硬水
C.经常饮用牛奶、豆奶
D.适量补充维生素D
解析:晒太阳和适量补充维生素D都能促进钙的吸收;牛奶、豆奶中钙的含量高,故饮用牛奶、豆奶也可以补钙;硬水中含有Mg2+、Ca2+的盐,且含量较高,长期饮用对身体没有好处。
11.关于维生素的下列说法正确的是(A)
A.维生素是生物生长发育和新陈代谢所必需的物质
B.维生素容易在体内积存,主要积存在肝脏
C.维生素容易被人体吸收,多余的随尿排出体外,不易在体内积存,所以容易缺乏D.维生素都是较强的还原剂
解析:人体对维生素的需要量极小,但其对人体的生长和健康至关重要,A正确。维生素按溶解性可分为脂溶性维生素和水溶性维生素。脂溶性维生素不易排泄,容易在体内积存,主要积存在肝脏中。水溶性维生素容易被人体吸收,多余的则随尿排出体外,一般不易在体内积存,容易缺乏。故B、C均不正确。维生素C容易被氧化,是一种较强的还原剂,并非所有维生素都是较强的还原剂,故D也不正确。
12.关于脂溶性维生素与水溶性维生素的比较正确的是(A)
A.前者易溶于有机溶剂,不易溶于水,后者易溶于水,不易溶于有机溶剂
B.两者都不易积存,容易排泄,易引起维生素缺乏症
C.前者主要包含维生素A、维生素B等,后者主要包括维生素C
D.前者主要来自水果、蔬菜,后者主要来自维生素片
解析:根据溶解性将维生素分为脂溶性维生素和水溶性维生素;脂溶性维生素不易排泄,主要存在于肝脏中。水溶性维生素易随尿排出,不易积存,易缺乏;前者主要包含维生素A、
D、E、K等,后者主要包括维生素C和维生素B族;前者主要来自动物肝脏,后者主要来自水果、蔬菜。
13.新闻媒体的市场调查表明,知识女性及老年群体比较青睐植物蛋白类饮料。关于此类饮料的说法不正确的是(A)
A.该饮料含有大量的维生素
B.该饮料不宜高温加热,加热温度应低于80°C
C.该饮料含有高能量物质
D.该饮料含有大量的氨基酸
解析:从题意“植物蛋白类饮料”可知,该饮料与蛋白质的性质和用途有关。
人教版高中化学选修1化学与生活_知识点
化学与生活 第一章关注营养平衡 第一节生命的基础能源---糖类 第二节重要的体内能源---油脂 第三节生命的基础---蛋白质 第四节维生素和微量元素 归纳与整理 第二章促进身心健康 第一节合理选择饮食 第二节正确使用药物 归纳与整理 第三章探索生活材料 第一节合金 第二节金属的腐蚀和防护 第三节玻璃、陶瓷和水泥 第四节塑料、纤维和橡胶 归纳与整理 第四章保护生存环境 第一节改善大气质量 第二节爱护水资源 第三节垃圾资源化 归纳与整理 高二化学选修1《化学与生活》 第一章关注营养平衡 1—1—生命的基础能源:糖类 人体必须的六大营养素糖类脂肪蛋白质维生素矿物质水 1 单 糖 C6H12O6 葡萄糖多羟基醛有多元醇和醛的性质,能发生银镜反应,红色Cu2O 果糖多羟基酮有多元醇和酮的性质 2 双 糖 C12H22O11 麦芽糖有醛基C12H22O11+H2O→C6H12O6+C6H12O6葡萄糖+葡萄糖 蔗糖无醛基C12H22O11+H2O→C6H12O6+C6H12O6葡萄糖+果糖 3 多 糖( C6H10O5)n 淀粉无醛基,属 高分子化合 物 遇碘变蓝(C6H10O5)n + n H2O→nC6H12O6纤维素(C6H10O5)n + n H2O→nC6H12O6 4 葡萄糖 光合作用6CO2(g)+6H2O(l)→C6H12O6(s)+6O2(g)呼 吸 作 用 有氧呼吸C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) 无氧呼吸C6H12O6→2C3H6O3(乳酸)→2CO2+2C2H5OH 1—2—重要的体内能源:油脂 1 油 脂 植物油液态含不饱和烃基多—C17H33 含双 键 能加成、水解动物脂肪固态含饱和烃基多—C17H35、—C15H31水解 水 解 油脂+ 3H2O→高级脂肪酸+丙三醇(甘油) 皂 化油脂在碱性条件下的水解 油脂+ 3NaOH→高级脂肪酸钠(肥皂)+丙三醇(甘油)在人体内功能供热储存能量合成人体所需的化合物脂肪酸有生理功能 1—3—生命的基础:蛋白质
高中化学选修四知识点复习(人教版)教学教材
高中化学选修四知识点复习(人教版)
化学选修化学反应原理复习 第一章 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△H(2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0 ☆常见的放热反应:①所有的燃烧反应②酸碱中和反应 ③大多数的化合反应④金属与酸的反应 ⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等 ☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl ②大多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。
②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热 1.概念:25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101 kPa ②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1 mol ④研究内容:放出的热量。(ΔH<0,单位kJ/mol) 四、中和热 1.概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。 2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq) +OH-(aq) =H2O(l) ΔH=-57.3kJ/mol 3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。 4.中和热的测定实验 五、盖斯定律
维生素和微量元素试题及答案(6)
第6章 维生素和微量元素试题及答案(6) 一、 单项选择题 1. 维生素B 1在体内的辅酶形式是 A. NAD + B. TPP C. FMN D. FAD E. CoA 2. 叶酸在体内的辅酶形式是 A. TPP B. FH 2 C. FH 4 D. FAD E. NAD + 3. 维生素D 的活性形式是 A. Vit D 3 B. 25-OH-Vit D 3 C. 1,25-(OH) 2- Vit D 3 D. 24,25-(OH) 2- Vit D 3 E. 25,26-(OH)2- Vit D 3 4.下列哪种辅酶或辅基参与酰基转移反应 A. TPP B. FAD C. FH 4 D. HSCoA E. 磷酸吡哆醛 5.下列哪种物质可参与构成视紫红质 A. 核黄素 B. 11-顺视黄醛 C. 生育酚 D. Vit K E. 硫辛酸 6.下列有关维生素C 生理功能的叙述,哪一项是错误的 A. 保护含-SH 的酶为还原状态 B. 保护谷胱甘肽为氧化型 C. 维生素C 参与体内氧化还原反应 D. 参与某些物质的羟化反应 E. 促进肠道对铁的吸收 7.在下列化合物中不含B 族维生素的是 A. NAD + B. FMN C. HSCoA D. CoQ E. FAD 8.下列有关生物素叙述正确的是 A. 噻唑与尿素相结合而成的双环化合物 B. 可用于治疗妊娠呕吐 C. 是羧化酶的辅酶 D. 又称生育酚 E. 生物素的吸收必须依靠内因子 9.参与胶原蛋白中羟脯氨酸及羟赖氨酸合成的是 A. Vit K B. Vit D C. Vit C D. Vit E E. Vit A 10.与γ-羧基谷氨酸残基合成有关的是 A. Vit K B. Vit D C. Vit E D. Vit C E. Vit A 11.需磷酸吡哆醛作为辅酶的反应是 A. 转氨基作用 B. 羧化反应 C. 丙酮酸脱羧 D. 琥珀酸脱氢 E. 丙酮酸激酶 12.与红细胞分化成熟有关的维生素是 A. 维生素B 1和叶酸 B. 维生素B 1和泛酸 C. 维生素B 12和叶酸 D. 维生素B 12和泛酸 E. 泛酸和叶酸
(人教版)高中化学选修四(全套)考点大全集(打印版)
(人教版)高中化学选修四(全册)考点大汇总(打印版) 考点1 常见的能量转化形式 【考点定位】本考点考查能量的常见转化形式, 重点分析化学能与热能、电能之间的转化, 涉及键能与化学能之间的关系及反应过程中能量变化形式. 【精确解读】 1.化学反应中的能力变化表现为热量的变化.常见能量转化有: ①化学能和电能的相互转化.如铜、锌形成原电池, 将化学能转化为电能; ②化学能和热能的相互转化.燃料燃烧产生能量最终带动发电机发电, 将化学能转化 为电能; ③化学能和光能、风能的相互转化等. 【精细剖析】 1.判断化学能转化为其它形式能的方法: 一看, 是否发生化学反应; 二看, 产生了什么, 如果是热量, 则转化为热能;如果产生了电, 则是转化为电能, 如果产生了光, 则是转化为光能. 【典例剖析】化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )
A.化学反应中能量变化的主要原因是化学键的断裂与生成 B.铝热反应中, 反应物的总能量比生成物的总能量低 C.图I所示的装置能将化学能转变为电能 D.图II所示的反应为吸热反应 【答案】A 【变式训练】模拟植物的光合作用, 利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3), 装置如图所示, 下列说法错误的是( ) A.H+由交换膜右侧向左侧迁移 B.催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O C.该过程是太阳能转化为化学能的过程 D.消耗CO2与生成O2体积比为1:1 【答案】D
【实战演练】 1.下列反应中能量变化与其它不同的是( ) A.铝热反应B.燃料燃烧C.酸碱中和反应 D.Ba(OH)2?8H2O与 NH4Cl固体混合 【答案】D 【解析】A.铝粉与氧化铁的反应是放热反应, 故A错误;B.燃料燃烧是放热反应, 故B 错误;C.酸碱中和反应是放热反应, 故C错误;D.氯化铵晶体与Ba(OH)2?8H2O的反应是吸热反应, 故D正确;故答案为D. 2.2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下, 二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( ) A.此反应可将光能转化为化学能 B.CO2和CH4均含极性共价键 C.产物可能还有O2 D.CO2溶于水呈酸性的原因:CO2+H2O?H2CO3H2CO3?2H++CO32- 【答案】D
人教版高中化学选修四知识点总结
化学选修4化学反应与原理 第一章化学反应与能量 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应 (1).符号:△H(2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热)△H为“-”或△H<0 吸收热量的化学反应。(吸热>放热)△H为“+”或△H>0 ☆常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反应④金属与酸的反应⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等 ☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl②大多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热
1.概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101kPa②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1mol④研究内容:放出的热量。(ΔH<0,单位kJ/mol) 四、中和热 1.概念:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热。 2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol 3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。4.中和热的测定实验 五、盖斯定律 1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。 第二章化学反应速率和化学平衡 一、化学反应速率 1.化学反应速率(v) ⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化 ⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示 ⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L·s)
人教版高中化学选修5教案(绝对经典版)
课题:第一章认识有机化合物 第一节有机化合物的分类 教学目的 知识 技能 1、了解有机化合物常见的分类方法 2、了解有机物的主要类别及官能团 过程 方法 根据生活中常见的分类方法,认识有机化合物分类的必要性。利用投影、动画、多媒体等教学手段,演示有机化合物的结构简式和分子模型,掌握有机化合物结构的相似性。价值观体会物质之间的普遍联系与特殊性,体会分类思想在科学研究中的重要意义 重点了解有机物常见的分类方法;难点了解有机物的主要类别及官能团 板书设计第一章认识有机化合物 第一节有机化合物的分类 一、按碳的骨架分类 二、按官能团分类 教学过程 [引入]我们知道有机物就是有机化合物的简称,最初有机物是指有生机的物质,如油脂、糖类和蛋白质等,它们是从动、植物体中得到的,直到1828年,德国科学家维勒发现由无机化合物通过加热可以变为尿素的实验事实。我们先来了解有机物的分类。 [板书]第一章认识有机化合物 第一节有机化合物的分类 [讲]高一时我们学习过两种基本的分类方法—交叉分类法和树状分类法,那么今天我们利用树状分类法对有机物进行分类。今天我们利用有机物结构上的差异做分类标准对有机物进行分类,从结构上有两种分类方法:一是按照构成有机物分子的碳的骨架来分类;二是按反映有机物特性的特定原子团来分类。[板书]一、按碳的骨架分类 链状化合物(如CH 3-CH 2 -CH 2 -CH 2 -CH 3 ) (碳原子相互连接成链) 有机化合物 脂环化合物(如)不含苯环 环状化合物 芳香化合物(如)含苯环 [讲]在这里我们需要注意的是,链状化合物和脂环化合物统称为脂肪族化合物。而芳香族化合物是指包含苯环的化合物,其又可根据所含元素种类分为芳香烃和芳香烃的衍生物。而芳香烃指的是含有苯环的烃,其中的一个特例是苯及苯的同系物,苯的同系物是指有一个苯环,环上侧链全为烷烃基的芳香烃。除此之外,我们常见的芳香烃还有一类是通过两个或多个苯环的合并而形成的芳香烃叫做稠环芳香烃。 [过]烃分子里的氢原子可以被其他原子或原子团所取代生成新的化合物,这种决定化合物特殊性质的原子或原子团叫官能团,下面让我们先来认识一下主要的官能团。
(人教版)高中化学选修四(全套)最全考点全集(打印版)
(人教版)高中化学选修四(全册)最全考点汇总(打印版) 考点1 用盖斯定律进行有关反应热的计算 【考点定位】本考点考查用盖斯定律进行有关反应热的计算, 巩固对盖斯定律的理解, 提升应用盖斯定律解决问题的能力, 重点是灵活应用盖斯定律. 【精确解读】 1.内容:化学反应不管是一步完成还是分几步完成, 其反应热是相同的;即化学反应热只与其反应的始态和终态有关, 而与具体反应进行的途径无关; 2.应用: a.利用总反应和一个反应确定另一个反应的热效应; b.热化学方程式之间可以进行代数变换等数学处理; 3.反应热与键能关系 ①键能:气态的基态原子形成1mol化学键释放的最低能量.键能既是形成1mol化学键所释 放的能量, 也是断裂1mol化学键所需要吸收的能量. ②由键能求反应热:反应热等于断裂反应物中的化学键所吸收的能量(为“+”)和形成生成 物中的化学键所放出的能量(为“-”)的代数和.即△H=反应物键能总和-生成物键能总和=∑E反-∑E生 ③常见物质结构中所含化学键类别和数目:1mol P4中含有6mol P-P键;1mol晶体硅中含 有2mol Si-Si键;1mol金刚石中含有2molC-C键;1mol二氧化硅晶体中含有4mol Si-O 键. 【精细剖析】 1.盖斯定律的使用方法:
①写出目标方程式; ②确定“过渡物质”(要消去的物质); ③用消元法逐一消去“过渡物质”. 例如: ①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H1 ②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2 ③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3 求反应FeO(s)+CO(g)=Fe(s)+CO2(g)△H4的焓变 三个反应中, FeO、CO、Fe、CO2是要保留的, 而与这四种物质无关的Fe2O3、Fe3O4要通过方程式的叠加处理予以消去, 先②+③×2-①×3先消除Fe3O4, 再消除Fe2O3, 得到④6Fe(s)+6CO2(g)=6FeO(s)+6CO(g)△H5, ④逆过来得到 ⑤6FeO(s)+6CO(g)=6Fe(s)+6CO2(g)-△H5, 再进行⑤÷6, 得到△H4=-; 2.计算过程中的注意事项: ①热化学方程式可以进行方向改变, 方向改变时, 反应热数值不变, 符号相 反; ②热化学方程式中物质的化学计量数和反应热可以同时改变倍数; ③热化学方程式可以叠加, 叠加时, 物质和反应热同时叠加; ④当对反应进行逆向时, 反应热数值不变, 符号相反. 【典例剖析】己知:Mn(s)+O2(g)═MnO2(s)△H l S(s)+O2(g)═SO2(g)△H2 Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3 则下列表述正确的是( ) A.△H2>0 B.△H3>△H1 C.Mn+SO2═MnO2+S△H=△H2-△H1 D.MnO2(s)+SO2(g)═MnSO4(s)△H═△H3-△H2-△H1 【答案】D
(完整版)化学选修4(新人教版)
新人教版《化学反应原理》全册知识点归纳 第一章化学反应与能量 一、焓变反应热 1.反应热(Q):一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应 (1).符号:△H(2).单位:kJ/mol(3)△H=H(生成物)-H(反应物) 3.微观角度解释产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热)△H为“-”或△H<0 吸收热量的化学反应。(吸热>放热)△H为“+”或△H>0 注:(高中阶段Q与△H二者通用) (4)影响晗变的主要因素:①发生变化的物质的物质的量,在其他条件一定时与变化物质的物质的量程正比。②物质的温度和压强 ☆常见的放热反应: ①所有的燃烧反应②酸碱中和反应 ③大多数的化合反应④金属与酸或水的反应 ⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等 ☆常见的吸热反应: ①晶体Ba(OH)2?8H2O与NH4Cl②大多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热 1.概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101kPa ②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1mol ④研究内容:放出的热量。(ΔH<0,单位kJ/mol)
高中化学选修4课后习题参考答案-人教版
人教版高中化学选修四——《化学反应原理》课本习题参考答案 第一单元第一节化学反应与能量的变化 1.化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的 焓变,符号是ΔH,单位是kJ/mol。例如1mol H 2(g)燃烧,生成1mol H 2 O(g),其反应热ΔH=-241.8 kJ/mol。 2.化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的 分子。旧键断裂需要吸收能量,新键形成需要放出能量。当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。 第一节燃烧热能源 1.在生产和生活中,可以根据燃烧热的数据选择燃料。如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很高,它们都是良好的燃料。 2.化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对措施。措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。由于上述制造甲醇、乙醇的原料是生物质,可以再生,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效措施。 3.氢气是最轻的燃料,而且单位质量的燃烧热值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料。在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输;二是制造氢气尚需电力或别的化石燃料,成本高。如果用太阳能和水廉价地制取氢气的技术能够突破,则氢气能源将具有广阔的发展前景。 4.甲烷是一种优质的燃料,它存在于天然气之中。但探明的天然气矿藏有限,这是人们所担心的。现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2倍。如果找到了适用的开采技术,将大大缓解能源危机。 5.柱状图略。关于如何合理利用资源、能源,学生可以自由设想。在上述工业原材料中,能源单耗最大的是铝;产量大,因而总耗能量大的是水泥和钢铁。在生产中节约使用原材料,加强废旧钢铁、铝、铜、锌、铅、塑料器件的回收利用,均是合理利用资源和能源的措施。
【重点推荐】人教版高中化学选修四第一章重要知识点总结
高中化学学习材料 (精心收集**整理制作) 第一章重要知识点总结 一、放热与吸热反应的几种类型: 下列反应中生成物总能量高于反应物总能量的是() A.碳酸钙受热分解B.乙醇燃烧C.铝粉与氧化铁粉末反应D.氧化钙溶于水 二、△H的计算方法=反应物的总键能-生成物的总键能=生成物的总能量-反应物的总能量 (15分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297KJ 即H-I键的键能为297kJ/mol,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:kJ/mol) 键能键能键能 H-H 436 Cl-Cl 243 H-Cl 432 S=S 255 H-S 339 C-F 427 C-Cl 330 C-I 218 H-F 565 C-O 347 H-O 464 Si—Si 176 Si—O 460 O=O 497 (1)根据表中数据判断CCl4的稳定性(填“大于”或“小于”)CF4的稳定性。 (2)结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g) ΔH=-QKJ/ mol;通过计算确定热化学方程式中Q 的值为②请写出晶体硅与氧气反应生成二氧化硅的热化学方程式: 三、物质稳定性的比较:能量越低越稳定键能越高越稳定 已知25℃、101KPa下,4Al(s)+3O2(g)=2Al2O3(s)ΔH=-2834.9KJ/mol 4Al(s)+2O3(g)=2Al2O3(s)ΔH=-3119.1KJ/mol,由此得出的结论正确的是() A.O2比O3能量低,由O2转变为O3为放热反B.O2比O3能量高,由O2转变为O3为吸热反应 C.O3比O2稳定,由O2转变为O3为放热反D.O2比O3稳定,由O2转变为O3为吸热反应 四、热化学方程式的书写判断: 下列热化学方程式书写正确的是 A、C(s)+O2(g)==CO2(g);△H=+393.5kJ/mol B、2SO2+O2==2SO3;△H= —196.6kJ/mol C、H2(g)+1/2O2(g)==H2O(l);△H=—285.8kJ/mol D、2H2(g)+O2(g)==2H2O(l);△H= —571.6KJ 五、反应热△H大小的比较: 根据以下3个热化学方程式:
人体所需维生素和微量元素
人体所需维生素和微量元素 维生素是人体用来制造辅酶的一种有机物质,而辅酶又可以帮助人体将食物转化成可以利用的能量。如果说“维生素是生命的基础”,这话一点都不夸张,虽然它们在人体内的数量很少,但对于保持性健康、促进生长、维持人体各系统的功能以及加强你的免疫系统有着重要的作用。 我们现在知道的维生素一共有13种,其中有4种(即维生素A、D、E、K)是溶 解在脂肪中,而其他9种如维生素B、C等是溶解在水中的。溶解在水中的维生素会被人体快速分解,要经常补充,而溶解在脂肪中的维生素可以在体内保存的时间较长,补充过多则会中毒。 缺乏维生素会出现相应的症状 *缺乏维生素A的几个症状有:夜盲、眼嘴干燥、牙齿发育不好、头发枯干、皮肤粗糙、等症状。绿色和黄色的水果与蔬菜、鱼肝油、牛奶、动物肝脏中含量多。 *缺乏维生素B1:对声音的过敏性反应增强,小腿感觉异常,断断续续出现酸痛。肝脏、豆类、全麦面包、壳类食物中含量多。 *缺维生素B2时,出现口角炎时嘴角破裂溃烂,可能会引起各种皮肤疾病。来源于绿叶青菜、肝脏、鸡蛋、牛奶、壳类食物。 口臭,口腔溃疡;有些患者还会出现精神障*缺维生素B3常出现消化问题,舌 头红肿, 碍,如情绪低落、烦躁等。在蛋、瘦肉、肝脏、黄豆、花生等含量较多。 *缺维生素B6引起失眠、神经质、贫血、肌肉痉挛等。下面是维生素E的来源:肉类、牛奶、土豆、麦芽、青菜中含量较高。 *缺少维生素B12最常见的是贫血。瘦肉、肝脏、蛋、奶制品等都是很好的来源。
*缺少维生素C:牙肉出血、流鼻血、伤口愈合缓慢,肌肉无力、时常感染疾病、体弱等。新鲜的水果、果汁、红辣椒、草莓中都有丰富的维生素C,而桔子、橙、柠檬及绿色蔬菜中含量更多。 *缺乏维生素K时即表现为易流血和擦伤,常流鼻血。猪肉、胡萝卜、绿色蔬菜中都有丰富的都是很好的来源。 *缺乏维生素D:儿童易患佝偻病,成人易患软骨病。 * 缺乏维生素E可至嗜眠无生气、不能集中精力、失衡、贫血。榛子、麦芽、葵花子、蛋黄酱中都有丰富的维生素E。 怎样合理服用维生素 补充维生素的最佳途径是通过天然食品,而不是化学合成的药片。正常情况下只要饮食均衡,就可以吸收到足够的维生素,而不需要刻意服用药物。只有当维生素的量严重不足, 已引起疾病时才需要吃药。在补充维生素时应注意以下几项: 1、服用维生素的剂量要适当,即使需要补充维生素也并非是剂量越大越好,超过正常的使用量会带来另外“麻烦”,比如引起中毒。 2、注意药物之间的影响,有些药物与维生素同时使用,会破坏或减低维生素的效果,如长 如果同时服用抗结核药会引起维期服石蜡油通便,就会发生维生素A、D、E、K 吸收不良; 生素B6缺乏。而且有些维生素之间也会相互影响,如烟酸过量可造成维生素B1、B2和胆碱缺乏,维生素C过多会破坏食物中的维生素B12等等。 3、妥善保管药物,如果你在服用几种不同的维生素,各种维生素要分别存放。而且要注意避光,密封,免得被氧化而失效,如维生素A(鱼肝油)、维生素C 维生素D、维生素B2、复合维生素B要用棕色瓶存放,药瓶要盖紧。维生素补充不
人教版高中化学选修1教案全册
第一章关注营养平衡 第一节生命的基础能源----糖类 教学目标: 1. 使学生掌握葡萄糖、蔗糖、淀粉、纤维素的组成和重要性质,以及它们之间的相互转变和跟烃的衍生物的关系. 2. 了解合理摄入营养物质的重要性,认识营养均衡与人体健康的关系。 3. 使学生掌握葡萄糖蔗糖淀粉的鉴别方法. 教学重点:认识糖类的组成和性质特点。 教学难点:掌握葡萄糖蔗糖淀粉的鉴别方法 教学方法:讨论、实验探究、调查或实验、查阅收集资料。 教学过程: [问题]根据P2~P3图回答人体中的各种成分。 我们已经知道化学与生活关系多么密切。在这一章里,我们将学习与生命有关的一些重要基础物质,以及它们在人体内发生的化学反应知识。如糖类、油脂、蛋白质、微生素
和微量元素等。希望学了本章后,有利于你们全面认识饮食与健康的关系,养成良好的饮食习惯。 [导入]讨论两个生活常识:①“饭要一口一口吃”的科学依据是什么?若饭慢慢地咀嚼会感觉到什么味道?②儿童因营养过剩的肥胖可能引发糖尿病来进行假设:这里盛放的是三个肥儿的尿样,如何诊断他们三个是否患有糖尿病?今天我们将通过学习相关知识来解决这两个问题.下面我们先来学习糖类的有关知识。 糖类: 从结构上看,它一般是多羟基醛或多羟基酮,以及水解生成它们的物质. 大部分通式C n(H2O)m。 糖的分类: 单糖低聚糖多糖 一、葡萄糖是怎样供给能量的 葡萄糖的分子式: C6H12O6、白色晶体,有甜味,溶于水。 1、葡萄糖的还原性 结构简式: CH2OH-CHOH-CHOH-CHOH-CHOH-CHO或CH2OH(CHOH)4CHO。
2、葡萄糖是人体内的重要能源物质 C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) 3、二糖(1)蔗糖:分子式:C12H22O11 物理性质:无色晶体,溶于水,有甜味 化学性质:无醛基,无还原性,但水解产物有还原性。 C12H22O11 + H2O C6H12O6 + C6H12O6 (蔗糖) (葡萄糖) (果糖) (2)麦芽糖: 物理性质: 白色晶体, 易溶于水,有甜味(不及蔗糖). 分子式: C12H22O11(与蔗糖同分异构) 化学性质: (1)有还原性: 能发生银镜反应(分子中含有醛基),是还原性糖. (2)水解反应: 产物为葡萄糖一种. C12H22O11 + H2O 2 C6H12O6 (麦芽糖) (葡萄糖)
人教版高中化学选修四化学试卷
灌南高级中学2007—2008学年第二学期高二期中考试 化学试卷 考试时间:100分钟 第Ⅰ卷(选择题 共48分) 可能用到的数据:H —1 O —16 Na —23 Fe —56 S —32 Ag —108 一、选择题(本小题包括8小题,每小题3分,共24分,每题只有一个正确选项) 1.下列物质按纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是( ) A .纯盐酸、水煤气、硫酸、醋酸、干冰 B .冰醋酸、玻璃、硫酸钡、氢氟酸、乙醇 C .单甘油酯、冰水混合物、苛性钠、氢硫酸、三氧化硫 D .绿矾、漂白粉、次氯酸、氯化钾、氯气 2.下列描述中,不符合生产实际的是 ( ) A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极 C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀铜,用铜作阳极 3. 在pH 都等于9的NaOH 和CH 3COONa 两种溶液中,设由水电离产生的OH -离子浓度分别为 Amol/L 与Bmol/L ,则A 和B 的关系为 ( ) A .A > B B .A =10-4B C .B =10-4A D .A =B 4. 在一定条件下发生下列反应,其中属于盐类水解反应的是 ( ) A .NH 4+ +2H 2O NH 3·H 2O + H 3O + B .HCO 3- + H 2O H 3O + + CO 32- C .HS -+H +═ H 2S D .Cl 2+H 2O H ++Cl -+HClO 5. 25℃时,由水电离出c(H +)=1×10-9 mol/L 的溶液中,一定能大量共存的离子组是 ( ) A .Al 3+、NH 4+、SO 42-、Cl - B .Mg 2+、K +、SO 42-、HCO 3- C .K +、Na +、Cl -、SO 42_ D .Ba 2+、Cl -、Na +、SO 42- 6. 已知一种[H +]=1×10-3mol/L 的酸和一种[OH -]=1×10-3mol/L 的碱溶液等体积混合后溶液呈酸 性,其原因可能是: ( ) A .浓的强酸和稀的强碱溶液反应 B .浓的弱酸和稀的强碱溶液反应 C .等浓度的强酸和弱碱溶液反应 D .生成了一种强酸弱碱盐 7、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可表示为 Ag 2O + Zn + H 2O 2Ag + Zn(OH)2,此电池放电时负极上发生反应的物质是 A 、Ag B 、Zn(OH)2 C 、Ag 2O D 、Zn 8. 对于难溶盐MX ,其饱和溶液中M +和X -的物质的量浓度之间的关系类似于c(H + )× c(OH -) = K w , 存在等式c(M +)×c(X -) = K sp 。现将足量AgCl 的分别放入下列物质中,AgCl 的溶解度大小的排列顺序是 放电 充电
人教版高中化学选修一知识点总结
《选修1·化学与生活》知识点总结 第一章关注营养平衡第一节 生命的基础能源—糖类 1、糖类是绿色植物光合作用的产物。由C 、H 、O 三种元素组成的一类有机化合物,也叫碳水化合物(通式为C n (H 20)m ),但其实此名称并不能真实反应糖类的组成和特征,如鼠李糖C 6H 12O 5是糖却不符合此通式,而符合此通式的,如甲醛HCHO 、乙酸CH 3COOH 却不是糖类。 2、葡萄糖分子式C 6H 12O 6,是一种白色晶体,有甜味,能溶于水 3、葡萄糖的还原性: 和银氨溶液反应: 3224324422()()23()Ag NH OH CH OH CHOH CHO Ag NH CH OH CHOH COONH H O +????→+++水浴加热↓↑; 和新制Cu(OH)2反应: 22422422()()()2Cu OH CH OH CHOH CHO Cu O CH OH CHOH COOH H O +??→++△↓。 4、葡萄糖为人体提供能源 ①葡萄糖提供能量的方程式:6126222666;0C H O O CO H O H +??→+酶△<; ②粮食中的糖类在人体中转化成葡萄糖而被吸收,在体内有三条途径,即:a 、直接氧化供能;b 、转化成糖元被肝脏和肌肉储存,当血液中的葡萄糖即血糖的质量分数比正常值低时,糖元就释放出来维持血糖浓度的相对稳定;c 、转变为脂肪,储存在脂肪组织里。 5、蔗糖和麦芽糖是二糖,它们水解的化学方程式分别是: 122211261266126 C H O H O C H O C H O +??→+酶(蔗糖)(葡萄糖)(果糖)12221126126 2C H O H O C H O +??→酶(麦芽糖)(葡萄糖) 6、淀粉是一种重要的多糖,分子式(C 6H 10O 5)n ,是一种相对分子质量很大的天然高分子有机化合物,没有甜味,是一种白色粉末,不溶于冷水,但在热水中一部分淀粉溶解在水中,一部分悬浮在水里,长时间或高温可产生糊化。它能水解。淀粉在人体内的水解过程可表示 为6105n 6105m 1222116126C H O C H O C H O C H O ??→??→??→酶酶酶()淀粉()糊精麦芽糖葡萄糖,也可在酸的
维生素和微量元素
维生素和微量元素 主讲:黄冈中学优秀化学教师汪响林 知识讲解 食物中的六大营养素:糖类、油脂、蛋白质、维生素、无机盐和水,是生命活动不可缺少的物质。 一、维生素 维生素又名维他命(vitamin),即维持生命的物质,是人和动物为维持正常的生理功能而必需从的一类微量有机物质,也是保持 人体健康的重要活性物质。 1、维生素的分类 维生素是个庞大的家族,目前所知的维生素就有几十种。根据维生素的溶解性,把维生素分为脂溶性维生素和水溶性维生素。 2、维生素的作用 维生素是参与生物生长发育和新陈代谢所必需的一类小分子有机化合物,它们能调节各种器官的机能并维持各种细胞的特性。 人体对维生素的需要量极小,但维生素对人体的生长和健康至关重 要。维生素对机体的新陈代谢、生长、发育、健康有极重要作用。
如果长期缺乏某种维生素,就会引起生理机能障碍而发生某种疾病。 3、维生素C 维生素C又叫抗坏血酸,是一种水溶性维生素,溶液显酸性,有酸味。在所有维生素中,维生素C是最不稳定的。在贮藏,加工和烹调时,容易被破坏和分解。它还易失去电子被氧化,是一种较强的还原剂。分子式为C 6H8O6,结构简式为: (1)维生素C主要生理功能 ①促进骨胶原的生物合成。利于组织创伤口的更快愈合; ②促进氨基酸中酪氨酸和色氨酸的代谢,延长肌体寿命。 ③改善铁、钙和叶酸的利用。 ④改善脂肪和类脂特别是胆固醇的代谢,预防心血管病。 ⑤促进牙齿和骨骼的生长,防止牙床出血。 ⑥增强肌体对外界环境的抗应激能力和免疫力。 (2)维生素C缺乏和疾病 维生素C缺乏时,其症状表现为: ①牙龈肿胀出血,牙床潰烂、牙齿松动。 ②骨骼畸形、易骨折。 ③伤口难愈合等。进一步则引起坏血症、贫血。
人教版高中化学选修四——课本习题参考答案
人教版高中化学选修四一一课本习题参考答案人教版高中化学选修四一一《化学反应原理》课本习题参考答案 J 1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是△ H,单位是kJ/mol。例如1 mol H (g)2 燃烧,生成1 mol HO(g),其反应热4 2 H=-241.8 kJ/mol。 2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。旧键断裂需要吸收能量,新键形成需要放出能量。当反应完成 时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为 吸热反应 1W卓4 :;JI g 2 W ⑴M g) F 出! f C k 亠 F i7.( J-lirt 灯?HMt) 1 :; 1 I 'u i “I* 匕 1 -厂|H1iH-!_.7 11mol ([i J ii 11*41' nt,:i kJ nn (;」+ i ■■J _■ 卜:-?H I Jl 1? A H-iJ * L|inoi i i t11 (1 > -学{L (ji J ― 9( < 1 1) I I i I i AJI-j .1 JM k l rni3: 仁■:I) I ■■ .H ■' ^:■< 'I F ,皿IL - j AH'1 <1tEUI 1 ! 211 'll- 1 :;! - H : J 厂 1 M ;!■ Ti f >(X: 』■1H-il kJ mill 第二节 1. 在生产和生活中,可以根据燃烧
热的数据选择燃料。如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很 高,它们都是良好的燃料。 2. 化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对措施。措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。由于上述制造甲醇、乙醇的原料是生物质,可以再生,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效措施。 3. 氢气是最轻的燃料,而且单位质 量的燃烧热值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料。在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输; 二是制造氢气尚需电力或别的化石燃料,成本高。如果用太阳能和水廉价地制取氢气的技术能够突破,则氢气能源将具有广阔的发展前景。 4. 甲烷是一种优质的燃料,它存在于天然气之中。但探明的天然气矿藏有限,这是人们所担心的。现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2 倍。如果找到了 J 适用的开采技术,将大大缓解能源危机。 5. 柱状图略。关于如何合理利用资源、能源,学生可以自由设想。在上述工业原材料中,能源单耗最大的是铝; 产量大,因而总耗能量大的是水泥和钢铁。在生产中节约使用原材料,加强废旧钢铁、铝、铜、锌、铅、塑料器件的回收利用,均是合理利用资源和能源的措施。
人教版高中化学选修1化学与生活课件
人教版高中化学选修1化学与生活课件人教版高中化学选修1化学与生活:4.3垃圾资源化PPT课件2.rar 人教版高中化学选修1化学与生活:4.3垃圾资源化PPT课件 1.rar 人教版高中化学选修1化学与生活:4.2爱护水资源PPT课件 3.rar 人教版高中化学选修1化学与生活:4.2爱护水资源PPT课件 2.rar 人教版高中化学选修1化学与生活:4.2爱护水资源PPT课件 1.rar 人教版高中化学选修1化学与生活:4.1改善大气质量PPT课 件3.rar 人教版高中化学选修1化学与生活:4.1改善大气质量PPT课 件2.rar 人教版高中化学选修1化学与生活:4.1改善大气质量PPT课 件1.rar 人教版高中化学选修1化学与生活:3.4塑料、纤维和橡胶 PPT课件4.rar... 人教版高中化学选修1化学与生活:3.4塑料、纤维和橡胶 PPT课件3.rar...
人教版高中化学选修1化学与生活:3.4塑料、纤维和橡胶 PPT课件2.rar... 人教版高中化学选修1化学与生活:3.4塑料、纤维和橡胶 PPT课件1.rar... 人教版高中化学选修1化学与生活:3.3玻璃、陶瓷和水泥 PPT课件4.rar... 人教版高中化学选修1化学与生活:3.3玻璃、陶瓷和水泥 PPT课件3.rar... 人教版高中化学选修1化学与生活:3.3玻璃、陶瓷和水泥 PPT课件2.rar... 人教版高中化学选修1化学与生活:3.3玻璃、陶瓷和水泥 PPT课件1.rar... 人教版高中化学选修1化学与生活:3.2金属的腐蚀和防护 PPT课件2.rar... 人教版高中化学选修1化学与生活:3.2金属的腐蚀和防护 PPT课件1.rar... 人教版高中化学选修1化学与生活:3.1合金PPT课件 2.rar 人教版高中化学选修1化学与生活:3.1合金PPT课件 1.rar 人教版高中化学选修1化学与生活:2.2正确使用药物PPT课 件3.rar
06- 维生素和微量元素
第6章 维生素和微量元素 一、 单项选择题 1. 维生素B 1在体内的辅酶形式是 A. NAD + B. TPP C. FMN D. FAD E. CoA 2. 叶酸在体内的辅酶形式是 A. TPP B. FH 2 C. FH 4 D. FAD E. NAD + 3. 维生素D 的活性形式是 A. Vit D 3 B. 25-OH-Vit D 3 C. 1,25-(OH) 2- Vit D 3 D. 24,25-(OH) 2- Vit D 3 E. 25,26-(OH)2- Vit D 3 4.下列哪种辅酶或辅基参与酰基转移反应 A. TPP B. FAD C. FH 4 D. HSCoA E. 磷酸吡哆醛 5.下列哪种物质可参与构成视紫红质 A. 核黄素 B. 11-顺视黄醛 C. 生育酚 D. Vit K E. 硫辛酸 6.下列有关维生素C 生理功能的叙述,哪一项是错误的 A. 保护含-SH 的酶为还原状态 B. 保护谷胱甘肽为氧化型 C. 维生素C 参与体内氧化还原反应 D. 参与某些物质的羟化反应 E. 促进肠道对铁的吸收 7.在下列化合物中不含B 族维生素的是 A. NAD + B. FMN C. HSCoA D. CoQ E. FAD 8.下列有关生物素叙述正确的是 A. 噻唑与尿素相结合而成的双环化合物 B. 可用于治疗妊娠呕吐 C. 是羧化酶的辅酶 D. 又称生育酚 E. 生物素的吸收必须依靠内因子 9.参与胶原蛋白中羟脯氨酸及羟赖氨酸合成的是 A. Vit K B. Vit D C. Vit C D. Vit E E. Vit A 10.与γ-羧基谷氨酸残基合成有关的是 A. Vit K B. Vit D C. Vit E D. Vit C E. Vit A 11.需磷酸吡哆醛作为辅酶的反应是 A. 转氨基作用 B. 羧化反应 C. 丙酮酸脱羧 D. 琥珀酸脱氢 E. 丙酮酸激酶 12.与红细胞分化成熟有关的维生素是 A. 维生素B 1和叶酸 B. 维生素B 1和泛酸 C. 维生素B 12和叶酸 D. 维生素B 12和泛酸 E. 泛酸和叶酸
