《溶液》测试题及答案

《溶液》测试题
本卷可能用到的相对原子质量: H—1 Cl—35.5 Zn—65
一、我会选择(每题只有一个正确答案,每小题2分,共40分。)
1、下列各组物质中前一种是溶液,后一种是化合物的是()
A.酒精、二氧化碳 B.稀硫酸、液氧 C.汽水、干冰 D.冰水混合物、氧化铜
2、下列说法不正确的是()
A.厨房洗涤剂清洗油污后形成溶液 B.用硬水洗衣服不如用软水洗得干净
C.硝酸铵溶于水制得的冰袋可用于给高烧病人降温
D.冬季向公路上的积雪撒盐,可使冰雪快速融化
3、在实验室,有一瓶失去标签的蒸馏水和一瓶失去标签的氯化钾溶液,鉴别它们的正确方法是()A.尝液体的味道 B.蒸发液体看是否结晶
C.加入白色硫酸铜粉末 D.看颜色
4、炎热的夏天,小林打开冰箱,从4℃的储藏室中拿出一杯内有少量蔗糖晶体的溶液m.在室温下放置一段时间后,发现晶体消失了。得到溶液n。下列说法正确的是()
A.4℃时 m溶液一定是饱和溶被 B.室温下,n溶液一定是饱和溶液
C.蔗糖晶体的溶解度随温度的升高而降低 D.m溶液的溶质的质量分数大于n溶液的溶质的质量分数5、下列变化属于化学变化的是()
A.蔗糖溶解于水 B.食盐水蒸干后出现白色粉末
C.饱和石灰水升温后变浑浊 D.澄清石灰水在空气中表面形成一层白膜
6、据文字记载,我们的祖先在神农氏时代就开始利用海水晒盐。海水晒盐的原理是()
A.日晒风吹使海水中的氯化钠蒸发 B.日晒风吹使溶液由饱和变为不饱和
C.日晒风吹使氯化钠的溶解度变小 D.日晒风吹使水分蒸发晶体析出
7、长期敞口放置的饱和食盐水,在保持温度不变的情况下,发现容器底部有少量晶体出现,这说明()A.溶液变为不饱和溶液 B.溶剂质量减少,溶液仍为饱和溶液
C.溶液中溶剂、溶质的质量均未改变 D.溶液比原来要浓一些
8、配制溶质质量分数一定的食盐溶液,正确的操作顺序是()
A.计算、称量、溶解、倒入试剂瓶、贴上标签 B.溶解、计算、称量、倒入试剂瓶、贴上标签
C.称量、溶解、计算、倒入试剂瓶、贴上标签 D.称量、计算、溶解、倒入试剂瓶、贴上标签
9、用50g 98%的浓H2SO4配制成20%的稀H2SO4,需加水的质量为()
A. 145g B.195g C.196g D.245g
10、向一接近饱和的KNO3溶液中,逐渐加入KNO3晶体,下列图像中符合溶液中溶质质量变化规律的是()
加入KNO3的量
A
加入KNO3的量
D
加入KNO3的量
C
加入KNO3的量
B
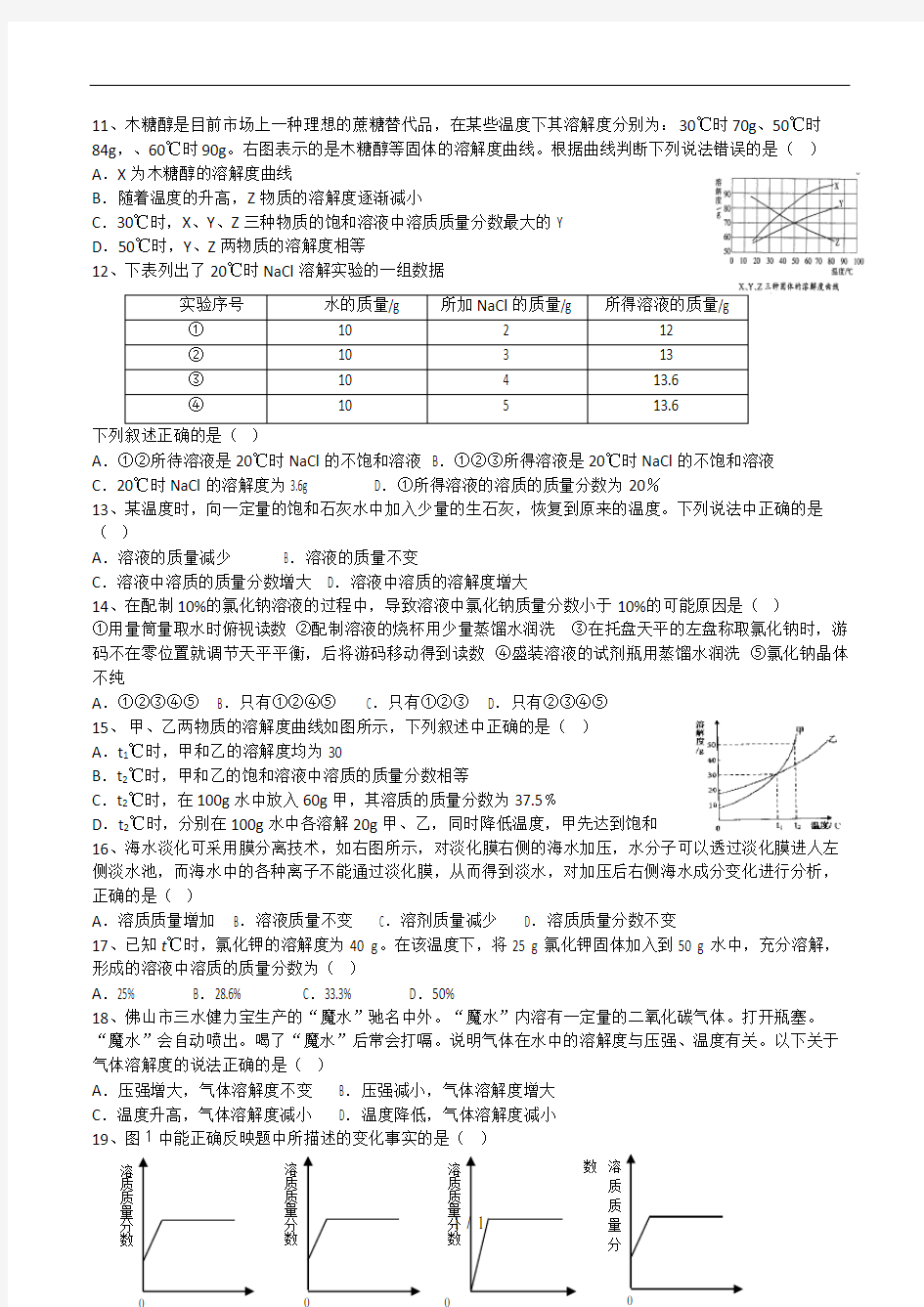
11、木糖醇是目前市场上一种理想的蔗糖替代品,在某些温度下其溶解度分别为:30℃时70g、50℃时
84g,、60℃时90g。右图表示的是木糖醇等固体的溶解度曲线。根据曲线判断下列说法错误的是()A.X为木糖醇的溶解度曲线
B.随着温度的升高,Z物质的溶解度逐渐减小
C.30℃时,X、Y、Z三种物质的饱和溶液中溶质质量分数最大的Y
D.50℃时,Y、Z两物质的溶解度相等
12、下表列出了20℃时NaCl溶解实验的一组数据
实验序号水的质量/g 所加NaCl的质量/g 所得溶液的质量/g
①10 2 12
②10 3 13
③10 4 13.6
④10 5 13.6
A.①②所待溶液是20℃时NaCl的不饱和溶液 B.①②③所得溶液是20℃时NaCl的不饱和溶液C.20℃时NaCl的溶解度为3.6g D.①所得溶液的溶质的质量分数为20%
13、某温度时,向一定量的饱和石灰水中加入少量的生石灰,恢复到原来的温度。下列说法中正确的是()
A.溶液的质量减少 B.溶液的质量不变
C.溶液中溶质的质量分数增大 D.溶液中溶质的溶解度增大
14、在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是()
①用量筒量取水时俯视读数②配制溶液的烧杯用少量蒸馏水润洗③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数④盛装溶液的试剂瓶用蒸馏水润洗⑤氯化钠晶体不纯
A.①②③④⑤ B.只有①②④⑤ C.只有①②③ D.只有②③④⑤
15、甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是()
A.t1℃时,甲和乙的溶解度均为30
B.t2℃时,甲和乙的饱和溶液中溶质的质量分数相等
C.t2℃时,在100g水中放入60g甲,其溶质的质量分数为37.5﹪
D.t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
16、海水淡化可采用膜分离技术,如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进人左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,对加压后右侧海水成分变化进行分析,正确的是()
A.溶质质量增加 B.溶液质量不变 C.溶剂质量减少 D.溶质质量分数不变
17、已知t℃时,氯化钾的溶解度为40 g。在该温度下,将25 g 氯化钾固体加入到50 g 水中,充分溶解,形成的溶液中溶质的质量分数为()
A.25% B.28.6% C.33.3% D.50%
18、佛山市三水健力宝生产的“魔水”驰名中外。“魔水”内溶有一定量的二氧化碳气体。打开瓶塞。“魔水”会自动喷出。喝了“魔水”后常会打嗝。说明气体在水中的溶解度与压强、温度有关。以下关于气体溶解度的说法正确的是()
A.压强增大,气体溶解度不变 B.压强减小,气体溶解度增大
C.温度升高,气体溶解度减小 D.温度降低,气体溶解度减小
19、图1中能正确反映题中所描述的变化事实的是()
溶质质溶
质
质
溶
质
数
溶
质
质
20、氯化钠和碳酸钠晶体的溶解度(00C---300C)如下表所示:
00C 100C 200C 300C
NaCI(g) 35.7 35.8 36.0 36.3
Na2CO3·10H2O(g) 7.0 12.5 21.5 38.8
根据上表分析下列几种说法: ①碳酸钠晶体的溶解度受温度影响较大②将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从300C降至O0C ,析出晶体的质量相等③氯化钠和碳酸钠晶体的溶解度相等时所对应的温度在2O0C --300C之间④欲从含有少量NaCI杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式上述说法中,完全正确的一组是()
A.①② B.①②③ C.①③④ D.①②④
二、我会填空(本大题包括3个小题,共24分。)
21、(4分)常温下,向盛有几小粒硝酸钾晶体的试管中,加入饱和硝酸钾溶液,并固定在盛有水的烧杯中(如右图所示)。
小军同学向烧杯中加入某种物质后并搅拌,结果试管中的晶体消失了。请你猜测,
小军同学加入的物质可能是、 (请写出两种不同类别的物质)。
22、(10分)如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于
P点。据图回答:
(1)P点的含义是。
(2)t2℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗? (填
写“能”或“不能”)。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是(填写物质序
号)。(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶
质质量分数大小关系是(填写选项序号)
A.c>a=b B.a=b>c C.a>b>c D.b>a>c
23、(10分)下图是配制50g质量分数为5% 的氯化钠溶液的操作过程示意图:试回
答:
A B C D E
(1)B操作中应称量氯化钠的质量是g 。放好砝码和游码后,向托盘上加氯化钠时,若指针偏向分度盘的右边,应进行的操作是。
(2)D操作应选用 mL 的量筒(从10 mL、100 mL中选择);量水时,量筒必须平放,视线要跟量筒凹液面的处保持水平。
(3)E操作的作用是。
三、我会探究(本大题包括3个小题,共26分。)
24、(6
某同学为了提纯某一苯甲酸样品(其中含泥沙等难溶于水的杂质),进行了如下实验:
(1)取样品约1g 放入烧杯中,加入50mL 蒸馏水充分搅拌,发现样品几乎没溶解,原因是 。 (2)将烧杯放在石棉网上加热,将样品充分溶解后,在加入少量蒸馏水,然后趁热过滤。趁热过滤的目的是 。
(3)将所得滤液 ,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体。 25、(10分)下图甲是A 、B 、C 三种固体物质的溶解度曲线图。
溶解度g
温度C
1
镁条
的饱和溶液甲乙
(1)甲图中,t 2℃时,A 、B 、C 三种物质中,溶解度最大的是 。
(2)t ℃时,将B 物质的不饱和溶液转变成饱和溶液可采取的方法 , 。
(3)如乙图所示,20℃时,把试管放入盛有X 的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL 稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X 可能为A 、B 、C 三种固体物质中的哪一种? 。
26、(10分)20℃时,取相同质量的a 、b 、c 三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示。图2为a 、b 、c 三种物质的溶解度曲线。请仔细阅读图1和图2回答下列问题:
(1)三种物质的溶解度关系为b >a >c 时的温度为t ℃,则t 的取值范围是 。 (2)烧杯甲里是 物质的溶液,烧杯乙里是 物质的溶液。 (3)40℃时,烧杯 里的溶液中溶剂最少。
(4)各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是 。
A .甲(状态2)>甲(状态1)
B .乙(状态1)>甲(状态3)
C .甲(状态1)=乙(状态2)
D .乙(状态3)>丙(状态3)
四、我会计算(本大题包括1个小题,共10分。)
27、下图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:
(1)欲配制100g溶质质量分数为8.64%的稀盐酸,需用这种盐酸多少毫升?
(2)取上述配制得到的足量稀盐酸与6.5g锌充分反应后,理论上可制得氢气多少克?(计算结果精确到0.1)
参考答案
一、我会选择(每小题2分,共40分)
二、我会填空(24分)
21、浓硫酸、氢氧化钠、生石灰等。
22、(1)t1℃时,a、b的溶解度都是20g,(2)不能(3)cba (4)D
23、(1)2.5继续向左盘加食盐(2)100、最低处保持水平(3)加快溶解速度
三、我会探究(26分)
24、(1)常温下苯甲酸溶解度很小(2)减小过滤时苯甲酸的损失(3)缓慢冷却至室温(2)
25、(1)A(2)降低温度、加入B或蒸发溶剂(3C
26、(1)20℃~30℃;(2)c;a;(3)b;(4)BC
四、我会计算(10分)
27、20mL 0.2g
