有机化学反应机理画法剖析
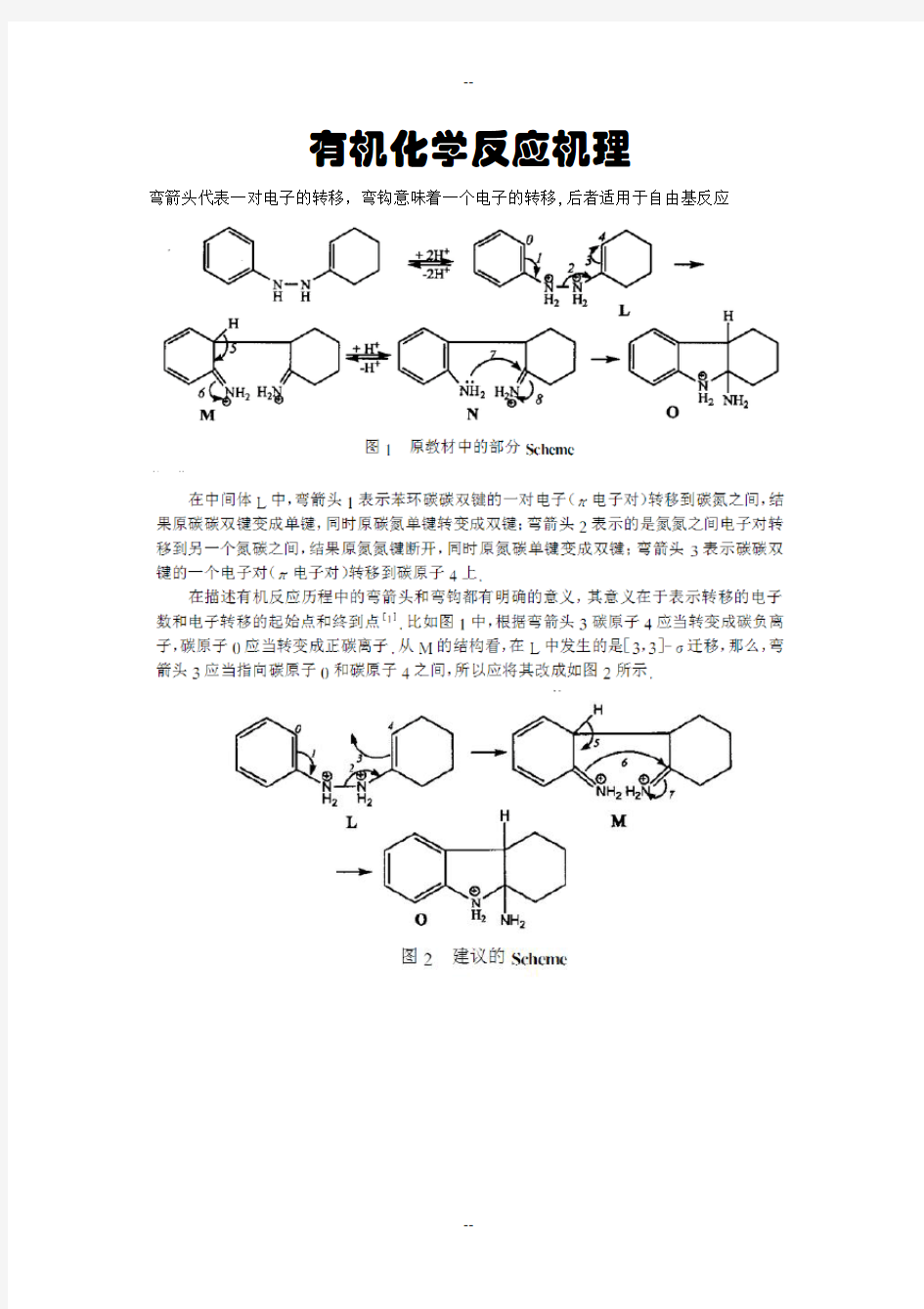
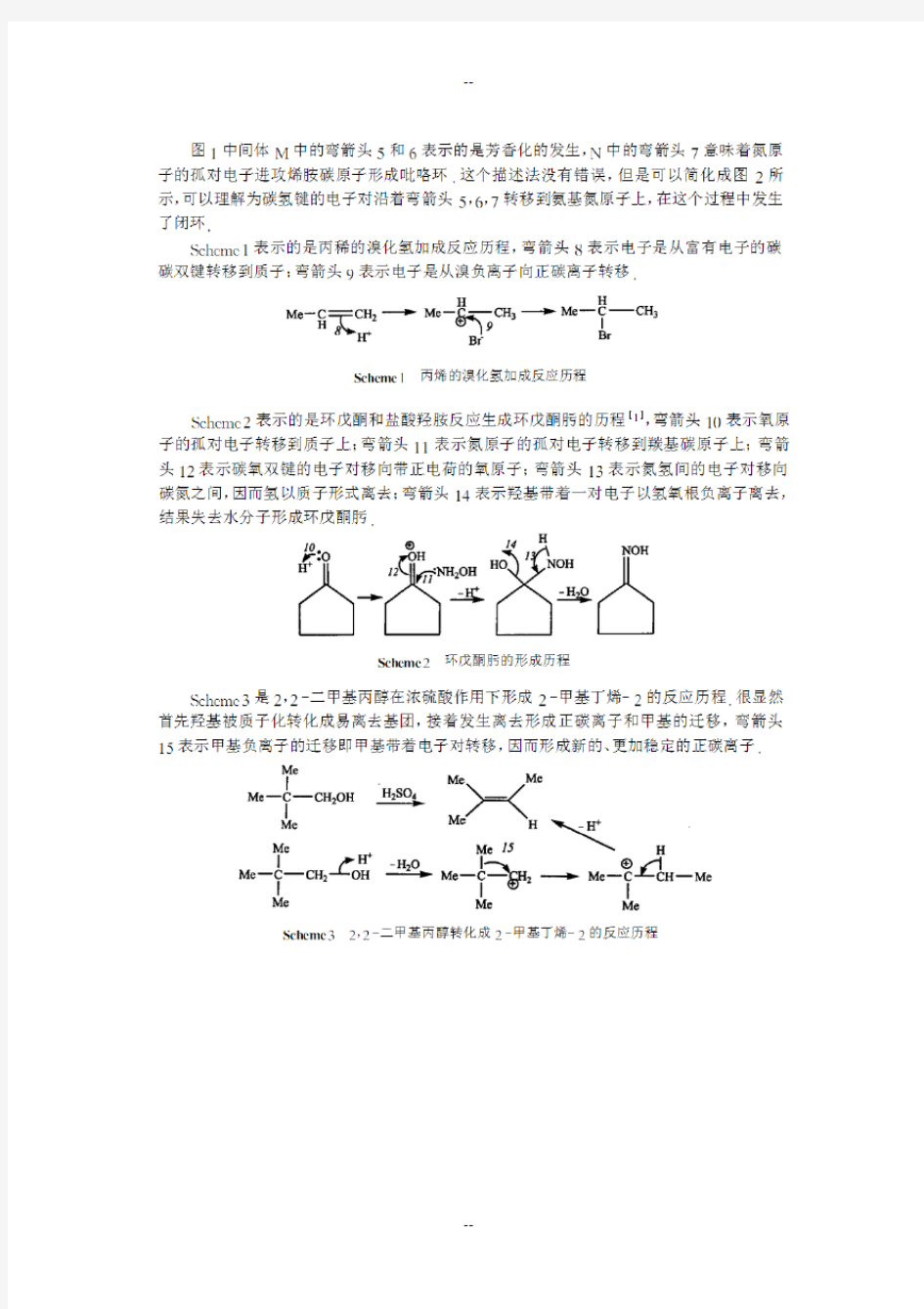
有机化学反应机理
弯箭头代表一对电子的转移,弯钩意味着一个电子的转移,后者适用于自由基反应
1 有机反应机理入门
1.1 画路易斯结构式
先画出分子的骨架,环和pi键应准确无误,然后用氢原子完成其余的化学键。对于有机分子,骨架有时以简化形式给出。
画出孤对电子,使每个原子核外满足充满电子的结构:氢2个;硼、铝和镓6个;其它原子8个。最后结构式中的每个原子总的成键电子数可以通过数其核外的成键电子获得(包括共享电子)。
提示:画路易斯结构式可参考以下结构特征:?(1) 氢原子永远在构的外围,因为它只能成一个共价键;
(2) 碳、氮和氧有特定的键合模式。?在以下的示例中R代表氢、烷基、芳基或它们的组合,这种变化并不影响成键模式。
①中性的碳原子为4键。这4个键可以都是sigma键,也可以是sigma键与pi键的组合(如双键和三键)。?②带有单个正电荷或负电荷的碳有3个键。
③中性的氮原子(氮烯除外)有3个键和一对未成对电子。?④正电荷的氮成4键,带有一个正电荷。
⑤负电荷的氮成2键,带有一个负电荷和2对未成键电子。
⑥中性的氧原子成2键,带有2对孤对电子。
⑦带正电荷的氧成3键,带有1对孤对电子。
(3) 有时磷原子和硫原子可有10个成键电子,这是因为磷和硫具有d轨道,可以扩展而容纳10个电子。
Lewis结构式是价键理论的重要内容,也是学习反应机理的基础。
1.2 电负性
多数有机反应依赖于带有正电荷(或部分正电荷)的分子与带有负电荷(或部分负电荷)的分子的相互作用而发生。在中性有机分子中,部分电荷的产生依赖于电负性的差异。?电负性的数值最初由LinusPauling在1960年确定。其数值越大,表明其吸电子能力越强,所以氟是吸电子能力最强的元素,见表:
成键后,电负性大的元素的原子拥有部分负电荷,而且,双键结构的部分电荷比单键结构的部分电荷密度更大,这是因为双键上的pi电子受原子核的束缚小,更易于流动。
电负性是很基础的知识,但很有用,很重要。通过电负性,可以解释为什么硼烷加成到烷基取代的不对称烯烃上不服从Markovnikov规则,为什么含活泼氢的羰基化合物去质子后主要以烯醇式存在...
1.3共振结构?当分子中成键电子的分布不能用一个路易斯结构充分表达时,可由若干个仅仅在电子的位置上有差别的路易斯结构的组合来表达。
这种仅仅在电子的位置上有差别的路易斯结构称为共振结构。共振结构表达了分子中电子的离域。
画共振结构?对于给定的分子或中间体,画共振结构的简单方法是先画出一个
路易斯结构,然后用箭头表示电子的流动,画出一个仅仅是电子分布不同的结构。
这种电子流动只是形式上的,而分子中并没有真正的流动发生。实际的分子就是这些共振结构的某些特征的杂化体。
所以,共振结构并不代表分子或中间体的实际结构,而只是一种帮助我们预测实际分子中电子分布的形式结构。例如:
提示:化学家常用以下几种箭头:
①双向箭头用来联结共振结构:??②
两个单箭头表示平衡:??③弯箭头表示一对电子沿箭头方向从起点流动到终点:
?④半弯箭头表示一个电子沿箭头方向从起点流动到终点:
共振结构的规则
①所有参与离域的电子都是pi电子或孤对电子,因为它们很容易进入p轨道。
②每个参加离域的电子一定要与其它电子有一定程度的交盖。这意味着如果轨道之间是90o定向的,将不会交盖,最好的交盖发生在0度定向的情况下。
③每个共振结构必须要有相同的pi电子数。双键计2个;三键计2个,因为三键中只有一个pi键可与相邻的pi体系交盖;pi体系带有电荷时,负电荷计2个,正电荷计0个。
④每个结构中必须具有相同数目的成对pi电子。?以下两个结构不是共振结构,第一个结构中有两对pi电子:一对pi键电子和一对负离子的孤对电子;
在第二个结构中没有成对的pi电子而只有未成对电子(图中点所示)。
?⑤所有的共振结构必须具有一致的几何构型,否则它们就不能代表相同的分子。例如以下结构(杜瓦苯)就不是苯的共振结构,因为它不是平面构型,而且少2个pi电子。由于几何构型是同杂化状态联系在一起的,这意味这所有的共振结构中的原子的杂化状态不能变。
⑥依赖电荷分离的共振结构能量很高,对共振结构的贡献较不依赖电荷分离的共振结构小。
?⑦通常,负电荷集中在电负性大的原子上,正电荷集中在电负性小的原子上,这样的结构对共振结构贡献大。
?
所以说含活泼氢的羰基化合物去质子产物主要以烯醇式为主,称其为碳负离子有失严密。
单个共振结构并不代表真正存在的化学实体,重要性在于可以帮助阐明化学物种(分子、中间体、过渡态等)的电子分布;一般而言,共振结构越多,其化学物种就越稳定,据此可以解释为什么在芳环的亲电取代中硝基钝化芳环,并成为第二类定位基。
1.4 互变异构体与平衡
互变异构体是那些仅在单、双键及小原子(通常为氢)的安排上不同的异构体。适当条件下,上述异构体可通过简单的机理达到平衡。?平衡存在于正、逆反应速率相等的过程中。?
?提示:以下因素可帮助区分共振结构与互变异构体:?①互变异构体是容易互相转化的异构体。它们仅在单、双键及氢的安排
上不同。互变异构体间的平衡用一对半箭头表示。?②不同的共振结构代表不同的sigma键模式,而不是不同的化学物种。共振结构用双箭头联结。?③对于给定的化合物,所有的共振结构都有一致的sigma键键合模式和一致的几何构型。而在互变异构体中,sigma键模式则不同。?
1.5酸和碱
(1) 布朗斯太德(Bronsted)酸和碱?布朗斯太德酸是质子供体;而布朗斯太德碱是质子受体:?
?如果上述反应可逆,反过来定义也一
样:?
(2) 路易斯(Lewis)酸和碱
路易斯酸是孤对电子或pi电子的受体,是缺电子体。换言之,路易斯酸上的原子由于与一个或多个电负性较大的原子相连而具有正电荷或部分正电荷。?路易斯碱是孤对电子或pi电子的供体。具有负电荷的路易斯碱的碱性较没有负电荷的路易斯碱的碱性强。?因此,有机反应也被认为是路易斯酸碱之间的反应:
?
1.6 亲核试剂与亲电试剂
亲核试剂是寻找缺电子中心的反应物种。它们含有带有负电荷或部分负电荷的原子(亲核性原子)。
缺电子中心称为亲电试剂,这些缺电子中心通常带有正电荷或部分正电荷,但缺电子物种也可以是中性分子。?提示:一些基本概念
①共价键断裂时,如果原来由两个原子共享的电子保留在一个碎片上,这种方式称为共价键的异裂。尽管异裂过程常常与离子中间体有关,但也有例外。?②对多数反应而言,称其中的一个反应物为底物而另一个为进攻试剂常常比较方便。为新键提供碳原子的分子常被指定为底物。而形成碳碳键时,则需要主观指定哪个是底物哪个是进攻试剂。
③在异裂反应过程中,进攻试剂有时带给底物一对电子,有时从底物带走一对电子。带来一对电子的称为亲核试剂,这样的反应称为亲核反应;带走一对电子的称为亲电试剂,这样的反应称为亲电反应。
④对于底物分子被异裂切断的反应,其断裂的一部分通常称为离去基团。带着一对电子离去的称为离核基团,而留下一对电子的离去基团称为离电基团。
这些概念看来枯燥,但若能熟练运用,对于讨论问题十分方便。
1.7 反应机理的表达
反应机理应一步一步地给出反应过程中化学键(电子)重新组合、安排的过程。?这些机理并没有真正的实体存在,只是为了表达反应是如何发生的一种尝试。尽管实验可以证明某些机理合理而另一些不合逻辑,但对多数反应而言,并没有证据支持其机理。因此,在遵从公认的准则的情况下,我们可以任意地描述一个反应的机理。
1.7.1 配平方程式
从有机化学的观点来看,只要碳和电荷平衡,就可以认为一个反应方程式已经配平了。不必配平反应过程中的无机物。
1.7.2用弯箭头表示电子的流动
?在表达机理时,旧键的断裂和新键的形成一般用弯箭头表示。这些箭头是表达反应过程中电子的重新分布的方便的工具。
这些说明电子重新分布的箭头是从电子云密度高的位点画向缺电子(电子云密度低)的位点。?也就是从负电荷或部分负电荷(孤对电子)的位点画向正电荷或部分正电荷的位点(偶极矩的正极点)。换言之,是从亲核试剂(路易斯碱)画向亲电试剂(路易斯酸)。而且一般只是一些在非常反应中才会出现两个箭头从同一原子同出(或同入)的情况。
例酰氯和氨生成酰胺的反应机理:
附:弯箭头简史?弯箭头的发明者被认为是Robert Robinson (1886-1975),
1947年Nobel化学奖得主。??The first use ofcurly arrows to represent the movement of electrons is in a paper entitledAn Explanation of the Property of InducedPolarityofAtoms and anInterpretation of the Theory o fPartial Valences on anElectronic Basis, by William Ogi lvy Kermack and Robert Robinson, published in The Journalof the Chemical Society, 1922, 121: 427.
酸、碱介质中的
反应机理?对于酸性介质中进行的反应,首先在反应物中找到碱性最强的原子,然后使其质子化,再给这个正离子寻找合适的反应。
对于碱性介质中的反应,先在反应物中找到酸性最强的质子,去质子后得到一个负离子,再给这个负离子寻找合适的反应。如果这个负离子有合适的离去集团,就可以发生消除反应。如果形成的负离子是良好的亲核试剂,就寻找亲电物种使之反应。
例Claisen缩合的反应机理:
1.7.3 化学反应的推动力
化学反应可以由焓减、熵增或这两个过程联合推动。由少数分子生成多数分子的反应是熵增推动的;而生成更稳定分子的过程则主要是焓减推动的。
考虑一个化学反应的机理时,应提出这样的问题:反应为什么这样进行?什么因素有助于反应进行?
(1) 离去基团
对于亲核取代反应,离去基团的性质常常成为该反应能否发生的关键。一般而言,离去基团的离去能力与其碱性的强弱相反。例如水(H2O)是比羟基(OH-)更好的离去基团;碘离子(I-)是比氟离子(F-)更好的离去基团。离去基团能力:
如果反应涉及到差的离去基团,要使反应发生,常常需要很强的亲核试剂。
(2) 生成稳定的小分子
生成稳定的小分子既是焓减过程也是熵增过程,因此成为化学反应的很好的推
动力。这些稳定的小分子包括:氮、二氧化碳、一氧化碳、水、二氧化硫和无机盐等。
例在四苯基环戊二烯酮和顺丁烯二酸酐的反应中,生成一氧化碳成为反应的推动力:
化学有机化学机理题Word版
有机化学试卷 班级姓名分数 一、机理题 ( 共44题 288分 ) 1. 8 分 (2701) 2701 为下述实验事实提出合理的、分步的反应机理(用弯箭头表示电子对的转移,用鱼钩箭头表示单电子的转移,并写出各步可能的中间体)。 邻苯二甲酰亚胺用Br2-NaOH处理获得邻氨基苯甲酸。 2. 8 分 (2702) 2702 为下述实验事实提出合理的、分步的反应机理(用弯箭头表示电子对的转移,用鱼钩箭头表示单电子的转移,并写出各步可能的中间体。 2,4-二硝基氟苯(A)及2,4-二硝基溴苯(B)分别用C2H5NH2处理,都获得N-乙基-2,4-二硝基苯胺,但A比B速率快。 3. 8 分 (2703) 2703 为下述实验事实提出合理的、分步的反应机理(用弯箭头表示电子对的转移,用鱼钩箭头表示单电子的转移,并写出各步可能的中间体)。 异丙苯过氧化氢用酸处理,获得苯酚和丙酮(石油化工生产)。 4. 8 分 (2704) 2704 为下述实验事实提出合理的、分步的反应机理(用弯箭头表示电子对的转移,用鱼钩箭头表示单电子的转移,并写出各步可能的中间体)。 用14C标记的2-甲基-6-烯丙基苯酚的烯丙醚(A)加热发生Claisen重排反应,生成的2-甲基-4,6-二烯丙基苯酚中有一半以上含14C的烯丙基在对位。
5. 6 分 (2705) 2705 为下述实验事实提出合理的、分步的反应机理(用弯箭头表示电子对的转移,用鱼钩箭头表示单电子的转移,并写出各步可能的中间体)。 邻位和对位的羟基苯甲酸容易失羧,而间位异构体无此特征。 6. 6 分 (2706) 2706 为下述实验事实提出合理的、分步的反应机理(用弯箭头表示电子对的转移,用鱼钩箭头表示单电子的转移,并写出各步可能的中间体)。 旋光的苯基二级丁基酮在碱性溶液中发生外消旋化;这个酮失去旋光性的速率正好和它在碱性条件下溴化的速率相等。 7. 6 分 (2707) 2707 为下述实验事实提出合理的、分步的反应机理。 旋光的扁桃酸乙酯[C6H5CH(OH)CO2C2H5]在碱性条件下易外消旋化。 8. 6 分 (2708) 2708 为下述实验事实提出合理的、分步的反应机理。 旋光的扁桃酸[C6H5CH(OH)CO2H]在碱中的外消旋化比其酯慢得多。 9. 6 分 (2709) 2709 为下述实验事实提出合理的、分步的反应机理(用弯箭头表示电子对的转移,用鱼钩箭头表示单电子的转移,并写出各步可能的中间体)。 苯基二级丁基酮进行酸催化的外消旋化与其碘代反应的速率常数相等。 *. 6 分 (2710) 2710 为下述实验事实提出合理的、分步的反应机理(用弯箭头表示电子对的转移,用鱼钩箭头表示单电子的转移,并写出各步可能的中间体)。 醇醛缩合(aldol)反应亦可酸催化,如乙醛在酸催化下可生成-羟基丁醛。
大学有机化学人名反应总结
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
大学有机化学知识点总结(推荐文档)
有机化学复习总结 一.有机化合物的命名 1. 能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。 2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。 立体结构的表示方法: 1 )伞形式: COOH OH H 3 2)锯架式:CH 3 OH H H OH C 2H 5 3) 纽曼投影式: H H 4)菲舍尔投影式:COOH CH 3 OH H 5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。 (3) 环己烷构象:最稳定构象是椅式构象。一取代环己烷最稳定构象是e 取代的椅 式构象。多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。 立体结构的标记方法 1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型, 在相反侧,为E 构型。 CH 3 C H C 2H 5CH 3C C H 2H 5Cl (Z)-3-氯-2-戊烯 (E)-3-氯-2-戊烯 2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式; 在相反侧,则为反式。
有机反应和反应机理
有机反应和反应机理(一) 有机反应:在一定的条件下,有机化合物分子中的成键电子发生重新分布,原有的键断裂,新的键形成,从而使原分子中原子间的组合发生了变化,新的分子产生。这种变化过程称为有机反应(organic reaction)。 一级反应:在动力学上,将反应速率只取决于一种化合物浓度的反应称为一级反应。 二级反应:在动力学上,将反应速率取决于两种化合物浓度的反应称为二级反应。 按化学键的断裂和生成分类 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。 自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。链转移阶段是由一个自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一环接一环的链,所以称之为链反应。链终止阶段是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。 离子型反应:由分子经过异裂生成离子而引发的反应称为离子型反应。离子型反应有亲核反应和亲电反应,由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是对原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反应。亲电试剂是对电子有显著亲合力而起反应的试剂。 按反应物和产物的结构关系分类 加成反应:两个或多个分子相互作用,生成一个加成产物的反应称为加成反应。 取代反应:有机化合物分子中的某个原子或基团被其它原子或基团所置换的反应称为取代反应。 重排反应:当化学键的断裂和形成发生在同一分子中时,会引起组成分子的原子的配置方式发生改变,从而形成组成相同,结构不同的新分子,这种反应称为重排反应。 消除反应:在一个有机分子中消去两个原子或基团的反应称为消除反应。可以根据两个消去基团的相对位置将其分类。若两个消去基团连在同一个碳原子上,称为1,1-消除或α-消除;两个消去基团连在两个相邻的碳原子上,则称为1,2-消除或β-消除;两个消去基团连在1,3位碳原子上,则称为1,3-消除或γ-消除。其余类推。
有机化学反应机理画法剖析
有机化学反应机理 弯箭头代表一对电子的转移,弯钩意味着一个电子的转移,后者适用于自由基反应
1 有机反应机理入门 1.1 画路易斯结构式 先画出分子的骨架,环和pi键应准确无误,然后用氢原子完成其余的化学键。对于有机分子,骨架有时以简化形式给出。 画出孤对电子,使每个原子核外满足充满电子的结构:氢2个;硼、铝和镓6个;其它原子8个。最后结构式中的每个原子总的成键电子数可以通过数其核外的成键电子获得(包括共享电子)。 提示:画路易斯结构式可参考以下结构特征: (1) 氢原子永远在构的外围,因为它只能成一个共价键; (2) 碳、氮和氧有特定的键合模式。 在以下的示例中R代表氢、烷基、芳基或它们的组合,这种变化并不影响成键模 式。 ①中性的碳原子为4键。这4个键可以都是sigma键,也可以是sigma键与pi
键的组合(如双键和三键)。 ②带有单个正电荷或负电荷的碳有3个键。 ③中性的氮原子(氮烯除外)有3个键和一对未成对电子。 键,带有一个正电荷。4正电荷的氮成④. ⑤负电荷的氮成2键,带有一个负电荷和2对未成键电子。 ⑥中性的氧原子成2键,带有2对孤对电子。 ⑦带正电荷的氧成3键,带有1对孤对电子。 (3) 有时磷原子和硫原子可有10个成键电子,这是因为磷和硫具有d轨道,可以扩展而容纳10个电子。 Lewis结构式是价键理论的重要内容,也是学习反应机理的基础。 1.2 电负性 多数有机反应依赖于带有正电荷(或部分正电荷)的分子与带有负电荷(或部分负电荷)的分子的相互作用而发生。在中性有机分子中,部分电荷的产生依赖于电负性的差异。 电负性的数值最初由Linus Pauling在1960年确定。其数值越大,表明其吸电子能力越强,所以氟是吸电子能力最强的元素,见表: 成键后,电负性大的元素的原子拥有部分负电荷,而且,双键结构的部分电荷比单键结构的部分电荷密度更大,这是因为双键上的pi电子受原子核的束缚小,更易于流动。
大学有机化学人名反应机理汇总
3.Baeyer----Villiger 反应拜耳-维立格氧化重排反应 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 4.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。 7.Cannizzaro 反应 凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇: 脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。 醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。 9.Claisen 酯缩合反应
含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。 乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的 pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。 10.Claisen 重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。
有机化学反应机理+范例+原理
1.A rndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例
2.Baeyer----Villiger 反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例
酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。 3.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 反应实例
大学有机化学人名反应总结
有 机化学 一、烯烃 1、卤化氢加成 (1) 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 2、硼氢化—氧化 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】 【例】 3、X 2加成 【机理】 【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。不对称的烯烃,亲核试剂进攻主要取决于空间效应。 【特点】反式加成 4、烯烃的氧化 1)稀冷高锰酸钾氧化成邻二醇。 3 H 33H 3稀冷KMnO 4 33M n O O H 2O 3 H 33H 3 2) 热浓酸性高锰酸钾氧化 3)臭氧氧化 4)过氧酸氧化 5、烯烃的复分解反应 【例】 6、共轭二烯烃 1)卤化氢加成 2)狄尔斯-阿德尔(Diels-Alder )反应 【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。 【例】
二、脂环烃 1、环丙烷的化学反应 【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。 【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。 【注】遵循马氏规则 【例】 2、环烷烃制备 1)武兹(Wurtz)反应 【描述】通过碱金属脱去卤素,制备环烷烃。 【例】 2)卡宾 ①卡宾的生成 A、多卤代物的α消除 B、由某些双键化合物的分解 ②卡宾与烯烃的加成反应 【特点】顺式加成,构型保持 【例】 ③类卡宾 【描述】类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的类卡宾是ICH2ZnI。 【特点】顺式加成,构型保持 【例】 三、炔烃 1、还原成烯烃 1)、顺式加成 2)、反式加成 2、亲电加成 1)、加X2 【机理】 中间体 Br + R2 R1 【特点】反式加成 2)、加HX R R HBr R Br (一摩尔的卤化氢主要为反式加成)3)、加H2O 【机理】 【特点】炔烃水合符合马式规则。 【注】只有乙炔水合生成乙醛,其他炔烃都生成相应的酮。
大学有机化学复习重点总结归纳
欢迎阅读 有机化学复习总结 一.有机化合物的命名 1.能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。 2.根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。 立体结构的表示方法: 1)伞形式:C COOH OH H 3C H 2)锯架式:CH 3 OH H H OH C 2H 5 3)纽曼投影式: H H H H H H H H H H H H 4)菲舍尔投影式:COOH CH 3 OH H 5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。 (3) 环己烷构象:最稳定构象是椅式构象。一取代环己烷最稳定构象是e 取代的椅式构象。多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。 立体结构的标记方法 1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。 2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。 3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。然后将最不优先的基团放在远离观察者,再以次观察其它三个基团,如果优先顺序是顺时针,则为R 构型,如果是逆时针,则为S 构型。 注:将伞状透视式与菲舍尔投影式互换的方法是:先按要求书写其透视式或投影式,然后分别标出其R/S 构型,如果两者构型相同,则为同一化合物,否则为其对映体。 二.有机化学反应及特点 1.反应类型 还原反应(包括催化加氢):烯烃、炔烃、环烷烃、芳烃、卤代烃
有机反应和反应机理
十、反应和反应机理 有机反应:在一定的条件下,有机化合物分子中的成键电子发生重新分布,原有的键断裂,新的键形成,从而使原分子中原子间的组合发生了变化,新的分子产生。这种变化过程称为有机反应(organic reaction)。 一级反应:在动力学上,将反应速率只取决于一种化合物浓度的反应称为一级反应。 二级反应:在动力学上,将反应速率取决于两种化合物浓度的反应称为二级反应。 按化学键的断裂和生成分类 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。 自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。链转移阶段是由一个自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一环接一环的链,所以称之为链反应。链终止阶段是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。 离子型反应:由分子经过异裂生成离子而引发的反应称为离子型反应。离子型反应有亲核反应和亲电反应,由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是对原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反应。亲电试剂是对电子有显著亲合力而起反应的试剂。 按反应物和产物的结构关系分类 加成反应:两个或多个分子相互作用,生成一个加成产物的反应称为加成反应。 取代反应:有机化合物分子中的某个原子或基团被其它原子或基团所置换的反应称为取代反应。 重排反应:当化学键的断裂和形成发生在同一分子中时,会引起组成分子的原子的配置方式发生改变,从而形成组成相同,结构不同的新分子,这种反应称为重排反应。 消除反应:在一个有机分子中消去两个原子或基团的反应称为消除反应。可以根据两个消去基团的相对位置将其分类。若两个消去基团连在同一个碳原子上,称为1,1-消除或α-消除;两个消去基团连在两个相邻的碳原子上,则称为1,2-消除或β-消除;两个消去基团连在1,3位碳原子上,则称为1,3-消除或γ-消除。其余类推。 氧化还原反应:有机化学中的氧化和还原是指有机化合物分子中碳原子和其它原子的氧化和还原,可根据氧化数的变化来确定。氧化数升高为氧化,氧化数降低为还原。氧化和还原总是同时发生的,由于有机反应的属性是根据底物的变化来确定的,因此常常将有机分子中碳原子氧化数升高的反应为氧化反应,碳原子氧化数降低的反应为还原反应。有机反应中,多数氧化反应表现为分子中氧的增加或氢的减少,多数还原反应表现为分子中氧的减少或氢的增加。
大学有机化学1要点及反应总结最新版本
Chap 1绪论 一、构造、构型、构象 二、共价键 轨道杂化:C:sp、sp2、sp3杂化方式、空间构型(键角)、未参与杂化p轨道与杂化轨道位置、电负性比较 基本属性:键长:越短键越牢固键能:越大键越牢固σ键能大于п键能 键角:取代基越大键角越大极性和极化性:偶极矩(会判断偶极矩大小:矢 量和) 键断裂方式和反应类型:自由基反应、离子型(亲电、亲核)、周环反应 Lewis酸、碱 氢键、电负性 三、官能团、优先次序(ppt) Chap 2饱和烃——烷烃 一、烃分类 烃:开链烃和环状烃 开链烃:饱和烃和不饱和烃环状烃:脂环烃和芳香烃 二、烷烃通式和构造异构、构象异构(乙烷和丁烷构象) 烷烃通式:C n H2n+2 构造异构体:分子内原子链接顺序不同 σ键形成及特性:电子云重叠程度大,键能大,不易断;可绕轴自由旋转;两核间不能有两个或以上σ键。 乙烷构象:Newman投影式、重叠式(不稳定,因为非键张力大)、交叉式(稳定,各个氢距离远,非键张力小) 丁烷构象:Newman投影式;稳定性(大到小):对位交叉式、邻位交叉式、部分重叠式、全部重叠式 甲烷结构和sp3杂化构型:正四面体型 三、命名 普通命名法(简单化合物):正、异、新 衍生物命名法:以甲烷为母体,选取取代基最多的C为母体C。 系统命名法:①选取最长碳链为主链,主链C标号从距离取代基最近的一端开始标。 ②多取代基时,合并相同取代基,尽量使取代基位次和最小。书写时按照 官能团大小(小在前)命名 ③含多个相同长度碳链时,选取取代基最多的为主链 四、物理性质 沸点(b.p.):直链烷烃随分子量增大而增大(分子间色散力与分子中原子大小和数目成正比,分子量增大,色散力增大,沸点增大) 支链越多,沸点越低(支链多,烷烃体积松散,分子间距离大,色散力小)熔点(m.p.):总趋势:分子量增大,m.p.增大 m.p.曲线(书P48) 相对密度:分子量增大,相对密度增大,接近于0.8 溶解度:不溶于水,易溶于有机溶剂(相似相溶,烷烃极性小)
有机化学中用来研究反应机理的方法
有机反应机制的研究方法 有机化学中用来解释反应机理的传统方法主要集中在Kinetics 和Dynamics两方面,即理解势能面、深入研究分子运动和碰撞、测定活化参数、测定速率常数、确定某个反应机理中一系列化学步骤的顺序、确定反应限速步骤和决速步骤。 研究机理的关键目的是反应机理知识可以对如何在原子或分子水平上操纵物质给出最快速的洞察,而不是依靠运气来获得偶然性的变化从而获得想要的结果。由于动力学在辨别机理方面起着关键作用,所以动力学是整个有机反应机理研究领域中最重要的分支之一。 传统的反应机理研究方法除了动力学分析之外,还有同位素效应、结构-功能分析等。这些都是研究有机反应机理的标准实验工具,然后实验化学家可以根据其想象力和化学创造性,设计出一些完全不同于之前出现过的研究方法。因此,本文总结了一些最为常见的方法。首先分析最简单的实验,例如产物和中间体的鉴定。但也会分析一些更为微妙、精细的实验,如交叉和同位素置乱(cross-over and isotope scrambling)实验。 1.改变反应物结构以转变或捕获预想的中间体 有时可以通过合成一种类似于所研究的反应物的新反应物来破译中间体的性质,但是这需要所预测的中间体能以一种可预想的方式进行反应。没有标准的方式来处理这一类实验,所以实验者必须根据具体实验情况来设计实验。下面以酶反应作为此方法的应用实例。 Lin[1]等人设计了一种转变中间体的方法。扁桃酸消旋化酶可使扁
桃酸根离子的对映体(2-羟基苯甲酸)互换。位于羧酸跟α位的碳负离子被认为是中间体。为了测试此中间体是否存在,作者合成设计了扁桃酸跟离子的类似物i,并用酶对其进行了外消旋化。其过程是首先形成碳负离子,然后经过溴化物的1,6-消除,最后经过互变异构化,分离得到产物ii。此结果支持了在扁桃酸根离子路径中碳负离子中间体iii的存在。 2.捕获实验和竞争实验 鉴定中间体的一种常见方法是通过加入额外的试剂来捕获中间体。目前存在着几种自由基不伙计,许多好的亲核试剂是半衰期很短的亲电试剂(如碳正离子)的可行的捕获剂。必须以自己的化学知识来设计捕获中间体(如碳正离子、卡宾等)的捕获剂。但是活泼中间体的半衰期很短,所以捕获剂必须是具有很高的活性,并能与活泼中间体的标准反应路径进行竞争。同样,因为捕获反应是典型的双分子反应,所以要求捕获剂具有高的浓度。另外,还可以将捕获剂与反应物共价结合,以便更容易地捕获活泼中间体。 与捕获反应所不同的另一种反应是竞争反应。在一般的动力学实
有机化学反应机理画法剖析汇编
学习-----好资料 有机化学反应机理 弯箭头代表一对电子的转移,弯钩意味着一个电子的转移,后者适用于自由基反应
更多精品文档.学习-----好资料 更多精品文档.
好资料学习----- 1 有机反应机理入门 1.1 画路易斯结构式键应准确无误,然后用氢原子完成其余的化学键。先画出分子的骨架,环和pi 对于有机分子,骨架有时以简化形式给出。62个;硼、铝和镓画出孤对电子,使每个原子核外满足充满电子的结构:氢个。最后结构式中的每个原子总的成键电子数可以通过数其核个;其它原子8 )。外的成键电子获得(包括共享电子提示:画路易斯结构式可参考以下结构特征:氢原子永远在构的外围,因为它只能成一个共价键;(1) 碳、氮和氧有特定的键合模式。(2) 代表氢、烷基、芳基或它们的组合,这种变化并不影响成键R在以下的示例中模 式。 pi也可以是sigma键与键。4这4个键可以都是sigma键,①中性的碳原子 为 )。如双键和三键键的组合( 个键。带有单个正电荷或负电荷的碳有3 ② )氮烯除外有3个键和一对未成对电子。( ③中性的氮原子键,带有一个正电荷。正电荷的氮成④ 4
更多精品文档. 学习-----好资料对未成键电子。 2⑤负电荷的氮成键,带有一个负电荷和2 对孤对电子。⑥中性的氧原子成2键,带有2 带正电荷的氧成3键,带有1对孤对电子。⑦轨道,可d(3) 有时磷原子和硫原子可有10个成键电子,这是因为磷和硫具有个电子。以扩展而容纳10 Lewis结构式是价键理论的重要内容,也是学习反应机理的基础。 1.2 电负性或部分)的分子与带有负电荷(多数有机反应依赖于带有正电荷(或部分正电荷部分电荷的产生依赖于)的分子的相互作 用而发生。在中性有机分子中,负电荷电负性的差异。年确定。其数值越大,表明其吸电1960Linus 电负性的数值最初由Pauling在子能力越强,所以氟是吸电子能力最强的元素,见表: 成键后,电负性大的元素的原子拥有部分负电荷,而且,双键结构的部分电荷电子受原子核的束缚小,pi比单键结构的部分电荷密度更大,这是因为双键上的更易于流动。 电负性是很基础的知识,但很有用,很重要。通过电负性,可以解释为什么硼规则,为什么含活泼氢烷加成到烷基取代的不对称烯烃上不服从Markovnikov... 的羰基化合物去质子后主要以烯醇式存在 1.3 共振结构 当分子中成键电子的分布不能用一个路易斯结构充分表达时,可由若干个仅仅 在电子的位置上有差别的路易斯结构的组合来表达。这种仅仅在电子的位置上有差别的路易斯结构称为共振结构。共振结构表达了分子中电子的离域。更多精品文档.
大学有机化学总结
有机化学总结 一、有机化合物的命名 (1)、几何异构体的命名烯烃几何异构体的命名包括顺、反和Z、E两种方法。 简单的化合物可以用顺反表示,也可以用Z、E表示。用顺反表示时,相同的原子或基团在双键碳原子同侧的为顺式,反之为反式。如果双键碳原子上所连四个基团都不相同时,不能用顺反表示,只能用Z、E表示。按照“次序规则”比较两对基团的优先顺序,较优基团在双键碳原子同侧的为Z型,反之为E型。必须注意,顺、反和Z、E是两种不同的表示方法,不存在必然的内在联系。有的化合物可以用顺反表示,也可以用Z、E表示,顺式的不一定是Z型,反式的不一定是E型。例如:CH3-CH2Br C=C (反式,Z型) H CH2-CH3 CH3-CH2 CH3 C=C (反式,E型) H CH2-CH3 脂环化合物也存在顺反异构体,两个取代基在环平面的同侧为顺式,反之为反式。 (2)、光学异构体的命名光学异构体的构型有两种表示方法D、L和R、S, D 、L标记法以甘油醛为标准,有一定的局限性,有些化合物很难确定它与甘油醛结构的对应关系,因此,更多的是应用R、S标记法,它是根据手性碳原子所连四个不同原子或基团在空间的排列顺序标记的。光学异构体一般用投影式表示,要掌握费歇尔投影式的投影原则及构型的判断方法。例如: COOH 根据投影式判断构型,首先要明确, H NH2 在投影式中,横线所连基团向前, CH2-CH3竖线所连基团向后;再根据“次序 规则”排列手性碳原子所连四个基团的优先顺序,在上式中: -NH2>-COOH>-CH2-CH3>-H ;将最小基团氢原子作为以碳原子为中心的正四面体顶端,其余三个基团为正四面体底部三角形的角顶,从四面体底部向顶端方向看三个基团,从大到小,顺时针为R,逆时针为S 。在上式中,从-NH2-COOH -CH2-CH3为顺时针方向,因此投影式所代表的化合物为R构型,命名为R-2-氨基丁酸。 (3)、双官能团化合物的命名双官能团和多官能团化合物的命名关键是确定母体。 常见的有以下几种情况: ①当卤素和硝基与其它官能团并存时,把卤素和硝基作为取代基,其它官能团为母体。 ②当双键与羟基、羰基、羧基并存时,不以烯烃为母体,而是以醇、醛、酮、羧酸为母体。 ③当羟基与羰基并存时,以醛、酮为母体。 ④当羰基与羧基并存时,以羧酸为母体。 ⑤当双键与三键并存时,应选择既含有双键又含有三键的最长碳链为主链,编号时给双键或三键以尽可能低的数字,如果双键与三键的位次数相同,则应给双键以最低编号。 (4).杂环化合物的命名由于大部分杂环母核是由外文名称音译而来,所以,一般采用音译法。要注意取代基的编号。 1. 能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能
有机化学反应机理
有机化学反应机理
有机化学反应机理 对于均裂反应来说:反应物既提供电子又接受电子注意:提供和接受的电子均为单电子 对于异裂反应来说: 提供和接受的电子为电子对 反应物的分类:亲核试剂:电子云密度高的中性分子或带负电荷的原子、原子团或 分子(又为Lewis 碱)。 亲电试剂:电子云密度低的中性原子、原子团或分子或带正电荷的 任何分子、原子、原子团(Lewis酸)。 ?取代反应:SN1 和SN2 ?伯卤代烃= SN2 ?仲卤代烃= SN1 和SN2 ! ?叔卤代烃= SN1 ?离去基团:大多数是卤素 ?亲核试剂:许多亲核试剂!! 邻基取代:在离去基团的邻位上能够进行邻基参与的基团 酯基、羧基、羟基、苯基、稀基、卤素。 .波谱特征 红外光谱 红外特征吸收峰是C-X键的振动吸收,都在指纹区,其中C-F 键的吸收频率在1400~1000 cm-1,C-Cl键为800~600 cm-1,C-Br 键为600~500 cm-1,而C-I 键的吸收频率在500 cm-1附近。 核磁共振谱 1H-NMR谱中,卤素电负性较大,因此与卤素直接相连的碳上的氢的化学位移移向低场 卤代烃及亲核取代反应 反应活性次序: 叔卤烷>仲卤烷>伯卤。用于卤烷的定性分析.
卤素相同、烃基结构不同的卤代烷,其活性顺序为:1°>2°>3°。 此反应也可用于鉴别卤代烃,反应最快的是伯卤代烷,其次是仲卤代烷,反应最慢的是叔卤代烷。 Saytzeff 规则 如果分子内含有几种β-H 时,主要消除含氢较少的碳上的氢,生成双键碳上连有较多取代基的烯烃,这一经验规则称Saytzeff 规则。 RX AgNO 3 C 2H 5OH RONO 2AgX ++RBr + NaI RI + NaBr RCl + NaI RI + NaCl 丙酮丙酮R-X ROH ROR'R-CN R-NH 2O H 2NaOH ,,NH R-R R'COOR R'C CR CNa R-O-NO 2AgX AgNO 3+ △
大学有机化学知识点考试必备
大学有机化学知识点整理考试必备
————————————————————————————————作者:————————————————————————————————日期:
大学有机化学知识点提纲(一)绪论 共价键 价键理论(杂化轨道理论);分子轨道理论;共振论. 共价键的属性:键能;键长;键角;键的极性. 键的极性和分子极性的关系;分子的偶极矩. 有机化合物的特征 (二)烷烃和环烷烃 基本概念 烃及其分类;同分异构现象;同系物;分子间作用力;a键,e键;构型,构象,构象分析,构象异构体;烷基;碳原子和氢原子的分类(即1,2,3碳,氢;4碳);反应机理,活化能. 对于基本概念,不是要求记住其定义,而是要求理解它们,应用它们说明问题. 命名 开链烷烃和环烷烃的IUPAC命名,简单的桥环和螺环的命名. 烷烃和环烷烃的结构 碳原子sp3杂化和四面体构型;环烷烃的结构(小环的张力). 烷烃的构象 开链烷烃的构象,能量变化;环烷烃的构象:重点理解环己烷和取代环己烷的构象及能 量变化,稳定构象,十氢萘及其它桥环的稳定构象. 烷烃的化学性质 自由基取代反应—卤代反应及机理;碳游离基中间体—结构,稳定性;不同的卤素在反应中的活性和选择性;反应过程中的能量变化. 环烷烃的化学性质 自由基取代反应(与烷烃一致);小环(3,4元环)性质的特殊性—加成. (三)烯烃 烯烃的结构特点 碳的sp2杂化和烯烃的平面结构;键和键. 烯烃的同分异构,命名 碳架异构,双键位置异构,顺反异构(Z,E). 烯烃的物理和化学性质 烯烃的亲电加成及其机理,马氏规则;碳正离子中间体—结构,稳定性,重排. 其它加成反应:催化加氢(立体化学,氢化热);硼氢化—氧化(加成取向,立体化学);羟汞化—脱汞(加成取向);与HBr/过氧化物加成(加成取向);其它游离基加成. 氧化反应:羟基化反应—邻二醇的形成;KMnO4/H+的氧化,臭氧化反应,烯烃结构的测定. α-位取代反应:烯丙基型取代反应(高温卤代和NBS卤代)及机理—烯丙基自由基. (四)炔烃和二烯烃 炔烃 ①结构:碳的sp杂化和碳-碳三键;sp杂化,sp2杂化和sp3杂化的碳的电负性的差异及相应化合物的偶极矩. ②同分异构体 ③化学性质:末端炔烃的酸性及相关的反应;三键的加成:催化加氢,亲电加成,亲核加成;碳—碳三键与H2/Lindlar催化剂反应(顺式烯烃);碳—碳三键与Na/液氨的反应(反式烯烃);加卤素;加HX(马氏规则);加H2O(羰基化合物的形成);加HBr/过氧化物;硼氢化—氧化;加HCN及乙炔的二聚;氧化反应:KMnO4氧化和臭氧化. 二烯烃 ①共轭二烯烃的稳定性:键能和键长平均化,共轭效应.
有机反应机理介绍
有机反应:在一定的条件下,有机化合物分子中的成键电子发生重新分布,原有的键断裂,新的键形成,从而使原分子中原子间的组合发生了变化,新的分子产生。这种变化过程称为有机反应(organic reaction)。一级反应:在动力学上,将反应速率只取决于一种化合物浓度的反应称为一级反应。 二级反应:在动力学上,将反应速率取决于两种化合物浓度的反应称为二级反应。 按化学键的断裂和生成分类 协同反应:在反应过程中,旧键的断裂和新键的形成都相互协调地在同一步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡态。它是一种基元反应。 自由基型反应:由于分子经过均裂产生自由基而引发的反应称为自由基型反应。自由基型反应分链引发、链转移和链终止三个阶段:链引发阶段是产生自由基的阶段。由于键的均裂需要能量,所以链引发阶段需要加热或光照。链转移阶段是由一个自由基转变成另一个自由基的阶段,犹如接力赛一样,自由基不断地传递下去,像一环接一环的链,所以称之为链反应。链终止阶段是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。 离子型反应:由分子经过异裂生成离子而引发的反应称为离子型反应。离子型反应有亲核反应和亲电反应,由亲核试剂进攻而发生的反应称为亲核反应,亲核试剂是对原子核有显著亲和力而起反应的试剂。由亲电试剂进攻而发生的反应称为亲电反应。亲电试剂是对电子有显著亲合力
而起反应的试剂。 按反应物和产物的结构关系分类 加成反应:两个或多个分子相互作用,生成一个加成产物的反应称为加成反应。 取代反应:有机化合物分子中的某个原子或基团被其它原子或基团所置换的反应称为取代反应。 重排反应:当化学键的断裂和形成发生在同一分子中时,会引起组成分子的原子的配置方式发生改变,从而形成组成相同,结构不同的新分子,这种反应称为重排反应。 消除反应: 在一个有机分子中消去两个原子或基团的反应称为消除反应。可以根据两个消去基团的相对位置将其分类。若两个消去基团连在同一个碳原子上,称为1,1-消除或α-消除;两个消去基团连在两个相邻的碳原子上,则称为1,2-消除或β-消除;两个消去基团连在1,3位碳原子上,则称为1,3-消除或γ-消除。其余类推。 氧化还原反应:有机化学中的氧化和还原是指有机化合物分子中碳原子和其它原子的氧化和还原,可根据氧化数的变化来确定。氧化数升高为氧化,氧化数降低为还原。氧化和还原总是同时发生的,由于有机反应的属性是根据底物的变化来确定的,因此常常将有机分子中碳原子氧化数升高的反应为氧化反应,碳原子氧化数降低的反应为还原反应。有机反应中,多数氧化反应表现为分子中氧的增加或氢的减少,多数还原反应表现为分子中氧的减少或氢的增加。
有机化学天堂秘笈PDF版 1
有機化學天堂祕笈──精要版 第1章鍵—線圖(Bond-Line Drawings)第2章共振(Resonance) 第3章酸—鹼反應(Acid-Base Reactions)第4章分子幾何學(Geometry) 第5章命名法(Nomenclature) 第6章構形(Conformations) 第7章組態(Configurations) 第8章反應機構(Mechanisms) 第9章取代反應(Substitution Reactions)第10章脫除反應(Elimination Reactions)第11章加成反應(Addition Reactions) 第12章預估產物(Predicting Products) 第13章合成(Synthesis)
第1章鍵—線圖 鍵線圖怎麼畫? 要在有機化學上得高分,你必須學會的第一件事是解讀有機化學中所有的圖像。首先,要學會畫鍵線圖。 畫鍵線圖有三個重點: 1. 長直鏈要畫成鋸齒狀 2. 與雙鍵相接的鍵,夾角越大越好 3. 鋸齒狀碳鏈,可以向外撇,也可以向內 畫鍵線圖的時候,有四個要避免的錯誤 1. 碳不可以接四個鍵,分子圖上的所有原子都要遵守八隅體法則 2. 只由C與H構成的分子,C與H要嘛就都畫出來,要嘛就都不畫 3. 畫碳鏈時,鍵的夾角越大越好
4. H如果接了非碳的原子,H就一定要畫出來 但是,學會畫鍵線圖,只是看懂有機化學圖形的第一步,能不能學好有機化學,要看搞不搞得懂共振是什麼! 第2章共振 共振是什麼? 從共振結構中,可以看出分子裡最容易反應的部位,因此要會畫共振結構,才能掌握有機化學反應。 畫共振結構的兩大戒律 1. 絕不可以打斷單鍵 2. 絕不違反八隅體法則
大学有机化学反应方程式总结(较全)
【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 【本质】不对称烯烃的亲电加成总是生成较 稳定的碳正离子中间体。 【注】碳正离子的重排 (2) HBr R —CH = CH 2 R — CH 2 一 CH 2—Br ROOR 【特点】反马氏规则 【机理】自由基机理(略) 【注】过氧化物效应仅限于 HBr 、对HCI 、HI 无效。 【本质】不对称烯烃加成时生成 稳定的自由基 中间体。 【例】 【特点】不对称烯烃经硼氢化 一氧化得一反马氏加成 的醇,加成是顺式的,并且不重排。 【机理】 烯烃 1、卤化氢加成 (1) 有机化学 HX R —CH=CH 2 ------- R —CH-CH 3 H 3 C H 3 C CH-CH 3 X + ----------- H 3C —CH 3 X + CH 2 X + H 3C X 次 H 3C --------------------- A HBr -CH 2 n I. 氧化 R- — CH CH 2 H 3C —CH-CH 2Br + H 3C-CH-CH 3 HBr CH 3CH 2CH 2Br Br H 3C —CH — CH Br R -CH 2 一 CH 2-OH 2)H 2O 2/OH - H 3C Br 2、硼氢化
H3C H3C H3C H3C CH -CH2 CH2 BH2 CH3C2CH2 H --------- B H2 3 H --------- B H2 CH2CH2CH3 I- 4 (CH3CH2CH2)3B 0_0£ H3CH2CH2C —B—O—OH BH2 CH 2CH 2CH 3 CH2CH2CH3 ? H3CH2CH2C—B——O + HO CH2CH2CH3 I- HO—O CH2CH2CH3 H3CH2CH2C-B——OCH 2CH2CH3 ■O-OH CH2CH2CH3 HOO- B ——OCH 2CH2CH3B(OCH 2CH 2CH 3)3 OCH 2CH 2CH 3 B(OCH 2CH2CH3)3 + 3NaOH 3NaOH 3HOCH 2 CH 2 CH 3 3+ Na 3 BO 3 【例 】 CH3 3、X2加成 Br 【机 理】 C=C Br C C Br H2O Br c—C c—C l' + Br + -H ■J r C—C / l\ HO 「Br C +C 一:-\l / c—c / l\ Br
