化学元素核外电子排布表

化学元素核外电子排布表教学文稿
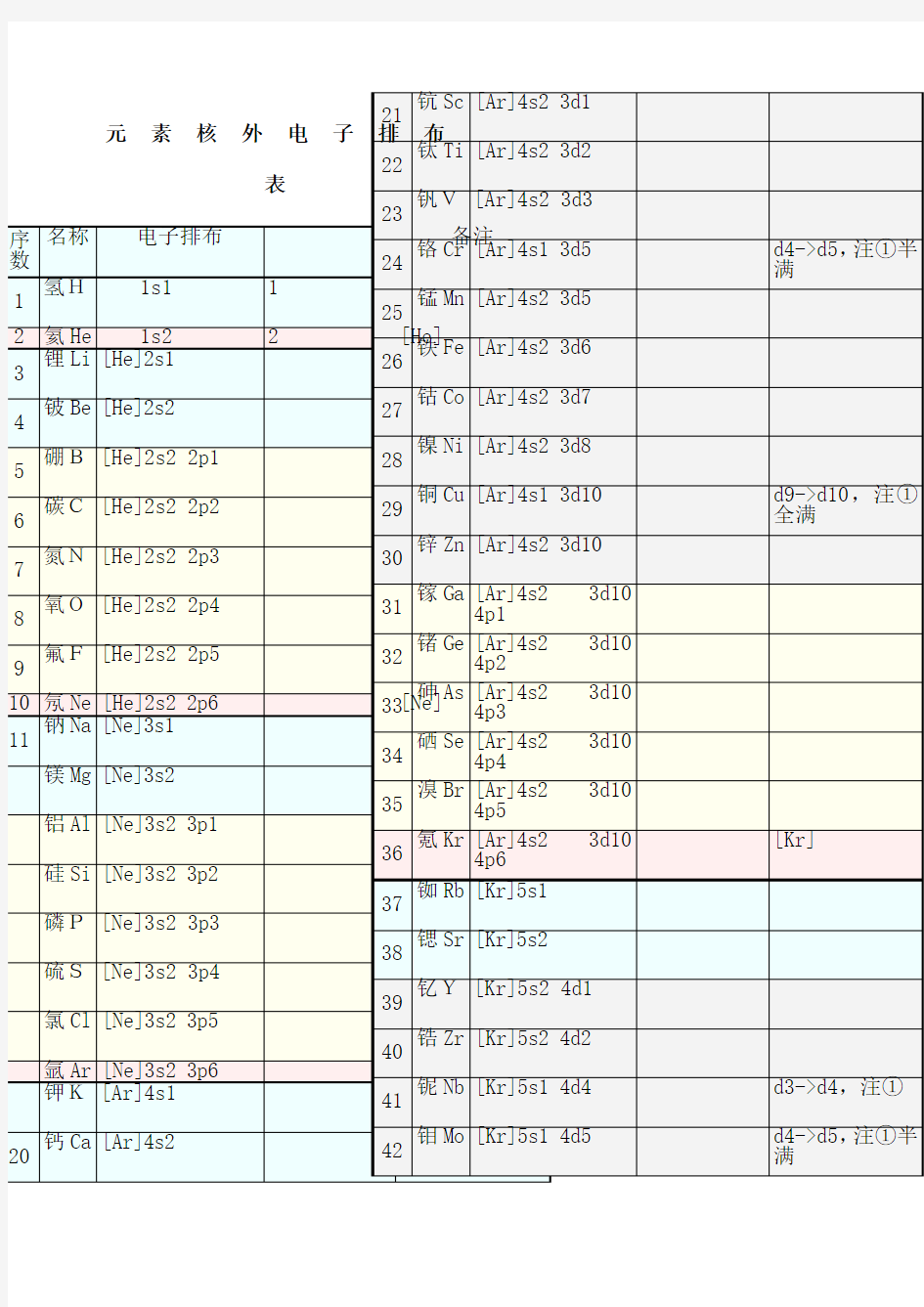
元素核外电子排布表 精品文档
76 锇Os [Xe]6s2 4f14 5d6 2.8.18.32.14.2 77 铱Ir [Xe]6s2 4f14 5d7 2.8.18.32.15.2 78 铂Pt [Xe]6s1 4f14 5d9 2.8.18.32.17.1 d8->d9,注① 79 金Au [Xe]6s1 4f14 5d10 2.8.18.32.18.1 d9->d10,注①全满 80 汞Hg [Xe]6s2 4f14 5d10 2.8.18.32.18.2 81 铊Tl [Xe]6s2 4f14 5d10 6p1 2.8.18.32.18.3 82 铅Pb [Xe]6s2 4f14 5d10 6p2 2.8.18.32.18.4 83 铋Bi [Xe]6s2 4f14 5d10 6p3 2.8.18.32.18.5 84 钋Po [Xe]6s2 4f14 5d10 6p4 2.8.18.32.18.6 红色为放射性元素 85 砹At [Xe]6s2 4f14 5d10 6p5 2.8.18.32.18.7 86 氡Rn [Xe]6s2 4f14 5d10 6p6 2.8.18.32.18.8 [Rn] 87 钫Fr [Rn]7s1 2.8.18.32.18.8.1 88 镭Ra [Rn]7s2 2.8.18.32.18.8.2 89 锕Ac [Rn]7s2 5f0 6d1 2.8.18.32.18.9.2 f1->f0,注②全空 90 钍Th [Rn]7s2 5f0 6d2 2.8.18.32.18.10.2 f2->f0,注②全空 91 镤Pa [Rn]7s2 5f2 6d1 2.8.18.32.20.9.2 f3->f2,注② 92 铀U[Rn]7s2 5f3 6d1 2.8.18.32.21.9.2 f4->f3,注② 93 镎Np [Rn]7s2 5f4 6d1 2.8.18.32.22.9.2 f5->f4,注② 94 钚Pu [Rn]7s2 5f6 2.8.18.32.24.8.2 95 镅Am [Rn]7s2 5f7 2.8.18.32.25.8.2 加粗为人造元素 96 锔Cm [Rn]7s2 5f7 6d1 2.8.18.32.25.9.2 f8->f7,注②半满 97 锫Bk [Rn]7s2 5f9 2.8.18.32.27.8.2 98 锎Cf [Rn]7s2 5f10 2.8.18.32.28.8.2 99 锿Es [Rn]7s2 5f11 2.8.18.32.29.8.2 100 镄Fm [Rn]7s2 5f12 2.8.18.32.30.8.2 101 钔Md [Rn]7s2 5f13 2.8.18.32.31.8.2 兰色为估计排布式102 锘No [Rn]7s2 5f14 2.8.18.32.32.8.2 103 铹Lr [Rn]7s2 5f14 6d1 2.8.18.32.32.9.2 104 Rf [Rn]7s2 5f14 6d2 2.8.18.32.32.10.2 105 Ha [Rn]7s2 5f14 6d3 2.8.18.32.32.11.2 106 [Rn]7s2 5f14 6d4 2.8.18.32.32.12.2 107 [Rn]7s2 5f14 6d5 2.8.18.32.32.13.2 108 [Rn]7s2 5f14 6d6 2.8.18.32.32.14.2 109 [Rn]7s2 5f14 6d7 2.8.18.32.32.15.2 110 [Rn]7s1 5f14 6d9 2.8.18.32.32.17.1 d8->d9,注① 111 [Rn]7s1 5f14 6d10 2.8.18.32.32.18.1 d9->d10,注①全满112 [Rn]7s2 5f14 6d10 2.8.18.32.32.18.2 113 [Rn]7s2 5f14 6d10 7p1 2.8.18.32.32.18.3 114 [Rn]7s2 5f14 6d10 7p2 2.8.18.32.32.18.4 115 [Rn]7s2 5f14 6d10 7p3 2.8.18.32.32.18.5 116 [Rn]7s2 5f14 6d10 7p4 2.8.18.32.32.18.6 117 [Rn]7s2 5f14 6d10 7p5 2.8.18.32.32.18.7 灰色为未发现元素118 [Rn]7s2 5f14 6d10 7p6 2.8.18.32.32.18.8 ②d亚层在f亚层外,常多填d亚层,少填f亚层(使之趋于全空/半满) 精品文档
1~36号元素基态原子的核外电子排布
1~36号元素基态原子的核外电子排布 广东郑春平 基态原子是处于能量最低状态下的原子,基态原子的核外电子排布,决定了元素周期表的划分和原子半径的变化规律。要认识基态原子的核外电子排布,必需要掌握排布原则和电子在原子轨道上的排布顺序。. 一、基态原子的核外电子排布三大原则 1、能量最低原则:核外电子的排布要使整个原子的能量最低,以形成稳定结构。 2、泡利不相容原理:一个原子轨道中最多只能容纳两个电子,并且这两个电子的 自旋方向必须相反。 3、洪特规则:对于基态原子,电子在能量相同的轨道上排布时,应尽可能的分占 不同的轨道并且自旋方向相同。 洪特规则实际上是为了更好的遵循能量最低原则,根据光谱实验结果,洪特进一 步指出,能量相同的原子轨道在全充满(p6和d10)、半充满(p3和d5)和全空(p0和 d0)状态时,体系能量最低,原子最稳定。 二、电子在原子轨道上的排布顺序 多电子原子中,电子填充电子轨道时,一般先填满能量低的轨道,再填能量高的轨道原子轨道能量的高低存在以下规律: 1、相同电子层上原子轨道能量的高低:ns 一、原子核外电子排布的原理 处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。 1.最低能量原理 电子在原子核外排布时,要尽可能使电子的能量最低。怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕。这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用。电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态。当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势。一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p…… 2.保里不相容原理 我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向。在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的。根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。也就是说,每一个轨道中只能容纳两个自旋方向相反的电子。这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间)。根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;f亚层有5个轨道,总共可以容纳10个电子。我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n2个电子。 3.洪特规则 元素核外电子排布表 只供学习与交流 76 锇Os [Xe]6s2 4f14 5d6 2.8.18.32.14.2 77 铱Ir [Xe]6s2 4f14 5d7 2.8.18.32.15.2 78 铂Pt [Xe]6s1 4f14 5d9 2.8.18.32.17.1 d8->d9,注① 79 金Au [Xe]6s1 4f14 5d10 2.8.18.32.18.1 d9->d10,注①全满 80 汞Hg [Xe]6s2 4f14 5d10 2.8.18.32.18.2 81 铊Tl [Xe]6s2 4f14 5d10 6p1 2.8.18.32.18.3 82 铅Pb [Xe]6s2 4f14 5d10 6p2 2.8.18.32.18.4 83 铋Bi [Xe]6s2 4f14 5d10 6p3 2.8.18.32.18.5 84 钋Po [Xe]6s2 4f14 5d10 6p4 2.8.18.32.18.6 红色为放射性元素 85 砹At [Xe]6s2 4f14 5d10 6p5 2.8.18.32.18.7 86 氡Rn [Xe]6s2 4f14 5d10 6p6 2.8.18.32.18.8 [Rn] 87 钫Fr [Rn]7s1 2.8.18.32.18.8.1 88 镭Ra [Rn]7s2 2.8.18.32.18.8.2 89 锕Ac [Rn]7s2 5f0 6d1 2.8.18.32.18.9.2 f1->f0,注②全空 90 钍Th [Rn]7s2 5f0 6d2 2.8.18.32.18.10.2 f2->f0,注②全空 91 镤Pa [Rn]7s2 5f2 6d1 2.8.18.32.20.9.2 f3->f2,注② 92 铀U[Rn]7s2 5f3 6d1 2.8.18.32.21.9.2 f4->f3,注② 93 镎Np [Rn]7s2 5f4 6d1 2.8.18.32.22.9.2 f5->f4,注② 94 钚Pu [Rn]7s2 5f6 2.8.18.32.24.8.2 95 镅Am [Rn]7s2 5f7 2.8.18.32.25.8.2 加粗为人造元素 96 锔Cm [Rn]7s2 5f7 6d1 2.8.18.32.25.9.2 f8->f7,注②半满 97 锫Bk [Rn]7s2 5f9 2.8.18.32.27.8.2 98 锎Cf [Rn]7s2 5f10 2.8.18.32.28.8.2 99 锿Es [Rn]7s2 5f11 2.8.18.32.29.8.2 100 镄Fm [Rn]7s2 5f12 2.8.18.32.30.8.2 101 钔Md [Rn]7s2 5f13 2.8.18.32.31.8.2 兰色为估计排布式102 锘No [Rn]7s2 5f14 2.8.18.32.32.8.2 103 铹Lr [Rn]7s2 5f14 6d1 2.8.18.32.32.9.2 104 Rf [Rn]7s2 5f14 6d2 2.8.18.32.32.10.2 105 Ha [Rn]7s2 5f14 6d3 2.8.18.32.32.11.2 106 [Rn]7s2 5f14 6d4 2.8.18.32.32.12.2 107 [Rn]7s2 5f14 6d5 2.8.18.32.32.13.2 108 [Rn]7s2 5f14 6d6 2.8.18.32.32.14.2 109 [Rn]7s2 5f14 6d7 2.8.18.32.32.15.2 110 [Rn]7s1 5f14 6d9 2.8.18.32.32.17.1 d8->d9,注① 111 [Rn]7s1 5f14 6d10 2.8.18.32.32.18.1 d9->d10,注①全满112 [Rn]7s2 5f14 6d10 2.8.18.32.32.18.2 113 [Rn]7s2 5f14 6d10 7p1 2.8.18.32.32.18.3 114 [Rn]7s2 5f14 6d10 7p2 2.8.18.32.32.18.4 115 [Rn]7s2 5f14 6d10 7p3 2.8.18.32.32.18.5 116 [Rn]7s2 5f14 6d10 7p4 2.8.18.32.32.18.6 117 [Rn]7s2 5f14 6d10 7p5 2.8.18.32.32.18.7 灰色为未发现元素118 [Rn]7s2 5f14 6d10 7p6 2.8.18.32.32.18.8 ②d亚层在f亚层外,常多填d亚层,少填f亚层(使之趋于全空/半满) 只供学习与交流 教材分析 《核外电子排布和元素周期表》是人教版九年级化学上册第四单元单元课题 子第一知识点《核外电子的排布》和课题 2:元素第三知识点《元素周期表简介》的内容。 通过核外电子的排布的教学使学生更容易理解元素周期表的特点,这样安排便于让前后知 识贯通,使教学的连贯性更强。本课时是在学生已经较好掌握原子的结构和元素基本知识 的基础上进行的,并为下一课时进行离子形成做好基础铺垫。 学情分析 为顺利完成本课时的教学要求,突出重点,帮助学生突破难点,我将采用讲练相结 合的教学方法,运用以引导讨论和指导练习为主,多媒体 PPt 课件直观展示、总结为辅的 手段进行组织教学。同时引导学生勤动手、多动脑、相互合作的学法来完成本课时的各项 教学任务。 教学目标 1、知道原子核外电子是分层排布的。 2、理解原子结构示意图含义,掌握前 18号元 素的原子结构示意图的书写。 3、通过观察1--18号元素的原子结构示意图,了解元素周期 表的特点。 教学重点和难点 重点:理解原子结构示意图含义,掌握前18号元素的原子结构示意图的书写。 难点:原子结构示意图的书写 和元素周期表的特点。 教学过程 课题 作单位 基本信息 3:离 1、原子是不是实心球体? 2、原子由哪些粒子构成?粒子 间存在什么关系? 3、原子核外电子是怎么排布 的呢? 、核外电子排布(板书) 1、出示原子结构平面图, 让学生数一数质子和电子的个 学生根据质子数,能较好 得出是钠原子的平面图,并 根据电子个数能得出质子数 等于核外电子数。 数。(问)这是什么元素的原 幻灯片,并介绍核外电子排布 3、(问)如果每一种原子结 1、 同心圆不好画。 2、 用圆点代表粒子不好 数 构都用平面图,有很多缺陷, 那怎么办? 教学环 节 教师活动 预设学生行为 设计意图 子是分层排布的。 引课 (设疑引课) 学生能正确完成所涉及 内容 温故所学知识,为 下一步教学做好铺垫 子?从这幅图你能知道什么信 息? 2、引导出示PPt 中第三副 通过幻灯片展示让 抽象的微观粒子直观 化,便于学生的理解掌 握,降低知识认知的难 度。知 道原子核外电 特点。 1~36号元素电子排布式依次如下: 1、氢H 1s1 2、氦He 1s2 3、锂Li 1s2 2s1 4、铍Be 1s22s2 5、硼 B 1s2 2s2 2p1 6、碳 C 1s22s22p2 7、氮N 1s22s22p3 8、氧O 1s22s22p4 9、氟 F 1s22s22p5 10、氖Ne 1s22s22p6 11、钠Na 1s22s22p63s1 12、镁Mg 1s22s22p63s2 13、铝Al 1s22s22p63s23p1 14、硅Si 1s22s22p63s23p2 15、磷P 1s22s22p63s23p3 16、硫S 1s22s22p63s23p4 17、氯Cl 1s22s22p63s23p5 18、氩Ar 1s22s22p63s23p6 19 钾K 1s22s22p63s23p64s1 20、钙Ca 1s22s22p63s23p64s2 21、钪Sc 1s22s22p63s23p63d14s2 22、钛Ti 1s22s22p63s23p63d24s2 23、钒V 1s22s22p63s23p63d34s2 24、铬Cr 1s22s22p63s23p63d54s1 25、锰Mn 1s22s22p63s23p63d54s2 26、铁Fe 1s22s22p63s23p63d64s2 27、钴Co 1s22s22p63s23p63d74s2 28、镍Ni 1s22s22p63s23p63d84s2 29、铜Cu 1s22s22p63s23p63d104s1 30、锌Zn 1s22s22p63s23p63d104s2 31、镓Ga 1s22s22p63s23p63d104s24p1 32、锗Ge 1s22s22p63s23p63d104s24p2 33、砷As 1s22s22p63s23p63d104s24p3 34、硒Se 1s22s22p63s23p63d104s24p4 35、溴Br 1s22s22p63s23p63d104s24p5 36、氪Kr 1s22s22p63s23p63d104s24p6 二、原子核外电子的排布 [教学目标] 1、知识与技能目标 (1)了解元素原子核外电子排布的基本规律,能用原子(离子)结构示意图表示原子(离子)的核外电子排布 (2)了解原子核外电子的排布规律,元素的金属性和非金属性,元素的化合价、原子半径等随元素核电核数呈周期性变化的规律,认识元素周期率。 2、过程与方法目标 培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。3.情感、态度与价值观 (1)初步体会物质构成的奥秘,培养学生的抽象思维能力、想像力和分析推理能力; (2)树立“结构决定性质”、“物质的粒子性”等辩证唯物主义观点。 [教学重、难点] 构成原子的微粒间的关系和核外电子排布规律。培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。了解假说、模型等科学研究方法和科学研究的历程。 [教学过程] [复习提问] 1.构成原子的粒子有哪些,它们之间有何关系? 2.为什么原子不显电性? 3.为什么说原子的质量主要集中原子核上? [引言]我们已经知道,原子是由原子核和电子构成的,原子核的体积很小,仅占原子体积的几千亿分之一,电子在原子内有“广阔”的运动空间。在这“广阔”的空间里,核外电子是怎样运动的呢? [板书]原子核外电子的排布 [交流与讨论1]原子在核外是怎样运动的? [打开书P78页,阅读教材,核外电子是怎么排布的?用两个字概括。 【讲解】原子中的核外电子运动虽然没有固定的轨道(太阳系中的地球等有运动轨道),但却有经常出现的区域,这些区域叫做电子层。 【过渡】电子究竟是怎样分层排布的呢? 【投影】讲解:核外电子最少的有1层,最多的有7层,最靠近原子核的是第一层(K 层)……第一层的能量最低,第七层能量最高。[归纳]按能量高低分层排布。(能量由低到高) K L M N O P Q …… 原子核外电子排布规律 ①能量最低原理:电子层划分为K过渡期元素核外电子排布
化学元素核外电子排布表
《核外电子排布和元素周期表》
1~36号元素电子排布图
(完整版)教案《原子核外电子的排布》
核外电子排布规律总结
