中国石油大学热工基础典型问题第三章 理想气体的性质与热力过程

工程热力学与传热学
第三章 理想气体的性质与热力过程 典型问题分析
一. 基本概念分析
1 c p ,c v ,c p -c v ,c p /c v 与物质的种类是否有关,与状态是否有关。
2 分析此式各步的适用条件:
3
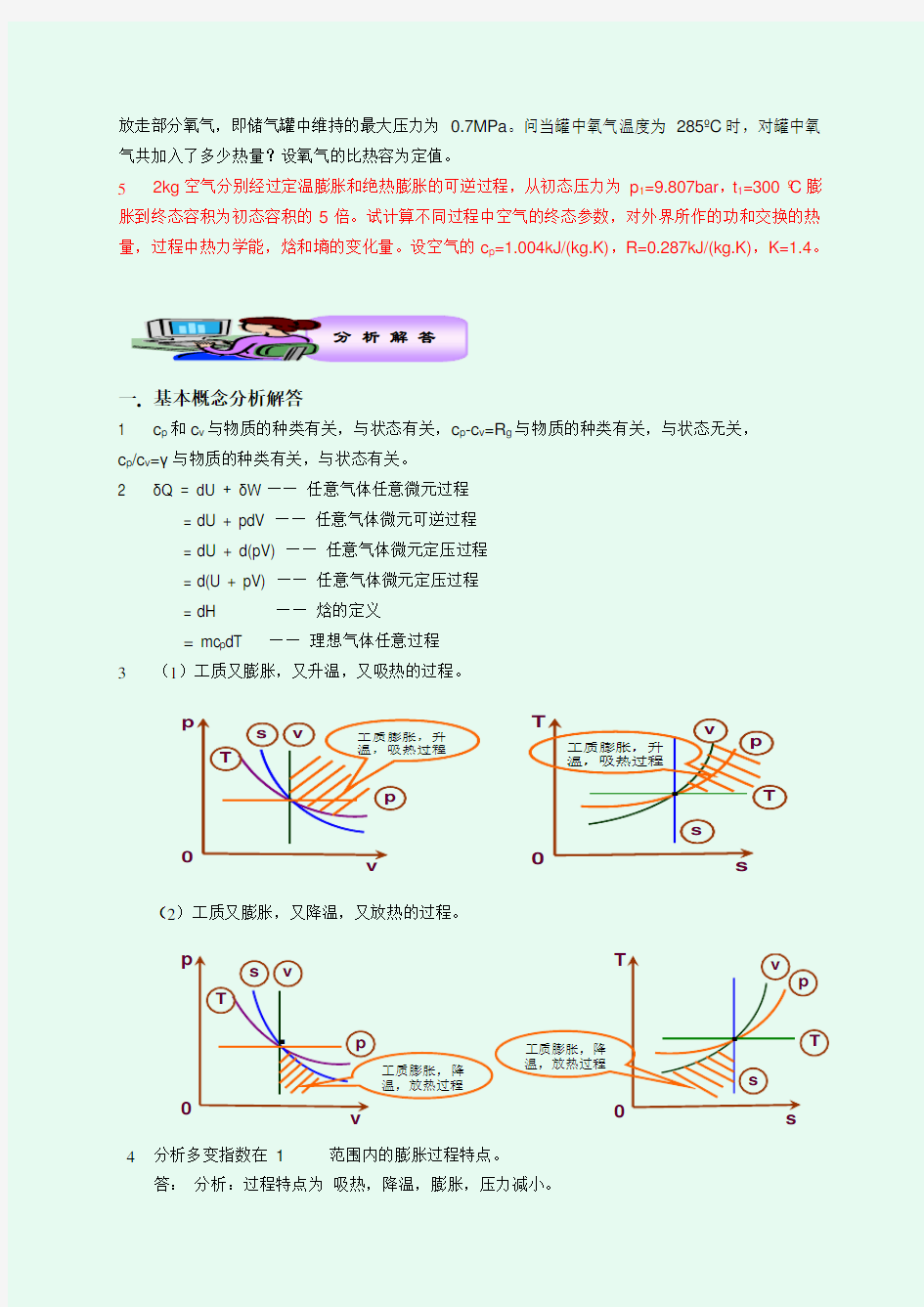
将满足下列要求的理想气体多变过程表示在p-v 图和T-s 图上。 (1) 工质又膨胀,又升温,又吸热的过程。 (2) 工质又膨胀,又降温,又放热的过程。
4 试分析多变指数在 1 二. 计算题分析 理想气体状态方程式的应用 1 某蒸汽锅炉燃煤需要的标准状况下,空气量为 q V =66000m 3/h ,若鼓风炉送入的热空气温度为 t 1=250°C ,表压力 p g1=20.0kPa 。当时当地的大气压力 p b =101.325kPa 。求实际的送风量为多少? 理想气体的比热容 2 在燃气轮机动力装置的回热器中,将空气从150oC 定压加热到350oC ,试按下列比热容值计算 对每公斤空气所加入的热量。 01 按真实比热容计算; 02 按平均比热容表计算(附表2,3); 03 按定值比热容计算; 04 按空气的热力性质表计算(附表4); 3 已知某理想气体的比定容热容c v =a+bt , 其中a ,b 为常数,试导出其热力学能,焓和熵变的 计算式。 理想气体的热力过程 4 一容积为 0.15m 3 的储气罐,内装氧气,其初始压力 p 1=0.55MPa ,温度 t 1=38oC 。若对氧气 加热,其温度,压力都升高。储气罐上装有压力控制阀,当压力超过 0.7MPa 时,阀门便自动打开, dT mc dH pV U d pV d dU pdV dU W dU Q P ==+=+=+=+=)()(δδ典 型 问 题 放走部分氧气,即储气罐中维持的最大压力为 0.7MPa 。问当罐中氧气温度为 285oC 时,对罐中氧气共加入了多少热量?设氧气的比热容为定值。 5 2kg 空气分别经过定温膨胀和绝热膨胀的可逆过程,从初态压力为 p 1=9.807bar ,t 1=300 oC 膨 胀到终态容积为初态容积的5倍。试计算不同过程中空气的终态参数,对外界所作的功和交换的热量,过程中热力学能,焓和墒的变化量。设空气的c p =1.004kJ/(kg.K),R=0.287kJ/(kg.K),K=1.4。 一. 基本概念分析解答 1 c p 和c v 与物质的种类有关,与状态有关,c p -c v =R g 与物质的种类有关,与状态无关, c p /c v =γ与物质的种类有关,与状态有关。 2 δQ = dU + δW —— 任意气体任意微元过程 = dU + pdV —— 任意气体微元可逆过程 = dU + d(pV) —— 任意气体微元定压过程 = d(U + pV) —— 任意气体微元定压过程 = dH —— 焓的定义 = mc p dT —— 理想气体任意过程 3 (1)工质又膨胀,又升温,又吸热的过程。 (2)工质又膨胀,又降温,又放热的过程。 4 分析多变指数在 1 答: 分析:过程特点为 吸热,降温,膨胀,压力减小。 分 析 解 答 工质膨胀,升 p v T s v p 温,吸热过程 工质膨胀,升T s . p T s v 温,吸热过程 . p v T s v p 工质膨胀,降温,放热过程 T s . p T s v 工质膨胀,降温,放热过程 二. 计算题分析解答 1 解:按理想气体状态方程式,可得: 0 11 00 1T P T P V V = 其中:mmHg p p p g b 91015076011=+=+= 故:h m V /10554315 .2732132.1) 250273(01325.16600031=?+??= 2 解:已知:T 1=(150+273.15)K= 423.15K ,T 2=(350+273.15)K= 623.15K 。 按真实热容经验公式计算:空气的摩尔定压热容式为 41239263,102763.010913.110294.310337.1653.3/K K K K m p T T T T R C ----?+?-?+?-=1mol 空气的加热量为: ()[] [] [] [] mol J K K K K K K K K K K K mol J dT R C R dT C Q K K K K m p m p p /05.5994) )15.423()15.623(5 102763.0)15.423()15.623(4 10913.1)15.423()15.623(310294.3)15.423()15.623(210337.115.42315.623(653.3)./(3145.85512 449 336 223 15.62315.42315.62315.423,,=-??+-??--??+-??- -??=== ----? ? 查表得空气的摩尔质量M=28.97X10-3kg/mol ,故对1 kg 空气的加热量为: kg kJ kg J mol kg mol J M Q q p p /9.206/109.206/1097.28/05.599433 =?=?= = - 按平均比热容表计算:查附表得: ) ./(028.1400);./(019.1300)./(012.1200);.(006.1100K kg kJ c C t K kg kJ c C t K kg kJ c C t K kg kJ c C t p p p p =?==?==?==?=时,时,时,时, 所以: []) ./(009.1) ./(006.110050)./(006.1)./(012.11500,K kg kJ K kg kJ C C K kg kJ K kg kJ c C C m p =+???-=?? []) ./(0235.1) ./(019.110050./(019.1)./(028.13500,K kg kJ K kg kJ C C K kg kJ K kg kJ c C C m p =+???-=?? ) ./(88.206150)./(009.1350)./(0235.11 1500,23500,K kg kJ C K kg kJ C K kg kJ t c t c q C C m p C C m p p =??-??=-=???? 按定值比热容计算: )./(89.200)150350(97 .28314.827)(27)(1212K kg kJ t t R t t c q g p p =-??=-= -= 按空气的热力性质表计算:查空气的热力性质表得:当 kg kJ h K T kg kJ h K T /25.633)08.63065.640(620630620 62308.630,623350273/34.426)29.42345.433(420 430420 42329.4234231502732211=-?--+==+==-?--+ ==+=时时, 所以:kg kJ h h q p /91.20634.42625.63312=-=-= 分析:气体比热容的处理方法主要采用上述几种形式,其中真实比热容,平均比热容表,气体热力 性质表是表述比热容随温度变化的曲线关系。由于平均比热容表和气体热力性质表都是根据比热容的精确数值编制的,因此可以求得最可靠的结果。与它们相比,按真实比热容算得的结果,其相对误差在1%左右。定值比热容是近似计算,误差较大,但由于其计算简单,在计算精确度要求不高,或气体温度不太高且变化范围不大时,一般按定值比热容计算。 3 解: 1 212121 2 122 12212212 212ln )(ln ln )(ln )(2 ))(()()(2 )()(21 212 1 2 12 1 2 1v v R T T b T T a v v R T dT bT a v v R T dT c s T T b T T R a dT R bT a dT c h T T b T T a dT bT a dT c u R bT a R c c g g T T g T T v T T g g T T p T T T T v g g v p +-+=++=+=?-+-+=++= = ?-+ -=+= = ?++=+=????? ? 4 解:分析:这一问题包含了两个过程:一是由压力为C t MPa p ?==38,55.011被定容加热到 ,7.02MPa p =该过程中氧气的质量不变;二是压力由,7.02MPa p =被定压加热到 C t MPa p ?==285,7.033,该过程是一个质量不断变化的定压过程。 因此(1)1-2定容过程 根据定容过程状态参数之间的变化规律,有 K MPa MPa K p p T T 8.39555.07.0)38273(121 2=?+== 该过程吸热量为: kJ K K K m Pa T T R T R V p T c m Q g g v V 24.56)3118.395(31115.01055.025)(2 5 3 6 1211=-???= -?=?= (2)2-3变质量定压过程 由于该过程中质量随时在变,因此应先列出其微元变化的吸热量 T dT V p dT R T R V p dT mc Q g g p p 222727=?= =δ 于是: kJ K K m Pa T T V p T dT V p Q T T p 2.1268.395)285273(ln 15.0107.027ln 2727362 3223 2=+???= == ? 故,对罐内氧气共加入热量: kJ kJ kJ Q Q Q p V 4.1822.12624.56=+=+= 分析:(1)当题目给出同一状态下的3个状态参数p ,V ,T 时,实际上已隐含给出了此状态下工 质的质量,所以求能量转换时,应求出总质量下的能量转换量,而不是单位质量的能量转换量; (2) 该题目的2-3过程是一个变质量,变温度过程,对于这样的过程,可先按质量不变列出微元表达式,然后积分求解。 5 解:取空气作热力系 (1)可逆定温过程1-2 由参数间的相互关系得:.961.15 1 807.9122bar v v p p =?== 按理想气体状态方程式得; . /8385.05,/1677.010807.9)300273(10287.031235 3111kg m v v kg m p RT v ===?+?== 定温过程:T 1 =T 2=573K , 气体对外所作的膨胀功及交换的热量: kJ V V V p Q W T T 4.5295ln )1677.02(10807.9ln 51 2 11=??=== 过程中热力学能,焓,熵的变化为: K kJ V V mR S H U /9238.0ln ,0,02 2 212121==?=?=?--- (2)可逆绝热过程: 按可逆绝热过程参数间关系可得:K T kg m v bar v v p p s s s 301,/8385.0.03.1)(2324 .11 212==== 气体对外所作膨胀功及交换的热量: 0,3.390)(1 1)(11212211==--=--= s s s Q kJ T T mR k V p V p k W 过程中热力学能,焓,熵的变化为: ,2.546)(, 3.390)(211202112021=?-=-=?-=-=?---s s p s S V s S kJ T T mc H kJ T T mc U 理想气体的基本热力过程 热力设备中,热能与机械能的相互转化,通常是通过气态工质的吸热、膨胀、放热、压缩等热力过程来实现的。 实际的热力过程都很复杂,而且几乎都是非平衡、非可逆的过程。但若仔细观察会发现,某些常见过程非常近似一些简单的可逆过程。 常见的主要有四种简单可逆过程-基本热力过程,指系统某一状态参数保持不变的可逆过程。 包括定容过程、定压过程、定温过程和绝热过程。 我们以1kg理想气体的闭口系统为例来分析这几种基本热力过程,分析方法包括5点: (1)依据过程特点建立过程方程式; (2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系,即P1、v1、T1和P2、v2、T2之间的关系; (3)绘制过程曲线; 我们主要绘制两种坐标图P-v图和T-s图,因为P-v图上可以表示过程中做功量的多少,而T-s图上可以表示过程中吸收或放出热量的多少; (4)分析计算△u,△h,△s; (5)分析计算过程的热量q和功w。 一、定容过程 定容过程即工质的容积在整个过程中维持不变,dv=0,通常是一定量的气体在刚性容器中进行定容加热或定容放热。 (1)依据过程特点建立过程方程式 定容过程的特点是体积保持不变,所以建立过程方程式: v=常数; 或dv=0 或v1=v2 (2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系 过程方程式:v1=v2 理想气体状态方程:112212 Pv P v T T = 由以上两个方程可以得到初末基本状态参数之间的关系: 122211 v v P T P T =???=?? 即定容过程中工质的压力与温度成正比。 (3)绘制过程曲线; 定容过程有两种情况:定容加热和定容放热。 (4)分析计算△u ,△h ,△s ; 2211 v v u u u c dT c T ?=-==?? 2 211p p h h h c dT c T ?=-==?? 222111 ln ln ln p v v v P P s c c c v P P ?=+=或222111ln ln ln v v T v T s c R c T v T ?=+= (5)分析计算过程的热量q 和功w 。 容积变化功:2 10w Pdv ==? 根据q=△u+w 可得: v q u c T =?=? 总结:定容过程中系统与外界无容积变化功,加给工质的热量全部用于增加工质的热力学能,而没有热能与机械能的转化。 第4章 理想气体热力过程及气体压缩 4.1 本章基本要求 熟练掌握定容、定压、定温、绝热、多变过程中状态参数p 、v 、T 、?u 、 ?h 、?s 的计算,过程量Q 、W 的计算,以及上述过程在p -v 、T -s 图上的表示。 4.2 本章重点 结合热力学第一定律,计算四个基本热力过程、多变过程中的状态参数和过程参数及在p -v 、T -s 图上表示。本章的学习应以多做练习题为主,并一定注意要在求出结果后,在p -v 、T -s 图上进行检验。 4.3 例 题 例1.2kg 空气分别经过定温膨胀和绝热膨胀的可逆过程,如图4.1,从初态1p =9.807bar,1t =300C ο膨胀到终态容积为初态容积的5倍,试计算不同过程中空气的终态参数,对外所做的功和交换的热量以及过程中内能、焓、熵的变化量。 图4.1 解:将空气取作闭口系 对可逆定温过程1-2,由过程中的参数关系,得 bar v v p p 961.15 1 807.9211 2=?== 按理想气体状态方程,得1 1 1p RT v = =0.1677kg m /3 125v v ==0.8385kg m /3 12T T ==573K 2t =300C ο 气体对外作的膨胀功及交换的热量为 1 2 11ln V V V p Q W T T ===529.4kJ 过程中内能、焓、熵的变化量为 12U ?=0 12H ?=0 12S ?= 1 T Q T =0.9239kJ /K 或12S ?=mRln 1 2 V V =0.9238kJ /K 对可逆绝热过程1-2′, 由可逆绝热过程参数间关系可得 k v v p p )( 2 11'2= 其中22'v v ==0.8385kg m /3 故 4.12)5 1 (807.9'=p =1.03bar R v p T ' ''222= =301K '2t =28C ο 气体对外所做的功及交换的热量为 )(1 1)(11'212211T T mR k V p V p k W s --=--= =390.3kJ 0'=s Q 过程中内能、焓、熵的变化量为 kJ T T mc U v 1.390)(1212''-=-=? 或kJ W U 3.390212'-=-=? kJ T T mc H p 2.546)(1212''-=-=? '12S ?=0 第三章 流体的热力学性质 一、选择题(共7小题,7分) 1、(1分)对理想气体有( )。 )/.(??T P H B 0)/.(=??T P H C 0)/.(=??P T H D 2、(1分)对单位质量,定组成的均相流体体系,在非流动条件下有( )。 A . dH = TdS + Vdp B .dH = SdT + Vdp C . dH = -SdT + Vdp D. dH = -TdS -Vdp 3、(1分)对1mol 符合)/(b V RT P -=状态方程的气体,T P S )(??应是( ) A.R/V ; B.R ; C. -R/P ; D.R/T 。 4、(1分)对1molVan der Waals 气体,有 。 A. (?S/?V)T =R/(v-b) B. (?S/?V)T =-R/(v-b) C. (?S/?V)T =R/(v+b) D. (?S/?V)T =P/(b-v) 5、(1分)对理想气体有 A. (?H/?P)T <0 B. (?H/?P)T >0 C. (?H/?P)T =0 6、(1分)对1mol 理想气体 T V S )(??等于__________ A R V - B V R C R p D R p - 二、填空题(共3小题,3分) 1、(1分)常用的 8个热力学变量 P 、V 、T 、S 、h 、U 、A 、G 可求出一阶偏导数336个,其中独立的偏导数共112个,但只有6个可通过实验直接测定,因此需要用 将不易测定的状态性质偏导数与可测状态性质偏导数联系起来。 2、(1分)麦克斯韦关系式的主要作用是 。 3、(1分)纯物质T-S 图的拱形曲线下部称 区。 三、名词解释(共2小题,8分) 1、(5分)剩余性质: 2、(3分)广度性质 四、简答题(共1小题,5分) 1、(5分)简述剩余性质的定义和作用。(5分) 五、计算题(共1小题,12分) 1、(12分)(12分)在T-S 图上画出下列各过程所经历的途径(注明起点和箭头方向),并说明过程特点:如ΔG=0 (1)饱和液体节流膨胀;(3分) (2)饱和蒸汽可逆绝热膨胀;(3分) (3)从临界点开始的等温压缩;(3分) (4)过热蒸汽经冷却冷凝为过冷液体(压力变化可忽略)。(3分) 范德瓦耳斯气体的热力学性质 陈东 2008061144 (黔南民族师范学院物理与电子科学系,贵州都匀 558000) 【摘要】讨论范德瓦尔斯气体的内能、熵、焓和自由能,给出相应的数学表达式,并对相应问题进行讨论。【关键词】范德瓦尔斯气体;内能;熵;焓;自由能;绝热过程;节流过程 Van der Waals gas thermodynamic properties Chen Dong 200806114 ( Qiannan Normal College for Nationalities Department of physics and electronic science, Guizhou Tuyun 558000) [ Abstract ] to discuss Van Der Waals gas internal energy, entropy, enthalpy and free energy, the corresponding mathematical expressions, and the relative problems are discussed. [ Key words ] Van Der Waals gas; energy; entropy; enthalpy; free energy; adiabatic process; throttling process 理想气体是反映各种实际气体在压强趋于零时所共有的极限性质的气体,是一种理想模型。在一般的压强和温度下,可以把实际气体近似地当作理想气体出来,但是在压强太大或温度太低(接近于其液化温度)时,实际气体与理想气体有显著的偏离。为了更精确地描述实际气体的行为,人们提出很多实际气体的状态方程,其中最重要、最有代表性的是范德瓦尔斯方程。 1、范德瓦尔斯气体的状态方程 范德瓦尔斯方程是在理想气体状态方程的基础上修改而得到的半经验方程。理想气体是完全忽略除分子碰撞瞬间外一切分子间的相互作用力的气体,而实际气体就不能忽 七、气体的热力性质 热机中的热能—机械能转换是通过体积功实现的,因而要求其工质的热膨胀性要好,故均选气体为工质。 7.1 理想气体 忽略自身分子所占体积与分子间作用力的气体。 此时,各种气体的许多性质趋同,其共性就只与分子的个数有关。 一、 状态方程 T mR pV g = T R pv g = 气体常数g R 与种类有关(同质量不同种气体分子的个数不等),与状态无关。 T nR pV m = T R pV m M = 气体常数M R 与种类、状态均无关,故被称为普适气体常数, K mol J R M ?=/314.8。 M R R m g =, M 为摩尔质量, mol kg /。 通常,气体若温度不太低,压力不太高, 均可视为理想气 体。如100大气压 %1≈总 分子 V V 气体分子间的相互作用与分子的间距亦即体积总V 有关。 二、 热系数与热力学函数 p p T V V ??? ????=1α T 1= v v T p p ??? ????= 1β T 1= T T p V V ??? ????-=1κ p 1= v T V T p T v c ???? ????=??? ????22 0= → )(T c V p T p T v T p c ???? ????-=???? ????22 0= → )(T c p T p V p v p T v T c c ??? ??????? ????-=-2 + T R pv g = g R = p p h J c v T v T p T -??? ????= ??? ????=μ 0= dv T p T p dT c du v V ??? ?? ???? ????--= dT c V = dp T v T v dT c dh p p ??? ?? ???? ????-+= dT c p = dv T p dT T c ds v V ??? ????+= v dv R T dT c g V += dp T v dT T c p p ??? ????-= p dp R T dT c g p -= 第三章 气体热力性质和热力过程 3-1 已知氖的相对分子质量为20.183,在25℃时比定压热容为 1.030 kJ /(kg.K)。试计算(按理想气体): (1)气体常数; (2)标准状况下的比体积和密度; (3)25℃时的比定容热容和热容比。 解:(1)气体常数 )/(411956.0)/(951.411/10183.20)/(31451.83 K kg kJ K kg J mol kg K mol J M R R g ?=?=??== - (2)由理想气体状态方程 T R pv g =得 比体积kg m Pa K K mol J p T R v g /111.11001325.115.273)/(956.4113 5 =???= = 密度33 /900.0/111.111m kg kg m v === ρ (3)由迈耶分式 g v p R c c =-00得 比定容热容 ) /(618.0)/(411956.0)/(030.100K kg kJ K kg kJ K kg kJ R c c g p v ?=?-?=-= 热容比667.1) /(618.0) /(030.10 00=??= = K kg kJ K kg kJ c c V p γ 3-2 容积为2.5 m 3的压缩空气储气罐,原来压力表读数为0.05 MPa ,温度为18℃。充气后压力表读数升为0.42 MPa ,温度升为40℃。当时大气压力为0.1 MPa 。求充进空气的质量。 解:充气前p 1 = p g1+p b = 0.05MPa+0.1MPa = 0.15MPa ,K T 15.2911815.2731=+= 充气后p 2 = p g2+p b = 0.42MPa+0.1MPa = 0.52MPa ,K T 15.3134015.2732=+= 由理想气体状态方程 T R pv g =,得 223.315.052.0)4015.273()1815.273(122121=++==MPa MPa K K p T p T v v 一、制冷用图形符号(JB/T7965-95) 1 主题内容与适用范围 本标准规定了制冷用阀门及管路附件、制冷机组、辅助设备、控制元件等的图形符号。 本标准适用于绘制制冷系统的流程图、示意图和编制相应的技术文件。 2 引用标准 GB4270 热工图形符号和文字代号 GB4457.4 机械制图图线 GB4458.5 机械制图尺寸注法 GB1114 采暖、通风与空气调节制图标准 3 一般规定 3.1 本标准中的图形符号一般用粗实线绘制,线宽b应符号GB4457.4的规定,对管路、管件、阀及控制元件等,允许用细实线(线宽为b/3)绘制。在同一图样上,图形符号的各类线型宽度应分别保持一致。 3.2 文字代号应按直体书写,笔划宽度约为文字高度的1/10。 3.3 图形符号允许由一基本符号与其他符号组合,图形符号的位置允许转动。 3.4 绘制图形符号时,可按本标准所示图例,按比例适当放大或缩小。 3.5 在不违反本标准的前提下,各单位可作出补充规定。 4 介质代号 介质代号见表1。 表 1 5 图形符号 5.1 管道 管道的图形符号见表2。 5.2 管接头 管接头的图形符号见表4。 5.3 管路弯头及三通 管路弯头及三通的图形符号见表5。 表 2 表 3 表 4 表 5 (续表) 5.4 阀门 阀门的图形符号见表6。 5.5 控制元件和测量用表 控制零件和测量用表的图形符号见表7。 5.6 管路附件 管路附件的图形符号见表8。 5.7 动力机械 动力机械的图形符号见表9。 5.8 辅助设备 辅助设备的图形符号见表10。 5.9 制冷机组 制冷机组的图形符号见表11。 5.10 空调系统 空调系统的符号应符合GBJ 114的规定。 表 6 (续表) 表 7 (续表) 表 8 (续表) 表 9 (续表) 表 10 (续表) 表 11 二、制冷空调电气技术资料 表2-1 电气技术中项目种类的字母代码表 (续表) 注:因为一个项目可能有几种名称,故可能有几个字母代码,使用时应选较确切的代码。表2-2 我国电气设备常用文字符号新旧对照表 (续表) 工程热力学与传热学 第三章 理想气体的性质与热力过程 典型问题分析 一. 基本概念分析 1 c p ,c v ,c p -c v ,c p /c v 与物质的种类是否有关,与状态是否有关。 2 分析此式各步的适用条件: 3 将满足下列要求的理想气体多变过程表示在p-v 图和T-s 图上。 (1) 工质又膨胀,又升温,又吸热的过程。 (2) 工质又膨胀,又降温,又放热的过程。 4 试分析多变指数在 1 第三章 理想气体的性质 1.怎样正确看待“理想气体”这个概念?在进行实际计算是如何决定是否可采用理想气体的一些公式? 答:理想气体:分子为不占体积的弹性质点,除碰撞外分子间无作用力。理想气体是实际气体在低压高温时的抽象,是一种实际并不存在的假想气体。 判断所使用气体是否为理想气体(1)依据气体所处的状态(如:气体的密度是否足够小)估计作为理想气体处理时可能引起的误差;(2)应考虑计算所要求的精度。若为理想气体则可使用理想气体的公式。 2.气体的摩尔体积是否因气体的种类而异?是否因所处状态不同而异?任何气体在任意状态下摩尔体积是否都是 0.022414m 3 /mol? 答:气体的摩尔体积在同温同压下的情况下不会因气体的种类而异;但因所处状态不同而变化。只有在标准状态下摩尔体积为 0.022414m 3 /mol 3.摩尔气体常数 R 值是否随气体的种类不同或状态不同而异? 答:摩尔气体常数不因气体的种类及状态的不同而变化。 4.如果某种工质的状态方程式为pv =R g T ,那么这种工质的比热容、热力学能、焓都仅仅是温度的函数吗? 答:一种气体满足理想气体状态方程则为理想气体,那么其比热容、热力学能、焓都仅仅是温度的函数。 5.对于一种确定的理想气体,()p v C C 是否等于定值?p v C C 是否为定 值?在不同温度下()p v C C -、p v C C 是否总是同一定值? 答:对于确定的理想气体在同一温度下()p v C C -为定值, p v C C 为定值。在不同温度下()p v C C -为定值,p v C C 不是定值。 6.麦耶公式p v g C C R -=是否适用于理想气体混合物?是否适用于实际 气体? 答:迈耶公式的推导用到理想气体方程,因此适用于理想气体混合物不适合实际气体。 7.气体有两个独立的参数,u(或 h)可以表示为 p 和 v 的函数,即(,)u u f p v =。但又曾得出结论,理想气体的热力学能、焓、熵只取决于温度,这两点是否矛盾?为什么? 答:不矛盾。实际气体有两个独立的参数。理想气体忽略了分子间的作用力,所以只取决于温度。 8.为什么工质的热力学能、焓、熵为零的基准可以任选?理想气体的热力学能或焓的参照状态通常选定哪个或哪些个状态参数值?对理想气体的熵又如何? 答:在工程热力学里需要的是过程中热力学能、焓、熵的变化量。热力学能、焓、熵都只是温度的单值函数,变化量的计算与基准的选取无关。热力学能或焓的参照状态通常取 0K 或 0℃时焓时为0,热力学能值为 0。熵的基准状态取p 0=101325Pa 、T 0=0K 熵值为 0 。 9.气体热力性质表中的h 、u 及s 0的基准是什么状态? 答:气体热力性质表中的h 、u 及s 0的基准是什么状态00(,)T P 00T K = 第四章理想气体的热力过程 一、目的及要求: 掌握四种基本热力过程的初终态状态参数的计算,掌握当理想气体经历某一热力过程后系统与外界所交换的热量及功量的计算。掌握多变过程的相关量的计算。会利用给定的已知条件在坐标图上定性的画出相应的过程曲线。 二、内容: 4.1研究理想气体的目的及一般方法 4.2定容过程、定压过程、定温过程、绝热过程及多变过程 4.3过程曲线在相应的坐标图上的表示。 三、重点及难点: 熟练掌握5种基本过程(定容过程、定压过程、定温过程、绝热过程及多变过程)的初 终态基本状态参数p、v、T之间的关系。 4.2熟练掌握当工质经历了4种基本过程以及多变过程过程系统与外界交换的热量、功量的 计算。 能将各过程表示在p-v图和T-s图上,并能正确地应用p-v图和T-s图判断过程的 特点,即△u,△h,q及w等的正负值。 四、主要外语词汇: thermodynamic Process, isometric process, isobaric process, isothermal process, adiabatic process, isentropic process, polytropic process 五、本章节采用多媒体课件 六、复习思考题及作业: 思考题: 1、在定容过程和定压过程中,气体的热量可根据过程中气体的比热容乘以温差来计算。定温过程气体的温度不变,在定温膨胀过程中是否需对气体加入热量?如果加入的话应如何计算? 2、任何定温过程都有?u=0, ?h=0?对于理想气体如何? 3、绝热过程,工质的温度都不变?反之温度一定变? 4、从同一初态,分别经历等温过程、等熵过程及n=1.2过程,能否到达同一终态? 5、一封闭系经某可逆吸热对外作功,问能否用一可逆绝热过程使系统回到初态 6、在p-v及T-s图上如何判断过程中的q、w、?u、?h的正负? 作业: 第二章 气体热力学性质 第一节 理想气体的性质 一、理想气体: 1、假设:①气体分子是弹性的、不占据体积的特点; ②气体分子间没有相互作用力。 对于气体分子的体积相对气体比容很小,分子间作用力相对于气体压力也很小时,可 作为理想气体处理。 2、状态方程 理想气体在任一平衡状态时的压力P 、温度T 、比容v 之间的关系应满足状态方程, 即克拉佩龙方程 Pv= RT mkg 质量气体为: Pv=mRT=m 0R T R 气体常数,反映气体特征的物理量,和气体所处状态无关; n 物质的量(千克数或摩尔数); 0R 通用气体常数,与气体状态、其他性质无关的普适恒量; K Kmol J R R ?==/8314150μ P V C C ,分别表示定压比容及定容比容,对于理想气体,他们仅是温度的单值函 数,P V C C > 其 R C C P V =- 比值k C C P V =/(绝热指数) 标准状态时(压力未101.325Kpa, 0℃) 单原子气体 k=1.66?1.67 双原子气体 k=1.40?1.41 多原子气体 k=1.10?1.3 此外 R k k C R R C C C k P V P V ?-=-=>=1 ,1,1/ 二、过程方程及过程功 气体在压缩和膨胀过程中,状态的变化应符合动量守恒及转换定律,即内能、外功、热交换三者间应满足 P d V dW dT C dU dW dU dq V ==+=,,其中 压缩过程中的能量关系 1、 等温过程 数字式:0==dT const T 即 过程方程式:const PV = 过程功:2 111121112ln ln ln P P V P V V V P V V RT W === 内能变化:012=-U U 热交换:w q = 等温过程的热交换q 和过程功w 值相等,且正负号相同,即气体加热进行等温膨胀时,加入的热量全部用于对外膨胀做功,气体被压缩时外界对气体所作的功全部转换为热量的形式排出。 2、 绝热过程 数字式:0,0==dq q 过程方程式:const PV K = 过程功:]1[1]1[112111 121--???? ??--=??? ? ??--=K k k V V T k R P P T R R W 内能变化:W U U =-12 功质在绝热过程中与外界没有热量交换,过程功只能来自工质本身的能量,绝热膨胀机等于内能降,绝热压缩时,工质消耗的压缩功等于内能的增加量。 3、 多变过程 状态变化过程中,状态参数都由显著的变化,存在热交换时他们的过程特征满足过程方程 过程功:)(1 1]1[1211121T T C n k P P T n R W V n n ---=???? ??--=- 内能变化:)(12T T C U V -=? 热量交换:)(1 21T T C n k n W U q V ---= =?= 压缩机级的工作工程理想气体基本热力过程要点
湖南大学工程热力学第4章理想气体热力过程(复习题)
第三章流体的热力学性质习题
范德瓦耳斯气体的热力学性质3
工程热力学7 气体的热力性质
第三章 气体热力性质和热力过程
气体热力学性质表
中国石油大学热工基础典型问题第三章 理想气体的性质与热力过程
工程热力学思考题答案-第三章
第四章理想气体的热力过程
气体热力学性质
