实验三血清总胆固醇的测定

血清总胆固醇(TCH)测定及临床意义
血清总胆固醇(TCH)测定及临床意义 以下是为大家整理的血清总胆固醇(Tch)测定及临床意义的相关范文,本文关键词为血清,胆固醇,Tch,测定,临床,意义,,您可以从右上方搜索框检索更多相关文章,如果您觉得有用,请继续关注我们并推荐给您的好友,您可以在综合文库中查看更多范文。 血清总胆固醇(Tch)测定及临床意义 【正常参考值】 人群血脂水平主要取决于生活因素,特别是饮食和营养,所以各
地区调查所得参考值高低不一,以致各地区有各自的高Tc划分标准。现在国际上以显著增加冠心病危险的Tc水平(医学决定水平)作为划分界限。在方法学标准化的基础上,采用共同的划分标准,有助于避免混乱。 我国《血脂异常防治建议》提出的标准为:理想范围:<5.2mmol/L(<200mg/dL) 边缘升高:5.23~5.69mmol/L(201~219mg/dL)升高:≥5.72mmol/L (≥220mg/dL) 美国胆固醇教育计划(ncep),成人治疗组提出的医学决定水平如下:理想范围:<5.2mmol/L(<200mg/dL)边缘升高:5.2~6.2mmol/L(200~239mg/dL)升高:≥6.21mmol/L(≥240mg/dL)【临床意义】 影响Tc水平的因素有:①年龄与性别:Tc水平往往随年龄上升,但到70岁后有所下降。中青年期女性低于男性,50岁以后女性高于男性。②长期的高胆固醇、高饱和脂肪和高热量饮食,可使Tc增高。 ③遗传因素。④其它:如缺少运动、脑力劳动、精神紧张等可能使Tc升高。 增高:高总胆固醇是冠心病的主要危险因素之一,有原发和继发两种,原发常由遗传因素引起如家族性高胆固醇血症(低密度脂蛋白受体缺陷)、家族性apob缺陷 症、多源性高Tc、混和性高脂蛋白血症等。继发的见于肾病综合征、甲状腺功能减退、糖尿病、胆总管阻塞、粘液性水肿、妊娠等。
胆固醇氧化酶法测定血清总胆固醇
胆固醇氧化酶法测定血清总胆固醇 【原理】 血清中总胆固醇(total cholesterol ,TC)包括游离胆固醇(free cholesterol ,FC)和胆固醇酯(cholesterol ester ,CE)两部分。血清中胆固醇酯可被胆固醇酯酶水解为游离胆固醇和游离脂肪酸(FFA),胆固醇在胆固醇氧化酶的氧化作用下生成△4-胆甾烯酮和过氧化氢,H 2O 2在4-氨基安替比林和酚存在时,经过氧化物酶催化,反应生成苯醌亚胺非那腙的红色醌类化合物,其颜色深浅与标本中TC 含量成正比。 【试剂】 1.胆固醇液体酶试剂组成(具体含量见相关文献) GOOD's 缓冲液(pH6.7) 50mmol/L 胆固醇酯酶 ≥200U/L 胆固醇氧化酶 ≥100U/L 过氧化物酶 ≥3 000U/L 4-AAP 0.3mmol/L 苯酚 5mmol/L 2.胆固醇标准溶液5.17 mmol/L (200 mg/dl) 精确称取胆固醇200 mg ,用异丙醇配成100 ml 溶液,分装后,4℃保存,临用取出。也可用定值的参考血清作标准。 【操作步骤】 终点法检测TC 按下表依次加样。 酶法测定TC 操作步骤 项目 测定管 标准管 空白管 血清(μl) 50 - - 标准液/定值血清(μl) - 50 - 蒸馏水(μl) - - 50 酶试剂(μl) 1.50 1.50 1.50 混匀后,37℃保温5 min ,用分光光度计比色,于500 nm 波长处以空白管调零,读出各管吸光度。 【计算】 血清TC (mmol/L)= 标准管吸光度 测定管吸光度 ×胆固醇标准液浓度
【参考范围】血清参考值:3.0~5.20 mmol/L;危险阈值:5.20~6.20 mmol/L;高胆固醇血症:≥6.20 mmol/L。 【临床意义】 1.TC增高常见于动脉粥样硬化、原发性高脂血症(如家族性高胆固醇血症、家族性ApoB缺陷症、多源性高胆固醇血症、混合性高脂蛋白血症等)、糖尿病、肾病综合征、总胆管阻塞、甲状腺功能减退、肥大性骨关节炎、老年性白内障和牛皮癣。 2.TC降低常见于低脂蛋白血症、贫血、败血症、甲状腺功能亢进、肝脏疾病、严重感染、营养不良、肠道吸收不良和药物治疗过程中的溶血性黄疸及慢性消耗性疾病,如癌症晚期等。 【注意事项】 1.试剂中酶的质量影响测定结果。 2.若需检测游离胆固醇浓度,将酶试剂成分中去掉胆固醇酯酶即可。 3.检测标本可为血清或者血浆(以肝素或EDTAK2抗凝)。 【评价】本方法线性范围为≤19.38 mmol/L (750 mg/d1)。 本方法特异性好和灵敏度高,既可用于手工操作,也可自动化分析;既可作终点法检测,也可作速率法检测。 在终点法中血红蛋白高于2 g/L时引起正干扰;胆红素高于0.1 g/L时有明显负干扰;血中维生素C与甲基多巴浓度高于治疗水平时,会使结果降低。但是在速率法中上述干扰物质影响较小。高TG血症对本法无明显影响。 检测TC的血清(浆)标本密闭保存时,在4℃可稳定1周,-20℃可稳定半年以上。
血清胆固醇的定量测定
血清胆固醇的定量测定 摘要:目的:定量测定人血清胆固醇。方法:采用磷硫铁法测定胆固醇含量。结果:该人血清胆固醇为132mg/ml。结论:该人的胆固醇含量正常。 关键词:胆固醇;磷硫铁法 胆固醇参与血浆蛋白的组成,是细胞膜的结构成分,胆汁酸盐,肾上腺皮质激素,维生素D等的前体。胆固醇的测定方法包括化学显色法(磷硫铁法和邻苯二甲醛法)和酶学法(试剂盒),本实验采用磷硫铁法测定血清胆固醇。血清经无水乙醇处理,蛋白质被沉淀,胆固醇则溶在无水乙醇中。在乙醇提取液中加入磷硫铁试剂,胆固醇和试剂会产生紫红色化合物,呈色度与胆固醇含量成正比,可用比色法测定。 1 仪器与试药 1.1 仪器 721型分光光度计;离心机;试管;EP管; 1.2 药品与试剂人血清;10%三氯化铁溶液;磷硫铁试剂;胆固醇标准溶液;无水乙醇 2 方法 2.1 胆固醇的提取取人血清约100μL,分装到两个EP管中,每个管中分别加入200μL无水乙醇,摇匀,每个管中加入无水乙醇1000μL,摇匀,静置10min,离心(3000rpm,5min),得到上清液备用。 2.2 比色测定取三支试管,分别按照表1加入如下试剂。摇匀,室温静置10min。将混合溶液加入比色皿中,若比色皿过大,可加入无水乙醇稀释,放入分光光度计中进行测定吸光度。 表1 试管编号1(测定管)2(标准管)3(空白管)胆固醇提取液 1.0ml ———— 胆固醇标准液—— 1.0ml ——无水乙醇———— 1.0ml 磷硫铁试剂 1.0ml 1.0ml 1.0ml 2.3 计算人血清胆固醇=(OD 2/OD 1 )×0.08×(100/0.04)= (OD 2 /OD 1 )×200,其中, OD 2表示测定管的吸光度,OD 1 表示标准管的吸光度。 3 结果与讨论 3.1 计算结果 OD 2为0.096,OD 1 为0.145,计算可得,人血清胆固醇为132mg/ml. 3.2 讨论正常人胆固醇含量约为110-220 mg/ml,从结果来看,我们可以看处这个人的胆固醇含量是正常的。在实验操作中,配制试剂时要格外吸小心,看清标注以免搞错,胆固醇过高,会引起动脉粥样化,甚至引起冠心病,胆固醇过低,会使人抵抗力不足,容易引发感染性疾病。
总胆固醇(TC)检测试剂盒(COD-PAP单试剂比色法)
总胆固醇(TC)检测试剂盒(COD-PAP 单试剂比色法) 简介: 胆固醇(Cholesterol)又称胆甾醇,是一种环戊烷多氢菲的衍生物,分子式C 27H 46O ,分子量为3860.65。胆固醇广泛存在于动物体内,其中脑、神经组织最丰富,在肾、脾、皮肤、肝和胆汁中含量也较高。 Leagene 总胆固醇(TC)检测试剂盒(COD-PAP 单试剂比色法)又称胆固醇氧化酶法或胆固醇氧化酶-过氧化物酶偶联法等,血液中的胆固醇约1/3为游离胆固醇,2/3为与脂肪酸结合的胆固醇酯,后者被CEH 水解为游离胆固醇,使4-氨基安替比林与酚(三者合称PAP)反应,生成红色醌亚胺色素(Trinder 反应)。分光光度计在500~520nm 处进行比色测定。本试剂盒用于人或动物的血清、血浆、脑脊液、细胞、组织等样本中的总胆固醇含量定量测定。本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 操作步骤(仅供参考): 1、 样本处理: ①血清、血浆、脑脊液样本:从待测样本中分理出的血清或血浆不应有溶血,直接检测,如超过线性范围,用生理盐水稀释后检测。 ②细胞样本: a 、取适量的细胞(一般推荐>106以上),离心,弃上清,留取沉淀。 b 、用PBS 或生理盐水清洗1~2次,离心,弃上清,留取沉淀。 c 、加入200~300μl 的PBS 或生理盐水匀浆,冰浴条件下超声破碎细胞,功率300W ,每次3~5s ,间隔30s ,重复3~5次。亦可手动匀浆,制备好的匀浆液不可离心,待用。 ③组织样本:准确称取适量组织样本,按质量(g):生理盐水或PBS(ml)=1:9的比例,加入生理盐水或PBS ,冰浴条件下手动或机械匀浆。离心,取上清待用。 2、 分光光度计(1ml 比色杯)、半自动生化分析仪TC 测定操作: 编号 名称 TC1213100T Storage 试剂(A): COD-PAP 工作液 Good's buffer 2×50ml -20℃ 避光 胆固醇氧化酶 胆固醇激酶 稳定剂 试剂(B): TC 标准(5mmol/L) 1ml -20℃ 避光 试剂(C): ddH 2O 1ml RT 使用说明书 1份
实验六蛋黄总胆固醇的测定(邻苯二甲醛法)(精)
实验六蛋黄总胆固醇的测定(邻苯二甲醛法) 一、实验目的 1、学习分光光度计的原理及操作。 2、学习用分光光度法测定蛋黄中总胆固醇(脂肪)含量及标准曲线的制作。 二、基本原理 胆固醇及其酯在硫酸存在下与邻苯二甲醛作用,产生紫红色物质,此物质在550nm由最大吸收值,可用比色法测定。胆固醇含量在400mg/100ml之内与吸光度呈现良好线性关系。本法操作简便,灵敏、稳定。 实验相关原理 根据物质对光的吸收特征和吸收强度,对物质进行定性和定量的分析方法,称为分光光度法(spectrophotometry)。该法具有一定的灵敏度和准确度,分析手续较简便快速,仪器设备也不复杂,故应用很广。 吸光度与液层厚度和溶液浓度的乘积成正比,称为朗伯—比尔定律,简称比尔定律,即光的吸收定律。 吸光系数的大小,取决于物质(溶质、溶剂)的本性和光的波长。 1. 物质不同,则吸光系数不同,所以吸光系数可作为物质的特性常数。在分光光度法中,常用摩尔吸光系数ε来衡量显色反应的灵敏度,ε值越大,灵敏度越高。 2. 溶剂不同,其吸光系数亦不同。 3. 光的波长不同,其吸光系数亦不同。如将不同波长的单色光依次通过被分析物质,分别测得吸光度,然后绘制吸光度—波长曲线,称为吸收曲线(absorption curve),吸收曲线上有极大值的部分,称为吸收峰。吸收峰所对应的波长,称为最大吸收波长,以符号λmax表示,这是物质定性的依据之一。 4.单色光的纯度也影响吸光系数。单色光越纯,即经单色器分光后的波长范围越窄,其吸光系数越大。定量方法: 1、吸光系数法 2、标准曲线法 不是任何情况下都能适用的。特别是在单色光不纯的情况下,测得的吸光度值可以随所用仪器不同而在一个相当大的幅度内变化不定,若用吸光系数换算成浓度,则将产生很大误差。 先配制一系列浓度不同的标准溶液,在测定条件相同情况下,分别测定其吸光度,然后以标准溶液的浓度为横坐标,以相应的吸光度为纵坐标,绘制A—C关系图,在相同条件下测出样品溶液的吸光度,就可以从标准曲线上查出样品溶液的浓度。 3、对照法 标准曲线的制作 (1)配置一系列浓度不同的标准溶液。 (2)在测定条件相同的情况下,分别测定其吸光度。 (3)以标准溶液浓度为横坐标,以相应的吸光度为纵坐标,绘制A-C关系图。 (4)在相同条件下测出样品溶液的吸光度,从标准曲线上查出浓度。 定性方法: 将一系列不同波长的单色光,照射到含待测组分的溶液,可测得相应的一系列吸光度。如果以吸光度为纵坐标,以波长为横坐标作图,便可得到该待测物质的吸收曲线。由于每一种物质均有其特征的吸收曲线,故可与其标准品比较而定性。但在实际工作中常用λmax 和ε来定性,λmax可从吸收曲线中吸收峰所对应的波长直接找出;ε通常需配制待测物质三种不同浓度的溶液,于1cm
实验三血清总胆固醇的测定
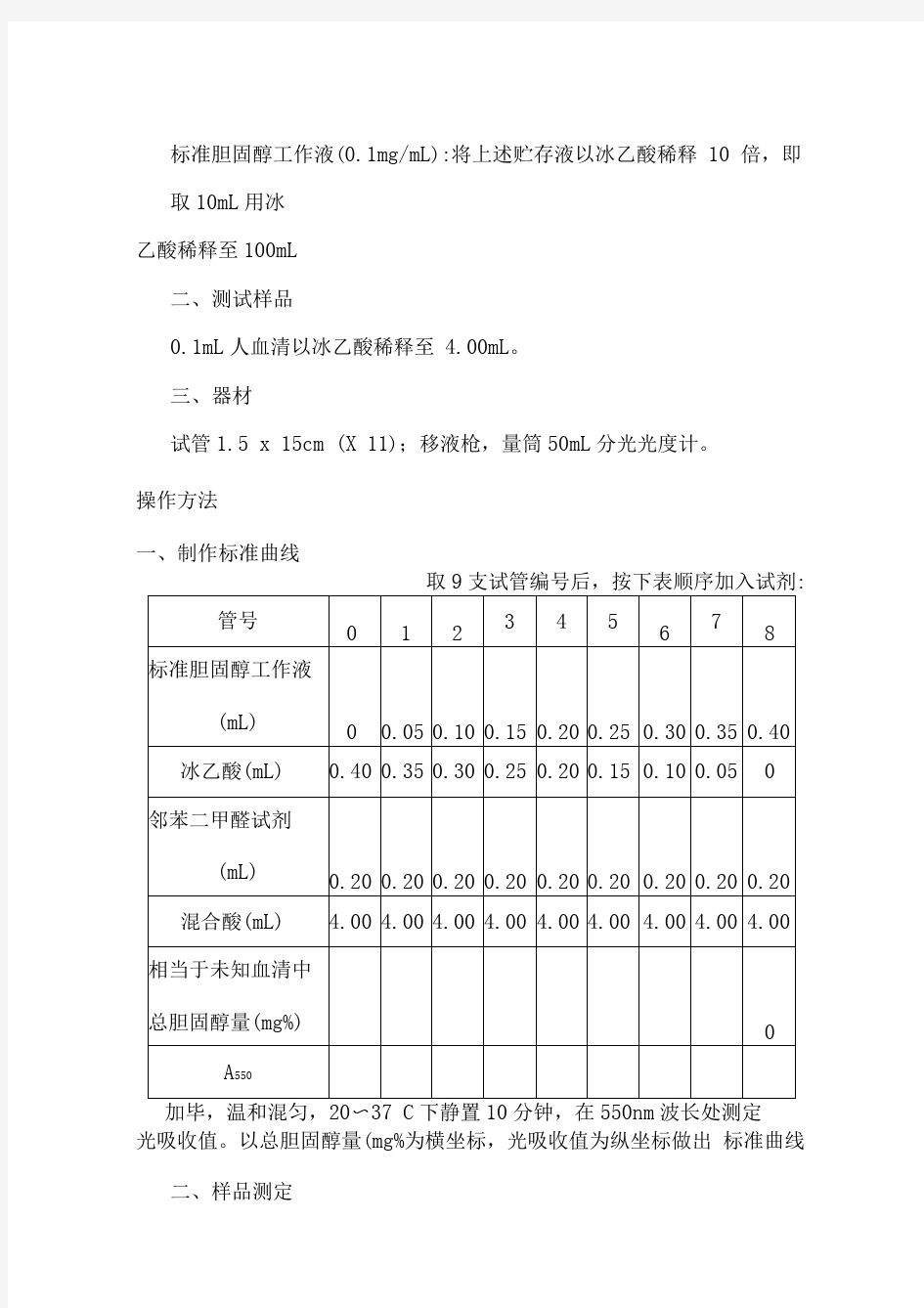
实验三血清总胆固醇的测定 目的要求 了解并掌握胆固醇测定的原理和方法。 实验原理 血清胆固醇(chol)测定是动脉粥样硬化性疾病防治、临床诊断和营养研究的重要指标。正常人血清胆固醇含量范围为100 ~ 250mg/mL。 胆固醇是环戊烷多氢菲的衍生物,它不仅参与血浆蛋白的组成,而且也是细胞的必要结构成分,还可以转化成胆汁酸盐、肾上腺皮质激素和维生素D等。胆固醇在体内以游离胆固醇及胆固醇酯两种形式存在,统称总胆固醇。总胆固醇的测定有化学比色法和酶学方法两类。本实验采用前一种方法。 胆固醇及其酯在硫酸作用下与邻苯二甲醛产生紫红色物质,此物质在550nm波长处有最大吸收。因此,可用比色法作总胆固醇的定量测定。胆固醇含量在400mg/100mL以内时,与光吸收值呈良好线性关系。 本法不必离心,颜色产物也比较稳定。 试剂和器材 一、试剂 邻苯二甲醛试剂:称取邻苯二甲醛50mg,以无水乙醇溶至50mL冷藏,有效期为一个半月。 混合酸:冰乙酸100mL与浓硫酸100mL混合。 标准胆固醇贮存液(1mg/mL):准确称取胆固醇100mg,溶于冰乙酸中,定溶至100mL。 标准胆固醇工作液(0.1mg/mL):将上述贮存液以冰乙酸稀释10倍,即取10mL用冰乙酸稀释至100mL。 二、测试样品 0.1mL人血清以冰乙酸稀释至4.00mL。 三、器材 试管1.5×15cm(×11);移液枪,量筒50mL分光光度计。 操作方法 一、制作标准曲线 取9支试管编号后,按下表顺序加入试剂:
加毕,温和混匀,20~37℃下静置10分钟,在550nm波长处测定光吸收值。以总胆固醇量(mg%)为横坐标,光吸收值为纵坐标做出标准曲线。 二、样品测定 取3支试管编号后,分别加入试剂,与标准曲线同时作比色测定: 加毕,温和混匀,20~37℃下静置10分钟,在550nm下测定光吸收值。然后,从标准曲线上可查出样品中总胆固醇的含量。 注意事项 1.本法在20~37℃条件下显色。 2.混合酸粘度比较大,颜色容易分层,比色前一定要混匀。 思考题 1. 本实验操作中特别需要注意些什么?为什么? 2. 酯类难溶于水,将它们均匀分散在水中则形成乳浊液,为什么正常人血浆和血清中含有酯类虽多,但却清澈透明?
实验七__胆固醇氧化酶法测定血清总胆固醇
生物化学与分子生物学设计实验 (胆固醇氧化酶法测定血清总胆固醇及二乙酰一肟法测定血清尿 素) 小组成员: 班级:麻醉11-2班 日期:2012年12月19 胆固醇氧化酶法测定血清总胆固醇及二乙酰一肟法测定血清尿素 实验目的 1、掌握酶法测定总胆固醇的原理和方法。 2、学习用比色法测定血清尿素。
3、巩固有关胆固醇和尿素的知识。 4、进一步熟练UV2100型分光光度计的 重点、难点: 重点:1、氧化酶法测定总胆固醇的原理 2、二乙酰一肟法测定血清尿素的注意事项 难点:氧化酶法测定总胆固醇的原理 一、实验原理 (一)氧化酶法测定血清总胆固醇 血清总胆固醇(TC)包括:游离胆固醇(FC)和胆固醇酯(CE)两部分。本实验是胆固醇酯酶、胆固醇氧化酶和过氧化物酶相偶联发生的偶联反应。 第一步:血清胆固醇酯可被胆固醇酯酶水解为游离胆固醇和游离脂肪酸(FFA) 。 第二步:胆固醇在胆固醇氧化酶的氧化作用下生成△4-胆甾烯酮和H 2O 2。 第三步:H 2O 2 在4-氨基安替比林和酚存在时,经过氧化物酶催化,反应生成 苯醌亚胺非那腙的红色醌类化合物,其颜色深浅与标本中TC含量成正比。 (二)二乙酰一肟法测定血清尿素 二乙酰在强酸条件下与尿素缩合成红色的4,5-二甲基-2-氧咪唑化合物,颜色深浅与尿素含量成正比。因二乙酰不稳定,故由试剂中二乙酰一肟与强酸作用产生二乙酰。 二、操作步骤 (一)氧化酶法测定血清总胆固醇 终点法检测TC,取试管3支按下表依次加样。 酶法测定TC操作步骤 加入物(μl)空白管标准管测定管 血清--20 标准液或定值血清-20- 蒸馏水20--
酶试剂 1 000 1 000 1 000 混匀后,37℃保温10 min,每管加3ml水混匀,用分光光度计比色,于500 nm波长处以空白管调零,读出各管吸光度。 (二)二乙酰一肟法测定血清尿素 取试管3支,按下表依次加样。 二乙酰一肟法操作步骤 加入物(ml)空白管标准管测定管 血清-- 尿素标准应用液-- 蒸馏水-- 二乙酰一肟溶液 酸性试剂 混匀,置沸水浴加热12min,取出置冷水中冷却5min,以空白管调零,在540nm处读取各管吸光度。 三、注意事项 (一)氧化酶法测定血清总胆固醇 1、最后加酶试剂,各管反应时间应一致; 2、比色应在30min内完成; 3、试管在操作前尽量保持干燥; 4、试剂中酶的质量影响测定结果; 5、若需检测游离胆固醇浓度,将酶试剂成分中去掉胆固醇酯酶即可。 (二)二乙酰一肟法测定血清尿素 1、试剂中加入氨基硫脲和镉离子,可增进显色强度和色泽稳定性,但仍有轻度褪色现象,(每小 时小于5%)。煮沸显色经冷却后,应及时比色。 2、尿液中尿素也可用此法测定,但因浓度高,需先用去离子水作50倍以上稀释。 3、注意洁净干燥,加量务必准确。 4、水浴时注意打开水浴箱盖,以免水汽入管。 5、酸性试剂中酸的含量较浓,要小心使用。
血清胆固醇含量的测定实验报告
实验二 血清胆固醇含量的测定的实验报告 实验目的:学会利用氧化酶法测定血清胆固醇含量的原理和方法。 实验原理:血清胆固醇由游离胆固醇(30%)和胆固醇酯(70%)组成。血清胆固醇经酯化酶水解后,生成游离胆固醇和脂肪酸;在胆固醇氧化酶的作用下,游离胆固醇产生的H 2O 2与4-氨基安替比林和DHBS 反应生成微红色的醌亚胺。醌亚胺在520nm 有特异吸收,反应产生的颜色与胆固醇含量成正比。 胆固醇酯+ H 2O ???→?胆固醇酯酶 胆固醇+脂肪酸 胆固醇+O 2?? ??→?胆固醇氧化酶 △4胆甾烯酮+ H 2O 2 H 2O 2+4-氨基安替比林+DHBS ???→?过氧化物酶 醌亚胺+ H 2O 实验步骤: 1、取2支试管分别加入的血清和标准胆固醇溶液,并分别标注为“H ”和“SH ”试管。往每支试管加入的沉淀剂,在室温下静置15min ,用2000rad/min 的离心机分离10min 。 2、准备5支试管分别标注为“T ”(总胆固醇)、“H ”(高密度脂蛋白胆固醇)、“ST ”(标准总胆固醇)、“SH ”(标准高密度脂蛋白胆固醇)、“B ”(空白实验)。按照下表准备各支试管:(标准胆固醇浓度为50mg/dL )
3、准备好以上试管后,充分混合并在37。 的温度下放置20min ,用波长520nm 的分光光度计测量各支试管的吸光度值。 实验结果: 计算公式:总胆固醇=ST T 吸光度值吸光度值×02 .01 .0×50 高密度脂蛋白胆固醇=SH H 吸光度值吸光度值×50 代入数据得:总胆固醇=252 .0167 .0×02.01.0×50=(mg/dL ) 高密度脂蛋白胆固醇=430 .0605 .0×50=(mg/dL )
胆固醇含量检测
法测定鸡蛋中胆固醇含量 一、原理 当固醇类化合物与酸作用时,可脱水并发生聚合反应,产生颜色物质。因此可先对食品样品进行皂化和提取,用硫磷铁试剂作为显色剂,测定食品中胆固醇的含量。 在样品的冰乙酸提取液中加磷硫铁试剂,胆固醇与试剂反应产生紫红色化合物,颜色的深浅与胆固醇的量成正比,可用分光光度计在波长560nm?处测定。 二、实验仪器及试材 1.仪器:分光光度计、水浴锅 2.试剂:本实验用水均需用蒸馏水或去离子水。试剂纯度均为分析纯。 (1)石油醚(沸点30-60℃)、无水乙醇、冰乙酸。 (2)50%氢氧化钾溶液:称取50g氢氧化钾,用蒸馏水溶解,并稀释至100mL。 (3)25%氯化钠溶液:称取25g氯化钠,用蒸馏水溶解,并稀释至100mL。 (4)10% 三氯化铁溶液:将10g FeCl3·6 H2O溶于磷酸中,定容至100 mL,储于棕色瓶中,冷藏保存。 (5)磷硫铁试剂:取10% 三氯化铁溶液1.5mL于100mL棕色容量瓶内,加浓硫酸定容至刻度。 (6)胆固醇标准储液:准确称取胆固醇100mg,溶于冰乙酸中,定容至100mL。 (7)胆固醇标准溶液:临用前将储液用冰乙酸稀释10倍。 三、实验方法与步骤 1.样品胆固醇提取 准确称取充分混匀的鸡蛋约0.20g于25mL具塞比色管中,加入0.5mL50%氢氧化钾溶液和4.5mL无水乙醇,振荡混匀,在80℃恒温水浴中皂化20min。皂化时每隔5min振摇一次使皂化完全。皂化完毕,取出比色管,冷却。加入 3mL 25%氯化钠溶液后再加入10mL石油醚,盖紧玻璃塞,振摇1min,静置分层。 取上层石油醚液1mL,置于25mL具塞比色管内,在65℃水浴中让石油醚自然挥发干,加入4mL冰乙酸,轻摇使胆固醇溶解,待测。 2.样品和标准胆固醇含量测定 另取两支25mL具塞比色管,一支(空白管)加入4mL冰乙酸,一支(标准管)加入1mL胆固醇标准溶液(0.1mg/mL)和3mL冰乙酸。包括样品管,各
总胆固醇测定试剂盒标准操作程序.
总胆固醇测定试剂盒标准操作程序 1. 摘要 本试剂盒供医疗机构用于体外定量测定人血清或血浆样本中总胆固醇的含量。 2. 适用范围 程序适用于AU5811自动生化分析仪检测血清样本中总胆固醇的含量。 3. 职责 使用AU5811自动生化分析仪进行测定总胆固醇浓度的工作人员要严格按照本SOP 程序进行,室负责人监督管理;本SOP 的改动,可由任一使用本SOP 的工作人员提出,并报经生化室负责人、科主任签字批准生效。 4. 检测方法 上海科华生物工程股份有限公司生产的总胆固醇测定试剂盒采用的是氧化酶法。 5. 原理 O H ESPAS O H O H O O H 222222244+???→?+-+-?+????→?++???→?+醌亚胺氨基安替比林胆甾烯酮 游离胆固醇脂肪酸 游离胆固醇总胆固醇过氧化物酶胆固醇氧化酶胆固醇酯酶 ESPAS:N-乙基-N-(3-磺丙基)-间-茴香胺 血清中的总胆固醇在胆固醇酯酶的作用下水解成游离胆固醇和脂肪酸,游离胆固醇在胆固醇氧化酶的催化下,氧化成Δ4-胆甾烯酮和双氧水,最后双氧水在过氧化物酶的催化下与色原底物4-氨基安替比林和ESPAS 反应生成红色化合物醌亚胺。 由于醌亚胺在波长550nm 处有吸收峰,所以在一定底物浓度范围内,550nm 处吸光度的变化值与样本中总胆固醇的含量成正比 6. 仪器 AU5811自动生化分析仪 7. 试剂 7.1 试剂来源: 上海科华生物工程股份有限公司提供 7.2 试剂瓶内主要成分: R1:胆固醇酯酶、抗坏血酸氧化酶、过氧化物酶、ESPAS (ADPS ); R2:胆固醇氧化酶、4-氨基安替比林; 校准品:胆固醇 7.3 试剂稳定性:
实验十六血清胆固醇的定量测定(醋酸酐法)
实验十六血清胆固醇的定量测定(醋酸酐法) 一实验目的 了解并掌握胆固醇定量测定的醋酸酐法。 二实验原理 血清意胆固醇测定对高脂血症的诊断、冠心病和动脉粥样硬化和防治均有意义。血清总胆固醇升高常见原发性高胆固醇血症、肾病综合症、甲状腺机能减退、糖尿病等疾病。 胆固醇的测定临床常用的比色法有两类: 1、固醇化的氯仿式醋酸溶液中加入醋酸酐-硫酸试剂,产生蓝绿色。 2、固醇的醋酸、乙醇式异丙醇溶液中加入高铁-硫酸试剂产生紫红色。 由于胆固醇颜色反应特异性差,直接测定往往受血液中其倔因素干扰,所以精细的方法是先经抽提,分离及纯化等步骤,然后显色定量。 本实验采用醋酐-硫酸单一试剂显色法。本法测定100ml血清总胆固醇的正常值为125~200mg。 醋酐能使胆固醇脱水,再与硫酸结合生成绿色化合物。 三实验器材 1、血清。 2、试管1.5cm×15cm(×3)。 3、吸管0.10ml(×3)、5.0ml(×1)。 4、容量瓶100ml(×1)。 5、烧杯100ml(×2)。 6、电子分析天平。 7、722型(或7220型)分光光度计。 四实验试剂 1、固醇标准液(2mg/ml): 准确称取干燥胆固醇200mg,先用少量无水乙醇溶液,完全转移到100ml 容量瓶中,再用无水乙醇稀释至刻度。 2、硫脲显色剂;
称取硫脲0.5g,溶解于350ml冰醋酸及650ml醋酐配制而成的混合物中,此溶液放置冰箱内可长期保存。 使用液系于上述每100ml硫脲溶液中逐滴加入浓硫酸10ml,边加边摇,不便溶液过热。冷却后放置冰箱中,可保存半个月以上。溶液发黄后不能再用。 五实验方法 取干燥试管3支,分别标明“空白管”、“测定管”及“标准管”,按表9进行操作。 表9 醋酸酐定量测定胆固醇化——操作表 快速加入显色剂,立即混匀,于37℃水浴中保温10min,取出后,立即以显色剂作为空白调零点,在620nm波长处进行比色。 六计算 10 0100 A C m A =? 式中m:100ml血清中胆固醇的质量(mg ); A1:样品液的吸光度; A0:标准液的吸光度; C0:标准液胆固醇的质量浓度,即2mg/ml; 100:100ml血清。 七注意事项 在显色后不宜曝于强光下,因强光可便溶液褪色而影响测定结果。所用各种反应试剂及玻璃器皿均须于燥无水。 八思考题 1.血清胆固醇醋酸酐测定的原理?
实验十四 血清胆固醇测定(胆固醇氧化酶法)
实验十四血清胆固醇测定 (胆固醇氧化酶法) 胆固醇的测定方法很多;通常可分为化学试剂比色法、酶法、气相色谱法、高效液相色谱法、核素稀释质谱法五大类。化学试剂比色法中有直接法和间接法;前者可用血清直接测定,后者是用溶剂或其它方法提取胆固醇后再作定量。酶法由于操作简便、结果准确,试剂无腐蚀性,而且因使用特异性酶,大大减少了血液中其它成分的干扰,目前已成为测定胆固醇的主要方法。 【目的】 1.了解胆固醇氧化酶法测定血清胆固醇的原理,能进行血清胆固醇测定的操作。 2.掌握血清胆固醇测定的临床意义。 【原理】 血清中总胆固醇(TC)包括胆固醇酯(CE)和游离型胆固醇(FC),酯型占70%,游离型占30%。胆固醇酯酶(CEH)先将胆固醇酯水解为胆固醇和游离脂肪酸(FFA),胆固醇在胆固醇氧化酶(COD)的作用下氧化生成Δ4-胆甾烯酮和过氧化氢。后者经过氧化物酶(POD)催化氢与4-氨基安替比林(4-AAP)和酚反应,生成红色的醌亚胺,其颜色深浅与胆固醇的含量呈正比,在500nm波长处测定吸光度,与标准管比较可计算出血清胆固醇的含量。反应式如下: CEH 胆固醇酯胆固醇 + 脂肪酸 胆固醇 + O2△4-胆甾烯酮 + H O2 2 POD 2H2O2 + 4-氨基安替比林 + 酚红色醌亚胺【器材】 试管、吸管、试管架、微量加样器、恒温水浴箱、分光光度计。 【试剂】 酶法测定胆固醇多采用市售试剂盒。 1. 酶应用液胆固醇酶试剂的组成为: pH6.7磷酸盐缓冲液50mmol/L
胆固醇酯酶≥200U/L 胆固醇氧化酶≥100U/L 过氧化物酶≥3 000U/L 4-氨基安替比林0.3 mmol/L 苯酚 5 mmol/L 此外还含有胆酸钠和Triton X-100,胆酸钠是胆固醇酯酶的激活剂,表面活性剂Triton X-100能促进脂蛋白释放胆固醇和胆固醇酯,有利于胆固醇酯的水解。 2.5.17 mmol/L(200mg /dl)胆固醇标准液 精确称取胆固醇200mg溶于无水乙醇,移入100ml容量瓶中,用无水乙醇稀释至刻度(也可用异丙醇等配制)。 【操作】 取试管3支,编号,按下操作。 表3-15 酶法测定血清胆固醇操作步骤 加入物(ml)测定管标准管空白管 血清0.02--胆固醇标准液-0.02- 蒸馏水--0.02 酶应用液 2.00 2.00 2.00 混匀后,37℃水浴保温15分钟,在500nm波长处比色,以空白管调零,读取各管吸光度。 【计算】 血清胆固醇 (mmol/L) = 测定管吸光度 标准管吸光度 × 5.17 【注意事项】 1. 黄疸血清过高的胆红素可还原—部分反应中的H2O2,降低显色反应,使结果偏低。但测定胆固醇,胆红素对酶法的干扰比化学法小。
血清总胆固醇(TC)测定操作规程
血清总胆固醇(TC)测定操作规程 A1.2 原理 血清中的胆固醇酯(CE)被胆固醇酯水解酶(CEH)水解成游离胆固醇(Chol),后者被胆固醇氧化酶(CHOD)氧化成△4—胆甾烯酮,并产生过氧化氢,再经过氧化物酶(POD)催化4—氨基安替比林与酚(三者合称PAP),生成红色醌亚胺色素(Trinder反应)。醌亚胺的最大吸收在500nm左右,吸光度与标本中总胆固醇呈正比。反应式如下: 胆固醇酯+H2O CEH 胆固醇+游离脂肪酸 胆固醇+02 CHOD △4-胆甾烯酮十H202 2H202+4-氨基安替比林+酚 POD 昆亚胺 +4H2O A1.3 标本采集与处理 对于血脂分析,特别需要强调“分析前”各个环节的质量管理。
A1.3.1 受检者(体检对象或病人)的准备:除总胆固醇不一定用空腹血外,测定甘油三酯、脂蛋白与载脂蛋白的病人必须空腹12h,不饮酒24h后采集血样。对于体检对象抽血前应有2周时间保持平时的饮食习惯,近期内体重稳定,无急性病、外伤、手术等意外情况。妊娠后期各项血脂都会增高,应在产后或终止哺乳后3个月检验才能反映其基本血脂水平。注意有无应用影响血脂的药物,如降血脂药、避孕药、噻嗪类利尿剂、β受体阻滞剂、免疫抑制剂、某些降压剂、降糖药、胰岛素及其他激素制剂等,检验以前应根据所用药物的特性停止用药数天或数周,否则应记录用药情况。对体检对象及做前瞻性观察者,还应注意采血的季节,因为血脂水平有季节性变动,为了前后比较应在每年同一季节检验。应嘱体检对象在抽血前24h 内不作剧烈运动。 A1.3.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。体位影响水分在血管内外的分布,因此影响血脂水平。例如站立
血清总胆固醇(TCH)测定 及临床意义
血清总胆固醇(TCH)测定及临床意义 【正常参考值】 人群血脂水平主要取决于生活因素,特别是饮食和营养,所以各地区调查所得参考值高低不一,以致各地区有各自的高TC划分标准。现在国际上以显著增加冠心病危险的TC水平(医学决定水平)作为划分界限。在方法学标准化的基础上,采用共同的划分标准,有助于避免混乱。 我国《血脂异常防治建议》提出的标准为: 理想范围:<5.2 mmol/L(<200 mg/dL) 边缘升高:5.23~5.69 mmol/L(201~219 mg/dL) 升高:≥5.72 mmol/L(≥220 mg/dL) 美国胆固醇教育计划(NCEP),成人治疗组提出的医学决定水平如下: 理想范围:<5.2 mmol/L(<200 mg/dL) 边缘升高:5.2~6.2 mmol/L(200~239 mg/dL) 升高:≥6.21 mmol/L(≥240 mg/dL) 【临床意义】 影响TC水平的因素有:①年龄与性别:TC水平往往随年龄上升,但到70岁后有所下降。中青年期女性低于男性,50岁以后女性高于男性。②长期的高胆固醇、高饱和脂肪和高热量饮食,可使TC增高。③遗传因素。④其它:如缺少运动、脑力劳动、精神紧张等可能使TC升高。 增高:高总胆固醇是冠心病的主要危险因素之一,有原发和继发两种,原发常由遗传因素引起如家族性高胆固醇血症(低密度脂蛋白受体缺陷)、家族性apoB缺陷
症、多源性高TC、混和性高脂蛋白血症等。继发的见于肾病综合征、甲状腺功能减退、糖尿病、胆总管阻塞、粘液性水肿、妊娠等。 减少:低总胆固醇也有原发和继发两种,前者常由遗传因素引起如家族性的无或低β脂蛋白血症,后者如甲状腺功能亢进、营养不良、慢性消耗性疾病、恶性贫血、溶血性贫血等。
血清总胆固醇酶试剂法测定法
血清总胆固醇酶试剂法测定法 1.实验原理 胆固醇酯酶(CHE)、胆固醇氧化酶(CHO)、过氧化物酶(POD)、Trinder反应偶联比色终点法。反应式如下: CHE 胆固醇酯+ H2O 胆固醇+脂肪酸 CHO 胆固醇+O2Δ4-胆甾烯酮+H2O2 POD 2H2O2 + 4-氨基安替比林+ 苯酚醌亚胺(显色) + 4H2O 2. 标本: 2.1 病人准备:12小时禁食。 2.2 类型:血清,肝素或EDTA抗凝血浆。 3. 标本存放:血清稳定性:20~25℃保存可稳定1周;4~8℃保存可稳定1周;-20℃保存可稳定3个月。 4. 标本运输:常温条件下保存运输。
5. 标本拒收标准:细菌污染的标本。 6. 实验材料 6.1 试剂威特曼总胆固醇试剂盒试剂1 试剂2 6.1.1 试剂准备试剂为即用式。 6.1.2 试剂稳定性与贮存:试剂保存于2~8℃,若无污染,可稳定至失效期。试剂不可冰冻。 6.1.3 变质指示:当试剂有看得见的微生物生长,有浊度,或者未开盖的液体有沉淀时,表明试剂已变质,不能继续使用。 6.1.4 注意事项:试剂中含叠氮钠(0.95g/L)为防腐剂。不可入口!避免接触皮肤及粘膜。应采取必要的预防措施使用试剂 6.2 校准品:使用奥林巴斯公司提供的校准品对自动分析仪进行校准,具体参见生化检验校准品和质控品.SOP 文件。 6.3 质控品:具体参见生化检验校准品和质控品.SOP文件。 7. 仪器:奥林巴斯AU2700生化分析仪
8. 操作步骤 8.1 项目基本参数:参见AU2700生化分析仪项目测定参数.SOP文件 8.2仪器操作步骤:参见AU2700生化分析仪操作规程.SOP 文件 9. 检验结果的判断与分析 10. 质量控制:在每一批标本中都应把非定值血清水平I 与II质控做为未知标本进行分析,以2S为质控警告限,3S为失控限,绘制质控图,判断是否在控。质控规则参见室内质控操作规程.SOP文件。 11. 计算方法:以TruCal U复合校准品总胆固醇校准值校准仪器后,在病人结果可报告范围内,仪器直接报告可靠检测结果。 12. 参考值范围(mmol/L) 合适范围: 5.2mmol/L 高度危险临界值: 5.2~6.2mmol/L 高度危险范围:>6.2mmol/L 13. 临床意义:胆固醇由体细胞合成和来自对食物的吸
血清总胆固醇测定法
血清总胆固醇测定法 1.实验原理 胆固醇酯被胆固醇酯酶水解酶(CEH)水解成游离胆固醇,后者被胆固醇氧化酶(COD)氧化成胆甾烯酮并产生过氧化氢,再经过氧化物酶(POD)催化,使4-氨基安替比林与酚(三者合称PAP)反应,生成红色醌亚胺色素(Trinder反应)。醌亚胺的最大吸光度在500nm左右,吸光度与标本中TC含量成正比。反应式如下: CEH 胆固醇酯+ H2O 胆固醇+脂肪酸 COD 胆固醇+O2Δ4-胆甾烯酮+H2O2 POD 2H2O2+ 4-AAP +酚苯醌亚胺(显色) + 4H2O 2. 标本: 2.1 病人准备:12小时禁食。 2.2 类型:血清,肝素或EDTA抗凝血浆。 3. 标本存放:血清稳定性:20~25℃保存可稳定1
周;4~8℃保存可稳定1周;-20℃保存可稳定3个月。 4. 标本运输:常温条件下保存运输。 5. 标本拒收标准:细菌污染的标本。 6. 实验材料 6.1 试剂欧泰克总胆固醇试剂盒(货号:112 1307170 1 试剂8×70ml) 6.1.1 试剂组成 Tris缓冲液pH7.3 50mmol/L 酚20mmol/L 4-氨基安替比林 1.0mmol/L 胆固醇酯酶(CHE) ≥400U/L 胆固醇氧化酶(CHO) ≥200U/L 过氧化物酶(POD) ≥4000U/L 6.1.2 试剂准备试剂为即用式。 6.1.3 试剂稳定性与贮存:试剂保存于2~8℃,若无污染,可稳定至失效期。试剂不可冰冻。 6.1.4 变质指示:当试剂有看得见的微生物生长,有浊度,或者未开盖的液体有沉淀时,表明试剂已变质,不能继续使用。 6.1.5 注意事项:试剂中含叠氮钠(0.95g/L)为防腐剂。不可入口!避免接触皮肤及粘膜。应采取必要的预防措施使用试剂
食物中胆固醇的测定方法
食物中胆固醇的测定方法 食物中胆固醇的测定方法主要有气相色谱法和比色法。色谱法必须具备气相色谱仪,此仪器价格昂贵,故在国内不易普及,因此选用经济、简便、实用的比色法进行食物中胆固醇的测定。 比色法 1.原理 固醇类化合物与酸试剂作用,可脱水,发生聚合反应并产生强的颜色反应。 2.适用范围 此方法适用于动物性食物中胆固醇的测定。 3.仪器 (1)实验室常用设备 (2)分光光度计 (3)电热恒温水浴 4.试剂 所有试剂,如未注明规格,均指分析纯,所有实验用水,均为蒸馏水。 (1)石油醚 (2)无水乙醇 (3)浓硫酸 (4)冰乙酸(优级纯) (5)磷酸 (6)胆固醇标准(美国Sigma公司) 标准储备液:准确称取胆固醇100mg,(胆固醇标准开启后放在干燥器内)溶于冰乙酸中,并定溶至100ml。其浓度为1g/L。可保存2个月。 标准工作液:取标准储备液10ml,用冰乙酸定溶至100ml。其浓度为0.1g/L。此液用时临时配制。 (7) 铁矾显色液: 储备液:溶解4.463克硫酸铁铵[FeNH4(SO4)2·12H2O]于100ml 85%磷酸中贮于干燥器内,此溶液在室温中稳定。 * 铁矾储备液须在实验前两周配制,因硫酸铁铵不易溶解,每天要进行短时间的振摇待溶质完全溶于磷酸后再定溶到体积。 工作液:吸取储备液10ml用浓硫酸稀释到100ml。贮于干燥器内。
(8)氢氧化钾50%溶液:溶解50g氢氧化钾于水中,定溶至100ml。 (9)氯化钠5%溶液:溶解5克氯化钠于水中,定溶至100ml。 (10)纯氮(99.99%) 5.操作步骤 5.1样品脂肪的提取与测定:根据食物种类分别用索氏提取法、研磨法和罗高氏法提取脂肪,并计算出每100克食物中脂肪含量。 5.2样品胆固醇的测定:准确称取提取的油脂3-4滴(约含胆固醇300-500μg)取样量可按样品中胆固醇的浓度增减。置于25ml试管内,加入4ml无水乙醇,0.5ml50%氢氧化钾,在65℃恒温水浴中皂化1小时。皂化时每隔20-30分钟振摇一次使皂化完全。皂化完毕,取出试管,冷却。加入3ml 5%氯化钠、10ml石油醚,盖紧玻璃塞,振摇2分钟,静置分层(一般需1小时以上)。 取上层石油醚2ml,置于10ml具玻璃塞的试管内,在65℃恒温水浴中用氮气吹干,加入4ml 冰乙酸,2ml铁矾显色液,混匀,放置15分钟后560-575nm下比色。 5.3标准曲线:准确吸取胆固醇工作液0;0.5;1.0;1.5;2.0ml分别置于10ml试管内,在各管内加入冰乙酸,使总体积达4ml。沿管壁加2ml铁矾显色液,混匀,在15-90分钟内,560-575nm下比色。 6.分析结果 样品中胆固醇含量(mg/100g)=C×V/V'×1/W×F/1000 式中 C=测得的光密度值在胆固醇标准曲线上显示的胆固醇量(μg) V=石油醚总体积(ml) V'=取出的石油醚体积(ml) W=称取油脂重量(g) F=样品的脂肪含量(g/100g) 1/1000=折算成每100克食物中胆固醇的毫克数。 7.注意事项 同一实验室同时或连续两次测定结果之差不得超过平均值的10%。
实验七、血清胆固醇的定量测定(磷硫铁法)
实验七、血清胆固醇的定量测定(磷硫铁法) 实验目的: 掌握磷硫铁法测定血清胆固醇的原理、方法及临床意义。 实验原理: 总胆固醇的测定有化学比色法(磷硫铁法和邻苯二甲醛法)和酶学方法(试剂盒)两类。本实验采用磷硫铁法测定血清胆固醇含量。 用无水乙醇提取血清中的胆固醇,再与硫磷铁试剂作用,产生颜色反应,呈色度与胆固醇含量成正比,可用比色法测定血清中胆固醇含量。 血清经无水乙醇处理,蛋白质被沉淀,胆固醇及其酯溶解在无水乙醇。在乙醇提取液中,加磷硫铁试剂,胆固醇及其酯与试剂形成比较稳定的紫红色化合物,此物质在560nm 波长处有特征吸收峰,可用比色法作胆固醇的定量测定。正常血清中胆固醇的含量有随年龄增大而增加的趋势,其平均正常值在110~220mg/100ml。 胆固醇含量在400mg/100ml内,与A(或OD)值呈良好线性关系。 实验讲授: 722型分光光度计的使用 722型分光光度计的使用 测量原理 分光光度法测量的理论依据是伯郎—比耳定律:当容液中的物质在光的照射和激发下,产生了对光吸收的效应。但物质对光的吸收是有选择性的,各种不同的物质都有其各自的吸收光谱。所以根据定律当一束单色光通过一定浓度范围的稀有色溶液时,溶液对光的吸收程度A与溶液的浓度c(g/l)或液层厚度b (cm) 成正比。其定律表达式A = abc(a是比例系数)。当c的单位为mol/l时,A = εbc,比例系数用ε表示,称为摩尔吸光系数。其单
位为L·mol-1·cm-1,它是有色物质在一定波长下的特征常数。 T (透光率) = I/I0 A (吸光度) = -lgT 或 A = K·C·L (比色皿的厚度) 测定时,入射光I, 吸光系数和溶液的光径长度不变时,透过光是根据溶液的浓度而变化的,即“K”为常数。比色皿厚度一定,“L”、“I0”也一定。只要测出A即可算出“C”。《分光光度计的表头上,一行是透光率,一行是吸光度。》 722型分光光度计的使用 1、将灵敏度旋钮调至“1”档(信号放大倍率最小)。 2、开启电源,指示灯亮,选择开关臵于“T”,波长调至到测试用波长。仪器预热20分钟。 3、打开试样室(光门自动关闭),调节透光率零点旋钮,使数字显示为000.0。(调节100%T旋钮),盖上试样室盖,将比色皿架处于蒸馏水校正位臵,使光电管受光,调节透光率100%旋钮使数字显示100.0。如显示不到100.0,则可适当增加微电流放大的倍数。(增加灵敏度的档数同时应重复(3)调节仪器透光率的“0”位)但尽量使倍率臵于低档使用。这样仪器会有更高的稳定性。 4、预热后,按(3)连续几次调整透光率的“0”位和“100%”的位臵,待稳定后仪器可进行测定工作。 吸光度“A”的测量 将选择开关臵于A 。调节吸光度调零旋钮,使得数字显示为零,然后将被测样品移入光路,显示值即为被测样品的吸光度值。 浓度C的测量 将选择开关由“A”旋至“C”,将已标定浓度的样品放入光路,调节浓度旋钮,使得数字显示为标定值,将被测样品放入光路即可读出被测样品的浓度值。 使用方法 (1)预热仪器将选择开关臵于“T”,打开电源开关,使仪器预热20分钟。为了防止光电管疲劳,不要连续光照,预热仪器时和不测定时应将试样室盖打开,使光路切断。(2)选定波长根据实验要求,转动波长手轮,调至所需要的单色波长。 (3)固定灵敏度档在能使空白溶液很好地调到“100%”的情况下,尽可能采用灵敏度较低的挡,使用时,首先调到“1”挡,灵敏度不够时再逐渐升高。但换挡改变灵敏度后,须重新校正“0%”和“100%”。选好的灵敏度,实验过程中不要再变动。 (4)调节T=0% 轻轻旋动“0%”旋钮,使数字显示为“00.0”,(此时试样室是打开的)。(5)调节T=100% 将盛蒸馏水(或空白溶液,或纯溶剂)的比色皿放入比色皿座架中的第一格内,并对准光路,把试样室盖子轻轻盖上,调节透过率“100%”旋钮,使数字显示正好为“100.0”。
