门静脉高压的药物治疗

门静脉高压的药物治疗
门静脉高压(PHT)是慢性肝病最常见的并发症,也是导致肝硬化患者胃食管静脉曲张、静脉曲张破裂出血、腹水、肾功能不全等并发症进展的主要因素。
临床上最常用的评估门静脉压力的方法是测量肝静脉压力差(HVPG)。在肝静脉导管术时,HVPG是指肝静脉楔压(WHVP)和自由肝静脉压(FHVP)之差。多数情况下,HVPG>10 mmHg时才引起静脉曲张,HPVG增大到12 mmHg时才引起静脉曲张出血;10 mmHg这一阈值即可被定义为“有临床意义的门静脉高压”(clinically significant PHT)。
PHT的药物治疗目的是在不引起全身性性低血压的前提下减少静脉压力,具体而言就是减少HVPG至<10-12 mmHg或至少减少到其基线值的20%。
门静脉高压药物治疗的作用机制
门脉系统的压力梯度由门脉血流量和血管阻力决定。因此,减少肝血管阻力和/或门静脉血流量的药物或手术可减少静脉压力。
在晚期慢性肝病患者中,由于肝硬化导致肝血管的结构改变(如肝纤维化、再生结节引起的血管畸变、肝窦血管重塑和微血管血栓),进而使门脉压力增加。肝血管结构改变也是肝内阻力
增加的主要原因(70%),其可以通过病因治疗(如抗病毒治疗)、使用抗纤维化药物和抗凝药物进行靶向治疗改善。
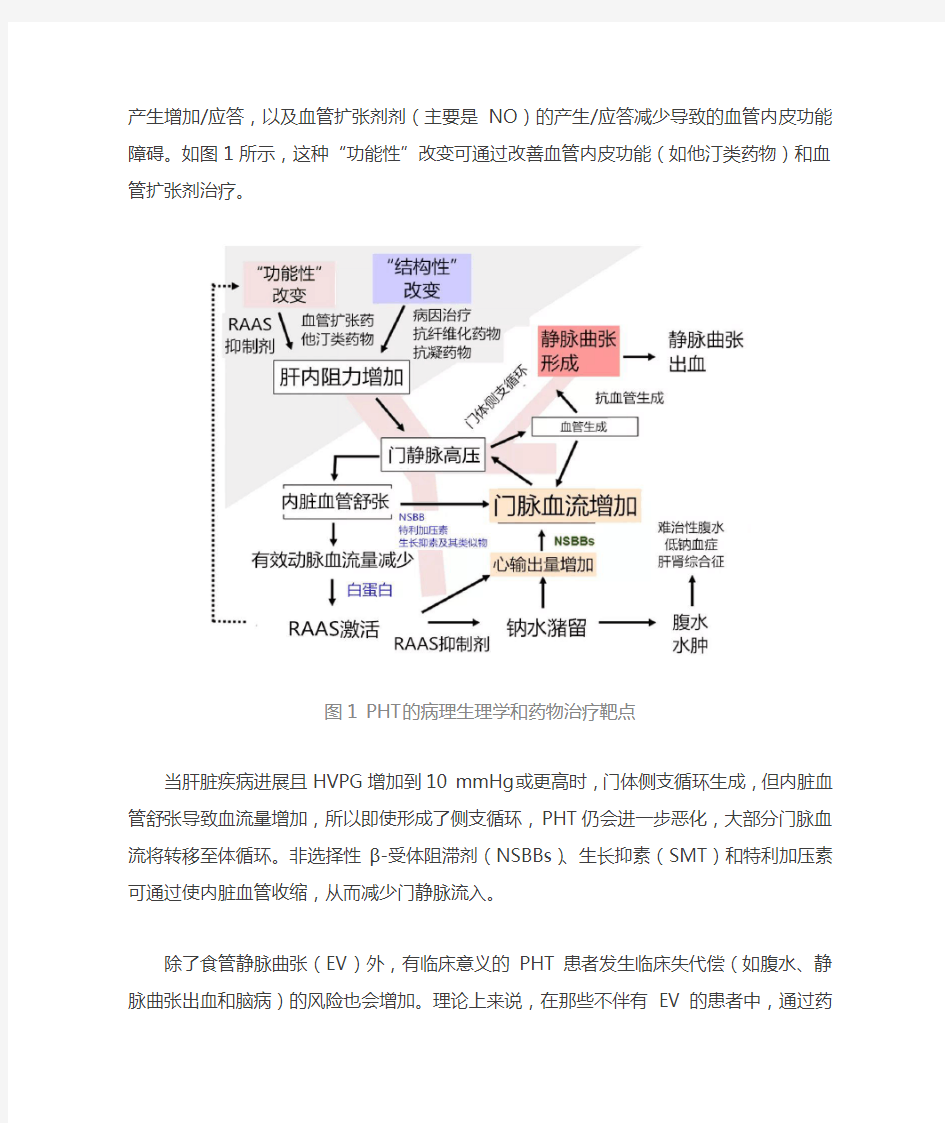
另外,约30%的肝内阻力增加是由于肝内血管紧张度的增加,其是由于血管收缩剂的产生增加/应答,以及血管扩张剂剂(主要是NO)的产生/应答减少导致的血管内皮功能障碍。如图1所示,这种“功能性”改变可通过改善血管内皮功能(如他汀类药物)和血管扩张剂治疗。
图1 PHT的病理生理学和药物治疗靶点
当肝脏疾病进展且HVPG增加到10 mmHg或更高时,门体侧支循环生成,但内脏血管舒张导致血流量增加,所以即使形成了侧
支循环,PHT仍会进一步恶化,大部分门脉血流将转移至体循环。非选择性β-受体阻滞剂(NSBBs)、生长抑素(SMT)和特利加压素可通过使内脏血管收缩,从而减少门静脉流入。
除了食管静脉曲张(EV)外,有临床意义的PHT患者发生临床失代偿(如腹水、静脉曲张出血和脑病)的风险也会增加。理论上来说,在那些不伴有EV的患者中,通过药物治疗使HVPG小幅降低(<10%的基线值),能够预防临床失代偿的进展。
NO的产生是内脏血管舒张和血流增加的关键因素。不仅如此,全身循环也可发生血管舒张,导致如肾素-血管紧张素-醛固酮系统(RAAS)等血管收缩系统激活,钠水潴留,血容量增加,心输出量增加(高动力性循环状态),进而使门静脉流入量和静脉压力进一步增加。对于有症状的PHT患者,应更积极地使用药物治疗。
急性静脉曲张出血(VH)的治疗
1. 生长抑素及其类似物(如奥曲肽)
生长抑素(SMT)是一种十四肽,可通过抑制血管舒张肽(主要是胰高血糖素),也通过直接的血管收缩作用,使内脏血管收缩,从而降低门脉压力。其生物半衰期很短(1.2-4.8 min),因此需要持续静脉输液以维持足够的血清浓度。表1所示的是2016年美国肝病学会的推荐剂量。
表1 用于治疗急性静脉曲张出血的血管活性药物
(来源:见参考文献[2])
对肝硬化患者注射250 μ十四肽生长抑素后,其肝静脉楔压迅速下降约30%,而在连续输注250 μg/h后,肝静脉楔压和门脉血流均下降约17%。在急性VH期间,SMT可使HVPG显著持续下降(约15%)。值得注意的是,更高剂量的SMT输注(500 μg/h)对HVPG和门脉血流的影响比经典剂量(250μg/h)更显著。
奥曲肽是一种人工合成的8肽SMT类似物,半衰期更长(70-90 min),具有与SMT类似的药理作用。除静脉给药外,奥曲肽也可皮下注射,但对于急性VH不推荐这种给药方式。此外,奥曲肽可预防餐后内脏充血,增强普萘洛尔对PHT患者的血液动力学作用。
2. 血管加压素及其类似物(如特利加压素)
血管加压素是一种内源性肽类激素,通过引起内脏血管收缩来减少门静脉流入,从而使门静脉血压下降。然而,由于其全身性副作用,如
心排血量减少、心动过缓和全身血管收缩,因此并不常规用于急性VH。为了减少其全身副作用,血管加压素静脉给药需联合静脉滴注硝酸甘油(表1),且不能给药持续时间不能超过24小时。
特利加压素是人工合成的血管加压素类似物,具有较长的半衰期和较好的心血管安全性。与SMT相比,特利加压素在降低静脉压力方面具有更持久的血流动力学效应。我国指南[4]的意见是,对于生长抑素及其类似物控制出血失败者,可换用或联合应用特利加压素。
长期策略:预防静脉曲张出血,缓解门脉高压及其并发症
1. 非选择性β受体阻滞剂和卡维地洛
如前所述,门静脉压力的一个重要决定因素是门静脉血流,后者取决于肠系膜小动脉的阻力,而β-肾上腺能受体可舒张这些血管。非选择性β受体阻滞剂(NSBBs)——如普萘洛尔、纳多洛尔、噻吗洛尔等——的β2-肾上腺能受体阻断作用可引起内脏血管收缩,继而减少门静脉血流;而其β1-肾上腺能受体阻断作用也可降低心输出量。美国肝病学会的指南推荐NSBB或内镜下食管静脉曲张套扎术(EVL)用于预防中-重度静脉曲张患者发生首次静脉曲张出血(一级预防)。相较于EVL,NSBB可能更具优势,因为EVL仅对EV的消除有局部作用,而NSBB还通过降低静脉压力发挥其他潜在的有益作用,包括减少了细菌易位、腹水、自发性细菌性腹膜炎的发生。
应该注意的是,只有30%-40%的患者在长期使用NSBB后达到门脉高压
的治疗目标。目前,尚无证据推荐NSBB可预防静脉曲张形成。
应用NSBBs治疗肝硬化有一定的局限性。大约15%的患者伴有治疗禁忌症(如顽固性哮喘、呼吸衰竭、Ⅱ-Ⅲ度房室传导阻滞、重度或急性心力衰竭),另有15%的患者由于常见的副作用(如疲劳、虚弱和呼吸短促)需要减少剂量或停用。
此外,NSBBs可引起低血压和影响心输出量,而难治性腹水患者的病理生理学特点是难治性腹水患者,因为这些病人的特点是内脏和全身性血管舒张、全身性低血压且肾脏灌注减少,有人担心NSBBs可导致这类患者血压变得更低,心排出量减少,心率加速和死亡风险增加。因此,不建议顽固性腹水或自发性细菌性腹膜炎者使用大剂量NSBBs。顽固性腹水合并严重血压下降(收缩压小于90 mmHg)、低钠血症(血钠浓度小于130 mmol/L)、肝肾综合征的患者应减少使用NSBBs的剂量,甚至停药[3]。
卡维地洛是一种同时具有阻断α1受体作用的NSBB,并具有促进NO 释放的能力,从而导致血管舒张。卡维地洛通过阻断α1肾上腺能受体,降低肝血管张力和肝阻力,导致PP进一步下降,但也可导致动脉低血压,使钠潴留加重。
表2 中度-重度静脉曲张、无出血患者的管理
(来源:见参考文献[2])
2. 他汀类药物
他汀类药物可抑制HMG-CoA还原酶(合成胆固醇的关键酶),被广泛应用于血脂异常的治疗。除具有降脂作用外,他汀类药物还具有抗氧化、抗恶性细胞增生、抗炎等多种作用,并具有改善内皮细胞功能、促进新生血管形成的能力。这些多效性效应可能对某些慢性疾病有益,包括慢性肝病和PHT。多项研究显示,辛伐他汀可增加肝脏中NO 的含量,从而降低肝硬化患者HVPG且不影响全身血流动力学稳定。但他汀类药物长期应用的有效性和安全性尚需更大样本的研究。
3. 其他药物
其他可能对PVT患者有益的药物包括抗凝药物(如华法林)和RAAS 抑制剂(如ARB),不过目前的研究有限,这些药物的疗效和安全性仍存有争议,再次不做赘述。
