化学键类型及其与物质类别的关系
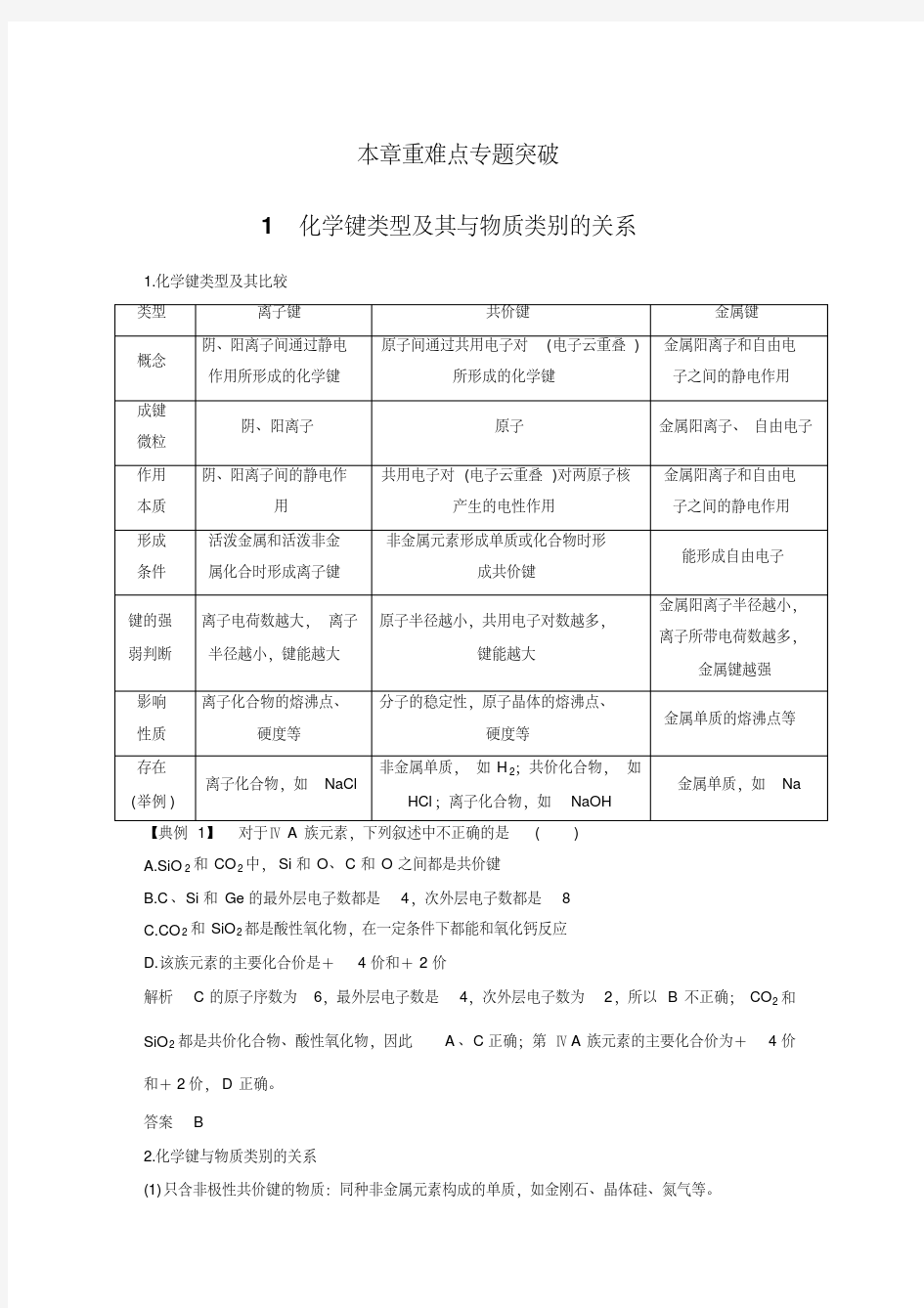

化学键、晶体类型0
“化学键、晶体类型”高考选择题锦集 1.(90)下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种类型的是AD A.碘和干冰的升华B.二氧化硅和生石灰的熔化 C.氯化钠和铁的熔化D.苯和已烷的蒸发 2.(91)碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是A A.①③②B.②③①C.③①②D.②①③ 3.(91)下列说法中正确的是 D A.分子中键能越大,键越长,则分子越稳定 B.失电子难的原子获得电子的能力一定强 C.在化学反应中,某元素由化合态变为游离态,该元素被还原 D.电子层结构相同的不同离子,其半径随核电荷数增多而减小 4.(92)下列分子中,属于含有极性键的非极性分子的是 D A.H2O B.Cl2C.NH3D.CCl4 5.(92)下列晶体中,不属于原子晶体的是 A A.干冰B.水晶C.晶体硅D.金刚石 6.(93)下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 B A.SO2和Si B.CO2和H2O C.NaCl和HCl D.CCl4和KCl 7.(96)关于化学键的下列叙述中,正确的是AD A.离子化合物可能含共价键B.共价化合物可能含离子键 C.离子化合物中只含离子键D.共价化合物中不含离子键 8.(98)下列叙述正确的是BC A.同主族金属的原子半径越大熔点越高 B.稀有气体原子序数越大沸点越高 C.分子间作用力越弱分子晶体的熔点越低 D.同周期元素的原子半径越小越易失去电子 9.(99)关于晶体的下列说法正确的是 A A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子 C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低 10.(2000)下列每组物质发生状态变化所克服的微粒间的相互作用属于同类型的是C A.食盐和蔗糖熔化B.钠和硫熔化 C.碘和干冰升华D.二氧化硅和氧化钠熔化 11.(2004上海)有关晶体的下列说法中正确的是AB A.晶体中分子间作用力越大,分子越稳定
高考化学 专题04(化学键与晶体结构)
C H H H H 专题四:化学键和晶体结构 专题目标:1、掌握三种化学键概念、实质,了解键的极性 2、掌握各类晶体的物理性质,构成晶体的基本粒子及相互作用,能判断常见物 质的晶体类型。 [经典题型] [题型一]化学键类型、分子极性和晶体类型的判断 [ 例1 ]4.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 [ ] (A)SO 2和SiO 2 (B)CO 2和H 2 (C)NaCl 和HCl (D)CCl 4和KCl [点拨]首先根据化学键、晶体结构等判断出各自晶体类型。A 都是极性共价键,但晶体类型不同,选项B 均是含极性键的分子晶体,符合题意。C NaCl 为离子晶体,HCl 为分子晶体 D 中CCl 4极性共价键,KCl 离子键,晶体类型也不同。 规律总结 1、含离子键的化合物可形成离子晶体 2、含共价键的单质、化合物多数形成分子晶体,少数形成原子晶体如金刚石、晶体硅、二氧化硅等。 3、金属一般可形成金属晶体 [例2]、.关于化学键的下列叙述中,正确的是( ). (A)离子化合物可能含共价键 (B)共价化合物可能含离子键 (C)离子化合物中只含离子键 (D)共价化合物中不含离子键 [点拨]化合物只要含离子键就为离子化合物。共价化合物中一定不含离子键,而离子化合物中还可能含共价键。答案 A 、D [巩固]下列叙述正确的是 A. P 4和NO 2都是共价化合物 B. CCl 4和NH 3都是以极性键结合的极性分子 C. 在CaO 和SiO 2晶体中,都不存在单个小分子 D. 甲烷的结构式: ,是对称的平面结构,所以是非极性分子 答案:C 题型二:各类晶体物理性质(如溶沸点、硬度)比较 [例3]下列各组物质中,按熔点由低到高排列正确的是( ) A O2 、I2 Hg B 、CO 2 KCl SiO 2 C 、Na K Rb D 、SiC NaCl SO2 [点拨]物质的熔点一般与其晶体类型有关,原子晶体最高,离子晶体(金属晶体)次之,分子晶体最低,应注意汞常温液态选B [例4]碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是 A. ①③② B. ②③① C. ③①② D. ②①③ [解析]由于题给的三种物质都属于原子晶体,而且结构相似都是正四面体形的空间网状结构,所以晶体的熔点有微粒间的共价键强弱决定,这里共价键强弱主要由键长决定,可近
化学键以及电子式
化学键 考点一 离子键和共价键 1.离子键和共价键的比较 离子键 共价键 概念 带相反电荷离子之间的相互作用 原子间通过共用电子对形成的相互作用 成键粒子 阴、阳离子 原子 成键实质 静电作用:包括阴、阳离子之间 的静电吸引作用,电子与电子之间以及原子核与原子核之间的静电排斥作用 静电作用:包括共用电子对与两核之间的静电吸引作用,电子与电子之间以及原子核与原子核之间的静电排斥作用 形成条件 活泼金属与活泼非金属化合 一般是非金属与非金属化合 2(1)非极性共价键:同种元素的原子间形成的共价键,共用电子对不偏向任何一个原子,各原子都不显电性,简称非极性键。 (2)极性共价键:不同元素的原子间形成共价键时,电子对偏向非金属性强的一方,两种原子,一方略显正电性,一方略显负电性,简称极性键。 3.离子键的表示方法 (1)用电子式表示离子化合物的形成过程 ①Na 2S : ; ②CaCl 2: (2)写出下列物质的电子式 ①MgCl 2:;②Na 2O 2: ③NaOH: ④NH 4Cl : 4.共价键的表示方法 (1)用电子式表示共价化合物的形成过程 ①CH 4 ·C ·· ·+4H·―→; ②CO 2 ·C ·· ·+2·O ·· ·· ·―→ (2)写出下列物质的电子式 ①Cl 2: ; ②N 2: ③H 2O 2: ④CO 2: ⑤HClO: ⑥CCl 4: (3)写出下列物质的结构式 ①N 2:N≡N; ②H 2O : ③CO 2:
1.(1)形成离子键的静电作用指的是阴、阳离子间的静电吸引吗 (2)形成离子键的元素一定是金属元素和非金属元素吗仅由非金属元素组成的物质 中一定不含离子键吗 (3)金属元素和非金属元素形成的化学键一定是离子键吗 (4)含有离子键的化合物中,一个阴离子可同时与几个阳离子形成静电作用吗 2.(1)共价键仅存在于共价化合物中吗 3.判断正误,正确的划“√”,错误的划“×” (1)形成离子键的阴、阳离子间只存在静电吸引力 ( ) (2)全部由非金属元素形成的化合物一定是共价化合物 ( ) (3)某些金属与非金属原子间能形成共价键( ) (4)分子中只有共价键的化合物一定是共价化合物 ( ) (5)某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键 (6)在水溶液中能导电的化合物一定是离子化合物 ( ) (7)离子化合物在任何状态下都能导电( ) 1.下列电子式书写正确的是( ) 2.氯水中存在多种微粒,下列有关粒子的表示方法正确的是( ) A.氯气的电子式: B.氢氧根离子的电子式: C.次氯酸分子的结构式:H—O—Cl D.HClO的电子式: 电子式书写时常见的错 (1)漏写未参与成键的电子,如:N2:N??N,应写为··N??N··。(2)化合物类型不 清楚,漏写或多写[ ]及错写电荷数,如:NaCl:;HF:,应写为 NaCl:;HF:。 (3)书写不规范,错写共用电子对,如:N2的电子式为,不能写成
【化学】化学二模试题分类汇编—— 化学键综合附答案解析
【化学】化学二模试题分类汇编——化学键综合附答案解析 一、化学键练习题(含详细答案解析) 1. 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。 (1)表中字母h元素在周期表中位置___。 (2)写出b元素的最高价氧化物对应的水化物所含化学键类型___。 (3)下列事实能说明a元素的非金属性比c元素的非金属性强的有___。 A.a单质与c的氢化物溶液反应,溶液变浑浊 B.在氧化还原反应中,1mola单质比1molc单质得电子数目多 C.a和c两元素的简单氢化物受热分解,前者的分解温度高 (4)g与h两元素的单质反应生成1molg的最高价化合物。恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式___。 (5)常温下d遇浓硫酸形成致密氧化膜,若薄膜为具有磁性的该元素氧化物,写出该反应的化学方程式___。 (6)e与f形成的1mol化合物Q与水反应,生成2mol氢氧化物和1mol烃,该烃分子中碳氢质量比为9∶1,写出烃分子电子式___。 【答案】第三周期、ⅦA族离子键、(极性)共价键 AC Si(s)+2Cl2(g)=SiCl4(l) ?H= - 687kJ·mol-1 3Fe+4H2SO4(浓)=Fe3O4+4SO2↑+4H2O 【解析】 【详解】 由元素周期表可知:a为氧元素、b为钠元素、c为硫元素、d为铁元素、e为镁元素、f为碳元素、g为硅元素、h为氯元素; (1)表中字母h为氯元素,其在周期表中位置为第三周期、ⅦA族; (2)b为钠元素,钠的最高价氧化物对应的水化物为NaOH,所含化学键类型为离子键、(极性)共价键; (3)a为氧元素、c为硫元素; A.O2与H2S的溶液反应,溶液变浑浊,说明有S生成,即O2的氧化性比S强,即氧元素的非金属性比硫元素的非金属性强,故A正确; B.元素的非金属性强弱体现得电子能力,与得电子数目无关,故B错误; C.O和S两元素的简单氢化物受热分解,前者的分解温度高,说明H2O比H2S稳定,即氧元素的非金属性比硫元素的非金属性强,故C正确; 故答案为AC;
高中化学 化学键与晶体结构
6、化学键与晶体结构 1.用绸布摩擦后的玻璃棒接近下列液体的细流,如果细流发生偏移,则这液体是( ) A.H2O B.CC4C.CS2D.苯 2.下列事实中,能证明氯化氢是共价化合物的是( )t A.氯化氢极易溶于水B.液态氯化氢不导电 C.氯化氢不易分解D.氯化氢溶液可以导电 3.有关晶体的下列说法中正确的是( ) A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.冰熔化时水分子中共价键发生断裂D.氯化钠熔化时离子键未被破坏 4.下列叙述错误的是( ) A.溶于水可以导电的晶体一定是离子晶体B.含有离子键的晶体一定是离子晶体C.Na2O和SiO2的晶体中都不存在单个小分子D.冰醋酸和冰熔化均需要克服范德华力5.下列化学式,在通常状况下能代表某种物质分子式的是( ) A.KClO3 B. NH4NO3C.CO2D.SiO2 6.碱金属与卤素所形成的化合物大都具有的性质是( ) ①高沸点②能溶于水③水溶液能导电④低熔点⑤熔融状态不导电 A.①②③B.③④⑤C.①④⑤ D. ②③⑤ 7.下列化合物中,阳离子与阴离子的半径比最小的是( ) A.CsI B.LiI C.NaF D.KCl 8.在下列有关晶体的叙述中错误的是() A.离子晶体中一定存在离子键B.原子晶体中只存在共价键 C.金属晶体的熔沸点均很高D.稀有气体的原子能形成分子晶体 9.下列说法正确的是() A.分子晶体中一定含有共价键B.Na2O2晶体中阴、阳离子比为1:1 C.只有非金属元素才能形成共价化合物D.在晶体中只有阴离子就一定阳离子10.下列叙述正确的是( ) A.离子晶体中肯定不含非极性共价键 B.原子晶体的熔点肯定高于其他晶体 C.由分子组成的物质其熔点一定低 D.原子晶体中除非极性共价键之外不存在其他类型的化学键 11.关于晶体的下列说法中正确的是( )。 A.只有含金属阳离子的晶体才是离子晶体 B.离子晶体中一定含有金属阳离子和酸根离子 C.在共价化合物分子中各原子的最外层都形成8电子结构 D.分子晶体的熔点不一定比金属晶体的熔点低 12.下列叙述中,不正确的是( )。 A.化学键的形成必须具有空轨道或半空轨道可被利用 B.阴、阳离子间通过静电吸引而形成离子键 C.凡具有共价键的化合物一定是共价化合物. D.铵根离子中四个N—H键的形成过程不都相同,但其键长、键角、键能都相同 13.下列各组分子中,都属于含极性键的非极性分子的是() A.CO2、H2S B.C2H4、CH4C.Cl2、C2H2D.HCl、NH3 14.下列关于共价化合物的说法中,正确的是( )。 ①通常有较低的熔沸点,②是非电解质,③每一种物质都存在着一个一个的分子, ④它们的晶体都是分子晶体,⑤它们在液态时都不导电。
化学键类型及其与物质类别的关系
本章重难点专题突破 1化学键类型及其与物质类别的关系 1.化学键类型及其比较 A.SiO2和CO2中,Si和O、C和O之间都是共价键 B.C、Si和Ge的最外层电子数都是4,次外层电子数都是8 C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 D.该族元素的主要化合价是+4价和+2价 解析C的原子序数为6,最外层电子数是4,次外层电子数为2,所以B不正确;CO2和SiO2都是共价化合物、酸性氧化物,因此A、C正确;第ⅣA族元素的主要化合价为+4价和+2价,D正确。 答案 B 2.化学键与物质类别的关系 (1)只含非极性共价键的物质:同种非金属元素构成的单质,如金刚石、晶体硅、氮气等。
(2)只含极性共价键的物质:一般是不同非金属元素构成的化合物,如HCl、NH3等。 (3)既有极性键又有非极性键的物质,如H2O2、C2H2、C2H6等。 (4)离子化合物中一定有离子键,可能还有共价键。如MgO、NaCl中只含有离子键,NaOH、Na2O2、NH4Cl中既含有离子键,又含有共价键。 (5)共价化合物中只有共价键,一定没有离子键。 (6)构成稀有气体的单质分子,由于原子已达到稳定结构,在这些原子的分子中不存在化学键。 (7)非金属元素的原子之间也可以形成离子键,如NH4Cl等。 (8)金属键只存在于金属单质或合金中。 3.离子键、共价键与离子化合物、共价化合物的关系 极性分子: 非极性分子:、O==C==O A.两种非金属原子间不可能形成离子键 B.非金属原子间不可能形成离子化合物 C.离子化合物中不可能有共价键 D.共价化合物中可能有离子键 解析两种非金属原子间不能得失电子,不能形成离子键,A对;当非金属原子组成原子团时,可以形成离子化合物,如NH4Cl,B错;离子化合物中可以有共价键,如:NaOH中的O—H键,C错;有离子键就是离子化合物,D错。 答案 A
专题复习,化学键与晶体类型
专题复习,化学键与晶体结构 巩固·夯实基础 ●网络构建 1.离子键与共价键 (1)下列物质受热熔化时,不需要破坏化学键的是( ) A.食盐 B.纯碱 C.干冰 D.冰 (2)下列五种物质中,只存在共价键的是( ),只存在离子键的是( ),既存在离子键又存在共价键的是( );不存在化学键的是( )(填序号)。 ①Ar ②CO 2 ③SiO 2 ④NaOH ⑤K 2S (3)用电子式表示下列物质的形成过程: ①N 2 ; ②PCl 3 。 ③MgF 2 ;④Na 2O 。 ⑤H 2O ; ⑥NaH 。 2.极性分子与非极性分子 (1)下列关于分子的极性的说法,不正确的是( ) A.极性分子中可能含有非极性键 B.非极性分子中可能含有极性键 C.极性分子中只含有极性键 D.非极性分子中只含有非极性键 (2)在HF 、H 2O 、NH 3、CS 2、CH 4、N 2分子中: ①以非极性键结合的非极性分子是()。 ②以极性键相结合,具有直线形结构的非极性分子是()。 ③以极性键相结合,具有正四面体结构的非极性分子是()。 ④以极性键相结合,具有三角锥形结构的极性分子是()。 ⑤以极性键相结合,具有V 形结构的极性分子是()。 ⑥以极性键相结合,而且分子极性最大的是()。 链接·拓展 物质的结构常用电子式来表示。书写物质的电子式时应注意的问题有: (1)阴离子和复杂阳离子(+ 4NH 、+ 3CH )要加括号,并注明所带电荷数。如: 等 (2)要注意化学键中原子直接相邻的事实。如MgBr 2的电子式为 ,不能写作 。 (3)要注意书写单质、化合物的电子式与单质、化合物形成过程电子式的差别。如CO 2的电子式为∶ ,CO 2形成过程的电子式为:
化学键以及电子式
化学键以及电子式 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
化学键 考点一离子键和共价键 1.离子键和共价键的比较 离子键共价键 概念带相反电荷离子之间的相互 作用 原子间通过共用电子对形成 的相互作用 成键粒子阴、阳离子原子 成键实质静电作用:包括阴、阳离子 之间的静电吸引作用,电子 与电子之间以及原子核与原 子核之间的静电排斥作用 静电作用:包括共用电子对 与两核之间的静电吸引作 用,电子与电子之间以及原 子核与原子核之间的静电排 斥作用 形成条件活泼金属与活泼非金属化合一般是非金属与非金属化合 (1)非极性共价键:同种元素的原子间形成的共价键,共用电子对不偏向 任何一个原子,各原子都不显电性,简称非极性键。 (2)极性共价键:不同元素的原子间形成共价键时,电子对偏向非金属性 强的一方,两种原子,一方略显正电性,一方略显负电性,简称极性键。 3.离子键的表示方法 (1)用电子式表示离子化合物的形成过程 ①Na2S:;②CaCl2: (2)写出下列物质的电子式 ①MgCl2:;②Na2O2:③NaOH:④NH4Cl: 4.共价键的表示方法 (1)用电子式表示共价化合物的形成过程
①CH4··+4H·―→;②CO2··+2··―→ (2)写出下列物质的电子式 ①Cl2:;②N2:③H2O2:④CO2:⑤HClO:⑥CCl4: (3)写出下列物质的结构式 ①N2:N≡N;②H2O:③CO2: 1.(1)形成离子键的静电作用指的是阴、阳离子间的静电吸引吗 (2)形成离子键的元素一定是金属元素和非金属元素吗仅由非金属元素组 成的物质中一定不含离子键吗 (3)金属元素和非金属元素形成的化学键一定是离子键吗 (4)含有离子键的化合物中,一个阴离子可同时与几个阳离子形成静电作用吗 2.(1)共价键仅存在于共价化合物中吗 3.判断正误,正确的划“√”,错误的划“×” (1)形成离子键的阴、阳离子间只存在静电吸引力 () (2)全部由非金属元素形成的化合物一定是共价化合物 () (3)某些金属与非金属原子间能形成共价键 () (4)分子中只有共价键的化合物一定是共价化合物 () (5)某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键
2020-2021全国高考化学 化学键的综合高考模拟和真题分类汇总含详细答案
2020-2021全国高考化学化学键的综合高考模拟和真题分类汇总含 详细答案 一、化学键练习题(含详细答案解析) 1. 煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从 而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题: (1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。 (2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。 ①COS的分子结构与CO2相似,COS的电子式为_____________。 ②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。 ③已知断裂1mol化学键所需的能量如下(能量的单位为kJ): H—H C═O C═S H—S C≡O 436745********** H2还原COS发生的反应为H2(g)+COS(g)═H2S(g)+CO(g),该反应的 △H=________kJ·mol-1。 ④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g)垐? 噲?CO2(g)+ H2S (g)△H<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的 转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与 () 2 n H O n(COS) 的关系如图 2所示。 由图1可知,催化剂活性最大时对应的温度约为________;由图2可知,P点时平衡常数K=_____(保留2位有效数字)。 【答案】Fe2+(或FeCl2) COS + 4Br2 + 12OH- = CO32- + SO42- + 8Br- + 6H2O +8 150℃ 0.048 【解析】
化学键的三种基本类型
化学键主要有三种基本类型,即离子键、共价键和金属键。 一、离子键 离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。即正离子和负离子之间由于静电引力所形成的化学键。离子既可以是单离子,如Na+、CL-;也可以由原子团形成;如SO4 2-,NO3-等。 离子键的作用力强,无饱和性,无方向性。离子键形成的矿物总是以离子晶体的形式存在。 二、共价键 — 共价键的形成是相邻两个原子之间自旋方向相反的电子相互配对,此时原子轨道相互重叠,两核间的电子云密度相对地增大,从而增加对两核的引力。共价键的作用力很强,有饱和性与方向性。因为只有自旋方向相反的电子才能配对成键,所以共价键有饱和性;另外,原子轨道互相重叠时,必须满足对称条件和最大重叠条件,所以共价键有方向性。共价键又可分为三种: (1)非极性共价键形成共价键的电子云正好位于键合的两个原子正中间,如金刚石的C—C 键。 (2)极性共价键形成共价键的电子云偏于对电子引力较大的一个原子,如Pb—S 键,电子云偏于S一侧,可表示为Pb→S。 (3)配价键共享的电子对只有一个原子单独提供。如Zn—S键,共享的电子对由锌提供,Z:+ ¨..S:=Z n→S 共价键可以形成两类晶体,即原子晶体共价键与分子晶体。原子晶体的晶格结点上排列着原子。原子之间有共价键联系着。在分子晶体的晶格结点上排列着分子(极性分子或非极性分子),在分子之间有分子间力作用着,在某些晶体中还存在着氢键。关于分子键精辟氢键后面要讲到。 · 三、金属键 由于金属晶体中存在着自由电子,整个金属晶体的原子(或离子)与自由电子形成化学键。这种键可以看成由多个原子共用这些自由电子所组成,所以有人把它叫做改性的共价键。对于这种键还有一种形象化的说法:“好象把金属原子沉浸在自由电子的海洋中”。金属键没有方向性与饱和性。 和离子晶体、原子晶体一样,金属晶体中没独立存在的原子或分子;金属单质的化学式(也叫分子式)通常用化学符号来表示。
{高中试卷}高考热点选择题化学键、晶体类型[仅供参考]
20XX年高中测试 高 中 试 题 试 卷 科目: 年级: 考点:
监考老师: 日期: 20XX高考热点选择题——20XX化学键、晶体类型 1、(90)下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种类型的是 A 碘和干冰的升华 B 二氧化硅和生石灰的熔化 C 氯化钠和铁的熔化 D 苯和已烷的蒸发 2、(91)碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是 A ①③② B ②③① C ③①② D ②①③ 3、(91)下列说法中正确的是 A 分子中键能越大,键越长,则分子越稳定 B 失电子难的原子获得电子的能力一定强 C 在化学反应中,某元素由化合态变为游离态,该元素被还原 D 电子层结构相同的不同离子,其半径随核电荷数增多而减小 4、(92)下列分子中,属于含有极性键的非极性分子的是 A H2O B Cl2 C NH3 D CCl4 5、(92)下列晶体中,不属于原子晶体的是 A 干冰 B 水晶 C 晶体硅 D 金刚石 6、(93)下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 A SO2和Si B CO2和H2O C NaCl和HCl D CCl4和KCl
7、(96)关于化学键的下列叙述中,正确的是 A 离子化合物可能含共价键 B 共价化合物可能含离子键 C 离子化合物中只含离子键 D 共价化合物中不含离子键 8、(98)下列叙述正确的是 A 同主族金属的原子半径越大熔点越高 B 稀有气体原子序数越大沸点越高 C 分子间作用力越弱分子晶体的熔点越低 D 同周期元素的原子半径越小越易失去电子 9、(99)关于晶体的下列说法正确的是 A 在晶体中只要有阴离子就一定有阳离子 B 在晶体中只要有阳离子就一定有阴离子 C 原子晶体的熔点一定比金属晶体的高 D 分子晶体的熔点一定比金属晶体的低 10、(2000)下列每组物质发生状态变化所克服的微粒间的相互作用属于同类型的是 A 食盐和蔗糖熔化 B 钠和硫熔化 C 碘和干冰升华 D 二氧化硅和氧化钠熔化 11、(20XX上海)有关晶体的下列说法中正确的是 A晶体中分子间作用力越大,分子越稳定 B原子晶体中共价键越强,熔点越高 C冰熔化时水分子中共价键发生断裂 D氯化钠熔化时离子键未被破坏 12、(20XX老课程理综)下列分子含有的电子数目与HF相同,且只有两个极性共价键的是 A
化学键知识点
离子键 一离子键与离子化合物 1.氯化钠的形成过程: 2.离子键 (1)概念:带相反电荷离子之间的相互作用称为离子键。 (2)实质: (3)成键微粒:阴、阳离子。 (4)离子键的形成条件:离子键是阴、阳离子间的相互作用,如果是原子成离子键时,一方要容易失去电子,另一方要容易得到电子。 ①活泼金属与活泼的非金属化合时,一般都能形成离子键。如第IA、ⅡA族的金属元素(如Li、Na、K、Mg、Ca等)与第ⅥA、ⅦA族的非金属元素(如O、S、F、Cl、Br、I等)化合时,一般都能形成离子键。 ②金属阳离子与某些带负电荷的原子团之间(如Na+与OH-、SO4-2等)形成离子键。 ③铵根离子与酸根离子(或酸式根离子)之间形成离子键,如NH4NO3、NH4HSO4。 【注意】①形成离子键的主要原因是原子间发生了电子的得失。 ②离子键是阴、阳离子间吸引力和排斥力达到平衡的结果,所以阴、阳离子不会无限的靠近,也不会间距很远。 3.离子化合物 (1)概念:由离子键构成的化合物叫做离子化合物。 (2)离子化合物主要包括强碱[NaOH、KOH、B a(O H)2等]、金属氧化物(K2O、Na2O、
MgO 等)和绝大数盐。 【注意】离子化合物中一定含有离子键,含有离子键的化合物一定是离子化合物。 二 电子式 1.电子式的概念 在元素符号周围,用“· ”或“×”来表示原子的最外层电子的式子叫电子式。 (1)原子的电子式:元素周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分步,多于4时多出部分以电子对分布。例如: (2)简单阳离子的电子式:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,如: Na +、Li +、Mg +2、Al +3等。 (3)简单阴离子的电子式:不但要画出最外层电子数,而且还应用括号“[ ]”括起来,并在右上角标出“- n ”电荷字样。例如:氧离子 、氟离子 。 (4)多原子离子的电子式:不仅要画出各原子最外层电子数,而且还应用括号“[ ]”括 起来,并在右上角标出“-n ”或“+ n 电荷字样。例如:铵根离子 氢氧根离子 。 (5)离子化合物的电子式:每个离子都要单独写,而且要符合阴阳离子相邻关系,如MgCl 2要写成 ,不能写成,也不能写成 。 2.用电子式表示离子化合物的形成过程 例如:NaCl 的形成过程:; Na 2O 的形成过程: CaBr 2的形成过程: F
(完整版)化学键与晶体类型
第八讲化学键与晶体类型 考试大纲要求 1.理解离子键、共价键的涵义,了解键的极性。 2.了解几种晶体类型(离子晶体、原子晶体、分子晶体)及其性质。 知识规律总结 一、化学键与分子间作用力 二、化学键的分类 表4-2离子键、共价键和金属键的比较 三、共价键的类型 表4-3非极性键和极性键的比较 四、分子的极性
1.非极性分子和极性分子 表4-4 非极性分子和极性分子的比较 2.常见分子的类型与形状 表4-5常见分子的类型与形状比较 3.分子极性的判断 (1)只含有非极性键的单质分子是非极性分子。 (2)含有极性键的双原子化合物分子都是极性分子。 (3)含有极性键的多原子分子,空间结构对称的是非极性分子;空间结构不对称的为极性分子。 注意:判断AB n型分子可参考使用以下经验规律:①若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,若不等则为极性分子;②若中心原子有孤对电子(未参与成键的电子对)则为极性分子,若无孤对电子则为非极性分子。 五、晶体类型 1.分类 表4-6各种晶体类型的比较 2
极性溶剂,熔化时能够导电,溶沸点高多数溶剂,导电性 差,熔沸点很高 液能够导电, 溶沸点低 电和热的良 导体,熔沸点 高或低 实例食盐晶体金刚石氨、氯化氢镁、铝 2.物质溶沸点的比较 (1)不同类晶体:一般情况下,原子晶体>离子晶体>分子晶体 (2)同种类型晶体:构成晶体质点间的作用大,则熔沸点高,反之则小。 ①离子晶体:离子所带的电荷数越高,离子半径越小,则其熔沸点就越高。 ②分子晶体:对于同类分子晶体,式量越大,则熔沸点越高。 ③原子晶体:键长越小、键能越大,则熔沸点越高。 (3)常温常压下状态 ①熔点:固态物质>液态物质 ②沸点:液态物质>气态物质 3.“相似相溶”规律 极性分子组成的溶质易溶于由极性分子组成的溶剂;非极性分子组成的溶质易溶于由非极性分子组成的溶剂。 思维技巧点拨 一、化学键及分子极性的判断 【例1】下列叙述正确的是 A.P4和NO2都是共价化合物 https://www.360docs.net/doc/ab10613613.html,l4和NH3都是以极性键结合的极性分子 C.在CaO和SiO2晶体中,都不存在单个小分子 D.甲烷的结构式:是对称的平面结构,所以是非极性分子 【解析】P4和NO2分子中都含有共价键,但P4是单质,故选项A错误。CCl4是含有极性键的非极性分子,故选项B错误。原子晶体、离子晶体和金属晶体中不存在小分子,只有分子晶体中才存在小分子,故选项C正确。甲烷分子为正四面体形的非极性分子,故选项D错误。本题正确答案为C。 【例2】关于化学键的下列叙述中,正确的是 A.离子化合物可能含共价键 B.共价化合物可能含离子键 C.离子化合物中含离子键 D.共价化合物中不含离子键 【解析】凡含有离子键的化合物不管是否含有共价键,一定属于离子化合物,所以共价化合物中不可能含有离子键。本题正确答案为ACD。 二、熔沸点判断 【例3】碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的 第3页
化学键分类
化学键分类 1.电负性 电负性是元素的原子在化合物中吸引电子能力的标度, 元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性数值越小,相应原子在化合物中吸引电子的能力越弱(稀有气体原子除外)。 2.化学键 化学键(英语:Chemical Bond)是一种粒子间的吸引力,其中粒子可以是原子、离子或分子。化学键种类繁多,其能量大小、键长亦有所不同;能量较高的“强化学键”包括共价键、离子键,而分子间力、氢键等“弱化学键”能量较低。 2.1离子键 阳离子、阴离子通过静电作用形成的化学键称作离子键。两个原子间的电负性相差极大时,一般是金属与非金属,例如:氯与钠,若他们要结合,电负性大的氯会从电负性小的钠抢走一个电子,以符合八隅体。之后氯会以-1价的方式存在,而钠则以+1价的方式存在,两者再以库仑静电力因正负相吸而结合在一起,因此也有人说离子键是金属与非金属结合用的键结方式。 离子键亦有强弱之分。其强弱影响该离子化合物的熔点、沸点和溶解性等性质。离子键越强,其熔点越高。离子半径越小或所带电荷越多,阴、阳离子间的作用就越强。例如钠离子Na+的微粒半径比钾离子K+的微粒半径小,则氯化钠NaCl中的离子键较氯化钾KCl中的离子键强,而氯化钠的熔点比氯化钾的高。 离子化合物 根据化合物中所含化学键类型的不同,把含有离子键的化合物称为离子化合物(ionic
compound),碱类(如KOH)、大多数盐类(如MgCl2)、大多数金属氧化物(如CaO)都是离子化合物。离子化合物中可能存在共价键,这与其定义并不矛盾(参看下文对共价化合物的定义),如NH4Cl、NaOH便是既具有共价键又具有离子键的离子化合物。 2.2共价键 原子间通过共用电子形成的化学键,叫做共价键。它通过两个电负度相近的原子,例如两个氧,互相共用其外围电子以符合八隅体的键结方式结合,因此也有人说这是非金属元素间的结合方式。而共价键有键角及方向的限制,因此不能随意延伸,也就是有分子结构。 共价键广泛存在于气体之中,例如氢气、氯气、二氧化碳。有些物质如金刚石,则是由碳原子通过共价键(巨型共价结构)形成的。 共价键又可分为极性共价键与非极性共价键。 共价化合物 只含有共价键的化合物称为共价化合物(covalent compound),如HCl(在溶液中会成为H+及Cl?)、H2O、CO2、CH4、NH3等。因此根据其定义,共价化合物中肯定不存在离子键。键能强,通常具有高熔点特性。 2.3金属键 浸没在公有化的电子云中的正离子和负电子云间的库仑相互作用形成的化学键。金属键则是金属原子间的键结方式,金属阳离子透过与带负电的电子海间的库仑静电力,金属原子间共用游走于空价轨域的电子海,而结合成稳定态,因此金属有很高的延性及展性,而且有很高的熔点(汞除外),并无分子结构。 2.4氢键 与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y
第一章第三节化学键知识点归纳总结
高中化学必修2知识点归纳总结 第一章 物质结构 元素周期律 第三节 化学键 知识点一化学键的定义 一、化学键:使离子相结合或使原子相结合的作用力叫做化学键。相邻的(两个或多个)离子或原子间的强烈的相互作用。 【对定义的强调】(1)首先必须相邻。不相邻一般就不强烈 (2)只相邻但不强烈,也不叫化学键 (3)“相互作用”不能说成“相互吸引”(实际既包括吸引又包括排斥) 一定要注意“相邻..”和“强烈..”。如水分子里氢原子和氧原子之间存在化学键,而两个氢原子之间及水分子与水分子之间是不存在化学键的。 二、形成原因:原子有达到稳定结构的趋势,是原子体系能量降低。 三、类型: 离子键 化学键 共价键 极性键 非极性键 知识点二离子键和共价键 一、离子键和共价键比较 二、非极性键和极性键
知识点三离子化合物和共价化合物 通常以晶体形态存在 离子键为主,该化合物也称为离子化合物(3)只有 ..当化合物中只存在共价键时,该化合物才称为共价化合物。(4)在离子化合物中一般既含有金属元素又含有非金属元素;共价化合物一般只含有非金属元素(NH4+例外) 注意:(1)离子化合物中不一定含金属元素,如NH4NO3,是离子化合物,但全部由非金属元素组成。(2)含金属元素的化合物不一定是离子化合物,如A1C13、BeCl2等是共价化合物。 二、化学键与物质类别的关系 、
知识点四电子式和结构式的书写方法 一、电子式: 1.各种粒子的电子式的书写: (1)原子的电子式:常把其最外层电子数用小黑点“·”或小叉“×”来表示。 例如: (2)简单离子的电子式: ①简单阳离子:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示,如Na+、Li+、Ca2+、Al3+等。②简单阴离子:书写简单阴离子的电子式时不但要画出最外层电子数,而且还应用括号“[]” 括起来,并在右上角标出“n—”电荷字样。例如:氧离子、氟离子。 ③原子团的电子式:书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还应用括号“[]”括起来,并在右上角标出“n—”或“n+”电荷字样。 例如:铵根离子、氢氧根离子。 (3)部分化合物的电子式: ①离子化合物的电子式表示方法:在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。所以,离子化合物的电子式是由阳离子和带中括号的阴离子组成,且简单的阳离子不带最外层电子,而阴离子要标明最外层电子多少。 如:。 ②共价化合物的电子式表示方法:在共价化合物中,原子之间是通过共用电子对形成的共价键的作用结合在一起的,所以本身没有阴阳离子,因此不会出现阴阳离子和中括号。 如: 2.用电子式表示化学反应的实质: (1)用电子式表示离子化合物的形成过程: (2)用电子式表示共价化合物的形成过程: 说明:用电子式表示化合物的形成过程时要注意: (1)反应物要用原子的电子式表示,而不是用分子或分子的电子式表示。用弯箭头表示电子的转移情况,而共价化合物不能标。
化学键和晶体类型
专题复习,化学键与晶体结构 1.离子键与共价键 1下列物质受热熔化时,不需要破坏化学键的是() A.食盐 B.纯碱 C.干冰 D.冰 2下列五种物质中,只存在共价键的是(),只存在离子键的是(),既存在离子键又存在共价键的是();不存在化学键的是()(填序号) ①Ar ②CO2③SiO2④NaOH ⑤K2S (3)用电子式表示下列物质的形成过程: ①N2 ②PCl3 ③MgF2 ④Na2O ⑤H2O ⑥NaH 2.极性分子与非极性分子 1下列关于分子的极性的说法,不正确的是() A.极性分子中可能含有非极性键 B.非极性分子中可能含有极性键 C.极性分子中只含有极性键 D. 非极性分子中只含有非极性键 (2)在HF、H2O、NH3、CS2、CH4、N2分子中: ①以非极性键结合的非极性分子是() ②以极性键相结合,具有直线形结构的非极性分子是() ③以极性键相结合,具有正四面体结构的非极性分子是() ④以极性键相结合,具有三角锥形结构的极性分子是() ⑤以极性键相结合,具有V形结构的极性分子是() ⑥以极性键相结合,而且分子极性最大的是() 链接·拓展 物质的结构常用电子式来表示。书写物质的电子式时应注意的问题有: (1)阴离子和复杂阳离子(NH4+、CH3+) 要加括号,并注明所带电荷数。如: (2)要注意化学键中原子直接相邻的事实。如 MgBr2 的电子式为,不能写作 。 (3)要注意书写单质、化合物的电子式与单质、化合物形成过程电子式的差别。如CO2的电子式为, CO2形成过程的电子式为: (4)要熟练掌握一些重要物质的电子式的书写。如HClO NaH ;Na2O2 HCl 考点
化学键知识详解
化学键 一、化学键 1.化学键 (1)化学键的定义及分类 (2)化学反应的本质:反应物的旧化学键断裂与生成物的新化学键形成。 2.离子键、共价键的比较 易错提醒:(1)物质中不一定含有化学键,如单原子分子He等稀有气体分子中不含化学键。 (2)并非活泼金属与活泼非金属互相化合一定形成离子键,如AlCl3中没有离子键,只有共价键。 (3)非金属元素的两个原子之间一定形成共价键,但多个非金属原子间可以形成离子键,如NH4Cl。 (4)存在离子键的化合物一定是离子化合物,但存在共价键的化合物不一定是共价化合物,如NaOH、Na2O2等。 3.电子式的书写方法 (1)概念:在元素符号周围用“·”或“×”来表示原子的最外层电子的式子。 (2)书写方法
(3)用电子式表示化合物的形成过程 ①离子化合物 如NaCl:。 ②共价化合物 如HCl:+―→ 4.化学键与化合物的关系 易错提醒: (1)有化学键变化的不一定是化学变化。如NaCl晶体从溶液中析出只有化学键的形成,没有化学键的断裂,HCl溶于水电离成H+和Cl-等,只有旧化学键的断裂没有新化学键的形成,二者都没有发生化学变化。 (2)存在离子键的化合物一定是离子化合物。 (3)离子化合物中一定存在离子键,可能存在共价键,如NaOH、Na2O2、(NH4)2SO4等。 (4)共价化合物中只有共价键,一定没有离子键。 (5)熔化时导电的化合物一定是离子化合物;溶解时导电,不能判别。 (6)全部由非金属元素组成的化合物也可能是离子化合物,如NH4Cl、NH4NO3等铵盐,铵根离子和酸根离子之间以离子键结合。由金属元素和非金属元素形成的化合物也可能是共价化合物,如AlCl3。 (7)非金属单质只有共价键(稀有气体除外)。
专题复习化学键和晶体结构wg
考点一:化学键:相邻原子之间强烈的相互作用叫化学键。 化学键的存在:①稀有气体单质中不存在; ②多原子单质分子中存在共价键; ③非金属化合物分子中存在共价键(包括酸); ④离子化合物中一定存在离子键,可能有共价键的存在(Na2O2、NaOH、NH4Cl),共价化合物中不存在离子键; ⑤离子化合物可由非金属构成,如:NH4NO3、NH4Cl 。 1.离子键 1)定义:使阴阳离子结合成化合物的静电作用,叫做离子键。 成键微粒:阴阳离子 相互作用:静电作用(静电引力和斥力) 成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。 2)形成离子键的条件: ①活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。 ②活泼的金属元素和酸根离子形成的盐酸根离子:SO42-、NO3-、Cl-等 ③铵盐子和酸根离子(或活泼非金属元素)形成的盐。把NH4+看作是活泼的金属阳离子 ④离子化合物:含有离子键的化合物。 3)离子键的强弱比较 影响因素:离子半径(反比)、电荷数(正比) 比较离子键强弱:KCl与KBr、 Na2O与MgO 决定:稳定性及某些物理性质,如熔点等。 2.共价键 1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对 氢分子的形成: 共价键特点:共用电子对不偏移,成键原子不显电性 氯化氢分子的形成: 共价键特点:共用电子对偏向氯原子,氯原子带部分负电荷,氢原子带部分正电荷。 2)形成共价键条件: 同种或不同种非金属元素原子结合; 部分金属元素原子与非金属元素原子,如AlCl3,FeCl3; 3)存在:存在于非金属单质和共价化合物中,也存在于某些离子化合物和原子团中 H2 HCl NaOH NH4Cl Na2O2 SO42- NO3-
化学键知识点归纳总结
高中化学必修2知识点归纳总结 第一章物质结构元素周期律 第三节化学键 知识点一化学键的定义 一、化学键:使离子相结合或使原子相结合的作用力叫做化学键。相邻的(两个或多个)离子或原子间的强烈 的相互作用。 【对定义的强调】(1)首先必须相邻。不相邻一般就不强烈(2)只相邻但不强烈,也不叫化学键(3)“相互作用”不能说成“相互吸引”(实际既包括吸引又包括排斥) 一定要注意“相邻 ..”和“强烈 ..”。如水分子里氢原子和氧原子之间存在化学键,而两个氢原子之间及水分子与水分子之间是不存在化学键的。 二、形成原因:原子有达到稳定结构的趋势,是原子体系能量降低。 三、类型: 离子键 化学键共价键极性键 非极性键 知识点二离子键和共价键 一、离子键和共价键比较 化学键类型离子键共价键 概念阴、阳离子间通过静电作用所形成的化学键原子间通过共用电子对所形成的化学键 成键微粒阴、阳离子原子 成键性质静电作用共用电子对 形成条件活泼金属与活泼非金属 a.IA、ⅡA族的金属元素与ⅥA、ⅦA族的非 金属元素。 b.金属阳离子与某些带电的原子团之间(如 Na+与0H—、SO42-等)。 非金属元素的原子之间 某些不活泼金属与非金属之间。 形成示例共用电子对 存在离子化合物中非金属单质、共价化合物和部分离子化合物中作用力大小一般阴、阳离子电荷数越多离子半径越小作用 力越强 原子半径越小,作用力越强 与性质的关系离子间越强离子化合物的熔沸点越高。 如:MgO>NaCl 共价键越强(键能越大),所形成的共价分子越 稳定,所形成的原子晶体的熔沸点越高。如稳 定性:H2O>H2S,熔沸点:金刚石>晶体硅实例NaCl、MgO Cl2、HCl、NaOH(O、H之间) 二、非极性键和极性键 非极性共价键极性共价键 概念同种元素原子形成的共价键不同种元素原子形成的共价键, 共用电子对发生偏移 原子吸引电子能力相同不同 共用电子对不偏向任何一方偏向吸引电子能力强的原子 形成条件由同种非金属元素组成由不同种非金属元素组成 通式及示例A—A、A==A、A≡A,如Cl-Cl、C=C、N≡N A—B、A==B、A≡B,如H-Cl、 C=O、C≡N
