生产注册申请的药物临床试验数据自查报告表.doc
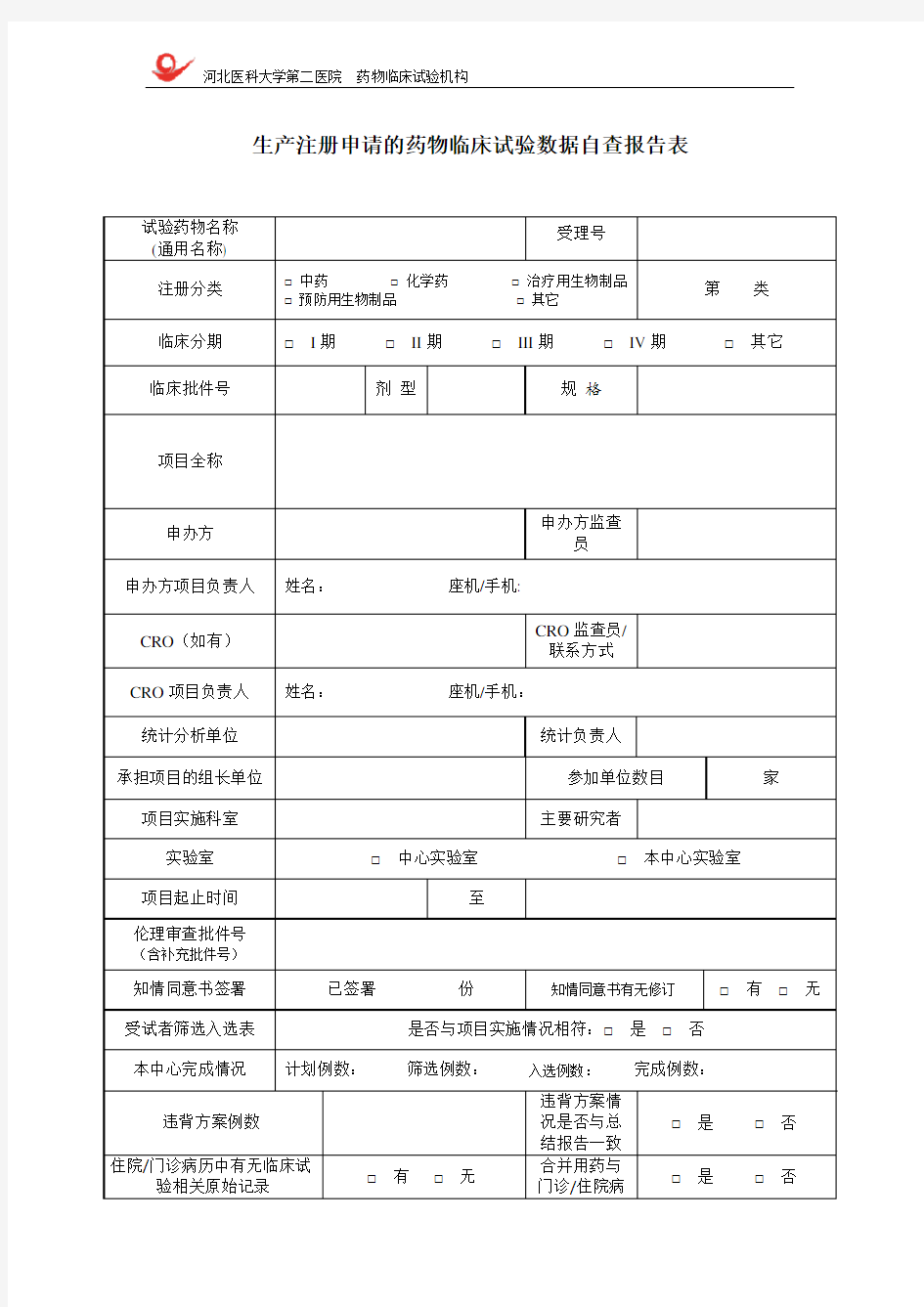
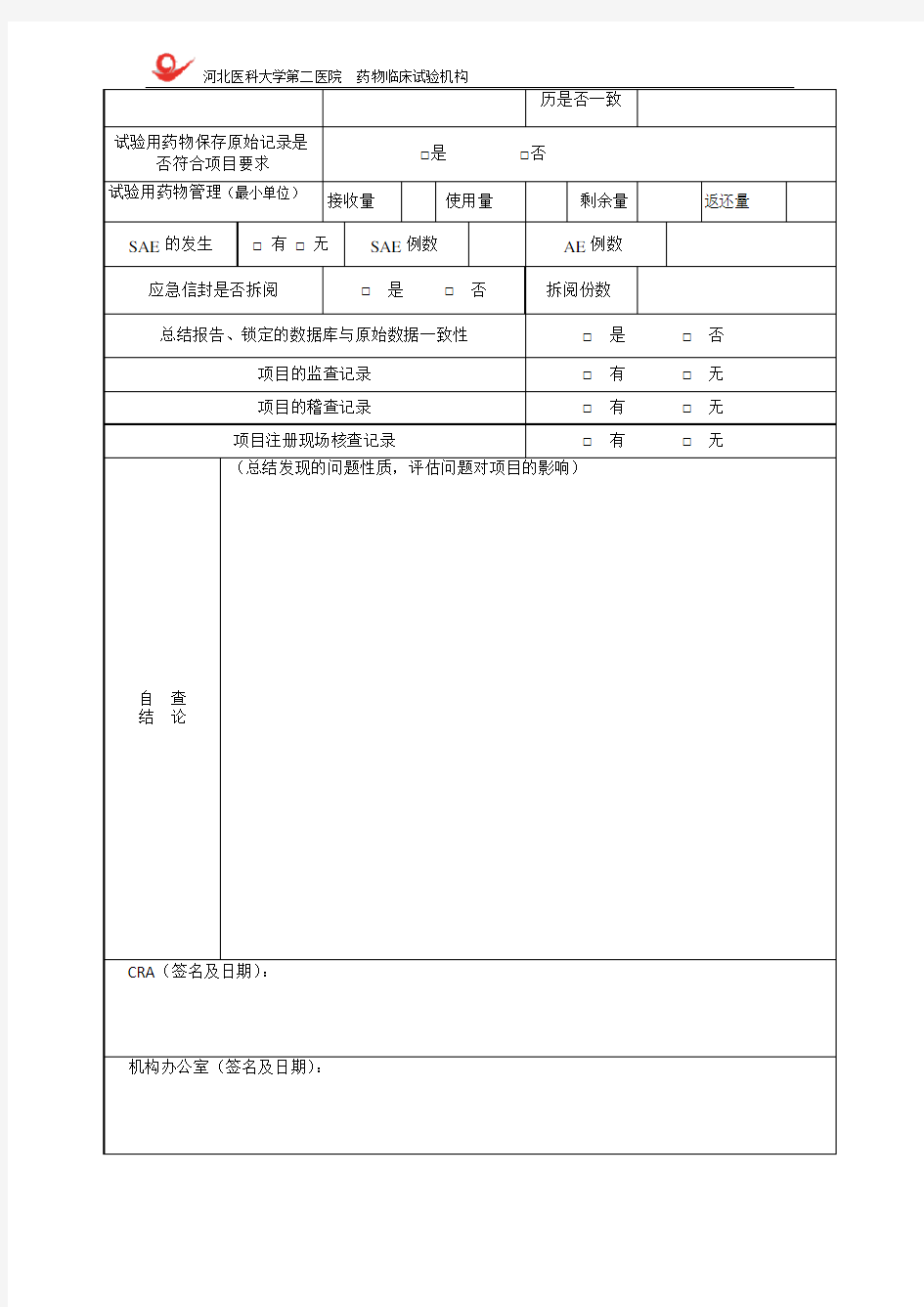
生产注册申请的药物临床试验数据自查报告表
药物临床试验源数据管理
药物临床试验源数据管理·广东共识(2018) (广东省药学会2018年9月18日发布) 撰写说明 临床试验数据质量是评价新药有效性和安全性的关键,完整数据链贯穿临床试验全过程。数据溯源是对数据的追本溯源,以实现对历史数据的重现。在临床试验中,源数据是作为溯源依据的数据,源文件是承载源数据的原始文件。临床试验产生的数据有其特殊性,数据类别较多、载体多样且保存方式各异。 自开展临床试验数据现场核查以来,药监管理部门不断强调临床试验数据的产生、收集、记录和报告过程应真实、完整和准确。目前,对于临床试验中涉及源数据/源文件的记录、内容完整性、载体形式、授权人员、设备确证、可靠储存手段等要求,申办方/CRO、研究者、试验机构管理人员等各方仍存在认识的差异,或是并未引起足够的关注。基于源数据质量的重要性,广东省药学会药物临床试验专业委员会组织有关专家撰写《药物临床试验源数据管理·广东共识》,以阐明源数据/源文件的记录与修改要求,规范源数据/源文件等载体的保存,以及研究各方在源数据管理方面应该承担的责任。 本共识参考了药监管理部门颁布的相关管理规范,结合数据现场核查案例,且在起草和征集意见阶段得到业内诸多专家的指导,在此向各位同道的无私帮助表示衷心感谢!本共识可能存在不少缺漏和尚需完善之处,期待业内同道继续提出宝贵建议和意见。 共识撰写小组 2018年8月31日
1源数据定义 源数据(SourceData)指临床试验中的原始记录或其复印件(核证副本)上记载的所有信息,包括临床发现、观测结果以及用于重建和评价临床试验所必须的其他相关活动记录[1]。 在临床医疗实践中,同一事件的数据可能会由不同人获取并记录(如临床护士和研究医生可能都会采集试验中受试者的生命体征并分别记录在护理单和病历中,或由同一人获得并记录在不同的地方,如研究人员将采集的生命体征分别记录在临床病历和受试者文件中),为确证病例报告表(CRF)所记录数据的有效来源,应在临床试验开始前,采用“源数据鉴认表”(见附录1)与研究者确认完整的原始记录来源;另外,为确保临床试验的源数据得到完整、规范、准确的记录,可参考“原始文件记录建议”(见附录2)及对研究者进行培训和沟通。 2源文件的定义及类别 源文件的定义 源文件(SourceDocuments)指临床试验中产生的原始医学记录、医疗文件和数据。源文件包含了源数据,如医院病历、医学图像、实验室记录、临床试验的相关备忘录、受试者临床试验日记或评估表单、发药记录、仪器自动记录的数据、缩微胶片、照相底片、磁介质、X光片,及药房保存的处方、实验室和医技科室的相关文件和记录,包括复制或抄录的核证副本。源文件可以是纸质的和/或电子的[1]。临床试验中原始文件是指初次记录临床观察的文件,比如试验过程的文字记录、研究者开具的治疗方案、知情同意书等一系列文件等;或承载实验室检查及影像检查数据的文件,如血常规结果报告单及CT片等。有纸质形式和电子形式或可能的其他形式[2]。 当原件不利于保存(例如热敏纸)、不便获得或丢失时,会采用核证副本作为源文件。核证副本指经核实的(如注明日期的签字或通过可验证的程序产生的),与原始记录信息相同的副本,并须有合理的解释说明。 源文件的类别 常规医疗文件(MedicalRecord)根据卫健委医疗病历管理要求,患者的就诊记录可分为两大类:住院病历及门(急)诊病历。具体内容可参考《医疗机构病历管理规定》。符合《电子病历应用管理规范》的电子病历也属于此类,打印存档的纸质病历应与电子病历一致。这些文件通常包含患者隐私和可识别信息。
医疗器械临床试验病例报告表1
编号:□□□□ 患者姓名拼音缩写:□□□□ 病例报告表 (Case Report Form,CRF) 患者姓名拼音缩写:□□□□ 试验编号:□□□□ 医院名称: 研究者签名: 申办单位:
病例报告表填写要求 1、所有记入本手册的数据需对照原始资料进行核查 2、用签字笔填写,中文字应清晰可辨,英文字母需大写 3、每格填写一个字,不适用的空格,请填“/” 4、选择项请打“√” 5、填写错误修改时,用单线划掉,切毋涂抹,原字迹需清晰可辨,并签名和注明修改时间 6、患者的姓名不得出现在本病例报告表中,患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字二字母,四字姓名填写每一个字的首子母。举例:张红ZHHO,张红旗ZHQI 欧阳予黄OYYH。 7、日期填写为:□□□□年□□月□□日。
一、入选标准: 1、年龄18~65岁,性别不限;□是□否 2、创面面积小于体表面积的50%;□是□否 3、签署知情同意书;□是□否如以上任何答案为“否”,则该病人不能入选 二、排除标准: 1、年龄小于18岁或大于65岁;□是□否 2、有严重心、脑、肝、肾功能不全的患者;□是□否 3、严重营养不良的患者;□是□否 4、创面面积大于体表面积50%的患者;□是□否 5、有精神疾病的患者以及无自知力、不能确切表达者。□是□否 如以上任何答案为“是”,则该病人不能入选 观察医师签名:日期年月日
受试者一般资料 姓名:□□□□性别:男□女□年龄:□□岁 出生日期:□□□□年□□月□□日 体重:□□□㎏病例号:□□□□□□ 创面资料: 创面原因:□火焰□热液□化学□电烧伤□其他创面形成时间:□□月□□日创面部位: 创面面积:□□□□cm2肉芽:无□有□
临床试验数据管理工作技术指南51577
附件 临床试验数据管理工作技术指南 一、概述 临床试验数据质量是评价临床试验结果的基础。为了确保临床试验结果的准确可靠、科学可信,国际社会和世界各国都纷纷出台了一系列的法规、规定和指导原则,用以规范临床试验数据管理的整个流程。同时,现代新药临床试验的发展和科学技术的不断进步,特别是计算机、网络的发展又为临床试验及其数据管理的规范化提供了新的技术支持,也推动了各国政府和国际社会积极探索临床试验及数据管理新的规范化模式。 (一)国内临床试验数据管理现状 我国的《药物临床试验质量管理规范》(Good Clinical Practice,GCP)对临床试验数据管理提出了一些原则要求,但关于具体的数据管理操作的法规和技术规定目前还处于空白。由于缺乏配套的技术指导原则,我国在药物临床试验数据管理方面的规范化程度不高,临床试验数据管理质量良莠不齐,进而影响到新药有效性和安全性的客观科学评价。此外,国内临床试验中电子化数据管理系统的开发和应用尚处于起步阶段,临床试验的数据管理模式大多基于纸质病例报告表(Case Report Form,CRF)的数据采集阶段,电子化数据采集与数据管理系统应用有待推广和普及。同时,由于缺乏国家数据标准,同类研究的数据库之间难以做到信息共享。
(二)国际临床试验数据管理简介 国际上,人用药品注册技术要求国际协调会议的药物临床研究质量管理规范(以下简称ICH E6 GCP)对临床试验数据管理有着原则性要求。对开展临床试验的研究者、研制厂商的职责以及有关试验过程的记录、源数据、数据核查等都直接或间接地提出了原则性的规定,以保证临床试验中获得的各类数据信息真实、准确、完整和可靠。 各国也颁布了相应的法规和指导原则,为临床试验数据管理的标准化和规范化提供具体的依据和指导。如:美国21号联邦法规第11部分(21 CFR Part 11)对临床试验数据的电子记录和电子签名的规定(1997年),使得电子记录、电子签名与传统的手写记录与手写签名具有同等的法律效力,从而使得美国食品药品管理局(FDA)能够接受电子化临床研究材料。据此,美国FDA于2003年8月发布了相应的技术指导原则,对Part 11的规定作了具体阐释,并在计算机系统的验证、稽查轨迹,以及文件记录的复制等方面提出明确的要求。 2007年5月,美国FDA颁布的《临床试验中使用的计算机化系统的指导原则》(Guidance for Industry: Computerized Systems Used in Clinical Investigations)为临床试验中计算机系统的开发和使用提供了基本的参照标准。 而且由国际上相关领域专家组成的临床试验数据管理学会(Society of Clinical Data Management, SCDM)还形成了一部《良好的临床数据管理规范》(Good Clinical Data Management Practice,GCDMP),该文件为临床试验数据管理工作的每个关键环节都规
参考新药临床试验数据管理研究
新药临床试验数据管理研究 摘要新药临床试验数据管理作为新药研发的重要组成部分,在整个新药研发的工作中起着至关重要的作用。高质量的数据不仅是正确评价药物安全性和有效性的基础和依据,更是规范化高质量临床试验的重要标志。为了提高国内的临床数据规范化管理水平,尽快与国际的GCP(Good Clinical Practice)规范和先进的临床数据管理规范接轨,真正能够获取高质量的数据进行了本次研究。 本文分析了临床试验数据管理的研究现状,阐述了临床试验数据管理的具体内容、特征和临床试验数据产生全过程,综述了临床数据管理计划以及新药临床试验数据管理规范体系。回顾了国内外新药临床数据管理的发展历程,分析了国内传统“纸质”临床试验数据管理中存在的不足,探讨了目前临床试验数据管理的电子化系统包括电子数据采集、电子病例报告表的应用,提出在我国电子化临床试验数据管理的必要性和重要性,构建了电子化临床试验数据管理的设想,为提高新药临床试验数据管理的质量、效率和低研究成本开展了有益的尝试。 关键字临床试验数据管理临床试验数据管理临床试验数据管理计划临床试验数据管理电子化
The research of new drug clinical trial data management Abstract Clinical trial data management is the important component of clinical trial, which plays crucial role in the whole process in the clinical trial. Now not only true evaluation of the safety and effectiveness of new drug, but also high qualified clinical arises from the clean and high quality data. In order to improve the domestic standardized management level of clinical data, join the international GCP standards and advanced clinical data management, can make the high quality of data. This article discusses the background of the clinical trial data management, the contents of the clinical trial data management and the generation of clinical trial data, explains the clinical data management plan and the clinical data management standard system. Then it review s the development and current status of clinical data management home and abroad and analysis the deficiencies of domestic traditional "paper- based clinical trial data management. It discusses the current clinical trial data management system including the electronic data acquisition, electronic case reports, the application of electronic signature, etc. At last, it Analysis of the opportunities and challenges faced by the domestic new drug clinical trial data management. Key words C linical Trial Data Management Clinical Trial Data Management Clinical Data Management Plan Clinical Trial Data Management Electronic System.
临床研究病例报告表
XXXXXXXXXXXXXXX XXXXXXXXXXXXXXXX XXXXXXXXXXXXX 临床研究病例报告表 (X日用药) 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日
填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。 4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。 6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。
试验观察流程图 入组筛选表
1.受试者应为: ?年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周内曾参加过其他临床试验 ?正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时内用过XX类镇痛药,或5日内用过XXX ?癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗 ?呼吸抑制、(肺)气道阻塞或组织缺氧 ?胆道疾病 ?心脏疾患(即Ⅱ级和Ⅱ级以上心功能) ?血压高于正常值 ?血液系统疾病 ?肝、肾功能明显异常(即指标高于正常值一倍以上) ?脑部疾病,判定能力异常 ?XX药耐受、过敏,或曾在使用时因不良反应停药 ?药物及∕或酒精滥用 ?孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 医生签名:______日期____年___月___日 病历简况 1.1检查日期:年月日
医疗器械临床试验病例报告表范本
附件3 医疗器械临床试验病例报告表范本试验项目名称:受试者病例号:试验用医疗器械编号:临床试验机构(或编号):临床试验 方案编号:临床试验方案版本号和日期:试验开始日期:年 月日随访结束日期:年月日记录人签名: 1 填表说明: 1. 每项内容填写应当准确、完整、及时、可读。 2. 记录的试验数据和信息应当与原始文件一致。 3. 填写内容不得随意更改,如发现内容有误,应当在原记录上划单横线,不得用任何方式掩盖,并在旁边注明正确内容及修改原因,由研究者签名并注明日期。 2 一、受试者病历简况 1.签署知情同意日期年月日入组日期年月日2.受试者姓名缩写及鉴认代码 3.出生日期年月 4.性别男□ 女□ 5.临床诊断 6.接受的诊断/治疗方式(既往病史、用药和/或手术) 7.入组前基础症状 8.入组时体格检查、实验室检查二、符合入选/排除标准三、诊断/治疗情况记录四、随访情况记录五、一般情况观察记录(伴随疾病/药物)六、不良事件记录表如果在试验期间没
有不良事件发生,请在此□中打“×”,并在此表下方签名。如有请用标准医学术语记录所有观察到的不良事件(包括直接询问出的)。每一栏记录一个不良事件。不良事件描述开始发生时间1结束时间不良事件□阵发性发作次数□□特点□持续性 3 □ 轻不良事件记录□ 中2报告及程度□ 重报告有□ 无□ 严重不良事件□是□否□ 肯定有关□ 很可能有关与试验□ 可能有关的关系□ 可能无关□ 无关□消失后遗症有□ 无□ 转归□继续□死亡□是□否纠正治疗因不良事件而□是□否退出试验 1. 如果不良事件仍存在,请不要填写此项。 2. 程度: 症状按轻(询问出);中(主动叙述但能忍耐);重(有客观备注表现,难忍耐)填写。七、严重不良事件和器械缺陷记录八、试验方案的偏离情况记录九、试验完成情况十、声明此病例报告表中的信息记录真实、准确,符合试验方案的要求,特此声明。研究者签名:年月日 4
临床试验递送资料目录(药物类别)
临床试验递送资料目录(药物类别)
备注: 1.文件夹请使用打孔的硬皮文件夹; 2.药品类须提供所有研究者履历(签名)及所有成员的GCP证书复印件; 3.伦理批件:提供组长单位的批件(必要时提供其他参加单位伦理批件); 4.按要求注明版本号及日期,所有文件若有英文版本则一并提供中文翻译版本; 5.所有材料一式三份,并加盖申办方及CRO红章,超过一页须同时加盖骑缝章。清单中所列项目请按原 顺序装订,并用分页纸隔开,没有的项目注明不适用或无,但不能删除; 6.递交信要求:抬头是:北京大学深圳医院药物临床试验伦理委员会。落款是主要研究者。申办方或CRO 在空白处盖章。(在一页纸内写清楚方案的研究背景、方法、受试者例数、研究中心情况、目前进展情况、本院承担例数、受试者获益和风险、药物检查是否免费等内容) 7.另有增加的项目请续在最后; 8.提供电子版文件一份; 9. 受理申请表只需递交一份。
临床试验递送资料目录(器械及诊断试剂类别) 资料递交说明:1.文件夹请使用打孔的硬皮文件夹;2.伦理批件:提供其他参加单位伦理批件;3.按要求注明版本号;所有文件若有英文版本则一并提供中文翻译版本;4.所有材料一式三份,并加盖申办方及CRO红章,清单中所列项目请按原顺序装订,并用分页纸隔开,没有的项目注明不适用或无,但不能删除;5另有增加的项目请续在最后;6递交信要求:抬头是:北京大学深圳医院药物临床试验伦理委员会。落款是主要研究者。申办方或CRO在空白处盖章。(在一页纸内写清楚方案的研究背景、方法、受试者例数、研究中心情况、目前进展情况、本院承担例数、受试者获益和风险、药物检查是否免费等内容);7.提供电子版文件一份;8.立项申请表只需递交一份。
药物临床试验数据管理与统计分析的计划和报告指导原则
附件 药物临床试验数据管理与统计分析的 计划和报告指导原则 一、前言 规范的数据管理计划有助于获得真实、准确、完整和可靠的高质量数据;而详细的统计分析计划则有助于保证统计分析结论正确和令人信服。为保证临床试验数据的质量和科学评价药物的有效性与安全性,必须事先对数据管理工作和统计学分析原则制定详细的计划书。在试验完成时,对试验中的数据管理和统计分析工作进行全面完整的总结至关重要,通过数据管理报告真实反映临床试验过程中的数据质量和试验样本特征,通过统计分析报告为临床试验总结报告的内容和研究结论提供主要依据。因此,在药物上市注册时,监管部门将数据管理计划和报告与统计分析计划和报告视为评价临床试验结果的重要文件和依据。 虽然我国《药物临床试验质量管理规范》(Good Clinical Pr actice,GCP)中对药物临床试验数据管理与统计分析进行了原 则要求,且国家食品药品监督管理总局已发布的有关药物临床试验及其统计学的相应技术指南也涉及数据管理和统计分析工作的主要环节,但针对数据管理计划和报告、统计分析计划和报告却没有详细的技术规范和指导性建议。因此,本技术指导原则对此进行了较为详细的介绍和阐述,并提出具体要求,旨在为临床试验的数据管理和统计分析人员提供技术指导,帮助其更好地完
成相关工作以达到监管要求。 二、数据管理的计划和报告 (一)一般考虑 数据管理计划(Data Management Plan, DMP)是由数据管理人员依据临床试验方案书写的一份动态文件,它详细、全面地规定并记录某一特定临床试验的数据管理任务,包括人员角色、工作内容、操作规范等。数据管理计划应在试验方案确定之后、第一位受试者筛选之前定稿,经批准后方可执行。通常数据管理计划需要根据实际操作及时更新与修订。 数据管理工作涉及多个单位或业务部门,包括数据管理、临床研究者、统计分析、医学事务、临床监查、临床稽查等单位或部门。数据管理的职责可分为负责、参与、审核、批准、告知等,各单位/部门在数据管理各步骤的职责不尽相同。数据管理计划需明确参与数据管理的相关组织及人员职责。数据管理各步骤需建立并遵循相应的标准操作规程(Standard Operation Procedure,SOP),数据管理计划应列出项目所遵循的SOP清单。 数据管理报告是在临床研究结束后,数据管理人员撰写的研究项目数据管理全过程的工作总结,是数据管理执行过程、操作规范及管理质量的重要呈现手段。通常以定性和定量的参数来表达,如数据量、疑问数等,并与数据管理计划一起作为药物注册上市的申请材料提交给监管部门用于对临床试验结果的评价。 (二)数据管理计划的基本内容 数据管理计划应全面且详细地描述数据管理流程、数据采集与管理所使用的系统、数据管理各步骤及任务,以及数据管理的质量保障措施。
临床试验数据管理工作技术指南【最新版】
临床试验数据管理工作技术指南 一、试验数据的标准化 1.1 临床数据标准化的现状与发展趋势 近些年来随着国家大力推动医疗机构进行信息化建设,医院信息系统建设发展迅速,电子病历作为医院信息系统的重要组成部分,其应用也正成为一种趋势。但是,信息标准化的问题已经成为医疗卫生信息化进一步发展的瓶颈。目前在建立区域医疗信息化过程中存在系统分割、业务流程不统一、信息系统孤岛等问题。在医学研究领域,各医院、科研院所等都积累了大量丰富的临床数据,但不能互相共享利用。所以,为了实现跨机构、跨区域、跨领域的临床数据资源互联互通、共享利用,必须研究建立统一的临床数据标准体系。 我国标准化研究起步较晚,随着加入WTO,以及贸易全球化和经济集团化、高新技术的迅猛发展,优先借鉴和引用国际标准(ISO[1]、IEC[2]及ITU[3]的标准以及被ISO认可收入KWIC索引[4]的其它25个国际组织制定的标准)和国外先进标准(未经ISO确认并公布的其它国际组织的标准、发达国家的国家标准、区域性组织的标准,国际上有权威的企业公司标准中的先进标准)已经成为发展趋势。与临床数据相关的国际标准和国外先进标准包括:(1)数据/信息交换标准,
如医院信息传输协议HL7、临床数据交换标准CDISC、放射影像信息交换标准DICOM等;(2)医学术语及代码标准,如实验室检查结果代码LONIC、临床医学术语SNOMED、疾病诊断分类代码ICD-10等;(3)临床医学文档标准,如临床文档结构标准CDA等;(4)临床医学概念标准,如HL7信息模型RIM等。 1.2 临床试验的数据标准化 临床试验数据标准化的意义在于: l标准化的数据格式是临床试验数据管理系统与临床试验机构建立医疗信息互通性的基础。 l在申办者内部不同研究之间建立无缝数据交换,并为申办者之间的交流,申办者与药物评审机构之间的交流提供便利。 l便于各临床试验的药物安全性数据共享。 l方便元数据(Meta Data)的存储和监管部门的视察,为不同系统和运用程序之间数据的整合提供统一的技术标准。 l为评审机构提供方便,从而缩短审批周期。
(完整)医疗器械临床试验病例报告表
(完整)医疗器械临床试验病例报告表 编辑整理: 尊敬的读者朋友们: 这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)医疗器械临床试验病例报告表)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。 本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)医疗器械临床试验病例报告表的全部内容。
编号:□□□□ 患者姓名拼音缩写:□□□□ 产品名称*****(商品名:***) 的安全性和有效性研究 病例报告表 (Case Report Form,CRF) 患者姓名拼音缩写:□□□□ 试验编号:□□□□ 医院名称: 研究者签名: 申办单位:上海******有限公司
病例报告表填写要求 1、所有记入本手册的数据需对照原始资料进行核查 2、用签字笔填写,中文字应清晰可辨,英文字母需大写 3、每格填写一个字,不适用的空格,请填“/" 4、选择项请打“√" 5、填写错误修改时,用单线划掉,切毋涂抹,原字迹需清晰可辨,并签名和注明修改时间 6、患者的姓名不得出现在本病例报告表中,患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字二字母,四字姓名填写每一个字的首子母。举例:张红ZHHO,张红旗ZHQI 欧阳予黄 OYYH. 7、日期填写为:□□□□年□□月□□日。
一、入选标准: 1、年龄18~65岁,性别不限;□是□否 2、创面面积小于体表面积的50%;□是□否 3、签署知情同意书; □是□否 如以上任何答案为“否”,则该病人不能入选 二、排除标准: 1、年龄小于18岁或大于65岁;□是□否 2、有严重心、脑、肝、肾功能不全的患者;□是□否 3、严重营养不良的患者;□是□否 4、创面面积大于体表面积50%的患者;□是□否 5、有精神疾病的患者以及无自知力、不能确切表达者。□是□否 如以上任何答案为“是",则该病人不能入选 观察医师签名: 日期年月日
临床试验数据管理工作指南
临床试验数据管理工作指南 1.研究者认真填写病例报告表(CRF表),保证准确无误。 2.监察员应定期的去各试验中心,确认所有的数据记录、报告正确完整,与原始记录一致,对于完成的CRF表,监察员应及时送至数据管理员处。3.数据管理员在第一份CRF表送达之前准备好数据库(需要保密性强,可靠)。4.数据管理员对CRF表作进一步检查,发生疑问时,填写疑问表(query form)返回监察员,通知研究者作出回答。 5.数据录入:由两个数据录入员分别将数据双份输入计算机数据库中。6.利用软件将两份独立的数据文件进行对比,并对照CRF表进行修改核对。7.质控核对:从全部病例中随机抽取一部分(为5%,但不能少于5份病例)进行人工核对(数据库中数据与CRF表的数据),如果数据错误大于0.15%(10000个数据有15个错误),应对数据库中的全部数据进行人工核对。 8.制定统计分析计划:由生物统计人员配合主要研究者在制定试验方案时写成初稿,在试验的进行中,不断完善分析计划,但必须在数据锁定前定稿。9.盲态审核:数据录入完成后,直到第一次揭盲之前,由主要研究者、生物统计人员、数据管理员和申办者对数据库内数据进行核对和评价。审核内容包括:对统计计划书的修改和确认;对研究方案中主要内容的确认;对全部入组病例和全部数据的确认(包括脱落病例,主要疗效,安全性数据等),盲态审核完后,锁定数据。 10.第一次揭盲:打开第一次揭盲信封,将A、B两组数据进行统计分析。 11.第二次揭盲:在临床试验总结报告会上进行第二次揭盲,参加开盲人员:申办者或申办者委托人、主要研究者、统计分析人员或组长单位临床研究基地负责人等。如试验组与对照组比例不是1:1,则临床试验仅开盲一次。 12.统计单位出具临床试验设盲试验揭盲记录。
临床研究病例报告表三篇
临床研究病例报告表三篇 篇一:临床研究病例报告表 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日 填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留
以上记录副本。 知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。 试验观察流程图
入组筛选表
1.受试者应为: ?年龄:18-70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于 40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周内曾参加过其他临床试验 ?正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时内用过XX类镇痛药,或5日内用过XXX 是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □
临床试验专业负责人授权委托书
临床试验专业负责人授权委托书 即日起,委托同志(身份证号:)作为(项目名称)的主要研究者,遵循药物临床试验质量管理规范(GCP)、国家有关临床试验的法律法规、机构及本专业组的制定的管理制度、标准操作规程及主要研究者职责。 该委托书有效期为20XX年XX月XX日至国家食品药品监督管理总局及卫生行政部门对此项目的最终核查结束。 特此说明! 委托人(签名): 职务:XXXXX 专业负责人 签名日期: 本人XXXXX,同意接受专业负责人的委托,承担(项目名称)的主要研究者的工作,本人清楚并愿意承担此项目临床试验期间的责任。 被委托人(签名): 签名日期:
附件: 专业负责人职责 一、目的 明确药物临床试验专业组负责人职责,提高试验管理水平,保证试验安全、有序、及时、保质保量地完成。 二、范围 肿瘤科专业组负责人。 三、内容 1.熟悉和遵从药物临床试验质量管理规范(GCP)、国家有关临床试验的法律法规、机 构及本专业组的制度和标准操作规范。 2.药物临床试验机构的授权下,负责与申办者的接洽工作和试验项目的洽谈。 3.与申办者和统计人员共同制定临床试验方案、知情同意书和病例报告表。 4.参与临床试验协议的商谈及签订工作。 5.对临床试验全过程负责,确保有良好的医疗设施、实验设备和研究团队来处理临床 试验中的紧急情况。 6.监督试验经费的使用和临床试验进度、合同的履行情况。 7.负责本专业研究人员及资源的调配工作。 8.负责本专业的研究人员的培训。 9.指导研究者对不良事件的处理。 10.督促和监督申办者在临床试验中履行相关的责任与义务。 11.负责完成总结报告或分中心小结报告的撰写工作。 12.接受相关方面的稽查以及卫生监督管理部门的视察。 四、参考资料 国家食品药品监督管理局令第3号发布《药物临床试验质量管理规范》,2003
病例报告表(样板)
碳水化合物交换份法在糖尿病饮食干预中的应用研究多中心随机对照临床试验 病例报告表 (Case Report Form,CRF) □ 01 医院 □ 02 医院 □ 03 医院 □04 医院 受试者姓名(拼音缩写):□□□□ 研究者签名: 申办者:浙江医院
注意事项 1.本试验主要研究者必须经过GCP培训,必须事先充分了解试验方案及有关资料,严格按方案执行,病例筛选合格者按数字随机表分组,不得随意更改分配。 2.筛选合格者填写正式病例报告表,病例报告表填写务必准确、清晰,不得随意涂改,错误之处纠正时需用双横线居中划出,并签署修改者姓名缩写及修改时间。 3.每页页眉均应填写,其中中心代码填 1,2,3,4等;入组顺序号由各医院按受试者就诊时间顺序填写(入组顺序号的次序应与就诊先后时间及住院号顺序相符合); 随机对应号请按试验设计要求填写;受试者姓名拼音缩写四格应填满,两字姓名按每个字前两个字母填写;三字姓名按每个字的首个字母和第三个字的第二个字母填写;四字姓名按每个字的首个字母填写。举例:张红 ZHHO 李书名 LSMI 欧阳小惠 OYXH 4.血糖因故未查或漏查,应填写ND。 5.填写数字时应将□都填满,位数不够的靠右侧填写,左侧空出填“0”。如□0□4。
入组选择表 请回答以下问题 纳入标准是否无关1. 2014年6月-2016年6月收治内分泌科被诊断为2型 □□□糖尿病患者; 2. 年龄在18~80岁之间;□□□ 3. 确诊2型糖尿病1年以上□□□ 4. 受试者自愿参加研究并己签署知情同意书□□□ 5. 神志清,可自行进行饮食控制;□□□ 上述问题任一回答是“否”时,该病例不能纳入研究 排除标准是否无关 1. 预计住院时间不满3天□□□ 2. 近期接受过大手术或任何一项超过2小时的手术□□□ 3. 正在接受糖皮质激素治疗者□□□ 4. 正在接受肠内或肠外营养□□□ 5. 肝、肾功能障碍及其他禁忌症□□□ 6. 糖尿病酮症酸中毒□□□ 7. 妊娠期女性□□□ 8. 不愿意接受饮食管理或无法签署知情同意书者□□□ 上述问题任一回答是“是”时,该病例不能纳入研究 研究者签名日期□□□□年□□月□□日
临床试验数据管理工作的主要内容
临床试验数据管理工作的主要内容 在进行临床试验数据管理之前,必须由数据管理部门根据项目实际情况制定数据管理计划(DMP ,Data Management Plan)。数据管理计划应包括以下内容和数据管理的一些时间点并明确相关人员职责。 1 CRF的设计与填写 1.1 CRF的设计 临床试验主要依赖于CRF来收集试验过程中产生的各种临床试验数据。CRF的设计必须保证收集试验方案里要求的所有临床数据。CRF的设计、制作、批准和版本控制过程必须进行完整记录。CRF的设计、修改及最后确认会涉及多方人员的参与,包括申办者、申办者委托的CRO、研究者、数据管理和统计人员等。一般而言,CRF初稿由申办者或CRO完成,但其修改与完善由上述各方共同参与,最终定稿必须由申办者或申办者委托的CRO完成。 1.2 CRF填写指南 CRF填写指南是根据研究方案对于关键字段和容易引发歧义的条目进行特定的 填写说明。CRF填写指南可以有不同的形式,并可以应用于不同类型的CRF或其他数据收集工具和方式。对于纸质CRF而言,CRF填写指南应作为CRF的一部分或一个单独的文档打印出来。对电子CRF或EDC系统而言,填写指南也可能是针对表格的说明,在线帮助系统,或是系统提示以及针对录入的数据产生的对话框。保证临床试验中心在入选受试者之前获得CRF及其填写指南,并对临床试验中心相关工作人员进行方案、CRF填写和数据提交流程的培训,该过程需存档记录。 1.3 注释CRF 注释CRF 是对空白的CRF的标注,记录CRF各数据项的位置及其在相对应的数据库中的变量名和编码。每一个CRF中的所有数据项都需要标注,不录入数据库的数据项则应标注为“不录入数据库”。注释CRF作为数据库与CRF之间的联系纽带,帮助数据管理员、统计人员、程序员和评审机构了解数据库。注释CRF 可采用手工标注,也可采用电子化技术自动标注。 1.4 CRF的填写 临床研究者必须根据原始资料信息准确、及时、完整、规范地填写CRF。CRF数据的修改必须遵照标准操作程序,保留修改痕迹。
临床试验—病例表
甘露聚糖肽注射液辅助治疗恶性肿瘤的安全性和有效性的随机、双盲、与安慰剂平行对照、多中心临床再评价试验 病例报告表 (Case Report Form) 受试者缩写□□□□ 药物编号:□□□ 试验中心编号:□□ 试验开始日期年月日
填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。 4.每项填写容务必准确,不得随便涂改,如发现填写容有误,应在原记录上划单横线,在旁边写明正确容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。 6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。
试验观察流程图 -6 17 -1
入组筛选表 1.受试者应为: ?年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周曾参加过其他临床试验 ?正在服用或本试验开始前2周曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时用过XX类镇痛药,或5日用过XXX ?癌痛骨转移患者,近4周接受同位素放疗或/和双磷酸盐类药物治疗 ?呼吸抑制、(肺)气道阻塞或组织缺氧 ?胆道疾病 ?心脏疾患(即Ⅱ级和Ⅱ级以上心功能) ?血压高于正常值 ?血液系统疾病 ?肝、肾功能明显异常(即指标高于正常值一倍以上) ?脑部疾病,判定能力异常 ?XX药耐受、过敏,或曾在使用时因不良反应停药 ?药物及∕或酒精滥用 ?孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 医生签名:______日期____年___月___日 病历简况
药物临床试验协议(模板)
SOP MED-A-09
大连医科大学附属第二医院 药物临床试验协议(模板)
试验药物医学名称: 临床试验方案号: 试验名称/目的: 国家食品药品监督管理局批准文号: 伦理委员会批准文号: 研究机构:大连医科大学附属第二医院 研究者: 申办方: 申办方研制的 XXXXXX(药品名)已获得新药临床试验批件(批 件号: 有效期起止日期 ),现需要进行 x 期多中
心临床研究(以下简称“临床研究”或“研究”)。这项临床研究将 由 XXX 教授作为大连医科大学附属第二医院本项目领衔研究者, 与其 他中心参加单位一起执导进行。 申办方委托 XX 公司作为 CRO 对该项 临床试验提供某些服务 在平等互利的基础上,双方对研究中涉及的主要条款达成以下一
方案号 KRN321-C-002/合同/第 1 版/版本日期:2013 年 1 月 24 日
Version 6.0/24 Feb 2012 template Page: 1 of 12
Confidential
SOP MED-A-09
致协议。 1. 保密责任 研究方有责任对申办者提供的任何研究资料以及在研究中得 到的试验数据保密,在得到申办方书面同意的基础上方可向第三方 公开。 2. 文章发表 申办方将负责发表文章事宜。如有必要就此项研究发表文章, 申办方将和研究者讨论有关研究结果的文章所发表的杂志及计划 时间。 3. GCP 双方在进行临床研究时需遵循国家药品监督管理局制定的 GCP 原则,中华人民共和国颁布的各项法律、法规和规章制度及 Helsinki 宣言。 4. 研究方案和研究手册 申办方将为研究者提供所研究药物背景的研究者手册。临床方 案经双方签字和经 CFDA 审批同意后,方可开展临床试验。对方案 的任何改动须经主要研究者、申办方、伦理委员会等各方的一致书 面同意。研究者、申办方、监查员在临床试验操作过程中需严格遵 守方案。 5. 伦理委员会 研究者在开展临床试验前须得到伦理委员会的正式批准。研究
方案号 KRN321-C-002/合同/第 1 版/版本日期:2013 年 1 月 24 日
Version 6.0/24 Feb 2012 template Page: 2 of 12
Confidential
病例报告表(CRF)记录标准操作规程
病例报告表(CRF)记录标准操作规程 1.目的:为加强对药物研究的监督管理,保证药物临床病历报告表记录真实、规范、完整,提高药物临床试验的质量,根据《中华人民共和国药品管理法》、《国家档案法》以及药物申报和审批中的有关要求,制订本规程。 2.凡在我机构进行的药物临床试验,其病例报告表记录均应遵循本操作规程。 3.药物临床试验病例报告表是指按试验方案所规定设计的一种文件,用以记录每一名受试者在试验过程中的数据。每位受试者在试验中的有关资料均应记录于病例报告表中。 4.病例报告表记录的基本要求:真实、及时、准确、完整、规范,防止漏记和随意涂改。不得伪造、编造数据。为确保达到以上要求,记录时需注意以下事项: 4.1病例报告表中的数据来自原始文件并与原始文件一致,试验中的任何观察、检查结果均应及时、准确、完整、规范、真实地记录于病历和正确地填写至病例报告表中,不得随意更改,确因填写错误,作任何更正时应保持原始记录清晰可辨,由更正者签署姓名和时间; 4.2临床试验中各种实验室数据均应记录或将原始报告复印件粘贴在病例报告表上,在正常范围内的数据也应具体记录。对显著偏离或在临床可接受范围外的数据须加以核实。检测项目必须注明所采用的计量单位; 4.3病例报告表必须使用本研究机构统一专用的带有页码编号的病例报告表。病例报告表的幅面,根据需要设定。 4.4病例报告表中记录的内容要有必要的依据。计算机、自动记录仪器打印的图表和数据资料,临床研究中的检验报告书、体检表、知情同意书、试验图片、照片等应按顺序粘贴在病例报告表的相应位臵上,并在相应处注明试验日期和时间;底片装在统一制作的底片袋内,编号后另行保存。用热敏纸打印的试验记录,须保留其复印件。不宜粘贴的,可另行整理装订成册并加以编号,同时在病例报告表相应处注明,以便查对。 4.5病例报告表应保持完整,不得缺页或挖补;如有缺页、漏页,应详细说明原因。 4.6病例报告表的记录不得使用容易擦改的记录工具如铅笔等,宜用钢笔或圆珠笔写。先用铅笔填写,最后根据需要再擦去后用钢笔填写的做法是不可取的。原始资料记录应用字规范,字迹工整。 4.7常用的外文缩写(包括试验试剂的外文缩写)应符合规范。首次出现时须用中文加以注释。病例报告表中属译文的应注明其外文名称。 4.8病例报告表记录应使用规范的专业术语,计量单位应采用国际标准计量单位,有效数字的取舍应符合试验要求。 4.9临床试验过程中所出现的严重不良事件应详细描述和评价。 4.10入选的未按研究方案完成疗程的病例作为脱落病例处理,需说明脱落原因并记录在案,用于分析研究的质量。脱落病例的数目一般不宜超过10%~15%,比例高时表明随机性很差,意味着试验不够成功。 5.为保护受试者隐私,病例报告表上不应出现受试者姓名。研究者应按受试者的代码确认其身份并记录。 6.监查员可在试验的前、中、后期查访试验点和研究者,确认病例报告表中
