二氧化碳和氢氧化钠反应探究!

二氧化碳与氢氧化钠溶液反应考题归类解析
1、化学课上,老师将CO2分别通入澄清石灰水和氢氧化钠溶液中,我们观察到前者变浑,后者没有明显现象,CO2和 NaOH是否发生了化学反应呢?甲、乙两同学设计了右图所示的A、B两个实验来验证,观察到现象是:装置A软塑料变扁,装置B活塞向上运动。(1)甲同学认为这两个实验都可行,其反应原理都可以用化学方程式表示为。
(2)乙同学提出了质疑,他认为这两个实验都不能证明使容器内压强变小的原因是CO2与
反应,还是CO2溶于水,甲同学认为可以补充一个实验来回答该问题,该实验是。(只利用A装置――矿泉水瓶进行)
2、某化学实验小组在探究CO2和NaOH是否发生反应时,小明设计出下列三种装置进行实验:
请回答以下几个问题:
(1)写出上图中标有字母的仪器名称:a ,b 。
(2)以上三个实验中,①③有明显现象,请你帮小明记录他观察到的实验现象:
实验①。实验③。
(3)实验②因选用仪器不当导致未能观察到明显现象,请你帮小明寻找一种物品替代该装置中的广口瓶,以使实验取得成功,你将选用的物品是,改进后能看到的实验现象是。
(4)小余同学提出了质疑,他认为小明实验还不足以证明CO2与NaOH确实发生了反应,其理由是。
(5)小余同学又补充了设计如下实验方案来进一步证明,我来帮他完成:
实验步骤和方法实验现象实验结论
方案1CO2和NaOH确实发生了化学反应
(6)请你再设计一个与上述实验不同原理的实验来证明并检验CO2和NaOH溶液反应生成了Na2CO3,并将有关的实验操作、现象、结论填入下表:
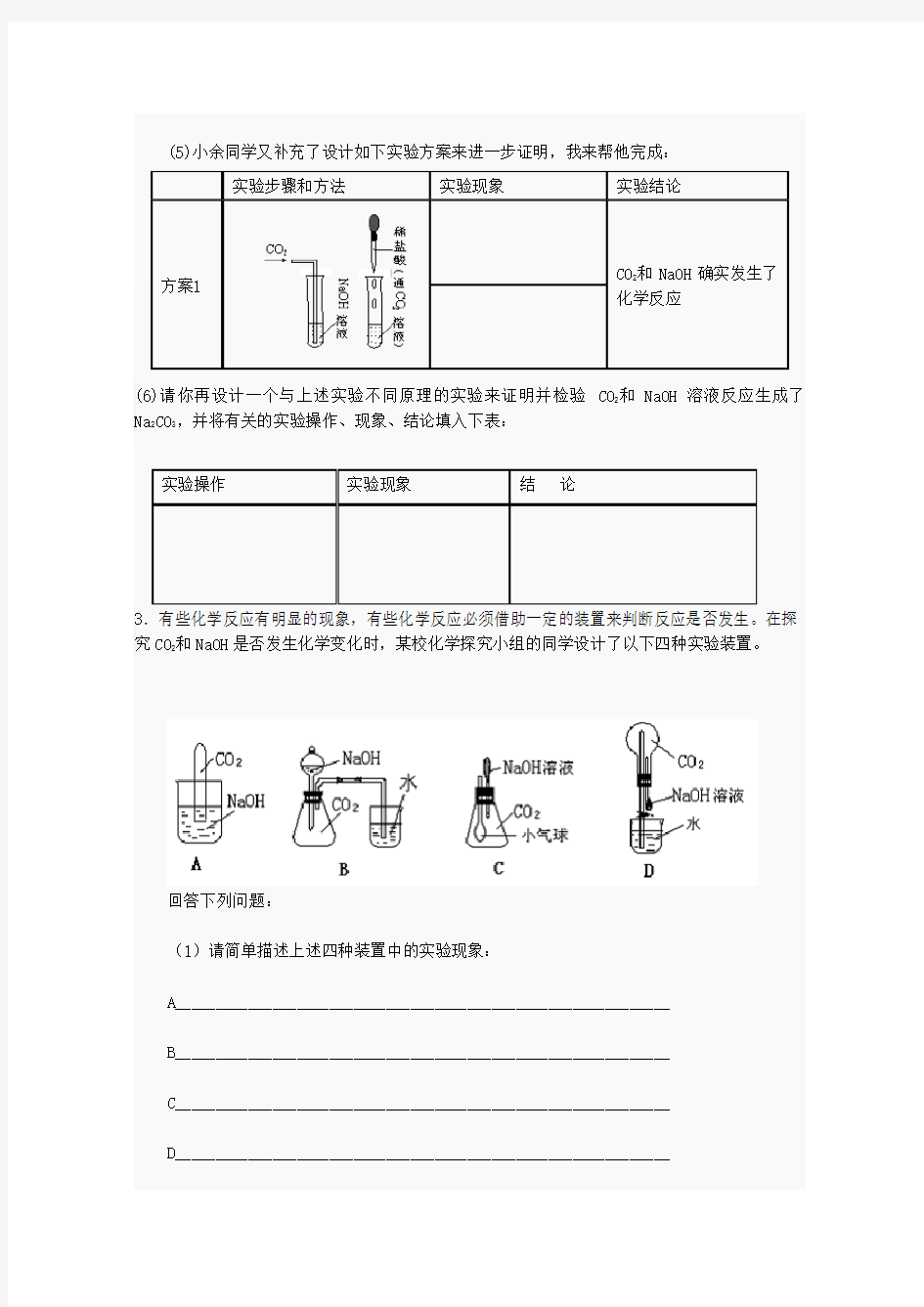
3.有些化学反应有明显的现象,有些化学反应必须借助一定的装置来判断反应是否发生。在探究CO2和NaOH是否发生化学变化时,某校化学探究小组的同学设计了以下四种实验装置。
回答下列问题:
(1)请简单描述上述四种装置中的实验现象:
A_____________________________________________________________
B_____________________________________________________________
C_____________________________________________________________
D_____________________________________________________________
实验操作实验现象结论
(2)上述四种实验设计所依据的共同原理是_________________________________
4、常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有明显的现象变化。某研究小组设计了下列实验装置 (所有装置的气密性良好),试图通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应。
⑴请根据上图实验装置和下表的操作方法,将可能观察到的实验现象填入下表中:
所选
操作方法实验现象
装置
A将充满二氧化碳的试管倒扣在水中试管内的液面略有上升
B将充满二氧化碳的试管倒扣在氢氧化钠溶液中
C将氢氧化钠溶液滴入烧瓶
D将氢氧化钠溶液滴入锥形瓶
E将胶头滴管中氢氧化钠溶液挤入烧瓶
F将分液漏斗中氢氧化钠溶液注入集气瓶中
⑵若再分别向A、B装置的烧杯中滴入少量氯化钙溶液,将会看到的现象是:
A:;B:。
5.化学反应往往伴随着一些现象发生,但CO2与NaOH溶液的反应没有明显的现象。为了通过一些现象说明CO2与NaOH发生了反应,某班同学分两组作了如下探究实验:
(1)第一组同学把一支收集有CO2的试管倒立在装有饱和NaOH溶液的烧杯中(如右图所示),看到试管内液面上升。这种现象是因为试管内外产生()
A.温度差 B.重力差 C.压强差 D.浮力差
(2)第二组同学从中得到启发,也设计了如下实验装置进行探究:
A现象为,B现象为,
C现象为。
(3)同学们经过分析讨论,认为第一组的实验中产生液面上升现象的原因可能有两种。
一种是因为CO2与溶液中的NaOH反应,消耗了CO2,你认为另一种原因是。
(4)为了进一步证实CO2与NaOH溶液已经发生了反应,他们设计了如下方案:取上述实验后的溶液,第一组同学滴加 ,现象为;
第二组同学滴加 ,现象为。他们虽然看到的现象不同,但都可以证实CO2与NaOH溶液已经发生了反应。
6.为了探究二氧化碳能与水发生反应生成具有酸性的物质,A、B两同学分别设计了探究实验的方案。A同学的实验方案是将二氧化碳通入紫色石蕊试液中,观察溶液的颜色变化,如图甲所示。B同学的实验方案是取四朵用石蕊试液染成紫色的干燥的小花,按图乙进行实验,观察小花颜色变化。请你对A、B两同学的实验探究方案进行评价:
①哪个同学的方案更合理:______________,方案合理的理由是 ______________。
②图甲实验中的化学方程式是。
③图乙中第(Ⅰ)(Ⅱ)步骤的目的是说明:。
④图乙中步骤(Ⅲ)的现象是:。
⑤若将图乙步骤(Ⅳ)已经变色的小花从集气瓶中取出,再放到装有浓硫酸的烧杯中有空塑料板上(如右图),一段时间后,现象是:。
参考答案
1.(1) CO2+2NaOH=Na2CO3+H2O
(2)或做个对比实验:取两个同样大的矿泉水瓶充满CO2后,注入同体积的水和NaOH溶液盖上瓶盖振荡,比较两矿泉水瓶变瘪的程度等;(也可图示)
2.(1)a烧杯;b胶头滴管(或滴管)
(2)实验①试管内液面逐渐上升,形成水柱;实验③小气球胀大
3)矿泉水瓶(或其它合理答案);矿泉水瓶变瘪或向内凹进
(4)NaOH溶液中有水,CO2又能溶于水且和水会反应,究竟是CO2溶于水或和水会反应使气压减小的结果?还是CO2与NaOH反应使气压减小的结果?
(5)有气泡产生(实验步骤方法:取反应后的溶液少许于试管中,再逐滴加入稀盐酸)(6)在反应后的溶液中(将CO2通入NaOH溶液后)滴入CaCl2溶液(或石灰水Ca(OH)2溶液或BaCl2溶液或Ba(OH)2溶液……);或在反应后的溶液中滴入稀盐酸;表明CO2与NaOH反应生成了Na2CO3 3、(1)A:溶液进入试管内 B:反应后烧杯内的水会倒吸到锥形瓶中 C:挤压滴管内的氢氧化钠溶液后,小气球会胀大 D:挤压滴管内的氢氧化钠溶液后,会形成喷泉。
(2)因二氧化碳被吸收,盛有二氧化碳的容器内的压强减小,与外界大气压形成压强差。(3)取少量反应后的溶液于试管中,滴入稀盐酸,若有气泡产生,说明有碳酸盐存在,证明二氧化碳同氢氧化钠溶液发生了化学反应。
4.⑴B.试管内的液面明显上升;C.水槽中的水倒吸入烧瓶中;D.盛氢氧化钠溶液的试剂瓶内的长导管口有气泡产生;E.烧瓶内形成喷泉。F.瓶内小气球会胀大。
⑵A:无明显的现象变化;B:产生白色沉淀。
5.(1)C (2)A现象:塑料瓶变瘪了,B现象:鸡蛋进入(或部分进入)瓶中,C现象:气球胀大。(3)CO2溶于水(或与水反应),消耗了CO2;(4)稀酸,冒气泡;CaCl2溶液(含Ca2+或Ba2+的溶液均可),产生白色沉淀。(两种方法不分先后)
6.①B同学的方案合理 B同学进行了几个对比实验,通过观察小花颜色的变化可以说明:紫色石蕊变红不是水的作用,也不是二氧化碳的作用,而是二氧化碳与水反应生成酸的结果;
②CO2+H2O=H2CO3;
③证明醋酸能使紫色石蕊变红,而水不能使紫色石蕊变红;
④紫色小花变红;
⑤红花又变成紫色。
小强和小芳两位同学用下图所示装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发
生反应.
(1)小强关闭k,通入二氧化碳,A、B中均无明显变化.则B中盛放的是氢氧化钙溶液.
(2)小强打开k,继续通入二氧化碳.B中反应的化学方程式为Ca(OH)
2+C02=CaCO3↓+H20;此步实验目的是验证B中盛放的是澄清石灰水.
小芳认为:通常状况下,1体积的水约能溶解1体积的二氧化碳,因此上述实验不足以证明
二氧化碳和氢氧化钠发生了反应.
(3)小芳用洗干净的上述实验装置重新实验,分别量取50mL上述溶液放入A、B中,关
闭k,通入约500mL二氧化碳,A、B中均无明显变化.此实验可以说明二氧化碳和氢氧化
钠发生了反应,其理由是如果没反应,则B中会出现浑浊现象.
(4)请你另外设计一组实验,来证明二氧化碳与氢氧化钠发生了反应.将有关的设计实验
步骤和现象填入下列表格中.
考点:二氧化碳的化学性质;碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙;反应现象和本质
的联系;书写化学方程式、文字表达式、电离方程式。
专题:实验性简答题;实验设计题。
分析:(1)小强关闭k,通入二氧化碳,如果A中为氢氧化钙,则会出现浑浊现象;而A、
B中均无明显变化,则B中一定为氢氧化钙.
(2)二氧化碳与澄清石灰水反应,出现浑浊现象.
(3)说明二氧化碳和氢氧化钠发生了反应,如果没反应,则B中会出现浑浊现象.
(4)将二氧化碳通入氢氧化钠,过一会儿;再向其中注入一定量的氯化钙溶液,如果出现浑浊现象,则证明二氧化碳和氢氧化钠发生了反应.
解答:解:(1)二氧化碳与氢氧化钙反应生成白色沉淀碳酸钙,所以会出现浑浊现象.(2)利用现象,得出本质:Ca(OH)2+C02=CaCO3↓+H20
(3)A、B中均无明显变化.则二氧化碳已与氢氧化钠反应,否则B中会出现浑浊现象.(4)二氧化碳和氯化钙不反应,但碳酸钠溶液和氯化钙溶液反应,生成白色沉淀.
故答为:(1)氢氧化钙
(2)Ca(OH)2+C02=CaCO3↓+H20 验证B中盛放的是澄清石灰水
(3)如果没反应,则B中会出现浑浊现象
(4)实验步骤:将二氧化碳通入氢氧化钠,过一会儿;再向其中注入一定量的氯化钙溶液实验现象:出现浑浊现象.
点评:掌握反应现象与本质的联系,了解碱的化学性质;正确书写化学方程式.(2010?泰州)某兴趣小组对氢氧化钠固体暴露在空气中的变质情况进行了研究.把一小块固体氢氧化钠放在表面皿里,长时间暴露在空气中,发现其固体表面逐渐湿润,部分溶化成液体后又逐渐形成晶体,最终变成粉末.请回答兴趣小组产生的下列问题:
(1)实验室中,氢氧化钠固体应怎样保存?密封保存.
(2)氢氧化钠固体暴露在空气中,表面容易变湿,主要原因是什么?氢氧化钠固体吸收水或潮解.
(3)氢氧化钠固体长期暴露在空气中,最终产物主要是什么碳酸钠.
(4)用酚酞试液不能(填“能”或“不能”)检验氢氧化钠变质.为什么碳酸钠溶液也能使酚酞试液变红.
(5)除加酸以外,怎样用其他方法检验氢氧化钠固体已经变质?取试样溶于水,加入CaCl2溶液,有白色沉淀生成.
(6)为了检验氢氧化钠是否已经全部变质,兴趣小组中小薇同学设计了如下实验方案:
准确称取一定质量的变质固体样品,放在右图所示装置中,然后从分液漏斗中加入足量的盐酸,用排水法收集产生的二氧化碳,根据二氧化碳的体积和密度计算变质产物的质量,确定是否全部变质.
①你认为这个方案不行(填“行”或“不行”).理由是什么?CO2能溶于水不能用排水法集气,用排水法收集误差较大.
②请你另外设计一个方案,并简要说明实验方法和结论.将试样溶于水,加入足量CaCl2(溶液,过滤,在滤液中滴加酚酞试液,,不变色,则氢氧化钠已经全部变质,变红,则部分变质.
铝与氢氧化钠溶液反应
第3课时铝与氢氧化钠溶液的反应 【学习目标】 1. 知道Al与NaOH溶液反应的产物及本质,能正确书写化学方程式和离子方程式。 2. 学会化学方程式计算的一般方法和步骤。 【新知导学】 一、铝与氢氧化钠溶液的反应 铝与强酸和强碱的反应 【归纳总结】 (1) 铝是一种典型________ 金属,既能与酸反应,又能与强碱溶液反应,其反应中都有___________ 生成,反应的还原剂都是________ 。 (2) 在铝与盐酸和氢氧化钠溶液的反应中,铝元素的化合价都是由________ 价变为 _______ 价,当1 mol铝分别与盐酸、氢氧化钠溶液反应时都产生__________ m ol氢气。 【活学活用】 1. 在铝制易拉罐中收集满 CO气体,然后向其中倒入 10 mL浓NaOH溶液,并迅速用胶带将 易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,经过一段时间后,又可以观察 到的现象是________________________________________________________________ 。 试解释易拉罐变瘪的原因:__________________________________________________________
并解释后一现象的原因:_________________________________________________________________
写出反应过程中的两个离子方程式: 2. 铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相 等时,反应中消耗的 HCI和NaOH物质的量之比为() A. 1 : 1 B. 2 : 1 C. 3 : 1 D. 1 : 3 二、物质的量在化学方程式计算中的应用 1 .化学方程式是表示物质间发生化学反应的式子,它必须遵循质量守恒定律,即在反应前后质量守恒、原子种类和数目守恒。在化学方程式中,可反映出物质的质量关系、粒子数目关 系、物质的量关系等。 例如:2Na + 2H2O===2NaCHHf f 质量之比46 g 36 g 80 g 2 g 计量数之比 2 ____ ____ ______ 扩大NA倍 2 2 ______________ _______ 物质的量之比 2 mol _______ ___ ______ 结论:化学方程式中各物质的化学计量数之比,等于_____________ 之比,等于 _______ 之比,在同一条件下也等于_________ 之比。 2 ?物质的量应用于化学方程式计算的基本步骤 将已知物珅址转化旳物炳的址 过听求物黄的WWJ 写出榕摊的北学方程式 柱有蛉狗匪的化学武下而标岀(2如帯和梢U戢 科iiH匕例或 摆据比例_<<榊 简明地育岀答案 例如:2Na + 2H2O===2NaOH + HH 2X 23 g 2 mol 2 mol 22.4 L n(Na) n(H2O) n (NaOH) V(H2) 2 X 2 3 g 2 mol 2 mol 22. 4 L 则有= = =
铝和氢氧化钠的反应
铝和氢氧化钠溶液的反应 教学目标 1. 认识铝既能与盐酸反应,又能与氢氧化钠溶液反应,并掌握反应的实质。 2. 了解金属的一般化学性质和特性,从而对金属的化学性质有一个整体的认识。 3. 培养学生知识综合运用和计算能力。 教学重点 铝与NaOH溶液的反应。 教学内容 【探究实验】 在 2支小试管里分别加入 5 mL盐酸和 5 mL NaOH溶液,再分别放入一小段铝片。观察实验现象。过一段时间后,将点燃的木条分别放在2支试管口,观察现象。 (1)化学方程式及离子方程式: 2Al+6HCl=2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Al+2OH-+2H2O=2AlO2?+3H2↑ 偏铝酸钠
(2)比较这两个反应的异同 相同:铝的化合价升高,变成 +3价,失去电子,铝作还原剂。氢元素的化合价降低,得到电子,转化成 H2。 不同:作氧化剂的物质不同。 (3)铝的特殊性 铝既能跟酸反应产生氢气,又能跟强碱反应产生氢气。 【拓展】 铝与强碱溶液反应的实质 铝和强碱溶液反应(必须是强碱,如NaOH溶液、KOH溶液),不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成氢氧化铝,然后氢氧化铝再和强碱反应生成偏铝酸盐. 反应过程如下: 2×3e- O = 2Al(OH)3+ 3H2↑ 2 Al(OH)3+ NaOH = NaAlO2 + 2H2O - 总反应式:2O+2NaOH = 2NaAlO2 +3H2↑ +4H2O 在此反应中,Al是还原剂,H2O是氧化剂,而不是NaOH.NaOH起的作用只是使生成的Al(OH)3溶解,促进Al和H2O的氧化还原反应.由于弱碱如氨水无法使Al(OH)3溶解,所以Al不能在弱碱中发生反应. 上式可简写为:2Al + 2NaOH + 2H2O =2NaAlO2 + 3H2↑. 【思考】 铝制餐具是否适宜用来蒸煮或长时间盛放酸性和碱性的食物?为什么? 日常生活中,如果用铝锅烹饪,哪些食物会导致铝过量溶出? 知识总结 ①铝与氢氧化钠的反应: ②金属通性:金属的化合价从0价升为正价,金属表现出较强的还原性。正因为多 数金属单质有较强的还原性,所以自然界中多以化合态形式存在只有少数极不活 泼的金属如金等以游离态的形式存在。
铝与氢氧化钠反应经典例题及解析
双基限时练(十二) 金属与酸和水的反应铝与氢氧化钠溶液的反应 基础强化 1.把下列金属投入0.1 mol/L盐酸中,能发生反应且反应最剧烈的是( ) A.Cu B.Fe C.Mg D.Al 解析由金属活动顺序表可知,Fe、Mg、Al能与盐酸反应,而Cu不与盐酸反应,金属越活泼与酸反应越剧烈,在Fe、Mg、Al中,Mg最活泼,反应最剧烈。 答案 C 2.除去镁粉中的少量铝粉,可选用( ) A.硫酸B.氢氧化钠溶液 C.水D.盐酸 解析铝与NaOH溶液反应而镁不与NaOH溶液反应,可以除去。 答案 B 3.等质量的钠、镁、铝分别与足量的盐酸反应,产生H2的质量由大到小的排列顺序正确的是( ) A.Al、Mg、Na B.Mg、Al、Na C.Na、Mg、Al D.Na、Al、Mg 解析因足量的盐酸与等质量的金属反应,则金属完全反应,根据电子守恒,等质量的Na、Mg、Al产生H2的质量由大到小应为Al、Mg、Na,也可根据化学式计算。 答案 A
4.有关Al与NaOH溶液反应的说法中,正确的是( ) A.Al是还原剂,NaOH及H2O均是氧化剂 B.还原产物是H2,且由H2O还原所得的H2与由NaOH还原所得的H2物质的量之比为2:1 C.反应中NaOH是氧化剂,NaAlO2是氧化产物 D.此反应中,只有水是氧化剂,NaOH既不是氧化剂也不是还原剂 解析在Al与NaOH溶液反应中,铝是还原剂,水是氧化剂,NaOH 既不是氧化剂也不是还原剂,NaAlO2是氧化产物,H2是还原产物。 答案 D 5.金属钠着火,能用来灭火的是( ) A. 水 B. 湿抹布 C. 泡沫灭火器 D. 干沙 解析钠与水发生剧烈反应,放出大量的热,且有可燃气体H2产生,不可用水、湿抹布、泡沫灭火器灭火。 答案 D 6.下列离子方程式正确的是( ) A.将钠投入到CuCl2溶液中: 2Na+Cu2+===Cu+2Na+ B.Na与水反应: Na+2H2O===Na++2OH-+H2↑ C.铝和NaOH溶液的反应: 2Al+2OH-+2H2O===2AlO-2+3H2↑ D.铁屑与硫酸的反应: 2Fe+6H+===2Fe3++3H2↑
铝与碱的反应
铝与碱的反应 实验演示 在两个试管里各放入大小相近的铝条,然后分别注入2~3mL 的NaOH容液和KOH溶液,稍加热,观察现象。 实验现象 铝条中注入NaOH或KOH溶液加热一段时间后,都有气体放出。 实验结论在两个试管里各放入大小相近的铝条,然后分别注入2~3mL 的NaOH容液和KOH溶液,稍加热,观察现象。 铝条表面氧化膜与铝都与强碱反应,铝与强碱反应有氢气放出。反应方程式如下: AI2O3+2NaOH=2NaAIO2+H2O 2AI+2NaOH+2H2O=2NaAIO2+3H2 铝与氢氧化钾反应同上。 实验考点 1、铝元素的金属性与非金属性; 2、两性氧化物和氢氧化物的性质。经典考题 1、把镁粉中混有的少量铝粉除去,应选用的试剂是: A、盐酸 B、氨水 C、烧碱溶液 D、纯碱溶液 试题难度:易 2、称取两份铝粉,第一份加入足量的NaOH溶液,第二份加 入足量的盐酸,若放出的氢气的体积相等(同温同压) 。则 两份铝粉的质量比为: A、1:2 B、1:3 C、3:2 D、1:1
试题难度:中 3、如图所示,向MgCI2和AICI3混合溶液中加入a或b时, 沉淀的物质的量与加入a 或b 的体积的关系图为: 以下结论不正确的是: A、混合液中c (AICI3 ): c (MgCI2)= 1: 1 B、c (AICI3 ): c (MgCI2)= 3: 1 C、t之前加NaOH容液,t之后加盐酸 D、盐酸与NaOH容液的物质的量浓度相同 试题难度:难 1 答案: C 2 答案: D 解析: 铝与酸反应和与碱反应的本质相同,都是还原+1 价的 H,反应掉等量的铝,就会生成等量的氢气。 3 答案: B 解析:本题涉及氢氧化铝的两性。反应顺序为金属离子先与碱作用,生成混合沉淀,继续加碱,氢氧化铝溶解;氢氧化铝恰好溶解后,改加酸,先是偏铝酸钠生成氢氧化铝沉淀,然后混合沉淀继续溶解。 铝基本知识介绍 1、自然属性铝是一种轻金属,其化合物在自然界中分布极广,地壳中
铝与氢氧化钠的反应教学设计
教学设计 《金属的化学性质》(第三课时) 一、教材结构和内容分析 1.1、教材地位和作用 本节内容在全章以及在整个中学化学课程中的地位:本章开始学生初步、系统地接触元素化合物知识,内容在化学实验基本方法和化学物质及其变化之后。在本章和本节中,学生初步尝试从实验操作和实验现象去探索(金属)物质化学性质;从基本原理(氧化还原反应原理)去深化对这些性质的理解,这种学习方式的过程和方法一经掌握后,可以驾轻就熟地学习后一章非金属及其化合物的内容。 1.2教学目标 依据新课程理念,本着对教材结构和内容的深刻理解,提出本节教学的目标:1.知识目标:了解金属和碱性溶液的反应,铝与氢氧化钠溶液的反应,探索金属铝的特性, 2. 技能目标:初步学会由一般到特殊的探究方法。 3.情感目标:通过探究性学习、感受化学世界的美妙变化,提高学习化学的兴趣。 1.3、重点、难点 重点: 铝的特殊性 难点:铝与碱溶液的多步反应。 二、教法 以上的重点和难点的突破是本节成功与否的关键,通过什么样的教法和学法显得异常重要。 我的教法是: 1. 边讲边实验。这是化学教学的常用方法,也是非常有用的方法,可以充分展示知识的建构过程,充分体现建构理念。具体如何去做呢?我的方法是教师演示和学生演示相结合,让学生去实验,去体验,去发现问题,提出问题自己去思考,这样做完全符合新课程以学生为主体的理念,不要老是老师做学生看,老师提问题学生回答问题。 2. 提出问题展开讨论并及时总结归纳。可以是老师提出问题,也可以让学生在充分认识实验现象的基础上提出问题,可以是学生与学生的讨论,也可以是师生讨论。。 三.学法 学法是:学生在学习的时候可以多做比较,如为什么其他金属与碱液反应没有气体产生。
铝和氢氧化钠溶液的反应
铝和氢氧化钠溶液的反应 授课人:王文静 班级:1班 学号:25 上课时间:2016、5、17
教学目标 知识与技能 学会观察实验现象,并能正确描述实验现象,了解铝的重要性质。 过程与方法 在教师指导下,通过实验探究铝与氢氧化钠溶液的反应。情感态度与价值观 培养学生探究精神,体会用对比法进行实验的探究过程。教学重点:铝和氢氧化钠的反应以及实验操作 教学难点:对反应的实验探究 教师活动学生活动设计意图 【引课】在之前我们已经做过 了金属与酸的反应,那么今天 我们就一起来探究一下金属与 碱的反应。 【提问】在之前理论课学习中,【答】铝 我们就知道什么金属既能和酸 反应又能个碱反应? 【讲授】是的,铝可以和酸反 应又可以和碱反应,今天我们 就一起来做铝和氢氧化钠反应 的实验。 【板书】铝和氢氧化钠的反应 【讲授】首先,我们来看一下 所需要的实验仪器以及药品, 这是氢氧化钠溶液,这是铝片, 这是试管。 【讲授】然后,我们将氢氧化 教师活动学生活动设计意图 钠溶液倒一部分于试管中,注
意试管中的液体不能超过它的 1/3,倒完了以后,向溶液中加 入打磨好的铝片,大家注意观 察实验现象。(下去让同学观察) 【提问】请一名同学来回答一 下有什么现象?【答】1.铝片慢慢溶解让同学们仔细观察现 2.产生大量气泡象并且仔细思考生成 3.试管壁发热了什么会产生这种现 象。【板书】一、现象 铝片慢慢溶解 产生大量气泡 试管壁发热 【讲授】根据这些现象,我们 现在就来考虑一下铝和氢氧化 钠在一起产生了什么呢?请同 学们小组讨论一下。小组讨论通过讨论,培养学生 【提问】首先,产生大量气泡探究能力、提高应用 说明有气体产生,那么这种气知识能力、学以致用 体是什么呢?哪个小组来回答 一下?【答】根据反应物守恒定 律可以判断出产生的气 体可能是氧气也可能是 氢气。 【提问】那么用什么方法可以【答】用燃着的木条放到 验证气体呢?试管口,若有暴鸣声则是 氢气。 【实验】点燃后有暴鸣声,所 铝和氢氧化钠反应生成的是氢 气。 【板书】原理: 2Al+2NaOH+2H2O=H2 +2NaAlO2 【讲授】铝和氢氧化钠反应有 偏铝酸钠生成,但要注意它的 实质反应,就是铝在氢氧化钠 的作用下水发生了反应生成了 氢氧化钠反应生成了偏铝酸钠。 【板书】 Al(OH)3+NaOH=NaAlO2+2H2O 【小结】铝是两性物质,既可 教师活动学生活动设计意图 以与酸反应又可以和碱反应,学生一起总结 因此铝制品餐具不宜用来蒸煮
铝与氢氧化钠的反应教学设计
铝与氢氧化钠的反应教 学设计 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
教学设计 《金属的化学性质》(第三课时) 一、教材结构和内容分析 1.1、教材地位和作用 本节内容在全章以及在整个中学化学课程中的地位:本章开始学生初步、系统地接触元素化合物知识,内容在化学实验基本方法和化学物质及其变化之后。在本章和本节中,学生初步尝试从实验操作和实验现象去探索(金属)物质化学性质;从基本原理(氧化还原反应原理)去深化对这些性质的理解,这种学习方式的过程和方法一经掌握后,可以驾轻就熟地学习后一章非金属及其化合物的内容。 1.2教学目标 依据新课程理念,本着对教材结构和内容的深刻理解,提出本节教学的目标: 1.知识目标:了解金属和碱性溶液的反应,铝与氢氧化钠溶液的反应,探索金属铝的特性, 2. 技能目标:初步学会由一般到特殊的探究方法。 3.情感目标:通过探究性学习、感受化学世界的美妙变化,提高学习化学的兴趣。 1.3、重点、难点 重点: 铝的特殊性 难点:铝与碱溶液的多步反应。 二、教法 以上的重点和难点的突破是本节成功与否的关键,通过什么样的教法和学法显得异常重要。 我的教法是: 1. 边讲边实验。这是化学教学的常用方法,也是非常有用的方法,可以充分展示知识的建构过程,充分体现建构理念。具体如何去做呢?我的方法是教师演示和学生演示相结合,让学生去实验,去体验,去发现问题,提出问题自己去思考,这样做完全符合新课程以学生为主体的理念,不要老是老师做学生看,老师提问题学生回答问题。 2. 提出问题展开讨论并及时总结归纳。可以是老师提出问题,也可以让学生在充分认识实验现象的基础上提出问题,可以是学生与学生的讨论,也可以是师生讨论。。 三.学法 学法是:学生在学习的时候可以多做比较,如为什么其他金属与碱液反应没有气体产生。
