靛酚蓝_分光光度法测定发酵液中氨态氮含量研究

土壤脲酶活性的测得
靛酚蓝比色法测定土壤脲酶的活性 一、实验目的: 1. 测定土壤脲酶活性的意义。 2. 掌握测定土壤脲酶活性的原理和方法。 二、实验原理 靛酚蓝比色法的基本原理是:被测物浸提剂中的NH4+,在强碱性介质中与次氯酸盐和苯酚反应,生成水溶性染料靛酚蓝,其深浅与溶液中的NH4+-N含量呈正比,线性范围为0.05~0.5mg/l之间。 靛酚蓝反应原理如下: NH3 + OCl——NH2 Cl +OH- 三、实验试剂 1) 10%尿素:称取10g尿素,用蒸馏水溶至100ml。 2)柠檬酸盐缓冲液(PH=6.7):184克柠檬酸和147.5克氢氧化钾溶于蒸馏水。将两溶液合并,用1mol/LNaOH将PH调至6.7,用水稀释至1000毫升。 3)苯酚钠溶液(1.35mol/L):62.5克苯酚溶于少量无水乙醇,加2毫升甲醇和18.5毫升丙酮,用无水乙醇稀释至100毫升(A),存于冰箱中;27克NaOH溶于100毫升水(B)。将AB溶液保存在冰箱中。使用前将2溶液各20毫升混合,用蒸馏水稀释至100毫升。 4)次氯酸钠溶液:用水稀释试剂至活性氯的浓度为0.9%,溶液稳定。 5)氮的标准溶液(0.1mg/ml):精确称取0.4717克硫酸铵溶于水并稀释至1000ml,得到1ml含有0.1mg氮的标准液。 四、实验过程 1.标准曲线的测定 吸取10ml氮的标准溶液定容至100ml,摇匀。从其中分别吸取0,1.00,3.00,5.00,7.00,10.00ml移至50ml比色管中,加水至20ml,再加入4ml苯酚钠,充分混合。加入3ml次氯酸钠,充分摇荡,放置20分钟,用水稀释至刻度。将显色液在可见分光光度计上于578nm处,以1cm比色皿进行比色测定,以试剂空白为参比。以标准溶液氮含量为横坐标,以吸光度值为纵坐标绘制标准曲线。 2.土样中脲酶活性的测定 分别称取2g过1mm筛的风干土样于3个100ml锥形瓶中,向其中加入1ml甲苯,以使土样全部湿润为宜。放置15分钟后,加入5ml 10%尿素溶液和10ml柠檬酸缓冲液(pH=6.7),并摇匀。将锥形瓶放入37℃恒温箱中,培养24h。培养结束后,用热至38℃水稀释至刻度,充分摇荡,并将悬液用滤纸过滤到锥形瓶中。 设置有土无基质对照,即考察各种溶液和土壤中氨氮存在带来的影响。相当于其他实验中所做的空白对照。
比色分析的基本原理朗伯比尔定律,吸光度,消光度,吸光系数
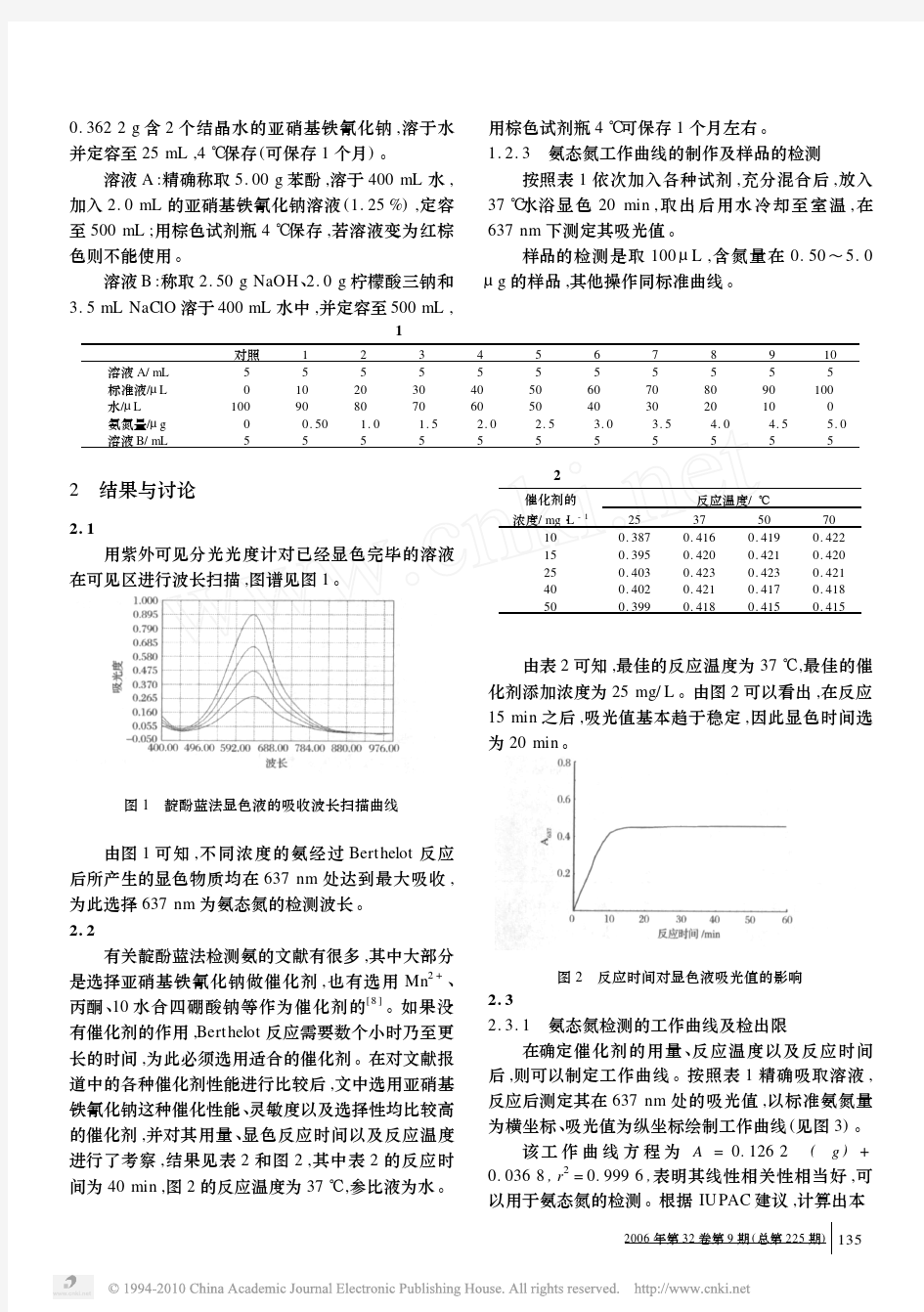
比色分析的基本原理 (朗伯-比尔定律,吸光度,消光度,吸光系数) ( 关键词:比色分析,吸光光度法,光电比色法,分光光度法,朗伯-比尔定律,吸光度,消光度,吸光系数) 比色分析是基于溶液对光的选择性吸收而建立起来的一种分析方法,又称吸光光度法。 有色物质溶液的颜色与其浓度有关。溶液的浓度越大,颜色越深。利用光学比较溶液颜色的深度,可以测定溶液的浓度。 根据吸收光的波长范围不同以及所使用的仪器精密程度,可分为光电比色法和分光光度法等。 比色分析具有简单、快速、灵敏度高等特点,广泛应用于微量组分的测定。通常中测定含量在10-1~10-4mg·L-1的痕量组分。比色分析如同其他仪器分析一样,也具有相对误差较大(一般为1%~5%)的缺点。但对于微量组分测定来说,由于绝对误差很小,测定结果也是令人满意的。在现代仪器分析中,有60%左右采用或部分采用了这种分析方法。在医学学科中,比色分析也被广泛应用于药物分析、卫生分析、生化分析等方面。 一、物质的颜色和光的关系 光是一种电磁波。自然是由不同波长(400~700nm)的电磁波按一定比例组成的混合光,通过棱镜可分解成红、橙、黄、绿、青、蓝、紫等各种颜色相连续的可见光谱。如把
两种光以适当比例混合而产生白光感觉时,则这两种光的颜色互为补色。图8-1中处于同一直线关系的两种色光(如绿与紫、黄与蓝)互为补色。 当白光通过溶液时,如果溶液对各种波长的光都不吸收,溶液就没有颜色。如果溶液吸收了其中一部分波长的光,则溶液就蜈现透过溶液后剩余部分光的颜色。例如,我们看到KMnO4溶液在白光下呈紫红色,就是因为白光透过溶液时,绿色光大部分被吸收,而其他各色都能透过。在透过的光中除紫红色外都能两两互补成白色,所以KMnO4溶液呈现紫红色。 同理,CuSO4溶液能吸收黄色光,所以溶液呈蓝色。由此可见,有色溶液的颜色是被吸收光颜色的补色。吸收越多,则补色的颜色越深。比较溶液颜色的深度,实质上就是比较溶液对它所吸收光的吸收程度。表8-1列出了溶液的颜色与吸收光颜色的关系。 表8-1 溶液的颜色与吸收光颜色的关系 二、朗伯-比尔(Lambert-Beer)定律 当一束平行单色光(只有一种波长的光)照射有色溶液时,光的一部分被吸收,一部分透过溶液(图8-2)。
活性硅的测定(钼蓝比色法)
活性硅的测定(钼蓝比色法) 1原理 在PH值为1.1~1.3的溶液中,可溶硅与钼酸铵反应生成硅钼黄,再用氯化亚锡还原生成硅钼蓝,此蓝色的色度与水样中可溶性硅的含量有关。磷酸盐对本方法的干扰可用调整酸度及加草酸或酒石酸的方法加以消除。 当水样中可溶性硅含量小于每升0.5mgSiO2 时,可用硅钼蓝光度法或用正丁醇等有机溶剂萃取浓缩,以提高灵敏度,便于比色。 硅的测定范围:10-500μgSiO2/L和0.5-20mgSiO2/L。 2仪器 具有磨口塞的25ml比色管。 3试剂 3.1 5%(m/V)钼酸铵溶液:用除盐水配制,配制后溶液澄清透明。 3.2 1%氯化亚锡溶液:称取1.19g氯化亚锡(SnCl2 2H2O)于烧杯中,加20ml盐酸溶液(1+1),加热溶解后,再加80ml纯甘油(丙三醇),搅匀后将溶液转入塑料瓶中备用。 3.3C(H2SO4)= 5mol/L硫酸溶液:于720ml试剂水中徐徐加入280ml浓硫酸。3.4SiO2储备液的配制 称取0.1000(±0.001)克经700—800℃灼烧过(已研磨细)二氧化硅(优级纯),与(0.7~1.0)克已于270—300℃焙烧过的粉状无水碳酸钠(优级纯)置铂坩埚内混匀,用马弗炉升温至900—950℃,保温20~30min后,把铂坩埚在900—950℃温度下熔融5 min冷却后,将铂坩埚放入硬质烧杯中,用热的超纯水溶解熔融物,放在水浴锅上不断搅拌。待熔融物全部溶解后取出坩埚,以超纯水仔细冲洗坩埚内外壁,待溶液冷却至室温后,移入1L容量瓶中,用超纯水稀
释至刻度,混匀后移入塑料瓶中储存。此液应完全透明,如有浑浊须重新配制。 3.5 SiO2工作液的配制 3.5.11ug/ml的SiO2工作溶液: 吸取100ug/ml的SiO2储备液1.0ml,于100ml的容量瓶中.用高纯水稀释至刻度。 注:SiO2工作溶液应在使用时配制,且储存时间不宜过长。 3.5.20.02mg/ml的SiO2工作溶液: 吸取10ml的SiO2储备液,于50ml的容量瓶中,用高纯水稀释至刻度。 3.6正丁醇(或异戊醇) 4分析步骤 4.1活性硅含量大于每升0.5mgSiO2时,测定方法如下: 4.1.1于一组比色管中分别注入二氧化硅工作液(1ml含0.02mgSiO2)0.25、0.5、1.0、1. 5......ml,用无硅水稀释到10ml。 4.1.2在另一支比色管中注入适量水样并用无硅水补足到10ml。 4.1.3往上述比色管中各加0.2ml 5mol/L硫酸溶液,摇匀。 4.1.4用滴定管分别加入1ml钼酸铵溶液,摇匀。 4.1.5静置5min后,用滴定管分别加入5ml 5mol/L硫酸溶液,摇匀,静置1min。 4.1.6再分别加入2滴氯化亚锡溶液,摇匀。 4.1.7静置5min后进行比色。
FHZHJDQ0148 环境空气 五氧化二磷的测定 钼蓝分光光度法
FHZHJDQ0148 环境空气 五氧化二磷的测定 钼蓝分光光度法 F-HZ-HJ-DQ-0148 环境空气—五氧化二磷的测定—钼蓝分光光度法 1 范围 本法为测定环境空气中五氧化二磷的钼蓝比色法。检出限为0.5μg/10mL ,测定范围为1~20μg/10mL 。如果采样体积为100L ,可测浓度范围为0.01~0.2mg/m 3。 2 原理 空气中五氧化二磷气溶胶被采集在滤料上,与水作用生成磷酸,再与钼酸按形成磷钼酸,在还原剂作用下,磷钼酸被还原成蓝色的化合物。根据颜色深浅,分光光度法定量。 3 试剂 3.1 采样滤纸:取直径40mm 定量滤纸,浸泡在0.5%硫酸溶液中,在60~70℃水浴上加热30min ,取出后用水洗至中性,然后于60~80℃烘干,备用。或者用直径40mm 聚氯乙烯滤膜。 3.2 (1+4)硫酸溶液。 3.3 钼酸铵溶液:称量1g 钼酸铵溶于 10mL 水,再加 50mL (1+4)硫酸溶液。 3.4 10g/L 抗坏血酸溶液,临用现配。 3.5 标准溶液:准确称量0.2454g 经105℃烘干2h 的磷酸氢二钾(优级纯),加水溶解,移入100mL 容量瓶中,并稀释至刻度。此溶液 1.00mL 含 1mg 五氧化二磷。临用时,用水稀释成 1.00mL 含 10μg 五氧化二磷的标准溶液。 4 仪器 4.1 滤料采样夹:采样夹的滤料有效直径为35mm ,进口为敞开式,进口直径为30mm ,用O 形橡胶圈密封,尺寸规格见图1。Ⅰ、Ⅱ为滤料夹,Ⅲ为尾座。一个尾座应配备几套滤料夹备用。每套滤料采样夹使用时需作密封性能质量检查:方法是装上滤料后以10~15L/min 流量抽气,当密封进气口时,流量计应无指示。 4.2 空气采样器:流量范围1~15L/min ,流量稳定。使用时,用皂膜流量计校正采样系列在采样前和采样后的流量,流量误差小于5%。 4.3 具塞比色管:10mL ,刻度应校正。 4.4 分光光度计:用10mm 比色皿,在波长840nm 下,测吸光度。 5 采样 将采样滤纸安装在滤料采样夹上,夹紧。以5L/min 流量,采气100L 。记录采样时的温度和大气压力。 6 操作步骤 6.1 绘制标准曲线 取8支10mL 比色管,按下表制备标准色列管。 0 1 2 3 4 5 6 7 标准溶液V/mL 0.00 0.10 0.20 0.40 0.70 1.00 1.50 2.00 水V/mL 10.0 9.9 9.8 9.6 9.3 9.0 8.5 8.0 五氧化二磷含量m/μg 0 1 2 4 7 10 15 20 各管加入1mL 钼酸铵溶液及0.5mL 10g/L 抗坏血酸,混匀,置于沸水浴中准确加热3min ,取出后冷却。用10mm 比色皿,以水作参比,在波长840nm 或680nm 处测定吸光度。以五氧化二磷含量(μg )为横坐标,吸光度为纵坐标,绘制标准曲线,并计算回归线的斜率。以斜 率的倒数作为样品测定的计算因子B S (μg ) 。 中国分析网
6-二氯酚靛酚法测定Vc
2,6-二氯酚靛酚法测定Vc 的含量 一.实验目的掌握2,6-二氯酚靛酚法测定Vc 的含量 二.实验原理 Vc具有还原性,可以还原2,6-二氯酚靛酚(由玫瑰色至无色),所以可以用2,6-二氯酚靛酚滴定样品溶液中的Vc。 抗坏血酸+2,6-二氯酚靛酚→脱氢抗坏血酸+2,6-二氯酚靛酚 (还原型)(氧化型)玫瑰色(氧化型)(还原型)无色 滴定终点:出现浅玫瑰色时,表明样品液中的维生素c全部被氧化。 计算公式:维生素c毫克数/100g 样品=(Va-Vb)*s/w*100 Va:滴定样品中提取液所用的2,6-二氯酚靛酚的平均毫克数。 Vb:滴定空白对照所用的2,6-二氯酚靛酚的平均毫克数。 S:1ml2,6-二氯酚靛酚溶液相当于维生素c的毫克数。 W:10ml样品提取液中含样品的克数。 三.实验试剂与仪器: 菜花10%盐酸溶液偏磷酸-醋酸溶液2,6-二氯酚靛酚溶液 50ml容量瓶滤纸漏斗滴定管铁架台分析天平研钵 四.实验步骤: 1、30g菜花在研钵中研磨后,用滤纸过滤,滤液置50毫升容量瓶中,用偏磷酸溶液定容,至50毫升,备用。 2、量取10毫升滤液,用2,6-二氯酚靛酚溶液滴定至玫瑰色5s不退色为滴定终点(滴定过程不超过2分钟),记录2,6-二氯酚靛酚溶液用量。 3、空白取偏磷酸溶液10ml,滴定 4、侧S值。取5ml标准抗坏血酸溶液加入5ml偏磷酸-醋酸溶液,然后用2,6-二氯酚靛酚溶液滴定,以生成微玫瑰红色持续15s不退为终点,计算2,6-二氯酚靛酚溶液的浓度,以每毫升2,6-二氯酚靛酚溶液相当于抗坏血酸的毫克数(S)来表示。 5、计算结果。 五.数据处理: m=30.07g; V A=2.0mL; V B=0.18mL; w=6.014g; s=0.171mg/ml 维生素C毫克数/100g样品=(2.0-0.18)*0.171*100/6.014=5.17 (mg/100g样品) 六、注意事项 ●提取时,滤液过度浑浊会影响滴定终点的判断,纱布过滤时,要尽可能滤干净抽提 液,以免有残留的Vc 。 ●终点时玫瑰色要持续15s. ●滴定速度要尽可能快一点,以免杂质干扰反应。 碘量法测定维生素C的含量 一、实验目的掌握碘量法测定维生素c的含量的方法。 二、实验原理 2CuSO4+4KI-------2CuI2+2K2SO4 2CuI2 ---------Cu2I2+I2 抗坏血酸(还原型)+I2→2HI+抗坏血酸(氧化型) 终点:声誉的微量碘与淀粉指示剂生成蓝色。 三、仪器与试剂
吸光光度法知识点
第九章吸光光度法知识点 吸光光度法是基于分子对光的选择性吸收而建立的一种分析方法,包括比色法、紫外一可见吸光光度法、红外光谱法等。 1.吸光光度法的基本原理 ①物质对光的选择性吸收:当光照射到物质上时,会产生反射、散射、吸收或透射。若被照射的物质为溶液,光的散射可以忽略。当一束白光照射某一有色溶液时,一些波长的光被溶液吸收,另一些波长的光则透过,溶液的颜色由透射光的波长所决定。吸收光与透射光互为补色光(它们混合在一起可组成白光)。 分子与原子、离子一样,都具有不连续的量子化能级,在一般情况下分子处于最低能态(基态)。当入射光照射物质时,分子会选择性地吸收某些频率的光子的能量,由基态跃迁到激发态(较高能级),其能级差E激发态一E基态与选择性吸收的光子能量hv的关系为Hv=E激发态一E基态 分子运动包括分子的转动、分子的振动和电子的运动。 分子转动、振动能级间隔一般小于1 eV,其光谱处于红外和远红外区。 电子能级间的能量差一般为1~20 eV,由电子能级跃迁而产生的吸收光谱位于紫外及可见光区,其实验方法为比色法和可见-紫外吸光光度法。 ②吸收曲线:以波长为横坐标,以吸收光的强度为纵坐标绘制的曲线,称为吸收光谱图,也称吸收曲线。它能清楚地描述物质对不同
波长的光的吸收情况。 ③光的吸收定律——朗伯一比尔定律:当一束平行单色光垂直通过一厚度为b、非散射的均匀吸光物质溶液时,吸光物质吸收光能,致使透射光强度减弱。 若用I。表示入射光强度,I t表示透射光强度,I。与I t之比称为透光率或透光度T,T=I。/I t,吸光物质对光的吸收程度,还常用吸光度A表示,A=lgT=log I。/I t。 实验证明,当一束平行单色光垂直照射某一均匀的非散射吸光物质溶液时,溶液的吸光度A与溶液浓度c和液层厚度b的乘积成正比,此即朗伯一比尔定律,其数学表达式为 A=lgT=log I。/I t =abc 式中,a为吸收系数。溶液浓度以g·L-1为单位、液层厚度以cm 为单位时,a的单位为L·g-1·cm-1。当溶液浓度以mol·L-1为单位、液层厚度以cm为单位时,此时吸收系数称为摩尔吸收系数,用符号k表示,其单位为L·mol-1·cm-1。 此时朗伯一比尔定律可写为A—Kbc。 摩尔吸收系数k是吸光物质在给定波长和溶剂下的特征常数,k越大,表示该物质对某波长光的吸收能力越强,测定方法的灵敏度也就越高。 根据朗伯一比尔定律,当吸光物质光程一定时,吸光度与吸光物质的浓度成线性关系,因此可以根据直接比较法和标准曲线法测定试样溶液中待测物质的浓度。
维生素C的测定(2,6-二氯酚靛酚滴定法
实验一维生素C的测定(2,6-二氯酚靛酚滴定法 一、测定原理 2,6-二氯酚靛酚滴定法用于测定还原型抗坏血酸。抗坏血酸分子中存在烯醇式结构(HO —C═C—OH),因而具有很强的还原性,还原型抗坏血酸能还原2,6-二氯酚靛酚染料。 2,6—二氯酚靛酚染料在酸性溶液中呈红色,在中性或碱性溶液中呈蓝色。因此,当用2,6—二氯酚靛酚染料滴定含有抗坏血酸的酸性溶液时,被还原后红色消失成为无色的衍生物,可作为维生素C含量测定的滴定剂和指示剂。 还原型抗坏血酸还原染料后,本身被氧化为脱氢抗坏血酸。 当抗坏血酸全部被氧化时,滴下的2,6—二氯酚靛酚溶液则呈红色。在测定过程中当溶液从无色转变成微红色时,表示抗坏血酸全部被氧化,此时即为滴定终点。根据滴定消耗染料标准溶液的体积,可以计算出被测定样品中抗坏血酸的含量。 在没有杂质干扰时,一定量的样品提取液还原标准染料液的量、与样品中所含抗坏血酸的量成正比。 反应式如下: 二、实验仪器与试剂 1.仪器 组织捣碎机;水果刀; 托盘天平;精密天平;称量纸;卷纸;台式离心机;电炉;吸耳球;玻璃棒; 蒸馏水,蒸馏水洗瓶;记号笔、标签纸、定性滤纸; 20cm镊子;5ml、10ml移液管、(微量)酸式滴定管、漏斗;漏斗架; 50ml、250ml、 500ml 、1000ml烧杯; 10ml 、500 ml、1000 ml量筒;100ml具塞量筒(或普通量筒); 100mL、250mL棕色容量瓶;50ml或100ml三角烧瓶。 2.原料及试剂 本实验材料是,用水均为蒸馏水,试剂纯度均为分析纯度。
(1)2%草酸溶液:草酸20g溶于700ml蒸馏水中,稀释至1000ml。 (2)1%草酸溶液:取上述2%草酸溶液450ml,稀释至900ml。 (3)抗坏血酸标准溶液: 称取抗坏血酸20mg,用适量1%草酸溶液溶解后,移入100mL棕色容量瓶中,并以1%草酸溶液定容,振摇混匀,备用。 (4)0.02% 2,6-二氯酚靛酚溶液: 称取碳酸氢钠52.2mg,溶解在200mL沸水中。再称取2,6-二氯酚靛酚49.2mg,溶于上述碳酸氢钠溶液中。冷后,过滤于250ml棕色容量瓶中,用水稀释至刻度,摇匀备用。 临用前标定: 取2mL浓度为0.2mg/ml的抗坏血酸标准溶液于三角瓶中,加1%草酸5mL,摇匀,用配制的2,6-二氯酚靛酚染料溶液滴定至微红色,15s不褪色即为终点,并计算如下:每1mL染料溶液相当于抗坏血酸的毫克数=滴定度(T)=C×V1/V2。 式中:C----抗坏血酸的浓度(mg/ml)= 0.2 V1----抗坏血酸的量(ml)=2 V2----消耗染料溶液的量(ml)=31.84 得出T=0.2×2/31.84=1.26×10﹣2 三、实验步骤 1. 取200g新鲜橙子(去皮、去核),置于1000ml烧杯内,称重。 2.将样品倒入组织捣碎机,加入等量2%草酸(W∶V),加盖旋紧,匀浆5min。 3. 取出匀浆物质。 4.称取30g匀浆物质于50ml小烧杯中编号,记录。 5. 用少量1%草酸将称取的匀浆物质倒入100ml容量瓶中,并用1%草酸反复洗涤烧杯(3次),其洗涤液一并移入,并用1%草酸定容到100ml。 6.加塞后将匀浆物质与1%草酸充分混合,静置10min。 7.取上述溶液过滤或离心。 8. 用移液管吸取10ml滤液置于三角烧瓶内,加入10ml 1%草酸(2个平行样品,编号);用 移液管吸取10ml蒸馏水,加入10ml 1%草酸(空白对照)。 9. 加1ml氯仿,将2,6二氯酚靛酚染料滴定至终点(淡粉红色,15s不褪色或观察氯仿层 呈现淡红色。),记录染料消耗量。 10. 计算每100g样品中维生素C的含量(ml)及平行样品误差范围,公式如下: 维生素C含量(ml/100g)=[(V1-V2)×T/W]×100 式中:V1----滴定样品时耗去的染料溶液的量(ml) V2----滴定空白时耗去的染料溶液的量(ml) T ---- 1mL染料溶液相当于抗坏血酸的毫克数 W ----滴定时所取的滤液中,含样品的量(g) 四、实验结果、数据计算与分析 组别耗去的染料溶液的量(ml) 分析数据(ml)
青岛湾环境质量现状与生物生态调查评价方案
青岛湾环境质量现状与生物生态调查评价方案 一、调查意义 综合运用《环境监测》课程所学知识与方法,对青岛市海湾生态系统进行野外观测,阐明海湾水质状况与生态系统的结构功能并对海湾环境与生态现状做出评价。 二、相关资料搜集 1.地质与生物分布资料 青岛湾栈桥附近属岩石海滩,潮间带各个潮带之间分界明显。高潮带生物以藤壶、滨螺为主,短滨螺个体较小、分布广泛;藤壶为高潮带优势种,密集分布于岩石上部,有的地方覆盖率高达100%。中潮带生物附着于岩石上,以牡蛎(褶牡蛎)、笠贝、贻贝为主,也有少量滨螺分布。牡蛎为中潮带优势种,有的地方覆盖率达100%。笠贝个体较小,附着在岩石上或牡蛎壳上。低潮带生物种类丰富,多种藻类和动物分布在岩石低洼处及水石临界处。鼠尾藻低潮带为优势种,广泛分布。叉枝藻、角叉藻、酸藻等也有分布。动物有朝鲜花冠小月螺、石鳖、贻贝等。 2..历年的水质资料 2007年,全省近岸海域水质以一、二类海水为主。其中一类海水测点占27.0%,二类海水测点占58.0%,三类、四类海水测点分别占10.0%和2.0%,劣四类海水测点占3.0%。全省近岸海域水质功能区达标率为83.7%,海水中主要污染物为无机氮、化学需氧量、石油类和活性磷酸盐。与2006年相比,全省近岸海域水质基本持平。 三、工作思路 污染源调查与评价 (1)采样 a.两个排污口取样,容积法、浮标法测流量。 b.以排污口为放射中心,按扇形布设。 水质站位:与排污口距离由近到远取6组。 沉积物质量站位:从水质站位中选取3组。 海洋生物站位:从沉积物质量站位中选取3组。 c.同时,在附近未受污染海域设2个对照站位。 (2)检测项目 特征污染物; 水质:水温、盐度、pH、SS、DO、COD(碱性高锰酸钾法)、 BOD(碘量瓶法)、氨氮(靛酚蓝分光光度法)、硝酸盐(锌镉还原法)、亚硝酸盐(盐酸萘乙二胺分光光度法)、活性磷酸盐(磷钼蓝法)海洋生物:底栖生物、潮间带生物; 沉积物质量:沉积物类型、石油类(荧光分光光度法)、重金属(原子吸收分光光度法)等。 (3)污染源评价 a.计算各污染物日排放量; b.应用等标污染指数法,确定主要污染物; c.根据相关标准确定水质、沉积物质量、生物体污染物残留量的超标情况及类别;
循环水中磷酸根的测定——磷钼蓝比色法
循环水中磷酸根的测定——磷钼蓝比色法 1.范围 本标准适用于循环冷中磷酸根的测定,测定范围为0.1mg/L~50mg/L。 2.方法概要 在0.45~0.55的硫酸介质中磷酸盐与钼酸钠生成磷钼杂多酸,然后被氯化亚锡还原成磷钼蓝,其蓝色深浅与水中正磷酸根含量成正比关系,在波长690nm处以比色法测定磷酸根的含量,磷酸根在2 ~25μg/mL范围内符合吸收定律。 有机磷酸(盐)可在0.05~0.20M的硫酸介质中用过硫酸铵加热分解为正磷酸盐后再用本方法测定。 回收率:90~110%。 3.仪器 3.1分光光度计 3.2电炉2KW 3.3水浴锅 4.试剂 4.1 钼酸钠—硫酸:将100mL浓硫酸(分析纯,比重1.84)慢慢地加到900mL 蒸馏水中,冷却后加入10g钼酸钠(分析纯),溶解后混匀。 4.2 氯化亚锡—甘油溶液:称取2.5g无水氯化亚锡(分析纯)于250mL烧杯中, 加入约0.5 mL浓盐酸加热溶解,然后加入100 mL甘油(丙三醇、分析纯)搅匀。 转入棕色滴瓶中,可长期使用。 4.3 硫酸:分析纯,配成1M的水溶液。 4.4 过硫酸铵:分析纯,配成0.4%的水溶液。 4.5 磷酸根标准溶液:准确称取0.7165g经105~110℃干燥过的分析纯磷酸二氢 钾(KH2PO4)溶于100mL蒸馏水中,然后转入500mL容量瓶中,用蒸馏水稀释至刻度,摇匀。每毫升此溶液含PO4 3-1.00mg。 用移液管移取10mL上述标准溶液于500mL容量瓶中,用蒸馏水稀释至刻度,摇匀,每毫升此溶液含PO4 3-20.0μg。
用移液管移取5mL 1.00mg/mL的标准溶液于1L容量瓶中,用蒸馏水稀释至刻度,摇匀,每毫升此溶液含PO4 3-5.00μg。 5.分析步骤 5.1标准曲线的绘制 5.1.1分别移取0、1、2、3、4、5mL 5.00μg/mL的PO4 3-标准溶液(即加 入的PO4 3-分别为0、5.00、10.0、15.0、20.0、25.0μg)于6个25mL比 色管中分别加入蒸馏水至约20mL,摇匀。 5.1.2分别加入3.5mL钼酸钠—硫酸溶液,并用蒸馏水稀释至刻度,摇匀。 5.1.3分别加入2滴氯化亚锡—甘油溶液,摇匀,放置15分钟。 5.1.4将溶液转入3cm比色皿中,在分光光度计上,以试剂空白为参比液, 于波长690nm处测量消光值E,以消光值E对PO4 3- 含量(μg)绘制标准 曲线。 5.2 样品分析 5.2.1 移取0.5mL~20mL过滤后的水样(含PO4 3- 2μg~25μg)于25mL 比色管中,加入蒸馏水至约20mL,摇匀。 5.2.2 以下操作同标准曲线的绘制5.1.2~5.1.4,测得消光值E,从标准曲 线上查出相应PO4 3- 的微克数。 6. 结果计算 水样的磷酸盐含量以mg/L计,按式(1)计算: PO4 3- =W / V =( K× E ) / V ( mg/L) (1) 式中: W——标准曲线查得PO4 3- 的含量(μg) V——取样体积(mL) K——标准曲线的斜率(PO4 3- ——E曲线) E——测得的消光值 取平行测定两结果的算术平均值作为水样的磷酸盐含量和总磷酸盐含量。
实验三 维生素C的定量测定(2,6-二氯靛酚滴定法)
实验三 维生素C 的定量测定(2,6-二氯靛酚滴定法) 一、原理 维生素c 又称为抗坏血酸,其还原型能还原染料2,6-二氯靛酚钠盐,本身则氧化成脱氢抗坏血酸。在酸性溶液中,2,6-二氯靛酚成红色,被还原后变为无色。因此可用2,6-二氯靛酚滴定样品中含有的维生素C ,当样品中的维生素C 被完全还原后,在滴加过量的2,6-二氯靛酚,溶液变为淡红色,即为终点。如无其他杂质干扰,则样品液所还原的2,6-二氯靛酚的量与样品中所含有维生素C 的量成正比。 二、 实验仪器 新鲜水果、吸管、容量瓶、滴定装置、锥形瓶、研钵、漏斗 三、实验试剂 1、标准抗坏血酸溶液:准确称取50毫克纯抗坏血酸,溶于1%的草酸溶液中,并稀释至500毫升,即浓度为0.1mg/ml ,贮棕色瓶,冷藏保存,最好临用时配制。 2、2%草酸溶液:草酸2克,溶于100毫升蒸馏水中。 3、1%草酸溶液:1克草酸溶于100毫升的蒸馏水中。 4、0.01% 2,6-二氯酚靛溶液:溶50毫克2,6-二氯酚靛于300毫升含有104毫克 NaHCO 3的热水中,冷却后加水稀释至500 毫升,滤去不溶物,贮于棕色瓶内。(4℃约可保存1周)每次临用时以标准抗坏血酸溶液标定。 四、实验步骤 (一)提取 水洗净新鲜的蔬菜(水果),用吸水纸吸干表面水分,然后称取5克剪碎加2%的草酸5毫升,置研钵中研成浆,倒入100毫升的容量瓶内,用2%草酸洗涤数次,最后定容至刻度,充分混匀后过滤。 (二)滴定 1、标定2,6-二氯酚靛酚溶液的浓度: 量取标准抗坏血酸溶液1ml 和9ml 1%草酸于50ml 锥形瓶1中,同时量取10ml 1%草酸加入另一个50ml 锥形瓶2中作空白对照V 2,用已标定的2,6-二氯酚靛酚滴定至粉红色出现,15秒不退色。记录所用的毫升数,计算每毫升2,6-二氯酚靛酚所能氧化抗坏血酸的毫克数(K )。 2、样品的测定: 取50ml 锥形瓶2个,分别加入滤液10ml (V 3),用已标定的2,6-二氯酚靛酚溶液滴定至终点,以微红色能保持15秒不退色为止,整个滴定过程宜迅速,不宜超过2min ,记录两次滴定所得的结果,求平均值V 1。空白滴定方法同前(V 2), (三)结果计算 根据实验数据计算出每100g 样品的维生素C 含量: 维生素C (mg/100g 样品)=123()V V K V W V -???×100 式中:V 1为滴定样品液所用去染料体积(ml ); V 2为滴定空白所用去染料体积(ml ); V 3为样品测定时所用滤液体积(10ml ); V 为样品提取液的总体积(100ml ); K 为1毫升染料能氧化抗坏血酸的质量(mg ); W 为称取样品重量(g )。 五、思考题 1、要测得准确的维生素C 值,实验过程中应注意哪些操作步骤,为什么? 2、在测定过程中,样品的草酸提取液为什么不能暴露在光下? 3、试简述维生素C 的生理意义。
植物全氮、全磷、全钾含量的测定
实验报告 课程名称:土壤学实验指导老师:倪吾钟成绩:__________________ 实验名称:植物全氮、全磷、全钾含量的测定 同组学生姓名:余慧珍 一、实验目的和要求 二、实验内容和原理 三、实验材料与试剂四、实验器材与仪器 五、操作方法和实验步骤六、实验数据记录和处理 七、实验结果与分析八、讨论、心得 一、 实验目的和要求 1. 掌握植物样品消煮液制备方法; 2. 掌握植物全氮、磷、钾的测定与结果分析。 二、 实验内容和原理 1. 植物样品消煮——H 2SO 4-H 2O 2消煮法 在浓H 2SO 4溶液中,植物样品经过脱水、碳化、氧化等作用后,易分解的有机物则分解。再加入H 2O 2 ,H 2O 2在热浓H 2SO 4溶液中会分解出新生态氧,具有强烈的氧化作用,可继续分解没被H 2SO 4破坏的有机物,使有机态氮全部转化为无机铵盐。同时,样品中的有机磷也转化为无机磷酸盐,植株中K 以离子态存在。故可用同一消煮液分别测定N 、P 、K 。 2. 植株全氮的测定——靛酚蓝比色法 经消煮待测液中氮主要以铵态氮存在,被测物浸提剂中的NH 4+,在强碱性介质中与次氯酸盐和苯酚反应,生成水溶性染料靛酚蓝,其深浅与溶液中的NH 4+-N 含量呈正比,线性范围为0.05-0.5mg/l 之间。 3. 植株全磷的测定——钒钼黄比色法 经消煮待测液中磷主要以磷酸盐存在,在酸性条件下,正磷酸能与偏钒酸和钼酸发生反应,形成黄色的三元杂多酸—钒钼磷酸[1]。溶液黄色稳定,黄色的深浅与磷的含量成正相关。 4. 植株全钾的测定——火焰光度计法 消煮待测液中难容硅酸盐分解,从而使矿物态钾转化为可溶性钾。待测液中钾主要以钾离子形式存在,用酸溶解稀释后即可用火焰光度计测定。
分光光度计基本原理
分光光度计基本原理 分光光度计主要用于反射和透射测量。 分三种光源:S偏振光、P偏振光和自然光。 现有设备7台(2台日立U4100、1台JACSO-V650、1台JACSO-V570、2台KT1100、1台瞬间7700)主要由是由分光光度计和电脑组成,由电脑程序驱动。 1 基本部件 光源: 用于提供足够强度和稳定的连续光谱。分光光度计中常用的光源有热辐射光源和气体放电光源两类。 热辐射光源用于可见光区,如钨丝灯和卤钨灯;气体放电光源用于紫外光区,如氢灯和氘灯。钨灯和碘钨灯可使用的范围在340 -- 2500 nm。氢灯和氘灯。它们可在180 -- 375 nm范围内产生连续光源。 紫外—可见分光光度计通常都配有可见和紫外两种光源。 单色器:是从连续光谱中获得所需单色光的装置。 (1)入射狭缝 (2)准直镜(透镜或凹面反射镜),它使入射光束变为平行光束。 (3)色散元件,棱镜或光栅,它使不同波长的入射光色散开来。 (4)聚焦透镜或聚焦凹面反射镜聚焦,它使不同波长的光聚焦在焦面的不同位置。 (5)出射狭缝。 积分球:它主要用途是测定光源发出的总光通量。它的制造:首先在球内壁上涂一层腻子,作为底层;然后喷点白漆,作为中间层;最后喷一层白涂料(硫酸钡或氧化镁)作为表层。 检测器:检测器的作用是检测光信号。常用的检测器有光电管和光电倍增管。电脑,就是微处理机。一方面可对分光光度计进行操作控制,另一方面可进行数据处理。 2、先用3台光度计的特点 U4100的 V650能测位相
3、日常测量 改参数 1.光源要求(.自然光) 2、扫描速度 3、狭缝 基本的步骤 设备测量种类 U4100测量:合色棱镜(成品、PL、2P)等 V650:单层,小DVD,带位相的零件,AR的反射测量等 4.测量的原理,影响准确性的因素 单光路分光光度计V650 双光路分光光度计 U4100 它的优点:光电传感器就可以交替探测到经过样品的探测光束的强度与参考光束的光强度,然后将两束光强信号进行相除,就可以得到样品的透过率。它可以降低光源稳定性对光谱测试精度的影响。 测量的原则:入射光轴重合,出射光轴重合,难在后着。 商用的光谱仪都有很好的性能,但是如果操作测试不当,就会获得错误的光谱测试结果。主要影响准确性的因素: 透射因素: 1、测量样品口径的影响 在测量中应保证仪器的测量光束全部穿过样品。 1)、在样品室的测量光路和参考光路中同时添加小孔光阑。 2)、只在样品池添加小孔光阑。
磷钼蓝比色法测量磷含量
发酵液中含有大量的微生物和有机物,首先必须将发酵液进行硝化,使其完全转化成无机物,然后取硝化液,用磷钼蓝比色方法测量消化液中的磷含量。其详细 或者用HPLC法选用“氮磷检测器” 不过,你的样品需要前处理,我看用楼上的方法就行 其他的按我说的做就行 水分完全蒸发至干,然后加入少量浓硫酸和硫酸钾以及极少量的硫酸铜加热至烧瓶内的有机物完全转变成无机物,溶液变澄清为止。将溶液转移定容后就可以按 可以用比色法,但要注意PH的控制;如果含量高,可以考虑用奎钼柠酮沉淀, 1.原理 食物中的有机物经酸氧化分解,使磷在酸性条件下与钼酸铵结合生成磷钼酸铵。此化合物经对苯二酚、亚硫酸钠还原成兰色化合物--钼蓝。用分光光度计在波长660nm处测定钼蓝的吸光值,以测定磷的含量。反应式为: H3PO4+12(NH4)3MoO4+21HNO3→(NH4)3PO4·12MoO3+21NH4NO3+12H2O 2.适用范围 依据中华人民共和国国家标准:GB12393-90,此方法适用于所有食品及保健品中磷元素含量的测定。 3.仪器 722可见分光光度计 4.试剂 (1)硝酸(G.R),高氯酸(G.R) 硫酸(A.R) (2)混合酸消化液:硝酸+高氯酸按4+1混合 (3) 15%(V/V)硫酸溶液:取15ml硫酸缓慢加入到80ml水中,并定容至100ml。(4) 5%(W/V)钼酸铵溶液:取5g钼酸铵,用15%硫酸溶液稀释至100ml。(5)对苯二酚溶液:取0.5g对苯二酚于100ml水中,溶解后加一滴浓硫酸。(6) 20%(W/V)亚硫酸钠溶液(注:此溶液需在每次实验前临时配制):称取一定量的亚硫酸钠,用蒸馏水溶解即可。 (7)标准质控物:猪肝粉(国家标准物质研究中心提供),质控物需室温干燥保存。 (8)国家标准物质中心提供:磷标准储备溶液,浓度为1000μg/mL (9)标准中间液的配制:吸取1ml磷标准储备溶液,然后移入100ml容量瓶中,
水杨酸测定氨氮
水杨酸-次氯酸盐分光光度法测定氨氮氨氮的测定方法:通常有纳氏试剂比色法、水杨酸-次氯酸盐,比色法和电极法。氨氮含量较高时,可采用蒸馏-酸滴定法。纳氏试剂比色法具有操作简便、灵敏等特点,但钙、镁、铁等金属离子、硫化物、醛、酮类,以及水中色度和混浊等干扰测定,需要相应的预处理。水杨酸-次氯酸盐法具灵敏、稳定等优点,操作简便、实验室污染少等优点而被广泛应用。 1、测定原理 在碱性介质(pH =11.6)中,亚硝基铁氰化钠[Na 2(Fe(CN) 6 )NO]·2H 2 O存在下, 水中的氨、铵离子与水杨酸盐和次氯酸离子反应生成蓝色化合物,在波长697nm 具最大吸收,用分光光度计测量吸光度。 这类反应称为Berthelot反应。这类反应的机理比较复杂,是个分步进行的反应: (1)第一步是氧与次氯酸盐反应生成氯胺。NH 3+HOCl←→NH 2 Cl+H 2 O (2)第二步氯胺与水杨酸C 6H 4 (OH)COOH反应形成一个中间产物:5氨基水杨酸。 (3)第三步是氨基水杨酸转变为醌亚胺 (4)最后是卤代醌亚胺与水杨酸缩合生成靛酚蓝。 pH对每一步反应几乎都有本质上的影响。最佳的pH值不仅随酚类化合物而不同,而且随催化剂和掩蔽剂的不同而变化。此外,pH还影响着发色速度、显色产物的稳定性以及最大吸收波长的位置。因此控制反应的pH值是重要的。
2、本标准适用于地下水、地表水、生活污水和工业废水中氨氮的测定。 当取样体积为8.0mL,使用10mm比色皿时,检出限为0.01mg/L,测定下限为0.04mg/L,测定上限为1.0mg/L(均以N计)。 3、干扰及消除 氯铵在此条件下均被定量地测定。钙、镁等阳离子的干扰,可加酒石酸钾钠掩蔽。如果水样的颜色过深、含盐量过多,酒石酸钾盐对水样中的金属离子掩蔽能力不够,或水样中存在高浓度的钙、镁和氯化物时,需要预蒸馏。 (一)水样的预处理 1.1 样品采集与保存 水样采集在聚乙烯瓶或玻璃瓶内,要尽快分析。如需保存,应加硫酸使水样酸化至pH<2,2℃~5℃下可保存7天。 1.2 水样的预处理 水样带色或浑浊以及含其他一些干扰物质,影响氨氮的测定。为此,在分析时需作适当的预处理。对较清洁的水,可采用絮凝沉淀法;对污染严重的水或工业废水,则用蒸馏消除干扰。 絮凝沉淀法 加适量的硫酸锌于水样中,并加氢氧化钠使呈碱性,在pH>10.5时,生成氢氧化锌絮状沉淀,再经过滤除颜色和浑浊等。 1.3. 仪器与试剂: 100 ml具塞量筒或比色管。 (1)10%硫酸锌溶液:称取10g硫酸锌溶于水,稀释至100 ml。 (2)25%氢氧化钠溶液:称取25g氢氧化钠溶于水,稀释至100ml,贮于聚乙烯 瓶中。 (3)硫酸, =1.84。 (4)中速滤纸 (5)漏斗 1.4.絮凝沉淀步骤:
铝合金中二氧化硅的测定钼蓝比色法
铝合金中二氧化硅的测定钼蓝比色法 在 pHl.2~1.3 的溶液中,可溶硅与钼酸铵反应生成硅钼黄,再用硫酸亚铁还原生成硅钼蓝,此蓝色的色度与水样中可溶性硅的含量有关。磷酸盐对本法的干扰可用调整酸度及加草酸或酒石酸的方法加以消除。 本标准适用于铝合金中硅的分析。硅的测定范围为:使用于10%以下二氧化硅的测定。 试剂: 5%(质量/体积)钼酸铵溶液:称15g分析纯钼酸铵,溶于300ml水里。 混合显色液(现配现用):称取 10 克分析纯草酸和10克分析纯硫酸亚铁铵于1L的烧杯,用少量水溶解,加入60ml(1+1)硫酸,用水定溶于1L即可。 盐酸分析纯:1+1的盐酸水溶液1L。 盐酸分析纯:7.5:92.5=盐酸:水,配置300ml。 氢氧化钠分析纯:10%的氢氧化钠水溶液500ml。 无水乙醇:分析纯,不要买湖南产的。 二氧化硅标准贮存溶液:称取0.2000g预先在1000℃灼烧2h并冷至室温的二氧化硅(99.99%)置于铂坩埚中,加3g无水碳酸钠(配标准最好用优级纯无水碳酸钠),与标准混匀,再覆盖上1g无水碳酸钠(配标准最好用优级纯无水碳酸钠),盖上坩埚盖,置于950℃-1000℃高温炉中熔融20-30min,取出,冷却。置于盛有300ml沸水聚四氟乙烯烧杯中,低温加热浸出熔块至溶液清亮,用热水洗出坩埚及盖,冷却运载室温。移入1L容量瓶中,用水稀释至刻度,摇匀,贮于塑料瓶中,此溶液1ml含200ug二氧化硅。 二氧化硅标准使用溶液:移取10.00ml二氧化硅标准贮存溶液,置于 100ml容量瓶中,用水稀释至刻度,摇匀,贮于塑料瓶中。此溶液1ml含20μg 二氧化硅。 分析步骤 称取铝合金样品0.1-0.2g(0.0001g),于150ml聚乙烯烧杯中,加入10%氢氧化钠,30ml,盖上表面皿,于水浴锅中,沸水浴加热,直到反应温度,大约30min,取下,用30ml1+1盐酸酸化,冷至室温后,转移至250ml容量瓶(最好是塑料容量瓶),用热水冲洗烧杯及表面皿,冷却至室温后定容。
靛酚蓝光度法测定海水中的氨型氮
第19卷,第5期光 谱 实 验 室 V o l .19,N o .52002年9月 Ch inese J ou rnal of S p ectroscop y L aboratory Sep te m ber ,2002 靛酚蓝光度法测定海水中的氨型氮 ①联系人,电话:(0633)8786723(宅);E 2m ail :analysis w f @https://www.360docs.net/doc/b011574554.html, 作者简介:王锋(1964—),男,山东省日照市人,日照职业技术学院讲师,从事分析化学教学与研究工作。收稿日期:2002202202 王 锋① 李玉环 (日照职业技术学院水产系 山东省日照市新市区烟台路南首 276826) 摘 要 研究了在碱性介质中,以丙酮为催化剂,氨氮与苯酚及次氯酸钠反应生成靛酚蓝的条件,靛酚蓝的最大吸收波长Κm ax =625nm ,Ε=119×104L ?mo l -1?c m -1,氨型氮含量在0—3Λg mL 范围内符合比耳定律,反应体系的灵敏度高,稳定性好,用于海水中痕量氨型氮的测定,结果令人满意。 关键词 靛酚蓝,光度法,海水,氨型氮。 中图分类号:O 657.32 文献标识码:B 文章编号:100428138(2002)0520631203 1 前言 氮的化合物是海洋生物所必须的重要的营养物质[1],其中氨型氮含量的高低,对海洋生物正常的生长、发育、繁殖具有重要意义。对于氨型氮的检测,比较经典的方法是奈氏试剂法[2],但加入奈氏试剂后,硫化物易使水体变浑浊,影响检测的灵敏度。另有离子色谱法[3,4]、毛细管电泳法[5]、离子选择性电极(ISE )[6]、靛酚蓝光度法[7]等。本文对靛酚蓝光度法[8,9]测定海水中的氨型氮进行了研究,并将分析结果应用于实际海水养殖业,收到良好的效果。 2 实验部分 2.1 仪器与试剂 721型分光光度计(上海第三分析仪器厂);754型分光光度计(上海第三分析仪器厂);Z D 22型 自动电位滴定仪(上海分析仪器厂);恒温磁力搅拌器;501超级恒温水浴锅。 5%ED TA 溶液; 酚钠溶液(126g L ):称取3115g 结晶苯酚溶解在5mL 异丙醇和10mL 丙酮中,并用异丙醇稀 释到50mL ,然后移取20mL 苯酚溶液与20mL 27%N a OH 溶液混合,用无氨蒸馏水定容至100mL ,装在有色瓶中于暗处保存; 次氯酸钠(N aC l O )贮备液(1%):量取40mL 无铵去离子水,加入10mL 5%的商品漂白液,用盐酸调pH 值至615—710;硫酸锰溶液(0.45g L ):准确称取50m g M nSO 4?H 2O 于适当蒸馏水中,并定容至100mL ;氨型氮贮备液(1m g mL ):准确称取31819g N H 4C l (预先在100℃下烘干2h )溶于适量无铵去离子水中,移入1000mL 的容量瓶中,并定容至刻度,配成 1m g mL 的氨型氮贮备液;
环境氨
环境氨 (试卷总分:100分考试时间:90分钟) 单项选择题(本大题共30小题,每小题1分,共30分) 1、次氯酸钠溶液的标定所用的方法()。A、酸碱中和法 B、碘量法 C、重量法 D、比色法 A B C D 2、物质呈现的颜色与光有着密切的关系,不同波长的可见光可使眼睛感觉到不同的颜色,那可见光的波长范围为()。 A、<400 B、400~760 C、>760 D、200~1500 A B C D 3、民用建筑工程及室内装修工程的室内环境质量验收,应在工程完工后多天进行()。 A、1天内 B、5天内 C、7天后 D、工程交付使用后 A B C D 4、GB/T 18204.25-2000靛酚蓝分光光度法检测空气中氨浓度所用的分光光度计可测波长为多少()nm 。A、412 B、425 C、536 D、697.5 A B C D
5、靛酚蓝分光光度法测定空气中氨所用的吸收液是()。A、0.005mol/L 硫酸溶液 B、0.005mol/L硝酸溶液 C、0.005mol/L氯化铵溶液 D、 0.005mol/L氢氧化钠溶液参照GB/T 18204.25-2000中条文3.1 A B C D 6、《公共场所空气中氨测定方法》GB/T18204.25-2000中,测定空气中氨浓度的仲裁法为那种()。A、纳氏试剂分光光度法 B、离子选择电极法C、水杨酸分光光度法 D、靛酚蓝分光光度法 A B C D 7、《公共场所空气中氨测定方法》GB/T18204.25-2000的标准由():。 A、中华人民共国建设部提出 B、中华人民共和国卫生部提出 C、中华人民共和国化工部提出 D、中华人民共和国劳动部提出 A B C D 8、配制0.05 mol/L硫酸溶液,需量取()浓硫酸加入水中稀释至1L 。A、 1.0ml B、 2.8ml C、4.9ml D、28ml A B C D 9、靛酚蓝分光光度法测定空气中氨的浓度方法,绘制标准曲线,是以什么作横坐标,以什么作纵坐标()。A、以吸光度为横坐标,以氨含量为纵坐标B、以氨含量为横坐标,以吸光度为纵坐标C、以吸收液为横坐标,以氨含量为纵坐标D、以吸光度为横坐标,以吸收液为纵坐标 A B C D
