初三化学原子结构示意图微观模拟
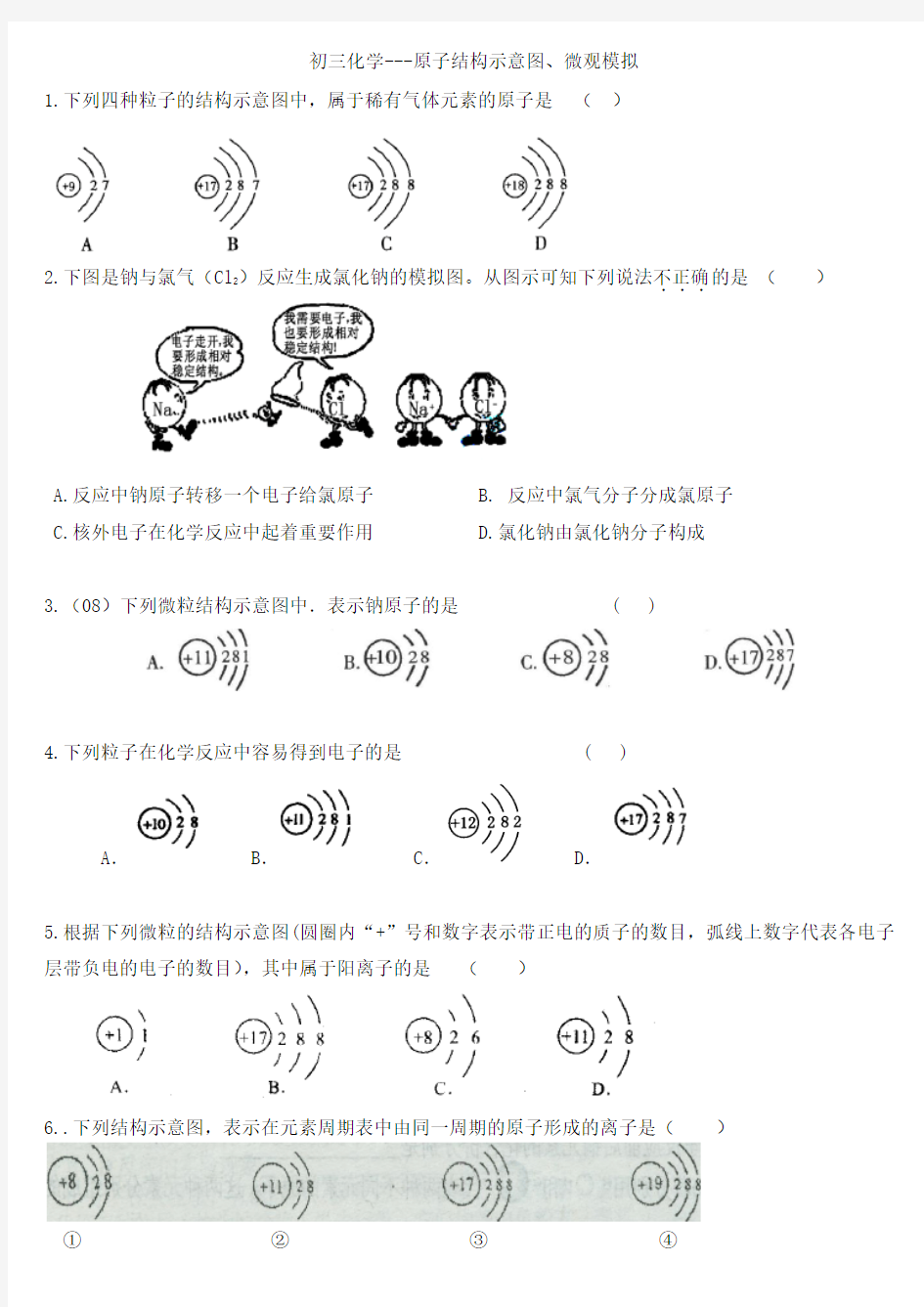

初三化学---原子结构示意图、微观模拟
1.下列四种粒子的结构示意图中,属于稀有气体元素的原子是()
2.下图是钠与氯气(Cl2)反应生成氯化钠的模拟图。从图示可知下列说法不正确
...的是()
A.反应中钠原子转移一个电子给氯原子
B. 反应中氯气分子分成氯原子
C.核外电子在化学反应中起着重要作用
D.氯化钠由氯化钠分子构成
3.(08)下列微粒结构示意图中.表示钠原子的是 ( )
4.下列粒子在化学反应中容易得到电子的是 ( )
A. B. C. D.
5.根据下列微粒的结构示意图(圆圈内“+”号和数字表示带正电的质子的数目,弧线上数字代表各电子层带负电的电子的数目),其中属于阳离子的是()
6..下列结构示意图,表示在元素周期表中由同一周期的原子形成的离子是()
① ② ③ ④
A.①② B.②③ C.③④ D.①④
7.下列微观粒子结构示意图的相关叙述正确的是()
① ② ③ ④
A.①②的原子的电子层数相同 B。①②③④具有相对稳定结构
C.①②能形成AB2型化合物
D.③④的元素在周期表中的同一横行
8、下列结构示意图表示元素周期表中同一横行的原子的是( )
A.①②③ B.①⑤ C.②③④ D.②③⑤
11、我国“神州号”宇宙飞船和“天宫1号”空间站已实现完美对接,制造二者的发动机中均使用了X
和Y两种元素形成的化合物,
己知X、Y的原子结构示意图依次为:
则下列说法错误的是( )
A.X原子易得电子形成X3-离子
B.Y原子核中质子数为14
C.X和Y形成的化学式为Y3X4
D. X和Y元素在元素周期表中是不同颜色区
12、下列有关说法正确的是
A.周期表中每一个纵行都是一个族
B.原子最外层有4个电子的粒子.该元素在化合物中一定显+4价
C.某原子的化学性质稳定,该原子最外层可能有8电子
D.电子层数相同的粒子,一定是同一周期的元素的不同粒子
13、下列微观粒子结构示意图的相关叙述正确的是( )
A.①②③④的原子的电子层数相同 B.①②的元素在周期表的同一族
C.①③具有相对稳定结构 D.②④都易得电子
14、下列有关结构示意图的说法正确的是()
A.①组的结构示意图化学性质相似 B。②组的结构示意图在元素周期表中属于同一族
C.③组的结构示意图在元素周期表中属于同一周期
D.④组的结构示意图可以形成分子构成的化合物
15、下列结构示意图表示元素周期表中同一横行的原子的是( )
A.○1○2 B.③④ c.①②③ D.①②③④
16、下列结构示意图说法正确的是()
A、③⑤属于同种元素的同种例子 B.①③⑤属于元素周期表中同一横行的离子
C.①②③④四种粒子的化学性质完全相似 D、②④属于元素周期表中同一纵行的原子
17、下列粒子是具有相对稳定结构的原子是()
18.下列有关粒子结构示意图的说法正确的是()
A.③和④元素周期表中属于同一族,⑤和⑥属于同一周期
B.⑤和⑥的化学性质相似,①和②属于同一种元素
C.②和⑥形成的化合物由离子构成 D、示意图中只有③和④具有稳定结构
1.(5分)下图是某化学变化的微观模拟过程,仔细观察,回答问题:
(1)先将丙图补充完整;
(2)从微观角度判断反应物物质分类的依据是____________________________________________ (3)甲到乙是通电条件下水分子分成氧原子和氢原子的过程,乙到丙表示的是_______________
2.(4分)下图是氢气、氧气发生变化的微观模拟过程,仔细观察图示,回答问题:
(1)将微观过程图补充完整,甲到乙过程是点燃的条件下___________________________;
乙到丙过程表示的是每两个氢原子和一个氧原子重新结合成一个水分子的过程。
(2)写出这个变化的化学方程式____________________________________;
(3)补充完整后,甲图的物质分类是__________,其微观依据是________________________。
3.(3分)用“⑩”和“⑨’’分别表示氮原子和氧原子,下图是氮气与氧气在放电条件下发生反应的微观模拟图。
请根据此图回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)生成物一定是_____________(填“纯净物”或“混合物”);
(3)此变化前后没有发生改变的微观粒子有___________________________。
4.下图是某变化的微观模拟图。请回答:
(1)该反应中参加反应的A与反应后的B和C的个数比为__________;
(2)该反应的基本反应类型是______________________________;
(3)从微观角度回答,化学反应遵守质量守恒定律的原因是:________________________________________________________;
人教版初三化学上册《原子的结构》精品教案
课题2 原子的结构 第1课时原子的构成相对原子质量 教学过程 情景导入 第二次世界大战的时候日本对我国进行了非常不人道的侵虐,当时穷 凶极恶的日本侵略者最后为什么会投降呢?那是因为美国给日本投了两颗 原子弹,原子弹爆炸产生的巨大杀伤力摧毁了日本最后的斗志……继而“问 题激疑”引入新课。 【问题激疑】为什么“原子弹的爆炸”会产生如此巨大的能量呢?要了解 这个问题,我们首先要弄清原子结构的奥秘。 合作探究 探究点一原子的构成 提出问题原子是化学变化中的最小粒子。在化学变化中原子不能再分,通过其他变化或方法原子还可以再分吗? 交流讨论阅读教材讨论归纳,了解原子的构成。 归纳总结 1.构成: 质子(每个质子带1个单位正电荷) 原子核 原子中子(不带电) 核外电子(每个电子带1个单位负电荷) 2.原子中核电荷数、质子数、核外电子数的关系 (1)原子不显电性,是由于原子核所带正电荷数(即核电荷数)和核外电子所带负电荷数电量相等,但电性相反,所以整个原子不显电性。 (2)在原子中,原子核所带的正电荷数(核电荷数)就是所有质子所带的电荷数(中子不带电),而每个质子带1个单位正电荷,因此,核电荷数=质子数,由于原子核内质子数与核外电子数相等,所以在原子中,核电荷数=质子数=核外电子数。 (3)根据分析教材中“几种原子的构成”的数据可知:①在原子中质子数不一定等于中子数。②并不是所有的原子都是由质子、中子和电子构成的。如氢原子。③不同种类的原子,核内的质子数不同。
探究点二 相对原子质量 提出问题 原子虽小但也有质量和体积,它的质量如何表示呢? 交流讨论 阅读教材讨论归纳,了解相对原子质量。 归纳总结 (1)定义:国际上以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比,作为这种原子的相对原子质量。 (2)表达式:相对原子质量=12 1*碳原子质量该原子的质量 (3)跟质子和中子相比,电子质量很小,所以原子的质量主要集中在原子核上。即相对原子质量≈质子数+中子数。 知识拓展 板书设计 第1课时 原子的构成、相对原子质量 一、原子的构成 质子(每个质子带1个单位正电荷) 原子核 原子 中子(不带电) 核外电子(每个电子带1个单位负电荷) 在原子里,核电荷数=质子数=核外电子数 二、相对原子质量 1.定义: 2.公式:某原子的相对原子质量=12 1*碳原子质量该原子的质量 3.相对原子质量=质子数+中子数
化学物构知识点
第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. ①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 ②根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性. 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化. (2).元素第一电离能的周期性变化. 随着原子序数的递增,元素的第一电离能呈周期性变化: ★同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小; ★同主族从上到下,第一电离能有逐渐减小的趋势. 说明: ①同周期元素,从左往右第一电离能呈增大趋势。电子亚层结构为全满、半满时较相邻元素要大即第ⅡA族、第ⅤA族元素的第一电离能分别大于同周期相邻元素。Be、N、Mg、P ②.元素第一电离能的运用: a.电离能是原子核外电子分层排布的实验验证. b.用来比较元素的金属性的强弱. I1越小,金属性越强,表征原子失电子能力强弱.
原子结构示意图大全
+19 2 8 8 1 钾K +20 2 8 8 2 钙Ca +21 2 8 9 2 钪Sc +22 2 8 10 2 钛Ti +23 2 8 11 2 钒V +24 2 8 13 1 铬Cr +25 2 8 13 2 锰Mn +26 2 8 14 2 铁Fe +27 2 8 15 2 钴Co +28 2 8 16 2 镍Ni +29 2 8 18 1 铜Cu +30 2 8 18 2 锌Zn +31 2 8 18 3 镓Ga +32 2 8 18 4 锗Ge +33 2 8 18 5 砷As +34 2 8 18 6 硒Se +35 2 8 18 7 溴Br +36 2 8 18 8 氪Kr +37 2 8 18 8 1 铷Rb +38 2 8 18 8 2 锶Sr +39 2 8 18 9 2 钇Y +40 2 8 18 10 2 锆Zr +41 2 8 18 12 1 铌Nb +42 2 8 18 13 1 钼Mo +43 2 8 18 13 2 锝Tc +44 2 8 18 15 1 钌Ru +45 2 8 18 16 1 铑Rh +46 2 8 18 18 钯Pd +47 2 8 18 18 1 银Ag +48 2 8 18 18 2 镉Cd +49 2 8 18 18 3 铟In +50 2 8 18 18 4 锡Sn +51 2 8 18 18 5 锑Sb +52 2 8 18 18 6 碲Te +53 2 8 18 18 7 碘I +54 2 8 18 18 8 氙Xe +55 2 8 18 18 8 1 铯Cs +56 2 8 18 18 8 2 钡Ba +57 2 8 18 18 9 2 镧La +58 2 8 18 19 9 2 铈Ce +59 2 8 18 21 8 2 镨Pr +60 2 8 18 22 8 2 钕Nd +61 2 8 18 23 8 2 钷Pm +62 2 8 18 24 8 2 钐Sm +63 2 8 18 25 8 2 铕Eu +64 2 8 18 25 9 2 钆Gd +65 2 8 18 27 8 2 铽Td +66 2 8 18 28 8 2 镝Dy +67 2 8 18 29 8 2 钬Ho +68 2 8 18 30 8 2 铒Er +69 2 8 18 31 8 2 铥Tm +70 2 8 18 32 8 2 镱Yb +71 2 8 18 32 9 2 镥Lu +72 2 8 18 32 10 2 铪Hf
初三化学上册原子的结构练习题
一选择题 1.下列有关原子的说法中正确的是( ) A.原子都是由质子、中子和核外电子构成的 B.原子的类别是由原子核内的质子数所决定的 C.原子中不存在带电微粒,因而整个原子不显电性 D.原子的质量主要集中在质子和电子上 2.碳和镁的相对原子质量分别是12和24,则碳和镁的原子质量之比为( ) :1 :12 :1 :2 3. 锂电池可用作心脏起搏器的电源。已知一种锂原子核内有3个质子和4个中子,则该锂原子的核外电子数为( ) D 7 4 下列物质由离子构成的是( ) A .铜 B .氯化钠 C .氧气 D .金刚石 ( 5.我市发展将有六大特色,其中之一是“打造主城休闲避暑养生区和主城近郊最大的负氧离子库”。空气中氧分子得到电子就能形成负氧离子(如O 22-),O 22-与O 2不相同的是( ) A .质子数 B .电子数 C .含氧原子个数 D .相对原子质量之和 6.某阳离子的结构示意图(右图所示)为则x 的数值可能是( ) A .9 B .10 D .17 7.已知一种粒子的核电荷数,一定能知道( ) 8.请判断以下说法,其中你认为正确的是( ) A . 原子是最小的微粒 B . 一切物质都是由分子组成的 [ C . 带电的原子是离子 D . 原子都是由质子、中子、电子构成的 9.下列有关原子知识的归纳中,你认为不正确的是( ) A . 原子是构成物质的一种粒子 " B . 原子在化学变化中可以再分 C . 同类原子的质子数一定相等 A . 相对原子质量 B . 相对分子质量 . C . 中子数 D . 质子数
D.原子里的质子数和中子数不一定相等 10.元素的化学性质与原子的()关系密切. 核电荷数B.核外电子数C.质子数D.最外层电子数 : A. 11.下列说法正确的是() 分子是保持物质性质的粒子 { A. B.质子数相同的粒子一定是同一种元素 C.离子在化学变化中都不能再分 D.| 原子是化学反应中不能再分的粒子 12.某元素原子的核外有三个电子层,最外层上有1个电子,这种元素是() A.非金属元素B.金属元素C.稀有气体元素D.# 无法确定 13.化学上用符号“Z A X”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和.已知a b X n+和c d Y m﹣的电子层排布完全相同,则下列关系正确的是() A.b﹣a=d﹣c B.a+n=c﹣m C.a﹣n=c+m D.| b﹣n=d+m 二、填空题 14.在分子、原子、质子、中子、电子、原子核这些粒子中选择填空: (1)能保持物质化学性质的粒子是; (2)化学变化中的最小微粒是; (3)能直接构成物质的粒子是; (4)构成原子核的粒子是; (5)带正电的粒子是; (6)带负电的粒子是; (7)不带电的粒子是; (8)质量与氢原子质量近似相等的粒子是; (9)质量最小的的是;
化学选修三知识点总结
化学选修三知识点总结 第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.
(2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. ①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 ②根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性.
九年级化学原子结构示意图怎么画,有什么规律
原子的定义 原子结构示意图: 由原子构成的物质: 绝大多数的单质是由原子构成的,如金属单质、稀有气体均是由原子直接构成的,碳、硫、磷等大多数的非金属单质也是由原子直接构成的。 原子的定义: 原子是化学变化中最小的粒子。例如,化学变化中,发生变化的是分子,原子的种类和数目都未发生变化。 对原子的概念可从以下三个方面理解: ①原子是构成物质的基本粒子之一。 ②原了也可以保持物质的化学性质,如由原子直接构成的物质的化学性质就由原子保持。
③原子在化学变化中不能再分,是“化学变化中最小的粒子”,脱离化学变化这一条件,原子仍可再分。 原子的性质: ①原子的质量、体积都很小; ②原子在不停地运动; ③原子之间有一定的间隔; ④原子可以构成分子,如一个氧分子是由两个氧原子构成的;也可以直接构成物质,如稀有气体、铁、汞等都是由原子直接构成的; ⑤化学反应中原子不可再分。 原子的表示方法—元素符号: 原子可用元索符号表示:如O既可表示氧元素,也可表示1个氧原子。 分子和原子的联系与区别:
道尔顿的原子模型: 英国自然科学家约翰·道尔顿将古希腊思辨的原子论改造成定量的化学理论,提出了世界上第一个原子的理论模型。他的理论主 要有以下四点: ①所有物质都是由非常微小的、不可再分的物质微粒即原子组成 ②同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同 ③原子是微小的、不可再分的实心球体 ④原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。虽然,经过后人证实,这是一个失败的理论模型,但道尔顿第一次将原子从哲学带入化学研究中,明确了今后化学家们努力的方向,化学真正从古老的炼金术中 摆脱出来,道尔顿也因此被后人誉为“近代化学之父”。 分子和原子怎么区分 分子和原子都是能够直接构成物质的微粒,特点是“小、空、动”。分子和原子可以从表观上和本质上来区分。
初三化学(原子结构示意图、微观模拟)
初三化学---原子结构示意图、微观模拟 1.下列四种粒子的结构示意图中,属于稀有气体元素的原子是() 2.下图是钠与氯气(Cl2)反应生成氯化钠的模拟图。从图示可知下列说法不正确 ...的是() A.反应中钠原子转移一个电子给氯原子 B. 反应中氯气分子分成氯原子 C.核外电子在化学反应中起着重要作用 D.氯化钠由氯化钠分子构成 3.(08)下列微粒结构示意图中.表示钠原子的是 ( ) 4.下列粒子在化学反应中容易得到电子的是 ( ) A. B. C. D. 5.根据下列微粒的结构示意图(圆圈内“+”号和数字表示带正电的质子的数目,弧线上数字代表各电子层带负电的电子的数目),其中属于阳离子的是() 6..下列结构示意图,表示在元素周期表中由同一周期的原子形成的离子是() ① ② ③ ④ A.①② B.②③ C.③④ D.①④
① ② ③ ④ A.①②的原子的电子层数相同 B。①②③④具有相对稳定结构 C.①②能形成AB2型化合物 D.③④的元素在周期表中的同一横行 8、下列结构示意图表示元素周期表中同一横行的原子的是( ) A.①②③ B.①⑤ C.②③④ D.②③⑤ 11、我国“神州号”宇宙飞船和“天宫1号”空间站已实现完美对接,制造二者的发动机中均使用了X 和Y两种元素形成的化合物, 己知X、Y的原子结构示意图依次为: 则下列说法错误的是( ) A.X原子易得电子形成X3-离子 B.Y原子核中质子数为14 C.X和Y形成的化学式为Y3X4 D. X和Y元素在元素周期表中是不同颜色区 12、下列有关说法正确的是 A.周期表中每一个纵行都是一个族 B.原子最外层有4个电子的粒子.该元素在化合物中一定显+4价 C.某原子的化学性质稳定,该原子最外层可能有8电子 D.电子层数相同的粒子,一定是同一周期的元素的不同粒子
高二化学选修三《原子结构》知识点总结归纳 典例导析
原子结构 【学习目标】 1、根据构造原理写出1~36号元素原子的电子排布式; 2、了解核外电子的运动状态; 3、掌握泡利原理、洪特规则。 【要点梳理】 要点一、原子的诞生 我们所在的宇宙诞生于一次大爆炸。大爆炸后约2小时,诞生了大量的氢、少量的氦及极少量的锂。其后,经过或长或短的发展过程,氢、氦等发生原子核的融合反应,分期分批地合成了其他元素。(如图所示) 要点二、能层与能级 1.能层 (1)含义:在含有多个电子的原子里,由于电子的能量各不相同,因此,它们运动的区域也不同。通常能量最低的电子在离核最近的区域运动,而能量高的电子在离核较远的区域运动。根据多电子原子核外电子的能量差异可将核外电子分成不同的能层(即电子层)。如钠原子核外有11个电子,第一能层有2个电子,第二能层有8个电子,第三能层有1个电子。 要点诠释:电子层、次外层、最外层、最内层、内层 在推断题中经常出现与层数有关的概念,理解这些概念是正确推断的关键。为了研究方便,人们形象地把原子核外电子运动看成分层运动,在原子结构示意图中,按能量高低将核外电子分为不同的能层,并用符号K、L、M、N、O、P、Q……表示相应的层,统称为电子层。一个原子在基态时,电子所占据的电子层数等于该元素在周期表中所处的周期数。倒数第一层,称为最外层;从外向内,倒数第二层称为次外层;最内层就是第一层(K 层);内层是除最外层外剩下电子层的统称。以基态铁原子结构示意图为例:铁原子共有4个电子层,最外层(N层)只有2个电子,次外层(M层)共有14个电子,最内层(K层)有2个电子,内层共有24个电子。 2.能级 (1)含义:在多电子原子中,同一能层的电子,能量也可能不同,这样同一能层就可分成不同的能级(也可称为电子亚层)。能层与能级类似于楼层与阶梯之间的关系。在每一个能层中,能级符号的顺序是ns、np、nd、nf……(n代表能层)
原子结构示意图大全
+19 2 8 8 1 钾 K +20 2 8 8 2 钙 Ca +21 2 8 9 2 钪 Sc +22 2 8 10 2 钛 Ti +23 2 8 11 2 钒 V +24 2 8 13 1 铬 Cr +25 2 8 13 2 锰 Mn +26 2 8 14 2 铁 Fe +27 2 8 15 2 钴 Co +28 2 8 16 2 镍 Ni +29 2 8 18 1 铜 Cu +30 2 8 18 2 锌 Zn +31 2 8 18 3 镓 Ga +32 2 8 18 4 锗 Ge +33 2 8 18 5 砷 As +34 2 8 18 6 硒 Se +35 2 8 18 7 溴 Br +36 2 8 18 8 氪 Kr +37 2 8 18 8 1 铷 Rb +38 2 8 18 8 2 锶 Sr +39 2 8 18 9 2 钇 Y +40 2 8 18 10 2 锆 Zr +41 2 8 18 12 1 铌 Nb +42 2 8 18 13 1 钼 Mo +43 2 8 18 13 2 锝 Tc +44 2 8 18 15 1 钌 Ru +45 2 8 18 16 1 铑 Rh +46 2 8 18 18 钯 Pd +47 2 8 18 18 1 银 Ag +48 2 8 18 18 2 镉 Cd +49 2 8 18 18 3 铟 In +50 2 8 18 18 4 锡 Sn +51 2 8 18 18 5 锑 Sb +52 2 8 18 18 6 碲 Te +53 2 8 18 18 7 碘 I +54 2 8 18 18 8 氙 Xe +55 2 8 18 18 8 1 铯 Cs +56 2 8 18 18 8 2 钡 Ba +57 2 8 18 18 9 2 镧 La +58 2 8 18 19 9 2 铈 Ce +59 2 8 18 21 8 2 镨 Pr +60 2 8 18 22 8 2 钕 Nd +61 2 8 18 23 8 2 钷 Pm +62 2 8 18 24 8 2 钐 Sm +63 2 8 18 25 8 2 铕 Eu
原子结构示意图大全
+19 2 8 8 1 钾K+20 2 8 8 2 钙Ca+21 2 8 9 2 钪Sc +22 2 8 10 2 钛Ti+23 2 8 11 2 钒V+24 2 8 13 1 铬Cr +25 2 8 13 2 锰Mn+26 2 8 14 2 铁Fe+27 2 8 15 2 钴Co +28 2 8 16 2 镍Ni+29 2 8 18 1 铜Cu+30 2 8 18 2 锌Zn +31 2 8 18 3 镓Ga+32 2 8 18 4 锗Ge+33 2 8 18 5 砷As +34 2 8 18 6 硒Se+35 2 8 18 7 溴Br+36 2 8 18 8 氪Kr +37 2 8 18 8 1 铷Rb+38 2 8 18 8 2 锶Sr+39 2 8 18 9 2 钇Y +40 2 8 18 10 2 锆Zr+41 2 8 18 12 1 铌Nb+42 2 8 18 13 1 钼Mo +43 2 8 18 13 2 锝Tc+44 2 8 18 15 1 钌Ru+45 2 8 18 16 1 铑Rh +46 2 8 18 18钯Pd+47 2 8 18 18 1 银Ag+48 2 8 18 18 2 镉Cd +49 2 8 18 18 3 铟In+50 2 8 18 18 4 锡Sn+51 2 8 18 18 5 锑Sb +52 2 8 18 18 6 碲Te+53 2 8 18 18 7 碘I+54 2 8 18 18 8 氙Xe+55 2 8 18 18 8 1 铯Cs+56 2 8 18 18 8 2 钡Ba+57 2 8 18 18 9 2 镧La +58 2 8 18 19 9 2 铈Ce+59 2 8 18 21 8 2 镨Pr+60 2 8 18 22 8 2 钕Nd +61 2 8 18 23 8 2 钷Pm+62 2 8 18 24 8 2 钐Sm+63 2 8 18 25 8 2 铕Eu +64 2 8 18 25 9 2 钆Gd+65 2 8 18 27 8 2 铽Td+66 2 8 18 28 8 2 镝Dy +67 2 8 18 29 8 2 钬Ho+68 2 8 18 30 8 2 铒Er+69 2 8 18 31 8 2 铥Tm +70 2 8 18 32 8 2 镱Yb+71 2 8 18 32 9 2 镥Lu+72 2 8 18 32 10 2 铪Hf
初三化学(原子结构示意图、微观模拟)教学提纲
初三化学(原子结构示意图、微观模拟)
初三化学---原子结构示意图、微观模拟 1.下列四种粒子的结构示意图中,属于稀有气体元素的原子是() 2.下图是钠与氯气(Cl2)反应生成氯化钠的模拟图。从图示可知下列说法不正确 ...的是() A.反应中钠原子转移一个电子给氯原子 B. 反应中氯气分子分成氯原子 C.核外电子在化学反应中起着重要作用 D.氯化钠由氯化钠分子构成 3.(08)下列微粒结构示意图中.表示钠原子的是 ( ) 4.下列粒子在化学反应中容易得到电子的是 ( ) A. B. C. D. 5.根据下列微粒的结构示意图(圆圈内“+”号和数字表示带正电的质子的数目,弧线上数字代表各电子层带负电的电子的数目),其中属于阳离子的是() 6..下列结构示意图,表示在元素周期表中由同一周期的原子形成的离子是()
① ② ③ ④ A.①② B.②③ C.③④ D.①④ 7.下列微观粒子结构示意图的相关叙述正确的是() ① ② ③ ④ A.①②的原子的电子层数相同 B。①②③④具有相对稳定结构 型化合物 D.③④的元素在周期表中的同一横行 C.①②能形成AB 2 8、下列结构示意图表示元素周期表中同一横行的原子的是( ) A.①②③ B.①⑤ C.②③④ D.②③⑤ 11、我国“神州号”宇宙飞船和“天宫1号”空间站已实现完美对接,制造二者的发动机中均使 用了X和Y两种元素形成的化合物, 己知X、Y的原子结构示意图依次为:
则下列说法错误的是( ) A.X原子易得电子形成X3-离子 B.Y原子核中质子数为14 C.X和Y形成的化学式为Y3X4 D. X和Y元素在元素周期表中是不同颜色区 12、下列有关说法正确的是 A.周期表中每一个纵行都是一个族 B.原子最外层有4个电子的粒子.该元素在化合物中一定显+4价 C.某原子的化学性质稳定,该原子最外层可能有8电子 D.电子层数相同的粒子,一定是同一周期的元素的不同粒子 13、下列微观粒子结构示意图的相关叙述正确的是( ) A.①②③④的原子的电子层数相同 B.①②的元素在周期表的同一族 C.①③具有相对稳定结构 D.②④都易得电子 14、下列有关结构示意图的说法正确的是() A.①组的结构示意图化学性质相似 B。②组的结构示意图在元素周期表中属于同一族C.③组的结构示意图在元素周期表中属于同一周期 D.④组的结构示意图可以形成分子构成的化合物 15、下列结构示意图表示元素周期表中同一横行的原子的是( ) A.○1○2 B.③④ c.①②③ D.①②③④
高考化学原子结构考点全归纳
原子结构 [考纲要求] 1.掌握元素、核素、同位素、相对原子质量、相对分子质量、原子构成、原子核外电子排布的含义。2.掌握原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。3.掌握1~18号元素的原子结构示意图的表示方法。 考点一原子构成 1.构成原子的微粒及作用 2.微粒之间的关系 (1)质子数(Z)=核电荷数=核外电子数; (2)质量数(A)=质子数(Z)+中子数(N); (3)阳离子的核外电子数=质子数-阳离子所带的电荷数; (4)阴离子的核外电子数=质子数+阴离子所带的电荷数。 3.一个信息丰富的符号 深度思考 18□、4019□+、4020□2+、4120□(“□”内元素符号1.有5种单核粒子,它们分别是4019□、40 未写出),则它们所属元素的种类有________种。 答案 3 解析质子数决定元素种类,质子数有19、18、20共3种,所以B正确。 2.(1)4822Ti的质子数为________、中子数为________、电子数为________、质量数为________。 (2)27Al3+的质子数为________、中子数为________、电子数为________、质量数为________。 (3)35Cl-的质子数为________、中子数为________、电子数为________、质量数为________。答案(1)22 26 22 48 (2)13 14 10 27 (3)17 18 18 35 题组一粒子中微粒关系的判断 1.下列离子中,电子数大于质子数且质子数大于中子数的是( )
A .D3O + B .Li + C .O D - D .OH - 答案 D 2.现有bXn -和aYm +两种离子,它们的电子层结构相同,则a 与下列式子有相等关系的是 ( ) A .b -m -n B .b +m +n C .b -m +n D .b +m -n 答案 B 规避3个易失分点 (1)任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子中;(2)有质子的微粒不一定有中子,如1H ,有质子的微粒不一定有电子,如H +;(3)质子数相同的微粒不一定属于同一种元素,如F 与OH -。 题组二 物质中某种微粒量的计算 3.已知阴离子R2-的原子核内有n 个中子,R 原子的质量数为m ,则ω g R 原子完全转化为R2-时,含有电子的物质的量是 ( ) A.m -n -2ω·m mol B.ωm -n n mol C .ω(m -n -2m ) mol D .ω(m -n +2m ) mol 答案 D 解析 R 原子的质子数为(m -n),其核外电子数也为(m -n),所以R2-的核外电子数为(m -n +2),而ω g R 原子的物质的量为ωm mol ,所以形成的R2-含有的电子为ω m (m -n +2)mol , 故选D 。 4.某元素的一种同位素X 的原子质量数为A ,含N 个中子,它与1H 原子组成HmX 分子,在a g HmX 中所含质子的物质的量是 ( ) A.a A +m (A -N +m)mol B.a A (A -N)mol C. a A +m (A -N)mol D.a A (A -N +m)mol 答案 A 解析 X 原子的质子数为(A -N),一个HmX 中所含的质子数为(A -N +m),HmX 的摩尔质量为(A +m)g·mol-1,所以a g HmX 中所含质子的物质的量为a A +m (A -N +m)mol 。 求一定质量的某物质中微粒数的答题模板 物质的质量―――――――――→ ÷摩尔质量来自质量数物质的量――――――――――――――→×一个分子或离子中含某粒子个数 指 定粒子的物质 的量――→×NA 粒子数
原子结构示意图大全38700教学内容
精品文档 +19 2 8 8 1 钾K +20 2 8 8 2 钙Ca +21 2 8 9 2 钪Sc +22 2 8 10 2 钛Ti +23 2 8 11 2 钒V +24 2 8 13 1 铬Cr +25 2 8 13 2 锰Mn +26 2 8 14 2 铁Fe +27 2 8 15 2 钴Co +28 2 8 16 2 镍Ni +29 2 8 18 1 铜Cu +30 2 8 18 2 锌Zn +31 2 8 18 3 镓Ga +32 2 8 18 4 锗Ge +33 2 8 18 5 砷As +34 2 8 18 6 硒Se +35 2 8 18 7 溴Br +36 2 8 18 8 氪Kr +37 2 8 18 8 1 铷Rb +38 2 8 18 8 2 锶Sr +39 2 8 18 9 2 钇Y +40 2 8 18 10 2 锆Zr +41 2 8 18 12 1 铌Nb +42 2 8 18 13 1 钼Mo +43 2 8 18 13 2 锝Tc +44 2 8 18 15 1 钌Ru +45 2 8 18 16 1 铑Rh +46 2 8 18 18 钯Pd +47 2 8 18 18 1 银Ag +48 2 8 18 18 2 镉Cd +49 2 8 18 18 3 铟In +50 2 8 18 18 4 锡Sn +51 2 8 18 18 5 锑Sb +52 2 8 18 18 6 碲Te +53 2 8 18 18 7 碘I +54 2 8 18 18 8 氙Xe +55 2 8 18 18 8 1 铯Cs +56 2 8 18 18 8 2 钡Ba +57 2 8 18 18 9 2 镧La +58 2 8 18 19 9 2 铈Ce +59 2 8 18 21 8 2 镨Pr +60 2 8 18 22 8 2 钕Nd +61 2 8 18 23 8 2 钷Pm +62 2 8 18 24 8 2 钐Sm +63 2 8 18 25 8 2 铕Eu +64 2 8 18 25 9 2 钆Gd +65 2 8 18 27 8 2 铽Td +66 2 8 18 28 8 2 镝Dy +67 2 8 18 29 8 2 钬Ho +68 2 8 18 30 8 2 铒Er +69 2 8 18 31 8 2 铥Tm +70 2 8 18 32 8 2 镱Yb +71 2 8 18 32 9 2 镥Lu +72 2 8 18 32 10 2 铪Hf 精品文档
所有原子结构示意图
H +1)1 He +2)2 Li +3)2)1 Be +4)2)2 B +5)2)3 C +6)2)4 N +7)2)5 0 +8)2)6 F +9)2)7 Ne +10)2)8 Na +11)2)8)1 Mg +12)2)8)2 Al +13)2)8)3 Si +14)2)8)4 P +15)2)8)5 S +16)2)8)6 Cl +17)2)8)7 Ar +18)2)8)8 K +19)2)8)8)1 Ca +20)2)8)8)2 Sc +21)2)8)9)2 Ti +21)2)8)10)2 V +22)2)8)11)2 Cr +24)2)8)13)1 Mn +25)2)8)13)2 Fe +26)2)8)14)2 Co +27)2)8)15)2 Ni +28)2)8)16)2 Cu +29)2)8)18)1 Zn +30)2)8)18)2 Ga +31)2)8)18)3 Ge +32)2)8)18)4 As +33)2)8)18)5 Se +34)2)8)18)6 Br +35)2)8)18)7 Kr +36)2)8)18)8 +19 2 8 8 1 钾K +20 2 8 8 2 钙Ca +21 2 8 9 2 钪Sc +22 2 8 10 2 钛Ti +23 2 8 11 2 钒V +24 2 8 13 1 铬Cr +25 2 8 13 2 锰Mn +26 2 8 14 2 铁Fe +27 2 8 15 2 钴Co +28 2 8 16 2 镍Ni +29 2 8 18 1 铜Cu +30 2 8 18 2 锌Zn +31 2 8 18 3 镓Ga +32 2 8 18 4 锗Ge +33 2 8 18 5 砷As +34 2 8 18 6 硒Se +35 2 8 18 7 溴Br +36 2 8 18 8 氪Kr +37 2 8 18 8 1 铷Rb +38 2 8 18 8 2 锶Sr +39 2 8 18 9 2 钇Y +40 2 8 18 10 2 锆Zr +41 2 8 18 12 1 铌Nb +42 2 8 18 13 1 钼Mo +43 2 8 18 13 2 锝Tc +44 2 8 18 15 1 钌Ru +45 2 8 18 16 1 铑Rh +46 2 8 18 18 钯Pd +47 2 8 18 18 1 银Ag +48 2 8 18 18 2 镉Cd +49 2 8 18 18 3 铟In +50 2 8 18 18 4 锡Sn +51 2 8 18 18 5 锑Sb +52 2 8 18 18 6 碲Te +53 2 8 18 18 7 碘I +54 2 8 18 18 8 氙Xe +55 2 8 18 18 8 1 铯Cs +56 2 8 18 18 8 2 钡Ba +57 2 8 18 18 9 2 镧La +58 2 8 18 19 9 2 铈Ce +59 2 8 18 21 8 2 镨Pr +60 2 8 18 22 8 2 钕Nd +61 2 8 18 23 8 2 钷Pm +62 2 8 18 24 8 2 钐Sm +63 2 8 18 25 8 2 铕Eu +64 2 8 18 25 9 2 钆Gd +65 2 8 18 27 8 2 铽Td
初三化学原子的结构
原子的结构 【情景激活】 原子还可以再分吗? 原子究竟是什么样子呢? 今天,咱们就来畅游原子的世界! 知识回顾: 在过氧化氢分解制氧气的实验中,过氧化氢________分裂为氢________和氧________ ,该反应的文字表达为: __________________________________。分子很小,但在化学反应中可以_____________,而________在化学变化中不可再分,所以说_________ 是化学变化中的最小的粒子。 (提示:填“分子”或“原子”) 那同学们想一想,那原子还能再分吗? 一. 科学史话——原子结构的探索历程 1.公元前5世纪,希腊哲学家德谟克利特等人认为:万物是由大量的不可分割的微粒构成的,即原子。 2.1803年,道尔顿提出:构成物质的最小粒子是原子,原子是不可再分的实心球体。 3.1897年,汤姆生在原子内部发现了电子,人们终于抛弃了原子不可分割的陈旧观念。
4.1911年,卢瑟福通过精密的实验证明在原子中心有一个极小的核,电子绕核做高速旋转。 二.原子的构成 1.原子结构 2.构成原子的微粒有三种:质子、中子、电子。决定原子种类的是:质子数。 (所有原子都是三种粒子构成原子吗?有没有例外?) 氢原子例外,它没有中子。 3. 原子中:质子数 = 核电荷数 = 核外电子数 = 原子序数 4. 原子不显电性的原因:原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带的正电荷数(核电荷数)和核外电子所带的负电相等,但电性相反,所以整个原子不显电性。 三. 原子核外的电子是如何运动的? (1).高速运动 (2).无规则运动 (3).分层运动
原子结构知识点总结
知识点总结 一.原子结构与性质. 一.认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K 、L 、M 、N 、O 、P 、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s 、p 、d 、f 表示不同形状的轨道,s 轨道呈球形、p 轨道呈纺锤形,d 轨道和f 轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p 6 、d 10 、f 14 )、半充满(p 3 、d 5、f 7)、全空时(p 0、d 0、f 0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d 54s 1、29Cu [Ar]3d 104s 1. (3).掌握能级交错图和1-36号元素的核外电子排布式. 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正 离子所需要的能量叫做第一电离能。常用符号I 1表示,单位为kJ/mol 。 (1).原子核外电子排布的周期性. 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns 1到ns 2np 6的周期性变化. (2).元素第一电离能的周期性变化. 随着原子序数的递增,元素的第一电离能呈周期性变化: ★同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小; ★同主族从上到下,第一电离能有逐渐减小的趋势. 说明: ①同周期元素,从左往右第一电离能呈增大趋势。电子亚层结构为全满、半满时较相邻元素要大即第 ⅡA 族、第 ⅤA 族元素的第一电离能分别大于同周期相邻元素。Be 、N 、Mg 、P ②.元素第一电离能的运用: a.用来比较元素的金属性的强弱. I 1越小,金属性越强,表征原子失电子能力强弱. B.逐级电离能发生突变是原子核外电子能层排发生了改变,如I(n+1)≥In ,其化合价为n 。 (3).元素电负性的周期性变化. 元素的电负性:元素的原子在分子中吸引电子对的能力叫做该元素的电负性。 随着原子序数的递增,元素的电负性呈周期性变化:同周期从左到右,主族元素电负性逐渐增大;同一主族从上到下,元素电负性呈现减小的趋势. 电负性的运用: a.确定元素类型(一般>1.8,非金属元素;<1.8,金属元素). b.确定化学键类型(两元素电负性差值>1.7,离子键;<1.7,共价键). c.判断元素价态正负(电负性大的为负价,小的为正价). D.对角线规则:Li 和Mg ,Be 和Al ,B 和Si 性质相识 二.化学键与物质的性质. 离子键――离子晶体 1.理解离子键的含义,能说明离子键的形成.了解NaCl 型和CsCl 型离 子晶体的结构特征,能用晶格能解释离子化合物的物理性质. (1).化学键:相邻原子之间强烈的相互作用.化学键包括离子键、共价键和金属键. (2).离子键:阴、阳离子通过静电作用形成的化学键. 离子键强弱的判断:离子半径越小,离子所带电荷越多,离子键越强,离子晶体的熔沸点越高. 离子键的强弱可以用晶格能的大小来衡量,晶格能是指拆开1mol 离子晶体使之形成气态阴离子和阳离子所吸收的能量.晶格能越大,离子晶体的熔点越高、硬度越大. 离子晶体:通过离子键作用形成的晶体. NaCl 晶体结构 1.NaCl 晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,NaCl 晶体中阴阳离子的配位 数是6。 2.晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有12个;晶体中,在每个Cl- 的周围与它最接近的且距离相等的Cl-有12个 3.一个NaCl 晶胞实际拥有的离子数目:Na +4个,Cl -4个。 4.晶体中Na +和Cl -间最小距离为a cm , 计算NaCl 晶体的密度:Ρ=4*M(NaCl)/N A ÷a 3 5.在氯化钠晶体中,与每个Na + 等距离且最近的Cl - 所围成的空间几何构型为正八面体 【探究二】CsCl 晶体结构 (1)在CsCl 晶体中每个铯离子周围有8个氯离子,每个氯离 子周围有8个铯离子,阴阳离子的配位 数是8 。 (2) Cs +周围有6个Cs +, Cl -周围有6个Cl -。 (3)一个氯化铯晶胞实际拥有的离子数目:Cs +离子1 个,Cl -1 个。 (4)晶体中Cs +和Cl -间最小距离为a cm , 计算CsCl 晶体的密度:Ρ=M(Cs Cl)/N A ÷a 3 3、从图中可以看出,Ca 跟F 形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·c m -3,则晶胞的体积是 (只要求列出算式)。 【探究三】ZnS 晶体结构 (1)ZnS 构造:ZnS 晶体中___离子先以__型紧密 堆积(填A 1、A 2或A 3),___离子再填充到空隙中。 (2)在ZnS 晶体中每个Zn 2+周围有__个S 2-,每个S 2-周围有__个Zn 2+,阴阳离子的配位数是__。 (3)一个ZnS 晶胞实际拥有的离子数目:Zn 2+离 子_____个, S 2- ___个。 (4)在ZnS 晶体中每个Zn 2+周围有__个S 2-,每个S 2-周围有__ 意图? 2、将ZnS 晶胞中的Zn 2+和S 2-都换为碳原子,可以得到金刚石晶体的 晶胞,计算金刚石晶胞中含的微粒数为 ,碳碳键的夹角
