黑龙江省大庆市铁人中学2020届高三考前模拟训练(二)化学试题 Word版含答案

铁人中学2017级高三学年考前模拟训练(二)
化学试题
(考试时间:150分钟试卷满分:300分)
可能用到的原子量:H 1 C 12 O 16 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷选择题部分
一、选择题:在每小题给出的四个选项中,只有一项是符合题目要求的。
7.个人卫生及防护与化学知识密切相关。下列说法中正确的是()
A.气溶胶是飞沫混合在空气中形成的胶体,飞沫是分散剂,空气是分散质
B.饮用水的净化常用到明矾,明矾中无重金属元素,长期使用对身体无害
C.制造口罩的核心材料熔喷布的主要成分是聚丙烯,聚丙烯是有机高分子化合物,属于混合物
D.家庭生活中可用84消毒液进行消毒,84消毒液与洁厕灵可以混合使用效果更好
8.设N A为阿伏加德罗常数的值,下列说法正确的是()
A.100 g溶质质量分数为46%的乙醇水溶液中,含有4N A个氧原子
B.标准状况下,11 g T216O中含有的质子数目为6N A
C.3.65 g液态HCl中含有的粒子总数为0.2N A
D.25 ℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3N A个Ca2+
9.R、X、Y、Z的原子序数依次增大,且都不超过10.这四种元素可组成一种化合物的结构如图所示。下列说法正确的是()
A.常温常压下,上述元素的单质都呈气态
B.最高价氧化物对应水化物的酸性:X>Y
C.Y、Z的气态氢化物能发生化合反应
D.由R、X两种元素只能形成一种化合物
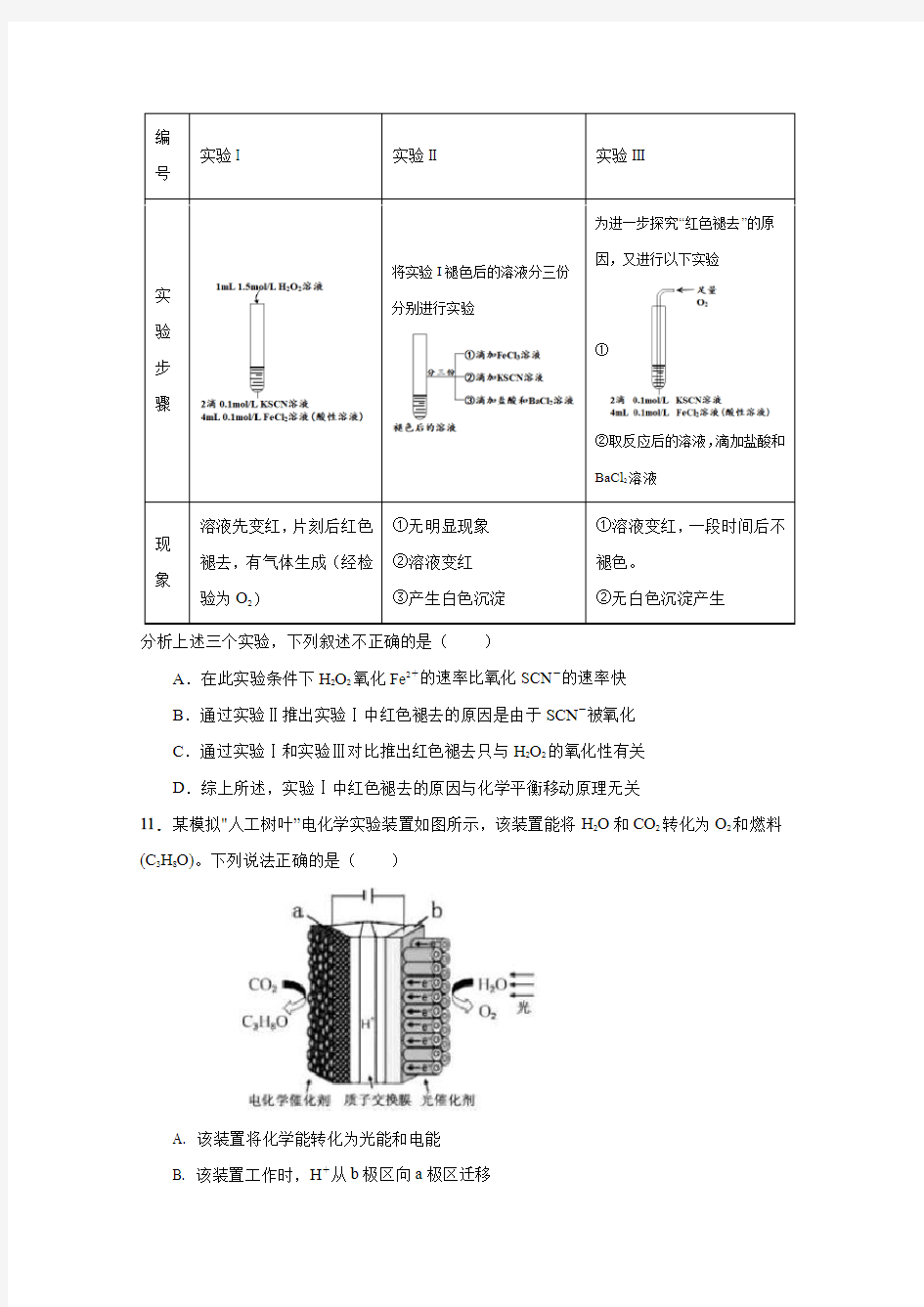
10.某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编
号
实验I 实验II 实验III
实验步骤将实验I褪色后的溶液分三份
分别进行实验
为进一步探究“红色褪去”的原
因,又进行以下实验
①
②取反应后的溶液,滴加盐酸和
BaCl2溶液
现象溶液先变红,片刻后红色
褪去,有气体生成(经检
验为O2)
①无明显现象
②溶液变红
③产生白色沉淀
①溶液变红,一段时间后不
褪色。
②无白色沉淀产生
分析上述三个实验,下列叙述不正确的是()
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
11.某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是()
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
12.现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是()
A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
13.常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布
分数α
(X)=-2-
2333
c(X)
c(H CO)+c(HCO)+c(CO)
与pH的关系如图所示:
下列说法正确的是()
A. 反应HCO3-H++CO32-的lg K=-6.4
B. pH=8溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)=c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:
HCO3-+OH-=CO32-+H2O
第II卷
三、非选择题:
(一)必考题:
26.(15分)茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是V C 的5~10 倍),它易
溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+
与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A 表示)与茶多酚在一定浓度范围内成正比。A 与茶多酚标准液浓度的关系如图1 所示:
某实验小组设计如下实验流程从茶叶中提取茶多酚:
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图2 所示,原因是。若用乙醇浸取茶多酚操作如下:称取10 g 茶叶末,用滤纸包好,装入中,圆底烧瓶内加和适量乙醇,如图3 安装后,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃。为使恒压漏斗内液面高出茶叶包约0.5 cm,并保持约 1 h,可行的操作方法
是。
(2)减压蒸发相对于一般蒸发的优点是;氯仿的作用是。
(3)下列有关实验基本操作不正确的是。
A.图3 中冷凝水流向为a 进b 出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液(4)称取1.25 g 粗产品,用蒸馏水溶解并定容至1000 mL,移取该溶液 1.00 mL,加过量Fe3+和酸性溶液,用蒸馏水定容至100 mL 后,测得溶液光密度值A=0.800,则产品的纯度是(以质量分数表示)。
27.(14分)草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;
②Fe(SCN)
3-+3C2O42-=Fe(C2O4)33-+6SCN-。
6
回答下列问题:
Ⅰ.
甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为_______(填“正确”或“不正确”),理由是___________________________________。
Ⅱ.
乙同学为测定草酸亚铁晶体FeC2O4﹒xH2O中的结晶水含量,利用如下装置:
①做实验前首先要_____________________________;
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤依次为______________,重复实验直至B中恒重。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K
d.打开K,缓缓通入空气
e.冷却至室温
f.称量
Ⅲ.
丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a克草酸亚铁晶体溶入稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c mol/L 的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式。
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有。
(3)x= 。
(4)若实验中滴入KMnO4溶液过多,则所得x值___________(填偏大、偏小或无影响)
28.(14分)联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性.都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ?mol-1
②N
2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ?mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H= 。
(2)已知反应N 2H4(g)+ 2Cl2(g)N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
①0~ 10 min 内,用N 2(g)表示的平均反应速率v (N 2)= 。
②M 点时,N 2H 4的转化率为 (精确到0.1)%。
③T °C 时,达到平衡后再向该容器中加入1.2 mol N 2H 4(g)、0.4 mol Cl 2(g)、0. 8 mol N 2 (g)、
1.2 mol HCl(g),此时平衡 (填“正向移动”“逆向移动”或“不移动”)。
(3)①在惰性气体中,将黄磷(P 4)与石灰乳和碳酸钠溶液一同加入高速乳化反应器中制得NaH 2PO 2,同时还产生磷化氢(PH 3)气体,该反应的化学方程式为 。
②次磷酸(H 3PO 2)是一元酸,常温下,1.0 mol ?L -1的NaH 2PO 2溶液pH 为8,则次磷酸的Ka = 。
③用次磷酸钠通过电渗析法制备次磷酸.装置如图2所示。交换膜A 属于____(填“阳离子”或“阴离子”)交换膜,电极N 的电极反应式为 ,当电路中流过3.8528×105库仑电量时,制得次磷酸的物质的量为 (一个电子的电量为
1.6×10- 19库仑,N A 数值约为6. 02× 1023)。
(二)选考题:
35.[化学——选修3:物质结构与性质](15分)
Fe 、Cu 、Cr 都是第四周期过渡元素,回答下列问题。
(1)FeCl 3是一种常用的净水剂,氯元素的原子核外有 种不同运动状态的电子;有 种不同能级的电子,基态Fe 3+的电子排布式为 。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的结构如图所示(K+未画出),则一个晶胞中的K+个数为。
(3)Cu2+能与乙二胺(H2N-CH2-CH2-NH2)形成配离子。该配离子中含有的化学键类型
有。(填字母)
a.配位键b.极性键c.离子键d.非极性键,
乙二胺中共有____个σ键,C原子的杂化方式为。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g·cm-3,则铜原子的直径约为____pm。
(5)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。回答下列问题。某化合物的化学式为Na3CrO8,其阴离子结构可表示为,则Cr的化合价为____。CrO42-呈四面体构型,结构为,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为。
36.[化学——选修5:有机化学基础](15分)
洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:
回答下列问题:
(1)A的化学名称是;A制备B反应的化学方程式为(注明反应条件)。
(2)D生成E的反应类型为;F中能与氢气发生加成反应的官能团名称为。
(3)C的分子式为;一定条件下,C能发生缩聚反应,化学方程式为。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH CH3COCl,(2,6-二甲基苯氧基)乙酰氯()是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线(其它无机试剂任选)。
化学参考答案
7.C
【解析】A.飞沫在空气中形成气溶胶,飞沫是分散质,空气是分散剂,A不正确;
B.明矾中的Al3+对人体有害,不能长期使用,B不正确;
C.聚丙烯是由链节相同但聚合度不同的分子形成的混合物,D正确;
D.84消毒液(有效成分为NaClO)与洁厕灵(主要成分为HCl)混合,会反应生成Cl2,污染环境,D不正确;8.A
【解析】A.乙醇溶液中除了乙醇外,水也含氧原子,100 g 46%的乙醇溶液中,乙醇的质量为46 g,物质的量为1 mol,乙醇含1 mol氧原子;水的质量为100 g-46 g=54 g,物质的量为3 mol,水含3 mol氧原子,所以此溶液中含有的氧原子的物质的量共为4 mol,个数为4N A,故A正确;
B.标准状况下,11 g T216O的物质的量是0.5mol,其中含有的质子数目为5N A,故B错误;
C.3.65 g液态HCl的物质的量是0.1mol,含有的微粒是HCl分子,则其中含有的粒子总数为0.1N A,故C错误;
D.25 ℃时,K sp(CaSO4)=9×10-6,则CaSO4饱和溶液中Ca2+浓度为3×10-3mol/L,不知溶液体积,不能计算粒子数,故D错误。
9.C
【解析】R、X、Y、Z的原子序数依次增大,且都不超过10,由化合物的结构可知,R、Z只形成1个共价键,且可形成R+、Z-离子,X的最外层有3个电子,Y最外层有5个电子,结合原子序数可知R为H、X为B、Y为N、Z为F。
A.X为B元素,B元素的单质在常温下为固体,故A错误;
B.非金属性B<N,最高价氧化物对应水化物分别为硼酸、硝酸,硼酸为弱酸,硝酸为强酸,所以酸性:X <Y,故B错误;
C.Y、Z的气态氢化物分别为氨气、氟化氢,二者能发生化合反应生成NH4F,故C正确;
D.由R、X两种元素可形成多种硼烷,类似烷烃,故D错误;
10.D
【解析】氯化亚铁酸化的溶液中滴入KSCN溶液,滴入过氧化氢发生氧化还原反应,通入足量氧气,溶液变红且不褪色,说明氧气氧化亚铁离子生成铁离子,滴加盐酸和BaCl2溶液,无白色沉淀,无硫酸钡沉淀生成,排除了生成的氧气氧化SCN-的可能,
A. 在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快,所以溶液先变红,当SCN-被完全氧化后,
红色褪去,故A 正确;
B. 实验II 中滴加FeCl 3溶液不变红,说明无SCN -,滴加盐酸和BaCl 2溶液,有白色沉淀生成,说明SCN -被氧化为SO 42-,可以推出实验Ⅰ中红色褪去的原因是由于SCN -被氧化,故B 正确;
C. 对比实验Ⅰ、Ⅲ,实验Ⅰ排除了铁离子反应,而是SCN -离子反应,实验Ⅲ排除了生成的氧气氧化SCN -的可能,Ⅰ中红色褪去可以判定酸性条件下是H 2O 2的氧化性把SCN -离子氧化为硫酸根离子,故C 正确;
D. 红色物质为Fe 3+与SCN -结合形成的络合物,为可逆反应,当SCN -被氧化,平衡逆向移动,红色褪去,与化学平衡移动原理有关,故D 错误;故选D 。
11.B
【详解】A .根据图示可知,该装置将电能和光能转化为化学能,错误;
B .根据同种电荷相互排斥,异种电荷相互吸引的原则,该装置工作时,H +从正电荷较多的阳极b 极区向负电荷较多的阴极a 极区迁移,正确;
C .该反应的总方程式是:6CO 2+8H 2O=2C 3H 8O+9O 2。根据反应方程式可知,每生成1 mol O 2,有2/3molCO 2被还原,其质量是88/3g ,错误;
D .根据图示可知与电源负极连接的a 电极为阴极,发生还原反应,电极的反应式为:3CO 2+ 18H ++18e -= C 3H 8O+5H 2O ,错误;
12.D
【解析】A .该有机物的分子式为:C 18H 32N 3O 8P 2Cl ,A 错误;
B .分子中含有苯环、氯原子,该有机物能够发生加成反应、取代反应,有机物可以燃烧,能发生氧化反应,B 错误;
C .该有机物苯环上的1-溴代物只有3种,C 错误;
D .氯原子水解形成酚羟基,磷酸能与氢氧化钠反应,因此1mol 该有机物最多能和8molNaOH 发生反应,D 正确。
13.B
【详解】A 、pH═6.4时,c (HCO 3-)═c (H 2CO 3),反应H 2CO 3
H ++HCO 3-的lgK═lgc(H +)=lg10-6.4=一6.4,
故A 项错误;
B 、pH═8的溶液中:c (H +)
)>c (HCO 3-),故B 正确;
C 、向NaHCO 3溶液中滴入少量盐酸至溶液显中性时,c (H +)═c (OH -),根据电荷守恒有c (Na +)+c (H +)═c (C1-)十c (HCO 3-)+2c (CO 32-)+c (OH -),即c (Na +)═c (C1-)十c (HCO 3-)+2c (CO 32-),故C
项错误;
D 、pH═6.4的溶液中含有等物质的量的NaHCO 3和H 2CO 3,由图像可知,pH=8时溶液中HCO 3-继续增大,继续减少H 2CO 3,故主要发生的离子反应为H 2CO 3+OH -=HCO 3-+H 2O ,故D 项错误。
26.(1)茶多酚易被氧气氧化,搅拌速度越快,茶多酚氧化速度越快,浸出率越低(2分)
恒压滴液漏斗(1分) 沸石(1分)
关闭活塞,当漏斗内液面高出茶叶包约0.5cm 时,调节活塞使乙醇冷凝速度与漏斗放液速度一致(2分) (2)降低蒸发温度防止产物氧化或分解 (2分) 萃取(2分) (3)CD (2分)
(4)K 3Fe(CN)6 (1分) 96% (2分)
【解析】 (1)操作①用水浸取茶多酚时,从图2中可以看出,搅拌速率越快,光密度值(A)越小,即茶多酚浓度越小,因为茶多酚易被氧气氧化,搅拌越快,与空气的接触越多,由此得出原因是:茶多酚易被氧气氧化,搅拌速度越快,茶多酚氧化速度越快,浸出率越低。为使恒压漏斗内液面高出茶叶包约 0.5 cm ,并保持约 1 h ,可行的操作方法是关闭活塞,当漏斗内液面高出茶叶包约0.5cm 时,调节活塞使乙醇冷凝速度与漏斗放液速度一致。答案为:茶多酚易被氧气氧化,搅拌速度越快,茶多酚氧化速度越快,浸出率越低;关闭活塞,当漏斗内液面高出茶叶包约0.5cm 时,调节活塞使乙醇冷凝速度与漏斗放液速度一致;
(2)减压蒸发比蒸发所需的温度低,除节省能源外,还可使环境的温度降低,其优点是降低蒸发温度防止产物氧化或分解;因为后加入的乙酸乙酯萃取茶多酚,则氯仿萃取的应是杂质,由此得出氯仿的作用是萃取(或除杂)。答案为:降低蒸发温度防止产物氧化或分解;萃取(或除杂);
(3)A .图 3 中冷凝水流向应下进上出,即a 进b 出,A 正确;
B .分液漏斗使用前,为防漏液,应查漏,然后洗涤备用,B 正确;
C .操作①过滤时,不可用玻璃棒搅拌,否则会造成滤纸损坏,C 不正确;
D .萃取过程中,分液漏斗应静置分层后,再进行分液,D 不正确;
故选CD 。答案为:CD ;
(4) 根据题目信息,应加入显色剂K 3Fe(CN)6。溶液光密度值 A=0.800,从表中可查得茶多酚的浓度为
1.2×10-5g/mL ,由此可得出原1000 mL 溶液中所含茶多酚的质量为1.2×10-5g/mL×100mL×1000mL 1mL
=1.2g ,则产品的纯度是
1.2g 100%1.25g
=96%。答案为:96%。
27. Ⅰ. 不正确 1分 根据已知C 2O 42-比SCN -更易与Fe 3+结合 2分 Ⅱ.检查装置气密性1分 . dabecf 2分
Ⅲ.(1)3MnO 4- + 5Fe 2++5C 2O 42— + 24H + = 3Mn 2+ + 5Fe 3+ + 12H 2O+10CO 2↑
或3MnO4- + 5Fe2++5H2C2O4 + 14H+ = 3Mn2+ + 5Fe3+ + 12H2O+10CO2↑ 2分
(2)500mL容量瓶、胶头滴管2分
(3)(50a-72cV)/(9cV) 2分
(4)偏小2分
【详解】I. 根据题给信息可知,C2O42-比SCN-更易与Fe3+结合,所以取少量的晶体样品溶于稀硫酸,滴加KSCN 溶液,溶液无明显变化,不能判定晶体中不存在+3价的铁,不正确;正确答案:不正确;根据已知C2O42-比SCN-更易与Fe3+结合。
II. ①做实验前首先要检查装置是否漏气;正确答案:检查装置气密性。
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤:由于草酸亚铁晶体中亚铁离子易被氧气氧化,所以要排净装置内的空气,打开K,缓缓通入空气(d),然后点燃酒精灯,加热(a),反应发生,结束后,熄灭酒精灯(b),冷却至室温(e),关闭K (c),进行称量(f),重复实验直至B中恒重;正确的操作步骤为:dabecf。
III. (1)草酸亚铁晶体中含有Fe2+和C2O42—,在酸性条件下,均能被KMnO4溶液氧化为Fe3+和CO2,而MnO4-被还原为Mn2+,根据电子守恒、电荷守恒及原子守恒写出离子方程式:3MnO4- + 5Fe2++5C2O42— + 24H+ = 3Mn2+ + 5Fe3+ + 12H2O+10CO2↑或3MnO4- + 5Fe2++5H2C2O4 + 14H+ = 3Mn2+ + 5Fe3+ + 12H2O+10CO2↑ ;正确答案:3MnO4- + 5Fe2++5C2O42— + 24H+ = 3Mn2+ + 5Fe3+ + 12H2O+10CO2↑或3MnO4- + 5Fe2++5H2C2O4 + 14H+ = 3Mn2+ + 5Fe3+ + 12H2O+10CO2↑ 。
(2)把草酸亚铁溶液稀释成500mL溶液时,除烧杯和玻璃棒外,还必需的玻璃仪器有500mL容量瓶、胶头滴管;正确答案:500mL容量瓶、胶头滴管。
(3)根据反应:3MnO4- + 5Fe2++5C2O42— + 24H+ = 3Mn2+ + 5Fe3+ + 12H2O+10CO2↑可知,反应产生的Fe3+把碘离子氧化为碘单质,反应为2Fe3++ 2I-= 2Fe2++ I2;生成的碘又被Na2S2O3还原为I-,反应为
2Na2S2O3+I2=Na2S4O6+2NaI;根据上述反应关系可知:n(FeC2O4﹒xH2O)= n(FeC2O4)= n(Fe2+)=
n(Fe3+)=1/2n(I2)=n(Na2S2O3),n(Na2S2O3)= V×10-3×cmol,所以50mL溶液中n(FeC2O4﹒xH2O)=( V×10-3×c)mol,又原溶液为500mL,所以n(FeC2O4﹒xH2O)=( V×10-3×c)×(500/50)mol=10(V×10-3×c) mol;草酸亚铁晶体ag,所以a/(144+18x)= 10( V×10-3×c),x=(50a-72cV)/(9cV) ;正确答案:(50a-72cV)/(9cV) 。
(4)若实验中滴入KMnO4溶液过多,碘离子被氧化的量增多,消耗的n(Na2S2O3)= cV增多,根据x=(50a-72cV)/(9cV)关系可知,则所得x值偏小;正确答案:偏小。
28.(1)-1038.7kJ?mol-12分
(2)①0.06mol/(L?min) 1分②33.3 2分③逆向移动1分
(3)①2P4+3Ca(OH)2+3Na2CO3+6H2O==== 6NaH2PO2+2PH3↑+3CaCO32分
②1.0×
10-2 2分 ③阳离子 1分 . 2H 2O+2e -=H 2↑+2OH - 1分 4mol 2分
【详解】(1)根据盖斯定律,反应①×
2+②即可得火箭燃料的燃烧反应: 2N 2H 4(1)+N 2O 4(l)===3N 2(g)+4H 2O(g)△H =(-621.5×2+204.3)kJ?mol -1=-1038.7kJ?mol -1;
(2)根据图示,Cl 2作为反应物浓度需减小,HCl 作为生成物浓度需增大,
①△c (Cl 2)=(2-0.8)mol/L=1.2mol/L ,v (Cl 2)=
1.2mol/L =10min c t ??=0.12mol/(L?min),根据反应速率与计量系数成正比可得v (N 2)=12
v (Cl 2)=0.06mol/(L?min), ②据图可知反应开始时c (Cl 2)=2mol/L ,投料为2 mol N 2H 4(g)和4 mol Cl 2(g) ,则开始时c (N 2H 4)=1mol/L ,容器体积为2L ,设M 点 N 2H 4的转化量为x mol/L ,列三段式:
()()
()()2-1-1-2142N H g +2+mol L 12
00m Cl ol L x 2x
x 4x mo g N g 4HC l L 1-x 2-2l x x 4x g 起始()转化()平衡() M 点Cl 2和HCl 的浓度相等,则2-2x=4x 解得x=13mol/L ,则N 2H 4的转化率为-1-11mol L 31mol L
=33.3%; ③据图可知反应平衡时c (Cl 2)=0.8mol/L ,初始c (Cl 2)=2mol/L ,c (N 2H 4)=1mol/L ,则根据反应方程式N 2H 4(g)+ 2Cl 2(g)N 2(g)+4HCl(g)可知,反应中消耗c (Cl 2)=1.2mol/L ,消耗c (N 2H 4)=0.6mol/L ,生成c (N 2)=0.6mol/L ,c (HCl)=2.4mol/L ,所以平衡时各物质的浓度为c (Cl 2)=0.8mol/L ,c (N 2H 4)=0.4mol/L ,c (N 2)=0.6mol/L ,
c (HCl)=2.4mol/L ,则该温度下的平衡常数K =4
2
0.6 2.40.40.8??=77.76; 平衡后再向该容器中加入1.2molN 2H 4(g)、0.4 mol Cl 2(g)、0.8molN 2(g)、1.2molHCl(g),各物质的浓度变为
c (Cl 2)=1mol/L ,c (N 2H 4)=1mol/L ,c (N 2)=1mol/L ,c (HCl)=3mol/L ,此时Q c =4
21311
??=81>K ,所以平衡逆向移动; (3)①该反应中反应物有P 4、Ca(OH)2、Na 2CO 3等、生成物有NaH 2PO 2、PH 3等,据此可知该反应中P 元素化合价既升高又降低,发生歧化,升高1价,降低3价,则NaH 2PO 2和PH 3系数比为3:1,再结合元素守恒可知方程式为:2P 4+3Ca(OH)2+3Na 2CO 3+6H 2O==== 6NaH 2PO 2+2PH 3↑+3CaCO 3;
②次磷酸(H 3PO 2)是一元酸,1.0mol?L -1的 NaH 2PO 2溶液水解方程式为:H 2PO 2-+H 2O=H 3PO 2+OH -,pH=8,则c (H +)=10-8mol/L ,c (OH -)=c (H 3PO 2)=10-6mol/L ,c (H 2PO 2-)=(1.0-10-6)mol/L≈1mol/L ,
K a =()()()+--822-632H H PO 101=H PO 10
c c c ?=1.0×10-2; ③根据图示可知,产品室产生次磷酸,则电极M 应为阳极电解水中的OH -,剩余H +通过交换膜A 移向产品室,所以交换膜A 为阳离子交换膜;电极N 为阴极电解H +,电极N 的电极反应式为2H 2O+2e -=H 2↑+2OH -;
电路中流过3.8528×105库仑电量时,转移的电子的物质的量为
5
-19
A
1
1.610
3.852810
N
?
?
?
=4mol,次磷酸根带一个
负电荷,氢离子带一个正电荷,所以电解过程中转移1mol电子生成1mol次磷酸,则转移4mol电子时生成4mol次磷酸。
35.(1)17(1分)5(1分)1s22s22p63s23p63d5(1分)(2)K2[Fe(SCN)5] (1分) 4 (1分)(3)abd(2分)11 (2分)sp3(1分)(4)255 (2分)(5)+5 (1分)Cr n O(3n+1)2-(2分)【解析】(1)氯原子核外电子数为17,每个电子的运动状态均不同,故氯原子核外有17种不同运动状态的电子;氯原子核外电子排布式为1s22s22p63s23p5,电子分布在1s、2s、2p、3s、3p这五个能级;Fe是26号元素,铁原子核外电子排布式为1s22s22p63s23p63d64s2,铁原子失去4s能级2个电子,再失去3d能级1个电子形成Fe3+,故基态Fe3+的电子排布式为1s22s22p63s23p63d5。
(2)Fe3+与SCN-形成配位数为5的配离子为[Fe(SCN)5]2-,根据电荷守恒可知配离子与K+形成的配合物的化学式为K2[Fe(SCN)5];题给物质晶胞的结构中,Fe3+的个数为4×=,Fe2+的个数为4×=,CN-的个数为12×=3,根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),可得N(K+)=,故一个晶胞中的K+个数为×8=4;
(3)Cu2+与乙二胺(H2N-CH2-CH2-NH2)之间形成配位键,H2N-CH2-CH2-NH2中碳原子之间形成非极性键,不同原子之间形成极性键,所以选abd;单键为σ键,一个乙二胺分子中含有11个σ键,碳原子均饱和没有孤电子对,形成4个σ键,所以碳原子采取sp3杂化;
(4)根据铜晶胞为面心立方最密堆积,由边长可计算出晶胞的体积V=(361pm)3≈4.70×10-23cm3,根据
m=ρ×V=9.00 g?cm-3×4.70×10-23cm3=4.23×10-22g;由于一个铜晶胞中含有的铜原子数为8×+6×=4(个),每个铜原子的体积约为==1.18×10-23 cm3,则×π×d3=1.18×10-23cm3,解得铜原子的直径d≈255pm;
(5)由阴离子结构可知,Cr与O中形成5个价键,共用电子对偏向O,则Cr的化合价为+5价,两个CrO42-每共用一个角顶氧原子,就少一个氧原子,所以由n(n>1)个CrO42-通过角顶氧原子连续的链式,减少(n-1)个氧原子,微粒电荷不变,则由n(n>1)个CrO42-通过角顶氧原子连续的链式结构的化学式为Cr n O(3n+1)2-。
36.(1)甲苯+Cl2+HCl (2)取代反应羰基、碳碳双键
(3)C9H11O2N
(4)吸收反应生成的HCl,提高反应转化率(5)或
(6)
【解析】(1)A是,名称为甲苯,A与Cl2光照反应产生和HCl,反应方程式为:+Cl2+HCl;
(2)D与CH3CN在NaNH2作用下反应产生E:,是D上的被-CH2CN取代产生,
故反应类型为取代反应;
F分子中的、与H2发生加成反应形成G,故F中能够与氢气发生加成反应的官能团名称为羰基、碳碳双键;
(3)C结构简式为,可知C的分子式为C9H11O2N;C分子中含有羧基、氨基,一定条件下,能发生缩聚反应,氨基脱去H原子,羧基脱去羟基,二者结合形成H2O,其余部分结合形成高聚物,该反应
的化学方程式为:;
(4)K2CO3是强碱弱酸盐,CO32-水解使溶液显碱性,B发生水解反应会产生HCl,溶液中OH-消耗HCl电离产生的H+,使反应生成的HCl被吸收,从而提高反应转化率;
(5)C结构简式是,分子式为C9H11O2N,C的同分异构体X符合下列条件:①含有苯环,且
苯环上的取代基数目≤2;②含有硝基;③有四种不同化学环境的氢,个数比为6:2:2:1,则X可能的结构为或;
(6)2,6-二甲基苯酚()与ClCH2COOCH2CH3在K2CO3作用下发生取代反应产生
,该物质与NaOH水溶液加热发生水解反应,然后酸化得到,与SOCl2发生取代反应产生,故合成路线为
