化学选修四第四章《电化学基础》测试题

高二化学选修四《电化学基础》复习检测试题相对原子质量:H:1 C:12 N:14 O:16 Cu:64 Ag:108 选择题(每题只有一个选项符合题意)
1.下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是( )
A.水中的钢闸门连接电源的负极
B.金属护拦表面涂漆
C.汽水底盘喷涂高分子膜
D.地下钢管连接锌板
2.下列叙述正确的是( )
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl
2
C.氢氧燃料电池(酸性电解质)中O
2
通入正极,
电极反应为O
2+4H++4e-===2H
2
O
D.右图中电子由Zn极流向Cu,盐桥中的Cl-移
向CuSO
4
溶液
3.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是()
A.由Al、Cu、稀H
2SO
4
组成原电池,其负极反应式为:Al-3eˉ=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:
Al-3eˉ+4OHˉ=AlO
2ˉ+2H
2
O
C.由Fe、Cu、FeCl
3
溶液组成原电池,其负极反应式为:Cu-2eˉ=Cu2+ D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2eˉ=Cu2+
4.有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
5.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。有关该电池的说法正确的是()
A.Mg为电池的正极 B.负极反应为AgCl+e-=Ag+Cl-
C.不能被KCl 溶液激活 D.可用于海上应急照明供电
6.用铁丝、铜丝和CuSO
4
溶液可以构成原电池或电解池,如图所示则下列说法正确的是( )
A.构成原电池时Cu极反应为:Cu—2e=Cu2+
B.构成电解池时Cu极质量可能减少也可能增加
C.构成电解池时Fe极质量一定减少
D.构成的原电池或电解池工作后都可能产生大量气体
Fe Cu
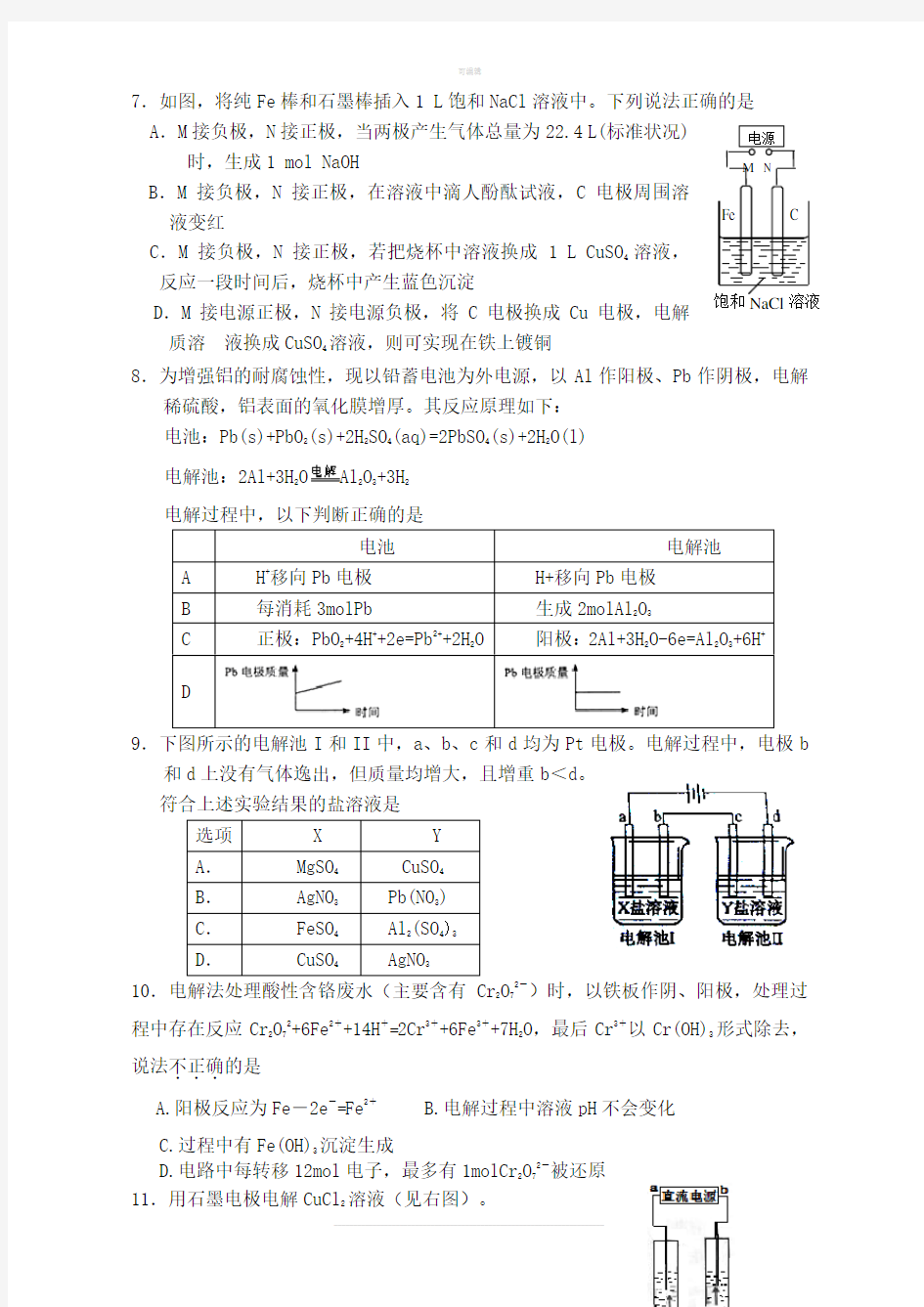
7.如图,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是
A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况) 时,生成1 mol NaOH
B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红
C.M接负极,N接正极,若把烧杯中溶液换成 1 L CuSO
4
溶液,反应一段时间后,烧杯中产生蓝色沉淀
D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解
质溶液换成CuSO
4
溶液,则可实现在铁上镀铜
8.为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s)+PbO
2(s)+2H
2
SO
4
(aq)=2PbSO
4
(s)+2H
2
O(l)
电解池:2Al+3H
2O Al
2
O
3
+3H
2
电解过程中,以下判断正确的是
电池电解池A H+移向Pb电极H+移向Pb电极
B每消耗3molPb生成2molAl
2O 3
C正极:PbO
2+4H++2e=Pb2++2H
2
O阳极:2Al+3H
2
O-6e=Al
2
O
3
+6H+
D
9.下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b 和d上没有气体逸出,但质量均增大,且增重b<d。
符合上述实验结果的盐溶液是
选项X Y
A.MgSO
4CuSO
4
B.AgNO
3Pb(NO
3
)
C.FeSO
4Al
2
(SO
4
)3
D.CuSO
4AgNO
3
10.电解法处理酸性含铬废水(主要含有Cr
2O
7
2-)时,以铁板作阴、阳极,处理过
程中存在反应Cr
2O
7
2+6Fe2++14H+=2Cr3++6Fe3++7H
2
O,最后Cr3+以Cr(OH)
3
形式除去,
说法不正确
...的是
A.阳极反应为Fe-2e-=Fe2+
B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)
3
沉淀生成
D.电路中每转移12mol电子,最多有1molCr
2O
7
2-被还原
11.用石墨电极电解CuCl
2溶液(见右图)。
Fe C
电源
M N
下列分析正确的是
A.a端是直流电源的负极
B.通电使CuCl
2
发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
12..目前人们正研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,
以Na+导电的β-Al
2O
3
陶瓷作固体电解质,反应为:2Na+xS Na
2
Sx下列说法正
确的是()
A.放电时,钠作负极,硫作正极
B.放电时,钠极发生还原反应
C.充电时,钠极与外电源的正极相连,硫极与外电源的负极相连D.充电时,阳极发生的反应是S
x
2--2e-=xS
13.500 mL NaNO
3和Cu(NO
3
)
2
的混合溶液中c(NO-3)=6 mol·L-1,用石墨作电极电解
此溶液,当通电一段时间后,两极均收集到气体22.4 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Na+)=6 mol·L-1 B.电解后溶液中c(H+)=4 mol·L-1 C.上述电解过程中共转移8 mol电子 D.电解后得到的Cu的物质的量为2 mol
14.用石墨电极电解CuSO
4溶液一段时间后,向所得溶液中加入0.2 mol Cu(OH)
2
后,
恰好使溶液恢复到电解前的浓度。则电解过程中转移的电子的物质的量为( )
A.0.4 mol B.0.5 mol C.0.6 mol D.0.8 mol
15.金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe
2O
3
b.NaCl c.Cu
2
S d.Al
2
O
3
e.AlCl
3
(2)精铜冶炼的阳极反应方程式为。
以CuSO
4
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)
的电解精炼,下列说法正确的是。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)利用反应2Cu+O
2+2H
2
SO
4
=CuSO
4
+2H
2
O可以制备CuSO
4
,若将该反应设计为原电池,
其正极电极反应式为。
(4)右图为电解精炼银的示意图,(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为
16.某校化学研究性学习小组欲设计实验验证Zn、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制 _____________ 、_____________ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为 。
(2)①若用Zn 、Cu 作电极设计成原电池,并能产生持续稳定的电流,以确定Zn 、Cu 的活动性。试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液。
上述装置中正极反应式为 。 ②某小组同学采用Zn 、Fe 作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用 。
A.0.5 mol·L 1氯化亚铁溶液 B . 0.5 mol·L 1氯化铜溶液 C. 0.5 mol·L 1盐酸 D. 0.5 mol·L 1氯化亚铁和0.5 mol·L 1氯化铜混合溶液
17.某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K 时,观察到电流计的指针发生了偏转。
请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或“电镀池”),A 电极的电极反应式为 。
(2)丙池中F 电极为 (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为 。 (3)当池中C 极质量减轻10.8 g 时,甲池中B 电极理论上消耗O 2的体积为 mL(标准状况)。
(4)已知丙池中的溶液为500 mL ,合上开关K ,一段时间后,丙池中共收集到气体224 mL(标况下)气体,则此时溶液的pH 为 。断开K 后,如果要恢复丙池中原溶液的浓度,可以加入 克的下列物质 。如果要使乙池恢复到反应前的浓度则可选择 (填选项字母)。
CH 3OH 甲池
石墨 B A
O 2 C Ag 32乙池
D Ag
E CuSO 4溶液 丙池
F 石墨
K
A
A.Cu B.CuO C.Cu(OH)
2 D.Cu
2
(OH)
2
CO
3
