浙江省宁波市余姚中学化学硫及其化合物 知识点及练习题

浙江省宁波市余姚中学化学硫及其化合物知识点及练习题
一、选择题
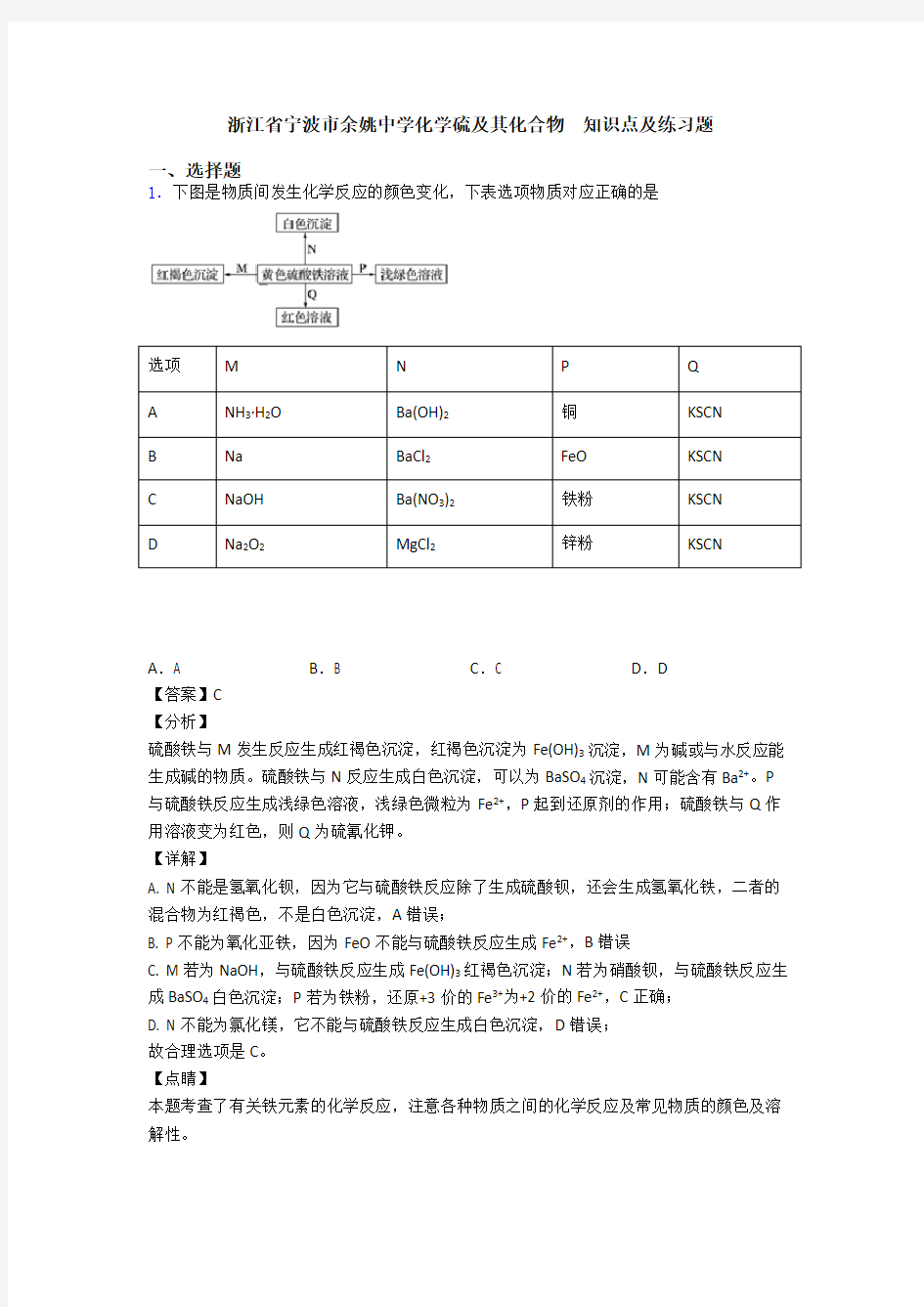
1.下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
选项M N P Q
A NH3·H2O Ba(OH)2铜KSCN
B Na BaCl2FeO KSCN
C NaOH Ba(NO3)2铁粉KSCN
D Na2O2MgCl2锌粉KSCN
A.A B.B C.C D.D
【答案】C
【分析】
硫酸铁与M发生反应生成红褐色沉淀,红褐色沉淀为Fe(OH)3沉淀,M为碱或与水反应能生成碱的物质。硫酸铁与N反应生成白色沉淀,可以为BaSO4沉淀,N可能含有Ba2+。P 与硫酸铁反应生成浅绿色溶液,浅绿色微粒为Fe2+,P起到还原剂的作用;硫酸铁与Q作用溶液变为红色,则Q为硫氰化钾。
【详解】
A. N不能是氢氧化钡,因为它与硫酸铁反应除了生成硫酸钡,还会生成氢氧化铁,二者的混合物为红褐色,不是白色沉淀,A错误;
B. P不能为氧化亚铁,因为FeO不能与硫酸铁反应生成Fe2+,B错误
C. M若为NaOH,与硫酸铁反应生成Fe(OH)3红褐色沉淀;N若为硝酸钡,与硫酸铁反应生成BaSO4白色沉淀;P若为铁粉,还原+3价的Fe3+为+2价的Fe2+,C正确;
D. N不能为氯化镁,它不能与硫酸铁反应生成白色沉淀,D错误;
故合理选项是C。
【点睛】
本题考查了有关铁元素的化学反应,注意各种物质之间的化学反应及常见物质的颜色及溶解性。
2.下列四种有色溶液与SO2气体作用,其实质相同的是()
①酸性高锰酸钾溶液;②品红溶液;③溴水;④滴有酚酞的氢氧化钠溶液;
A.②③B.①③C.①④D.②④
【答案】B
【详解】
①酸性高锰酸钾溶液与二氧化硫反应发生氧化还原反应,体现二氧化硫的还原性;
②品红溶液与二氧化硫发生非氧化还原反应生成无色的物质,体现二氧化硫的漂白性;
③溴水与二氧化硫反应发生氧化还原反应,体现二氧化硫的还原性;
④滴有酚酞的氢氧化钠溶液与二氧化硫反应生成亚硫酸钠和水,体现二氧化硫的酸性;综上所述,①③反应原理相同,答案为B。
3.如图是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是()
硫酸化学纯(CP)(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.该硫酸的物质的量浓度18.0 mol·L-1
B.1molZn与足量的该硫酸反应能产生22.4L H2
C.配制230mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
【答案】C
【详解】
A.该硫酸的物质的量浓度为1000w
M
ρ
=
1000 1.8
9
4
8
98%
??
=18.4mol/L,故A错误;
B.18.4mol/L的硫酸为浓硫酸,浓硫酸与Zn反应生成二氧化硫,不会生成氢气,故B错误;
C.配制230mL4.6mol·L-1的稀硫酸需要选取250 mL容量瓶,设需浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则250mL×4.6 mol?L-1=V×18.4mol/L,解得V=62.5mL,故C正确;
D.NaOH溶液具有强腐蚀性,会腐蚀皮肤,若不小心将该硫酸溅到皮肤上,应该用水冲洗后,再用稀的碳酸氢钠溶液涂抹,故D错误;
故选C。
4.下列有关硫及其化合物的说法中正确的是
A.浓硫酸具有吸水性,可做干燥剂,如可干燥氯气、二氧化硫、氨气等
B.浓硫酸与炭共热反应,仅体现了浓硫酸的强氧化性
C.SO2和 Cl2均可使品红溶液褪色,但溶有 SO2的品红溶液加热后恢复红色,说明 SO2的氧化性没有 Cl2强
D.以 FeS2为原料生产硫酸过程中,要用到沸腾炉、接触室、吸收塔等设备,所涉及的反应均为氧化还原反应
【答案】B
【详解】
A.浓硫酸的强氧化性和酸性,不能干燥氨气和硫化氢等还原性气体,可干燥氯气和二氧化硫,故A错误;
B.浓硫酸与灼热的炭反应,硫元素化合价都发生变化,只体现了浓硫酸的强氧化性,故B 正确;
C.二氧化硫的漂白性是因为二氧化硫和有色物质反应生成无色物质,该反应中二氧化硫不体现氧化性,次氯酸的漂白性是利用次氯酸的强氧化性,二者漂白原理不同,不能说明二氧化硫的氧化性没有氯气强,故C错误;
D.工业制硫酸的三设备是:沸腾炉4FeS2+11O22Fe2O3+4SO2,接触室
2SO2(g)+O2(g)2SO3(g),吸收塔SO3+H2O=H2SO4,沸腾炉、接触室所涉及的反应均为氧化还原反应、吸收塔所涉及的反应不是,故D错误;
故答案为B。
5.某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是()
A.烧杯中H2O2溶液的作用是将Fe2+氧化为Fe3+
B.A中存在氧化铁与盐酸反应生成氯化铁的反应
C.利用B装置不能准确测量生成氢气的体积
D.将反应后的溶液放入烧杯中再通入少量SO2,则溶液颜色立即由棕黄色变为浅绿色
【答案】D
【分析】
铁和盐酸反应生成氯化亚铁和氢气,氧化铁与盐酸反应生成氯化铁,因铁与铁离子反应,则A中得到物质为氯化亚铁,反应后打开K2,过氧化氢可氧化亚铁离子生成铁离子,据此解答。
【详解】
铁和盐酸反应生成氯化亚铁和氢气,氧化铁与盐酸反应生成氯化铁,因铁与铁离子反应,则A中得到物质为氯化亚铁,反应后打开K2,过氧化氢可氧化亚铁离子生成铁离子;
A. 双氧水具有氧化性,可将Fe2+氧化为Fe3+,A项正确;
B. 氧化铁为碱性氧化物,可与盐酸反应生成氯化铁和水,B项正确;
C. 铁和盐酸反应生成氯化亚铁和氢气,所以B中收集到的气体是氢气,可用排水法测量生成氢气的体积,C项正确;
D. 因H2O2溶液过量,所以通入少量SO2先被H2O2氧化,将H2O2还原完后才还原Fe3+,D 项错误;
答案选D。
6.由下列实验及现象,推出的相应结论正确的是
A.A B.B C.C D.D
【答案】C
【详解】
A.钾的焰色是浅紫色,容易被钠的黄色火焰所掩盖,因此要在蓝色钴玻璃下进行观察才能确定有没有钾元素,A项错误;
CO,B.酸性:盐酸大于碳酸,碳酸大于次氯酸;因此次氯酸不可能与碳酸氢钠反应得到2
应该考虑是盐酸的影响,B项错误;
SO的水溶液显酸性,C项正确;
C.石蕊变红则证明溶液显酸性,因此说明2
SO和高锰酸钾之间发生的是氧化还原反应导致褪色,与漂白性无关,D项错误;
D.2
答案选C。
【点睛】
二氧化硫能够漂白一些有机色质,如品红溶液,属于非氧化性漂白;而二氧化硫在与酸性高锰酸钾溶液、溴水、氯化铁等溶液反应时,体现了二氧化硫的强的还原性,导致了溶液的颜色发生了变化,而非漂白性。
7.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是()
A .①②③④
B .②③④⑤
C .①③④
D .②③④
【答案】A 【解析】 【详解】
①由于石灰水过量,因此必有3CaCO 和3CaSO 沉淀生成,故①正确;
②同样由于石灰水过量,因此必有3CaCO 沉淀生成,故②正确;
2CO ③气体与32Ba(NO )不反应,2SO 气体通入32Ba(NO )溶液后,由于溶液酸性增
强,2SO 将被3NO -
氧化生成24SO -
,因此有4BaSO 沉淀生成,故③正确;
2NO ④和2SO 混合后,2SO 将被2NO 氧化成3SO ,通入2BaCl 溶液后有4BaSO 沉淀生
成,故④正确;
⑤当3NH 过量时溶液中3CaCO 沉淀生成,发生反应的化学方程式为:
3222342NH CO CaCl H O CaCO 2NH Cl +++=↓+;当3NH 不足时,最终无沉淀生成,
发生反应的化学方程式为:32223242NH 2CO CaCl 2H O Ca(HCO )2NH Cl +++=+,故⑤错误。 故选A 。 【点睛】
本题考查元素化合物知识,注意丙过量,对相应物质的化学性质要掌握到位。解题时要认真审题、一一排查,同时要掌握2NO 的氧化性,2SO 具有还原性,2SO 具有酸性氧化物的性质、2SO 气体通入32Ba(NO )溶液后,由于溶液酸性增强,2SO 将被3NO -
氧化生成
24SO -
,此时有
4BaSO 沉淀生成。
8.下列有关化学实验的说法正确的是
A.SO2能使品红溶液、酸性KMnO4溶液褪色,加热后都能恢复原来颜色
B.用铂丝蘸取某溶液在酒精灯的火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中含有K+,不含Na+
C.用滴加BaCl2溶液观察有无白色沉淀生成的方法鉴别K2CO3和NaHCO3
D.少量CO2通入CaCl2溶液能生成白色沉淀,CO2过量时白色沉淀溶解
【答案】C
【解析】
【详解】
A. SO2具有漂白性,能使品红溶液,但反应产生的无色物质不稳定,加热物质分解,又恢复原来的颜色;SO2具有还原剂,会将酸性KMnO4溶液还原而褪色,加热后不能恢复原来颜色,A错误;
B. 用铂丝蘸取某溶液在酒精灯的火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中含有K+,不能说明是否含Na+,B错误;
C. BaCl2与K2CO3反应产生BaCO3白色沉淀,与NaHCO3不能反应,因此可以用滴加BaCl2溶液观察有无白色沉淀生成的方法鉴别K2CO3和NaHCO3,C正确;
D. CO2通入CaCl2溶液不能反应,无白色沉淀生成,D错误;
故合理选项是C。
9.把70 mL硫化氢和90 mL氧气(标准状况)混合,在一定条件下点燃,使之反应。当反应完全后恢复到原来状况时,可得到SO2的体积是(不考虑二氧化硫在水中溶解)()
A.50 mL B.55 mL C.60 mL D.70 mL
【答案】B
【详解】
H2S完全燃烧的化学方程式为:2H2S+3O22SO2+2H2O,根据方程式可知90mLO2完全反应消耗60mLH2S,同时产生60mLSO2,剩余10mL H2S,剩余H2S与反应产生的SO2会进一步发生反应:SO2+2H2S=3S+2H2O,10mLH2S反应消耗5mL SO2,因此充分反应后,剩余SO2气体的体积是60mL-5mL=55mL,故合理选项是B。
10.下列物质都具有漂白性,漂白原理与其它几种不同的是()
A.氯水B.SO2C.H2O2D.HClO
【答案】B
【详解】
二氧化硫漂白原理是它与有色物质化合生成不稳定的无色物质;氯水、双氧水、次氯酸具有强氧化性能使有色物质褪色,故选B。
11.将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是()
A.过程①发生非氧化还原反应
B.过程②中,发生反应为S2-+Fe3+=S+Fe2+
C.过程③中,氧气是氧化剂
D.整个转化过程中Fe3+可以循环使用
【答案】B
【详解】
A.过程①中发生H2S+Cu2+=CuS↓+2H+,Cu元素化合价都是+2价、H元素化合价都是+1价、S元素化合价都是-2价,没有化合价变化,是非氧化还原反应,故A正确;
B.过程②中发生CuS+2Fe3+=S+2Fe2++Cu2+,故B错误;
C.过程③中发生4Fe2++O2+4H+=4Fe3++2H2O,Fe元素的化合价升高,被氧化,Fe2+作还原剂,O2中O元素的化合价降低,被还原,O2作氧化剂,故C正确;
D.由过程②③中反应可知,Fe3+可以循环使用,故D正确;
答案为B。
12.某未知溶液可能含Cl-、CO32-、Na+、SO42-、Cu2+。将溶液滴在蓝色石蕊试纸上试纸变红;取少量试液,先滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,再在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
A.一定没有Na+、Cl-
B.可能有Cl-、CO32-
C.一定没有CO32-、可能有SO42-
D.一定有SO42-、Cu2+
【答案】D
【详解】
将溶液滴在蓝色石蕊试纸上,试纸变红说明溶液呈酸性,则CO32-不存在;因为Cu2+水解呈酸性,所以有Cu2+;取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中有SO42-;在上层清液中滴加硝酸银溶液,产生白色沉淀,则不能确定原溶液中有Cl-,因为前面已滴加了氯化钡,可知溶液中一定含有Cu2+和SO42-,一定不含CO32-,可能含有Cl-、Na+,故选D。
【点睛】
本题考查了溶液中离子的检验,题目难度中等,熟练掌握常见离子的性质及检验方法为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力。
13.下列实验的现象与对应结论均正确的是()
A.A B.B C.C D.D
【答案】A
【详解】
A. 将浓硫酸滴到蔗糖表面,固体变黑膨胀,浓硫酸具有脱水性使蔗糖脱水生成碳变黑,碳和浓硫酸反应生成二氧化碳和二氧化硫气体表现浓硫酸的氧化性,故A正确;
B. 常温下将Al片放入浓硝酸中,无明显变化,铝和浓硝酸发生钝化现象,发生反应生成一薄层致密的氧化物薄膜阻止反应进行,表现了强氧化性,故B错误;
C. 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,由于铁粉过量,生成亚铁离子,不能变成红色,故C错误;
D. 将水蒸气通过灼热的铁粉,反应生成黑色的四氧化三铁固体,说明铁在高温下和水反应,不是生成氧化铁,故D错误;
故选:A。
14.下列气体中既可用浓硫酸干燥又可用碱石灰干燥的是
A.CO B.H2S C.SO2D.NH3
【答案】A
【详解】
A.一氧化碳与浓硫酸、碱石灰都不发生反应,既可用浓硫酸干燥又可用碱石灰干燥,选项A正确;
B.硫化氢具有还原性,为酸性气体,既不能用浓硫酸也不能用碱石灰干燥,选项B错误;
C.二氧化硫为酸性氧化物,能够与氢氧化钠、氧化钙反应,不能用碱石灰干燥,选项C
错误;
D.氨气为碱性气体,不能用浓硫酸干燥,选项D错误;
答案选A。
【点睛】
本题考查了干燥剂的选择,明确干燥剂的性质及气体的性质是解题关键,浓硫酸具有酸性、强的氧化性,不能干燥还原性、碱性气体;碱石灰成分为氢氧化钠和氧化钙,不能干燥酸性气体。
15.浓硫酸与下列物质反应(可以加热),既体现酸性、又体现氧化性的是( )
A.铜B.炭C.五水硫酸铜D.氧化铜
【答案】A
【详解】
A.铜与浓硫酸在加热条件下反应,生成硫酸铜、二氧化硫和水,浓硫酸表现酸性和强氧化性,A符合题意;
B.炭与浓硫酸在加热条件下反应,生成二氧化碳、二氧化硫和水,浓硫酸表现强氧化性,B不符合题意;
C.五水硫酸铜中加入浓硫酸,生成无水硫酸铜,浓硫酸表现吸水性,C不符合题意;D.氧化铜与浓硫酸反应,生成硫酸铜和水,浓硫酸表现酸性,D不符合题意;
故选A。
16.下列“推理或结论”与“实验操作及现象”相符的一组是
A.A B.B C.C D.D
【答案】B
【详解】
A.氯化银、碳酸钡、亚硫酸钡和硫酸钡均为白色沉淀,与氯化钡溶液反应生成白色沉淀,溶液中不一定含有硫酸根离子,还可能含有银离子或碳酸根离子或亚硫酸根离子,故A错
误;
B.金属钠浮在水面上说明金属钠的密度比水小,熔成闪亮的小球说明钠的熔点低,与水的反应放出的热量使熔成闪亮的小球,故B正确;
C.碳酸氢钠、亚硫酸钠和亚硫酸氢钠都能与盐酸反应放出使澄清石灰水变浑浊的二氧化碳和二氧化硫气体,则向某钠盐溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体,该盐不一定是碳酸钠,还可能是碳酸氢钠或亚硫酸钠或亚硫酸氢钠,故C错误;
D.某物质的焰色试验火焰显黄色,说明该物质一定含有钠元素,黄色光掩盖紫色光,由于没用蓝色钴玻璃片滤去黄色光,则不能确定该物质是否含有钾元素,故D错误;
故选B。
17.一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标况)。将反应液稀释至1 L,测得溶液的c(H+)=0.1mo1·L-1,则叙述中错误的是()
A.气体A为SO2和H2的混合物B.气体A中SO2与H2的体积之比为4︰1 C.反应中共消耗97.5g Zn D.反应中共转移3 mol电子
【答案】B
【分析】
生成气体的物质的量为33.6
22.4
=1.5mol,溶液剩余硫酸的物质的量为0.1×
1
2
=0.05mol,参加
反应是硫酸的物质的量为0.1×18.5-0.05=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,设生成xmol二氧化硫,ymol氢气,则有 x+y=1.5 2x+y=1.8 ,解x=0.3,y=1.2;根据电子得失守恒可知:2n(Zn)=2n(SO2)+2n(H2)=2×0.3+2×1.2,所以n(Zn)=1.5mol,据以上分析解答。
【详解】
生成气体的物质的量为33.6
22.4
=1.5mol,溶液剩余硫酸的物质的量为0.1×
1
2
=0.05mol,参加
反应是硫酸的物质的量为0.1×18.5-0.05=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,设生成xmol二氧化硫,ymol氢气,则有 x+y=1.5 2x+y=1.8 ,解x=0.3,y=1.2;根据电子得失守恒可知:2n(Zn)=2n(SO2)+2n(H2)=2×0.3+2×1.2,所以n(Zn)=1.5mol,
A、由以上分析可知气体为二氧化硫和氢气的混合气体,正确,不选A;
B、气体为二氧化硫和氢气,体积比为0.3:1.2=1:4,错误,选B;
C、由以上分析可知,反应中共消耗金属锌的质量为1.5×65=97.5g,正确,不选C;
D、由以上分析可知,根据金属锌计算转移电子数为1.5×2=3mol,正确,不选D;
故答案选B。
18.在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断水溶液中含有
A .Cl-,SO B.Cl-,NO C.Cl-,CO D.Cl-,OH-
【答案】C
【解析】
加入硝酸后沉淀部分溶解,且产生无色无味能使澄清的石灰水变浑浊的气体,则该溶液中
含有Cl -和CO 32-
,C 项正确。
19.下列有关S 和2SO 的叙述正确的是( ) A .硫粉在过量的氧气中燃烧可以生成3SO B .空气吹出法提取海水中的溴常用2SO 作氧化剂 C .将2SO 通入()32Ba
NO 溶液能生成白色沉淀
D .2SO 具有漂白性,所以能使品红溶液和高锰酸钾酸性溶液褪色 【答案】C 【详解】
A .硫粉在过量的氧气中燃烧也只能生成2SO ,A 不正确;
B .空气吹出法提取海水中的溴,常用2SO 作还原剂,将溴还原为易溶于水的氢溴酸而富集,B 不正确;
C .二氧化硫的水溶液显酸性,硝酸根离子在酸性条件下有强氧化性,可以将二氧化硫氧化为硫酸,因此,将2SO 通入()32Ba
NO 溶液能生成白色沉淀硫酸钡,C 正确;
D .2SO 具有漂白性,所以能使品红溶液褪色,但是其能使高锰酸钾酸性溶液褪色不是因为其有漂白性,而是因为其有还原性,D 不正确。 综上所述,有关S 和2SO 的叙述正确的是C 。
20.下列图象表示的意义与相关的化学反应完全正确的是
A .向FeCl 3溶液中不断加入铁粉
B .Fe(OH)2固体露置在空气中质量的变化
C.25℃时,向Cl2水溶液中通入二氧化硫(生成两种常见的酸)
D.向AlCl3溶液中不断滴入烧碱溶液
【答案】A
【分析】
A. 向FeCl3溶液中不断加入铁粉,反应生成FeCl2;
B. Fe(OH)2固体露置在空气中最终会被氧化为Fe(OH)3;
C. 向Cl2水溶液中通入二氧化硫,反应生成盐酸和硫酸;
D. 向AlCl3溶液中不断滴入烧碱溶液一开始沉淀逐渐生成,当加入的烧碱溶液过量时,沉淀逐渐溶解。
【详解】
A. 向FeCl3溶液中不断加入铁粉,反应生成FeCl2,Cl-的质量不发生变化,溶液的质量逐渐增大,因此Cl-的质量分数减小,A项正确;
B. Fe(OH)2固体露置在空气中最终会被氧化为Fe(OH)3,质量增加,B项错误;
C. 向Cl2水溶液中通入二氧化硫,反应生成盐酸和硫酸,c(H+)逐渐增大,pH逐渐减小,但Cl2水中存在H+,因此起始时pH不是7,C项错误;
D. 向AlCl3溶液中不断滴入烧碱溶液一开始沉淀逐渐生成,当加入的烧碱溶液过量时,沉淀逐渐溶解,且用于沉淀的烧碱和用于溶解Al(OH)3的少见的物质的量之比为3:1,D项错误;
答案选A。
【点睛】
解答本题的难点是可溶性铝盐溶液与NaOH溶液反应的图像
滴加顺序向Al3+中滴加OH-
现象立即产生白色沉淀→渐多→最多→渐少→消失
图像
离
子
方
程
式
OA段Al3++3OH-=Al(OH)3↓
AB段Al(OH)3+OH-=AlO+2H2O
二、非选择题
21.为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
请回答下列问题:
(1)在A中发生的化学反应方程式为_____;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是_____(用操作编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置c中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)若该实验中还需检测产物水蒸气,则应在C装置前添加干燥管,并在其中放置_____试剂。
(4)实验时,装置C中盛放的试剂是_____,现象时_____,可用来验证_____的存在。(5)装置D中发生的反应方程式为_____,当D中_____现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2。
【答案】2H2SO4(浓)+C2SO2↑+CO2↑+2H2O ③①②无水CuSO4品红溶液
品红溶液褪色 SO2 SO2+I2+2H2O=4H++2I﹣+SO42进气口一端脱脂棉上蓝色变浅,出气口一端脱脂棉上蓝色不变
【分析】
根据实验目的和装置图考虑操作步骤和试剂的作用及发生反应。从整体考虑,A为制取气体装置,B为收集气体装置,C为检验二氧化硫装置,D为除去二氧化硫并检验是否除尽二氧化硫的装置,最后为检验二氧化碳的装置,
(1)木炭粉与浓硫酸发生反应产生水、SO2和CO2气体;
(2)根据具体操作可知,要控制气体流速,应先收集气体,然后慢慢挤压气球来控制流速;
(3)通常用无水硫酸铜检验水;
(4)品红溶液用来检验二氧化硫;
(5)检验二氧化碳,应排除二氧化硫的干扰,碘单质与二氧化硫发生氧化还原反应,D是用来除去二氧化硫并检验二氧化硫是否除尽的双重作用。
【详解】
(1)木炭粉与浓硫酸加热反应产生SO2和CO2气体,该反应的化学方程式为:2H2SO4(浓)+C2SO2↑+CO2↑+2H2O;
故答案为2H2SO4(浓)+C2SO2↑+CO2↑+2H2O;
(2)根据气囊B的作用是收集气体,要想控制流速,从虚线框设计来看,应先收集气体,然后再慢慢释放气体,所以正确的操作顺序是③①②;
故答案为③①②;
(3)白色的无水CuSO4遇到水生成蓝色的五水硫酸铜,可用无水CuSO4检验水;
故答案为无水CuSO4;
(4)A装置中产生了二氧化硫气体,C装置用于检验二氧化硫,可选用品红溶液,当品红溶液褪色,证明有SO2气体生成,
故答案为品红溶液;品红溶液褪色;SO2;
(5)D装置是用来除去二氧化硫并检验二氧化硫是否除尽的双重作用,二氧化硫和碘反应为:SO2+I2+2H2O=4H++2I﹣+SO42﹣;当在进气一端碘与二氧化硫反应使得进气口一端脱脂棉蓝色变浅,在出气口一端二氧化硫被除尽,出气口一端脱脂棉蓝色不变,说明出气口出的是二氧化碳;
故答案为SO2+I2+2H2O=4H++2I﹣+SO42﹣;进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变。
22.已知SO2+I2+2H2O=H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
【答案】c→d→b→a→e SO2+I2+2H2O===4H++SO42-+2I-蓝色褪去7%
【分析】
(1)本题考查了排水法的连接顺序;SO2用碘吸收,氧气和氮气不溶于水,可用通过排水法测量起体积。
(2)根据方程式可直接写出离子方程式。
(3)找出SO2与I2对应关系,求出SO2体积,可以求出混合气体中SO2的体积分数。
【详解】
:(1)SO2用碘水吸收,氧气和氮气不溶于水,可用通过排水法测量起体积;所以正确的顺序为原料气→c→d→b→a→e;正确答案:c→d→b→a→e。
(2)二氧化硫、碘与水混合反应生成硫酸和氢碘酸,反应的离子方程式
为:SO2+I2+2H2O=4H++SO42-+2I-;由于碘遇淀粉显蓝色,所以当溶液蓝色褪去时,即停止通气;正确答案:SO2+I2+2H2O=4H++SO42-+2I-;蓝色褪去。
(3)由反应方程式可知: SO2---I2关系可知:V(SO2)=0.05×20×10-3×22.4×1000mL=22.4mL,则SO2的体积分数为=22.4/(297.6+22.4)×100%=7%;正确答案:7%。
23.某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠(Na2SO3)的仪器名称是___,其中发生反应的化学方程式为___。
(2)实验过程中,装置B中紫红色变为无色,说明SO2具有___(填“氧化性”或“还原性”),C中无色溶液中出现黄色浑浊,说明SO2具有___(填“氧化性”或“还原
性”)。
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象____;(4)尾气可以用NaOH溶液吸收,其反应的化学方程式为____。
【答案】蒸馏烧瓶 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 还原性氧化性品红溶液褪色后关闭
..为红色 SO2+2NaOH=Na2SO3+
..,溶液恢复
.....分液漏斗活塞,点燃酒精灯加热
H2O
【分析】
(1)装置A中盛放亚硫酸钠(Na2SO3)的仪器名称是蒸馏烧瓶,其中发生的反应为亚硫酸钠与硫酸发生的复分解反应。
(2)实验过程中,装置B中紫红色变为无色,说明SO2能将MnO4-转化为Mn2+,C中无色溶液中出现黄色浑浊,说明SO2将H2S转化为S。
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,先通SO2,然后再给烧杯加热;(4)尾气可以用NaOH溶液吸收,生成盐和水。
【详解】
(1)装置A中盛放亚硫酸钠(Na2SO3)的仪器名称是蒸馏烧瓶,其中发生的反应为亚硫酸钠与硫酸发生的复分解反应,方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。答案为:蒸馏烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)实验过程中,装置B中紫红色变为无色,说明SO2能将MnO4-转化为Mn2+,具有还原性;C中无色溶液中出现黄色浑浊,说明SO2将H2S转化为S,具有氧化性。答案为:还原性;氧化性;
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,先通SO2,品红溶液褪色后关闭
.....
分液漏斗活塞,点燃酒精灯加热
..,溶液恢复
.....分液漏
..为红色。答案为:品红溶液褪色后关闭
斗活塞,点燃酒精灯加热
..为红色;
..,溶液恢复
(4)尾气可以用NaOH溶液吸收,生成盐和水,反应的化学方程式为SO2+2NaOH=Na2SO3+H2O。答案为:SO2+2NaOH=Na2SO3+H2O。
【点睛】
二氧化硫的漂白原理有别于氯水和活性炭,活性炭吸附有色物质,属于物理过程;二氧化硫与水反应生成的亚硫酸与有色物质结合,生成不稳定的无色化合物,属于非氧化还原反应;氯水具有强氧化性,能将有色物质氧化成无色物质,属于氧化还原反应,产物稳定,是永久性漂白。
24.为了验证木炭可被浓H2SO4氧化成CO2,选用如图所示仪器(内含物质)组装成实验装置(资料:SO2能与酸性KMnO4反应:2KMnO4 + 5SO2 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 )。
甲.乙.丙.
丁.
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):A接________,________接________,________接________;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2。乙中_______,丙中______。【答案】F E C D B乙中出现白色沉淀丙中品红未褪色
【分析】
(1)根据实验室浓H2SO4氧化木炭的反应原理、条件,固液加热下反应,进行选择发生和验证产物装置;
(2)根据二氧化碳和二氧化硫的性质进行解答。
【详解】
(1)根据实验室浓H2SO4氧化木炭的反应原理、条件,固液加热下反应,进行选择发生装置,高锰酸钾可氧化二氧化硫,用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色确认SO2已除干净,验证木炭可被浓H2SO4氧化成CO2,可通过二氧化碳能使澄清的石灰水变浑浊确认,即装置的连接顺序为A接F;E接C;D接B;
(2)乙中为澄清的石灰水,澄清的石灰水和二氧化碳反应变浑浊,二氧化硫具有漂白性,二氧化硫能使品红褪色,丁装置用高锰酸钾酸性溶液除SO2,再通过品红溶液不褪色。
25.实验室里研究不同价态硫元素之间的转化
(1)A中发生反应的化学方程式为__________。
(2)B中的现象是__________。
(3)C中的现象是__________,Na2S在反应中做__________剂。
(4)D中氯水褪色,此反应中硫元素的化合价由_____转化为______;甲认为可以补充一个实验进一步证明硫元素的价态转化,实验方案和现象为:取D中褪色后的溶液于试管中
________。
(5)E的作用是__________,离子方程式为__________。
(6)上述实验体现SO2的性质有__________。
【答案】Cu + 2 H2SO4(浓)Δ
CuSO4 + SO2↑+ 2 H2O 品红溶液褪色有淡黄色沉淀生成还原
+4 +6 向其中加入BaCl2溶液(可以不加“盐酸酸化”),有白色沉淀生成吸收SO2尾气,防止污染环境 SO2 + 2OH-= SO32- + H2O 漂白性、氧化性、还原性、酸性氧化物通性【分析】
该实验的目的是研究不同价态硫元素之间的转化;A为SO2的发生装置,B为检验SO2的装置,C中Na2S和SO2发生氧化还原反应生S沉淀,D中SO2和Cl2以及水反应生成H2SO4,E 是吸收多余SO2的装置。
【详解】
(1)A中Cu和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)Δ
CuSO4+SO2↑+2H2O;
(2)B为检验SO2的装置,现象是品红溶液褪色;
(3)C中,Na2S和SO2发生反应:2Na2S+SO2+2H2O=3S↓+4NaOH,故可观察到有淡黄色沉淀生成,该反应中,Na2S中S的化合价由-2价升为0价,故Na2S作还原剂;
(4)D中,Cl2和SO2发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,S由+4价变为+6价;要想证明硫元素的价态转化,只需要证明产物中有SO42-即可,由于产物中已经有HCl,故只需要取D中褪色后的溶液于试管中,加入BaCl2溶液即可,对应的现象是有白色沉淀生成;(5)E的作用是吸收SO2尾气,防止污染环境;离子方程式为:SO2+2OH-= SO32-+H2O
(6)B中现象体现SO2的漂白性,C中现象体现SO2的氧化性,D中现象体现SO2的还原性,E中现象体现酸性氧化物的通性。
26.海洋资源的利用具有广阔前景
I.工业上对海水资源综合开发利用的部分工艺流程如下图所示:
请回答下列问题:
(1)物质C和M均为强氧化性物质,则C的电子式为_________,M的学化式为________。
(2)反应⑤的化学方程式是_________。
(3)工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是________。
(4)将氯化镁晶体(MgCl2·6H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体,请写出MgCl2·6H2O在523℃时发生以上分解的化学方程式是_________。
II.其课外小组在实验室完成了下列有关实验,设计以下装置(夹持装置己略去),进行实验,模拟海水提溴的部分过程。
(1)a是一种黄绿色气体。A装置中通入a气体的目的是____________(用离子方程式表示)。
(2)反应过程中,B装置中有2-
4
SO生成,则气体b的化学式是_______。检验B装置的溶液
中含有2-
4
SO的方法是________。
(3)C装置的作用是_________。
【答案】:Cl:Cl:
????
???? NaClO MgCl2(熔融)
电解
Mg+Cl2↑氧化镁的熔点高,耗能大 MgCl2
? 6H2O 523℃
MgO+2HCl ↑ +5H2O ↑ Cl2+2Br-=Br2+2Cl- SO2取少量 B 中的溶液于试管中,
加入 HCl 溶液无沉淀生成,再滴入BaCl2溶液出现白色沉淀,则证明溶液中含有2-4
SO吸
收尾气中Cl 2、Br 2、SO 2,防止污染环境 【分析】
I.由流程图知,A 为CaO ,B 为Ca(OH)2,操作①是海水晒盐后过滤,操作②为电解饱和食盐水,得到氢氧化的氢气和氯气,故C 为氯气,③为氢氧化钠和氯气反应生成氯化钠,次氯酸钠和水,已知M 具强氧化性,故M 为次氯酸钠,④是氢气在氯气里燃烧生成氯化氢,故N 是氯化氢气体,⑤是电解熔融氯化镁制取镁和氯气;
II.关于溴的提取的部分过程:母液中通氯气,将溴离子氧化为溴单质,通入热空气到含低浓度溴水的混合液中,溴易挥发,利用热空气的加热、搅拌作用吹出溴进入B 装置,再用二氧化硫把溴单质还原为溴离子,B 装置的尾气必须处理,以防止空气污染。 【详解】
I. (1)据分析,物质C 和M 均为强氧化性物质,则C 的电子式为:Cl :Cl :????
????
,M 的学化式为
NaClO ;
(2)反应⑤的化学方程式是MgCl 2(熔融) =电解
Mg + Cl 2 ↑;
(3)工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是氧化镁的熔点高,耗能大;
(4)将氯化镁晶体(MgCl 2·6H 2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体即水,该反应为费氧化还原反应,故另一种气体为HCl ,则MgCl 2·6H 2O 在523℃时发生以上分解的化学方程式是:MgCl 2 ? 6H 2O 523=℃
MgO + 2HCl ↑ +5H 2O ↑;
II.(1)a 是一种黄绿色气体即氯气,A 装置中通入氯气,把溴离子氧化为溴分子,故离子方程式为:Cl 2+2Br -=Br 2+2Cl -;
(2)反应过程中,热空气把A 中的溴吹入到B 中,反应中B 装置中有2-
4SO 生成,则气体b 的化学式是SO 2,发生的反应为:2222+
4SO Br 2H O 2Br
SO +4H -
-++=+,是氧化还原反
应,要检验B 装置的溶液中含有2-4SO 的方法是:取少量 B 中的溶液于试管中,加入 HCl 溶液无沉淀生成,再滴入BaCl 2溶液出现白色沉淀,则证明溶液中含有2-
4SO ;
(3)C 中有NaOH 溶液,能与Cl 2、Br 2、SO 2反应得到盐溶液, C 装置的作用是吸收尾气中Cl 2、Br 2、SO 2,防止污染环境。 【点睛】
以海水的综合利用为载体,考察了氯、溴及其化合物之间的转化、电子式、化学方程式、离子方程式的书写,硫酸根离子的检验等,熟练掌握元素及其化合物的性质是推断的关键。
浙江省宁波余姚市财政总收入和一般公共预算收入3年数据解读报告2019版
浙江省宁波余姚市财政总收入和一般公共预算收入3年数据解读报告2019版
引言 本报告借助数据对宁波余姚市财政总收入和一般公共预算收入进行深度剖析,从财政总收入,一般公共预算收入等方面进行阐述,以全面、客观的角度展示宁波余姚市财政总收入和一般公共预算收入真实现状及发展脉络,为需求者制定战略、为投资者投资提供参考和借鉴。 宁波余姚市财政总收入和一般公共预算收入解读报告的数据来源于权威部门如中国国家统计局、重点科研机构及行业协会等,数据以事实为基准,公正,客观、严谨。 宁波余姚市财政总收入和一般公共预算收入数据解读报告旨在全面梳理宁波余姚市财政总收入和一般公共预算收入的真实现状、发展脉络及趋势,相信能够为从业者、投资者和研究者提供有意义的启发和借鉴。
目录 第一节宁波余姚市财政总收入和一般公共预算收入现状 (1) 第二节宁波余姚市财政总收入指标分析 (3) 一、宁波余姚市财政总收入现状统计 (3) 二、全省财政总收入现状统计 (3) 三、宁波余姚市财政总收入占全省财政总收入比重统计 (3) 四、宁波余姚市财政总收入(2016-2018)统计分析 (4) 五、宁波余姚市财政总收入(2017-2018)变动分析 (4) 六、全省财政总收入(2016-2018)统计分析 (5) 七、全省财政总收入(2017-2018)变动分析 (5) 八、宁波余姚市财政总收入同全省财政总收入(2017-2018)变动对比分析 (6) 第三节宁波余姚市一般公共预算收入指标分析 (7) 一、宁波余姚市一般公共预算收入现状统计 (7) 二、全省一般公共预算收入现状统计分析 (7) 三、宁波余姚市一般公共预算收入占全省一般公共预算收入比重统计分析 (7) 四、宁波余姚市一般公共预算收入(2016-2018)统计分析 (8) 五、宁波余姚市一般公共预算收入(2017-2018)变动分析 (8) 六、全省一般公共预算收入(2016-2018)统计分析 (9)
浙江省宁波余姚市户籍人口年龄构成具体情况3年数据分析报告2020版
浙江省宁波余姚市户籍人口年龄构成具体情况3年数据分析 报告2020版
序言 宁波余姚市户籍人口年龄构成具体情况数据分析报告旨在运用严谨的数据 分析,以更为客观、真实的角度,对宁波余姚市户籍人口年龄构成具体情况进行剖析和阐述。 宁波余姚市户籍人口年龄构成具体情况数据分析报告同时围绕关键指标即 总人口数量,户籍18岁以下人口数量,户籍18岁以下人口比重,户籍18岁-35岁人口数量,户籍18岁-35岁人口比重,户籍35岁-60岁人口数量,户籍35岁-60岁人口比重等,对宁波余姚市户籍人口年龄构成具体情况进行了全面深入的分析总结。本报告知识产权为发布方即我公司天津旷维所有,其他方引用我方报告均需注明出处。 宁波余姚市户籍人口年龄构成具体情况数据分析报告可以帮助投资决策者 效益最大化,是了解宁波余姚市户籍人口年龄构成具体情况的重要参考渠道。报告中数据来源于中国国家统计局等权威部门,数据客观、精准。
目录 第一节宁波余姚市户籍人口年龄构成具体情况现状 (1) 第二节宁波余姚市总人口数量指标分析 (3) 一、宁波余姚市总人口数量现状统计 (3) 二、全省总人口数量现状统计 (3) 三、宁波余姚市总人口数量占全省总人口数量比重统计 (3) 四、宁波余姚市总人口数量(2017-2019)统计分析 (4) 五、宁波余姚市总人口数量(2018-2019)变动分析 (4) 六、全省总人口数量(2017-2019)统计分析 (5) 七、全省总人口数量(2018-2019)变动分析 (5) 八、宁波余姚市总人口数量同全省总人口数量(2018-2019)变动对比分析 (6) 第三节宁波余姚市户籍18岁以下人口数量指标分析 (7) 一、宁波余姚市户籍18岁以下人口数量现状统计 (7) 二、全省户籍18岁以下人口数量现状统计分析 (7) 三、宁波余姚市户籍18岁以下人口数量占全省户籍18岁以下人口数量比重统计分析 (7) 四、宁波余姚市户籍18岁以下人口数量(2017-2019)统计分析 (8) 五、宁波余姚市户籍18岁以下人口数量(2018-2019)变动分析 (8) 六、全省户籍18岁以下人口数量(2017-2019)统计分析 (9)
浙江省宁波市鄞州区2019-2020学年(上)七年级语文期中考试试卷(含答案)
2019学年第一学期七年级语文学科期中试卷 一、书写(3分)(本题根据卷面书写情况评分。请你在答题时努力做到书写正确、工整。) 二、积累和运用(27分) 1.根据拼音写汉字(4分) 轻轻地打开七年级上册语文课本,眼前花团锦簇、美不胜收:解决散步时的分歧,zhāng (▲)显中华民族尊老爱幼的美德;瘫痪的史铁生在秋天怀念与母亲jué(▲)别时收获着“好好儿活”的勇气;跟轻风流水应hè(▲)着的牧童的笛声传递着春的气息;还有那可爱的水藻把终年zhù(▲)蓄的绿色奉献给济南的冬天…… 2.古诗文名句默写(8分) (1)峨眉山月半轮秋,▲。(《峨眉山月歌》李白) (2)▲,于我如浮云。(《<论语>十二则》) (3)乡书何处达,▲。(《次北固山下》王湾) (4)▲,一夜征人尽望乡。(《夜上受降城闻笛》李益) (5)《<论语>十二则》中论述学与思的辩证关系的句子是:▲,▲。(6)古诗中多有借明月抒发思乡怀人之情的诗句,请写出连续的两句:▲,▲。 3.解释下列句中加点词语(4分) (1)撒盐空中差可拟.(▲ )(2)未若柳絮因.风起(▲ ) (3)人不知而不愠.(▲ )(4)博学而笃.志(▲ ) 4.下列的文化常识错误的一项是(▲ )(3分) A .《闻王昌龄左迁龙标遥有此寄》中的左迁在古代表示降职贬官。 B .古人称谓有谦称和尊称,称别人的父母为令尊、令堂,称自己的父母则为家严、家慈。 C .古代男子20岁(成人)举行加冠礼时取字,字是指在本名以外表示德行或本名的意义的名字,例如孔子字仲尼。 D .“寒舍”“晚生”“拙笔”“阁下”都是谦辞。 5.名著阅读(8分) (1)对名著《朝花夕拾》内容理解不正确的一项是(▲ )(3分) A .《朝花夕拾》是鲁迅先生于1926年所作的一部回忆性小说集。 B .在《无常》一文中,鲁迅提到:无常有黑白两种,白无常又叫活无常,黑无常又叫死无常,人们喜爱的是白无常。 C .《五猖会》记叙作者儿时父子之间一场微妙的冲突——我对五猖会的热切盼望和父亲的阻难。
浙江省宁波市余姚市八年级(上)期末物理试卷
浙江省宁波市余姚市八年级(上)期末物理试卷 一、选择题(本题共有20小题,每小题2分,共40分) 1.(2分)人类对力与运动关系的认识经历了漫长曲折的过程,下面是三位不同时代科学家的主要观点,这三种观点形成的先后顺序是() A.①②③B.③①②C.②③①D.③②① 2.(2分)骑自行车是一种既健身又低碳的出行方式,下列说法正确的是()A.自行车轮胎上的花纹是为了增大摩擦 B.用力蹬车是为了增大车的惯性来增大速度 C.下坡时以自行车为参照物,车的坐垫是运动的 D.停在路边的自行车,它对地面的压力和所受到的重力是一对平衡力 3.(2分)垫排球是我市一项体育测试项目,下列对排球离开后继续上升过程分析正确的是() A.速度越来越小B.受到的重力越来越大 C.到达最高点时受力平衡D.球受到惯性作用 4.(2分)新型膨胀式安全带(如图)紧缚力达到一定的值,藏在安全带里的气囊就会快速充气,迅速形成气囊袋,对驾乘人员起到更好的保护作用。下列关于膨胀式安全带说法正确的是() A.该安全带会使人的惯性减小 B.该安全带可以使人所承受的力减小
C.当车加速时,该安全带就会自动充气 D.该安全带充气后增大与人体的接触面积,减小压强,可避免人员被勒伤 5.(2分)图中的实验中不能揭示流体压强与流速关系的实验是()A.B. C.D. 6.(2分)如图,图1是小车甲运动的s﹣t图象,图2是小车乙运动的v﹣t图象,由图象可知() A.甲、乙都由静止开始运动 B.甲、乙都以2m/s匀速运动 C.甲、乙两车经过5s不一定相遇 D.甲车速度越来越大,乙车速度不变 7.(2分)用隔板将玻璃容器均分为两部分,隔板中有一小孔用薄橡皮膜封闭(如图),下列问题中可以用该装置探究的是() ①液体压强是否与液体的深度有关 ②液体压强是否与液体的密度有关 ③液体是否对容器的底部产生压强 ④液体是否对容器的侧壁产生压强。 A.①②③B.①②④C.②③④D.①③④
2015-2016学年浙江省宁波市余姚中学高三(上)开学物理试卷【解析版】
2015-2016学年浙江省宁波市余姚中学高三(上)开 学物理试卷 一.单项选择题(每小题只有一个选项符合题意,每小题4分,共32分) 1.一个物体位移与时间的关系为与x=5t﹣t2+2(x以m为单位,t以s为单位),关于此物体下列说法中正确的是( ) A.第2s初的速度比1s末速度小2m/s B.2s内的平均速度为4m/s C.第2s内的平均速度为2m/s D.第2s位移比第1s位移大4m 2.两同学用如图所示方法做共点力平衡实验.M、N为摩擦不计的定滑轮,O点是轻质细绳OA、OB和OC的结点,桌上有若干相同的钩码,某同学已经在A点和C点分别挂了3个和4个钩码,为使O点在两滑轮间某位置受力平衡,另一同学在B点挂的钩码数应是( ) A.1个B.3个C.5个D.7个 3.下列说法正确的是( ) A.若物体运动速率始终不变,则物体所受合力一定为零 B.若物体的加速度均匀增加,则物体做匀加速直线运动 C.若物体所受合力与其速度方向相反,则物体做匀减速直线运动 D.若物体在任意的相等时间间隔内位移相等,则物体做匀速直线运动 4.如图,半圆形凹槽的半径为R,O点为其圆心.在与O点等高的边缘A、B两点分别以速度v1、v2水平相向抛出两个小球,已知v1:v2=1:3,两小球恰落在弧面上的P点.则以下说法中正确的是( ) A.∠AOP为45° B.若要使两小球落在P点右侧的弧面上同一点,则应使v1、v2都增大 C.改变v1、v2,只要两小球落在弧面上的同一点,v1与v2之和就不变 D.若只增大v1,两小球可在空中相遇
5.如图,三根轻细绳悬挂两个质量相同的小球保持静止,A、D间细绳是水平的,现对B 球施加一个水平向右的力F,将B缓缓拉到图中虚线位置,这时三根细绳张力T AC、T AD、T AB的变化情况是( ) A.都变大B.T AD和T AB变大,T AC不变 C.T AC和T AB变大,T AD不变D.T AC和T AD变大,T AB不变 6.公路急转弯处通常是交通事故多发地带.如图,某公路急转弯处是一圆弧,当汽车行驶的速率为v c时,汽车恰好没有向公路内外两侧滑动的趋势,则在该弯道处( ) A.路面外侧低内侧高 B.车速只要低于v c,车辆便会向内侧滑动 C.车速虽然高于v c,但只要不超出某一高度限度,车辆便不会向外侧滑动 D.当路面结冰时,与未结冰时相比,v c的值变小 7.如图所示,在高度为h、倾角为30°的粗糙固定的斜面上,有一质量为m、与一轻弹簧拴接的物块恰好静止于斜面底端.物块与斜面的动摩擦因数为,且最大静摩擦力等于滑动 摩擦力.现用一平行于斜面的力F拉动弹簧的A点,使m缓慢上滑到斜面顶端.此过程中( ) A.F做功为2mgh B.F做的功大于2mgh C.F做的功等于物块克服重力做功与克服摩擦力做功之和 D.F做的功等于物块的重力势能与弹簧的弹性势能增加量之和 8.如图所示,物体从光滑斜面上的A点由静止开始下滑,经过B点后进入水平面(设经过B点前后速度大小不变),最后停在C点.每隔0.2秒钟通过速度传感器测量物体的瞬时速度,下表给出了部分测量数据,g=10m/s2.则物体在0.6s时的速度为( )
浙江省宁波余姚市常住人口数量和财政主要指标数据研究报告2019版
浙江省宁波余姚市常住人口数量和财政主要指标数据研究报 告2019版
引言 本报告针对宁波余姚市常住人口数量和财政主要指标现状,以数据为基础,通过数据分析为大家展示宁波余姚市常住人口数量和财政主要指标现状,趋势及发展脉络,为大众充分了解宁波余姚市常住人口数量和财政主要指标提供重要参考及指引。 宁波余姚市常住人口数量和财政主要指标数据研究报告对关键因素年末常 住人口数量,财政总收入,一般公共预算收入,一般公共预算支出等进行了分析和梳理并进行了深入研究。 报告力求做到精准、精细、精确,公正,客观,报告中数据来源于中国国家统计局、相关行业协会等权威部门,并借助统计分析方法科学得出。相信宁波余姚市常住人口数量和财政主要指标数据研究报告能够帮助大众更加跨 越向前。
目录 第一节宁波余姚市常住人口数量和财政主要指标现状 (1) 第二节宁波余姚市年末常住人口数量指标分析 (3) 一、宁波余姚市年末常住人口数量现状统计 (3) 二、全省年末常住人口数量现状统计 (3) 三、宁波余姚市年末常住人口数量占全省年末常住人口数量比重统计 (3) 四、宁波余姚市年末常住人口数量(2016-2018)统计分析 (4) 五、宁波余姚市年末常住人口数量(2017-2018)变动分析 (4) 六、全省年末常住人口数量(2016-2018)统计分析 (5) 七、全省年末常住人口数量(2017-2018)变动分析 (5) 八、宁波余姚市年末常住人口数量同全省年末常住人口数量(2017-2018)变动对比分析6 第三节宁波余姚市财政总收入指标分析 (7) 一、宁波余姚市财政总收入现状统计 (7) 二、全省财政总收入现状统计分析 (7) 三、宁波余姚市财政总收入占全省财政总收入比重统计分析 (7) 四、宁波余姚市财政总收入(2016-2018)统计分析 (8) 五、宁波余姚市财政总收入(2017-2018)变动分析 (8) 六、全省财政总收入(2016-2018)统计分析 (9)
2016宁波余姚事业单位招聘公告
2016宁波余姚事业单位招聘公告 温馨提示:2016余姚事业单位考试公告暂未发布,中公浙江事业单位考试网建议您参考去年考试公告,了解考试安排,提前备考。以下为2015浙江宁波余姚市部分事业单位招聘46人公告: 为满足我市事业单位补充工作人员需要,根据事业单位公开招聘的有关规定,经研究,决定面向社会公开招聘部分事业单位工作人员46名。现将有关事项公告如下: 一、招聘的岗位、指标(详见附件1) 最新招考信息及备考资料请关注: 浙江省事业单位招聘网(公告信息/备考资料),实时更新。 二、招聘的范围、对象和条件 (一)招聘的范围和对象 1、宁波生源全日制普通高校2015年应届毕业生和宁波市常住户口、大专及以上学历且已毕业取得学历(学位)证书的社会人员; 2、研究生毕业并具有硕士学位的人员或具有相应副高级专业技术职务任职资格者,户籍地不限; 3、乡镇所属事业单位从大学生“村官”中招聘的具体对象为:余姚市行政区域内,经组织、人力社保部门统一选聘到村(社区)任职满3年及以上(任职时间从签订劳动合同之日起算,下同),历年年度考核均为称职及以上,且仍在服务岗位的人员;参加大学生“村官”项目服务满2个聘期、历年年度考核均为称职及以上,且离开服务岗位未满3年的人员; 4、经所在单位和主管部门同意后,余姚市在编的自收自支事业单位工作人员可以报考差额补助或全额补助事业单位、差额补助事业单位工作人员可以报考全额补助事业单位(以下简称“逆向报考”)。其他事业单位工作人员不能报考; 5、公务员、现役军人、现仍在全日制普通高校就读的学生(含在读专升本、在读研究生)不能报考。在相应人事考试中因违纪违规,按有关规定不能报考的人员,不得报考。 (二)招聘条件 报考人员除应符合上述招聘范围和对象规定外,还须符合以下条件: 1、拥护党的基本路线,遵纪守法,品行端正,爱岗敬业; 2、报考人员须具有国家承认的学历和专业,且符合招聘岗位所需的学历和专业要求(报考人员毕业证书上的学历和专业,必须与招聘岗位的学历和专业要求相符); 3、年龄35周岁以下(1980年8月25日之后出生),对具有相应副高级专业技术职务任职资格者,年龄要求40周岁以下(1975年8月25日之后出生); 4、身体健康;
浙江省宁波市余姚市19-20九上期末数学试卷
浙江省宁波市余姚市19-20九上期末数学试卷一、选择题(本大题共12小题,共48.0分) 1.如果a b =2,则a+b a?b 的值是() A. 3 B. ?3 C. 1 2D. 3 2 2.下列事件为必然事件的是() A. 买一张电影票,座位号是偶数 B. 抛掷一枚普通的正方体骰子1点朝上 C. 明天一定会下雨 D. 百米短跑比赛,一定产生第一名 3.抛物线y=x2+1的顶点坐标是() A. (1,0) B. (?1,0) C. (0,1) D. (1,1) 4.△ABC的三边长分别为6、8、10,则其内切圆和外接圆的半径分别是() A. 2,5 B. 1,5 C. 4,5 D. 4,10 5.若扇形的圆心角为90°,半径为6,则该扇形的弧长为() A. 3 2 π B. 2π C. 3π D. 6π 6.点P1(?1,y1),P2(3,y2),P3(5,y3)均在二次函数y=?x2+2x+c的图象上,则y1,y2,y3的大 小关系是() A. y1=y2>y3 B. y1>y2>y3 C. y3>y2>y1 D. y3>y1=y2 7.如图,已知⊙O是△ABC的外接圆,⊙O的半径为5,AB=5,则∠C为 () A. 60° B. 90° C. 45° D. 30° 8.若抛物线y=ax2+c经过点P(1,?2),则它也经过() A. P1(?1,?2) B. P2(?1,2) C. P3(1,2) D. P4(2,1) 9.如图,在等腰△ABC中,AB=AC,BC=3√10,sinA=3 5 ,则AB的长为()
A. 15 B. 5√10 C. 20 D. 10√5 10.如图,在△ABC中,两条中线BE,CD相交于点O,则S△DOE:S△COB等 于() A. 1:2 B. 1:3 C. 1:4 D. 2:3 11.已知OA=4cm,以O为圆心,r为半径作⊙O.若使点A在⊙O内,则r的值可以是() A. 2cm B. 3cm C. 4cm D. 5cm 12.如图,在矩形ABCD内放入六个小正方形后形成一个中心对称图形, 其中顶点E、F分别在边BC、AD上,则长AD与宽AB的比为() A. 6:5 B. 13:10 C. 8:7 D. 4:3 二、填空题(本大题共6小题,共24.0分) 13.一个正八边形每个内角的度数为______度. 14.比较下列三角函数值的大小:sin40°____sin50°. 15.有五张背面完全相同的卡片,正面分别写有数字1,2,3,4,5,把这些卡片背面朝上洗匀后, 从中随机抽取一张,其正面的数字是奇数的概率为. 16.把二次函数y=2x2向左平移3个单位长度,再向下平移4个单位长度得到的解析式为______. 17.在△ABC中,AB=AC,∠BAC=120°,AD⊥AC交BC于点D,BD=1,则BC的长为______.
浙江省宁波市余姚市2018-2019学年七年级下学期数学期末考试试卷
浙江省宁波市余姚市2018-2019学年七年级下学期数学期末考试试卷 一、选择题(本题有12小题,每小题3分,共36分)(共12题;共36分) 1.下列各组数中,是二元一次方程2x-3y=1的解的是() A. B. C. D. 2.下列计算正确的是() A. a4-a2=a2 B. a4÷a2=a2 C. a4+a2=a6 D. a4·a2=a8 3.为了解本校学生课外使用网络情况,学校采用抽样问卷调查,下面的抽样方法最恰当的是() A. 随机抽取七年级5位同学 B. 随机抽取七年级每班各5位同学 C. 随机抽取全校5位同学 D. 随机抽取全校每班各5位同学 4.已知∠1和∠2是同旁内角.若∠1=40°,则∠2的度数是() A. 40° B. 140° C. 160° D. 无法确定 5.已知1纳米等于0.000 000 001米,那么2纳米用科学记数法表示为() A. 2×10-9米 B. 0.2×10-8米 C. 20×108米 D. 2×109米 6.如图是某手机店今年1-5月份某品牌手机销售额的统计图,根据图中信息,可以判断相邻两个月该品牌手机销售额变化最大的是() A. 1月至2月 B. 2月至3月 C. 3月至4月 D. 4月至5月 7.下列等式不正确的是() A. (a+b)(a-b)=a2-b2 B. (a+b)(-a-b)=-(a+b)2 C. (a-b)(-a+b)=-(a-b)2 D. (a-b)(-a-b)=-a2-b2 8.已知在同一平面内有三条不同的直线a,b,c,下列说法错误的是() A. 如果a∥b,a⊥c,那么b⊥c B. 如果b∥a,c∥a,那么b∥c C. 如果b⊥a,c⊥a,那么b⊥c D. 如果b⊥a,c⊥a,那么b∥c 9.要使分式有意义,则实数x的取值应满足() A. x≠0 B. x≠1 C. x≠0或x≠1 D. x≠0且x≠1 10.若(x+2y)2=(x-2y)2+A,则A等于() A. 8xy B. -8xy C. 8y2 D. 4xy
浙江省宁波余姚市常住人口数量和社会消费品零售总额数据解读报告2019版
浙江省宁波余姚市常住人口数量和社会消费品零售总额数据解读报告2019版
前言 本报告主要收集权威机构数据如中国国家统计局,行业年报等,通过整理及清洗,从数据出发解读宁波余姚市常住人口数量和社会消费品零售总额现状及趋势。 宁波余姚市常住人口数量和社会消费品零售总额数据解读报告知识产权为发布方即我公司天津旷维所有,其他方引用我方报告均需要注明出处。 宁波余姚市常住人口数量和社会消费品零售总额数据解读报告深度解读宁波余姚市常住人口数量和社会消费品零售总额核心指标从年末常住人口数量,社会消费品零售总额等不同角度分析并对宁波余姚市常住人口数量和社会消费品零售总额现状及发展态势梳理,相信能为你全面、客观的呈现宁波余姚市常住人口数量和社会消费品零售总额价值信息,帮助需求者提供重要决策参考及借鉴。
目录 第一节宁波余姚市常住人口数量和社会消费品零售总额现状 (1) 第二节宁波余姚市年末常住人口数量指标分析 (3) 一、宁波余姚市年末常住人口数量现状统计 (3) 二、全省年末常住人口数量现状统计 (3) 三、宁波余姚市年末常住人口数量占全省年末常住人口数量比重统计 (3) 四、宁波余姚市年末常住人口数量(2016-2018)统计分析 (4) 五、宁波余姚市年末常住人口数量(2017-2018)变动分析 (4) 六、全省年末常住人口数量(2016-2018)统计分析 (5) 七、全省年末常住人口数量(2017-2018)变动分析 (5) 八、宁波余姚市年末常住人口数量同全省年末常住人口数量(2017-2018)变动对比分析6 第三节宁波余姚市社会消费品零售总额指标分析 (7) 一、宁波余姚市社会消费品零售总额现状统计 (7) 二、全省社会消费品零售总额现状统计分析 (7) 三、宁波余姚市社会消费品零售总额占全省社会消费品零售总额比重统计分析 (7) 四、宁波余姚市社会消费品零售总额(2016-2018)统计分析 (8) 五、宁波余姚市社会消费品零售总额(2017-2018)变动分析 (8) 六、全省社会消费品零售总额(2016-2018)统计分析 (9)
宁波市各高中排名表
为了孩子,该知道的宁波全大市中学排名 ★★★★★ 1. 镇海中学(经过二十年的追赶,成为宁波 NO.1,是无可争议,实至名归,今年成为百年学府。最近美国某教育机构给中国高中的排名中,名列浙江省第1,全国第22名) 2. 效实中学(又称5中,瘦死的骆驼比马大,市区双骆驼之一,学子心目中曾经和镇海齐名的名校。比镇海中学小一岁,如今江河日下,居然沦落到靠上线总人数来吆喝,感觉其素质教育也是言过其实,不过英语教学着实不错,近年中考难度下降,生源质量有下降之嫌。虽然在中国名校的高考升学率,已经被镇海中学赶超,但凭其过硬的英语教育,在海外,尤其是北美,欧洲的世界顶级研究生院中,效实学子的数量和势力异常庞大,远非其他学校可比拟) 以上2所名校代表宁波中等教育界的最好水平,人才辈出,各自为共和国培养的中科院院士数量都是两位数。中国第一学府给宁波地区的自主招生名额,也只给这两所学校。 ★★★★ 3. 慈溪中学(老牌名校,县级市学校里面的老大,每年都有北大、清华。目前稳居宁波三甲) 4. 鄞州中学(老牌名校,吸引了鄞州的最好生源,近年高考成绩不输效实,但是缺乏顶尖学生) 5~9. 余姚中学,奉化中学,北仑中学,象山中学,宁海中学(这5所为个县市的老大,算是齐名,成绩优异,不再细分) 10. 宁波中学(又称1中,市区双骆驼的第二只,宁波名校中资历最老的学校,宁波地区传统3强。在上世纪,已经成为百年学府,曾经的“国立”二字,更是拥有宁波地区其他中学从没有享受过的待遇。90年代出过省状元,曾风光一时,2000年后一蹶不振,搬到鄞州后更是把不少生源拱手让给二中,当年响誉全省的“国立浙江四中”,现在已沦落到“宁波高教园区第一名校”。好在历界毕业生留在宁波发展的居多,不像效实那样,在外地和海外比例高。随着近几年“国考”盛行,宁中校友当上宁波市区公务员的数量众多,正所谓“朝中有人好提拔”,
浙江省宁波市余姚中学2020-2021学年高一上学期期中语文试题(原卷版)
余姚中学 2020 学年第一学期期中考试高一语文试卷 一、现代文阅读(36 分) (一)(共 3 题,9 分) 阅读下面的文字,完成下面小题。 社会是由众多家庭组成的,家庭和谐关乎社会和谐。要在家庭中建立一种和谐的关系,就需要有家庭伦理。中国自古以来就有维护家庭关系的种种伦理规范,它们往往体现在各种“礼”之中。从《礼记》中可以看到各种礼制的记载,如婚丧嫁娶,这些都包含着各种家庭伦理规范,而要使这些规范成为一种社会遵守的伦理,就要使“礼”制度化。 在中国古代,“孝”无疑是家庭伦理中最重要的观念。《孝经》中有孔子的一段话:“夫孝,天之经也,地之义也,民之行也。”这是说“孝”是“天道”常规,是“地道”通则,是人们遵之而行的规矩。为什么“孝”有这样大的意义?这与中国古代宗法制有关。中国古代社会基本上是宗法性的农耕社会,家庭不仅是生活单位,而且是生产单位。要较好地维护家庭中长幼尊卑的秩序,使家族得以顺利延续,必须有一套维护当时社会稳定的家庭伦理规范。这种伦理规范又必须是一套自天子至庶人都遵守的伦理规范,这样社会才得以稳定。 “孝”成为一种家庭伦理规范,并进而成为社会的伦理制度,必有其哲理上的根据。《郭店楚简·成之闻之》中说:“天登大常,以理人伦,制为君臣之义,作为父子之亲,分为夫妇之辩。”理顺君臣、父子、夫妇的关系是“天道”的要求。君子以“天道”常规处理君臣、父子、夫妇伦理关系,社会才能治理好。所以,“人道”与“天道”是息息相关的。 “孝”作为一种家庭伦理的哲理根据就是孔子的“仁学”。以“亲亲”(爱自己的亲人)为基点,扩大到“仁民”,以及于“爱物”。基于孔子的“仁学”,把“孝”看成是“天之经”“地之义”“人之行”是可以理解的。一方面,它体现了孔子“爱人”(“泛爱众”)的精义;另一方面,在孔子儒家思想中,“孝”在社会生活实践中有一个不断扩大的过程。因此,“孝”不是凝固教条,而是基于“仁学”的“爱”不断释放的过程,只有在家庭实践和社会实践中,以“仁学”为基础的“孝”的意义才能真正显现出来。 社会在发展,现代社会中的家庭伦理会变化。“孝”的内涵也会随之变化。例如“四世同堂”“养儿防老”,就因家庭作为生产单位的逐渐消失而失去意义,又如“二十四孝”中的某些形式已没有必要提倡,但作为“孝”之核心理念的“仁爱”仍有家庭伦理之意义。在家庭不再是生产单位的情况下,保障家庭良好的生活状态,将主要由社会保障体系来承担,但“孝”的“仁爱”精神则不会改变。对长辈的爱敬,对子孙的培育,都是出于人之内在本心的“仁爱”。鲁迅在《我们现在怎样做父亲》中批评抹掉了“爱”,一味说“恩”的“父为子纲”说,提出:“我现在以为然的,便只是‘爱’。”“孝”之核心理念“仁爱”作为家庭伦理仍具有某种普遍价值的意义。
浙江省宁波余姚市国民经济综合情况数据解读报告2019版
浙江省宁波余姚市国民经济综合情况数据解读报告2019版
前言 本报告主要收集权威机构数据如中国国家统计局,行业年报等,通过整理及清洗,从数据出发解读宁波余姚市国民经济综合情况现状及趋势。 宁波余姚市国民经济综合情况数据解读报告相关知识产权为发布方即我公司天津旷维所有,其他方引用我方报告均需要注明出处。 宁波余姚市国民经济综合情况数据解读报告深度解读宁波余姚市国民经济综合情况核心指标从土地面积,年末常住人口,生产总值,第一产业生产总值,第二产业生产总值,第三产业生产总值,工业生产总值,人均生产总值等不同角度分析并对宁波余姚市国民经济综合情况现状及发展态势梳理,相信能为你全面、客观的呈现宁波余姚市国民经济综合情况价值信息,帮助需求者提供重要决策参考及借鉴。
目录 第一节宁波余姚市国民经济综合情况现状 (1) 第二节宁波余姚市土地面积指标分析 (3) 一、宁波余姚市土地面积现状统计 (3) 二、全省土地面积现状统计 (3) 三、宁波余姚市土地面积占全省土地面积比重统计 (3) 四、宁波余姚市土地面积(2016-2018)统计分析 (4) 五、宁波余姚市土地面积(2017-2018)变动分析 (4) 六、全省土地面积(2016-2018)统计分析 (5) 七、全省土地面积(2017-2018)变动分析 (5) 八、宁波余姚市土地面积同全省土地面积(2017-2018)变动对比分析 (6) 第三节宁波余姚市年末常住人口指标分析 (7) 一、宁波余姚市年末常住人口现状统计 (7) 二、全省年末常住人口现状统计分析 (7) 三、宁波余姚市年末常住人口占全省年末常住人口比重统计分析 (7) 四、宁波余姚市年末常住人口(2016-2018)统计分析 (8) 五、宁波余姚市年末常住人口(2017-2018)变动分析 (8) 六、全省年末常住人口(2016-2018)统计分析 (9)
浙江省宁波余姚市国民经济基本情况数据洞察报告2019版
浙江省宁波余姚市国民经济基本情况数据洞察报告2019版
引言 本报告针对宁波余姚市国民经济基本情况现状,以数据为基础,通过数据分析为大家展示宁波余姚市国民经济基本情况现状,趋势及发展脉络,为大众充分了解宁波余姚市国民经济基本情况提供重要参考及指引。 宁波余姚市国民经济基本情况数据洞察报告对关键因素土地面积,年末常住人口,生产总值,第一产业生产总值,第二产业生产总值,第三产业生产总值,工业生产总值,人均生产总值等进行了分析和梳理并进行了深入研究。报告力求做到精准、精细、精确,公正,客观,报告中数据来源于中国国家统计局、相关行业协会等权威部门,并借助统计分析方法科学得出。相信宁波余姚市国民经济基本情况数据洞察报告能够帮助大众更加跨越向前。
目录 第一节宁波余姚市国民经济基本情况现状 (1) 第二节宁波余姚市土地面积指标分析 (3) 一、宁波余姚市土地面积现状统计 (3) 二、全省土地面积现状统计 (3) 三、宁波余姚市土地面积占全省土地面积比重统计 (3) 四、宁波余姚市土地面积(2016-2018)统计分析 (4) 五、宁波余姚市土地面积(2017-2018)变动分析 (4) 六、全省土地面积(2016-2018)统计分析 (5) 七、全省土地面积(2017-2018)变动分析 (5) 八、宁波余姚市土地面积同全省土地面积(2017-2018)变动对比分析 (6) 第三节宁波余姚市年末常住人口指标分析 (7) 一、宁波余姚市年末常住人口现状统计 (7) 二、全省年末常住人口现状统计分析 (7) 三、宁波余姚市年末常住人口占全省年末常住人口比重统计分析 (7) 四、宁波余姚市年末常住人口(2016-2018)统计分析 (8) 五、宁波余姚市年末常住人口(2017-2018)变动分析 (8) 六、全省年末常住人口(2016-2018)统计分析 (9)
2019-2020学年浙江省宁波市余姚中学高一下学期期中数学试卷 (解析版)
2019-2020学年浙江省宁波市余姚中学高一第二学期期中数学试 卷 一、选择题(共10小题). 1.直线y=﹣x+1的倾斜角为() A.30°B.60°C.120°D.150° 2.若a<b<0,则下列不等式中错误的是() A.B.C.|a|>|b|D.a2>b2 3.不等式ax2+bx+2>0的解集是,则a+b的值是() A.10B.﹣10C.14D.﹣14 4.若对任意x∈R,不等式|x|≥ax恒成立,则实数a的取值范围是()A.a<﹣1B.|a|≤1C.|a|<1D.a≥1 5.已知不等式mx2+4mx﹣4<0对任意实数x恒成立.则m取值范围是()A.(﹣1,0)B.[﹣1,0] C.(﹣∞,﹣1)∪[0,+∞)D.(﹣1,0] 6.已知正数x,y,且x+4y=1,则xy的最大值为() A.B.C.D. 7.△ABC的三个内角为A,B,C,若=tan,则sin B?sin C的最大值为() A.B.1C.D.2 8.等差数列{a n}的公差d≠0,a n∈R,前n项和为S n,则对正整数m,下列四个结论中:(1)S m,S2m﹣S m,S3m﹣S2m成等差数列,也可能成等比数列; (2)S m,S2m﹣S m,S3m﹣S2m成等差数列,但不可能成等比数列; (3)S m,S2m,S3m可能成等比数列,但不可能成等差数列; (4)S m,S2m,S3m不可能成等比数列,也不可能成等差数列; 正确的是() A.(1)(3)B.(1)(4)C.(2)(3)D.(2)(4)9.在平面直角坐标系xOy中,圆C1:(x+1)2+(y﹣6)2=25,圆C2:(x﹣17)2+(y
浙江省宁波市鄞州中学2019-2020学年高三下学期期初考试地理试题(word无答案)
浙江省宁波市鄞州中学2019-2020学年高三下学期期初考试地理试 题 一、单选题 (★) 1 . 武汉火神山医院总建筑面积3.39万平方米,从方案设计到建成交付仅用时10天,被誉为“中国速度”。下图反映了火神山医院建设过程中周边地表的变化过程。对周边地表的变化过程进行动态监测运用的地理信息技术是() A.GPS B.RS C.数字地球D.GIS (★★) 2 . 读图,完成下面小题 【小题1】关于图示地区各处的岩石叙述正确的是() A.①处岩石是变质作用形成的B.②处岩石曾经历高温高压环境 C.③处岩石肯定含有化石D.④处岩石不可能含有较多气孔 【小题2】关于图示地区叙述正确的是()A.甲处断层发育侵蚀成谷B.乙处是沉积作用形成的山 C.丙处是地壳断裂下陷形成的谷D.丁处的山形成早于乙处 (★) 3 . 下图为欧洲局部地区示意图。完成下面小题。
【小题1】形成M洋流的大气环流是 A.东北信风B.盛行西风C.西南季风D.极地东风 【小题2】洋流M使N地 A.水循环更新速度加快B.河流冬季结冰期缩短 C.沿海地区的降水减少D.内河航运的速度加快 (★★) 4 . 从秦岭第二高峰鳌山(海拔3476米)徒步至第一高峰太白山(海拔3767米)的户外徒步线路——鳌太线(左图),以山水形胜而出名。但其积雪多、难度大、危险性高对户外爱好者提出挑战,尤其以称为“石海”一段的路段最难,基本上是在碎石上攀爬。右图示意“石海”景观。据此完成下面小题。 【小题1】“石海”形成的主要地质作用是() A.风化作用B.流水侵蚀C.风力侵蚀D.冰川作用 【小题2】如果徒步旅行者从北坡攀登鳌山并沿穿越线路至主峰太白山,沿途可能看到() A.山麓常绿树种郁郁葱葱B.穿越线路沿途溪流潺潺 C.山顶终年白雪皑皑D.又高又密的针阔混交林 (★★) 5 . 读某地海平面等压线分布示意图,图示时间内该地区的天气变化为()
2019-2020学年浙江省宁波市余姚市八年级(上)期末数学试卷
2019-2020学年浙江省宁波市余姚市八年级(上)期末数学试卷 一、选择题(本题有12小题,每小题3分,共36分) 1.(3分)下面四个图是“余姚阳明故里LOGO 征集大赛”的四件作品,其中是轴对称图形的是( ) A . B . C . D . 2.(3分)在平面直角坐标系中,点(1,2)-在( ) A .第一象限 B .第二象限 C .第三象限 D .第四象限 3.(3分)已知一个等腰三角形的底角为50?,则这个三角形的顶角为( ) A .40? B .50? C .80? D .100? 4.(3分)下列选项错误的是( ) A .若a b >,b c >,则a c > B .若a b >,则33a b ->- C .若a b >,则22a b ->- D .若a b >,则2323a b -+<-+ 5.(3分)下列平面直角坐标系中的图象,不能表示y 是x 的函数是( ) A .
B. C. D. 6.(3分)下列尺规作图分别表示:①作一个角的平分线,②作一个角等于已知角.③作一条线段的垂直平分线.其中作法正确的是() A.①②B.①③C.②③D.①②③ 7.(3分)能说明命题“对于任意正整数n,则2 …”是假命题的一个反例可以是() 2n n A.1 n= n=D.3 n=-B.1 n=C.2 8.(3分)若a,b,c为ABC ?是直角三角形的 ?的三边长,则下列条件中不能判定ABC
是() A. 1.5 a=,2 b=, 2.5 c=B.::3:4:5 a b c= C.A B C ∠+∠=∠D.::3:4:5 A B C ∠∠∠= 9.(3分)如图,有一张直角三角形纸片,90 ACB ∠=?,5 AB cm =,3 AC cm =,现将ABC ? 折叠,使边AC与AB重合,折痕为AE,则CE的长为() A.1cm B.2cm C.3 2 cm D. 5 2 cm 10.(3分)如图,ABC ?是等边三角形,D是边BC上一点,且ADC ∠的度数为(520) x-?,则x的值可能是() A.10B.20C.30D.40 11.(3分)某天,某同学早上8点坐车从余姚图书馆出发去宁波大学,汽车离开余姚图书馆的距离S(千米)与所用时间t(分)之间的函数关系如图所示.已知汽车在途中停车加油一次,则下列描述不正确的是() A.汽车在途中加油用了10分钟 B.若// OA BC,则加满油以后的速度为80千米/小时 C.若汽车加油后的速度是90千米/小时,则25 a= D.该同学8:55到达宁波大学 12.(3分)如图,点A,B,C,D顺次在直线l上,以AC为底边向下作等腰直角三角
浙江省宁波市余姚中学2020-2021学年高一下学期期中地理试题
浙江省宁波市余姚中学2020-2021学年高一下学期期中地理 试题 学校:___________姓名:___________班级:___________考号:___________ 一、单选题 2021年1月,“嫦娥四号”月球探测器首次实现在月球背面着陆。读图完成下面小题。 1.“嫦娥四号”探测器的目标 天体属于 A.恒星B.卫星C.行星D.彗星2.在月球绕地运行过程中,月球探测器 A.在①处经受太阳高温考验B.在①处观测不到水星和金星 C.在②处能拍摄到地球照片D.在②处可以观察到太阳黑子黄山的奇松是以石为母,顽强地扎根于花岗岩巨岩裂隙中,形成了黄山一道亮丽的风景线。下图为黄山松景观图,完成下面小题。 1
3.黄山松根系对巨岩 的破坏属于() A.物理风化作用B.生物风化作用 C.流水侵蚀作用D.生物侵蚀作用 4.经过外力作用的花岗岩,首先转变为() A.变质岩B.岩浆岩 C.侵入岩D.沉积岩 读“某城市多年平均气候统计资料图”,完成下列问题。 5.该城市最可能是 A.辽宁沈阳B.海南三亚C.浙江杭州D.陕西西安6.该城市6月份降水量最大,其影响因素主要是 A.锋面B.对流雨C.台风D.反气旋
下图是以我国东部某市760万手机用户为样本,统计的该地人口年龄数据。读下图,回答下列各题。 7.新居民迁入,对该 市人口状况的影响是 A.加剧迁入地老龄化B.提高了青壮年比例 C.提高迁入地死亡率D.提高人口预期寿命 8.推测新居民迁入该市的主要影响因素是 A.医疗卫生B.人口政策C.收入差距D.自然环境 读“山东省某县城2015~2021年城市总体规划示意图”,完成下面小题。 9.按照 3
浙江省宁波余姚市规模以上工业企业单位数量具体情况数据分析报告2019版
浙江省宁波余姚市规模以上工业企业单位数量具体情况数据分析报告2019版
序言 本报告从规模以上工业企业单位总数量,规模以上内资工业企业单位数量,规模以上港澳台商投资工业企业单位数量,规模以上外商投资工业企业单位数量等重要因素进行分析,剖析了宁波余姚市规模以上工业企业单位数量具体情况现状、趋势变化。 宁波余姚市规模以上工业企业单位数量具体情况数据分析报告知识产权为 发布方即我公司天津旷维所有,其他方引用此报告均请注明出处。 借助对数据的发掘及分析,提供一个全面、严谨、客观的视角来了解宁波余姚市规模以上工业企业单位数量具体情况现状及发展趋势。本分析报告数据来源于中国国家统计局等权威部门,并经过专业统计分析及清洗而得。 宁波余姚市规模以上工业企业单位数量具体情况数据分析报告以数据呈现 方式客观、多维度、深入介绍宁波余姚市规模以上工业企业单位数量具体情况真实状况及发展脉络,为需求者提供必要借鉴及重要参考。
目录 第一节宁波余姚市规模以上工业企业单位数量具体情况现状 (1) 第二节宁波余姚市规模以上工业企业单位总数量指标分析 (3) 一、宁波余姚市规模以上工业企业单位总数量现状统计 (3) 二、全省规模以上工业企业单位总数量现状统计 (3) 三、宁波余姚市规模以上工业企业单位总数量占全省规模以上工业企业单位总数量比重统 计 (3) 四、宁波余姚市规模以上工业企业单位总数量(2016-2018)统计分析 (4) 五、宁波余姚市规模以上工业企业单位总数量(2017-2018)变动分析 (4) 六、全省规模以上工业企业单位总数量(2016-2018)统计分析 (5) 七、全省规模以上工业企业单位总数量(2017-2018)变动分析 (5) 八、宁波余姚市规模以上工业企业单位总数量同全省规模以上工业企业单位总数量 (2017-2018)变动对比分析 (6) 第三节宁波余姚市规模以上内资工业企业单位数量指标分析 (7) 一、宁波余姚市规模以上内资工业企业单位数量现状统计 (7) 二、全省规模以上内资工业企业单位数量现状统计分析 (7) 三、宁波余姚市规模以上内资工业企业单位数量占全省规模以上内资工业企业单位数量比 重统计分析 (7)
2019-2020学年浙江省宁波市鄞州中学高一上学期期中数学试题(解析版)
浙江省宁波市鄞州中学高一上学期期中数学试题 一、单选题 1.已知集合A ={}|13x x ≤<,集合B ={}|05y y <≤,则() R A B ?e=( ) A .(-∞,1)∪[3,+∞) B .(0,1)∪[3,5] C .(0,1]∪(3,5] D .(0,5] 【答案】B 【解析】再求集合A 的补集,再根据交集定义求解即可 【详解】 由{}{} |13|13R A x x A x x x =≤,21()1 x g x x -=-对应的定义域中1x ≠, 故不是同一函数; 对B ,()1g x x ==-,与()f x 表达式不一致,故不是同一函数; 对C , ()g x = == ,1 x > ,()1f x x =>,是同一函
数; 对D ,1(1)ln x f R x e x x -=-=∈,,21()(1)1,g x x x x =-=≥-,定义域不同,不是同一函数; 故选:C 【点睛】 本题考查同一函数的判断,需满足两点:定义域相同,对应关系相同(化简后表达式相同),属于中档题 3.函数1x y b a ?? =- ??? 与函数()log a y x b =-在同一平面直角坐标系内的图像可能是 ( ) A . B . C . D . 【答案】B 【解析】由于参数,a b 不能确定,可结合图像,选定一个函数图像,去分析参数的范围,以确定另一个函数图像的合理性 【详解】 对A ,若对数型函数经过()0,0,则1b =-且1a >,则111x x y b a a ???? =-=+ ? ????? ,指数型 函数应单调递减,图形不符合,排除; 对B ,若指数型函数经过()0,0,则()0,1,1a b ∈=,则()log a y x b =-应单调递减且向右平移一个单位,图像符合,正确; 对,C D ,若指数型函数经过()0,0,则1a >,1b =,则()log a y x b =-应为增函数且向右平移一个单位,都不符合,排除;
