离子对试剂汇总

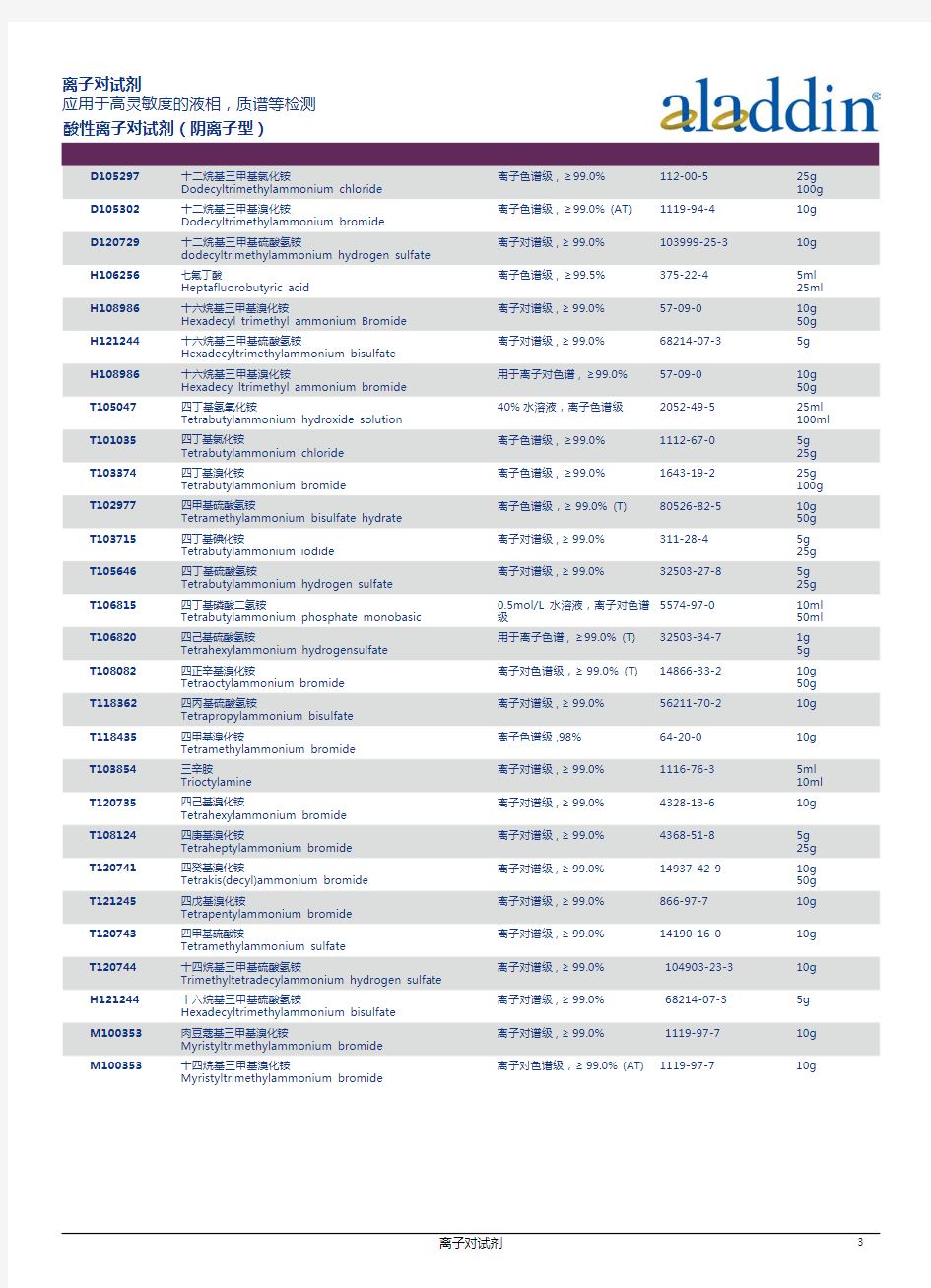
货号 品名 规格 CAS 包装
D105297十二烷基三甲基氯化铵
Dodecyltrimethylammonium chloride 离子色谱级, ≥99.0%112-00-525g
100g
D105302十二烷基三甲基溴化铵
Dodecyltrimethylammonium bromide
离子色谱级, ≥99.0% (AT)1119-94-410g
D120729十二烷基三甲基硫酸氢铵
dodecyltrimethylammonium hydrogen sulfate
离子对谱级,≥99.0%103999-25-310g
H106256七氟丁酸
Heptafluorobutyric acid 离子色谱级, ≥99.5%375-22-45ml
25ml
H108986十六烷基三甲基溴化铵
Hexadecyl trimethyl ammonium Bromide 离子对谱级,≥99.0%57-09-0 10g
50g
H121244十六烷基三甲基硫酸氢铵
Hexadecyltrimethylammonium bisulfate
离子对谱级,≥99.0%68214-07-35g
H108986十六烷基三甲基溴化铵
Hexadecy ltrimethyl ammonium bromide 用于离子对色谱, ≥99.0%57-09-010g
50g
T105047四丁基氢氧化铵
Tetrabutylammonium hydroxide solution 40%水溶液,离子色谱级2052-49-525ml
100ml
T101035四丁基氯化铵
Tetrabutylammonium chloride 离子色谱级, ≥99.0%1112-67-05g
25g
T103374四丁基溴化铵
Tetrabutylammonium bromide 离子色谱级, ≥99.0%1643-19-225g
100g
T102977四甲基硫酸氢铵
Tetramethylammonium bisulfate hydrate 离子色谱级,≥99.0% (T)80526-82-510g
50g
T103715四丁基碘化铵
Tetrabutylammonium iodide 离子对谱级,≥99.0%311-28-45g
25g
T105646四丁基硫酸氢铵
Tetrabutylammonium hydrogen sulfate 离子对谱级,≥99.0%32503-27-85g
25g
T106815四丁基磷酸二氢铵
Tetrabutylammonium phosphate monobasic 0.5mol/L 水溶液,离子对色谱
级
5574-97-010ml
50ml
T106820四己基硫酸氢铵
Tetrahexylammonium hydrogensulfate 用于离子色谱, ≥99.0% (T)32503-34-71g
5g
T108082四正辛基溴化铵
Tetraoctylammonium bromide 离子对色谱级,≥99.0% (T)14866-33-210g
50g
T118362四丙基硫酸氢铵
Tetrapropylammonium bisulfate
离子对谱级,≥99.0%56211-70-210g
T118435四甲基溴化铵
Tetramethylammonium bromide
离子色谱级,98%64-20-010g
T103854三辛胺
Trioctylamine 离子对谱级,≥99.0%1116-76-3 5ml
10ml
T120735四己基溴化铵
Tetrahexylammonium bromide
离子对谱级,≥99.0%4328-13-610g
T108124四庚基溴化铵
Tetraheptylammonium bromide 离子对谱级,≥99.0%4368-51-85g
25g
T120741四癸基溴化铵
Tetrakis(decyl)ammonium bromide 离子对谱级,≥99.0%14937-42-910g
50g
T121245四戊基溴化铵
Tetrapentylammonium bromide
离子对谱级,≥99.0%866-97-710g
T120743四甲基硫酸铵
Tetramethylammonium sulfate
离子对谱级,≥99.0%14190-16-0 10g
T120744十四烷基三甲基硫酸氢铵
Trimethyltetradecylammonium hydrogen sulfate
离子对谱级,≥99.0% 104903-23-3 10g
H121244十六烷基三甲基硫酸氢铵
Hexadecyltrimethylammonium bisulfate
离子对谱级,≥99.0% 68214-07-35g
M100353肉豆蔻基三甲基溴化铵
Myristyltrimethylammonium bromide
离子对谱级,≥99.0% 1119-97-710g
M100353十四烷基三甲基溴化铵
Myristyltrimethylammonium bromide
离子对色谱级,≥99.0% (AT) 1119-97-710g
货号 品名 规格 CAS 包装
S1049341-庚烷磺酸钠
Sodium 1-heptanesulfonate 离子色谱级,98%22767-50-65g
25g
S1049481-己烷磺酸钠
Sodium 1-hexanesulfonate
离子色谱级,98%2832-45-35g
S1089271-辛烷磺酸钠
Sodium 1-octanesulfonate 离子对谱级,≥99.0%5324-84-55g
25g
S1186621-丁烷磺酸钠
Sodium 1-butanesulfonate 离子对色谱级, ≥99.0% (T)2386-54-15g
25g
S1002841-癸烷磺酸钠
Sodium 1-decanesulfonate 离子对谱级,≥98.0%13419-61-925g
5g
S105390十二烷基磺酸钠
Sodium laurylsulfonate 离子对谱级,≥99.0%2386-53-05g
25g
S118592十二烷基硫酸钠
Sodium dodecyl sulfate 离子对色谱级,≥99.0% (GC)151-21-310g
50g
S120540丙烷磺酸钠 一水合物
Sodium 1-propanesulfonate monohydrate 离子对谱级,≥99.0% 304672-01-3 10g
50g
S1212472-丙烷磺酸钠 一水合物
Sodium 2-propanesulfonate monohydrate
离子对谱级,≥99.0% 304851-99-810g
S1212491,2-乙烷基二磺酸钠
Sodium 1,2-ethanedisulfonate
离子对谱级,≥99.0% 5325-43-95g
S1212511-戊烷磺酸钠 一水合物
Sodium 1-pentanesulfonate monohydrate 离子对谱级,≥99.0% 207605-40-110g
50g
S121253癸烷基硫酸钠
Sodium decyl sulfate
离子对谱级,≥99.0% 142-87-010g
s121254辛基硫酸钠
odium octyl sulfate
离子对谱级,≥99.0% 142-31-410g
N1207472-萘磺酸钠
Sodium 2-naphthalenesulfonate
离子对谱级,≥99.0% 532-02-510g
常用有机溶剂的沸点、溶解性及毒性
初中化学化学除杂分离和提纯试题(有答案和解析)
初中化学化学除杂分离和提纯试题(有答案和解析) 一、中考化学除杂分离和提纯 1.如表中除去物质所含少量杂质的方法,错误的是() A.A B.B C.C D.D 【答案】C 【解析】 试题分析:A、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. B、碳酸钙高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. C、盐酸能与过量氢氧化钙溶液反应生成氯化钙和水,能除去杂质但引入了新的杂质氢氧化钙(过量的),不符合除杂原则,故选项所采取的方法错 误. D、氯化镁能与过量氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,再过滤、向滤液中加适量稀盐酸除去过量的氢氧化钠,至溶液pH=7,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.故选C. 考点:物质除杂或净化的探究;常见气体的检验与除杂方法;酸的化学性质;盐的化学性质. 2.为除去下列物质中的少量杂质(括号内为杂质),下列操作方法能达到目的的是
A.A B.B C.C D.D 【答案】A 【解析】 【分析】 【详解】 A、铜在空气中充分灼烧能产生氧化铜,而氧化铜不能反应,可以用于除杂;故选项正确; B、生石灰与水反应产氢氧化钙,氢氧化钙能与二氧化碳反应产生碳酸钙,不能用于除杂;故选项错误; C、硝酸钡能与硫酸钠反应产生硫酸钡沉淀和硝酸钠,引入新的杂质硝酸根离子,不能用于除杂;故选项错误; D、氧化钙能与水反应产生氢氧化钙,不能用于除杂;故选项错误; 故选:A。 3.下列除去杂质的方法错误的是 A.A B.B C.C D.D 【答案】A 【解析】
离子选择电极的应用
离子选择电极的应用 班级;2013应用化学(专转本)姓名:程楚楚学号:2013070499004 摘要:离子选择电极分析方法一类电化学传感体,由于离子选择性电极选择性好,灵敏度高及使用简便并且能直接测定液体试样,应用范围广,原则上可以制取各种离子的选择电极。且离子选择电极测量迅速,检验简便,不破坏溶液条件,不进行分离操作。离子选择电极在的电位对溶液中所给定的离子活度的对数呈线性关系,对某一定离子有特殊的选择性非常适合在食品中进行检验。,在药物检测中也经常被使用。 离子选择电极分析方法一类电化学传感体,是化学领域中的一种常用的分析手段。由于离子选择性电极选择性好,灵敏度高及使用简便并且能直接测定液体试样,使溶液的颜色和浊度一般不影响测试结果;对复杂样品无需预处理。所需仪器设备简单,操作方便,有利于连续与自动分,因此发展非常迅速,目前在愈来愈多的领域都有所应用,许多商品化的离子选择电极在临床分析、环保、空间探测、生命科学、自动化装置、食品和药物分析等多个领域得到广泛应用。本文我们主要谈一谈离子选择电极在食品与药品中的应用。 1.离子选择电极在食品中的应用 由于离子选择性电极的适应范围广,原则上可以制取各种离子的选择电极。且离子选择电极测量迅速,检验简便,不破坏溶液条件,不进行分离操作。非常适合在食品中进行检验。通常人们用离子选择电极测定食品中的钾、钙、铜、氟、铅等离子的测定。 1.1在钾离子中的应用 测定食品中钾离子的含量对于临床医学有重要,当血清中的浓度超过一定浓度时,心脏会停止跳动。因此准确滴测定食品总钾离子的含量具有重要意义。目前用流动注射与全固相钾离子选择性电极联用测定食品、疫血清样品中钾含量得到数据让大部分人满意,为测定钾离子含量的常用方法。 1.2在钙离子种的应用 钙是人体内极其重要的元素,从饮食中摄入钙质是人体获取钙的主要途径。目前,钙的测定方法有质谱法、发射光谱法、分光光度法、化学滴定法和电位滴定法。常量钙测定的经典方法为化学滴定法,方法成熟,操作简便,但是对于颜色较深及混浊的样品,终点难以观察,有一定的局限性。但以钙离子选择性电极为指示电极,甘汞电极为参比电极,EGTA标准溶液为滴定剂( 与钙离子形成络和物),用电位滴定法测定有色或混浊饮料中的钙含量,由电位突跃判断滴定终点,用二阶微商法计算EGTA标准溶液的消耗量,只需要突跃点前后四个数据即可。查阅一些相关的文献得到,许多专家在用离子选择电极测定钙离子含量的方面都得到了人满意的结果。[1] 1.3在铜离子中的应用 铜能参与酶的催化功能,使脂肪和磷酯氧化,使含糖的食品加速分解,铜也是有机体必需
离子选择性电极法测定水中氟离子
离子选择性电极法测定溶液中氟离子 一、实验目的 1、了解电位分析法的基本原理。 2、掌握电位分析法的操作过程。 3、掌握用标准曲线法测定水中微量氟离子的方法。 4、了解总离子强度调节液的意义和作用。 二、实验原理 一般氟测定最方便、灵敏的方法是氟离子选择电极。氟离子选择电极的敏感膜由LaF 3单晶片制成,为改善导电性能,晶体中还掺杂了少量0.1%~0.5% 的EuF 2和1%~5%的CaF 2。膜导电由离子半径较小、带电荷较少的晶体离子氟 离子来担任。Eu 2+、Ca 2+代替了晶格点阵中的La 3+,形成了较多空的氟离子点阵,降低了晶体膜的电阻。 将氟离子选择电极插入待测溶液中,待测离子可以吸附在膜表面,它与膜上相同离子交换,并通过扩散进入膜相。膜相中存在的晶体缺陷,产生的离子也可以扩散进入溶液相,这样在晶体膜与溶液界面上建立了双电层结构,产生相界电位,氟离子活度的变化符合能斯特方程: --=F a F RT K E lg 303.2 氟离子选择电极对氟离子有良好的选择性,一般阴离子,除OH -外,均不干扰电极对氟离子的响应。氟离子选择电极的适宜pH 范围为5-7。一般氟离子电极的测定范围为10-6~10-1mol /L 。水中氟离子浓度一般为10-5mol /L 。 在测定中为了将活度和浓度联系起来,必须控制离子强度,为此,应该加入惰性电解质(如KNO 3)。一般将含有惰性电解质的溶液称为总离子强度调节液 (total Ionic strength adjustment buffer ,TISAB)。对氟离子选择电极来说,它由KNO 3、柠檬酸三钠溶液组成。 用离子选择电极测定离子浓度有两种基本方法。方法一:标准曲线法。先测定已知离子浓度的标准溶液的电位E ,以电位E 对lgc 作一工作曲线,由测得的未知样品的电位值,在E-lgc 曲线上求出分析物的浓度。方法二:标准加人法。首先测定待分析物的电位E1,然后加人已知浓度的分析物,记录电位E2,通过能斯特方程,由电位E1和E2可以求出待分析物的浓度。本实验测定氟离子采用标准曲线法。 三、仪器与试剂 氟离子选择电极一支;饱和甘汞电极一支;恒温水浴锅一台。100mL 烧杯若干个,50mL 容量瓶若5个,25mL 移液管、10mL 移液管,1mL 和10mL 有分刻度的移液管各一支,100mL 容量瓶一个。 NaF(基准试剂);KNO 3(分析纯);柠檬酸三钠(分析纯);NaOH(分析纯)。 氟标准溶液0.5g/L :称取于120°C 干燥2小时并冷却的NaF 1.106g 溶于去离子水中,而后转移至1000 mL 容量瓶中,稀释至刻度,摇匀,保存在聚乙烯塑料瓶中备用。 氟标准溶液0.2g/L :移取0.5g/L 氟离子标准溶液20mL 稀释到50mL 。实验前随配随用,用完倒掉洗净容量瓶。 依照上述方法依次配制0.01g/L 、0.04g/L 的氟标准溶液。
(化学)初三化学化学除杂分离和提纯试题(有答案和解析)
(化学)初三化学化学除杂分离和提纯试题(有答案和解析) 一、中考化学除杂分离和提纯 1.下列除去杂质(在括号内)选用的试剂(在箭头右侧)不正确的是 A.CO2(CO)→CuO B.CaCl2溶液(HCl)→碳酸钙 C.NaCl(泥沙)→水 D.NaOH溶液(Na2CO3)→稀盐酸 【答案】D 【解析】 A、CO能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确. B、HCl能与碳酸钙反应生成氯化钙、水和二氧化碳,碳酸钙不溶于水,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确. C、氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的试剂正确. D、NaOH溶液和Na2CO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的试剂错误.故选D. 2.下列除去杂质的方法错误的是 A.A B.B C.C D.D 【答案】A 【解析】 【分析】 物质除杂时,可以根据物质性质,采用物理方法或化学方法,原则上选用的除杂试剂不能
与原有物质反应,反应后不能引入新的杂质. 【详解】 A、氢氧化钠容易与二氧化碳反应而不与一氧化碳反应,所以使用氢氧化钠不仅除不去一氧化碳,反而把二氧化碳吸收了,所以A不正确; B、将氮气和氧气的混合气体通过灼热的铜网,氧气会与铜反应,而氮气不会,所以能将氧气除掉,故B正确; C、氯化钙易溶于水,而碳酸钙不溶于水,加水溶解后再过滤,可以除去碳酸钙,将滤液蒸发即可得氯化钙,故C正确; D、硝酸中混有盐酸,使用的硝酸银溶液只与盐酸反应,反应后生成氯化银沉淀和硝酸,再经过滤操作除去氯化银沉淀即可得硝酸,故D正确, 故选A. 3.除去下列物质中的少量杂质( 括号内为杂质),所选的试剂不正确的是( ) A.CO(CO2) 足量澄清石水 B.N2 (O2) 足量木炭 C.CO2(CO) 足量氧化铜 D.CuO(C) 在空气中点燃 【答案】B 【解析】 【分析】 【详解】 A、澄清石灰水为氢氧化钙的水溶液,一氧化碳不与氢氧化钙反应,且不溶于水,而二氧化碳可与氢氧化钙反应,且能溶于水,因此通过澄清石灰水后,实现去除二氧化碳的目的,选项A正确; B、氮气与木炭不反应,而氧气少量,木炭足量,氧气与木炭反应生成一氧化碳,氮气中混有了一氧化碳,引入新的杂质,不能达到去除杂质气体的目的,选项B不正确; C、一氧化碳与氧化铜反应生成铜和二氧化碳,二氧化碳不参与反应,混合气体通过氧化铜后只有二氧化碳气体,达到去除一氧化碳的目的,选项C正确; D、氧化铜为固体,在空气中稳定存在,碳与氧气反应生成二氧化碳,变为气体,排放到空气中,剩余固体只有氧化铜,达到去除碳的目的,选项D正确。故选B。 【点睛】 去除杂质时,不仅保证原物质不被吸收,还要保证去除杂质时不得引入新的杂质,已达到去除杂质的目的。 4.除去下列物质中的少量杂质,所选试剂及操作不正确的是()
离子选择电极
三、离子选择电极(Membrane potential and ISE)和膜电位 1. 膜电位及其产生 膜电极(Membrane potential and ISE),具有敏感膜且能产生膜电位的电极。膜电位产生于被分隔两边不同成分的溶液,测量体系为: 参比电极1|溶液1|膜|溶液2|参比电极2 膜电极特点:仅对溶液中特定离子有选择性响应(离子选择性电极)。 膜电极的关键:选择膜的敏感元件。 敏感元件构成:特殊组分的玻璃、单晶、混晶、液膜、高分子功能膜及生物膜等。 膜电极组成的半电池,没有电极反应; 相界间没有发生电子交换过程。 表现为离子在相界上的扩散,造成双电层存在,产生界面电位差。该类主指离子选择性电极。?膜电位: = 膜内扩散电位和膜与电解质溶液形成的内外界面的Donnan电位的代数和。 膜电位=扩散电位(膜内) + Donnan电位(膜与溶液之间) (1)扩散电位:液液界面或固体膜内,因不同离子之间或离子相同而浓度不同而发生扩散即扩散电位。其中,液液界面之间产生的扩散电位也叫液接电位。 特点:这类扩散是自由扩散,正负离子可自由通过界面,没有强制性和选择性。 (2)Donnan电位: 选择性渗透膜或离子交换膜,它至少阻止一种离子从一个液相扩散至另一液相或与溶液中的离子发生交换。这样将使两相界面之间电荷分布不均匀——形成双电层——产生电位差——Donnan 电位。 这类扩散具强制性和选择性。 2. 离子选择性电极 ISE 原电极 晶体膜 均相膜如F-,Cl-,Cu2+ 非均相膜如硅橡胶膜 非晶体膜刚性基质如PH,PNa 流动载体带正电荷如NO3-,ClO4-,BF4- 带负电荷如Ca2+, Mg2+ 中性如K+ 敏化电极气敏电极如CO2, NH4+电极 生物电极如酶电极,生物组织电极
九年级化学化学除杂分离和提纯技巧(很有用)及练习题
九年级化学化学除杂分离和提纯技巧(很有用)及练习题 一、中考化学除杂分离和提纯 1.除去下列物质中混有的少量杂质所选试剂的操作方法正确的是() A.A B.B C.C D.D 【答案】D 【解析】 【分析】 【详解】 A、将气体通过足量NaOH溶液,NaOH能与HCl反应生成NaCl和水,氢氧化钠也能与二氧化碳反应生成碳酸钠和水,虽然除去了杂质,也除去了原物质,不符合题意; B、加入适量稀盐酸,氧化铜能与稀盐酸反应生成氯化铜和水,碳不与稀盐酸反应,过滤、洗涤、干燥可得碳,不但没有除去杂质,反而除去了原物质,不符合题意; C、加入适量K2CO3溶液,氯化钙能与碳酸钾反应生成碳酸钙和氯化钾,过滤,除去碳酸钙,虽然除去了杂质,但是引入了新的杂质氯化钾,不符合题意; D、加入适量AgNO3溶液,氯化铜能与硝酸银反应生成硝酸铜和氯化银,过滤,除去氯化银,可得硝酸铜,符合题意。 故选D。 【点睛】 除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。 2.除去下列各物质中混有的少量杂质,所用试剂和操作均正确的是
A.A B.B C.C D.D 【答案】B 【解析】 【分析】 【详解】 A、Ba(NO3)2溶液会和Na2SO4溶液发生反应,生成硫酸钡沉淀和硝酸钠,虽然过滤去除了硫酸钡沉淀,溶液中还有硝酸钠,不符合题意; B、通过足量的NaOH溶液可以去除HCl,通过浓硫酸可以去除水蒸气,进而得到纯净的 H2,操作正确,符合题意; C、CO在CO2中不能点燃,不符合题意; D、加入足量的稀盐酸不仅会和Fe2O3反应,还会和铁粉反应,不符合题意; 故选:B 3.下列除杂(括号内为杂质)选用的试剂或方法错误的是() A.Cu(CuO):加入足量的稀盐酸,过滤,洗涤、烘干 B.NaCl 溶液(HCl):加入过量碳酸钠,充分反应后过滤 C.CO2气体(CO):将气体通过灼热的氧化铜层后收集气体 D.NaCl(泥沙):加适量水充分溶解,过滤、蒸发结晶 【答案】B 【解析】 【分析】 【详解】 A、在金属活动性顺序里,铜位于氢之前,不与稀盐酸反应,氧化铜能与稀盐酸反应生成氯化铜和水,加入足量稀盐酸,过滤、洗涤、干燥可得铜,不符合题意; B、加入过量的碳酸钠,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,碳酸钠过量,虽然除去了杂质,但是引入了新的杂质碳酸钠,符合题意; C、将混合气体通过灼热的氧化铜,氧化铜能与一氧化碳在加热的条件下反应生成铜和二氧化碳,收集气体可得纯净的二氧化碳,不符合题意; D、氯化钠溶于水,泥沙不溶于水,加适量水充分溶解,过滤、蒸发结晶,可得氯化钠,不符合题意。 故选B。 【点睛】 除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
最新初中化学化学除杂分离和提纯技巧(很有用)及练习题
最新初中化学化学除杂分离和提纯技巧(很有用)及练习题 一、中考化学除杂分离和提纯 1.下列除去杂质(在括号内)选用的试剂(在箭头右侧)不正确的是 A.CO2(CO)→CuO B.CaCl2溶液(HCl)→碳酸钙 C.NaCl(泥沙)→水 D.NaOH溶液(Na2CO3)→稀盐酸 【答案】D 【解析】 A、CO能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确. B、HCl能与碳酸钙反应生成氯化钙、水和二氧化碳,碳酸钙不溶于水,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确. C、氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的试剂正确. D、NaOH溶液和Na2CO3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的试剂错误.故选D. 2.欲除去下列物质中的少量杂质,所用试剂及方法不正确的是() A.A B.B C.C D.D 【答案】C 【解析】 【分析】 【详解】 A、因为二氧化碳不与铜反应,氧气在加热条件下可以与铜反应,所以可以除掉氧气,故正确; B、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,再通过浓硫酸进行干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故正确;
C、铁粉能与稀盐酸反应生成氯化亚铁和氢气,铜不与稀盐酸反应,反而会把原物质除去,不符合除杂原则,故错误; D、碳酸钾能与适量氯化钙溶液反应生成碳酸钙沉淀和氯化钾,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故正确。 故选:C。 【点睛】 除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。 3.下列实验操作中(括号内为杂质)不能达到实验目的的是() A.A B.B C.C D.D 【答案】C 【解析】 【分析】 【详解】 A、浓氢氧化钠溶液可以去除氯化氢,再经过浓硫酸可以去除水蒸气,得到较为纯净的氢气,选项A不符合题意; B、碳酸钙不溶于水,氯化钙溶于水,溶解过滤后,将固体洗涤、干燥后就可以得到纯净的碳酸钙,滤液经过蒸发溶剂,得到氯化钙,达到分离的目的,选项B不符合题意; C、氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,加入盐酸除杂,杂质和主要物质都被反应掉,选项C符合题意; D、铜金属活动性强于银,所以银不能置换出硫酸铜中的铜,因此观察不到有红色固体析出,由此判断银的金属活动性弱于铜,选项D不符合题意。故选C。 【点睛】 去除杂质时,保证杂质被充分去除,同时不得引入新的杂质。 4.下列除杂质的方法正确的是()
【化学】中考化学化学除杂分离和提纯技巧(很有用)及练习题
【化学】中考化学化学除杂分离和提纯技巧(很有用)及练习题 一、中考化学除杂分离和提纯 1.稀硝酸中混有少量的硫酸,为了除去硫酸,可加入适量的物质是() A.Ba(NO3)2B.AgNO3C.NaCl D.CuO 【答案】A 【解析】 【分析】 除杂(提纯),是指除去杂质,同时被提纯物质不得改变。 【详解】 A、硫酸能与硝酸钡溶液反应生成硫酸钡沉淀和硝酸,能除去杂质且没有引入新的杂质,符合除杂原则,故A正确; B、硫酸能与硝酸银溶液反应生成微溶于水的硫酸银沉淀和硝酸,能除去杂质但引入了新的杂质硫酸银(微溶于水),不符合除杂原则,故B不正确; C、硫酸与氯化钠不反应,加入氯化钠,引入了氯化钠杂质,不符合除杂原则,故C不正确; D、稀硝酸和硫酸均能与氧化铜反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故D不正确。故选A。 【点睛】 除杂条件:加入的试剂只能与杂质反应,不能与原物质反应;反应后不能引入新的杂质。 2.下列除去杂质所选择的试剂或方法中(括号里为杂质),正确的是() A.CO2(CO):点燃 B.CO2(HCl):NaOH溶液 C.NaCl(Na2CO3):H2SO4 D.N2(O2):通过灼热的铜 【答案】D 【解析】 【分析】 【详解】 A、除去CO2中少量的CO,点燃是无法除去一氧化碳的,因为混合气体中没有氧气来支持燃烧,A不正确; B、除去CO2中少量的HCl气体,用NaOH溶液来吸收,虽然能把氯化氢气体除去,但也把二氧化碳除去了,B不正确; C、除去NaCl中少量的Na2CO3,滴加适量的H2SO4,碳酸钠与硫酸反应,虽然除去了碳酸钠,但又引进了新的物质硫酸钠,C不正确; D、除去N2中少量O2,把混合气体通过灼热的铜,氧气能与铜反应生成氧化铜,从而除去了氧气,剩余氮气,D正确。故选D。 【点睛】 用化学方法进混合物的除杂时,把杂质转化为与主要物质不同状态的物质即可除去,但又
初三化学化学除杂分离和提纯及其解题技巧及练习题(含答案)
初三化学化学除杂分离和提纯及其解题技巧及练习题(含答案) 一、中考化学除杂分离和提纯 1.下列实验方案中,能达到实验目的的是 A.A B.B C.C D.D 【答案】B 【解析】 A、分离碳酸钠和氢氧化钠的混合物时加入氢氧化钙,氢氧化钙能与碳酸钠反应生成氢氧化钠和碳酸钙,过滤可除掉碳酸钙,此过程除掉了原物质中的碳酸钠,不能起到分离碳酸钠与氢氧化钠的目的; B、除去氯化钠固体中的少量碳酸钠时加适量的稀盐酸,稀盐酸会与碳酸钠反应生成氯化钠水和二氧化碳,二氧化碳从溶液中跑出,剩余的溶液蒸发结晶即可得较纯净的氯化钠; C、该方式是利用一氧化碳还原氧化铁生成二氧化碳的原理来验证一氧化碳的存在,所以实验开始时一定要先除掉混合物中的原有二氧化碳,以防止对实验的干扰; D、酚酞试液在酸性和中性溶液中均不变色,所以无法区分氯化钠溶液(显中性)和稀盐酸(显酸性),只能鉴定出能使其变红的碱性氢氧化钠的溶液。 2.下列除去杂质的试剂和方法可行的是
A.A B.B C.C D.D 【答案】B 【解析】 试题分析:A、铁粉与硝酸银反应,生成银和硝酸亚铁,引来新的杂质,错误;B、硫酸钠与适量氯化钡反应,生成硫酸钡和氯化钠,正确;C、CO与澄清石灰水不发生反应,错误;D、氧化铜与氧气不发生化学反应,错误。故选B 考点:除杂质问题。 3.除去下列各物质中混有的少量杂质,所用试剂和操作方法均正确的是() A.A B.B C.C D.D 【答案】C 【解析】 【分析】 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。 【详解】 A、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。 B、Na2CO3能与过量的CaCl2溶液反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钙(过量的),不符合除杂原则,故选项所采取的方法错误。 C、CuO能与稀硫酸反应生成硫酸铜和水,铜不与稀硫酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。 D、H2SO4能与适量BaCl2溶液反应生成硫酸钡沉淀和盐酸,能除去杂质但引入了新的杂质盐酸,不符合除杂原则,故选项所采取的方法错误。 故选:C。
【化学】化学化学除杂分离和提纯练习题及答案
【化学】化学化学除杂分离和提纯练习题及答案 一、中考化学除杂分离和提纯 1.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是( ) 物质杂质试剂操作方法 A K2CO3溶液K2SO4BaCO3加适量BaCO3,粉末,充分反应后,过滤 B MgCl2溶液HCl过量Mg(OH)2过滤 C CO2水蒸气足量NaOH固体干燥 D CaCO3CaO无高温煅烧 A.A B.B C.C D.D 【答案】B 【解析】 【分析】 除杂条件是不引入新的杂质,加入的物质不和原物质反应。 【详解】 A、碳酸钡为沉淀,不能与硫酸钾发生反应,故A不正确; B、加入过量氢氧化镁,氢氧化镁能与盐酸反应生成氯化镁和水,再过滤掉剩余氢氧化镁得 到氯化镁溶液,故B正确; C、氢氧化钠与原物质二氧化碳能发生反应,故C不正确; D、高温燃烧时原物质碳酸钙发生分解反应,故D不正确。故选B。 【点睛】 物质除杂时选择的药品要只与杂质发生反应,不与原物质反应,且在除杂时不能引入新杂 质。 2.下列实验操作中(括号内为杂质)不能达到实验目的的是() 选项物质目的主要实验操作 A H2(HCl)气体除杂先通入浓氢氧化钠溶液,再通过浓硫酸干燥 B CaCO3固体(CaCl2固体)分离溶解、过滤、洗涤、干燥、蒸发 C NaOH(Na2CO3)溶液除杂滴加适量的稀盐酸,充分反应 D Cu(Ag)比较活动性银片浸入硫酸铜溶液中,观察现象
A.A B.B C.C D.D 【答案】C 【解析】 【分析】 【详解】 A、浓氢氧化钠溶液可以去除氯化氢,再经过浓硫酸可以去除水蒸气,得到较为纯净的氢气,选项A不符合题意; B、碳酸钙不溶于水,氯化钙溶于水,溶解过滤后,将固体洗涤、干燥后就可以得到纯净的碳酸钙,滤液经过蒸发溶剂,得到氯化钙,达到分离的目的,选项B不符合题意; C、氢氧化钠和盐酸反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,加入盐酸除杂,杂质和主要物质都被反应掉,选项C符合题意; D、铜金属活动性强于银,所以银不能置换出硫酸铜中的铜,因此观察不到有红色固体析出,由此判断银的金属活动性弱于铜,选项D不符合题意。故选C。 【点睛】 去除杂质时,保证杂质被充分去除,同时不得引入新的杂质。 3.除去CO气体中少量CO2,可采用的方法是() A.把混合气体点燃 B.把混合气体通过水中 C.把混合气体通过灼热的CuO粉末 D.把混合气体通过足量的澄清石灰水 【答案】D 【解析】 【分析】 【详解】 A、一氧化碳能与氧气反应生成二氧化碳,反而会把原物质除去,不符合除杂原则,故选项错误。 B、二氧化碳能与水反应生成碳酸,但是碳酸不稳定会分解成二氧化碳和水,不能彻底除去杂质,故选项出错误。 C、一氧化碳能与灼热的氧化铜反应生成铜和二氧化碳,二氧化碳不能与灼热的氧化铜反应,反而会把原物质除去,不符合除杂原则,故选项错误。 D、CO2能与足量澄清石灰水反应生成碳酸钙和水,CO不与足量澄清石灰水反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项正确。 故选:D。 【点睛】 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质
离子选择电极法测定氟离子
实验报告 实验课程:仪器分析 学生姓名:崔清玥 学号: 专业班级:化学(创新)1301 实验名称:离子选择电极法测定氟离子
一.实验目的 1.了解氟离子选择电极的构造及测定自来水中氟离子的实验条件; 2.掌握离子计的使用方法。 二.实验原理 氟离子选择电极使目前最成熟的一种离子选择电极。将氟化镧单晶封在塑料管的一端,管内装L NaF和L NaCl溶液,以Ag-AgCl电极为参比电极,构成氟离子选择电极。用氟离子选择电极测定水样时,以氟离子选择电极作指示电极,以饱和甘汞电极作为参比电极,组成的测量电池为: 氟离子选择电极︱试液‖SCE 如果忽略液接电位,电池的电动势为: 即电池的电动势与试液中氟离子活度的对数成正比,氟离子选择电极一般在1~10-6范围符合能斯特方程式。 1.氟离子选择电极具有较好的选择性 阴离子: : OH- LaF3 + 3OH-=La(OH)3 + 3F- 阳离子: Fe3+、Al3+、Sn(Ⅳ) ( 易与F-形成稳定配位离子) 2.氟离子选择电极法测定的是溶液中离子的活度,因此,必须加入大量支持 电解质,如NaCl控制试液的离子强度。 3.用总离子强度调节缓冲液控制试液pH和离子强度以及消除干扰。通常用 乙酸缓冲溶液控制溶液的pH。用柠檬酸钠进行掩蔽。 三、仪器与试剂 离子计或pH计;氟离子选择电极;饱和甘汞电极;电磁搅拌器;容量瓶(50mL 7只);烧杯(100 mL 6个);10 mL移液管(2个);F-标准溶液mol/L);离子强度调节缓冲液(TISAB) 四、实验步骤 1.氟离子选择电极的准备: 氟离子选择电极在使用前,应在含10-4-1 F 或更低浓度的F-溶液中浸泡(活化)约30 min。 2.线性范围及能斯特斜率的测量:
高中化学除杂总结大全
除杂问题专题除杂题除杂选择试剂的原则是:不增、不减、不繁。 需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。 (2)除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。(3)除杂装置与气体干燥相同。 典型例题 (1)H2、CO2的化学性质。 (2)SO42-的特性。 评析:①利用H2、CO2的性质不同,加以鉴别。 如H2有还原性而CO2没有,将气体分别通入灼热的CuO加以鉴别。 CuO+H2Cu+H2O 或利用H2有可燃性而CO2不燃烧也不支持燃烧,将气体分别点燃加以鉴别。 或利用CO2的水溶液显酸性而H2难溶于水,将气体分别通入紫色石蕊试液加以鉴别。CO2使紫色石蕊试液变红而H2不能。 ②属于除杂质问题,加入试剂或选用方法要符合三个原则:(1)试剂与杂质反应,且使杂质转化为难溶物质或气体而分离掉;(2)在除杂质过程中原物质的
质量不减少;(3)不能引入新杂质。 在混合物中加入BaC l2,与H2SO4生成白色沉淀,过滤后将其除去,同时生成物是HC l,没有引入新的离子。 答案: 2.下列各选项中的杂质,欲用括号内物质除去,其中能达到目的的是( ) A CO中混有少量CO2 (澄清石灰水) B CO2中混有少量氯化氢气体 (NaOH溶液) C O2中混有少量H2 (灼热氧化铜) D N2中混有少量O2 (白磷) 分析: A 澄清石灰水能吸收CO2,不能吸收CO ,可到达目的. B CO2与HCl都和NaOH反应,故不能达到目的. C O2和H2混合二者体积比不知道,通过灼热氧化铜可能爆炸,不能达到目的. D 白磷自燃且生成物为固体,除去O2,能达到目的. 回答除杂问题,一定要全面分析,既要除去杂质,又要使主要成分(被净化的气体)不变质。 答案: A D 3.实验室配制氯化钠溶液,但氯化钠晶体里混入了少量硫酸钠和碳酸氢铵,设计一组实验,配制不含杂质的氯化钠溶液。 提示:本题为除杂问题的实验设计,这样的问题一般要遵循“甲中有乙,加丙去乙,可产生甲,但不能产生丁”的原则。 答案:将不纯的氯化钠晶体溶于适量的蒸馏水中,滴加稍过量的Ba(OH)2溶液,使SO42-及CO32-(原HCO3-与OH-反应后生成)完全沉淀。再续加稍过量的Na2CO3溶液,以除去过量的Ba2+。过滤,保留滤液在滤液中,滴加稀盐酸至溶液呈中性(用PH 试纸控制),得不含杂质的氯化钠溶液。 分析:为了除去杂质NH4HCO3和Na2SO4,一般可提出两个实验方案:第一方案是利用NH4HCO3受热(35℃以上)易分解成气态物质的特性,先加热氯化钠晶体除掉NH4HCO3,再加Ba2+除掉SO42-;第二方案是用Ba(OH)2同时除掉两种杂质,这种方法简便,“一举两得”,故优先选用。 具体操作步骤如下:①将不纯的氯化钠晶体溶于适量的蒸馏水中,滴加稍过量的Ba(OH)2溶液,使SO42-及CO32-(原HCO3-与OH-反应后生成)完全沉淀。 检验Ba(OH)2是否过量的方法:取少量滤液,滴几滴Na2SO4或稀H2SO4,如产生白色浑浊或沉淀,则表示Ba(OH)2已过量。 ②再续加稍过量的Na2CO3溶液,以除去过量的Ba2+离子。过滤,保留滤液。 检验Na2CO3是否过量的方法,取少量滤液,滴加几滴HCl,如产生气泡则表示Na2CO3已过量。
(化学)中考化学化学除杂分离和提纯专项练习及解析
(化学)中考化学化学除杂分离和提纯专项练习及解析 一、中考化学除杂分离和提纯 1.除去下列物质中的杂质,选用的方法和试剂正确的是 A.A B.B C.C D.D 【答案】A 【解析】 【详解】 A、碳酸钠溶于水,碳酸钙不溶于水,故加足量水过滤除去碳酸钙,再蒸发得到碳酸钠,符合题意; B、二氧化碳不燃烧也不支持燃烧,氧气不是可燃性气体,混合气体不能被点燃,不符合题意; C、铁能与盐酸反应生成氯化亚铁和氢气,氧化铁能与盐酸反应生成氯化铁和水,不但除去了氧化铁,还除去了原物质,不符合题意; D、铁与盐酸反应生成氯化亚铁和氢气,虽然除去了盐酸,但是引入了新的杂质氯化亚铁,不符合题意。 故选A。 【点睛】 除杂选择试剂的原则是:不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。 2.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是()
A.A B.B C.C D.D 【答案】B 【解析】 【分析】 【详解】 A、将混合气体通过足量的铜网,铜与氮气不反应,铜与氧气能在加热的条件下反应生成氧化铜,但是常温下铜与氧气不反应,常温下,通过足量的铜网,不能除去混合气体中的氧气,不符合题意; B、氯化钾能溶于水,二氧化锰不溶于水,加水溶解、过滤,除去二氧化锰,蒸发、结晶得到氯化钾,符合题意; C、活性炭具有吸附性,能吸附水中的色素和异味,故加活性炭可除去水中的臭味,过滤,除去活性炭,才能得到水,需加过滤步骤,不符合题意; D、将混合气体通过适量的氢氧化钠溶液,氢氧化钠与二氧化碳反应生成碳酸钠和水,虽然除去了杂质二氧化碳,但是一氧化碳通过氢氧化钠溶液会携带上水蒸气,引入了新的杂质水蒸气,不符合题意。 故选B。 3.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是() A.A B.B C.C D.D 【答案】A 【解析】 【分析】 【详解】 A、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。 B、氢氧化钠固体具有吸水性,但能与二氧化碳反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。 C、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法错误。
初中化学除杂题的常用方法
初中化学除杂题的常用方法 除杂即去除物质中的杂质。初中化学物质除杂的原则是:不引入新的杂质(包括水蒸气等),不能将原有的物质反映掉,除杂选择试剂的原则是:不增、不减、不繁。 1、过滤法 原理:把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。如:氯化钙中含有少量碳酸钙杂质,先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去杂质碳酸钙,然后蒸发滤液,得到固体氯化钙。如果要获得杂质碳酸钙,可洗涤烘干。 2、结晶法 原理:几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度或溶解度随温度的变化趋势不同,可用结晶的方法分离。例如:除去固体硝酸钾中混有的氯化钠杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氨化钠溶液分开。为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。 化学方法
原理 1、加入的试剂只与杂质反应,不与原物反应。 2、反应后不能带入新的杂质。 3、反应后恢复原物状态。 4、操作方法简便易行。 5、有时题目中有特殊要求(不外加指示剂。为了控制除杂液体加入的量,必须有明显现象) 1、沉淀法 原理:使混合物中的杂质与适当试剂反应,生成沉淀通过过滤而除去。 2、化气法 原理:将混合物中的杂质与适当试剂反应变成气体而除去。 如:硝酸钠固体中含有少量碳酸钠杂质,可将混合物加水溶解,再加入适量稀硝酸溶液,硝酸与碳酸钠反应生成硝酸钠、水和二氧化碳,再蒸发滤液,获得硝酸钠固体。 3、置换法 原理:将混合物中的杂质与适量试剂通过发生置换反应而除去。如:硫酸锌固体中含有少量硫酸铜杂质,可将混合物溶解之后,加人适量锌粉,再过滤除去被置换出来的铜,蒸发滤液获得硫酸铜固体。 4、吸收法 原理:两种以上混合气体中的杂质被某种溶剂或溶液吸收,而要提纯的气体不能被吸收时,可用此方法。
第十五章 电位分析及离子选择性电极分析法
第十五章电位分析及离子选择性电极分析法 15-1 概述 电位分析法(potentiometry):是以测量原电池的电动势为基础,根据电动势与溶液中某种离子的活度(或浓度)之间的定量关系(能斯特方程)来测定待测物质活度(或浓度)的一种电化学分析方法。它是以待测是液作为化学电池的电解质溶液,于其中插入两支电极,一支是电极电位随试液中待测离子的活度(或浓度)的变化而变化,用以指示待测离子的活度(或浓度)的指示电极(一般做负极);另一支是在一定温度下电极电位基本不变,不随试液中待测离子的活度(或浓度)的变化而变化的参比电极(常作正极),通过测量该电池的电动势来确定待测物质的含量。 根据原理不同可分为直接电位法和电位滴定法。 1 直接电位法(direct potentiometry) :是将电极插入被测液中构成原电池,根据原电池的电动势与被测离子活度间的函数关系直接测定离子活度的方法。 2 电位滴定法(potentiometric titration):是借助测量滴定过程中电池电动势的突变来确定滴定终点,再由滴定终点所消耗的标准溶液的体积和浓度,根据反应计量关系对待测物质进行定量的方法。 电位分析及离子选择性电极分析法具有选择性好、灵敏度高(10-5~10-8mol/L,微量分析)、仪器设备简单、操作方便、分析速度快、不破坏试液等优点。广泛应用于多种领域。 15-2 离子选择性电极及其主要性能参数 离子选择性电极是电位分析法中应用最广泛的指示电极。它属于薄膜电极,对溶液中特定离子具有选择性响应。 一电极的基本构造 是由对特定离子具有选择性响应的薄膜(敏感膜或传感膜)、内参 比溶液、内参比电极、导线和电极杆等部件构成,又称为膜电极。 1 敏感膜:是电极的关键部件。将内侧的内参比溶液和外侧的待测溶液 分开,对电极电位的响应、选择性、稳定性等起着决定作用。 2 内参比电极:一般为Ag-AgCl电极 3 内参比溶液:由用以恒定内参比电极电位的Cl-和能被敏感膜选择性响应的特定离子组成。二膜电位 1 膜电位 m:指横跨敏感膜两侧溶液之间产生的电位差。 产生原理:是溶液中离子与电极敏感膜上的离子发生离子交换作用的结果。当敏感膜两侧分
初三化学化学除杂分离和提纯试题(有答案和解析)
初三化学化学除杂分离和提纯试题(有答案和解析) 一、中考化学除杂分离和提纯 1.除去下列物质中的少量杂质,所选用的试剂和操作方法都正确的是() A.A B.B C.C D.D 【答案】B 【解析】 【分析】 【详解】 A、将混合气体通过足量的铜网,铜与氮气不反应,铜与氧气能在加热的条件下反应生成氧化铜,但是常温下铜与氧气不反应,常温下,通过足量的铜网,不能除去混合气体中的氧气,不符合题意; B、氯化钾能溶于水,二氧化锰不溶于水,加水溶解、过滤,除去二氧化锰,蒸发、结晶得到氯化钾,符合题意; C、活性炭具有吸附性,能吸附水中的色素和异味,故加活性炭可除去水中的臭味,过滤,除去活性炭,才能得到水,需加过滤步骤,不符合题意; D、将混合气体通过适量的氢氧化钠溶液,氢氧化钠与二氧化碳反应生成碳酸钠和水,虽然除去了杂质二氧化碳,但是一氧化碳通过氢氧化钠溶液会携带上水蒸气,引入了新的杂质水蒸气,不符合题意。 故选B。 2.除去CO气体中少量CO2,可采用的方法是() A.把混合气体点燃 B.把混合气体通过水中 C.把混合气体通过灼热的CuO粉末 D.把混合气体通过足量的澄清石灰水 【答案】D 【解析】 【分析】 【详解】
A、一氧化碳能与氧气反应生成二氧化碳,反而会把原物质除去,不符合除杂原则,故选项错误。 B、二氧化碳能与水反应生成碳酸,但是碳酸不稳定会分解成二氧化碳和水,不能彻底除去杂质,故选项出错误。 C、一氧化碳能与灼热的氧化铜反应生成铜和二氧化碳,二氧化碳不能与灼热的氧化铜反应,反而会把原物质除去,不符合除杂原则,故选项错误。 D、CO2能与足量澄清石灰水反应生成碳酸钙和水,CO不与足量澄清石灰水反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项正确。 故选:D。 【点睛】 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质. 3.为除去粗盐中的泥沙、Ca2+、Mg2+、SO42-等杂质,可将粗盐溶于水,再进行下列五步操作:①过滤②加过量的氢氧化钠溶液③加稍过量的盐酸④加过量的碳酸钠溶液⑤加过量的氯化钡溶液⑥蒸发结晶。正确的操作顺序是() A.④②⑤③①⑥B.②④⑤①③⑥C.②⑤④①③⑥D.⑤④②③①⑥【答案】C 【解析】 【详解】 镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,进行过滤,再加入稍过量盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后蒸发结晶,所以正确的顺序为:②⑤④①③⑥或⑤②④①③⑥。 故选:C。 【点睛】 根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。 4.除去下列物质中少量杂质(括号内为杂质),所用除去杂质的方法正确的是() 选项待提纯的物质除去杂质的方法 A FeSO4溶液(CuSO4)加入适量Zn粉,过滤 B KCl( MnO2)加水溶解、过滤、洗涤、干燥
电位分析习题大学分析化学习题+课后答案
电位分析法?习题 一、选择题 1.下列参量中,不属于电分析化学方法所测量的是(???) A?电动势B?电流???C?电容??D?电量 2.下列方法中不属于电化学分析方法的是(???)? A?电位分析法????B?伏安法???C?库仑分析法???D?电子能谱 3.区分原电池正极和负极的根据是(???) A?电极电位??B?电极材料???C?电极反应????D?离子浓度 4.区分电解池阴极和阳极的根据是(???) A?电极电位???B?电极材料???C?电极反应???D?离子浓度 5.下列不符合作为一个参比电极的条件的是(?????) A?电位的稳定性??B?固体电极??C?重现性好??D?可逆性好 6.甘汞电极是常用参比电极,它的电极电位取决于(????) A?温度???B?氯离子的活度???C?主体溶液的浓度???D?K+的浓度 7.下列哪项不是玻璃电极的组成部分?(????) A?Ag-AgCl电极???B?一定浓度的HCl溶液 C?饱和KCl溶液????D?玻璃管 8.测定溶液pH值时,常用的指示电极是:(????)? A?氢电极???B?铂电极???C?氢醌电极???D?pH玻璃电极 9.玻璃电极在使用前,需在去离子水中浸泡24小时以上,其目的是:(????) A?清除不对称电位???B?清除液接电位??? C?清洗电极?????????D?使不对称电位处于稳定 10.晶体膜离子选择电极的检出限取决于(????) A?响应离子在溶液中的迁移速度????B?膜物质在水中的溶解度 C?响应离子的活度系数????????????D?晶体膜的厚度 11.氟离子选择电极测定溶液中F-离子的含量时,主要的干扰离子是(????) A?Cl-??????B?Br-?????C?OH-???????D?NO3- 12.实验测定溶液pH值时,都是用标准缓冲溶液来校正电极,其目的是消除何种的影响。 A?不对称电位????B?液接电位????C?温度?????D?不对称电位和液接电位 13.pH玻璃电极产生的不对称电位来源于(?????) A内外玻璃膜表面特性不同???????????B内外溶液中H+浓度不同 C内外溶液的H+活度系数不同???D内外参比电极不一样 14.用离子选择电极标准加入法进行定量分析时,对加入标准溶液的要求为(????) A体积要大,其浓度要高??????B体积要小,其浓度要低 C体积要大,其浓度要低???????D体积要小,其浓度要高 15.离子选择电极的电位选择性系数可用于???????(?????) A估计电极的检测限??????????B估计共存离子的干扰程度 C校正方法误差?????????????????D计算电极的响应斜率 16.用氯化银晶体膜离子选择电极测定氯离子时,如以饱和甘汞电极作为参比电极,应选用的盐桥为:?????????????????(?????)
