通用引物
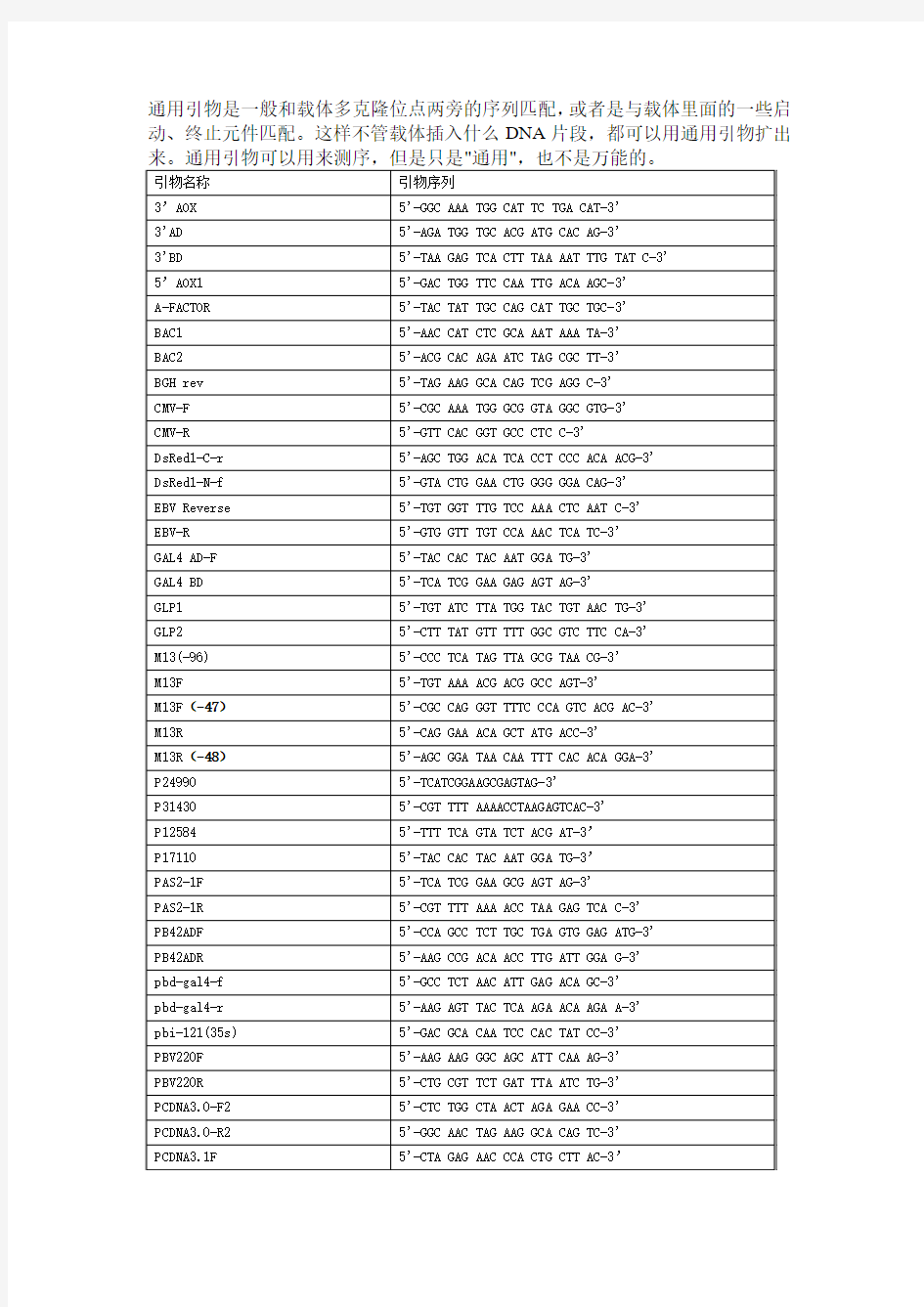
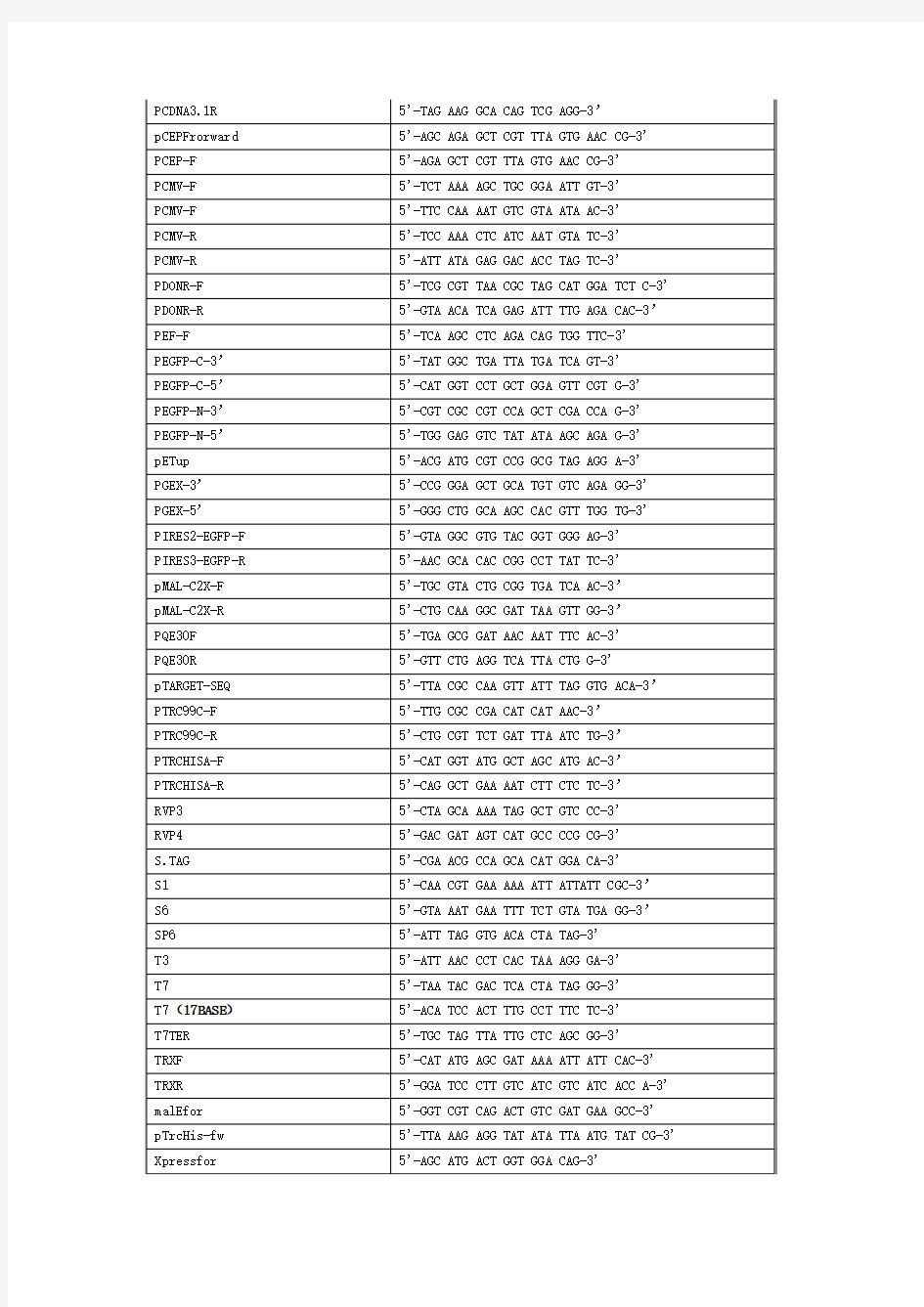
通用引物是一般和载体多克隆位点两旁的序列匹配,或者是与载体里面的一些启动、终止元件匹配。这样不管载体插入什么DNA片段,都可以用通用引物扩出
分子生物学 常用引物序列
日常备库引物序列(5'-3') 1492R GGTTACCTTGTTACGACTT 27F\8F AGAGTTTGATCCTGGCTCA 35S GACGCACAATCCCACTATCC 3'AD AGATGGTGCACGATGCACAG 3'AOX\AOX1rev GGCAAATGGCATTCTGACAT 3'BD TAAGAGTCACTTTAAAATTTGTATAC 5'AD\GAL4AD\P17110 TACCACTACAATGGATGATG 5'AOX\AOX1for GACTGGTTCCAATTGACAAGC 5'BD\GAL4-BD-Cfor TCATCGGAAGAGAGTAG 96gIII\M13-96 CCCTCATAGTTAGCGTAACG a-FACTOR\Alphafor TACTATTGCCAGCATTGCTGC BAC1 AACCATCTCGCAAATAAATA BAC2 ACGCACAGAATCTAGCGCTT BGH\pCDNA3.1R TAGAAGGCACAGTCGAGG CMV-24 TTAGGACAAGGCTGGTGG CMV-30 ATAACCCCGCCCCGTTG CMV-F\CMV-Profor CGCAAATGGGCGGTAGGCGTG\ATGGGCGGTAGGCGT G CMV-R TCGTTGGGCGGTCAGC DuetDOWN1 GATTATGCGGCCGTGTACAA DuetUP1 GATCTCGACGCTCTCCCT DuetUP2 TTGTACACGGCCGCATAATC EBVrev GTGGTTTGTCCAAACTCATC EGFP-Cfor AGCACCCAGTCCGCCCTGAGC EGFP-Nrev CGTCGCCGTCCAGCTC GAL1-Profor AACATTTTCGGTTTGTATTACTTC GLP1 TGTATCTTATGGTACTGTAACTG GLP2 CTTTATGTTTTTGGCGTCTTCCA
DNA合成常见问题解答
DNA合成常见问题解答 1.DNA合成粗产物中含有什么杂质 DNA合成仪合成的粗产物经过浓氨水氨解以后,其中除了含有所需的目的DNA片段(n)以外,还含有合成反应过程中产生的目的片段短的失败片段(n-1,n-2,…)以及脱保护基团产生的铵盐。需要通过纯化去除短片段、通过脱盐去除盐分。 2.如何进行合成产物的纯化 目前公认和大多采用的DNA粗产物后处理方式有4种: A) C18柱脱盐,这是一种活性炭柱子,有人称其为简易反相柱,它对DNA有特异性的吸附,可以被有机溶解洗脱,但不会被水洗脱,所以能有效地去除盐分。但是它不能有效去除比目的片段短的小片段。实际上,它是一种脱盐的作用。这种方法处理的产物中虽然含有比目的片段少5' 端一个或两个或多个碱基的产物,却一般不会对普通PCR反应产生影响。但是对于需要用于测序、用于克隆的引物不能使用这个级别,以免后患无穷。 B) OPC柱纯化,OPC柱中装有对Dmt具有亲和力的树脂,合成DNA片段时保留5' 端最后一个碱基上的Dmt,所有合成产物吸附在OPC柱上以后,用稀的有机溶剂洗柱,带有Dmt 的片段吸附能力强,不易被洗脱,不带有Dmt的片段吸附能力弱, 被洗脱。然后用三氟乙酸TFA或三氯乙酸TCA脱去Dmt基团,再用浓一点的有机溶剂洗脱DNA这种方法的优点是快速,简易。但是其专一性吸附Dmt能力有限, 不免仍然有短片段带入的可能,而且负载量小。特别是对长于25 碱基以上的片段纯化效果不好。 C) HPLC纯化,这是国外厂家常常使用的办法。它是依据不同大小的片段带有的净 电荷多少来分离产物的。合成粗产物中不同长度的DNA片段决定了它带有不同的 净电荷,较长的片段带有高电荷比带电荷低的短片段在离子交换柱中流动得慢。 先将粗产物检测主峰位置,再增加加样量,回收主峰位置的部分。它的优点是自动化程度高、省人
引物设计基本方法
Primer 5.0搜索引物: 1.Primer Length我常设置在18-30bp,短了特异性不好,长了没有必要。当然有特殊要求的除外,如加个酶切位点什么的。 2.PCR Product size最好是100-500bp之间,小于100bp的PCR产物琼脂糖凝胶电泳出来,条带很模糊,不好看。至于上限倒也不必要求苛刻。 3.Search parameters还是选Manual吧,Search stringency应选High,GC含量一般是40-60%。其它参数默认就可以了。 4.搜索出来的引物,按Rating排序,逐个送Oligo软件里评估。当然,搜索出的引物,其扩增产物很短,你可以不选择它,或是引物3端≥2个A或T,或引物内部连续的G或C太多,或引物3端≥2个G或C,这样的引物应作为次选,没得选了就选它。对于这样的引物,如果其它各项指标还可以,我喜欢在引物末端去掉一个不满意的或加上一个碱基,看看引物的评估参数有没有变好点。 Oligo 6.0评估引物: 1.在analyze里,Duplex Formation不管是上游引物、下游引物还是上下游引物之间,The most stable 3’-Dimer绝对值应小于4.5kcal/mol, The most stable Dimer overall绝对值一般应小于多少kcal/mol跟PCR退火温度有关,我几次实验感觉在PCR退火温度在65°的时候,The most stable Dimer ove rall 6.7kcal/mol没有问题。 2.Hairpin Formation根据黄金法则 3.False priming sites: Primer的priming efficiency应该是错配地方的4倍左右,更多当然更好。 4.在PCR栏,个人感觉其所显示的optimal annealing temperature数值值得参考。在PCR摸索条件的时候,退火温度为其数值加减2的范围就可以了。 5.Internal stability很重要:我们希望引物的内部稳定性是中间高、两边低的弧形,最起码保证3端不要过于稳定。下图1引物3端过于稳定,很容易导致不适当扩增。△G参照黄金法则,这其实很好理解:把一滴水放到大海里,这滴水就会不停的扩散分布,扩散的越厉害越稳定,所以△G绝对值越大结构越稳定。 最后说一句,敢于尝试就会成功。 第二贴 --科室工作很多,小医生了,没有办法,所以肯怕不能满足很多战友的要求(qq聊或帮助设计),在此表示抱歉。就楼上的问题我试着回答一下,不一定正确,供参考吧。 --1、两个评价系统不一样,个人感觉oligo评价引物好点,primer出来的引物,我一般按效率排序,再结合退火温度和引物长度,选择引物到oligo测试。这是初步的选择,其实引物到了oligo里,退火温度也不一样。 --2、3端的二聚体应该避免,这个要看你的退火温度决定,一个50°的退火温度肯定和65°对二聚体的影响不一样了,一般来讲尽量控制在-4.5kcal/mol以下(个人观点,很多东西真得还是需要自己摸索)。 --3、个人感觉3端有A无A影响不大,3端有T的没有经验。有T是不是一定不行,个人感觉不见得。软件是评估,法则也不是没有例外,不是1+1=2那么确定。 --4、错配和二聚体谁轻谁重,个人觉得“到致命的程度”谁都重要,我也说不好。我设计的时候,尽量两个都不得罪。 --5、GC含量并非不重要,它直接影响引物各端稳定性,3端来两个G或C,稳定性就上去了,粘在模板上很牢。所以我设计的时候,尽量避免这样的情况出现。 谈一下我学这个引物设计的过程吧:
PCR常见问题分析报告及对策
PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物 现象:正对照有条带,而样品则无 原因: 1.模板:含有抑制物,含量低 2.Buffer对样品不合适 3.引物设计不当或者发生降解 4.反应条件:退火温度太高,延伸时间太短 对策: 1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量 2.更换Buffer或调整浓度 3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物 4.降低退火温度、延长延伸时间 问题2:非特异性扩增 现象:条带与预计的大小不一致或者非特异性扩增带 原因: 1.引物特异性差 2.模板或引物浓度过高 3.酶量过多 4.Mg2+浓度偏高 5.退火温度偏低
6.循环次数过多 对策: 1.重新设计引物或者使用巢式PCR 2.适当降低模板或引物浓度 3.适当减少酶量 4.降低镁离子浓度 5.适当提高退火温度或使用二阶段温度法 6.减少循环次数 问题3:拖尾 现象:产物在凝胶上呈Smear状态。 原因: 1.模板不纯 2.Buffer不合适 3.退火温度偏低 4.酶量过多 5.dNTP、Mg 2+浓度偏高 6.循环次数过多 对策: 1.纯化模板 2.更换Buffer 3.适当提高退火温度 4.适量用酶 5.适当降低dNTP和镁离子的浓度 6.减少循环次数 问题4:假阳性 现象:空白对照出现目的扩增产物 原因: 靶序列或扩增产物
的交*污染 对策: 1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外; 2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。所用离心管 及加样枪头等均应一次性使用。 3.各种试剂最好先进行分装,然后低温贮存 PCR产物的电泳检测时间 一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。 假阴性,不出现扩增条带 PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。寻找原因亦应针对上述环节进行分析研究。 模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。⑤模板核酸变性不彻底。在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。 酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。需注意的是有时忘加Taq酶或溴乙锭。 引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。④引物设计不合理,如引物长度不够,引物之间形成二聚体等。 Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。或100ul,应用多大体积进行PCR扩增,是根据科研和临床检测不同目的而设定,在做小体积如20ul 后,再做大体积时,一定要模索条件,否则容易失败。 物理原因:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。有时还有必要用标准的温度计,检测一下扩增仪或水溶锅内的变性、退火和延伸温度,这也是PCR 失败的原因之一。 靶序列变异:如靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。 假阳性 出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。 引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。靶序列太短或引物太短,容易出现假阳性。需重新设计引物。 靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。这种假阳性可用以下方法解决:①操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。②除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。所用离心管及样进枪头等均应一次性使用。③必要时,在加标本前,反应管和试剂用紫外线照射,以破坏存在的核酸。二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。 出现非特异性扩增带 PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。其次是酶的质和量,往往一些来源的酶易出现非
引物设计原则
1. 引物的长度一般为15-30 bp,常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA聚合酶进行反应。 2. 引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错配。引物3’端出现3个以上的连续碱基,如GGG或CCC,也会使错误引发机率增加。 3. 引物3’端的末位碱基对Taq酶的DNA合成效率有较大的影响。不同的末位碱基在错配位置导致不同的扩增效率,末位碱基为A的错配效率明显高于其他3个碱基,因此应当避免在引物的3’端使用碱基A。另外,引物二聚体或发夹结构也可能导致PCR反应失败。5’端序列对PCR影响不太大,因此常用来引进修饰位点或标记物。 4. 引物序列的GC含量一般为40-60%,过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大。 5. 引物所对应模板位置序列的Tm值在72℃左右可使复性条件最佳。Tm值的计算有多种方法,如按公式Tm=4(G+C)+2(A+T),在Oligo软件中使用的是最邻近法(the nearest neighbor method)。 6. ΔG值是指DNA双链形成所需的自由能,该值反映了双链结构内部碱基对的相对稳定性。应当选用3’端ΔG值较低(绝对值不超过9),而5’端和中间ΔG值相对较高的引物。引物的3’端的ΔG值过高,容易在错配位点形成双链结构并引发DNA聚合反应。 7. 引物二聚体及发夹结构的能值过高(超过mol)易导致产生引物二聚体带,并且降低引物有效浓度而使PCR反应不能正常进行。 8. 对引物的修饰一般是在5’端增加酶切位点,应根据下一步实验中要插入PCR 产物的载体的相应序列而确定。 引物序列应该都是写成5-3方向的, Tm之间的差异最好控制在1度之内, 另外我觉得扩增长度大一些比较好,500bp左右。 要设计引物首先要找到DNA序列的保守区。同时应预测将要扩增的片段单链是否形成二级结构。如这个区域单链能形成二级结构,就要避开它。如这一段不能形成二级结构,那就可以在这一区域设计引物。
引物设计的11条黄金法则
引物设计的11条黄金法则
PCR引物设计的11条黄金法则 1.引物最好在模板cDNA的保守区内设计。DNA序列的保守区是通过物种间相似序列的比较确定的。在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区。 2.引物长度一般在15~30碱基之间。 引物长度(primerlength)常用的是18-27bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于TaqDNA聚合酶进行反应。 3.引物GC含量在40%~60%之间,Tm值最好接近72℃。 GC含量(composition)过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大。另外,上下游引物的Tm值(meltingtemperature)是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度。有效启动温度,一般高于Tm值
5~10℃。若按公式Tm=4(G+C)+2(A+T)估计引物的Tm值,则有效引物的Tm为55~80℃,其Tm值最好接近72℃以使复性条件最佳。 4.引物3′端要避开密码子的第3位。 如扩增编码区域,引物3′端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增的特异性与效率。 5.引物3′端不能选择A,最好选择T。 引物3′端错配时,不同碱基引发效率存在着很大的差异,当末位的碱基为A时,即使在错配的情况下,也能有引发链的合成,而当末位链为T 时,错配的引发效率大大降低,G、C错配的引发效率介于A、T之间,所以3′端最好选择T。 6.碱基要随机分布。 引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错误引发(Falsepriming)。降低引物与模板相似性的一种方法是,引物中四种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。尤其3′端
常用的β-actin 引物序列
human actin f ctc cat cct ggc ctc gct gt human actin r gct gtc acc ttc acc gtt cc product size:268 rabbit actin r agt gcg acg tgg aca tcc g rabbit actin f tgg ctc taa cag tcc gcc tag product size:295 mouse actin r cgt tga cat ccg taa aga cc mouse actin f aac agt ccg cct aga agc ac product size:281 rat actin f TCAGGTCATCACTATCGGCAAT rat actin r AAAGAAAGGGTGTAAAACGCA product size:432 human actin r gag cta cga gct gcc tga cg human actin f cct aga agc att tgc ggt gg product size:416 mouse actin f tca tca cta ttg gca acg agc mouse actin r aac agt ccg cct aga agc ac product size:399 rat actin f CCCATCTATGAGGGTTACGC rat actin r TTTAATGTCACGCACGATTTC product size:150 rabbit actin f tct tcc agc cct cct tcc tg rabbit actin r cgt ttc tgc gcc gtt agg t product size:409 内参基因名称引物引物最佳退火扩增 基因库序列号引物名称序列位置Tm 温度C 长度 Human actin beta F305 ctgggacgacatggagaaaa 305-324 52.3 BC002409 R868 aaggaaggctggaagagtgc 868-849 52.6 59.4 564 F1379 agcgagcatcccccaaagtt 1379-1398 57.3 R1663 gggcacgaaggctcatcatt 1663-1644 56.3 54 285 Rat actin beta F18 cacccgcgagtacaaccttc 18-37 54.5 NM_031144 R224 cccatacccaccatcacacc 224-205 54.4 60.4 207 F694 gagagggaaatcgtgcgtgac 694-714 54 R1146 catctgctggaaggtggaca 1146-1127 53.2 57.1 452 Mouse actin beta F91 atatcgctgcgctggtcgtc 91-110 57.5 NM_007393 R607 aggatggcgtgagggagagc 607-588 57.8 60.4 517 F1566 gtccctcaccctcccaaaag 1566-1585 54.5 F1831 gctgcctcaacacctcaaccc 1831-1811 54.4 55.7 266 human GAPDH F369 agaaggctggggctcatttg 369-388 55.6 BC004109 R626 aggggccatccacagtcttc 626-607 55.1 57.5 258
引物的应用常识
引物的应用常识 引物的原理 引物是短的寡核苷酸片段,充当DNA复制的起点。因为几乎所有DNA聚合酶都不能从头合成,所以它们需要一个3’-羟基作为DNA合成的起始点。这个3’-羟基由相配的引物提供。在体内,由于DNA聚合酶的忠实性,不能从头合成DNA,因此只能由RNA聚合酶(称为引物酶)生成,采用RNA引物来延伸,在延伸过程中,RNA引物降解并由DNA取代。在体外PCR反应中所用到的DNA引物,是根据不同的要求及模板序列设计,然后用化学法人工合成的,与模板形成双链后在DNA聚合酶的作用下就可以继续链的延伸;对于大多数PCR反应,决定整个反应成功与否的最重要因素是引物的序列和质量。 1. 不同实验要求的引物选择 在开始设计引物之前,必须弄清以下几点: (1)明确PCR的目的(例如克隆、SNP检测、定量检测等) (2)确定样品材料(基因组DNA、RNA、微小RNA) (3)确定PCR的类型(普通的、定量PCR、RT-PCR、长片段PCR),在查找序列的时候还需要考虑可能存在的问题(如假基因等) 2.引物设计的重要因素 有一些不同的软件工具可用于引物设计和引物分析。引物设计的软件如Oligo 6.22 ,Premier 5.0,Primer Express 3。引物分析常用Primer 5,Oligo 6.22,Primer-Blast。目前生工生物给客户提供的引物设计服务引物用的是在线软件Primer 3 plus, ?引物长度和专一性 常见的引物长度为18-30个碱基。短的引物(≤15碱基)能非常高效地结合, 但是它们的专一性不够。较长的引物能提高专一性,然而退火效率低,从而导致PCR产量低下。 同时应避免编码单一序列和重复序列的引物。 ?平衡GC含量,避免GC-和AT-富集区域 引物的GC含量应介于40%~60%之间。应避免聚-(dC)-或聚(dG)-区域,因为它们会降低退火反应的专一性。聚-(dA)-和聚(dT)-也应避免,因为这样会形成不稳定的引物-模板复合物,从而降低扩增效率。 ?3’-序列 3’端为G-或C-核苷酸较好,因为能增加结合强度。同时它将提高PCR效率,因为引物-模板符合物的开放将达到最小。但是,超过3个G/C碱基将会具有负面效果,因为会 降低反应的专一性。 ?避免互补的引物序列
PCR常见问题分析及对策
. PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物 现象:正对照有条带,而样品则无 原因: 1.模板:含有抑制物,含量低 2.Buffer对样品不合适 3.引物设计不当或者发生降解 4.反应条件:退火温度太高,延伸时间太短 对策: 1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量 2.更换Buffer或调整浓度 3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物 4.降低退火温度、延长延伸时间 问题2:非特异性扩增 现象:条带与预计的大小不一致或者非特异性扩增带 原因: 1.引物特异性差 2.模板或引物浓度过高 3.酶量过多 4.Mg2+浓度偏高 5.退火温度偏低
. 6.循环次数过多 对策: 1.重新设计引物或者使用巢式PCR 2.适当降低模板或引物浓度 3.适当减少酶量 4.降低镁离子浓度 5.适当提高退火温度或使用二阶段温度法 6.减少循环次数
问题3:拖尾 现象:产物在凝胶上呈Smear状态。 原因: 1.模板不纯 2.Buffer不合适 3.退火温度偏低 4.酶量过多 5.dNTP、Mg 2+浓度偏高 6.循环次数过多 对策: 1.纯化模板 2.更换Buffer 3.适当提高退火温度 4.适量用酶 5.适当降低dNTP和镁离子的浓度 6.减少循环次数 问题4:假阳性 现象:空白对照出现目的扩增产物 原因: 靶序列或扩增产物 的交*污染 对策: 1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外; 2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。所用离心管 及加样枪头等均应一次性使用。 3.各种试剂最好先进行分装,然后低温贮存 PCR产物的电泳检测时间 一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
引物设计步骤与要点
引物设计step by step 1、在NCBI上搜索到目的基因,找到该基因的mRNA,在CDS选项中,找到编码区所在位置,在下面的origin中,Copy该编码序列作为软件查询序列的候选对象。 2、用Primer Premier5搜索引物 ①打开Primer Premier5,点击File-New-DNA sequence, 出现输入序列窗口,Copy目的序列在输入框内(选择As),此窗口内,序列也可以直接翻译成蛋白。点击Primer,进入引物窗口。 ②此窗口可以链接到“引物搜索”、“引物编辑”以及“搜索结果”选项,点击Search按钮,进入引物搜索框,选择“PCR primers”,“Pairs”,设定搜索区域和引物长度和产物长度。在Search Parameters里面,可以设定相应参数。一般若无特殊需要,参数选择默认即可,但产物长度可以适当变化,因为100~200bp的产物电泳跑得较散,所以可以选择300~500bp. ③点击OK,软件即开始自动搜索引物,搜索完成后,会自动跳出结果窗口,搜索结果默认按照评分(Rating)排序,点击其中任一个搜索结果,可以在“引物窗口”中,显示出该引物的综合情况,包括上游引物和下游引物的序列和位置,引物的各种信息等。 ④对于引物的序列,可以简单查看一下,避免出现下列情况:3’不要出现连续的3个碱基相连的情况,比如GGG或CCC,否则容易引起错配。此窗口中需要着重查看的包括:Tm 应该在55~70度之间,GC%应该在45%~55%间,上游引物和下游引物的Tm值最好不要相差太多,大概在2度以下较好。该窗口的最下面列出了两条引物的二级结构信息,包括,发卡,二聚体,引物间交叉二聚体和错误引发位置。若按钮显示为红色,表示存在该二级结构,点击该红色按钮,即可看到相应二级结构位置图示。最理想的引物,应该都不存在这些二级结构,即这几个按钮都显示为“None”为好。但有时很难找到各个条件都满足的引物,所以要求可以适当放宽,比如引物存在错配的话,可以就具体情况考察该错配的效率如何,是否会明显影响产物。对于引物具体详细的评价需要借助于Oligo来完成,Oligo自身虽然带有引物搜索功能,但其搜索出的引物质量感觉不如Primer5. ⑤在Primer5窗口中,若觉得某一对引物合适,可以在搜索结果窗口中,点击该引物,然后在菜单栏,选择File-Print-Current pair,使用PDF虚拟打印机,即可转换为Pdf文档,里面有该引物的详细信息。 3、用Oligo验证评估引物 ①在Oligo软件界面,File菜单下,选择Open,定位到目的cDNA序列(在primer中,该序列已经被保存为Seq文件),会跳出来两个窗口,分别为Internal Stability(Delta G)窗口和Tm窗口。在Tm窗口中,点击最左下角的按钮,会出来引物定位对话框,输入候选的上游引物序列位置(Primer5已经给出)即可,而引物长度可以通过点击Change-Current oligo length来改变。定位后,点击Tm窗口的Upper按钮,确定上游引物,同样方法定位下游引物位置,点击Lower按钮,确定下游引物。引物确定后,即可以充分利用Analyze 菜单中各种强大的引物分析功能了。
实验室常用缓冲液 常用引物序列汇总
实验常用试剂、缓冲液的配制方法 Na2HPO4,2 mM KH2PO4 1 M Tris-HCl 、11M Tris-HCl □组份浓度 □配制量□配制量1L 1L (pH7.4,7.6,8.0) □配置方法1. 称量下列试剂,置于1L烧杯中。烧杯中。□配置方法1. 称量121.1gTris置于1L NaCl 加入约800mL的去离子水,充分搅拌溶解。 8 g 2. KCl 0.2g 3. 按下表量加入浓盐酸调节所需要的pH值。 Na2HPO4 1.42 g 浓值 HCl pH KH2PO4 0.27g 7.4 约70mL 2. 向烧杯中加入约800 mL的去离子水,充分搅拌溶解。 7.6 约60mL 3. 滴加HCl将pH42mL 8.0 约值调节至7.4,然后加入去离子水将溶液定容至1L。 4. 将溶解定容至1L。 4. 高温高压灭菌后,室温保存。 5. 高温高压灭菌后,室温保存。注意:上述PBS Buffer中无二价阳离子,如需要,可在配方中pH注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的补充1mM CaCl2和0.5 mM MgCl2。pH值随温度的变化差很大,温度每升高1℃,溶液的值大约降低 6、10 M醋酸铵0.03个单位。□组份浓度10 M醋酸铵 □配制量100mL 1.5 M Tris-HCl 2、1.5 M Tris-HCl □组份浓度□配置方法1. 称量77.1g醋酸铵置于100~配制量pH8.8 ()□1L 200 mL烧杯中,加入约30 mL的去离子水搅拌溶解。1L1. □配置方法称取181.7gTris置于烧杯中。 2. 加入约800mL2.加去离子水将溶液定容至100mL。的去离子水,充分搅拌溶解。 3.使用8.8pH3. 用浓盐酸调值至。0.22μm滤膜过滤除菌。 4.密封瓶口于室温保存。。1L 4. 将溶液定容至 5. 高温高压灭菌后,室温保存。注意:醋酸铵受热易分解,所以不能高温高压灭菌。 7、Tris- HCl平衡苯酚□溶液的注意:应使溶液冷却至室温后再调定pH值,因为Tris配置方法 1. 使用原料:大多数市售液化苯酚是清亮无色的,pH值大约无需重蒸馏℃,溶液的值随温度的变化差异很大,温度每升高pH1便可用于分子生物学实验。0.03降低个单位。但有些液化苯酚呈粉红色或黄色,应避免使用。同时也应避免使用结晶苯酚,结晶苯酚必须在160℃对其,□TE Buffer、310×组份浓度100 mM Tris-HCl10 mM EDTA
引物设计常见问题
引物设计常见问题与解答(二) 17. 长链引物为什么出错的几率非常高 答:引物合成时,每一步反应效率都不能达到100%,产生碱基插入,缺失,置换突变的因素客观条件都有一直存在。引物链越长,突变的频率累加起来就越高。研究人员总希望合成的引物万无一失,这种心情可以理解。但是犹如PCR扩增,不可能绝对保证扩增产物中没有突变,引物合成也不可能保证100%正确。要知道,引物合成中发生错误(非人为因素)的频率,比任何高保真高温聚合酶PCR扩增过程所产生的频率都要高。做引物合成,长链引物合成,您要有引物中部分引物可能有突变的思想准备。 18. 如果测序发现突变,该如何处理 答:对您遇到的困惑,我们表示同情。遇到这种情况,首先和我们取得联系,我们的生产人员会检查生产的原始记录,主要是核对合成序列是否和定单一致,我们在电脑中保留所有原始数据。如果确认引物合成序列没有输错,我们建议重新挑取克隆测序,您可能会找到正确克隆的。根据我们经验,40个碱基以下的引物,测1-2个克隆就可以了;40个以上的特别是用于全片段拼接合成的,就需要多测一些了。一般情况下,每个克隆突变的位点都不一样,提示正确的总是有的,就是如何找到它。您也可以要求我们将引物免费重合一次,不过重合的引物和第一次的引物一样,都可能含突变,不会因为重合的引物就减少您的遇到问题的几率。基因拼接过程中,如果发现一段区域突变点不多,就多测几个,否则就重合一下引物。 19. 如果测序发现引物突变,是否有补偿 答:没有。我们可以免费重合一次,没有其他任何补偿或赔偿,不承担其他连带责任。原因我们在前面已提到,化学合成效率不可能达到100%.您选择了化学合成引物,合成过程中一些副产品所带来的后果就可能不可避免的遇到。 20. 引物是经过PAGE纯化的,为什么还有碱基缺失或插入 答:理论上分析型PAGE变性电泳,可以区分引物之间一个碱基的差别。但是制备PAGE电泳,上样量都是非常大,电泳时的条带非常宽,带与带之间有重叠,分辨率已下降,电泳后割带回收目的引物时,很难说不割到差别仅几个碱基的引物。国内有一个不好的现象,PAGE纯化的引物,特别是长引物要的量都比较高,导致割的条带有时可能比较宽。建议:您如果减少OD数,引物遇到的问题可能就会少一些。 21. 为什么OPC或PAGE纯化的引物,再用HPLC鉴定纯度不高
引物设计的原理与方法
引物设计的原理与方法 This model paper was revised by the Standardization Office on December 10, 2020
PCR引物设计的原理及方法 阎振鑫S111666(四川大学生命科学学院细胞生物学成都 610014) 摘要:自20世纪后期发展了PCR技术以来,PCR已经改变了整个生物学研究的进程。而PCR反应的第一步就是设计引物,引物设计的好坏直接关系到PCR的成败。PCR引物设计有许多的原则必须要遵循:引物与引物之间避免形成稳定的二聚体或发夹结构,引物与模板的序列要紧密互补。引物不能在模板的非目的位点引发DNA聚合反应等。另外,引物的设计方法也越来越多,出现了许多专门的设计软件和网站,如:PrimerPremier5.0等。 关键词:PCR 引物原理方法 NCBI PrimerPremier5.0 PCR primer design principle and method YanZhenxin (sichuan Univercity, Life science college cell biology chengdu 610014 ) Abstract: When PCR technology was find, PCR has changed all of the program in research of biology. The design of primer is the frist step of PCR. It is relation to the fate of PCR. There are some principals must be obey: dipolymer and hairpin structure must be avoid between different primers. The DNA polymerization reaction should not be triggered at the wrong site. Therefore, there are more and more methods of design primer, include the professional softwares and professional web site. Key word: PCR primer principle NCBI PrimerPremier5.0 聚合酶链式反应(Polymerase chain reaction。PCR)是20世纪后期发展起来的 一种体外扩增特异DNA片断的技术。具有快速、简便及高度敏感等优点,能极大地缩短目的基因扩增时间[1]。因此,其一直是生物学者们致力于构建cDNA文库、基因克隆以及表达调控研究的必要前提和基础[2]。PCR的第一步就是引物设计。引物设计的好坏,直接影响了PCR的结果,因此这一步很关键。成功的PCR反应既要高效,又要特异性扩增产物,因此对引物设计提出了较高的要求。引物设计需要注意的地方很多,在大多数情况下,我们都是在知道已知模板序列时进行PCR扩增的。在某些情况比如构建文库的时候也会在不知道模板序列的情况下进行设计。这个时候随机核苷酸序列
甲基化引物探针设计方法
本文叙述了一种用于甲基化分析的探针法定量PCR的引物和探针设计方法,目前用于甲基化检测的引物探针设计工具非常多,都有使用成功的案例,经过初步多方尝试,本文中叙述的为本人认为较为靠谱的方法。Oligo7的优势在于专业,参数详尽且可自由设置,模块化设计,学会后使用便利。专业的活就是要专业的用专业的工具干。
首先是进行序列转换,有较多的在线工具和联机软件都可实现,这里使用https://www.360docs.net/doc/b513091969.html,/methprimer/,较为简单直观。
直接将目标序列放入如上图的编辑框中,此也可直接用于相关引物的设计,不过本人没使用过,因为不能设计探针。submit后就有转化后的序列信息,如下图: 以上详细标记了CpG位置和非CpG位置的C,可直接复制到Word标注使用,下面就可以使用Oligo7利用上边的序列设计引物和探针了,如果是设计非甲基化引物探针,则使用原始序列。
关于引物和探针的一些主要参数,主要参考invtrogen的建议: Primer设计的基本原则: a)引物长度一般在18-35mer。 b)G-C含量控制在40-60%左右。 c)避免近3’端有酶切位点或发夹结构。 d)如果可能避免在3’端最后5个碱基有2个以上的G或C。 e)如果可能避免在3’端最后1个碱基为A。 f)避免连续相同碱基的出现,特别是要避免GGGG或更多G出现。 g)退火温度Tm控制在58-60C左右。 h)如果是设计点突变引物,突变点应尽可能在引物的中间。 T aqMan 探针设计的基本原则: a)T aqMan 探针位置尽可能靠近扩增引物(扩增产物50-150bp),但不能与引物重叠。 b)长度一般为18-40mer 。 c)G-C含量控制在40-80%左右。 d)避免连续相同碱基的出现,特别是要避免GGGG或更多G出现。 e)在引物的5’端避免使用G。 f)选用比较多的碱基C。 g)退火温度Tm控制在68-70℃左右。 另:目标变异碱基最好在3’末端或3’末端-1位置,保证扩增特异性,对于甲基化,则最好是C。
ISSR通用引物序列
ISSR通用引物序列
UBC Primer Set #9 (Microsatellite) 引物名称序列 801 ATA TAT ATA TAT ATA TT 802 ATA TAT ATA TAT ATA TG 803 ATA TAT ATA TAT ATA TC 804 TAT ATA TAT ATA TAT AA 805 TAT ATA TAT ATA TAT AC 806 TAT ATA TAT ATA TAT AG 807 AGA GAG AGA GAG AGA GT 808 AGA GAG AGA GAG AGA GC 809 AGA GAG AGA GAG AGA GG 810 GAG AGA GAG AGA GAG AT 811 GAG AGA GAG AGA GAG AC 812 GAG AGA GAG AGA GAG AA 813 CTC TCT CTC TCT CTC TT 814 CTC TCT CTC TCT CTC TA 815 CTC TCT CTC TCT CTC TG 816 CAC ACA CAC ACA CAC AT 817 CAC ACA CAC ACA CAC AA 818 CAC ACA CAC ACA CAC AG 819 GTG TGT GTG TGT GTG TA 820 GTG TGT GTG TGT GTG TC
821 GTG TGT GTG TGT GTG TT 822 TCT CTC TCT CTC TCT CA 823 TCT CTC TCT CTC TCT CC 824 TCT CTC TCT CTC TCT CG 825 ACA CAC ACA CAC ACA CT 826 ACA CAC ACA CAC ACA CC 827 ACA CAC ACA CAC ACA CG 828 TGT GTG TGT GTG TGT GA 829 TGT GTG TGT GTG TGT GC 830 TGT GTG TGT GTG TGT GG 831 ATA TAT ATA TAT ATA TYA 832 ATA TAT ATA TAT ATA TYC 833 ATA TAT ATA TAT ATA TYG 834 AGA GAG AGA GAG AGA GYT 835 AGA GAG AGA GAG AGA GYC 836 AGA GAG AGA GAG AGA GYA 837 TAT ATA TAT ATA TAT ART 838 TAT ATA TAT ATA TAT ARC 839 TAT ATA TAT ATA TAT ARG 840 GAG AGA GAG AGA GAG AYT 841 GAG AGA GAG AGA GAG AYC 842 GAG AGA GAG AGA GAG AYG
献给初学者:PCR常见问题分析
献给初学者:PCR常见问题分析 变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。 1没有扩展条带 可能的原因及对应的解决方案如下: 酶失活或在反应体系中未加入酶。Taq DNA聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。 模板含有杂质。特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA脱嘌呤而影响PCR的结果。 变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。 反应系统中污染了蛋白酶及核酸酶,应在未加Taq酶以前,将反应体系95℃加热5~10分钟。 引物变质失效。人工合成的引物是否正确。是否纯化,或因储存条件不当而失活。 引物错误。利用BLAST检查引物特异性或重新设计引物。 DNA凝胶电泳时加入阳性对照,确保不是DNA凝胶和PCR程序的问题。 2PCR产物量过少 可能的原因和对应的解决方案如下: 退火温度不合适。以2度为梯度设计梯度PCR反应优化退火温度。 DNA模板量太少。增加DNA模板量。 PCR循环数不足。增加反应循环数。 引物量不足。增加体系中引物含量。 延伸时间太短。以1 kb/分钟的原则设置延伸时间。 变性时间过长。变性时间过长会导致DNA聚合酶失活。 DNA模板中存在抑制剂。确保DNA模板干净 3扩增产物跑电泳条带弥散
可能的原因和对应的解决方案如下: 酶量过高。减少酶量;酶的质量差,调换另一来源的酶。 dNTP浓度过高。减少dNTP的浓度。 MgCl?浓度过高。可适当降低其用量。 模板量过多。质粒DNA的用量应<50 ng,而基因组DNA则应<200 ng。 引物浓度不够优化。对引物进行梯度稀释重复PCR反应。 循环次数过多;增加模板量减少循环次数至30,缩短退火时间及延伸时间,或改用二种温度的PCR循环。 退火温度过低。 电泳体系有问题: ①凝胶中缓冲液和电泳缓冲液浓度相差太大; ②凝胶没有凝固好; ③琼脂糖质量差。 若为PCR试剂盒则可能: ①由于运输储存不当引起试剂盒失效; ②试剂盒本身质量有问题,如引物选择、循环参数等选择不当。 降解的陈旧模板扩增也易产生涂布。 4扩展产物出现杂带 可能的原因和对应的解决方案如下: 引物用量偏大,引物的特异性不高。应调换引物或降低引物的使用量。 循环的次数过多。适当增加模板的量,减少循环次数。 酶的用量偏高或酶的质量不好,应降低酶量或调换另一来源的酶。 退火温度偏低,退火及延伸时间偏长。应提高退火温度,减少变性与延伸时间,也可采用二种温度的PCR扩增。以2度为梯度设计梯度PCR反应优化退火温度。 样品处理不当。 Mg2+浓度偏高,因适当调整Mg2+使用浓度。 若为PCR试剂盒,也可能时试剂盒本身质量有问题。 复制提前终止。使用非热启动的聚合酶时常有发生。冰上准备反应体系或采用热启动聚合酶。 反应缓冲液未完全融化或未充分混匀。确保反应缓冲液融化完全并彻底混匀。
