超声波提取实验方案
超声波提取实验方案
本实验采用单因素试验方法,以黄芩中的黄芩苷色素提取为代表,考察料液比、粒径大小、乙醇浓度、溶剂pH、提取时间、提取级数、超声功率等对色素提取的影响。
1.超声波提取
不锈钢超声杯为内径为60mm,高度为150mm不锈钢杯,超声波探头最大功率为120W。
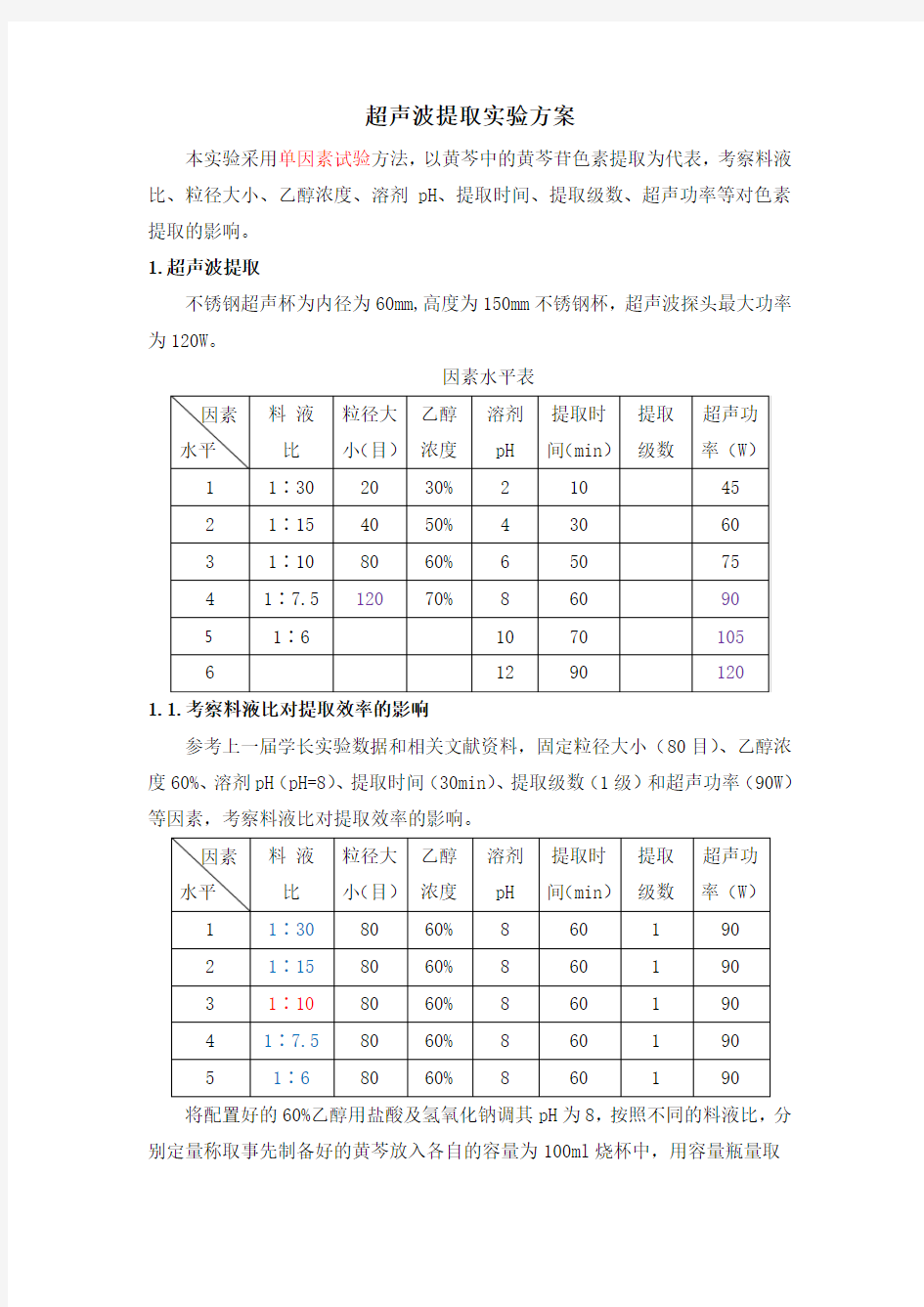
因素水平表
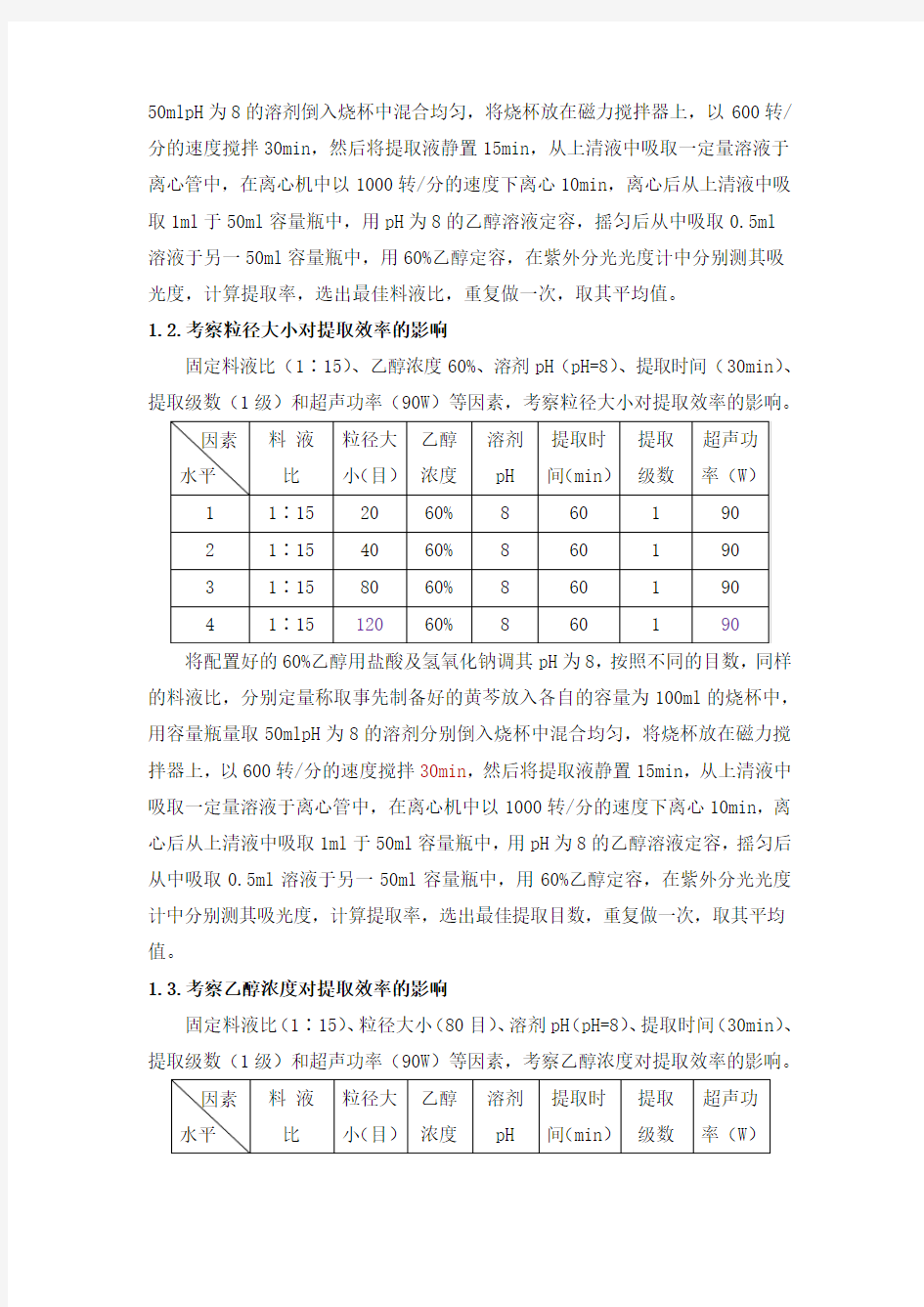
1.1.考察料液比对提取效率的影响
参考上一届学长实验数据和相关文献资料,固定粒径大小(80目)、乙醇浓度60%、溶剂pH(pH=8)、提取时间(30min)、提取级数(1级)和超声功率(90W)等因素,考察料液比对提取效率的影响。
将配置好的60%乙醇用盐酸及氢氧化钠调其pH为8,按照不同的料液比,分别定量称取事先制备好的黄芩放入各自的容量为100ml烧杯中,用容量瓶量取
50mlpH为8的溶剂倒入烧杯中混合均匀,将烧杯放在磁力搅拌器上,以600转/分的速度搅拌30min,然后将提取液静置15min,从上清液中吸取一定量溶液于离心管中,在离心机中以1000转/分的速度下离心10min,离心后从上清液中吸取1ml于50ml容量瓶中,用pH为8的乙醇溶液定容,摇匀后从中吸取0.5ml
溶液于另一50ml容量瓶中,用60%乙醇定容,在紫外分光光度计中分别测其吸光度,计算提取率,选出最佳料液比,重复做一次,取其平均值。
1.2.考察粒径大小对提取效率的影响
固定料液比(1∶15)、乙醇浓度60%、溶剂pH(pH=8)、提取时间(30min)、提取级数(1级)和超声功率(90W)等因素,考察粒径大小对提取效率的影响。
将配置好的60%乙醇用盐酸及氢氧化钠调其pH为8,按照不同的目数,同样的料液比,分别定量称取事先制备好的黄芩放入各自的容量为100ml的烧杯中,用容量瓶量取50mlpH为8的溶剂分别倒入烧杯中混合均匀,将烧杯放在磁力搅拌器上,以600转/分的速度搅拌30min,然后将提取液静置15min,从上清液中吸取一定量溶液于离心管中,在离心机中以1000转/分的速度下离心10min,离心后从上清液中吸取1ml于50ml容量瓶中,用pH为8的乙醇溶液定容,摇匀后从中吸取0.5ml溶液于另一50ml容量瓶中,用60%乙醇定容,在紫外分光光度计中分别测其吸光度,计算提取率,选出最佳提取目数,重复做一次,取其平均值。
1.3.考察乙醇浓度对提取效率的影响
固定料液比(1∶15)、粒径大小(80目)、溶剂pH(pH=8)、提取时间(30min)、提取级数(1级)和超声功率(90W)等因素,考察乙醇浓度对提取效率的影响。
分别将配置好的30%、50%、60%、70%的乙醇用盐酸及氢氧化钠调其pH为8,选定料液比为1∶15,80目的黄芩来做提取,定量称取事先制备好的黄芩放入100ml烧杯中,用容量瓶量取50mlpH为8的溶剂分别倒入事先编好号的烧杯中混合均匀,将烧杯放在磁力搅拌器上,以600转/分的速度搅拌30min,然后将提取液静置15min,从上清液中吸取一定量溶液于离心管中,在离心机中以1000转/分的速度下离心10min,离心后从上清液中吸取1ml于50ml容量瓶中,分别用浓度为30%、50%、60%、70%、pH为8的乙醇溶液定容,摇匀后从中吸取0.5ml 溶液于另一50ml容量瓶中,用60%乙醇定容,在紫外分光光度计中测其吸光度,计算提取率,选出最佳提取乙醇浓度,重复做一次,取其平均值。
1.4.考察溶剂pH值对提取效率的影响
固定料液比(1∶15)、粒径大小(80目)、乙醇浓度60%、提取时间(30min)、提取级数(1级)和超声功率(90W)等因素,考察溶剂pH值对提取效率的影响。
分别将配置好的60%乙醇用盐酸及氢氧化钠调其pH为2、4、6、8、10、12,选定料液比为1:17,80目的黄芩来做提取,定量称取事先制备好的黄芩放入100ml烧杯中,用容量瓶量取50mlpH为2、4、6、8、10、12的溶剂分别倒入事先编好号的烧杯中混合均匀,将烧杯放在磁力搅拌器上,以600转/分的速度搅拌30min,然后将提取液静置15min,从上清液中吸取一定量溶液于离心管中,
在离心机中以1000转/分的速度下离心10min,离心后从上清液中吸取1ml于
50ml容量瓶中,分别用pH为2、4、6、8、10、12的乙醇溶液定容,摇匀后从中吸取0.5ml溶液于另一50ml容量瓶中,用60%乙醇定容,在紫外分光光度计中测其吸光度,计算提取率,选出最佳提取pH。
1.5.考察提取时间对提取效率的影响
固定料液比(1∶15)、粒径大小(80目)、乙醇浓度60%、溶剂pH(pH=8)、提取级数(1级)和超声功率(90W)等因素,考察提取时间对提取效率的影响。
选取80目黄芩,料液比为1:15,乙醇浓度为60%,溶液pH为8等条件下,定量称取事先制备好的黄芩放入100ml烧杯中,用容量瓶量取50mlpH为8的溶剂分别倒入事先编好号的烧杯中混合均匀,将烧杯放在磁力搅拌器上,以600
转/分的速度分别搅拌20min、40min、30min、80min、100min、120min,然后将提取液静置15min,从上清液中吸取一定量溶液于离心管中,在离心机中以1000转/分的速度下离心10min,离心后从上清液中吸取1ml于50ml容量瓶中,用60%pH为8的乙醇溶液定容,摇匀后从中吸取0.5ml溶液于另一50ml容量瓶中,用60%乙醇定容,在紫外分光光度计中测其吸光度,计算提取率,选出最佳提取时间。
1.6.考察提取级数对提取效率的影响
固定料液比(1∶15)、粒径大小(80目)、乙醇浓度60%、溶剂pH(pH=8)、提取时间(30min)和超声功率(90W)等因素,考察提取级数对提取效率的影响。
称取80目黄芩5.0000g,取50ml浓度为60%pH为8的乙醇溶液于100ml烧杯中,在磁力搅拌器上以600转/min的速度搅拌30min,然后将提取液静置15 min,从上清液中吸取一定量溶液于离心管中,在离心机中以1000转/分的速度下离心10min,离心后从上清液中吸取1ml于50ml容量瓶中,用pH为8的乙醇溶液定容,摇匀后从中吸取0.5ml溶液于另一50ml容量瓶中,用60%乙醇定容,在紫外分光光度计中测其吸光度,将吸取后的残液过滤,滤渣放入100ml烧杯中,再加入50ml浓度为60%pH为8的乙醇溶液,重复上述操作,多次提取至提取液接近无色,停止试验。
1.7.考察超声功率对提取效率的影响
固定料液比(1∶15)、粒径大小(80目)、乙醇浓度60%、溶剂pH(pH=8)、提取时间(30min)和提取级数(1级)等因素,考察超声功率对提取效率的影响。
料液比按1∶15称65份2.5g的黄芩果皮,在6个事先标好号的烧杯中分别量取50ml60%的pH为8的溶液。按顺序将溶液与果皮混合均匀置于超声波发生器中,分别在超声功率为45W、60W、75W、90W、105W和120W下超声提取30min。将超声提取液静置15min,从上清液中吸取一定量溶液于离心管中,在离心机中以1000转/min的速度下离心10min,离心后从上清液中吸取1ml于50ml容量瓶中,用pH为8的溶液定容,摇匀后,在紫外分光光度计中测其吸光度,记录其
数据,计算提取浓度,料液比按1∶15重复上述操作,取其平均值。
芦丁的提取分离和鉴定
综合化学实验: 芦丁的提取分离和鉴定 芦丁简介: 芦丁(Rutin)又名芸香苷化学式: C27H30O16·3H2O,是一种浅黄色针状结晶有机化合物,广泛存在于自然界植物中,是一种被人们广泛使用的有机天然产物。目前已发现含有芦丁的植物至少在70种以上,常见的如烟叶、槐花、荞麦和蒲公英中均有不同含量。尤其以中药槐米(豆科、槐属,槐树Sophorajaponica的花蕾)和荞麦中含量最高,因此槐米可作为大量提取芦丁的天然植物原料。 中药槐米(炒碳)味苦性凉、具清热凉血、止血之功。常用于治疗多种出血症:肠风便血、痔血、尿血、衄血、崩漏下血、赤血下痢等。西医研究其主要有效成分为有机化合物“芦丁”而中药槐米中芦丁的含量可高达12~16%,是主要的芦丁天然来源。槐米中还含有槲皮素、三萜皂苷、槐花米甲素、槐花米乙素、槐花米丙素等。研究文献证明芦丁具有VitP(维生素P)样作用(VitP具有生物类黄酮的功能,可防止维生素C被氧化而受到破坏,增强维生素功效;增加毛细血管壁强度,防止瘀伤。有助于牙龈出血的预防和治疗,有助于因内耳疾病引起的浮肿或头晕的治疗等)。而芦丁具有类似作用如可降低毛细血管脆性和调节通透性等,在医学临床上常将其用作毛细血管脆性引起的出血症以及防治高血压病等的辅助治疗药物。 芦丁是由槲皮素(quercetin)3位上的羟基与芸香糖(rutinose,一种由葡萄糖glucose与鼠李糖rhamnose组成的双糖)脱水合成的苷,是一种浅黄色粉末或极细的针状结晶,含有三分子的结晶水,熔点为174~178℃,无结晶水时188~190℃。溶解度:冷水中为1:10000;热水中1:200;冷乙醇1:650;热乙醇1:60;冷吡啶1:12。微溶于丙酮、乙酸乙酯,不溶于苯、乙醚、氯仿、石油醚,溶于碱而呈黄色。 补充知识:
细胞外泌体提取方法
外泌体提取详细步骤及方法 1、差速离心 差速离心仍然是最常见的外泌体分离技术之一。该方法包括几个步骤,包括低速离心去除细胞和凋亡碎片;更高速离心以消除更大的囊泡;最后高速离心沉淀外泌体: 300×g离心10分钟,取上清。 2000×g离心10分钟,取上清。 10,000×g离心30分钟,取上清。100,000×g,在4℃下持续离心90分钟,去掉上清,留下的沉淀PBS重悬后,再次以100,000×g离心90分钟。 2、密度梯度离心 该方法将超速离心与蔗糖密度梯度相结合,实现外泌体与非囊泡颗粒分离,例如蛋白质和蛋白质/RNA聚集体。因此,该方法将囊泡与不同密度的颗粒分开,能够提取含量低的外泌体。但是,合适的离心时间非常重要,否则如果它们具有相似的密度,则仍可在外泌体中发现污染颗粒。 3、尺寸排阻色谱 尺寸排阻色谱(Size-exclusion chromatography,SEC)是基于大小而非分子量实现分离大分子。该技术应用填充多孔聚合物微球的柱子,分子根据其直径通过微球,半径小的分子需要更长的时间才能通过色谱柱的孔隙迁移,而大分子则从色谱柱中更早地洗脱。尺寸排阻色谱可以精确分离大小分子。此外,可以将不同的洗脱溶液应用于该方法。与离心方法相比,色谱分离已被证明具有更多优势,因为通过色谱分离的外泌体不受剪切力的影响,这可能会改变囊泡的结构。目前,SEC是一种广泛接受的分离血液和尿液中外泌体的技术。不过,该方法耗时较长,不适合大量样本处理。 4、过滤 超滤膜也可用于分离外泌体。根据外泌体的大小,从蛋白质和其他大分子中分离外泌体。最常见的过滤膜具有0.8μm、0.45μm或0.22μm的孔径,可用于收集大于800nm、400nm或200nm的外泌体,也有设计成微柱多孔硅纤毛结构以分离40-100nm外泌体:不过,该方法由于过滤膜的粘附,可能会损失外泌体,并且过滤时的压力和剪切力,可能会使外泌体变形受损。 5、基于聚合物的沉淀技术 基于聚合物的沉淀技术通常包括将样本与含聚合物的沉淀溶液混合,在4℃温育并低速离心。用于聚合物沉淀的最常见聚合物之一是聚乙二醇(PEG)。用
果胶的提取与果胶含量的测定
果胶的提取与果胶含量 的测定 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
果胶的提取与果胶含量的测定 一、引言 果胶广泛存在于水果和蔬菜中,如苹果中含量为—%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。果胶的基本结构是以α-1,4苷键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中的游离羧基相结合。原果胶不溶于水,故用酸水解,生成可溶性的果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶(酯化度在70%以上)。在食品工业中常利用果胶制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。 二、实验材料、试剂与仪器 材料:桔皮,苹果等; 试剂:%HCL,95%乙醇(AR),精制乙醇,乙醚,LHCl,%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯) 仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等三、实验步骤 (一)果胶的提取 1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。用水冲洗后切成3~5mm的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗)。 2、酸水解提取:将预处理过的果皮粒放入烧杯中,加约%HCL溶液,以浸没果皮为宜,调pH至~,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。 3、脱色:在滤液中加入~%的活性炭,于80℃加热20min,进行脱色和除异味,趁热抽滤(如抽滤困难可加入2%~4%的硅藻土作为助滤剂)。如果柑橘皮漂洗干净萃取液为清澈透明则不用脱色。
果胶实验方案
果胶提取 1方法 1.1原料制备称取10克冬青,切碎,放入烧杯中。在烧杯中加入蒸馏水,用水浴锅加热到90度,加热10分钟,以除去果胶酶。过滤,将滤液用蒸馏水多次洗涤,直到滤出液变得澄清,以出去色素。 1.2果胶提取把滤渣放入烧杯中,加入盐酸,调节PH至2,放到水浴锅中,100度加热1.5小时。过滤,得到的溶液就是果胶溶液,向其中加入等量的稍多的无水乙醇。即可得到湿果胶 2果胶提取的单因素实验, 2.1 提取温度对果胶提取率的影响, 在PH 2,加热时间1.5小时,料液比1:10的条件下。设置50℃60℃80℃100℃120℃做一组实验。 2.2PH对果胶提取率的影响 在温度100℃加热时间1.5小时,料液比1:10的条件下。设置PH 1 2 3 4 5做一组实验 2.3 提取时间对果胶提取率的影响 在温度100℃PH 2 ,料液比1:10的条件下。设置加热时间50min 60min 80min 100min 120min做一组实验。 2.4料液比对果胶提取率的影响 在温度100℃加热时间1.5小时,PH为2的条件下。设置料液比为1:6 1:8 1;10 1;12 1;14做一组实验。
3 实验目的 在单因素的基础上找出每个因素下的最优条件,为正交实验做准备。 4.果胶的干燥(四种方法) 1.果胶干燥大多采用喷雾干燥,即用压力式喷雾干燥,将浓缩液在进料温度150~160℃,出料温度220~230℃的条件下干燥,连续化操作中可不断得到粉末状产品。 2.将湿果胶转移于100 mL烧杯中,加入30 mL无水乙醇洗涤湿果胶,再用尼龙布过滤、挤压。将脱水的果胶放入表面皿中摊开,在60~70 ℃烘干。将烘干的果胶磨碎过筛,制得干果胶。 3.冷冻干燥。将湿果胶冷冻,然后在较高真空下将溶液蒸发而干燥的方法。 4.用布氏漏斗过滤得到果胶沉淀,把果胶移动于烧杯中用95%乙醇洗涤吸过滤。搓碎放于表面皿中在干燥器中过夜,用研钵研磨得到果胶粉,计算产率 5果胶的纯度检验 1.重量法
芦丁的提取
实验从槐花米中提取芦丁P.198 【实验目的】 通过从槐花米中提取芦丁的实验,掌握用酸碱调节提取中药活性成分的方法. 【实验原理】 槐花米又名槐米,是槐花的花蕾.性凉,味苦,功能凉血,止血,主治肠风,痔血,便血等症.槐花米的主要活性成分是芦丁. 芦丁又名芸香苷,不仅存在于槐花米中(含量达10-20%),在荞麦叶等中,也有存在.结构式如下: 从结构式中不难看出,芦丁实际上是由黄酮与糖(葡萄糖和鼠李糖)形成的苷.由于含有黄酮结构,所以,呈黄色.黄酮部分连有许多酚-OH,故易溶于碱液,酸化复析出,这是本实验采用酸-碱调节法来提取芦丁的依据. 纯芦丁为淡黄色针状结晶,不溶于乙醇,氯仿等有机溶剂,熔点为188℃(理论值),带三个结晶水的熔点为174-178℃. 芦丁能增强毛细管的韧性,适用于毛细管脆弱的患者. 【实验步骤】 称取15g槐花米,用粉碎机研成粉状.置于250ml烧杯中,加入150ml饱和石灰水[1],于石棉网上加热至沸,并不断搅拌,煮沸15分钟后,抽滤[2].滤渣再用100ml饱和石灰水煮沸10分钟,抽滤. 合并两次滤液,用5%盐酸调节至pH3-4[3].放置1-2小时,使沉淀完全,抽滤,并用水洗涤2-3次,即得芦丁粗品. 将粗品置于250ml的烧杯中,加水150ml,在石棉网上加热至沸,不断搅拌,并慢慢加入约50ml 饱和石灰水,调节溶液pH值为8-9,待沉淀溶解后,趁热过滤.滤液置于250ml的烧杯中,用5%盐酸调节至pH4-5,静置30分钟.芦丁即以浅黄色结晶析出,抽滤,并用水洗涤1-2次,烘干,称重[4],测熔点. 【注解】 [1] 加入饱和石灰水既可达到用碱液提取芦丁的目的,同时,还可除去槐花米中的多糖粘液质. [2] 抽滤时,宜先小心倾出上层清液,再慢慢倒出带结晶的溶液,以防结晶过早堵住滤纸孔.后面的抽滤均需如此. [3] 注意小心滴加,约需7-8ml稀盐酸.如果滴加过多,pH值过低,芦丁(苷类)则易水解. [4] 产量约为1.5g. 【实验结果】 产品的外观性状 产量 【问题与讨论】 1 本实验中,开始用饱和石灰水提取,再用酸调节到pH3-4,这段pH值范围较宽;后来又用饱和石灰水调节到pH3-4,再用酸调节到pH4-5,这段pH值范围较窄.为什么要这样做如果反过来(先调窄后调宽)行不行 2 在一开始用酸调节pH值时,某生不小心,加入的稀盐酸过量,pH值小于3-4,请问对实验会产生什么后果为什么 3 根据这个实验,请总结出用酸碱调节法提取中药活性成分的适用条件及一般原理.
槐米中芦丁的提取
O HO O HO O OH OH O HO OH CH2 HO O OH OH HO O H3C 槐米中芦丁的提取、提纯和鉴定 一、实验目的 1.掌握芦丁提取和提纯的基本原理和方法。 2.掌握重结晶及过滤等基本操作。 3.学习芦丁及槲(hū)皮素的鉴定方法。 二、实验原理 芦丁(Rutin)亦称芸香苷,广泛存在于植物组织中,其中以槐花米和荞麦叶含量较高,槐米中含量高达12~16%,是提取芦丁的最佳原料。芦丁有减少毛细血管通透性的作用,临床上用作毛细血管止血药和高血压病的辅助治疗药物。近年来,芦丁及槲皮素作为抗癌药物的研究,取得了大量成果。芦丁属黄酮苷,其结构如下: 芦丁为淡黄色针状结晶,含有三分子结晶水(C27H36O16·3 H2O),熔点为177~178 ℃,无水物熔点为190~192 ℃,难溶于冷水,微溶于冷乙醇,可溶于热水和热乙醇中。此外,还难溶于乙酸乙酯、丙酮,不溶于苯、氯仿、乙醚及石油醚等溶剂。易溶于碱性溶液中呈黄色,酸化后又析出。本实验利用芦丁在冷热水和冷热乙醇中溶解度的差异进行提取与精制。 芦丁在不同溶剂中的溶液度: 芦丁的紫外吸收波长(CH3OH溶液):λmax = 259mm,266nm sh,299nm sh,359nm。 槲皮素(Quercetin)是芦丁水解得到的黄酮苷元,是芦丁药用功能的主要部分,大多数黄酮类物质都具有较高的药用价值。 槲皮素为黄色结晶,含两分子结晶水(C15H10O7·2 H2O),熔点313~314 ℃,无水
物熔点为316 ℃。可溶于甲醇、乙酸、吡啶、丙酮、乙酸乙酯等溶剂,不溶于水、乙醚、苯、氯仿、石油醚。在沸腾的无水乙醇中溶解度为4.4 ,在室温下乙醇中的溶解度为0.35 。可利用槲皮素在冷热乙醇中的溶解度差进行提纯。槲皮素的结构式如下: 槲皮素的紫外吸收波长(CH 3OH 溶液):λmax = 259nm ,266nm ,299nm ,359nm 。 三、实验步骤 (一)芦丁的提取 取15 g 槐米研成粉状,置烧杯中,加水300 mL ,煮沸30分钟(注意适量加水,补充蒸发损失),趁热过滤,滤渣再提取两次(每次用水250 mL ,煮沸15分钟),过滤,合并滤液,放置24小时,使沉淀完全析出。过滤,粗产物用少量水洗涤,得芦丁粗品,烘干,称重,计算提取率。 (二)芦丁的精制 将芦丁粗品研细,倒入圆底烧瓶中,加入100 mL 95% 乙醇,加热回流至芦丁完全溶解,再加少量活性炭回流10分钟,然后趁热过滤于另一圆底烧瓶中,得黄色澄清溶液。蒸馏滤液并回收乙醇,待溶液剩10~15 mL 时停止加热,将浓缩液倒入小烧杯中,用少量乙醇洗涤烧瓶,将洗涤液合并于小烧杯中,放置使结晶完全析出。过滤(滤液回收),得芦丁精品,烘干,称重,计算产率,测其熔点。 (三)芦丁水解制取槲皮素 取芦丁精品1.0 g 于烧杯中,研细,加30%乙醇水溶液150 mL ,再加浓盐酸4 mL ,加热煮沸30分钟(注意观察)。放置冷却,过滤,水洗至滤液呈中性,烘干,称重,计算产率。测其熔点(如质量不合格,可用75%乙醇重结晶),计算产率。 (四)性质试验 取芦丁及槲皮素精品少许,用95%乙醇溶解,作为样品溶液,进行下列试验,并比较两者试验结果的差异。 1.Molish 反应 取两试样各l mL ,各加入10%α—萘酚溶液10滴,充分摇匀,将试管倾斜,沿管壁慢慢加入1 mL 浓硫酸,勿摇,观察溶液界面的颜色变化。 O OH HO OH OH O OH
果胶的提取
实验果胶的提取 一、目的要求 1.掌握从柚子皮中提取果胶的方法。 2. 了解果胶的性质和提取原理。 3. 了解果胶在食品工业中的用途。 二、实验原理 果胶物质广泛存在于植物中,主要分布于细胞壁之间的中胶层,尤其以果蔬中含量为多。不同的果蔬含果胶物质的量不同,山楂约为6.6%,柑橘约为0.7~1.5%,南瓜含量较多,约为7%~17%。在果蔬中,尤其是在未成熟的水果和果皮中,果胶多数以原果胶存在,原果胶不溶于水,用酸水解,生成可溶性果胶,再进行脱色、沉淀、干燥即得商品果胶。从柚子皮中提取的果胶是高酯化度的果胶,在食品工业中常用来制作果酱、果冻等食品。 果胶是一种分子中含有几百到几千个结构单元的线性多糖,平均分子量大约在50000~180000之间,其基本结构是以α-1,4苷键结合而成的聚半乳糖醛酸,在聚半乳糖醛酸中,部分羧基被甲醇酯化,剩余部分与钾、钠或铵等离子结合。 在果蔬中果胶多以原果胶存在。在原果胶中,聚半乳糖醛酸可被甲醇部分酯化,并以金属桥(特别是钙离子)与多聚半乳糖醛酸分子残基上的游离羧基相连接。原果胶不溶于水,用酸水解时这种金属离子桥(离子键)被破坏,即可得可溶性果胶。再进行纯化和干燥即为商品果胶。 三、实验器材 恒温水浴、布氏漏斗、抽滤瓶、玻棒、尼龙布、表面皿、精密pH试纸、烧杯、电子天平、小刀、真空泵、柚子皮(新鲜)。 四、实验试剂 1.95%乙醇。 2.浓盐酸 3.2mol/L氨水 4.活性炭 五、操作步骤 1.称取新鲜柚子皮5g,用水冲洗后切成3~5 mm大小的颗粒,放入100 mL烧杯中,加20 mL水,加热至90 ℃保温5~10 min,使酶失活。把果皮粒用尼龙布挤干,用50 ℃左右的热水漂洗,直至水为无色,果皮无异味为止。每次漂洗都要把果皮用尼龙布挤干,再进行下一次漂洗[注1]。 2.将处理过的果皮粒放入烧杯中,加入45 mL水,滴加浓盐酸调溶液的pH 2.0~2.5之间。加热至90 ℃,在恒温水浴中保温30 min,保温期间要不断地搅动,趁热用垫有100目尼龙布(或四层纱布)的布氏漏斗抽滤,收集滤液。 3.在滤液中加入0.5—1%的活性炭于80℃加热10 分钟进行脱色和除异味,趁热抽滤[注2]。 4.滤液冷却后,滴加2mol/L氨水调至pH 3~4,在不断搅拌下缓缓地加入95%酒精溶液,加入乙醇的量为原滤液体积的1.5倍(使其中酒精的质量分数达50%~60%)。酒精加入过程中即可看到絮状果胶物质析出,静置10 min后,用尼龙布过滤、挤压。将脱水的果胶放入表面皿中摊开,在60~70 ℃烘干。将烘干的果胶磨碎过筛,制得干果胶。 5.滤液可用蒸馏法收回乙醇。 六、问题与思考 1.从柚子皮中提取果胶时,为什么要加热使酶失活? 2.沉淀果胶除用乙醇外,还可用什么试剂? 3.在工业上,可用什么果蔬原料提取果胶? [注1]:处理的主要目的是灭酶,以防果胶酶解。同时也是对果皮进行清洗,以除去泥土、杂质、色素等。 这种处理的好坏直接影响果胶的色泽和质量。 [注2]:如果柚子皮漂洗干净,滤液清沏,则可不脱色。因为胶状物容易堵塞滤纸,这时可加入占滤液2~4%的硅藻土用助滤剂。
实验槐米中芦丁的提取分离和鉴定
实验一槐米中芦丁的提取、分离和鉴定 一、概述 槐米系豆科植物槐树(Sophora japonica L.)的花蕾(槐米)。具有清热、凉血、止血的功效,用于治疗便血、痔血,尿血、血淋,崩漏,赤血痢下,风热目赤,痛疽疮毒,还可用于预防中风。近年来被用作治疗高血压的辅助药物。 药理实验证明,槐花米具有调节毛细血管的渗透作用,抗炎作用,解痉、抗渍疡作用,影响脂质代谢,抗菌等多种生物活性。槐花米中主要含有黄酮苷,皂苷、甾醇和鞣质等成分,其中芦丁(Rutin)含量最高,达12~20%。 主要化学成分的结构及理化性质: 芦丁(rutin):C 27H 30 O 16 ·3H 2 O,浅黄色针状结晶,mp174~178℃(含三分子 水);188℃(无水物)。难溶于冷水(1:8000~10000),可溶于热水(1:180~200),热甲醇(1:10),冷甲醇(1:100),热乙醇(1:60),冷乙醇(1:650);难溶于乙醚、三氯甲烷、石油醚、乙酸乙酯、丙酮等,易溶于碱液。 槲皮素(quercetin):C 15H 10 O 7 ·2H 2 O,黄色结晶,mp313~314℃(2分子结 晶水),316℃(无水物)。能溶于冷乙醇(1:290),易溶于沸乙醇(1:23),可溶于甲醇、乙酸乙酯、冰醋酸、吡啶、丙酮等;难溶于水、苯、石油醚等溶剂。 二、实验部分 (一)实验目的 1、通过芦丁的制备,掌握黄酮类化合物提取分离的原理和操作。 2、掌握酸水解将芦丁生成槲皮素的方法。 3、掌握芦丁与槲皮素的鉴别方法,聚酰胺薄膜的操作方法,电子天平的使用方法。 (二)实验原理 1、芦丁的提取原理:芦丁中含有多个酚羟基,具有酸性,故用碱提酸沉法。 2、芦丁的分离原理:芦丁在沸水中溶解,在冷水中析出。 3、芦丁的鉴定原理:芦丁与槲皮素分别为黄酮类化合物的苷与苷元,用Molish反应可以进行鉴别,也可以利用聚酰胺的氢键吸附性质进行定性分析,Rf值也应不同。 (三)实验药材、仪器与试剂 1、药材:槐米50g(每组)。
果胶含量的测定方法二
果胶的测定(方案一): 黄晓钰,刘邻渭等.食品化学综合实验[M].中国农业大学出版社. 2002.158~159 实验原理:果胶经水解,其产物——半乳糖醛酸可在强酸环境中与咔唑试剂产生缩合反应,生成紫红色化合物,其呈色深浅与半乳糖醛酸含量成正比,由此可进行比色定量 测定果胶。 实验试剂:1.化学纯无水乙醇或95%乙醇。 2.精制乙醇:取无水乙醇或95%乙醇1000ml,加入锌粉4g,硫酸(1:1)4ml, 至于衡温水浴中回流10h,用全玻璃仪器蒸馏,馏出液每1000ml加锌粉和氢 氧化钾各4g,并进行蒸馏。 3. 0.15%咔唑乙醇溶液:称取咔唑g,溶于精制乙醇并定容至100ml。 4.半乳糖醛酸标准溶液:先用水配置成浓度1 g/L的溶液,再配制成浓度分别为 (0、10mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70mg/L)的 系列半乳糖醛酸标准溶液。 5.优级纯浓硫酸。 操作方法:1样品处理: 总果胶提取:(鲜样)研磨新鲜样品50g,放入1000ml烧杯中,加入L HCl 400mL,放置沸水浴中加热1h,加热时应随时补充蒸发损失的水分。冷却后, 移入500ml容量瓶,定容摇匀,过滤,滤液待用。(干样)磨细的干燥样品 5g,置于250ml三角烧瓶,加入L HCL 150ml,装上冷凝器,与沸水浴中加热 回流1h,取出冷却甚至室温,用水定容至200ml,摇匀,过滤,滤液待用。 水溶性果胶提取:新鲜样品应尽量研磨碎,干燥的样品应磨细后过60目筛。 样品中存在有果胶酶时,为了顿化酶的活性,可以加入适量热的95%乙醇, 是样品溶液的乙醇最终浓度约为70%,然后于沸水浴中沸腾回流15min,使果 胶酶钝化,冷却过滤后,以95%乙醇洗涤多次,再用乙醚洗涤,以除去全部 糖类、脂类及色素,最后风干除去乙醚。 2果胶提取:水溶性果胶的提取:将样品研碎,新鲜样品标准称取30~50g,干 燥样品准确称取5~10g至于250ml烧杯,加入150ml水。加热至沸腾,并保 持此状态1h。加热过程随时填补蒸发损失的水分。取出冷却,将杯中物质移 入250ml容量瓶,用水洗涤烧杯,洗液并入容量瓶,最终定容至刻度,摇匀 过滤,记录滤液体积。 3标准曲线制作:取试管8支,各加入12ml浓硫酸,置冰水浴中冷却后,分别 将各种浓度的半乳糖醛酸2ml 徐徐各加入试管中,充分混匀后,再置冰水浴 中冷却,然后置沸水浴中加热10min,迅速冷却至室温,各加入1ml %咔唑试 剂,摇匀,与室温下静置30min,用0好使观众的溶液调仪器零点,在530nm 波长下测定各管溶液的A530nm值,以A为横坐标,半乳糖醛酸浓度为纵坐标 绘制标准曲线。 4测定:取果胶提取液用水稀释至适量浓度(含半乳糖醛酸10~70mg/L)。移 取12ml 冰水冷却的浓硫酸加入试管中,然后加入2ml 样品稀释液,充分混 合后,至于冰水冷却。取出后在沸水浴中加热10min,冷却至室温,加入1mL % 咔唑试剂,摇匀,于室温下静置30min,用空白试剂调零,在530nm波长下 测定A530nm值,与标样对照,求出样品果胶含量。 计算:
芦丁提取
实验一槐米中芦丁及槲皮素的提取分离及鉴定 [目的要求] 1.通过芦丁的提取与精制掌握碱酸法提取黄酮类化合物的原理及操作。 2.掌握槲皮素的制备原理及操作。 3.熟悉紫外光谱在黄酮结构鉴定中的应用 4.通过芦丁的结构检识,了解苷类结构研究的一般程序和方法。 [实验原理] 芦丁(rutin):C27H30O16·3H2O,浅黄色针状结晶,mp174~178℃(含三 分子水);188℃(无水物)。难溶于冷水(1:8000~10000),可溶于热水(1:180~200),热甲醇(1:10),冷甲醇(1:100),热乙醇(1:60),冷乙醇(1:650);难溶于乙醚、三氯甲烷、石油醚、乙酸乙酯、丙酮等,易溶于碱液。 槲皮素(quercetin):C15H10O7·2H2O,黄色结晶,mp313~314℃(2分 子结晶水),316℃(无水物)。能溶于冷乙醇(1:290),易溶于沸乙醇(1:23), 可溶于甲醇、乙酸乙酯、冰醋酸、吡啶、丙酮等;难溶于水、苯、石油醚等溶剂。 +鼠李糖+葡萄糖 芦丁为黄酮苷,分子中具有酚羟基,显酸性,可溶于稀碱液中,在酸液中沉 淀析出,可利用此性质进行提取分离。利用芦丁易溶热水、热乙醇,较难溶于冷水、冷乙醇的性质选择重结晶方法进行精制。芦丁可被稀酸水解生成槲皮素及 葡萄糖、鼠李糖,依此进行制备槲皮素。通过纸色谱及紫外光谱进行黄酮及糖的 鉴定。 [实验内容] 一、芦丁的提取分离及精制 方法⑴ 槐米粗粉(50g) 置1000ml烧杯中,加入500ml饱和石灰水,加热,并维持pH8~9 煮沸20分钟,趁热滤过
滤液药渣 用300ml饱和石灰水煮沸10分钟,维持pH8~9 趁热滤过 滤液药渣(×) 合并 在60℃~70℃下用浓HCl调pH至4 ~5 静置,抽滤 沉淀 低温(80℃)干燥,称重。按1:200的比例加水, 加热使溶解,趁热滤过 滤液 静置,抽滤,减压干燥,计算收率 芦丁精制品 方法⑵利用芦丁在冷热溶剂中的溶解度不同进行提取分离。 槐米粗粉 沸水煮沸5~10分钟,反复2次 趁热滤过 水提取液药渣 放冷 沉淀析出(粗芦丁) 热水重结晶 或乙醇重结晶 芦丁结晶 二、槲皮素的制备 称取精品芦丁1g 置250ml烧瓶中 加2%H2SO4200ml 加热回流1小时 放冷,静置,抽滤 酸性滤液沉淀
exosomes外泌体实验方案
外泌体分离提纯草案 By 朱旭峰 一、以超高速离心的方法来分离外泌体(细胞上清) 1.1细胞培养液(CM)是来自无菌的80%-90%的培植细胞,并用浓度比 1:1.000的蛋白酶抑制剂混合。(sigma) 1.2快速地将CM用0.22μm 的过滤筛(Millipore)过滤,来分离完整地 细胞和残渣。超速离心于120,000_g (Sorvall WXULTRA SERIES, rotor A-641) 4 ℃.2 小时 1.3用1mL 冷的PBS 重悬和清洗小囊泡,再次超速离心120,000_g (Sorvall WXULTRA SERIES, rotor A-641) 4 ℃.2 小时 1.4再用100μL 冷的PBS 重悬后转移到低粘附的管中 1.5快速地使用或置于-80℃中待用为检测外泌体的蛋白浓度,取2μL 的样品置于卡上,用Direct Detect?(Millipore) 2材料 a)细胞培养液 b)蛋白酶抑制(Sigma) c)过滤筛(Millipore) d)冷的PBS e)低粘附的管 f)Direct Detect?(Millipore) 二、以超高速离心的方法来分离外泌体(人血浆) 1.1在提取外泌体之前应该向血浆里添加1;500浓度比的蛋白酶抑制剂 (Sigma) 1.2将上清液移至一个新的管中离心200*g 20分钟4℃ 1.3小心地再将上清液移至新的管中离心10000*g 30分钟于4℃来去 除较大的囊泡、 1.4此阶段的样品可以 1.5将样品用0.22μm的注射器滤筛(Millipore)过滤并且离心110000g (Sorvall WX ULTRA SERIES, rotor F65L) 2小时4℃ 1.6用冷的PBS重悬后再次超速离心(110,000g, 1 h, 4 ℃)., 1.7将外泌体小心干燥并且用冷的PBS重悬 1.8外泌体应该立即使用或-80摄氏度冷藏 2.材料
果胶的提取
果胶的提取 一、目的要求 1.学习从柑橘皮中提取果胶的方法。 2.进一步了解果胶质的有关知识。 二、实验原理 果胶物质广泛存在于植物中,主要分布于细胞壁之间的中胶层,尤其以果蔬中含量为多。不同的果蔬含果胶物质的量不同,山楂约为6.6%,柑橘约为0.7~1.5%,南瓜含量较多,约为7%~17%。在果蔬中,尤其是在未成熟的水果和果皮中,果胶多数以原果胶存在,原果胶不溶于水,用酸水解,生成可溶性果胶,再进行脱色、沉淀、干燥即得商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶,在食品工业中常用来制作果酱、果冻等食品。 三、实验器材 恒温水浴、布氏漏斗、抽滤瓶、玻棒、尼龙布、表面皿、精密pH试纸、烧杯、电子天平、小刀、真空泵。 柑橘皮(新鲜)。 四、实验试剂 1.95%乙醇、无水乙醇。 2.0.2 mol/L盐酸溶液 3.6 mol/L氨水 4.活性炭 五、操作步骤 1.称取新鲜柑橘皮20 g(干品为8 g),用清水洗净后,放入250 mL 烧杯中,加120 mL水,加热至90 ℃保温5~10 min,使酶失活。用水冲洗后切成3~5 mm大小的颗粒,用50 ℃左右的热水漂洗,直至水为无色,果皮无异味为止。每次漂洗都要把果皮用尼龙布挤干,再进行下一次漂洗。 2.将处理过的果皮粒放入烧杯中,加入0.2 mol/L的盐酸以浸没果皮为度,调溶液的pH 2.0~2.5之间。加热至90 ℃,在恒温水浴中保温40 min,保温期间要不断地搅动,趁热用垫有尼龙布(100目)的布氏漏斗抽滤,收集滤液。 3.在滤液中加入0.5%~1%的活性炭,加热至80 ℃,脱色20 min,趁热抽滤(如橘皮漂洗干净,滤液清沏,则可不脱色)。 4.滤液冷却后,用6 mol/L氨水调至pH 3~4,在不断搅拌下缓缓地加入95%酒精溶液,加入乙醇的量为原滤液体积的1.5倍(使其中酒精的质量分数达50%~60%)。酒精加入过程中即可看到絮状果胶物质析出,静置20 min 后,用尼龙布(100目)过滤制得湿果胶。 5.将湿果胶转移于100 mL烧杯中,加入30 mL无水乙醇洗涤湿果胶,
果胶酶实验报告
实验报告 果胶酶在果汁生产中的作用 一.实验目的 1.探究不同温度对果胶酶活性的影响; 2.探究不同 ph 对果胶酶活性的影响; 3.探究果胶酶的用量对果汁生产的影响。 二.实验原理 1.果胶酶的活性受温度影响。处于最适温度时,活性最高。果肉的出汁率、果汁的澄清 度与果胶酶的活性大小成正比。 2.果胶酶的活性受ph影响,处于最适ph,酶的活性最高,高于或低于此值活性均下 降。果肉的出汁率、果汁的澄清度与果胶酶的活性大小成正比。 3.在一定的条件下,随着酶浓度的增加,果汁的体积增加;当酶浓度达到某一数值后, 在增加酶的用量,果汁的体积不再改变,此值即是酶的最适用量。 三.实验材料与用具 苹果、果胶酶、盐酸溶液、榨汁机、电子天平、恒温水浴锅、烧杯、量筒、试管、漏斗、温度计、玻璃棒、滤纸、滴管、三脚架 四.实验步骤 (一)温度对果胶酶活性的影响 1.制备果汁选取一个中等大小的苹果( 约 200g) 洗净后,不去皮,切成小块,放入榨 汁机中,加入约 200ml 水,榨取 2min,制得苹果泥。量取一定体积的苹果泥, 不同条件下处理后,用滤纸进 行过滤即可得到果汁; 2.取9支试管编号并分别加入等量的果汁和果胶酶; 3.将9支试管分别放入30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃的水 浴锅中保温10分钟; 4.过滤果汁用量筒测量果汁的里量,并记录数据。 (二)ph 对果胶酶活性的影响 1.制备果汁; 2.取5支试管编号并分别加入等量的果汁和果胶酶; 3.将5支试管放入40℃恒温水浴锅中加热; 4.待试管内温度稳定后在5支试管分别加入ph分别为5、6、7、8、9的盐酸溶液; 5.恒温保持10min; 6.过滤果汁用量筒测量果汁的里量,并记录数据。 (三)果胶酶的用量对果汁生产的影响 1.配制不同浓度的果胶酶溶液准确称取纯的果胶酶1mg、2mg、3mg、4mg、5mg、6mg、 7mg、8mg、9mg,配制成相等体积的水溶液,取等量放入9支试管中,并编号1~ 9。; 2.在9支试管中加入等量的苹果汁; 3.将上述试管放入恒温水浴加热一段时间。 4.将不同浓度的果胶酶分别迅速与各试管的苹果泥混合,然后再放入恒温水箱中。 5.恒温水浴约20分钟 6.过滤后测量果汁的体积 四.实验结果 五.分析与结论篇二:果胶酶活性测定实验报告 一、实验设计 二、实验报告 篇三:果胶的实验报告
外泌体捕获分离
外泌体,带来革命变革的小不点(三)——外泌体捕获分离 外泌体天然存在于体液中,在包括血液、唾液、尿液、脑脊液和乳汁等体液中广泛分布,而且,所有培养的细胞类型均可分泌外泌体;但是,想要研究这个分布广泛的小不点可不是一件容易的事情,其中,最为困难的就是从体液或者细胞培养基中分离出高纯度的外泌体。今天,小优专题给您带来的就是外泌体研究的最关键步骤——外泌体捕获与分离这一部分的技术讲解与解决方案。 外泌体分离的传统方法为差速超速离心法和密度梯度超速离心法等,差速超速离心法是目前外泌体提取最常用的方法。简单来说是将细胞培养液或体液等样本依次在300 g、2 000 g、10 000 g离心去除细胞碎片和大分子蛋白质,最后100 000 g离心得到外泌体。此种方法得到的外泌体量多,但是纯度不足,电镜鉴定时发现外泌体聚集成块,质量不好,由于微泡和外泌体没有非常统一的鉴定标准,也有一些研究认为此种方法得到的是微泡不是外泌体。另一种常用的外泌体分离方法为密度梯度离心法,将样本和梯度材料一起超速离心,样品中的不同组分沉降到各自的等密度区,分为连续和不连续梯度离心法。用于密度梯度离心法的介质要求对细胞无毒,在高浓度时粘度不高且易将pH调至中性。实验中常用蔗糖密度梯度离心法,在离心法的基础上,预先将两种浓度蔗糖溶液(如2.5 M 和0.25 M)配成连续梯度体系置于超速离心管中,样本铺在蔗糖溶液上,100 000 g离心16 h,外泌体会沉降到等密度区(1.10~1.18 g/ml)。用此种方法分离到的外泌体纯度高,但是前期准备工作繁杂,耗时,产量少。而且,这两种传统方法都需要用到超速离心机,设备昂贵,耗时长,一次最多只能做6个样品,效率低,并且需要大量的样品才能得到足够多的外泌体。 接下来小优就为您带来优宁维为您提供的高效外泌体捕获与分离技术,帮您远离枯燥乏味的超速离心,快速高效制备高质量的外泌体。话不多说,亮技术,上产品:首先闪亮登场的是简单的一步法分离外泌体,实验原理如下图: 一步法分离外泌体原理示意图 该技术的优势有节省时间,小体积样本适用(可从100 μl血浆中分离出足量外泌体),无需超速离心和其他预富集方式,试剂方便储存于运输(4℃保存)等。 除了一步法分离外泌体的技术外,小优还为您提供免疫捕获法,包括免疫微球产品与免疫预制板产品。首先我们来看免疫微球捕获分离外泌体的技术原理:
从果皮中提取果胶
从果皮中提取果胶 一、实验目的 1、学习从从果皮中提取果胶的基本原理和方法, 了解果胶的一般性质。 2、掌握提取有机物的原理和方法。 3、进一步熟悉萃取、蒸馏、升华等基本操作。 二、实验原理 果胶是一种高分子聚合物,存在于植物组织内,一般以原果胶、果胶酯酸和果胶酸3种形式存在于各种植物的果实、果皮以及根、茎、叶的组织之中。果胶为白色、浅黄色到黄色的粉末,有非常好的特殊水果香味,无异味,无固定熔点和溶解度,不溶于乙醇、甲醇等有机溶剂中。粉末果胶溶于20倍水中形成粘稠状透明胶体,胶体的等电点pH值为3.5。果胶的主要成分为多聚D—半乳糖醛酸,各醛酸单位间经a—1,4糖甙键联结,具体结构式如图1。 图1 果胶的结构式 在植物体中,果胶一般以不溶于水的原果胶形式存在。在果实成熟过程中,原果胶在果胶酶的作用下逐渐分解为可溶性果胶,最后分解成不溶于水的果胶酸。在生产果胶时,原料经酸、碱或果胶酶处理,在一定条件下分解,形成可溶性果胶,然后在果胶液中加入乙醇或多价金属盐类,使果胶沉淀析出,经漂洗、干燥、精制而形成产品。 三、主要仪器和药品 仪器:恒温水浴锅、真空干燥箱、布氏漏斗、抽滤瓶、玻棒、纱布、表面皿、精密pH试纸、烧杯、电子天平、小刀、小剪刀、真空泵、。 药品:干柑桔皮、稀盐酸、95%乙醇(分析纯)等。 四、实验内容 1、柑桔皮的预处理 称取干柑桔皮20g,将其浸泡在温水中(60~70℃)约30min,使其充分吸水软化,并除掉可溶性糖、有机酸、苦味和色素等;把柑桔皮沥干浸入沸水5min进行灭酶,防止果胶分解;然后用小剪刀将柑皮剪成2~3mm的颗粒;再将剪碎后的柑桔皮置于流水中漂洗,进一步除去色素、苦味和糖分等,漂洗至沥液近无色为止,最后甩干。 2、酸提取
从果皮中提取果胶
从果皮中提取果胶 、实验目的 1、 学习从从果皮中提取果胶的基本原理和方法 ,了解果胶的一般性质。 2、 掌握提取有机物的原理和方法。 3、 进一步熟悉萃取、蒸馏、升华等基本操作。 、实验原理 果胶是一种高分子聚合物,存在于植物组织内,一般以原果胶、果胶酯酸和果胶酸 种形式存在于各种植物的果实、果皮以及根、茎、叶的组织之中。果胶为白色、浅黄色到黄 色的粉末,有非常好的特殊水果香味,无异味,无固定熔点和溶解度,不溶于乙醇、甲醇等 有机溶剂中。粉末果胶溶于 20倍水中形成粘稠状透明胶体,胶体的等电点 pH 值为3.5。果 胶的主要成分为多聚 D —半乳糖醛酸,各醛酸单位间经a — 1, 4糖甙键联结,具体结构式如 图1。 coon 小 |\oii H A )II 'ri El O'JII 图1果胶的结构式 在植物体中,果胶一般以不溶于水的原果胶 形式存在。 在果实成熟过程中,原果胶在果 胶酶的作用下逐渐分解为可溶性果胶, 最后分解 成不溶于水的果胶酸。 在生产果胶时,原料 经酸、碱或果胶酶处理,在一定条件下分解, 形成可溶性果胶,然后在果胶液中加入乙醇或 多价金属盐类,使果胶沉淀析出,经漂洗、干燥、精制而形成产品。 三、主要仪器和药品 仪器:恒温水浴锅、真空干燥箱、布氏漏斗、抽滤瓶、玻棒、纱布、表面皿、精密 烧杯、电子天平、小刀、小剪刀、真空泵、。 药品:干柑桔皮、稀盐酸、95%乙醇(分析纯)等。 四、实验内容 1、 柑桔皮的预处理 称取干柑桔皮20g ,将其浸泡在温水中(60?70C )约30min ,使其充分吸水软化, 并除掉 可溶性糖、有机酸、苦味和色素等;把柑桔皮沥干浸入沸水 5min 进行灭酶,防止果胶分解; 然后用小剪刀将柑皮剪成 2?3mm 的颗粒;再将剪碎后的柑桔皮置于流水中漂洗,进一步 除去色素、苦味和糖分等,漂洗至沥液近无色为止,最后甩干。 2、 酸提取 Illi Oil pH 试纸、 (}
外泌体提取方法总结
1、细胞培养上清:即在4℃下,首先300×g离心10 min,吸取 上清液,然后2 000×g离心10 min;吸取上清液后,10 000×g 高速离心30 min,吸取上清液;140000×g超速离心90 min;除去上清液,所获得的沉淀即为外泌体。用PBS缓冲液洗涤沉淀并重悬后,140 000×g 再次离心90 min,100 μL PBS缓冲液重悬沉淀,冻存于-80℃备用。 2、将小鼠或人血收集在1.5mL管中,并使其在37℃下凝结1小 时而不进行抗凝。此后,将其以2,000×g离心持续10分钟获得血清。接着将血清以3,000×g离心10分钟。将上清液以无菌PBS 以1:1的比例稀释并离心再次以10,000×g保持30分钟,然后以200,000×g进行2小时超速离心。将颗粒在a中洗涤大量PBS,通过0.2-μm注射器过滤器过滤,并以200,000×g离心1小时,然后收集沉淀并重悬于PBS或PBS中用于后期功能或生化测定的培养基。 3、 为了从体液(例如尿液,支气管肺泡灌洗液,血清,血浆,肿瘤腹水)中纯化外泌体,只需通过常规方法收集液体即可。血浆用紫色的管子,EDTA抗凝,血清的话不抗凝直接离心。在4°C下在玻璃瓶中储存长达5天,直至进行外泌体纯化。 外泌体纯化的原理与从组织培养条件培养基开始时的原理相同,但由于某些流体的粘度,必须稀释它们,并增加离心的速度和长度。该方案已在作者的实验室中用于从人血浆中纯化外泌体(Caby等,2005)。
基本方案1中指出的所有预处理也适用于该方案。材料液体(例如,血浆:通过Ficoll离心与血细胞分离;淋巴,血清,尿液,细支气管灌洗或肿瘤腹水)磷酸盐缓冲盐水(PBS;附录) 2A)冷冻离心机 50毫升聚丙烯离心管0.22微米过滤装置(如Steritop,Millipore)超速离心机和固定角度或摆动式转子(见表 3.22.1)适用于超速离心机转子的聚合物管或聚碳酸酯瓶(见表3.22) 0.1) 注意:所有离心均应在4℃下进行。 1.用等体积的PBS稀释液体。将稀释的液体转移到50毫升管中。在2,000×g,4℃下离心30分钟。 2.将上清液转移到超速离心管或瓶中,没有颗粒污染(参见基本方案1,步骤3注释)。在12,000×g,4℃下离心45分钟。 3.小心地将上清液转移到超速离心管或瓶中(根据处理的液体体积,可参见表3.22.1中的管)。在110,000×g,4℃下离心2小时。 4.将沉淀重悬于1ml PBS中,并将其在其中一个管中汇集。用PBS填充管以大量稀释再悬浮液。 5.通过0.22-μm过滤器过滤悬浮液,并收集在新鲜的超速离心管或瓶中。 6.在110,000×g,4℃下离心70分钟。倒出上清液。 7.将沉淀重悬于1ml PBS中,然后用PBS填充管。在110,000×g,4℃下离心70分钟。倒出上清液。 8.将沉淀重悬于50至200μlPBS中。在-80℃下储存长达1年。
实验四 果胶的提取
实验四果胶的提取 一、引言 果胶广泛存在于水果和蔬菜中,如苹果中含量为0.7—1.5%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。果胶的基本结构是以α-1,4苷键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。 在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中的游离羧基相结合。原果胶不溶于水,故用酸水解,生成可溶性的果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶(酯化度在70%以上)。在食品工业中常利用果胶制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。 二、实验材料、试剂与仪器 材料:桔皮,苹果等; 试剂:0.25% HCL,95%乙醇(AR),精制乙醇,乙醚,0.05mol/L HCl,0.15%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯) 仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等 三、实验步骤 (一)果胶的提取 1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。用水冲洗后切成3~5mm的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗)。 2、酸水解提取:将预处理过的果皮粒放入烧杯中,加约60mL 0.25% HCL 溶液,以浸没果皮为宜,调pH至2.0~2.5,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。 3、脱色:在滤液中加入0.5~1.0%的活性炭,于80℃加热20min,进行脱色和除异味,趁热抽滤(如抽滤困难可加入2%~4%的硅藻土作为助滤剂)。如果柑橘皮漂洗干净萃取液为清澈透明则不用脱色。 4、沉淀:待提取液冷却后,用稀氨水调pH至3~4。在不断搅拌下加入95%乙醇溶液,加入乙醇的量约为原体积的1.3倍,使酒精浓度达到50%~65%。 5、过滤、洗涤、烘干:用尼龙布过滤(滤液可用蒸馏法回收酒精),收集果胶,并用95%乙醇洗涤果胶2~3次,再于60~70℃干燥果胶,即为果胶产品。
实验一至三__芦丁提取纯化及分析2014-修正终版
实验名称指导教师 实验1 芦丁的提取及水解制备槲皮素周延 实验2 高效液相色谱法芦丁及槲皮素标准曲线的测定周延 实验3 芦丁的大孔吸附树脂纯化梁浩 13-4人一组,每批9组(4个班学委自己协调分批,如有事,可与其他班同学调换。数据汇总到药1学委处,下周五7月4日前药1学委把每批的名单发我)以小组为单位进行实验。 2实验二分为2部分,实验二-1为标准曲线制作,实验二-2为样品测定。两次实验必须使用同一台色谱仪,否则实验结果无效。 3每组带洗净的250ml空饮料瓶1个。 4工艺实验教师起辅助作用,同学根据参考资料自己完成实验。提前预习关键点,设计实验记录表格,会检查预习笔记。实验1的条件为建议条件,可根据查阅文献,进行条件修改(报告中需说明理由和文献依据)。 5实验后原始记录需进行登记,收拾好老师检查后方可离开。
63个实验分别写报告,每个人的三份订在一起。完成实验后一起以班为单位尽早上交。最迟请于7月19日上午9点前交到制药工程办公室科西310。 实验一芦丁的提取及水解制备槲皮素 一、实验目的和要求 通过芦丁的提取与精制掌握碱-酸法提取黄酮类化合物的原理及操作。 通过测定芦丁和槲皮素含量巩固色谱仪使用方法。
二、实验原理 (一)概述 芦丁(Rutin)广泛存在于植物界中,现已发现含芦丁的植物至少在70种以上,如烟叶、槐花、荞麦和蒲公英中均含有。尤以槐花米(为植物Sophora japonica的未开放的花蕾)和荞麦中含量最高,可作为大量提取芦丁的原料。芦丁是由斛皮素(Quercetin)3位上的羟基与芸香糖(Rutinose)〔为葡萄糖(Glucose)与鼠李糖(Rhamnose)组成的双糖〕脱水合成的苷。芦丁有助于保持及恢复毛细血管的正常弹性,主要用作防治高血压病的辅助治疗剂,亦可用于防治因缺乏芦丁所致的其他出血症。 芦丁为浅黄色粉末或极细的针状结晶,含有三分子的结晶水,熔点为174~178℃,无水物188~190℃。溶解度:冷水中为1:10000;热水中1:200;冷乙醇1:650;热乙醇1:60;冷吡啶1:12。微溶于丙酮、乙酸乙酯,不溶于苯、乙醚、氯仿、石油醚,溶于碱而呈黄色。芦丁在酸性条件下可水解得到槲皮素。 利用芦丁易溶于碱性水,难溶于酸性水,可用碱性水提取,再调至酸性,黄酮苷(芦丁)即可沉淀析出。提取过程中为了防止芦丁氧化可加入焦亚硫酸钠抗氧化,并加入硼砂保护邻二酚羟基不被破坏。得到粗芦丁后利用其可溶于热水、难溶于冷水的性质重结晶进行精制。 三、仪器和试剂 1实验设备与仪器 烧瓶,温度计,布氏漏斗,抽滤瓶,循环真空泵,恒温加热及磁力搅拌装置,试管,量筒,烧杯,干燥箱,冷凝管,HPLC 2实验材料与试剂 槐花米,硼砂,焦亚硫酸钠,氧化钙,无水乙醇,甲醇,硫酸,盐酸,精确pH试纸, 四、实验内容 1 芦丁的提取 (1)将80g槐米,500mL(pH8-9)澄清石灰水,1.2g硼砂,2.4g焦亚硫酸钠一起置于1000mL圆底烧瓶中,65℃搅拌提取55min,注意添加蒸馏水及烧瓶中颜色的变化(深棕黄色),趁热过滤。 (2)滤下的槐米再次加入400mL澄清石灰水,0.9g硼砂和1.8g焦亚硫酸钠,65℃搅拌提取50min,趁热过滤。 (3)合并两次滤液,用浓HCl调pH至4,置于冰箱中。 2 芦丁的精制
