平面向量知识结构示意图
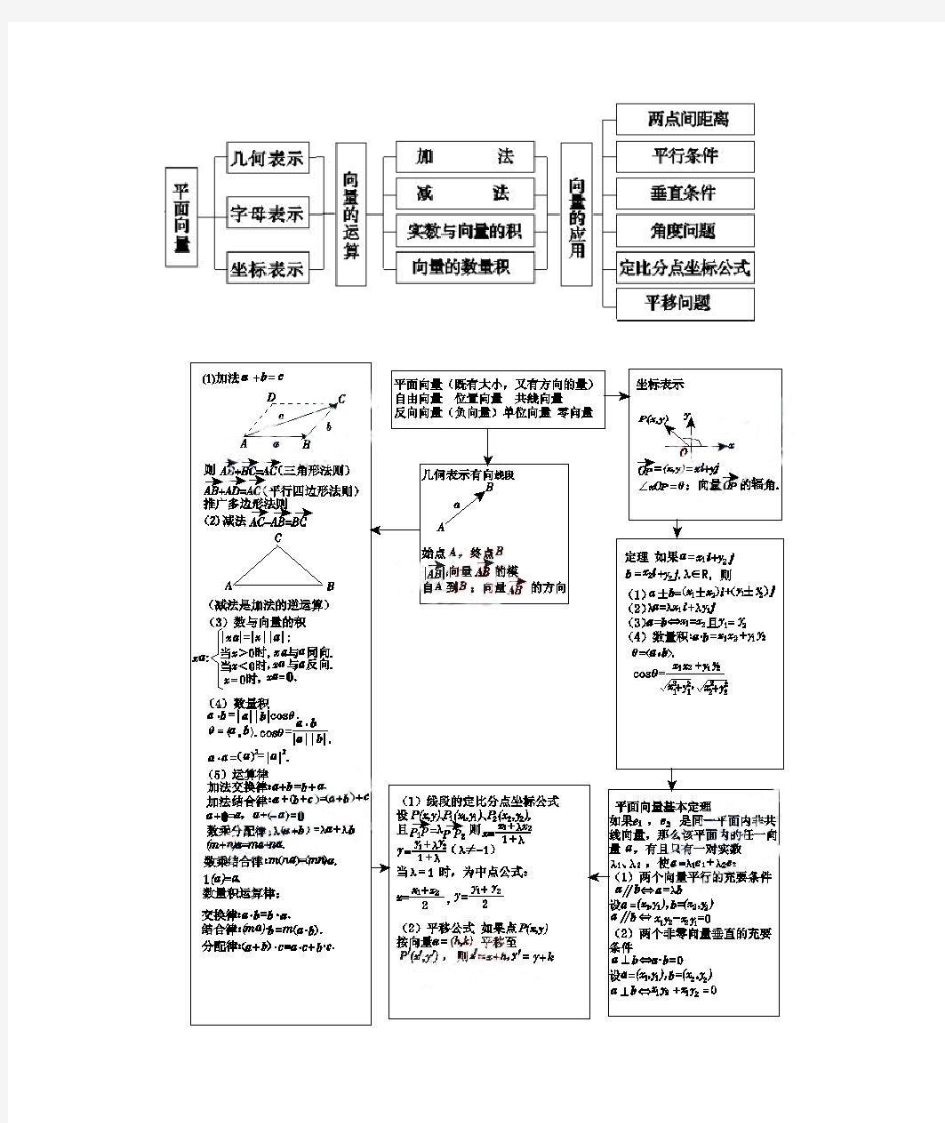
平面向量知识点总结(精华)
必修4 平面向量知识点小结 一、向量的基本概念 1.向量的概念:既有大小又有方向的量,注意向量和数量的区别. 向量常用有向线段来表示 . 注意:不能说向量就是有向线段,为什么?提示:向量可以平移. 举例 1 已知A(1,2),B(4,2),则把向量u A u B ur按向量a r( 1,3)平移后得到的向量是. 结果:(3,0) 2.零向量:长度为 0 的向量叫零向量,记作:0r,规定:零向量的方向是任意的; 3.单位向量:长度为一个单位长度的向量叫做单位 向量(与u A uu B r共线uuur 的单位向量是u A u B ur ); | AB| 4.相等向量:长度相等且方向相同的两个向量叫相等向量,相等向量有传递性; 5.平行向量(也叫共线向量):方向相同或相反的非零向量 a r、 b r叫做平行向量,记作:a r∥b r, 规定:零向量和任何向量平行 . 注:①相等向量一定是共线向量,但共线向量不一定相等;②两个向量平行与与两条直线平行是不同的两个概念:两个向量平行包含两个向量共线,但两条直线平行不包含两条直线重合; ③平行向量无传递性!(因为有r0); ④三点A、B、C 共线u A uu B r、u A u C ur共线. 6.相反向量:长度相等方向相反的向量叫做相反向量 . a r的相反向量记作a r. 举例 2 如下列命题:(1)若|a r | |b r | ,则a r b r. (2)两个向量相 等的充要条件是它们的起点相同,终点相同 . (3)若u A u B ur u D u C u r,则ABCD是平行四边形 . (4)若ABCD是平行四边形,则u A uu B r u D u C uur. (5)若a r b r,b r c r,则a r c r. (6)若a r / /b r,b r / /c r则a r / /c r.其中正确的是. 结果:(4)(5) 二、向量的表示方法
(完整版)第一章原子结构与性质知识点归纳
第一章 原子结构与性质知识点归纳 山东临沂市莒南三中(276600) 张琛 山东省烟台市蓬莱四中(265602) 马彩红 2.位、构、性关系的图解、表解与例析 (1)元素在周期表中的位置、元素的性质、元素原子结构之间存在如下关系: 同位素(两个特性)
3.元素的结构和性质的递变规律 4.核外电子构成原理 (1)核外电子是分能层排布的,每个能层又分为不同的能级。 随着原子序数递增 ① 原子结构呈周期性变化 ② 原子半径呈周期性变化 ③ 元素主要化合价呈周期性变化 ④ 元素的金属性与非金属形呈周期性变化 ⑤ 元素原子的第一电离能呈周期性变化 ⑥ 元素的电负性呈周期性变化 元素周期律 排列原则 ① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除外),排成一个 纵行 周期(7个横行) ① 短周期(第一、二、三周期) ② 长周期(第四、五、六周期) ③ 不完全周期(第七周期) 性质递变 原子半径 主要化合价 元 素 周 期 表 族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④ 结 构
(2)核外电子排布遵循的三个原理: a.能量最低原理b.泡利原理c.洪特规则及洪特规则特例 (3)原子核外电子排布表示式:a.原子结构简图b.电子排布式c.轨道表示式5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法 1.先推断元素在周期表中的位置。 2.一般说,族序数—2=本族非金属元素的种数(1 A族除外)。 3.若主族元素族序数为m,周期数为n,则: (1)m/n<1时为金属,m/n值越小,金属性越强: (2)m/n>1时是非金属,m/n越大,非金属性越强;(3)m/n=1时是两性元素。
(完整版)原子结构与性质知识点总结与练习
第一章原子结构与性质 一.原子结构 1.能级与能层 2.原子轨道 3.原子核外电子排布规律 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。 能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。 说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。 (2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。 构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。换言之,
一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。比如,p3 的轨道式为或,而不是。 洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。 前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。 4. 基态原子核外电子排布的表示方法 (1)电子排布式 ①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s22s22p63s23p64s1。 ②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K :[Ar]4s1。 (2)电子排布图(轨道表示式) 每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。 如基态硫原子的轨道表示式为 二.原子结构与元素周期表 1.原子的电子构型与周期的关系 (1)每周期第一种元素的最外层电子的排布式为ns1。每周期结尾元素的最外层电子排布式除He 为1s2外,其余为ns2np6。He 核外只有2个电子,只有1个s 轨道,还未出现p 轨道,所以第一周期结尾元素的电子排布跟其他周期不同。 (2)一个能级组最多所容纳的电子数等于一个周期所包含的元素种类。但一个能级组不一定全部是能量相同的能级,而是能量相近的能级。 2.元素周期表的分区 (1)根据核外电子排布 ①分区 ②各区元素化学性质及原子最外层电子排布特点 ↑↓ ↑ ↓ ↓ ↓ ↑ ↑ ↑
高考平面向量知识点总结
高考平面向量知识点总结 16、向量:既有大小,又有方向的量. 数量:只有大小,没有方向的量. 有向线段的三要素:起点、方向、长度. 零向量:长度为0的向量. 单位向量:长度等于1个单位的向量. 平行向量(共线向量):方向相同或相反的非零向量.零向量与任一向量平行. 相等向量:长度相等且方向相同的向量. 17、向量加法运算: ⑴三角形法则的特点:首尾相连. ⑵平行四边形法则的特点:共起点. ⑶三角形不等式: a b a b a b -≤+≤+. ⑷运算性质:①交换律:a b b a +=+; ②结合律:()() a b c a b c ++=++;③00a a a +=+=. ⑸坐标运算:设()11,a x y =,()22,b x y =,则()1212,a b x x y y +=++. 18、向量减法运算: ⑴三角形法则的特点:共起点,连终点,方向指向被减向量. ⑵坐标运算:设()11,a x y =,()22,b x y =,则()1212,a b x x y y -=--. 设A 、B 两点的坐标分别为 () 11,x y , () 22,x y ,则 ()1212,x x y y AB =--. 19、向量数乘运算: ⑴实数λ与向量a 的积是一个向量的运算叫做向量的数乘,记作a λ. ①a a λλ=; ②当0λ>时,a λ的方向与a 的方向相同;当0λ<时,a λ的方向与a 的方向相反;当0λ=时,0a λ=. ⑵运算律:①()()a a λμλμ=;②()a a a λμλμ+=+;③() a b a b λλλ+=+. ⑶坐标运算:设(),a x y =,则()(),,a x y x y λλλλ==. 20、向量共线定理:向量() 0a a ≠与b 共线,当且仅当有唯一一个实数λ ,使b a λ=. 设()11,a x y =,()22,b x y =,其中0b ≠,则当且仅当12210x y x y -=时,向 b a C B A a b C C -=A -AB =B
数学必修4_第二章_平面向量知识点word版本
数学必修4第二章 平面向量知识点 2.1 平面向量的实际背景及基本概念 1. 向量:既有大小又有方向的量。 2. 向量的模:向量的大小即向量的模(长度),如,AB a uu r r 的模分别记作|AB u u u r |和||a r 。 注:向量不能比较大小,但向量的模可以比较大小。 3. 几类特殊向量 (1)零向量:长度为0的向量,记为0r ,其方向是任意的,0r 与任意向量平行, 零向量a =0r |a |=0。由于0r 的方向是任意的,且规定0r 平行于任何向量,故在有关向量平行(共线)的问题中务必看清楚是否有“非零向量”这个条件。(注意与0的区别) (2)单位向量:模为1个单位长度的向量,向量0a 为单位向量0||1a u u r 。将一个 向量除以它的模即得到单位向量,如a r 的单位向量为: ||a a e a r r r (3)平行向量(共线向量):方向相同或相反的非零向量,称为平行向量.记作a ∥b 。 规定:0r 与任何向量平等, 任意一组平行向量都可以移到同一直线上,由于向量可以进行任意的平移(即自由向量),平行向量总可以平移到同一直线上,故平行向量也称为共线向量。 数学中研究的向量是自由向量,只有大小、方向两个要素,起点可以任意选取,现在必须区分清楚共线向量中的“共线”与几何中的“共线”、的含义,要理解好平行向量中的“平行”与几何中的“平行”是不一样的。 (4)相反向量:与a 长度相等、方向相反的向量,叫做a 的相反向量。记作a r 。 关于相反向量有:① 零向量的相反向量仍是零向量, ②)(a =a ; ③ ()0a a v v v ; ④若a 、b 是互为相反向量,则 a = b ,b =a ,a +b =0 。
原子结构与性质知识点归纳
第一章原子结构与性质知识点归纳 山东临沂市莒南三中(276600) 张琛 山东省烟台市蓬莱四中(265602) 马彩红 1原子结构 电子的吸引 外) 电负性逐渐减小 电负性增大 主要化合价 正价+1到+7 负价-4到 最高正价等于族序数(F 、O 除 元素性质 金属性逐渐减弱,非金属性逐 金属性逐渐增强,非金属性逐 渐增强 渐减弱,第一电离能逐渐减小, 原 2?位、构、性 质子 核电荷 决定元素种 系的图解、表解与例析_?近似相对原子 (1原元素持中中子置、元素的性质子种素原子位原子不特下关系: 子决定主族元素的化学 原子的电子式 子结构最高正价=8- F 原子纟逐渐增多 电子层数递增,最外层电子数 相同 原子核对外 逐渐增强 逐渐减弱 -1 电离能增大, 层 :电子排 同主族:从上到下 同主族:从上 位置 电子层结构 电子层数主族序数最= 递增 外 电 T *子 及化左 核电荷数 」到下一同周期::从左至负价
核外电 1族(18〈 个) 非金属性 ②副族(第I B 族一第% B 族共七 子是分能层排 3.元素的结构和性质的递变规律 随着原子序数递增 ①原子结构呈周期性变化序数递增的顺序从左到右排列 排②原则子半径呈周期性变化层数相同的元素排成一个横行 个横行)②长周期(第四、五、六周期) 厂金属性强 元素性质 Y 主要化主族(第I A 族—第% A 族共七验标志 元素周 、-③元素主要化合价 周期,7①外层变化第同的元三周别别)除外) 性质递变^原子半径 弱判断实
电子排布表示式:a .原子结构简图 b ?电子排布式c ?轨道表示式 5.原子核外电子运动状态的描述:电子云 6 .确定元素性质的方法 1 .先推断元素在周期表中的位置。 2 .一般说,族序数一2二本族非金属元素的种数(1 A 族 除外) 3 .若主族元素族序数为 m 周期数为n 贝y : (1)m/n<1 时为金属,m/n 值越小,金属性越强: ⑵m/n>1 时是非金属,m/n 越大,非金属性越强; ⑶m/n=1时是两性元素 ⑵核外电子 排布遵循的三 个原理: a .能量最低 原 理 b .泡 利 原 理 c .洪特规则及 洪特规则特例 (3)原子核外 布的,每个能层又分为不同的能级
平面向量知识点总结归纳
平面向量知识点总结归纳 1、向量:既有大小,又有方向的量. 数量:只有大小,没有方向的量. 有向线段的三要素:起点、方向、长度. 零向量:长度为0的向量. 单位向量:长度等于1个单位的向量. 平行向量(共线向量):方向相同或相反的非零向量.零向量与任一向量平行. 相等向量:长度相等且方向相同的向量. 2、向量加法运算: ⑴三角形法则的特点:首尾相连. ⑵平行四边形法则的特点:共起点. ⑶三角形不等式:a b a b a b -≤+≤+ . ⑷运算性质:①交换律:a b b a +=+ ;②结合律:()() a b c a b c ++=++ ; ③00a a a +=+= . ⑸坐标运算:设()11,a x y = ,()22,b x y = ,则()1212,a b x x y y +=++ . 3、向量减法运算: ⑴三角形法则的特点:共起点,连终点,方向指向被减向量. ⑵坐标运算:设()11,a x y = ,()22,b x y = ,则()1212,a b x x y y -=-- . b a C B A a b C C -=A -AB =B
设A 、B 两点的坐标分别为()11,x y ,()22,x y ,则()1212,x x y y AB =-- . 4、向量数乘运算: ⑴实数λ与向量a 的积是一个向量的运算叫做向量的数乘,记作a λ . ①a a λλ= ; ②当0λ>时,a λ 的方向与a 的方向相同;当0λ<时,a λ 的方向与a 的方向相 反;当0λ=时,0a λ= . ⑵运算律:①()()a a λμλμ= ;②()a a a λμλμ+=+ ;③() a b a b λλλ+=+ . ⑶坐标运算:设(),a x y = ,则()(),,a x y x y λλλλ== . 5、向量共线定理:向量() 0a a ≠ 与b 共线,当且仅当有唯一一个实数λ,使 b a λ= . 设()11,a x y = ,()22,b x y = ,其中0b ≠ ,则当且仅当12210x y x y -=时,向量a 、 () 0b b ≠ 共线. 6、平面向量基本定理:如果1e 、2e 是同一平面内的两个不共线向量,那么对于 这一平面内的任意向量a ,有且只有一对实数1λ、2λ,使1122a e e λλ=+ .(不共线的向量1e 、2e 作为这一平面内所有向量的一组基底) 7、分点坐标公式:设点P 是线段12P P 上的一点,1P 、2P 的坐标分别是()11,x y , ()22,x y ,当12λP P =PP 时,点P 的坐标是1212,11x x y y λλλ λ++?? ?++??. 8、平面向量的数量积: ⑴() cos 0,0,0180a b a b a b θθ?=≠≠≤≤ .零向量与任一向量的数量积为0. ⑵性质:设a 和b 都是非零向量,则①0a b a b ⊥??= .②当a 与b 同向时, a b a b ?= ;当a 与b 反向时,a b a b ?=- ;22a a a a ?== 或a .③ a b a b ?≤ . ⑶运算律:①a b b a ?=? ;②()()()a b a b a b λλλ?=?=? ;③() a b c a c b c +?=?+? . ⑷坐标运算:设两个非零向量()11,a x y = ,()22,b x y = ,则1212a b x x y y ?=+ .
完整版原子结构与性质知识点总结与练习
第一章原子结构与性质 ?原子结构 1?能级与能层 加:也瓦子的总十轨ift 呈哦讳醪 mW L1+ wpFfe 詆上 各隐级上的廉「孰直養副」枳|睡緘丄宇牛 佩址」一-牛 * + b +*-r ⑴相同题上㈱子執坦能量的高低; WS 畀卩M?i 『 ② 形状相R 的尙子報说能卡的髙低: 农2令触靭…… ③ 同橋层内用状相同而伸屛方向 不同的廉了蜿ifi 的昶章和专'如 即“ 2i 如即勘道仰能楚4A 零 3. 原子核外电子排布规律 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基 轨道(能级),叫做构造原理。 J ◎⑥?金 ? ◎⑥、⑥、⑥ ⑥⑥⑥? ?i/ 能级交错:由构造原理可知,电子先进入 说明:构造原理并不是说 4s 能级比3d 能级能 量低(实际上 4s 能级比3d 能级能量高),而是指这样顺 序填充电子可以使整个原子的能量最低。 也就是说,整个原子的能量不能机械地看做是各电子所处轨道的 能量之和。 (2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量 最低原理。 构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。 换言之, 态原子的电子按右图顺序填入核外电子运动 4s 轨道,后进入3d 轨道,这种现象叫能级交错。
一个轨道里最多只能容纳两个电子, 且电旋方向相反 (用“TJ”表示),这个原理称为泡利(Pauli )原理 (4) 洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道, 洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。 即 p0、dO 、fO 、p3、d5、f7、p6、d10、f14 时,是较稳定状态。 前36号元素中,全空状态的有 4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、 15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有 10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。 4. 基态原子核外电子排布的表示方法 (1) 电子排布式 ① 用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K : 1s22s22p63s23p64s1。 ② 为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相 应稀有气体 的元素符号外加方括号表示,例如 K : [Ar]4s1。 (2) 电子排布图(轨道表示式) 每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。 如基态硫原子的轨道表示式为 帀冋戸冋河丽FW1 In 2 驶 2fi 3* 3|> 二.原子结构与元素周期表 1. 原子的电子构型与周期的关系 (1) 每周期第一种元素的最外层电子的排布式为 ns1。每周 期结尾元素的最外层电子排布式除 He 为1s2 外,其余为ns2np6。He 核外只有2个电子,只有1个s 轨道,还未出现p 轨道,所以第一周期结尾元素的 电子排布跟其他周期不同。 (2) 一个能级组最多所容纳的电子数等于一个周期所包含的元素种类。但一个能级组不一定全部是能量 相同的能级,而 是能量相近的能级。 2. 元素周期表的分区 (1)根据核外电子排布 ① 分区 这个规则叫洪特( Hund )规则。比如, f J J J fJ I f p3的轨道式为 而且自旋方向相同,
高中化学选修3知识点全部归纳(物质的结构与性质)
高中化学选修3知识点全部归纳(物质的结构与性质) 第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7。 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性. 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化. (2).元素第一电离能的周期性变化. 随着原子序数的递增,元素的第一电离能呈周期性变化: ★同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小; ★同主族从上到下,第一电离能有逐渐减小的趋势. 说明: ①同周期元素,从左往右第一电离能呈增大趋势。电子亚层结构为全满、半满时较相邻元素要大即第ⅡA 族、第ⅤA 族元素的第一电离能分别大于同周期相邻元素。Be、N、Mg、P ②.元素电离能的运用: a. 用来比较元素的金属性的强弱. I1越小,金属性越强,表征原子失电子能力强弱. b .电离能是原子核外电子分层排布的实验验证. 分析原子核外电子层结构,如某元素的I n+1?I n,则该元素的最外层电子数为n。 (3).元素电负性的周期性变化. 元素的电负性:元素的原子在分子中吸引电子对的能力叫做该元素的电负性。 随着原子序数的递增,元素的电负性呈周期性变化:同周期从左到右,主族元素电负性逐渐增大;同一主族从上到下,元素电负性呈现减小的趋势. 电负性的运用: a.确定元素类型(一般>1.8,非金属元素;<1.8,金属元素). b.确定化学键类型(两元素电负性差值>1.7,离子键;<1.7,共价键). c.判断元素价态正负(电负性大的为负价,小的为正价).
平面向量知识点及方法总结总结
平面向量知识点及方法总结总结 一、平面向量两个定理 1、平面向量的基本定理 2、共线向量定理。 二、平面向量的数量积 1、向量在向量上的投影:,它是一个实数,但不一定大于0、 2、的几何意义:数量积等于的模与在上的投影的积、三坐标运算:设,,则(1)向量的加减法运算:,、(2)实数与向量的积:、(3)若,,则,即一个向量的坐标等于表示这个向量的有向线段的终点坐标减去起点坐标、(4)平面向量数量积:、(5)向量的模:、 四、向量平行(共线)的充要条件、 五、向量垂直的充要条件、六、七、向量中一些常用的结论 1、三角形重心公式在中,若,,,则重心坐标为、 2、三角形“三心”的向量表示(1)为△的重心、(2)为△的垂心、(3)为△的内心; 3、向量中三终点共线存在实数,使得且、 4、在中若D为BC边中点则 5、与共线的单位向量是七、向量问题中常用的方法 (一)基本结论的应用
1、设点M是线段BC的中点,点A在直线BC外,则(A)8 (B)4 (C)2 (D) 12、已知和点M满足、若存在实数m使得成立,则m= A、2 B、3 C、4 D、 53、设、都是非零向量,下列四个条件中,能使成立的条件是() A、 B、 C、 D、且 4、已知点____________ 5、平面向量,,(),且与的夹角等于与的夹角,则() A、 B、 C、 D、6、中,P是BN上一点若则m=__________ 7、o为平面内一点,若则o是____心 8、(xx课标I理)已知向量的夹角为,则、 (二)利用投影定义
9、如图,在ΔABC中,,,,则= (A)(B)(C)(D 10、已知点、、、,则向量在方向上的投影为 A、 B、 C、 D、11设是边上一定点,满足,且对于边上任一点,恒有则 A、 B、 C、 D、 (二)利用坐标法 12、已知直角梯形中,//,,,是腰上的动点,则的最小值为____________、 13、(xx课标II理)已知是边长为的等边三角形,为平面内一点,的最小值是() (三)向量问题基底化 14、在边长为1的正三角形ABC中, 设则____________、 15、(xx天津理)在中,,,、若,,且,则的值为 ___________、 16、见上第11题 (四)数形结合代数问题几何化,几何问题代数化例题 1、中,P是BN上一点若则m=__________
选修3第一章原子结构与性质知识总结
第一章 原子结构与性质知识点归纳 2.位、构、性关系的图解、表解与例析 同位素(两个特性)
3.元素的结构和性质的递变规律 4.核外电子构成原理 (1)核外电子是分能层排布的,每个能层又分为不同的能级。 (2)核外电子排布遵循的三个原理: a .能量最低原理 b .泡利原理 c .洪特规则及洪特规则特例 (3)原子核外电子排布表示式:a .原子结构简图 b .电子排布式 c .轨道表示式 5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法 第二章 分子结构与性质复习 随着原子序数递增 ① 原子结构呈周期性变化 ② 原子半径呈周期性变化 ③ 元素主要化合价呈周期性变化 ④ 元素的金属性与非金属形呈周期性变化 ⑤ 元素原子的第一电离能呈周期性变化 ⑥ 元素的电负性呈周期性变化 元素周期律 排列原则 ① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除 外),排成一个纵行 周期 (7个 横行) ① 短周期(第一、二、三周期) ② 长周期(第四、五、六周期) ③ 不完全周期(第七周期) 元 素 周 期 表 族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④结 构
1、微粒间的相互作用 (2)共价键的知识结构 2.分子构型与物质性质 (1)微粒间的 相互作用 σ键 π键 按成键电子云 的重叠方式 极性键 非极性键 一般共价键 配位键 离子键 共价键 金属键 按成键原子 的电子转移方式 化学键 范德华力 氢键 分子间作用力 本质:原子之间形成共用电子对(或电子云重叠) 特征:具有方向性和饱和性 σ键 特征 电子云呈轴对称 (如s —s σ键、 s —p σ键、p —p σ键) π键 特征 电子云分布的界面对通过键轴的一个平面对称(如p —p π键) 成键方式 共价单键—σ键 共价双键—1个σ键、1个π键 共价叁键—1个σ键、2个π键 规律 键能:键能越大,共价键越稳定 键长:键长越短,共价键越稳定 键角:描述分子空间结构的重要参数 用于衡量共价键的稳定性 键参数 共 价 键
文化生活知识结构简图教案
文化生活知识结构简图教 案 Prepared on 22 November 2020
文化生活知识结构简图 一、文化概述: 文化的含义 ________________________________________________________ 文化的力量 ________________________________________________________ 文化具有普遍性: 无处不在、无时不有 文化具有多样性 文化的特点文化具有相对稳定性(传统文化) 文化具有继承性或传承性(传统文化) 文化具有民族性(传统文化) 一定的文化由一定的政治经济决定 先进的健康的____ 文化对政治经济有重要的反作用 文化与政治经济的关系落后的腐朽的____ 文化文化与经济相互交融__________________________ 文化与政治相互交融__________________________ 文化作为一种精神力量(P9页)__________ 文化对政治经济有重要的反作用(P10页)____ 文化对社会政治经济的反作用文化在综合国力竞争中(P11 页)____________ 先进文化能够为经济建设提供(P12页)______ 文化是维护国家安全的精神武器(P22页)____
文化对人的影响来自于特定的文化环境和各种文化活动 文化影响人们的交往方式和交往行为 文化影响人们的实践活动认识活动和思维活动 文化对个人的影响文化对人的影响具有潜移默化和深远持久的特点优秀文化能够丰富人的精神世界_____________________ 世界观人生观价值观是_____________________________ 人的发展和社会发展是相互结合相互促进的___________ 二、中华文化: 发展历程:见课本63页 见证:史书典籍——重要见证 ___________________ 中华文化源远流长标识:汉字——重要标识 ___________________ 原因:包容性:求同存异,兼收并蓄,意义(65页) 基本特征文学艺术 科学技术:重要标志之一 博大精深区域文化:一方水土、一方文化 民族文化(中国内部各民族) 三、文化的多样性与文化传播: 民族节日文化遗产的价值 文化遗产世界文化遗产文化的多样性含义:世界遗产的分类世界自然遗产
高中数学平面向量知识点总结及常见题型x
平面向量 一.向量的基本概念与基本运算 1向量的概念: ①向量:既有大小又有方向的量向量一般用a,b,c……来表示,或用有向线段的起点与终 点的大写字母表示,如:AB几何表示法AB , a ;坐标表示法a =xi ? yj (x, y).向量 的大小即向量的模(长度),记作| A B |即向量的大小,记作I 向量不能比较大小,但向量的模可以比较大小. ②零向量:长度为0的向量,记为0,其方向是任意的,0与任意向量平行零向量a = 0 = I a I = 0"由于0的方向是任意的,且规定0平行于任何向量,故在有关向量平行(共线) 的问题中务必看清楚是否有“非零向量”这个条件. (注意与0的区别) ③单位向量:模为1个单位长度的向量向量a0为单位向量二I a0I = 1 ④平行向量(共线向量):方向相同或相反的非零向量任意一组平行向量都可以移到同一直 线上方向相同或相反的向量,称为平行向量.记作a // b ■由于向量可以进行任意的平移(即自由向量),平行向量总可以平移到同一直线上,故平行向量也称为共线向量 ⑤相等向量:长度相等且方向相同的向量相等向量经过平移后总可以重合,记为 亠% =x2 小相等,方向相同(x「yj = (x2, y2)=」 y2 2向量加法 求两个向量和的运算叫做向量的加法t―4 ―4 设AB 二a, BC =b,贝y a + b =AB BC = AC (1)0 a a,0二a ;( 2)向量加法满足交换律与结合律; 向量加法有“三角形法则”与“平行四边形法则”: (1)用平行四边形法则时,两个已知向量是要共始点的,和向量是始点与已知向量的始点重合的那条对角线,而差向量是另一条对角线,方向是从减向量指向被减向量 (2)三角形法则的特点是“首尾相接”,由第一个向量的起点指向最后一个向量的终点的有向线段就表示这些向量的和;差向量是从减向量的终点指向被减向量的终点 当两个向量的起点公共时,用平行四边形法则;当两向量是首尾连接时,用三角形法则?向量加法的三角形法则可推广至多个向量相加: AB BC CD PQ ? QR二AR,但这时必须“首尾相连” ? 3向量的减法 ①相反向量:与a长度相等、方向相反的向量,叫做a的相反向量 记作-a,零向量的相反向量仍是零向量 关于相反向量有:(i) -(-a)=a ; (ii) a+(-a)=( - a)+ a = 0 ; (iii) 若a、b是互为相反向量, 则a=-b,b = -a,a + b=0 ②向量减法:向量a加上b的相反向量叫做a与b的差, 记作:a - b二a ? (-b)求两个向量差的运算,叫做向量的减法 ③作图法:a -b可以表示为从b的终点指向a的终点的向量(a、b有共同起点) 4实数与向量的积: ①实数入与向量a的积是一个向量,记作入a,它的长度与方向规定如下: (I) a a ;
高中数学平面向量知识点总结[1]
高中数学必修4之平面向量 知识点归纳 一.向量的基本概念与基本运算 1向量的概念: ①向量:既有大小又有方向的量向量一般用c b a ,,……来表示,或用有向线段的起点与终 点的大写字母表示,如:AB 几何表示法 AB ,a ;坐标表示法),(y x yj xi a =+= 向 量的大小即向量的模(长度),记作|AB |即向量的大小,记作|a | 向量不能比较大小,但向量的模可以比较大小. ②零向量:长度为0的向量,记为0 ,其方向是任意的,0 与任意向量平行零向量a =0 ?| a |= 由于0 的方向是任意的,且规定0 平行于任何向量,故在有关向量平行(共线) 的问题中务必看清楚是否有“非零向量”这个条件.(注意与0的区别) ③单位向量:模为1个单位长度的向量 向量0a 为单位向量?|0a |=1 ④平行向量(共线向量):方向相同或相反的非零向量任意一组平行向量都可以移到同一直 线上方向相同或相反的向量,称为平行向量记作a ∥b (即 自由向量),平行向量总可以平移到同一直线上,故平行向量也称为共线向量 数学中研究的向量是自由向量,只有大小、方向两个要素,起点可以任意选取,现在必 须区分清楚共线向量中的“共线”与几何中的“共线”、的含义,要理解好平行向量中的“平行”与几何中的“平行”是不一样的. ⑤相等向量:长度相等且方向相同的向量相等向量经过平移后总可以重合,记为b a =大 小相等,方向相同 ),(),(2211y x y x =???==?2 12 1y y x x 2向量加法 求两个向量和的运算叫做向量的加法 设,AB a BC b == ,则a +b =AB BC + =A C (1)a a a =+=+00;(2)向量加法满足交换律与结合律; 向量加法有“三角形法则”与“平行四边形法则”: (1)用平行四边形法则时,两个已知向量是要共始点的,和向量是始点与已知向量的始点重合的那条对角线,而差向量是另一条对角线,方向是从减向量指向被减向量 (2) 三角形法则的特点是“首尾相接”,由第一个向量的起点指向最后一个向量的终点的有向线段就表示这些向量的和;差向量是从减向量的终点指向被减向量的终点 当两个向量的起点公共时,用平行四边形法则;当两向量是首尾连接时,用三角形法
高中数学平面向量知识点总结82641
平面向量知识点总结 第一部分:向量的概念与加减运算,向量与实数的积的运算。 一.向量的概念: 1. 向量:向量是既有大小又有方向的量叫向量。 2. 向量的表示方法: (1)几何表示法:点—射线 有向线段——具有一定方向的线段 有向线段的三要素:起点、方向、长度 记作(注意起讫) (2)字母表示法:可表示为 3.模的概念:向量的大小——长度称为向量的模。 记作:|| 模是可以比较大小的 4.两个特殊的向量: 1?零向量——长度(模)为0的向量,记作。的方向是任意的。 注意与0的区别 2?单位向量——长度(模)为1个单位长度的向量叫做单位向量。 二.向量间的关系: 1.平行向量:方向相同或相反的非零向量叫做平行向量。 记作:∥∥ 规定:与任一向量平行 2. 相等向量:长度相等且方向相同的向量叫做相等向量。 记作:= 规定:= 任两相等的非零向量都可用一有向线段表示,与起点无关。 3. 共线向量:任一组平行向量都可移到同一条直线上 , 所以平行向量也叫共线向量。 三.向量的加法: 1.定义:求两个向量的和的运算,叫做向量的加法。 注意:;两个向量的和仍旧是向量(简称和向量) 2.三角形法则: 强调: a b c a + b A A A B B B C C a +b a + b a a b b b a a
1?“向量平移”(自由向量):使前一个向量的终点为后一个向量的起点 2?可以推广到n 个向量连加 3?a a a =+=+00 4?不共线向量都可以采用这种法则——三角形法则 3.加法的交换律和平行四边形法则 1?向量加法的平行四边形法则(三角形法则): 2?向量加法的交换律:+=+ 3?向量加法的结合律:(+) +=+ (+) 4.向量加法作图:两个向量相加的和向量,箭头是由始向量始端指向终向量末端。 四.向量的减法: 1.用“相反向量”定义向量的减法 1?“相反向量”的定义:与a 长度相同、方向相反的向量。记作 -a 2?规定:零向量的相反向量仍是零向量。-(-a ) = a 任一向量与它的相反向量的和是零向量。a + (-a ) = 0 如果a 、b 互为相反向量,则a = -b , b = -a , a + b = 0 3?向量减法的定义:向量a 加上的b 相反向量,叫做a 与b 的差。 即:a - b = a + (-b ) 求两个向量差的运算叫做向量的减法。 2.用加法的逆运算定义向量的减法: 向量的减法是向量加法的逆运算: 若b + x = a ,则x 叫做a 与b 的差,记作a - b 3.向量减法做图:表示a - b 。强调:差向量“箭头”指向被减数 总结:1?向量的概念:定义、表示法、模、零向量、单位向量、平行向量、 相等向量、共线向量 2?向量的加法与减法:定义、三角形法则、平行四边形法则、运算定律 五:实数与向量的积(强调:“模”与“方向”两点) 1.实数与向量的积 实数λ与向量a ρ的积,记作:λa ρ 定义:实数λ与向量a ρ的积是一个向量,记作:λa ρ 1?|λa ρ|=|λ||a ρ | 2?λ>0时λa ρ与a ρ方向相同;λ<0时λa ρ与a ρ方向相反;λ=0时λa ρ = 2.运算定律:结合律:λ(μa ρ)=(λμ)a ρ ① 第一分配律:(λ+μ)a ρ=λa ρ+μa ρ ② 第二分配律:λ(a ρ+b ρ)=λa ρ +λb ρ ③ 3.向量共线充要条件:
物质结构与性质知识点总结
高中化学物质结构与性质知识点总结 一.原子结构与性质. 一.认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布.
(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式.
高中平面向量知识点总结
平面向量 1、 向量的定义:既有大小又有方向的量叫向量 2、 向量的表示方法 (1)几何表示:以A 为起点,以B 为终点的有向线段记作AB u u u r ,如果有向线段AB u u u r 表示 一个向量,通常我们就说向量AB u u u r . (2)字母表示:印刷时 粗黑体字母 a , b , c …向量 手写时 带箭头的小写字母 a ,b r … 3、向量点的长度(模) 向量的大小叫做向量的长或模,记作|AB u u u r |、|a | 4、零向量:长度为0的向量,记为0 ,其方向是任意的,0 与任意向量平行 a =0 |a |=0 单位向量:模为1个单位长度的向量 向量0a 为单位向量 |0a |=1 平行向量(共线向量):方向相同或相反的非零向量称为平行向量,也叫共线向量 记作a ∥b 5、相等向量:长度相等且方向相同的向量 相等向量经过平移后总可以重合,记为b a 即大小相等,方向相同),(),(2211y x y x 21 2 1y y x x 6、 对于任意非零向量的单位向量是 . 7、向量的加法 (1)三角形法则 设,AB a BC b u u u r u u u r r r ,则a +b r =AB BC u u u r u u u r =AC u u u r 对于零向量与任意向量a 的和有a a a 00 (2)平行四边形法则 已知两个不共线的向量a ,b r ,做,AB a BC b u u u r u u u r r r ,则A 、B 、D 三点不共线,以 AB 、AD 为邻边作平行四边形ABCD ,则对角线上的向量AC u u u r =a +b r .
