硝酸盐检测方法

硝酸盐检测方法
一、目的:建立硝酸盐检测操作标准,提供人员据以遵循,以确保检测结果准确。
二、范围:本方法适用于分光光度计DR2800,检测范围0~30mg/L。
三、仪器:移液枪、分光光度计(HACH DR2800)
四、试剂:HACH硝酸盐试剂26053-45(液)、26055-46(粉剂)
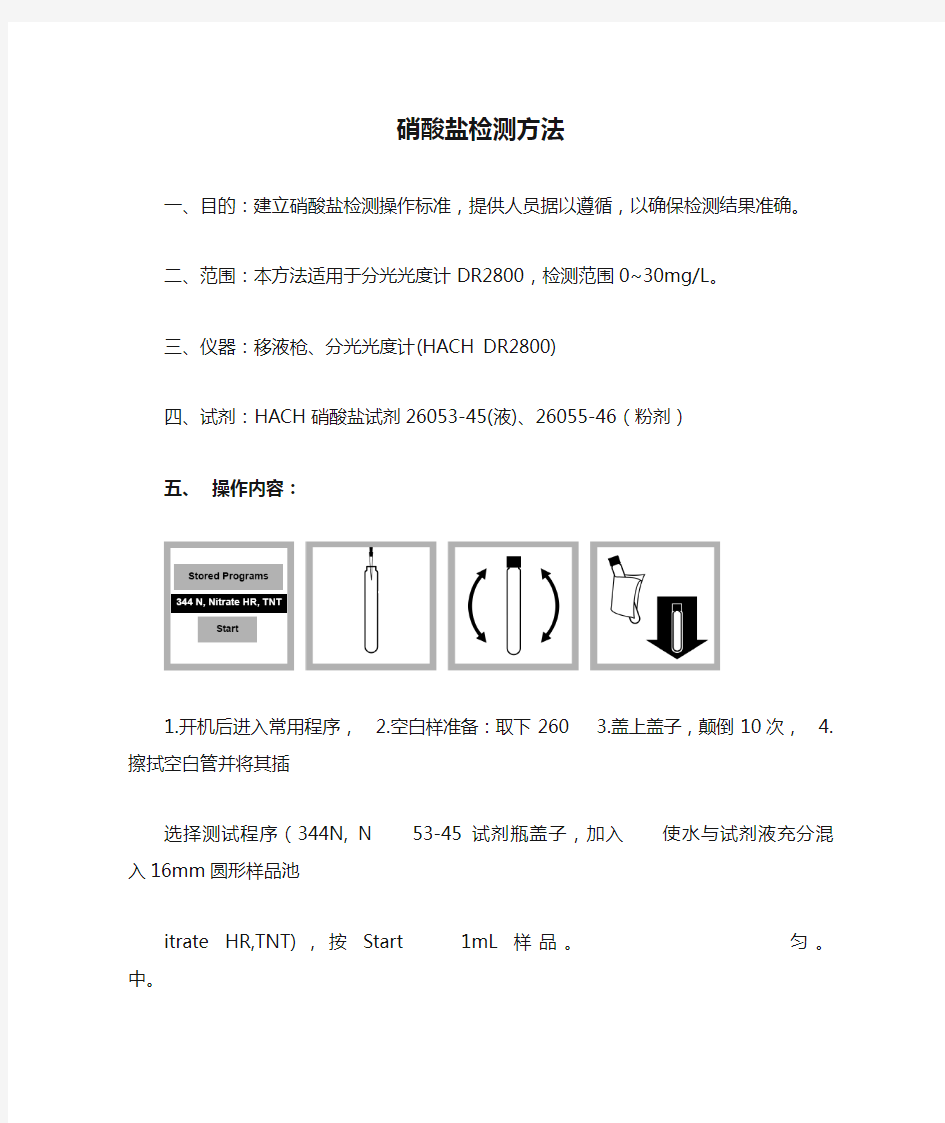
五、操作内容:
1.开机后进入常用程序,
2.空白样准备:取下260
3.盖上盖子,颠倒10次,
4.擦拭空白管并将其插选择测试程序(344N, N53-45试剂瓶盖子,加入使水与试剂液充分混入16mm圆形样品池itrate HR,TNT),按Start1mL样品。匀。中。
选择。
5.按下“Zero(零)”键
6.样品准备:剪开26055
7.盖紧盖子,颠倒10次,
8.启动仪器定时器,计时进行归零调整。这时-46试剂粉包,取出试混匀。可能会有固体反应5分钟。在反应期屏幕显示0.0mg/L 管加入其中。物无法完全溶解属正常。间切勿再颠倒试管。若NO3-N。有硝酸盐存在,溶液会
呈黄色。
9.反应到时后5分钟内,10.按“Read(读数)”键
将样品管擦拭干净,并读取结果。单位mg/L
将其放入样品池中。NO3-N。
六、注意事项
6.1本测试法对技术敏感。为了避免测试结果偏差,试验时必须每个动作都到位。
6.2颠倒试管操作细节:竖直拿好试管(盖子向上),上下颠倒试管,待所有的
液体都流向盖子一端,稍等片刻,再将试管倒回原位,待所有的液体都流到底部,这样的一个过程称为颠倒一次。
6.3 硝酸盐浓度超过30mg/L时,需对样本进行稀释。
6.4 所使用的器具需防止含硝酸盐物质的污染。
6.5 测试过程中粉料药剂需确保完全投入,无残留。
6.6每一批新的试剂都要测定试剂空白值。空白值测定与以上步骤相同,只是把
样品换成去离子水进行测试。空白值如果不是零,需调整仪器的试剂空白。
6.7 检测作业结束后将器具清洗干净归位、桌面整理好。
硝酸检测
硝酸根离子的检测,我们都经常用到,测量方法也较多,但是,到底什么时候该用什么方法呢?本文做一个简单的对比。 一、紫外分光光度法直接测量,其原理是硝酸根离子在210nm波长处有紫外吸收,并且可以用双波长法扣除有机质的干扰。下图是使用这种方法做的硝酸根标准曲线 [Abs] = K0 + K1 * [C] + K2 * [C]^2 K0 = 0.336202 K1 = 0.855646 K2 = 0.000000 R = 0.996219 Num C(mg/L) Abs 210nm 处 275nm处 1 0.50000 0.70084 0.73 886 0.03802 2 1.00000 1.22997 1 .26350 0.03353 3 1.50000 1.68886 1 .68998 0.00112 4 2.50000 2.43119 2 .46494 0.03375 该方法是在275nm和210nm处分别测量吸光度,Abs为这两个波长处的吸光度值之差。在不存在其他干扰的情况下可以使用这种方法,操作十分简便,效率高。 二、酚二磺酸法
原理:浓硫酸与酚作用生成二磺酸酚,在无水条件下二磺酸酚与硝酸盐作用生成二磺酸硝基酚,二磺酸硝基酚在碱性溶液中发生分子重排生成黄色化合物,最大吸收波长为410nm,利用其色度和硝酸盐含量成正相关的性质,可进行比色测定。 下图为标准曲线 [Abs] = K0 + K1 * [C] + K2 * [C]^2 K0 = 0.030334 K1 = 0.398435 K2 = 0.000000 R = 0.998389 Num C(mg/L) Abs 1 1.00000 0.44034 2 2.00000 0.80931 3 3.00000 1.30700 4 5.00000 1.97417 5 6.00000 2.42458 这种方法适用范围广,受干扰小。但是操作较复杂,尤其是需要制备酚二磺酸,反应为沸水浴六个小时,对实验人员的耐心和细心都是一个考验。 三、还原-显色法 原理:水样中的硝酸盐经过内装颗粒状铜-镉柱时,在一定的条件下,被还原为亚硝酸盐。还原生成的亚硝酸盐(包括水样中原有的亚硝酸盐)与对氨基苯磺酰胺重氮化,再与二盐酸-1-萘乙二胺偶合,形成玫瑰红色偶氮染料,用分光光度法测定。减去不经镉柱还原,用重氮化偶合比色法测得的亚硝酸盐,即可得出硝酸盐氮含量。 本实验室没做过这个实验。从原理上看,该法对实验设备要求较高。另外,该法可以结合流动分析仪使用,适合于批量检测。 以上三个方法中,直接比色法是最简便的检测方法,HG/T4135-2010稳定性肥料标准中使用
硝酸盐含量测定方法
硝酸盐测定 1原理 样品经沉淀蛋白质、除去脂肪后,溶液通过镉柱,或加入镉粉,使其中的硝酸根离子还原成亚硝酸根离子,在弱酸性条件下,亚硝酸根与对氨基苯磺酸重氮化后,再与N-1萘基乙二胺偶合形成红色染料,测得亚硝酸盐总量,由总量减去亚硝酸盐含量即得硝酸盐含量。 2试剂 2.1氯化铵缓冲溶液(pH9.6~9.7):同2.1。 2.2硫酸镉溶液(0.14mol/L):称取37g硫酸镉(CdSO4·8H2O),用水溶解,定容至1L。 2.3盐酸溶液(0.1mol/L):吸取8.4mL盐酸,用水稀释至1L。 2.4硝酸钠标准溶液:准确称取500.0mg于110~120℃干燥恒重的硝酸钠,加水溶解,移于500mL容量瓶中,加50mL氯化铵缓冲液,用水稀释至刻度,混匀,在4℃冰箱中避光保存。此溶液每毫升相当于1mg硝酸钠。 2.5硝酸钠标准使用液:临用时吸取硝酸钠标准溶液1.0mL,置于100mL容量瓶中,加水稀释至刻度,混匀,临用时现配。此溶液每毫升相当于10μg硝酸钠。 2.6亚硝酸钠标准使用液同2.8。 2.7镉柱: 2.7.1镉粉还原效率的测定:镉粉使用前,经盐酸浸泡活化处理,再以水洗两次,用水浸没待用。用牛角勺将镉粉加入25mL带
塞刻度试管中,至5mL刻度;用少量水封住。吸取2.0mL硝酸钠标准使用液,加入5mL氯化铵缓冲液。盖上试管塞,振摇2min,静止5min,用漏斗颈部塞有少量脱脂棉的小漏斗过滤,滤液定量收集于50mL容量瓶中,用15mL水少量多次地洗涤镉粉,洗液与滤液合并。加5mL乙酸(60%)后,立即加10mL显色剂,加水稀释至刻度,混匀,暗处置25min。用1cm比色杯,以标准零管调节零点,于550nm波长处测吸光度,根据亚硝酸盐标准曲线计算还原效率。 2.7.2计算 式中:X2——还原效率,%; 20——硝酸盐的质量,μg; m3——20μg硝酸盐还原后测得亚硝酸盐的质量,μg; 1.232——亚硝酸盐换算成硝酸盐的系数。 3分析步骤 3.1样品处理 称取约10.00g(粮食取5g)经绞碎混匀样品,置于打碎机中,加70mL水和12mL氢氧化钠溶液(20g/L),混匀,用氢氧化钠溶液(20g/L)调样品pH=8,定量转移至200mL容量瓶中加10mL硫酸锌溶液,混匀,如不产生白色沉淀,再补加2~5mL氢氧化钠,混匀。置60℃水浴中加热10min,取出后冷至室温,加水至刻度,混匀。放置0.5h,用滤纸过滤,弃去初滤液20mL,收集滤液备用。 3.2测定(用镉粉法还原硝酸盐为亚硝酸盐)
食品中亚硝酸盐测定实验
实验4 食品中亚硝酸盐测定(盐酸萘乙二胺法) 一、实验原理 制品中加入的亚硝酸盐产生的亚硝基与肌红蛋白反应,生产色泽鲜红的亚硝基肌红蛋白,使肉制品有美观的颜色。同时亚硝酸盐也是一种防腐剂,可抑制微生物的增殖。由于蛋白质代谢产物中仲胺基与亚硝酸反应能够生成具有很强毒性和致癌性的亚硝胺,因此,亚硝酸盐的使用量及在制品中的残留量均应按标准执行。亚硝酸盐的测定方法主要是重氮偶合比色法,此外可与荧光胺偶合,测定其荧光吸收强度,或衍生后用气相色谱法测定。 自样品中抽提分离出亚硝酸盐,亚硝酸盐在酸性条件下,与对氨基苯磺酸发生重氮化反应生成重氮盐,此重氮盐再与盐酸2—萘乙二胺试剂发生偶合反应,生成紫红色偶氮化合物。其颜色的深度与样品种亚硝酸含量成正比,故可比色测定。 二、试剂和器材 ①饱和硼砂溶液:5g硼酸钠溶于100mL热的重蒸水中,冷却备用。 ②亚铁氰化钾溶液:称取106g亚铁氰化钾溶于水,并稀释至1000mL。 ③乙酸锌溶液:称取220g乙酸锌,加30mL冰醋酸溶于水,并稀释至1000mL。 ④果蔬抽提液:溶解50g氯化汞和50g氯化钡于1000mL重蒸水中,用浓盐酸调整到pH值为1。 ⑤氢氧化铝乳液:溶解125g硫酸铝于1000mL重蒸水中,滴加氨水使氢氧化铝全部沉淀。用蒸馏水反 复洗涤,真空抽滤,直至洗液分别用氯化钡溶液检验不发生浑浊。取下沉淀物,加适量重蒸水使之呈薄糨糊状,捣拌均匀备用。 ⑥%对氨基苯磺酸溶液:称取对氨基苯磺酸,溶于100mL20%的盐酸溶液中,闭关保存。 ⑦%盐酸萘乙二胺溶液:称取盐酸萘乙二胺,溶于100mL重蒸水中。 ⑧亚硝酸钠标准溶液(5微克每毫升):精确称取亚硝酸铵,以重蒸水定容到500mL。再吸取此溶液25mL, 以重蒸水定容到1000mL,此工作液每毫升含亚硝酸钠5微克。 分光光度计,组织捣碎机。 三、试验步骤 1、样品处理 果蔬类样品用组织捣碎机打浆。称取适量浆液(视式样中硝酸盐含量而定,如青刀豆取10g,桃子、菠萝取30g),置于500mL容量瓶中。加200mL水,摇匀,再加100mL果蔬抽提液。震荡1h,加L氢氧化钠溶液40mL,用重蒸水定容后立即过滤。然后取60mL滤液于100mL容量瓶中,加氢氧化铝液至刻度。用滤纸过滤,滤液应为无色透明。
水质亚硝酸盐氮的测定分光光度法
水质亚硝酸盐氮的测定分光光度法
水质亚硝酸盐氮的测定分光光度法 本标准等效采用ISO 6777-1984《水质亚硝酸盐氮测定分子吸收分光光度法》。 本标准根据我国标准的格式对ISO 6777-1984标准技术上稍作修改和补充。 1 适用范围 本标准规定了用分光光度法测定饮用水、地下水、地面水及废水中亚硝酸盐氮的方法。 1.1 测定上限 当试份取最大体积(50ml)时,用本方法可以测定亚硝酸盐氮浓度高达0.20mg/L。 1.2 最低检出浓度 采用光程长为10mm的比色皿,试份体积为50ml,以吸光度0.01单位所对应的浓度值为最低检出限浓度,此值为0.003mg/L。 采用光程长为30mm的比色皿,试份体积为50ml,最低检出浓度为0.001mg/L。 1.3 灵敏度 采用光程长为10mm的比色皿,试份体积为50ml时,亚硝酸盐氮浓度cN=0.20mg/L,给出的吸光度约为0.67单位。 1.4 干扰 当试样pH≥11时,可能遇到某些干扰,遇此情况,可向试份中加入酚酞溶液(3.12)1滴,边搅拌边逐滴加入磷酸溶液(3.4),至红色刚消失。经此处理,则在加入显色剂后,体系pH值为1.8±0.3,而不影响测定。 试样如有颜色和悬浮物,可向每100ml试样中加入2ml氢氧化铝悬浮液(3.9),搅拌,静置,过滤,弃去25ml初滤液后,再取试份测定。 水样中常见的可能产生干扰物质的含量范围见附录A。其中氯胺、氯、硫代硫酸盐、聚磷酸钠和三价铁离子有明显干扰。 2 原理 在磷酸介质中,pH值为1.8时,试份中的亚硝酸根离子与4-氨基苯磺酰胺 (4-aminobenzenesulfonamide)反应生成重氮盐,它再与N-(1-萘基)-乙二胺二盐酸盐 [N-(1-naphthyl-1,2-diaminoethane dihydrochlo-ride]偶联生成红色染料,在540nm波长处测定吸光度。 如果使用光程长为10mm的比色皿,亚硝酸盐氮的浓度在0.2mg/L以内其呈色符合比尔定律。 3 试剂 在测定过程中,除非另有说明,均使用符合国家标准或专业标准的分析纯试剂,实验用水均为无亚硝酸盐的二次蒸馏水。 3.1 实验用水 采用下列方法之一进行制备: 3.1.1 加入高锰酸钾结晶少许于1 L蒸馏水中,使成红色,加氢氧化钡(或氢氧化钙)结晶至溶液呈碱性,使用硬质玻璃蒸馏器进行蒸馏,弃去最初的50ml馏出液,收集约700ml不含锰盐的馏出液, 待用。 3.1.2 于1 L蒸馏水中加入硫酸(3.3)1ml、硫酸锰溶液[每100ml水中含有36.49硫酸锰(MnSO4·H2O)]0.2ml,滴加0.04%(V/V)高锰酸钾溶液至呈红色(约l~3ml),使用硬质玻璃蒸馏器进行蒸馏,弃去最初的50ml馏出液,收集约700ml不含锰盐的馏出液,待用。 3.2 磷酸:15mol/L,ρ=1.70g/ml。 3.3 硫酸:18mol/L,ρ=l.84g/ml。 3.4 磷酸:1+9溶液(1.5mol/L)。
亚硝酸盐的检验实验报告
泡菜中亚硝酸盐的检验 实验组长:陈佶 实验组员:郝吴双石行健丁逸苇吴纪轩吕志轩 实验日期:11月23日 ~ 12月6日 实验准备(资料查阅): 心得体会: 这是我们第一次进行食品分析与检验实验课程。实验内容是食品中亚硝酸盐含量的测定。在这其中我学会了用盐酸萘乙二胺测量亚硝酸含量的基本操作技术,拓展了视野,无论将来我是否会从事生物方面的工作,这都将是我的一笔宝贵财富。 感谢老师耐心的讲解,使得我们对实验的各项要求目的都有了明确的掌握。但由于水平有限,实验报告中定有纰漏错误,请老师不吝赐教!
一、前言 “亚硝酸盐”这一名词对我们来说并不陌生,这是一类无机化合物的总称。主要指亚硝酸钠,这是一种白色至淡黄色粉末或颗粒状,味微咸,易溶于水。其外观及滋味都与食盐相似,并在工业、建筑业中广为使用,肉类制品中也允许作为发色剂限量使用。由亚硝酸盐引起食物中毒的机率较高。食入0.3~0.5克的亚硝酸盐即可引起中毒甚至死亡。 我们通过实验测定了泡菜中不同时期的亚硝酸盐的含量,这不仅是一次美妙的实践,更为我们的生活提供了指南,让我真真正正的接触到了这个平时只出现在报道上的奇妙物质。 二、实验原理 泡菜的制作离不开乳酸菌,乳酸菌是厌氧细菌,在无氧的情况下,将葡萄糖分解成乳酸。这其中也生成了一定量的的亚硝酸盐。 在盐酸酸化条件下,亚硝酸盐与对氨基苯磺酸发生重氮化反应后,与N-1-萘基乙二胺盐酸盐结合形成玫瑰色染料。将显色反应后的样品与已知浓度的标准液进行目测比较,可以大致估算出泡菜中亚硝酸盐的含量。 三、设备及试剂 泡菜坛、蔬菜、三角瓶、量筒、烧杯、pH试纸、玻璃棒、微量可调移液器、试管、亚硝酸盐含量的测定试剂盒。
实验 肉制品中亚硝酸盐的测定
实验肉制品中亚硝酸盐的测定 (盐酸萘乙二胺法) 一、目的与要求: 1.熟练掌握样品制备、提取的基本操作技能。 2.明确与掌握盐酸萘乙二胺比色法测定亚硝酸盐的基本原理及操作方法。 二、原理: 样品经沉淀蛋白质,除去脂肪后,在弱酸条件下亚硝酸盐与对氨基苯磺酸重氮化后,生成的重氮化合物,再与盐酸萘乙二氨偶合形成紫红色染料,此“染料”颜色的深浅与亚硝酸盐的含量成正比,其最大吸收波长为538nm ,可以测定吸光度并与标准比较定量。反应式如下:见教材P316 1.重氮化反应: 2.偶合反应: 三、样品、试剂与仪器 样品:品名: 厂家: 试剂: 1.蛋白质沉淀剂(公用) (1)饱和硼砂溶液:称取5克硼酸钠(Na2B07·10H20),溶于100毫升热水中,冷却 后备用。 (2) 亚铁氰化钾溶液:称取10.6克亚铁氰化钾[K4Fe9(CN)5.3H2O],溶于水后,稀释至 100毫升。 乙酸锌溶液:称取11g Zn(CHCOO)2 .2H2O加1.5mL冰乙酸,溶于水定容50mL。 2.显色剂 (1)0.4%对氨基苯磺酸溶液:称取0.4克对氨基苯磺酸,溶于100毫升20%的盐酸 中,避光保存。100ml/4组 ()0.2%盐酸萘乙二胺溶液:称取0.2克盐酸萘乙二胺,溶于100毫升重蒸馏水中, 避光保存。 100ml/4组 3.亚硝酸钠标准原液:精密称取0.1000克于硅胶干燥器中干燥24小时的亚硝酸钠, 加水溶解移入500毫升容量瓶中,并稀释至刻度。此溶液每毫升相当于200微克亚 硝酸钠。 4.亚硝酸钠标准使用液(5μg NaNO2/ml):临用前,吸取亚硝酸钠标准溶液 5.00毫升, 置于200毫升容量瓶中,加重蒸馏水稀释至刻度,此溶液每毫升相当于5μg亚硝 酸钠。亚硝酸钠标准原液由教师提供。 5.1:4盐酸 配制显色剂1用,每4组100ml。 仪器: 1. 小型绞肉机。 2. 721分光光度计。 3.25ml比色管每组7支 四、操作方法: 1.样品处理: 称取5.0克经绞碎混匀的样品,置于50毫升干洁的小烧杯中,加入12.5毫升饱和硼砂溶液,以玻璃棒搅拌均匀,以70℃左右的重蒸馏水约300毫升分数次将样品全部洗入500毫升容量瓶中。(此容量瓶专用)
水中硝酸盐氮的测定
水中硝酸盐氮的测定——紫外分光光度法 一、实验目的 1、熟悉并掌握紫外分光光度计的原理及使用方法 2、学习运用紫外分光光度法测定水中的NO3-N。 二、实验原理 硝酸盐中的氮称为硝酸盐氮,水中的有机氮、氨氮、亚硝酸盐氮和硝酸盐氮等几项指标的相对含量,在一定程度上反映了含氮有机物存在于水体的时间长短,从而对探讨水体污染历史、它们的分解趋势和水体自净情况有一定的参考价值。 在紫外光谱区,硝酸根有强烈的吸收,其吸收值与硝酸根的浓度成正比。 在波长210-220nm处,可测定其吸光度。 水中溶解的有机物,在波长220及275nm下均有吸收,而硝酸根在275nm 时没有吸收。这样,需在275nm处作一次测定,以校正硝酸根的吸光度。 三、主要仪器 紫外分光光度计;石英比色皿。 四、主要试剂 (1)盐酸溶液(c(HCl)=l mol/L):量取浓盐酸83mL,用蒸馏水稀释至1000mL; (2)硝酸根标准贮备溶液(100mg/L):准确称取在105~110℃烘干1h的硝酸钾0.1631g,溶于蒸馏水中,定容至1000mL。 (3)硝酸根标准溶液(10mg/L):取硝酸根标准贮备溶液(2)10.0mL于100mL 容量瓶中,用蒸馏水定容。 五、实验步骤 (1)待测水样前处理: 取25ml待测水样加入到50ml容量瓶中,加入盐酸溶液(l mol/L)1mL,用蒸馏水稀释至刻度,摇匀。 (2)空白样前处理: 取25ml无氨水加入到50ml容量瓶中,加入盐酸溶液1mL,用蒸馏水稀释至刻度。 (3)标准液前处理:
向7支50ml容量瓶中分别加入硝酸根标准溶液(10mg/L)1.0,2.0,4.0,10.0,15.0,20.0,40.0mL,各加入盐酸溶液1mL,用蒸馏水稀释至刻度。7支容量瓶中的NO3-N的质量分别为10,30,40,100,150,200,400 μg。 (4)分光光度计测定: ?标准液吸光度的测定,分别在220nm与275nm波长处测定7支装有不同浓度标准液和空白样溶液的吸光度,并且按照下列式进行校正: As=As220-2As275 Ab=Ab220-2Ab275 Ar=As-Ab 其中As220为标准溶液在220nm的吸光度,As275为标准溶液在275nm的吸光度,Ab220为空白液在220nm的吸光度,Ab275为空白液在275nm的吸光度。(s-standard,b-blank) ?按照每支标准溶液比色管中溶液的吸光度Ar和所含NO3-N质量绘制标准曲线。 ?按照同样方法测定水样的吸光度Ax。 (5)水样硝酸盐氮的计算: 得到水样的吸光度Ax,根据标准曲线找到Ax所对应的硝酸盐氮质量m,然后按下式计算水样硝酸盐氮: C N = m/V 其中,C为水样中的硝酸盐氮含量,m为根据标准曲线得出的水样硝酸盐氮质量,V为水样的测定体积,本操作取25ml(具体数值与水样添加值一致)。
亚硝酸盐氮测定方法
亚硝酸盐氮测定方法 关键词:生活饮用水,亚硝酸盐氮,测定 水中亚硝酸盐氮含量的多少是了解水污染程度的重要指标,况且亚硝酸盐氮被公认为是潜在的致癌物质,人体摄入过高可使血液中的变性蛋白增加。在《国家标准生活饮用水卫生规范》中亚硝酸盐氮被列为常规检测项目。因此,在日常水质亚硝酸盐氮的检测中,其检测结果的准确性、及时性显得尤为重要。 水中亚硝酸盐氮的测定方法国标采用重氮偶合分光光度法,不仅需要消耗大量的标准溶液、标准样品和试剂,而且极为费时,特别是当测定的水样较多时,采样后如不及时测定,检测人员难以及时判断水质污染程度及水体净化情况。通过查阅大量相关资料,对国标法进行适当改进。本文通过分光光度法和比色法测定水中亚硝酸盐氮,经过一年多的实验及大量检测数据证实:比色法测定水中亚硝酸盐氮具有仪器便宜、操作方便、成本低、检测时间短。精密度、准确度在误差允许范围之内。在紧急情况和平常可以代替分光光度法测定水中亚硝酸盐氮。 一、分光光度法 测定原理 在pH1.7以下,水中亚硝酸盐与氮基苯磺酰胺重氮化,再与盐酸N-(1萘)-乙二胺产生偶合反应。生成紫红色的偶氮染料。 1、方法依据 《生活饮用水标准检验方法》GB/T5750-2006 2、测定范围 本法用重氮偶合分光光度法测定生活饮用水及其水源水中的亚硝酸盐氮。 本法适用于测定生活饮用水及其水源水中亚硝酸盐氮的含量。 水中三氯胺产生红色干扰。铁,铅等离子可能产生沉淀,引起干扰。铜离子起催化作用,可分解重氮盐使结果偏低,有色离子干扰,也不应存在。 3、试剂 (1)氢氧化铝悬浮液 称取125g硫酸铝钾[KAl(SO4)2.12H2O]或硫酸铝铵[NH4Al(SO4)2.12H2O]溶于1000mL纯水中。加热至60oc,缓缓加入55mL氨水(ρ20=0.88g/mL)。使氢氧化铝沉淀完全。充分搅拌后静置,弃取上清液。用纯水反复洗涤沉淀,至倾出上清液中不含氯离子(用硝酸银溶液试验)。然后加入300mL纯水成悬浮液,适应前振摇均匀。 (2)对氨基苯磺酰胺溶液:(10g/L) (3)盐酸N-(1萘)-乙二胺溶液(1.09g/L) (4)亚硝酸盐氮标准储备液[ρ(NO2-_N)=50μg/mL]: 称取0.2463g在玻璃干燥器内放置24h的亚硝酸钠(NaNO2),溶于纯水中,并定容至1000mL。每升加2mL氯仿保存(本试剂剧毒)。 (5)亚硝酸盐氮标准使用液[ρ(NO2-_N)=0.1μg/mL]: 取10.00mL标准储备液于容量瓶中,用纯水定容至500mL。再从中吸取10mL,用纯水于容量瓶中定容至100mL。 (6)仪器
硝酸盐的测定
硝酸盐 硝酸盐是由硝酸衍生的化合物的总称。硝酸盐是离子化合物,含有硝酸根离子NO3—和另一正离子,如硝酸铵中的NH4+离子。由金属离子和硝酸根离子组成的化合物,重要的有:硝酸钠、硝酸钾、硝酸铵、硝酸钙、硝酸铅、硝酸铈等。如:AgNO3(银离子和硝酸根离子),Zn(NO3)2(锌离子和硝酸根离子)……都是硝酸盐。NaNO3(钠离子和硝酸根离子)只是“硝酸盐”的一种。硝酸盐极易溶于水,所以溶液中硝酸根不与其他阳离子反应。 硝酸盐测定方法的比较: 表1 水中硝酸盐测定方法的比较 酚二磺酸分光光度法 1、试剂 (1)酚二磺酸:称25g苯酚置于500mL锥形瓶中,加150mL浓硫酸使之溶解,再加75mL发烟硫酸(含13%三氧化硫)。充分混合。瓶口插一小漏斗,小心置瓶于沸水中加热2h,得淡棕色稠液,贮于棕色瓶中,密塞保存。
(2)硝酸盐氮标准贮备溶液:称取0.7218g经105—110℃干燥后的硝酸钾(KNO3)溶于水中,移入1000mL容量瓶,稀释至标线,混匀。加2mL三氯甲烷作保存剂,至少可稳定6个月。每毫升该标准储备液含0.1000mg硝酸盐氮。(3)硝酸盐氮标准使用溶液(10mg/L):吸取50.0mL硝酸盐氮标准贮备液,置蒸发皿内,加0.1mol/L氢氧化钠溶液使调至pH=8,在水浴上蒸发至干。加入少量水,移入500mL容量瓶中,稀释至标线,混匀。贮于棕色瓶中,此溶液至少稳定6个月。(注:本标准溶液应同时制备两份,用以检查硝化完全与否。如发现浓度存在差异时,应重新吸取标准贮备液进行制备。) (4)硫酸银溶液:1.00g/L (5)氢氧化铝悬浮液:将125g硫酸铝[KAl(SO4)2·12H2O]或硫酸铝铵[NH4Al(SO4)2·12H2O]溶于1000mL蒸馏水,加热至60℃,然后边搅拌边加入55mL氨水。放置约1h后,移至大瓶中,反复洗涤沉淀物,直至洗涤液中不含氯离子为止。 2、采样 水样中硝酸盐的测定,应在采样后尽快进行。如不能及时测定,为了抑制微生物活动的影响,应于每升水样中加入0.8mL浓硫酸,并于4℃保存。测定前用氢氧化钠中和。 3、测定步骤 (1)标准曲线的绘制:分别吸取一组硝酸盐氮标准使用液与一组50mL比色管中,用以配制系列标准溶液,将各比色管加入至约40mL,加3mL氨水使呈碱性,稀释至标线,混匀。在波长410nm处,以水为参比,测量吸光度。 将上述测得的吸光度减去空白后,绘制吸光度对硝酸盐氮的标准曲线。 (2)水样的预处理:水样混浊或带色时,可取100mL水样将其加2mL氢氧化铝悬浮液震荡,静置,过滤,弃去20mL初滤液。 水样中含有氯离子,则可用硫酸银沉淀后过滤去除。 水样中含有亚硝酸盐,则可先将亚硝酸盐氧化成硝酸盐,然后从硝酸盐氮的测定结果中减去亚硝酸盐氮的含量。 (3)样品的测定:取50.0mL经过预处理的水样于蒸发皿中,用pH试剂检查水样呈微碱性(pH=8),否则调节之;置水浴上蒸发至干。加1.0mL酚二磺酸,用玻璃棒研磨,使试剂与蒸发皿残渣充分接触,放置片刻,再研磨一次,放置
实验六 食品中亚硝酸盐含量测定
实验食品中亚硝酸盐含量测定 (格里斯试剂比色法) (—)目的 熟悉食品中亚硝酸盐的卫生标准,掌握食品中亚硝酸盐含量测定的基本方法。 (二)原理 样品经沉淀蛋白质、除去脂肪后,在弱酸性条件下亚硝酸盐与对氨基苯磺酸重氮化后,在与N-1-萘基乙二胺偶合形成紫红色染料后,与标准比较定量。(三)试剂 实验用水为蒸馏水,试剂不加说明者,均为分析纯试剂。 1.氯化胺缓冲液lL容量瓶中加入500ml水,准确加人20.0ml盐酸,振荡混匀,准确加入50ml氢氧化铵,用水稀释至刻度。必要时用稀盐酸和稀氢氧化铵调试至pH9.6~9.7。 2.0.42mol/L硫酸锌溶液称取120g硫酸锌(ZnSO4·7H20),用水溶解并稀释至1000ml。 3. 20g/L氢氧化钠溶液称取20g氢氧化钠用水溶解,稀释至1L。 4. 对氨基苯磺酸溶液称取10g对氨基苯磺酸,溶于700ml水和300ml冰乙酸中,置棕色瓶中混匀,室温保存。 5. 0.1%N-1-萘基乙二胺溶液称取0.lg N-1-荼基乙二胺,加60%乙酸溶解并稀释至100ml,混匀后,置棕色瓶中,在冰箱中保存,一周内稳定。 6. 显色剂临用前将0.1%N-1-萘基乙二胺溶液和对氨基苯磺酸溶液等体积混合。 7. 亚硝酸钠标准溶液准确称取250.0mg于硅胶干燥器中干燥24h的亚硝酸钠,加水溶解移入500ml容量瓶中,加100ml氯化胺缓冲液,加水稀释至刻度,混匀,在4℃避光保存。此溶液每毫升相当于500ug的亚硝酸钠。 8.亚硝酸钠标准使用液临用前,吸取亚硝酸钠标淮溶液1.00ml,置于100ml容量瓶中,加水稀释至刻度,此溶液每毫升相当于5.0ug亚硝酸钠。(四)仪器 1.小型粉碎机
硝酸盐氮的测定(紫外分光光度法)
中华人民共和国行业标准 硝酸盐氮的测定 (紫外分光光度法) SL84—1994 Determination of nitrogen (nitrate) (Ultraviolet spectrophtometric method) 水利部1995/05/01批准1995/05/01实施 1 总则 1.1主题内容 本标准规定了用紫外分光光度法测定水中的硝酸盐氮。 1.2 适用范围 本方法适用于清洁地面水和未受明显污染的地下水中硝酸盐氮的测定,其最低检出浓度为0.08mg/L,测量上限为4mg/L硝酸盐氮。 1.3干扰及消除溶解的有机物、表面活性剂、亚硝酸盐、六价铬、溴化物、碳酸氢盐和碳酸盐等干扰测定,需进行适当的预处理。本法采用絮凝共沉淀和大孔中性吸附树脂进行处理,以去除水样中大部分常见有机物、浊度和Fe3+、Cr6+对测定的干扰。 2 方法原理 利用硝酸根离子在220nm波长处的吸收而定量测定硝酸盐氮。溶解的有机物在220nm处和275nm处均有吸收,而硝酸根离子在275nm处没有吸收。因此,在275nm处作另一次测量,以校正硝酸盐氮值。 3仪器
3.1紫外分光光度计。 3.2离子交换柱(?1.4cm,装树脂高5~8cm)。 3.3常用实验设备。 4 试剂 4.1氢氧化铝悬浮液:溶解125g硫酸铝钾[KAl(SO4)2·12H2O]或硫酸铝铵[NH4Al(SO4)2·12H2O]于1000mL水中,加热至60℃。然后边搅拌边缓缓加入55mL浓氨水。放置约1h后,移至一个大瓶中,用倾泻法反复洗涤沉淀物,直到该溶液不含铵离子为止。最后加300mL纯水成悬浮液。使用前振荡均匀。 4.2硫酸锌溶液:10%(m/V)。 4.3氢氧化钠溶液:C(NaOH)=5mol/L。 4.4大孔型中性树脂:CAD/40或XAD/2型及类似型号树脂。 4.5甲醇。 4.6盐酸溶液:C(HCl)=1mol/L(盐酸系优级纯)。 4.7氨基磺酸(H2NSO3H)溶液:0.8%(m/V),避光保存于冰箱中。 4.8硝酸盐氮标准溶液:C(NO3-N)=100mg/L。 将0.7218g经105~110℃干燥2h的硝酸钾(KNO3)溶于水中,移入1000mL容量瓶,用水稀释至标线,混匀。加2mL氯仿作保存剂,至少可稳定6个月。每毫升此标准溶液含0.100mg硝酸盐氮。 5 步骤 5.1水样预处理: 5.1.1吸附柱制备:新的树脂先用200mL去离子水分两次洗涤,用甲醇(4.5)
食品中亚硝酸盐的检测方法
食品中亚硝酸盐的检测方法 方法一:亚硝酸盐快速检测管使用说明: 方法原理:按照国标GB/T 做成的速测管,与标准色卡比较定量。 操作方法: 1. 食盐中亚硝酸盐的快速检测及食盐与亚硝酸盐的快速鉴别:用袋内附带小勺取食盐1平勺,加入到检测管中,加入蒸馏水或纯净水至1ml刻度处,盖上盖,将固体部分摇溶,10分钟后与标准色板对比,该色板上的数值乘上10即为食盐中亚硝酸盐的含量mg/ kg,(国标规定食盐(精盐)中亚硝酸盐的限量卫生标准应≤2 mg/kg)。当样品出现血红色且有沉淀产生或很快退色变成黄色时,可判定亚硝酸盐含量相当高,或样品本身就是亚硝酸盐。 2. 液体样品检测:直接取澄清液体样品1ml加入到检测管中,盖上盖,将试剂摇溶,10分钟后与标准色板对比,找出与检测管中溶液颜色相同的色阶,该色阶上的数值即为样品中亚硝酸盐的含量mg/L(以NaNO2计)。(牛乳及豆浆也可直接检测,结果不得超过L ,有颜色的液体样品可加入一些活性炭脱色过滤后测定)。 3. 固体或半固体样品检测:取粉碎均匀的样品或至10ml比色管中,加蒸馏水或去离子水(纯净水)至刻度,充分震摇后放置,取上清液(或过滤或离心得到的上清液)加入到检测管中,盖上盖,将试剂摇溶,10分钟后与标准色板对比,该色板上的数值乘上10即为样品中亚硝酸盐的含量mg/ kg,L(以NaNO2计)。如果测试结果超出色板上的最高值,可定量稀释后测定,并在计算结果时乘上稀释倍数(如从10ml比色管中取出转入另一支10ml比色管中,加水至刻度,从中取加入到检测管中测定,测试结果乘上100(倍稀释)即为样品中亚硝酸盐的含量。 方法二:通过镀铜镉粒将硝酸盐还原为亚硝酸盐,并测其吸光度来计算牛奶中硝酸盐与亚硝酸盐含量的方法,可以检测市售牛乳中硝酸盐和亚硝酸盐。 方法三:检测硝酸盐有试纸条法,检测亚硝酸盐可应用硝酸根与无水对氨基苯磺酸重氮化再与奈胺偶合呈紫红色染料,根据颜色深浅来判定牛奶中亚硝酸盐的含量。但是两种方法准确度低,因而该方法还不够完善。 方法四:光度法 测定亚硝酸盐占据了重要的地位目前,光度法测定亚硝酸盐的方法除经典的格里斯试剂比色法及其改良法外,又有一些报道如催化(褪色)光度法流动注射系统-分光光度法顺序注射系统-分光光度法导数光度法等分光光度法主要有3种:可见分光光度法、紫外分光光度法、红外分光光度法。 方法五:示波极谱法 示波极谱分析法是指在特殊条件下进行电解分析以测定电解过程中所得到的电流- 电压曲线来做定量定性分析的电化学方法示波极谱法是新的极谱技术之一,该方法的优点是灵敏度高适用范围广检出限低和测量误差小等优点示波极谱法的原理是将样品经沉淀蛋白质去除脂肪后,在弱酸条件下亚硝酸盐与对氨基苯磺酸重氮化后,在弱碱性条件下再与8-羟基喹啉偶合成染料,该偶合染料在汞电极上还原产生电流,电流与亚硝酸盐浓度成线性关系,可与标准曲线定量在示波极谱仪上采用三电极体系,即以滴汞电极为工作电极,饱和甘汞电极为参比电极,铂电极为辅助电极进行测定测定时要注意显色条件的严格控制8- 羟基喹啉
泡菜制作和亚硝酸盐含量测定
泡菜制作和亚硝酸盐含量的检测 实验教案 学院 班级 姓名 学号 课程名称 上交日期
泡菜制作和亚硝酸盐含量的检测 授课学生:普通高中高三学生 授课类型:实验授课 一、教学目标 1.了解泡菜制作的原理、方法,尝试制作泡菜; 2.在泡菜制作过程中,深入理解乳酸菌的作用机理。 3.尝试用比色法测定泡菜中亚硝酸盐的含量变化,讨论与此相关的食品安全问题。 二、学情分析 泡菜,古称,是指为了利于长时间存放而经过的。泡菜历史悠久,流传广泛,几乎家家会做,人人吃,甚至在筵席上也要上几碟泡菜。班级中有相当一部分同学来自城市,对泡菜的制作工艺缺乏一定的了解,但是对这古老的制作工艺有着浓厚的兴趣,在老师的带领下,动手动脑,会积极主动去获取新知识。而对于来自农村的孩子,对泡菜制作有着一定的了解,但是对泡菜的制作原理的相关知识的了解程度低。通过对泡菜制作原理以及技术的学习,学生能够锻炼理论结合实际的能力,加强对日常生活的关注程度。 三、教学重难点 教学重点:制作泡菜并测定泡菜中亚硝酸盐含量; 教学难点:泡菜中亚硝酸盐含量的测定 本次实验的重点为泡菜的腌制,亚硝酸盐含量的测定只要求知道原理,具体操作视学校具体情况而定。 四、课时安排 2课时(制作泡菜和亚硝酸盐含量测定) 五、任务安排 1.课前以学习小组形式调查泡菜的种类,了解泡菜的制作原理与方法,做好准备; 2.第1课时,组织学生制作泡菜; 3.第2课时,分小组实验,测定泡菜中亚硝酸盐的含量
泡菜的制作 课时安排:1学时 (一)实验原理 乳酸菌是异养厌氧型,属于原核生物,是能从葡萄糖或乳糖的发酵过程中产生乳酸的细菌的统称,常见的乳酸菌包括乳酸链球菌和乳酸杆菌,后者可用于制作酸奶。乳酸菌在无氧条件下进行无氧呼吸葡萄糖分解成乳酸,使泡菜呈现酸味。 泡菜发酵过程的时间、温度、食盐的用量等都需要适合,温度过高、食盐用量不足10%、腌制时间过短,容易造成细菌大量繁殖,亚硝酸盐含量增加。 泡菜的发酵过程可以分为发酵前期、发酵中期、发酵后期。 发酵前期:蔬菜刚入坛时,表面带入的微生物,主要是以不抗酸的大肠杆菌和酵母菌等较为活跃,它们进行异型乳酸发酵和微弱的酒精发酵,产生较多的乳酸、酒精、醋酸和二氧化碳等,二氧化碳以气泡从水槽内放出,逐渐使坛内形成厌氧状态。此时乳酸菌和乳酸的量比较少,为泡菜初熟阶段,菜质咸而不酸、有生味。 发酵中期:由于前期乳酸的积累,pH 下降,厌氧状态形成,乳酸杆菌开始活跃,此时乳酸积累量可以达到%~%,pH 降至。大肠杆菌、酵母菌、霉菌等的活动受到抑制。这一期为完全成熟阶段,泡菜有酸味且清香品质最好。 发酵后期:乳酸积累达%以上时,乳酸杆菌的活性受到抑制,发酵速度逐渐变缓甚至停止。 实验流程示意图表现如下: (二)实验材料、试剂及用具 原料加工 修整、洗涤、晾晒、切形 冲洗 盐水冷却 泡菜盐水 加入调味料装坛 发酵 成品 测定亚硝酸盐含量
水体中硝酸盐含量检测
本科生毕业论文 水体中硝酸盐含量的检测研究 蔡友锋 院系:环境与生命科学系 专业:环境工程 班级: 072 学号: 710302216 指导教师:胡文英 职称(或学位):讲师 二零一一年五月
原创性声明 本人郑重声明:所呈交的论文(设计),是本人在导师的指导下,独立进行研究工作所取得的成果。除文中已经注明引用的内容外,本论文(设计)不含任何其他个人或集体已经发表或撰写过的作品成果。对本论文(设计)的研究做出重要贡献的个人和集体,均已在文中以明确方式标明。本人完全意识到本声明的法律结果由本人承担。 学生签名:年月日 指导声明 本人指导的同学的毕业论文(设计)题目大小、难度适当,且符合该同学所学专业的培养目标的要求。本人在指导过程中,通过网上文献搜索及文献比对等方式,对其毕业论文(设计)内容进行了检查,未发现抄袭现象,特此声明。 指导教师签名:年月日
目录 1 试验部分 (2) 1.1主要仪器和试剂 (2) 1.2试验方法 (2) 2结果与讨论 (3) 2.1方法还原率与曲线回归 (3) 2.2盐度对水体中硝酸盐还原率影响 (3) 2.3反应条件对水体中硝酸盐还原率的影响 (4) 2.4锌卷用量对水体中硝酸盐还原率影响 (5) 2.5海水中硝酸盐标准曲线 (5) 3水样中硝酸盐含量的测定 (6) 4结论 (6) 致谢 (7) 参考文献 (7) 附录 (8)
水体中硝酸盐含量的检测研究 蔡友锋 (环境与生命科学系指导教师:胡文英) 摘要:水体中硝酸盐通过锌-镉还原剂还原为亚硝酸盐,利用分光光度法采用磺胺和盐酸萘乙 二胺重氮偶氮(B.R)法对亚硝酸盐测定。试验同时研究多种测定硝酸盐含量的还原剂,通过 一系列试验验证选择最佳还原剂,并确定该还原剂最佳反应条件。 关键词:还原剂;硝酸盐;亚硝酸盐;紫外分光 Abstract:Nitrate in water is reduced nitrite by zinc-cadmium reductant, which by used spectrophotometry, trimethoprim-sulfamethoxazole and hydrochloric acid naphthalene ethylenediamine diazotization azo (B.R) method to determine content of nitrate. At the same time the test researched various determ ine content of nitrate reductant, through a series of tests to choose the best reductant, and determine the best reaction conditions of the reductant. Key words:reductant; Nitrate; Nitrite; Ultraviolet spectrophotometry 硝酸盐广泛存在于自然界中,其主要来源是固氮菌固氮形成,或在闪电高温下空气中的氧气与氮气直接反应化合成氮氧化物,溶在雨水形成硝酸,再与地面的矿物反应生成硝酸盐[1]。固体硝酸盐加热时能分解放出氧,其中比较活泼的金属的硝酸盐仅仅放出一部分氧而形成亚硝酸盐,其余大部分金属的硝酸盐,则是分解为金属的氧化物、二氧化氮和氧[2,3]。并且硝酸盐在高温时是强氧化剂,水溶液几乎没有氧化作用。 人为带进大自然的硝酸盐主要来自于各种化肥工业的排放和各种化肥的施用,海水中硝酸盐部分来源是由汇入河流中溶解的工业化肥硝酸盐。 硝酸盐对人体的影响在于硝酸盐在胃和肠道中可还原为亚硝酸盐.摄取过量的硝酸盐可导致人体活动迟钝,工作能力减退,头晕,昏迷;一次用量过大甚至可以导致死亡。这种盐能够抑制细胞的呼吸作用,使血液中乳酸,胆固醇,白血球的数量增多,蛋白质的数量减少;在同血红蛋白相互作用下,亚硝酸盐形成化合物——红铁血红蛋白,这种化合物能堵塞氧气输送,使人觉得呼吸困难,最后导致死亡[4,5]。所以,水体中硝酸盐的检测具有十分重要的意义。 本文采用紫外分光光度法测定水体中硝酸盐的含量,水体中硝酸盐还原为亚硝酸盐,亚硝酸盐采用磺胺和盐酸萘乙二胺重氮偶氮(B.R)法测定。B.R检测法的基本原理是在一定的酸度条件下,亚硝酸盐和磺胺发生反应生成重氮,反应5min以后加入盐酸萘乙二胺与重氮化合物偶联生成红色偶氮化合物,静置显色15min后测定。再应用紫外分光法测定亚硝酸盐含量测定来确定硝酸盐的含量。丰富了用紫外分光光度法对硝酸盐的测定方法,着重讨论各种反应条件对硝酸盐还原率的影响,选择效果最佳的还原
实验二食品中亚硝酸盐含量的测定
实验二 肉质品中亚硝酸盐含量的测定(比色法) 一、 原理和目的 (一)原理: 样品经沉淀蛋白质,除去脂肪后,在弱酸条件下,亚硝酸盐与对氨基苯磺酸重氮化,再与盐酸萘乙二胺偶合形成紫红色染料,其最大吸收波长为550 nm ,可测定吸光度并与标准比较定量。反应式如下 (二)目的: 我国是农业大国,化肥的大量使用主要造成了食品中硝酸盐的污染。硝酸盐进入人体,产生直接毒害和慢性毒害,因此硝酸盐的检测具有特别重要的意义。此试验是应用比色发来进行硝酸盐的检测。 二、试剂 (1) 氯化铵缓冲溶液,pH9.6~9.7:1L 容量瓶中加入500ml 水,准确 加入20.0ml 盐酸溶液,摇匀。准确加入50ml 氢氧化铵,用水稀释 至刻度,必要时用稀盐酸和稀氢氧化铵调pH 至所需范围。 (2) 0.42mol/l 硫酸锌溶液:称取120g 硫酸锌(ZnSO4·7H2O ),用水 溶解,稀释至1L 。 (3) 20g/l 氢氧化钠溶液:称取20g 氢氧化钠,用水溶解,稀释至1L 。 (4) 对氨基苯磺酸溶液:称取10g 对氨基苯磺酸,溶于700ml 水和300ml 冰乙酸中,置棕色试剂瓶中混匀,室温贮存。 (5) 1g/L 盐酸萘乙二胺溶液:称取0.1g 盐酸萘乙二胺,加100ml60%乙 酸溶解混匀后,置棕色试剂瓶中,在冰箱贮存,一周内稳定。 (6) 显色剂:临用前将1g/L 盐酸萘乙二胺和对氨基苯磺酸溶液等体积 混合,临用现配,仅供一次使用。 (7) 亚硝酸钠标准贮备液:精密称取250.0mg 于硅胶干燥器干燥24h 的 亚硝酸钠,加水溶解移入500ml 容量瓶中,加100ml 氯化铵缓冲溶 液,加水稀释至刻度,混匀,在4℃避光贮存。此溶液每毫升相当 于500μg 的亚硝酸钠。 (8) 亚硝酸钠标准使用液:准确吸取亚硝酸钠标准贮备液,稀释100倍, 临用现配,此溶液每毫升相当于5μg 的亚硝酸钠。 三、仪器:小型铰肉机,分光光度计,组织捣碎机,恒温水浴 四、操作步骤 (1)样品处理:准确称取10.0g 经铰碎混匀的样品,置于组织捣碎机中,加70ml 水和12ml20g/L 氢氧化钠溶液,打碎,混匀,测试样品溶液的pH ,转移至200ml 容量瓶中,加10ml 硫酸锌溶液,混匀,在60℃水浴中加热10min 。取出,冷至室温,稀释至刻度,混匀,过滤,弃去初滤液20ml ,收集滤液待测。 NO 22H +SO 3H H 2N N N +SO 3H NHCH 2CH 2NH 22.H Cl -2HCl SO 3H N N NHCH 2CH 2NH 2-H 2O +++紫红色染料
亚硝酸盐氮的测定(N-(1-萘基)-乙二胺分光光度法)
亚硝酸盐氮得测定(N-(1-萘基)-乙二胺分光光度法): 亚硝酸盐就是氮循环得中间产物,不稳定,根据水环境条件,可被氧化成硝酸盐,也可被还原成氨。亚硝酸盐可使人体正常得血红蛋白(地铁血红蛋白)氧化成为高铁血红蛋白,发生高铁血红蛋白症,失去血红蛋白在体内输送氧得能力,出现组织缺氧得症状。亚硝酸盐可与仲胺类反应生成具致癌性得亚硝胺类物质,在PH 值较低得酸性条件下,有利于亚硝胺类得形成。 水中亚硝酸盐得测定方法通常采用重氮-偶联反应,使生成红紫色染料。方法灵敏、选择性强。所用重氮与偶联试剂种类较多,最常用,前者为对氨基苯磺酰胺与对氨基苯磺酸,后者为N-(1-萘基)-乙二胺与a-萘胺。此外,还有目前国内外普遍使用得离子色谱法与新开发得气相分子吸收法。这两种方法虽然须使用专用仪器,但方法简便、快速,干扰较少。 亚硝酸盐在水中可受微生物等作用而很不稳定,在采集后应尽快进行分析,必要时冷藏以抑制微生物得影响。 1、实验原理 在磷酸介质中,pH1、8±0、3时,亚硝酸盐与对-氨基苯磺酰胺反应,生成重氮盐,再与N-(1-萘基)-乙二胺偶联生成红色染料。在540nm波长处有最大吸收。 2、干扰及消除 氯胺、氯、硫代硫酸盐、聚磷酸钠与高铁离子有明显干扰。水样呈碱性(PH>11)时,可加酚酞溶液为指示剂,滴加磷酸溶液至红色消失。水样有颜色或悬浮物,可加氢氧化铝悬浮液并过滤。 3、方法得适用范围 本方法适用于饮用水、地表水、地下水、生活污水、与工业废水中亚硝酸盐得测定。最低检出浓度为0、003mg/L;测定上限为0、20mg/L亚硝酸盐氮、 4、仪器 分光光度计 5、试剂 实验用水均为不含亚硝酸盐得水 1)无亚硝酸盐得水:于蒸馏水中加入少许高锰酸钾晶体,使呈红色,再加氢氧化钡(或氢氧化钙)使呈碱性。置于全玻璃蒸馏器中蒸馏,弃去50ml初馏液,收集中间约70%不含锰得馏出液。亦可于每升蒸馏水中加1ml浓硫酸与0、2ml硫酸 锰溶液(每100ml水中含36、4gMnSO 4、H 2 O),JIARU 1~3ml0、04%高锰酸钾溶液至 呈红色,重蒸馏。 2)磷酸密度=1.70g/ml。
蔬菜中硝酸盐含量的测定(精)
蔬菜中硝酸盐含量的测定 摘要 :基于硝酸根在 219 nm处有强烈吸收 , 且干扰少 , 测定提取液的吸光度, 从标准曲线上查得相应浓度。提取液用 pH=9.6-9.7的氨缓冲液,从待测样品中提取硝酸根离子。此法测定的结果表明回收率在 95.1%-100.9%之间 , 相对标准偏差为1.55%-4.14%。操作方法简便 , 适用于蔬菜中的硝酸盐含量的测定。 关键词:蔬菜 ; 硝酸盐 ; 紫外分光光度法 前言:蔬菜 ( 尤其叶菜类是一种容易累积硝酸盐的作物,硝酸盐含量超标已成为影响蔬菜品质的重要因素之一。由于当前我国蔬菜在种植过程中化肥过量施用 , 而且有些蔬菜生产者采用工业废水和生活污水浇地 , 造成许多蔬菜中硝酸盐含量过 高 , 已证明 , 硝酸盐在人体内经微生物作用可被还原为有毒的亚硝酸盐 , 它可与人体血红蛋白作用 , 使之失去载氧功能 , 造成高铁血红蛋白症 , 长期摄入硝酸盐会造成智力迟钝等危害 [ 1]。因此 , 蔬菜中硝酸盐的含量可作为衡量亚硝酸盐对人体潜在危害的一个指标 [ 2]。 蔬菜硝酸盐含量的测定方法很多,如镉柱还原分光光度法、离子色谱法。其中镉柱还原分光光度法为检测蔬菜中硝酸盐含量的国家标准方法 , 但由于干扰因素多, 操作步骤过于繁琐, 很难满足批量常规分析之需要,而其它几种方法则需要精密仪器, 测定条件较为严格,不适宜作常规监测分析 [3]。本实验采用操作简单、准确度高 的紫外分光光度法测定蔬菜中硝酸盐含量。 1 实验仪器与材料 1.1 主要仪器与试剂 1.1.1仪器 紫外分光光度计 ; 容量瓶;乳钵 1 .1.2试剂
①氨缓冲液(pH=9.6~9.7:2ml 浓盐酸加入 50ml 蒸馏水中,混合后再加入 5ml 浓 氨水, 最后用蒸馏水稀释至 100ml 。②粉末状活性炭(除去待测样品中的色素。③蛋白质沉淀剂Ⅰ,蛋白质沉淀剂Ⅱ (除去蛋白质及混浊物。④溶液Ⅰ:15克铁氰化 钾 (K3Fe(CN6 溶于 50ml 蒸馏水中, 定容于 100ml 。⑤溶液Ⅱ:30g 硫酸锌 (ZnSO4 溶于 60ml 蒸馏水中,定容于 100ml 。⑥硝酸盐标准液:称 0.722g 在 110℃条件下烘 干的 KNO3用蒸馏水溶解后定容至 1000ml 。此溶液为 100ug/ml标准贮液,放入冰 箱内保存。 1.1.3样品材料 京白菜 (Brassica campestris L. ssp. chinensis (L. Makino. var. communis Tsen et Lee、小瓜(Cucurbita moschata、胡萝卜 (Daucus carota 、莲花白 (Brassica oleracea L. var.capitata 、土豆 (Solanum tuberosum L 、黄瓜 (Cucumis sativus Linn. (以上各蔬 菜均在昆明蒜村农贸市场购买,产地昆明茨坝,高海拔的冬天摘取。 2 实验方法 2.1 标准曲线的绘制 依次配制 NO 浓度为 0.4ug/ml, 0.8ug/ml, 1.2ug/ml, 1.6ug/ml, 2.0ug/ml, 2.4ug/ml, 2.8ug/ml的溶液,以重蒸馏水做空白,用石英比色皿在 219nm 处测定吸光度(A 。以 标准溶液浓度为横坐标, 吸光度为纵坐标绘制标准曲线。如图 2, 得回归方程为 A = 0 . 00919 +0 . 0596C,相关系数 r = 0 . 9996( n = 5。
