贝曲沙班杂质列表-标准品
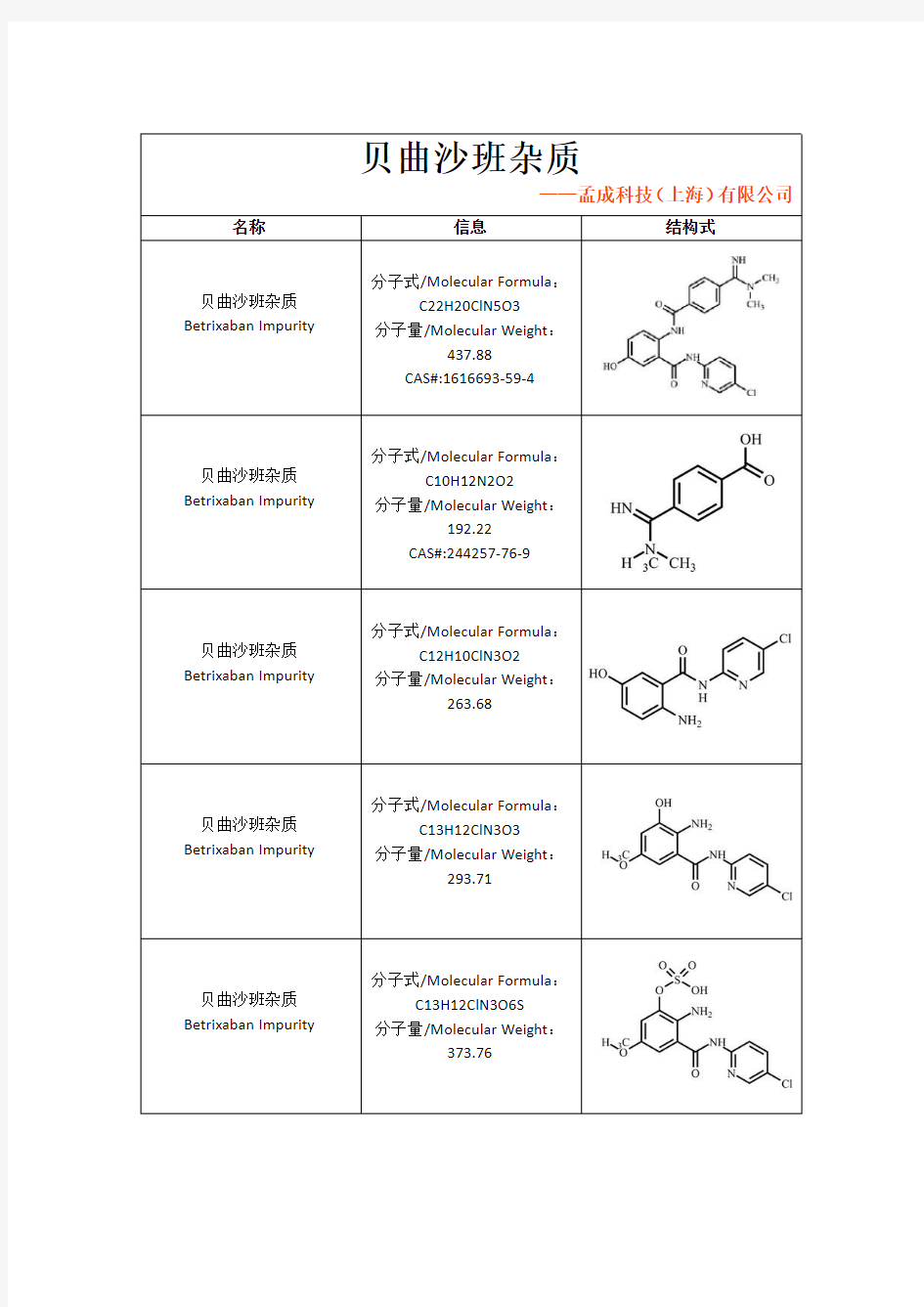
贝曲沙班杂质
——孟成科技(上海)有限公司
名称信息
结构式贝曲沙班杂质Betrixaban Impurity
分子式/Molecular Formula :
C22H20ClN5O3
分子量/Molecular Weight :
437.88
CAS#:1616693-59-4贝曲沙班杂质
Betrixaban Impurity 分子式/Molecular Formula :C10H12N2O2
分子量/Molecular Weight :
192.22
CAS#:244257-76-9
贝曲沙班杂质
Betrixaban Impurity 分子式/Molecular Formula :C12H10ClN3O2
分子量/Molecular Weight :
263.68
贝曲沙班杂质
Betrixaban Impurity 分子式/Molecular Formula :C13H12ClN3O3
分子量/Molecular Weight :
293.71
贝曲沙班杂质
Betrixaban Impurity 分子式/Molecular Formula :C13H12ClN3O6S
分子量/Molecular Weight :
373.76
HPLC法测定盐酸左氧氟沙星片的含量
HPLC法测定盐酸左氧氟沙星片的含量 摘要:目的:对HPLC及UV测定盐酸左氧氟沙星片的含量进行比较。方法:高效液相色谱法选择色谱柱为Agilent C18 (150 mm×4.6 mm,5 μm),流动相为醋酸铵高氯酸钠溶液(pH=2.2)-乙腈(85:15),流速为1.0mL·min-1,检测波长为294nm;紫外分光光度法选择294nm波长测定含量.结果:HPLC法中盐酸左氧氟沙星片在2.05ug·mL-1 ~51.15ug·mL-1范围内线性关系良好.回归方程Y =523247X-23331(r=0.9995),加样回收率平均值为100.36%,RSD 1.8%。结论:HPLC法及紫外分光光度法均准确性、重复性高、精密度好,可考虑将紫外分光光度法作为盐酸左氧氟沙星含量测定的替代方法使用。 关键词:高效液相法;紫外分光光度法;盐酸左氧氟沙星 左氧氟沙星是氧氟沙星的L-型光学活性异构体,因其抗菌谱广、抗菌作用强、不良反应率较低,而被广泛使用[1]。2015版药典推荐高效液相法来分析本品及其相关剂型,考虑到基层药物监测机构尚不能完全普及高效液相设备[2],本文对比分析高效液相法及紫外分光光度法测定盐酸左氧氟沙星含量。 1 材料 1.1 仪器与试药 岛津LC-20A (改为LC-2010CHT)型高效液相色谱仪;岛津UV-2501(改为UV-2450)型紫外分光光度计;超声波清洗器;乙腈由国药集团化学试剂有限公司提供(改为霍尼韦尔贸易(上海)有限公司提供),为色谱醇;磷酸、醋酸铵、高氯酸钠均为分析纯;盐酸左氧氟沙星对照品(美国西格玛公司,批号:160122)(中国食品药品检定研究院,批号:130455-20116);盐酸左氧氟沙星片(四川科伦药业股份有限公司)。 2 方法 2.1 高效液相法 2.1.1 色谱条件[2] 色谱柱选择Agilent C18 (150 mm×4.6 mm,5 μm),,流动相:醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH值至2.2)-乙腈(85:15),检测波长:294 nm, 进样量10μl,1.0 mL/min流速,柱温为室温(25℃)。 2.1.2 溶液的制备 2.1.2.1 供试品溶液的制备 精密称取20片盐酸左氧氟沙星,研细后混合均匀,精密称取上述供试品50mg置于50ml 容量瓶中,加入0.1mol/l盐酸溶解适量并定量稀释至刻度,经微孔滤膜(0.45um)过滤,取续滤液待用。 2.1.2.2 对照品溶液的制备 精密称取盐酸左氧氟沙星对照品10.23mg于100ml容量瓶中,用适量0.1mol/l盐酸稀释至刻度,摇匀即得。 2.1.3 方法学考察 2.1. 3.1 精密度试验 在“2.1.1”项色谱条件下,对照品溶液过0.45um滤膜后重复进样6次,每次10ul,分别测定峰面积,并计算6组数据所得的相对标准偏差RSD,结果为1.7%<2.0%,符合药典规定,提示,本组方法精密度良好。 2.1. 3.2 重复性试验 选择同批号盐酸左氧氟沙星片6份,精密称定后,根据供试品“2.1.2.1”项操作制备供试品溶液,采用“2.1.1”项色谱条件,进样10ul,采集6份样品的色谱图,计算溶液的相对标准偏差RSD = 1.3% (小于2.0%),符合标准规定,提示本组方法具有较好的重复性。 2.1. 3.3 稳定性试验
瑞戈非尼杂质标准品对照品产品详情对照表
产品信息: 中文名:瑞戈非尼杂质A 英文名:Regorafenib impurity A 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质B 英文名:Regorafenib impurity B 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质C 英文名:Regorafenib impurity C 规格:25mg和50mg 纯度大于99% 随货提供COA H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质D 英文名:Regorafenib impurity D 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质E 英文名:Regorafenib impurity E 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 基本信息: 产品ID117412 产品中文名称瑞戈非尼 产品英文名称Regorafenib 产品中文异名瑞格非尼; 产品英文异名Stivarga; CAS号755037-03-7 分子式C21H15ClF4N4O3
用于经标准治疗依然发生转移的结直肠癌患者。获批时间:9月(美国) 相关信息: 拜耳(Bayer)于2014年7月30日宣布,抗癌药Stivarga(regorafenib,瑞戈非尼)获欧盟委员会(EC)批准,用于既往经2种酪氨酸激酶抑制剂【格列卫(Gleevec,通用名:imatinib,伊马替尼),索坦(Sutent,通用名:sunitinib,舒尼替尼)】治疗后病情恶化或不耐受的不可切除性或转移性胃肠道间质瘤(GIST)患者的治疗。此前,Stivarga已于2013年8月获欧盟批准用于转移性结直肠癌(mCRC)的治疗。 Stivarga GIST新适应症的获批,是基于关键III期GRID研究的数据。数据显示,与安慰剂+最佳支持疗法(BSC)相比,Stivarga+BSC组合疗法使无进展生存期(PFS)取得了统计学意义的显著改善(4.8个月vs0.9个月,p<0.0001)。 目前,Stivarga已获美国、欧盟、日本批准,用于转移性结直肠癌(mCRC)的治疗。同时,该药已获美国和日本批准用于治疗胃肠道间质瘤(GIST)。Stivarga是FDA批准的第三个治疗胃肠道间质瘤(GIST)的药物,另2个药物为诺华的格列卫(Gleevec)、辉瑞的索坦(Sutent)。 胃肠道间质瘤(GIST)是癌细胞发生在胃肠道的一种肿瘤,患者多为老年人。GIST,由于其极具侵略性的特点,目前依然是尚未满足的医疗需求,同时治疗的选择也很有限,相关临床研究数据表明,Stivarga有望为那些经标准治疗后复发的患者提供一种重要的治疗方案。 Stivarga是一种口服多激酶抑制剂,在临床前研究中,regorafenib能够抑制数个促血管生成VEGF受体酪氨酸激酶,这些激酶在肿瘤的血管生成中发挥着重要作用。该药还可以抑制癌和肿瘤微环境中的多种激酶,包括VEGFR1-3,KIT,RET,PDGFR及FGFR。Stivarga由拜耳开发,由拜耳和Onyx制药联合推广。
培美曲塞二钠
培美曲塞二钠 培美曲塞二钠,Pemetrexed disodium;Alimta.生产厂家:济南中科一通化工有限公司 中文化学名:N-[4-[2-(2-氨基-4,7-二氢-4-氧代-1H-吡咯[2,3-d]嘧啶-5-基)乙基]苯甲酰]-L-谷氨酸二钠 英文化学名:N-[4-[2-(2-amino-4,7-dihydro-4-oxo-1H-pyrrolo[2,3-d]pyrimidin-5-yl)ethyl]benzoyl]-L-glutamic acid disodium salt 结构式: 分子式:C20H19N5Na2O6 分子量:471.37 用途:治疗非小细胞肺癌的二线药物 质量标准:企标,含量99%以上 药品介绍 【作用机制】 Alimta是一种抗叶酸代谢的抗肿瘤药物,它通过干扰细胞复制过程中叶酸依赖性代谢过程而发挥作用。体外试验显示,Alimta可以抑制胸苷酸合成酶、二氢叶酸还原酶、甘氨酸核糖核苷甲酰基转移酶等叶酸依赖性酶,这些酶参与胸腺嘧啶核苷和嘌呤核苷的生物合成。 【药代动力学】 主要经尿清除。在肾功能正常的患者(肌苷清除率为90 ml/min),Alimta的系统清除率为91.8 ml/min。与顺铂、叶酸、维生素B12联合应用时不影响Alimta的药代动力学。 特殊人群: 在26至80岁之间,未发现年龄对Alimta的代谢有影响。无儿童相关资料。药物代谢无性别差异。肝功能障碍者,升高的AST、ALT、胆红素不影响Alimta的代谢。 【适应症】 Alimta联合顺铂一线治疗不可切除的恶性胸膜间皮瘤。单药二线治疗非小细胞肺癌。 【禁忌症】 Alimta禁用于有严重培美曲唑过敏史的患者 【不良反应】 主要不良反应为骨髓抑制,表现为中性粒细胞减少症、血小板减少症和贫血。还有发热、感染、口腔炎/咽炎、皮疹/脱皮。对怀孕妇女可影响胎儿。培美曲塞二钠项目推荐报告 一、项目简介: 培美曲塞二钠 (一)简介 中文名称:培美曲塞二钠
氨磷汀相关杂质
相关杂质整理列表 中文名英文名CAS 号规格纯度结构式 氨磷汀杂质1(氨 磷汀二硫化物)Amifostine Impurity 1(Amifostine Disulfide)10027-65-310mg-25mg-50mg-100mg ≥99% 氨磷汀杂质2(氨 磷汀硫醇)Amifostine Impurity 2(Amifostine Thiol)14653-77-110mg-25mg-50mg-100mg ≥99% 氨磷汀杂质3Amifostine Impurity 3N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质4Amifostine Impurity 4N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质5Amifostine Impurity 5N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质6Amifostine Impurity 6N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质7Amifostine Impurity 7N/A 10mg-25mg-50mg-100mg ≥99%
湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD 、LGC 、TLC 、EP 、USP 、TRC 等多个品牌产品,提供上万种标准品 对照品,真诚为您服务。 氨磷汀杂质8Amifostine Impurity 8N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质9Amifostine Impurity 9N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质10Amifostine Impurity 10N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质11Amifostine Impurity 1123545-42-810mg-25mg-50mg-100mg ≥99%
培美曲塞二钠市场分析
培美曲塞二钠市场情况汇总 培美曲塞二钠(Alimta,商品名力比泰)是礼来公司推出的一种抗癌新药,2004年2月被美国FDA批准与顺铂联用治疗一种罕见的癌症——恶性胸膜间皮瘤,同年10月FDA又以快速审批的方式批准培美曲塞二钠作为局部晚期肺癌或转移性非小细胞肺癌的二线治疗药物,2004年销售额就达1.4亿多美元。目前,培美曲塞二钠已在全球60多个国家和地区上市。剂型及规格:原料药、粉针;200mg、500mg。 一、目前国内制剂生产厂家: 山东凤凰制药厂(500mg)国药准字 美国礼来公司(500mg)商品名:力比泰 南京东捷药业(500mg)商品名:捷佰立 江苏豪森药业(200mg)商品名:普来乐 上海克隆生物(500mg)商品名:怡罗泽 齐鲁制药(200mg)商品名:赛珍 山西泰盛药业(500mg)国药准字H20080249 广州白云山明星制药国药准字H20110059 德州德药(500mg)国药准字H20080230 深圳海王药业有限公司国药准字H20110055 陕西亚宝药业国药准字H20080169 江苏奥赛康药业国药准字H20080230 二、国内原料药生产厂家进入GMP认证阶段的有以下几家: 苏州立新制药有限公司 2011-10-2 连云港润众制药有限公司 2011-7-28 南京先声东元制药有限公司 2011-5-3 重庆医药工业研究院有限责任公司2011-5-11(主要是以技术转让为主) 齐鲁制药有限公司(补充审批)(主要自用为主) 北京协和药厂 2011-2-10(补充审批) 德州德药制药有限公司2011-1-17(一直没有生产) 山西普德药业有限公司 2010-8-3 连云港杰瑞药业有限公司(目前正在项目论证) 三、国内已经拿到批文的原料药厂家: 深圳海王药业有限公司制证完毕-已发批件广东省EL765851575CS(主要自用) 江苏奥赛康药业有限公司制证完毕-已发批件江苏省EK037137673CS(主要自用) 南京亚东启天药业有限公司制证完毕-已发批件江苏省EH144000735CN(主要自用) 江苏豪森药业股份有限公司制证完毕-已发批件江苏省EW866921134CN(主要自用、国产制剂销量第一) 南京制药厂有限公司已发批件江苏省EW600708904CN 南京东捷药业有限公司制证完毕-已发批件江苏省ED130942147CS 北京思普润安医药科技有限公司已发批件北京市EU411058492CN 江苏吴中苏药医药开发有限责任公司已发批件江苏省EU179516269CN
设计方案(左氧氟沙星)
盐酸左氧氟沙星片 人体相对生物利用度及生物等效性试验 临床研究方案 华中科技大学同济医学院临床药理研究所 华中科技大学同济医学院国家药品临床研究基地 2004年3月
前言 左氧氟沙星(Levofloxacin)又称可乐必妥、利复星、左氧沙星、Cravit、CVFX,由日本Daiichi(第一制药株式会社)公司开发研制;1993年1月在日本首次上市。国内首次注册时间是1995年,注册号为:X950251。 【药理作用】左氧氟沙星是消旋氧氟沙星的左旋体,其抗菌活性是氧氟沙星的2倍。本品作用于细菌的DNA旋转酶(拓扑异构酶II),通过抑制DNA旋转酶的活性来阻碍DNA复制,从而杀灭细菌;它还可以溶解细菌的部分结构。本品对包括厌氧菌在内的革兰氏阳性菌和阴性菌具有广谱抗菌作用,对葡萄球菌、肺炎球菌、淋球菌、化脓性链球菌、溶血性链球菌、肠球菌、大肠杆菌、克雷白氏杆菌、绿脓杆菌、变形杆菌等显示有较强的抗菌活性。另外,本品对衣原体、支原体也有抗菌作用。 【体内过程】左氧氟沙星口服吸收迅速、完全,生物利用度接近100%,同服食物不影响吸收。口服后能迅速有效地渗透到全身,在组织或体液中地药物浓度高于血浆浓度。健康成人单剂量口服本品50、100、200mg后,血浆药物浓度达峰时间为0.9~2.4h,峰浓度分别为0.6、1.2、2.0μg/ml,表观分布容积为1.09~1.26L/kg。本品在体内几乎不代谢,血浆半衰期为4.3~6.0h,在口服24h内,用药剂量的80%~85%以原形从尿液中排泄。 【用法用量】(1)口服:每次0.1~0.2g,每日2~3次,疗程为3~7天。用于淋病治疗时,可单剂量顿服0.4~0.6g。(2)静脉滴注:每次0.2~0.3g,每日2次。 【不良反应】本品的不良反应与氧氟沙星相同,但比较轻。主要
原料药杂质管理规程精讲
1. 目的:为了加强原料药杂质管理,确保上市药品质量。 2. 适用范围:本公司生产的原料药产品。 3. 责任者:QC、QC负责人、QA负责人、质量受权人。 4. 内容: 4.1杂质的定义及分类 4.1.1定义:任何影响药品纯度的物质均称为杂质。。 4.1.2分类: ●按化学特性分类:有机杂质、无机杂质、有机挥发性物质。(1)有机物质 ①有关物质 -起始原料 -中间体、副产物 -降解产物 -聚合物 -异构体 ②多晶型杂质 (2)无机杂质 -无机盐 阴离子 阳离子
-重金属催化剂 -过滤介质、活性炭 (3)有机挥发性物质 残留溶剂 ●按来源分类:有关物质(反应前体、中间体、副产物、降解产物等)、其它杂质、外来物质。 ●按结构分类:其他甾体、其他生物碱、几何异构体、光学异构体和聚合物。 4.2杂质的检测方法 ●原子吸收分光光度法:检查金属杂质 ●毛细管电泳法:抑肽酶中检查去丙氨酸-去甘氨酸-抑肽酶和去丙氨酸-抑肽酶两个特定杂质 ●色谱法:液相色谱法,检查有机杂质的主要方法 薄层色谱法,作为液相色谱法的补充 气相色谱法:检查挥发性杂质 ●热分析法:检查不同晶型的杂质(影响生物利用度和稳定性) ●拉曼光谱法、红外光谱法、X-射线粉末衍射 ●生物检定法、酶联免疫试剂盒(抗生素残留量) 4.3杂质的控制 4.3.1残留溶剂控制 ●标准起草过程中,应针对所用到的有机溶剂进行检查; ●建议采用了顶空进样方式和程序升温梯度洗脱的方法; ●应注意供试品溶液的配制,要求供试品在溶剂中溶解; ●方法学试验应进行回收试验,确认是否有基质干扰; ●采用标准加入法,该方法可减少基质干扰,提高方法的准确度。 4.3.1.1残留溶剂检测的常见问题 ①共出峰干扰 ②热降解干扰 ③基质效应的影响 ④药品溶解性的影响
培美曲塞二钠的合成工艺
培美曲塞二钠的合成 作者:佚名科研信息来源:文献资料点击数:392 更新时间:2007-3-9 [关键词]:培美曲塞,抗肿瘤药,非小细胞性肺癌 健康网讯: 培美曲塞二钠(pemetrexed disodium,1)北学名为N-[4-[2-(2-氨基-4,7-二氢4-4-氧-1H-吡咯[2,3- d] 嘧啶-5-基)乙基]苯甲酰]-L-谷氨酸二钠盐,是一种新型多靶位叶酸阻滞剂,能够阻断癌细胞分裂和增生过程中所需要的多种酶,包括胸苷合成酶(TS)、二氢叶酸还原酶(DHFR)和甘氨酸核糖核苷甲酞基转移酶(GARFT)等,由美国Eli Lilly公司开发,于2004年在美国首次上市,用于治疗恶性胸膜间皮瘤及非小细胞性肺癌。 有关1的合成国内未见文献报道,国外相关文献报道比较多,其主要区别在于关键中间体4- [2-(2-氨基-4,7-二氢4-氧-1H-毗咯并[2,3-d]嘧啶- 5-基)乙基]苯甲酸的合成方法不同。本研究主要参考了文献,对以对溴苯甲酸为起始原料合成1的工艺路线进行了改进。合成的反应式见图 1。由2制备4采用“一锅反应”的方法简化了操作,并将3到4制备过程中所用的3A醇与水的混合溶剂改为水;由4制备5时,一方面通过采用“一锅反应”的方法简化了操作,另一方面将反应所用的溶剂由二氯甲烷/水改为乙腈,使两相反应变成均相反应。结果,该步反应的收率比文献的方法提高了 10%。在由6制备7的过程中,采用丙酮-乙醇混合溶剂精制粗产物可以直接得到足够纯度的目标产物,避免了采用柱层析纯化或制成7的对甲苯磺酸盐(该物质在空气中不稳定)。此外,还将监测反应的HPLC法改为简便易行的薄层层析法。
20种氨基酸记忆口诀(张恒博整理)
老师让把20种氨基酸记住,带上英文缩写,还说是最低的要求,别的专业连结构式都得记熟,这些东西我看上一眼都会头痛,更别说背诵了,没办法,谁让自己学的这个呢,在网上查了点资料,竟然有好的口诀,希望会对自己有用 然后由于后面内容太多,广告打在前面吧 滨州医学院校友交流站https://www.360docs.net/doc/be10903871.html,,里面也经常有很多好东西哦 六伴穷光蛋,酸谷天出门,死猪肝色脸,只携一两钱。一本落色书,拣来精读之。芳香老本色,不抢甘肃来。 六伴穷光蛋:硫、半、光、蛋→半胱、光、蛋(甲硫)氨酸→含硫氨基酸 酸谷天出门:酸、谷、天→谷氨酸、天门冬氨酸→酸性氨基酸 死猪肝色脸:丝、组、甘、色→丝、组、甘、色氨酸→一碳单位来源的氨基酸 只携一两钱:支、缬、异亮、亮→缬、异亮、亮氨酸→支链氨基酸 一本落色书:异、苯、酪、色、苏→异亮、苯丙、酪、色、苏氨酸→生糖兼生酮拣来精读之:碱、赖、精、组→赖氨酸、精氨酸、组氨酸→碱性氨基酸 芳香老本色:芳香、酪、苯、色→酪、苯丙、色氨酸→芳香族氨基酸 不抢甘肃来:脯、羟、甘、苏、赖→脯、羟脯、甘、苏、赖氨酸→不参与转氨基的氨基酸
甘氨酸-----Gly-----G 干gan了le的叶ye子 丙氨酸-----Ala-----A 一个夹心饼干(把A想成一片饼干,两面都是A,中间加点东西) 缬氨酸-----Val-----V 缬读xie,和腹泻的泻同音!四川人管上厕所叫窝(Val)屎 亮氨酸-----Leu-----L 亮的英语单词是light 异亮氨酸---Ile----I 把I想成一 苯丙氨酸---Phe----F 他(he)人又苯,又爱放屁(P),我真的服(F)了他了 脯氨酸-----Pro----P 胸脯(p)肉(ro) 色氨酸-----Trp----W 我w喜欢看三three个人renXXXXp,我太色了 丝氨酸-----Ser----S S的读音 酪氨酸-----Tyr----Y 踢T你的your鸭儿r,让你变成懦夫 半胱氨酸---Cys----C 这个来自一个单词Cyst,是膀胱的意思。读音和妹妹差不多。妹妹的膀胱 蛋氨酸-----Met----M 小的时候,妈妈M老是叫我吃eat鸡蛋 天冬氨酸---Asp----D 把As想成天冬。医生D说AS的尿是酸性的 天冬酰胺---Asn----N 不能在冬天制造血案 谷氨酰胺----Gln---Q 谷物没多少了,最大的问题在于可能发生血案 谷氨酸------Glu---E 谷物的益处E在于可以变成葡萄糖 苏氨酸------Thr---T 他TA喝he了瓶苏打水,终于不热re了 赖氨酸------Lys---K 美国的国务卿耐丝LYS说她可以让台湾占山为王KING,老胡说,你简(碱性氨基酸)直 是在放屁 精氨酸------Arg---R 大家都看过周星驰的电影,有一次,他喝了杯精液,观众就在争论argue他 喝的是不是热RE的精液 组氨酸------His---H H想成医院,医院切掉了他的his病变组织
盐酸地左氧氟沙星片
盐酸左氧氟沙星片 Levofloxacin Hydrochloride Tablets 一、参比试剂的选择 1、国内上市情况 目前国内盐酸左氧氟沙星片有93个文号,规格有为100mg、200mg、250mg、500mg。 山东华信制药集团股份有限公司规格:100mg。 盐酸左氧氟沙星片国内无进口。 2、国外上市情况 左氧氟沙星由赛诺菲-安万特公司开发,商品名为“Tavanic”,美国市场授权给强生公司,美国上市规格为250mg、500mg、750mg。1993年赛诺菲将欧洲、亚洲、非洲、中东和南美等地区的生产和销售权授予给第一三共株式会社。 盐酸左氧氟沙星片未在EMEA上市。 左氧氟沙星片在日本上市,规格为100mg、250mg、500mg。其中第一三共株式会社上市规格为250mg、500mg。 3、参比制剂 左氧氟沙星片原研厂家为JANSSEN PHARMS,其于1996年12月20日获得FDA批准在美国上市,规格为250mg、500mg、750mg。规格与华信制药集团差别大且需要一次性进口。 左氧氟沙星片由第一三共株式会社在国内生产,规格分别为0.1g和0.5g,分别于2000年和2004年获得生产批件,批准文号分别为国药准字H20000655和国药准字H20040091。 盐酸左氧氟沙星在国内无进口制剂,也无进口本地化制剂上市。氧氟沙星片由第一三共株式会社生产,规格为0.1g和0.5g。第一三共株式会社在亚洲的生产和销售权为原研公司赛诺菲授予,因此第一三共株式会社的左氧氟沙星片既是原研制剂,可作为国内一致性评价的参比制剂。 二、体外溶出曲线 1、左氧氟沙星片FDA溶出方法
2018年上市十大重磅新药
2018年上市十大重磅新药
2018年上市十大重磅新药 作者: 李敏华 生物制药公司的研究开发人员在审视他们的后期开发项目时,都会津津乐道、滔滔不绝地谈论医疗领域尚未满足的需求。然而,市场是严酷的,潜在的希望会激起投资者的兴趣,有的创新他们也可能冷淡以对。著名的市场调查机构Evaluate公司日前公布了一份2018年上市的预期销售峰值Top10药品。一些成熟的公司正在鼎力为2018年上市新的重磅药品鼓足干劲。在艾滋病和糖尿病方面有了新的进展,10个预期的重磅药品中有6个是新的癌症治疗药物或罕见病治疗药物。NO.1 Bictegravir/F/TAF企业:吉利德销售峰值:50.5亿美元类别:艾滋病毒感染这是吉利德最大的“明星”项目,将实验性整合酶链转移抑制剂Bictegravir(50mg)(BIC)与恩曲他滨/替诺福韦甲酰胺(FTC/TAF)固定剂量组合,用于艾滋病患者治疗。吉利德公司已于今年6月12日向美国FDA提交了新药批准申请,并计划迅速在欧洲提交上市申请。该组合新药可以简化艾滋病治疗,给患者带来方便。该产品一直被寄予厚望,2017年1月,EvaluatePharma 预测其2022年销售额可达25.02亿美元。现在,吉利德公司正等待2018年2月12日(PDUFA,即美国FDA新药审批规定日期)的审批结果,并为该药上市作准备。该药将显示
出吉利德公司在艾滋病治疗市场的地位,不少分析师给予高度评价,对其期望值明显提高。吉利德多年来一直是抗艾滋病毒药物市场的主角,无意将市场拱手让给葛兰素史克刚刚(11月21日)获准的两种药物组合Juluca (Dolutegravir-Rilpivirine)。葛兰素史克的这个产品也是这个领域的标志性成就,鸡尾酒疗法依从性比以往更好;而吉利德的优势在于其更加了解艾滋病市场。届时,吉利德科学和葛兰素史克将在市场上直接竞争。NO.2 Semaglutide企业:诺和诺德销售峰值:27亿美元类别:糖尿病12月5日,美国FDA为诺和诺德(Novo Nordisk)的semaglutide(司美鲁肽)开了绿灯,这是一种每周一次的GLP-1(胰高血糖素样肽-1)糖尿病药物。它将以Ozempic为商品名销售,肌肉注射给药,其作用机理与礼来的Trulicity(Dulaglutide,杜拉鲁肽)相同,且在一项直接比较研究中击败了Trulicity。与同样每周一次的Trulicity相比,Semaglutide降低HbA1c (糖化血红蛋白)和体重更加显著。这将给礼来带来相当大的压力。作为销售预期高达20亿美元的重磅药品,诺和诺德还启动了一项大型的肥胖症试验,意在观察能否让病人摆脱导致糖尿病的体重问题。这使得该药对市场上所有的相关药品造成明显的威胁,其它药品在这方面都没有明显作用。NO.3 Epacadostat企业:Incyte公司销售峰值:19.4亿美元类别:肿瘤Epacadostat是Incyte公司研发的一种小分子吲
氟哌啶醇相关杂质
相关杂质整理列表 中文名英文名CAS号规格纯度结构式 氟哌啶醇杂质1(氟哌啶醇EP杂 质A) Haloperidol Impurity 1 (Haloperidol EP Impurity A) 3109-12-4 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质2(氟哌啶醇EP杂 质B) Haloperidol Impurity 2 (Haloperidol EP Impurity B) 1391052-5 3-1 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂3(氟哌啶醇EP杂质C) Haloperidol Impurity 3 (Haloperidol EP Impurity C) 1391052-8 7-1 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质4(氟哌啶醇EP杂 质D) Haloperidol Impurity 4 (Haloperidol EP Impurity D) 67987-08-0 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质5(氟哌啶醇EP杂 质E) Haloperidol Impurity 5 (Haloperidol EP Impurity E) 1391054-6 9-5 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质6(氟哌啶醇EP杂 质F) Haloperidol Impurity 6 (Haloperidol EP Impurity F) 1391052-6 7-7 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质7 Haloperidol Impurity 7 34104-67-1 10mg-25mg-50mg-100mg ≥99%
HPLC法测定盐酸左氧氟沙星片的含量
H P L C法测定盐酸左氧氟 沙星片的含量 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
HPLC法测定盐酸左氧氟沙星片的含量 摘要:目的:对HPLC及UV测定盐酸左氧氟沙星片的含量进行比较。方法:高效液相色谱法选择色谱柱为AgilentC18(150 mm×4.6 mm,5μm),流动相为醋酸铵高氯酸钠溶液(pH=-乙腈(85:15),流速为·min-1,检测波长为294nm;紫外分光光度法选择294nm波长测定含量.结果:HPLC法中盐酸左氧氟沙星片在·mL-1~·mL-1范围内线性关系良好.回归方程Y=523247X-23331(r=),加样回收率平均值为%,%。结论:HPLC法及紫外分光光度法均准确性、重复性高、精密度好,可考虑将紫外分光光度法作为盐酸左氧氟沙星含量测定的替代方法使用。 关键词:高效液相法;紫外分光光度法;盐酸左氧氟沙星 左氧氟沙星是氧氟沙星的L-型光学活性异构体,因其抗菌谱广、抗菌作用强、不良反应率较低,而被广泛使用[1]。2015版药典推荐高效液相法来分析本品及其相关剂型,考虑到基层药物监测机构尚不能完全普及高效液相设备[2],本文对比分析高效液相法及紫外分光光度法测定盐酸左氧氟沙星含量。 1材料 仪器与试药 岛津LC-20A(改为LC-2010CHT)型高效液相色谱仪;岛津UV-2501(改为UV-2450)型紫外分光光度计;超声波清洗器;乙腈由国药集团化学试剂有限公司提供(改为霍尼韦尔贸易(上海)有限公司提供),为色谱醇;磷酸、醋酸铵、高氯酸钠均为分析纯;盐酸左氧氟沙星对照品(美国西格玛公司,批号:
利伐沙班工艺杂质合成方法
利伐沙班原料药杂质合成工艺
目录 一、基本信息 (3) 1.1药品名称 (3) 1.2结构 (3) 二、利伐沙班杂质列表 (4) 2.1杂质合成工艺 (6) 2.2杂质A合成 (6) 2.3杂质B合成 (6) 2.4杂质C合成 (6) 2.5杂质D合成 (7) 2.6杂质E合成 (7) 2.7杂质F合成 (8) 2.8杂质G合成 (8)
利伐沙班原料药杂质合成工艺 一、基本信息 1.1药品名称 中文通用名:利伐沙班 英文通用名:Rivaroxaban 汉语拼音:LIFASHABAN 中文化学名::5-氯-N-(((5S)-2-氧代-3-(4-(3-氧代吗啉-4-基)苯基)-1,3-恶唑啉-5-基)甲基)噻吩-2-甲酰胺 英文化学名:5-Chloro-N-(((5S)-2-oxo-3-(4-(3-oxomorpholin-4-yl)phenyl)-1,3- oxazolidin-5-yl)methyl)thiophene-2-carboxamide 化学文摘登记(CAS)号:366789-02-8 外观与性状:白色至灰白色固体 1.2结构 分子式:C19H18ClN3O5S 分子量:435.88 立体结构:含一个手性中心 作用机理:利伐沙班是一种口服,具有生物利用度的Xa因子抑制剂,其选择性地阻断Xa因子的活性位点,且不需要辅因子(例如抗凝血酶Ⅲ)以发挥活性。通过内源性及外源性途径活化X因子为Xa因子(FXa),在凝血级联反应中发挥重要作用。利伐沙班在人体剂量依赖性抑制Xa因子活性,应用Neoplastin?试剂测定的凝血酶原时间(PT)、活化部分凝血活酶时间(aPTT)及HepTest?肝素定量检测可见剂量依赖性延长。抗Xa因子活性同样受利伐沙班影响。
FDA批准elbasvir grazoprevir使用说明书最新版
FDA的药品评价和研究中心中抗微生物产品室主任Edward Cox,M.D.说:“今天的批准对有基因型1和4 HCV感染没有需要使用干扰素[interferon]的患者提供另一种治疗选择。” 突破性治疗指定。 处方资料重点 这些重点不包括安全和有效使用ZEPATIER所需的资料。请参阅下文ZEPATIER完整处方资料。ZEPATIER?(elbasvir和grazoprevir)片,为口服使用 美国初次批准:2016 适应证和用途 ZEPATIER是一个固定剂量组合产品含elbasvir,一个丙型肝炎病毒(HCV)NS5A抑制剂,和grazoprevir,一个HCV NS3/4A蛋白酶抑制剂,和适用为有或无利巴韦林[ribavirin]在成年中对慢性HCV基因型1或4感染治疗。(1) 剂量和给药方法 ⑴开始前测试: ⑵基因型1a:建议测试对病毒有NS5A耐药-关联多态性的存在。(2.1) ⑶得到肝实验室测试。(2.1) ⑷推荐剂量:有或无食物口服一片每天1次。(2.2) ⑸HCV/HIV-1 共感染:遵循在上表中剂量推荐。(2.2) ⑹肾受损,包括血液透析:建议无ZEPATIER剂量调整。对利巴韦林给药和剂量调整参考利巴韦林处方资料。(2.3) 剂型和规格 片:50 mg elbasvir和100 mg grazoprevir(3) 禁忌证 ⑴有中度或严重肝受损(Child-Pugh B或C)患者。(4) ⑵OATP1B1/3抑制剂,强CYP3A诱导剂,和依法韦仑。(4) ⑶如ZEPATIER与利巴韦林给予,也应用对利巴韦林。(4) 警告和注意事项 ⑴ALT升高:治疗前,在治疗周8,和当临床上指示时进行肝实验室测试。对接受16周治疗患者,在治疗周12时进行另外肝实验室测试。对用ZEPATIER ALT升高,遵循在完整处方资料中建议。(5.1) ⑵伴随利巴韦林联合治疗风险:如ZEPATIER与利巴韦林给药,也应用对利巴韦林警告和注意事项。(5.2)
培美曲塞二钠
通用名 注射用培美曲塞二钠 商品名 英文: ALIMTA 中文:力比泰 国产:赛珍、普来乐、怡罗泽、全持安、爱立汀 英文名 Pemetrexed disodium for Injection 汉语拼音 Zhu She Yong Pei Mei Qu Sai Er Na 化学名称 谷氨酸, N -[4-[2-(2- 氨基 -4,7- 二氢 -4- 氧 -1H- 吡咯并 [2,3-d] 嘧啶 -5- 烷基 ) 乙基 ] 苯甲酰基 ]- ,二钠盐,七水合物 分子式 C 20H 19N 5Na 2O 6?7H 2O 分子量 597.49 性状 本品为白色至淡黄色或绿黄色的冷冻干燥固体。 药理作用 培美曲塞通过运载叶酸的载体和细胞膜上的叶酸结合蛋白运输系统进入细胞内。一旦培美曲塞进入细胞内,它就在叶酰多谷氨酸合成酶的作用下转化为多谷氨酸的形式。多谷氨酸存留于细胞内成为胸苷酸合成酶和甘氨酰胺核苷酸甲酰转移酶的抑制剂。多谷氨酸化在肿瘤细胞内呈现时间 - 浓度依赖性过程,而在正常组织内浓度很低。多谷氨酸化代谢物在肿瘤细胞内的半衰期延长,从而也就延长了药物在肿瘤细胞内的作用时间。 临床前研究显示培美曲塞体外可抑制间皮瘤细胞系 (MSTO?211H, NCI?H2052) 的生长。间皮瘤细胞系 MSTO?211H 的研究显示出培美曲塞与顺铂联合有协同作用。 人群药效学分析采用的指标是绝对中性粒细胞计数,此时人群接受的为单药培美曲塞,未接受叶酸和维生素 B 12 的补充治疗。通过观察粒细胞最低值来判断血液学毒性发生的严重程度,结果发现其与本品全身给药剂量呈负相关关系。研究中也发现如果患者基线检查时胱硫醚或高半胱氨酸浓度高,那么其绝对粒细
盐酸左氧氟沙星片药物稳定性研究的试验资料及文献资料
药物稳定性研究的试验资料 及文献资料 试验负责人: 试验参加者: 试验日期:20xx年02月-20xx年08月 资料保存处:xxxx制药有限公司 联系人: 电话: xxxx制药有限公司
药物稳定性研究的试验资料及文献资料 1、稳定性考察方法 1.1、试验仪器 高效液相色谱仪大连仪利特科学仪器有限公司 分析天平上海天平仪器厂 智能溶出试验仪 ZRS-4 天津大学无线电厂 智能崩解仪 ZB-1B 天津大学精密仪器厂 1.2、药品 供试样品:盐酸左氧氟沙星片自制批号为:xx0216 xx0217 xx0218 2、稳定性试验方法 2.1、加速试验 将盐酸左氧氟沙星片(xx0216 xx0217 xx0218)铝塑包装板(市售包装),在温度40±2℃,相对湿度75%±5%的条件下放置6个月,分别于1个月末、2个月末、3个月末、6个月末取样一次,按稳定性重点考察项目(性状、有关物质、崩解时限、含量)检测。 2.2、长期试验 将盐酸左氧氟沙星片(xx0216 xx0217 xx0218)拟市售包装(铝塑包装)在温度25±2℃,相对湿度60%±10%的条件下放置6个月。每3个月取样一次,分别于0个月、3个月、6个月,按稳定性重点考察项目(性状、有关物质、崩解时限、含量)进行检测。12个月以后,分别于18月、24月、36月取样进行检测。将结果与0月比较以确定药品的有效期。 3、检验项目及结果 3.1、加速试验 20xx年02月23日到20xx年08月28日对盐酸左氧氟沙星片进行了加速试验,对性状、含量、有关物质等项目进行了检测,并在0月、6月末对微生物限度进行考察,试验结果见表1、表2、表3、表4、表5。 HPLC图谱附后
20090511氧氟沙星系列药物有关物质控制探讨
20090511氧氟沙星系列药物有关物质控制探讨 氧氟沙星(Ofloxacin)为合成的第三代广谱氟喹诺酮类抗菌药,对大多数革兰氏阳性菌和革兰氏阴性菌均有明显的抑制作用。临床上主要用于敏感菌所致的呼吸系统感染、泌尿生殖系统感染。氧氟沙星由日本第一制药株式会社研发,于1985年在日本、德国上市,制剂为口服片剂、注射剂等。目前国内已上市的氧氟沙星制剂有片剂、胶囊剂、颗粒剂、缓释制剂、小针、葡萄糖注射液和氯化钠注射液等。左氧氟沙星(Levofloxacin)为氧氟沙星的左旋体,具有抗菌谱广、抗菌作用强的特点。日本第一制药株式会社于1993年在日本上市销售左氧氟沙星原料及片剂,并现已在英国、美国等多国上市。目前国内上市的左氧氟沙星制剂主要有片剂、小针、葡萄糖注射液和滴眼剂等。另外,国内已批准上市的左氧氟沙星还有其盐酸盐、乳酸盐和甲磺酸盐,三种加酸根的左氧氟沙星均有片剂、胶囊剂、注射制剂等多种剂型上市。二、国家标准中有关物质控制方法比较氧氟沙星系列药物的有关物质测定国家标准大多采用HPLC法,列表比较见表1。表1 氧氟沙星系列药物的有 关物质测定方法与限度的比较
这些方法有很多相似的地方,如均采用ODS柱,色谱条件与含量测定色谱条件相同,按照主成分自身稀释对照法定量等。但也有一些不同的地方值得关注,作者从以下三个方面来对这些国家标准方法的不同之处进行比较。1、流动按照流动相的不同,作者将有关物质测定方法分为六种,具体如下:方法A:醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH至2.2)-乙腈(85∶15)为流动相,在294nm下检测;方法B:略;方法C:略;方法D:己烷磺酸钠[取己烷磺酸钠0.98g,加磷酸盐缓冲溶液(取磷酸二氢钾6.8g,加水溶解并稀释至1000ml,加0.05mol/L磷酸约500ml,使pH为2.4)]-甲醇(3∶1)为流动相,在293nm下检测; 方法E:磷酸缓冲溶液(溶解27.2磷酸二氢钾在1000ml水中,用磷酸调节pH至2.4)-乙腈(90∶10)为流动相,在294nm下检测;方法F:己烷磺酸钠[取己烷磺酸钠0.98g,加磷酸盐缓冲溶液(取磷酸二氢钾6.8g,加水溶解并稀释至1000ml,加0.05mol/L磷酸约500ml,使pH为2.4)]-甲醇(65∶35)为流动相,在230nm下检测。六种流动相的共同特点是:组成均是酸性缓冲溶液加有机溶剂(甲醇或乙腈)。方法A、B、E未加表面活性剂,方法C、D加有表面活性剂己烷磺酸钠。除方法F在230nm下检测外,其他方法均在294或293nm下检测。2、主要杂质英国药典收载了氧氟沙星杂质A、B、C、D、E、F共6个已知杂质,依次分别为去哌嗪环、去羧基、去氟、氟取代位置不同、去甲基以及氮氧化的化合物物。英国药典氧氟沙星原料药采用TLC法控制杂质A,
氧氟沙星系列药物有关物质控制探讨
【摘要】本文总结了国家标准中氧氟沙星、左氧氟沙星、盐酸左氧氟沙星、乳酸左氧氟沙星、甲磺酸左氧氟沙星系列药物的有关物质控制方法,分析了该类药物注册申报中有关物质控制存在的问题,希望能为研发者提供帮助。 【关键词】氧氟沙星、左氧氟沙星、有关物质 一、概况 氧氟沙星(Ofloxacin)为合成的第三代广谱氟喹诺酮类抗菌药,对大多数革兰氏阳性菌和革兰氏阴性菌均有明显的抑制作用。临床上主要用于敏感菌所致的呼吸系统感染、泌尿生殖系统感染。氧氟沙星由日本第一制药株式会社研发,于1985年在日本、德国上市,制剂为口服片剂、注射剂等。目前国内已上市的氧氟沙星制剂有片剂、胶囊剂、颗粒剂、缓释制剂、小针、葡萄糖注射液和氯化钠注射液等。 左氧氟沙星(Levofloxacin)为氧氟沙星的左旋体,具有抗菌谱广、抗菌作用强的特点。日本第一制药株式会社于1993年在日本上市销售左氧氟沙星原料及片剂,并现已在英国、美国等多国上市。目前国内上市的左氧氟沙星制剂主要有片剂、小针、葡萄糖注射液和滴眼剂等。另外,国内已批准上市的左氧氟沙星还有其盐酸盐、乳酸盐和甲磺酸盐,三种加酸根的左氧氟沙星均有片剂、胶囊剂、注射制剂等多种剂型上市。 二、国家标准中有关物质控制方法比较 氧氟沙星系列药物的有关物质测定国家标准大多采用HPLC法,列表比较见表1。 表1 氧氟沙星系列药物的有关物质测定方法与限度的比较
这些方法有很多相似的地方,如均采用ODS 柱,色谱条件与含量测定色谱条件相同,按照主成分自身稀释对照法定量等。但也有一些不同的地方值得关注,作者从以下三个方面来对这些国家标准方法的不同之处进行比较。
1、流动相 按照流动相的不同,作者将有关物质测定方法分为六种,具体如下: 方法A:醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH至2.2)-乙腈(85∶15)为流动相,在294nm下检测; 方法B:略; 方法C:略; 方法D:己烷磺酸钠[取己烷磺酸钠0.98g,加磷酸盐缓冲溶液(取磷酸二氢钾6.8g,加水溶解并稀释至1000ml,加0.05mol/L磷酸约500ml,使pH为2.4)]-甲醇(3∶1)为流动相,在293nm下检测; 方法E:磷酸缓冲溶液(溶解27.2磷酸二氢钾在1000ml水中,用磷酸调节pH至2.4)-乙腈(90∶10)为流动相,在294nm下检测; 方法F:己烷磺酸钠[取己烷磺酸钠0.98g,加磷酸盐缓冲溶液(取磷酸二氢钾6.8g,加水溶解并稀释至1000ml,加0.05mol/L磷酸约500ml,使pH为2.4)]-甲醇(65∶35)为流动相,在230nm下检测。 六种流动相的共同特点是:组成均是酸性缓冲溶液加有机溶剂(甲醇或乙腈)。方法A、B、E未加表面活性剂,方法C、D加有表面活性剂己烷磺酸钠。除方法F在230nm下检测外,其他方法均在294或293nm下检测。 2、主要杂质 英国药典收载了氧氟沙星杂质A、B、C、D、E、F共6个已知杂质,依次分别为去哌嗪环、去羧基、去氟、氟取代位置不同、去甲基以及氮氧化的化合物物。英国药典氧氟沙星原料药采用TLC法控制杂质A,采用HPLC法控制其他已知和未知杂质。美国药典重点关注了杂质desfluoroofloxacin,日本药局方重点关注了ofloxacin demethyl substance,均与
