FDA批准的激酶小分子抑制剂类药物及分类一览

FDA批准的激酶小分子抑制剂类药物及分类一览
蛋白激酶
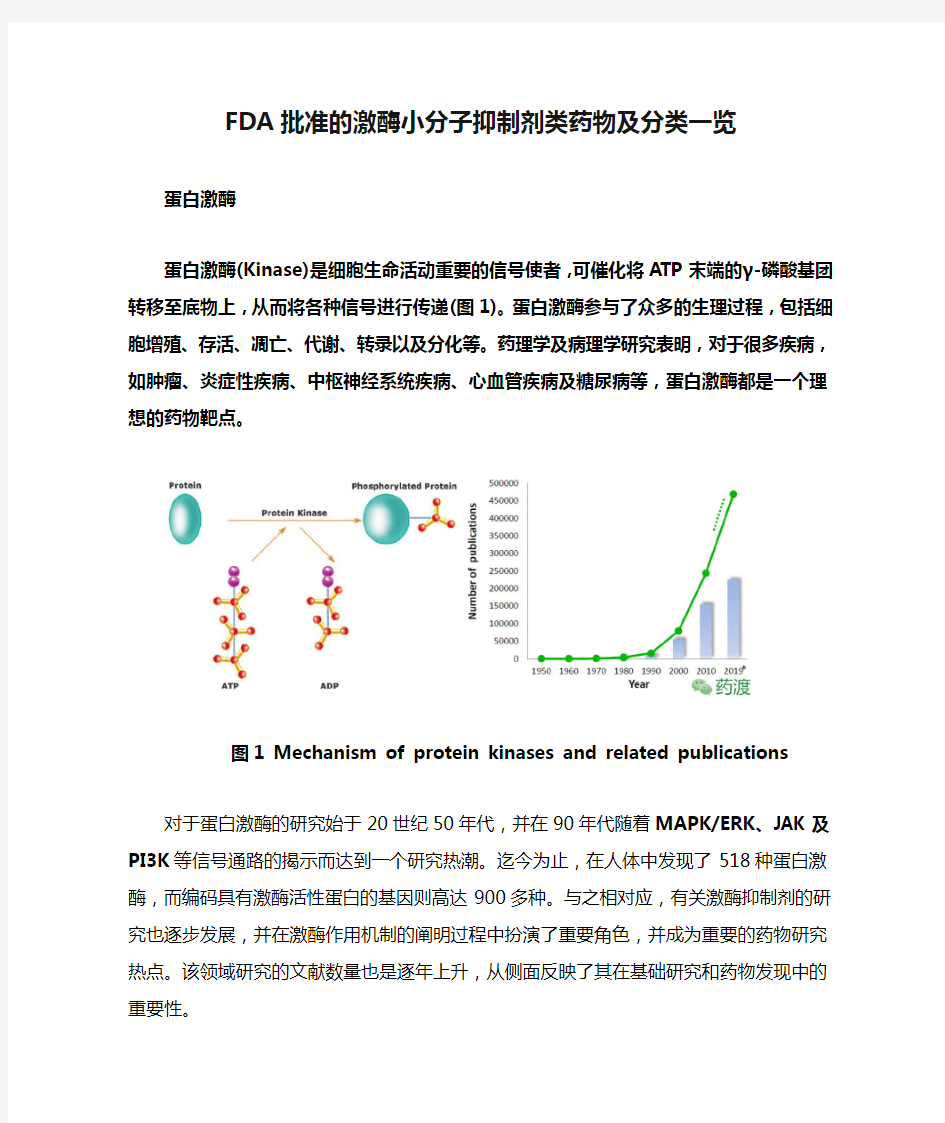
蛋白激酶(Kinase)是细胞生命活动重要的信号使者,可催化将ATP末端的γ-磷酸基团转移至底物上,从而将各种信号进行传递(图1)。蛋白激酶参与了众多的生理过程,包括细胞增殖、存活、凋亡、代谢、转录以及分化等。药理学及病理学研究表明,对于很多疾病,如肿瘤、炎症性疾病、中枢神经系统疾病、心血管疾病及糖尿病等,蛋白激酶都是一个理想的药物靶点。
图1 Mechanism of protein kinases and related publications
对于蛋白激酶的研究始于20世纪50年代,并在90年代随着MAPK/ERK、JAK 及PI3K等信号通路的揭示而达到一个研究热潮。迄今为止,在人体中发现了518种蛋白激酶,而编码具有激酶活性蛋白的基因则高达900多种。与之相对应,有关激酶抑制剂的研究也逐步发展,并在激酶作用机制的阐明过程中扮演了
重要角色,并成为重要的药物研究热点。该领域研究的文献数量也是逐年上升,从侧面反映了其在基础研究和药物发现中的重要性。
蛋白激酶抑制剂及其分类
过去的15年间,激酶抑制剂作为药物候选的研究取得了长足的进步,不论是基础研究还是在工业界。在人体现有药物靶点里面,蛋白激酶家族成员占比高达10%(FDA批准药物分子靶点深度解读)。2001年,第一个激酶抑制剂类药物Imatinib获得FDA批准,成为该领域发展的里程碑,此后十年该类药物以平均每年获批一种的速度稳步发展。而在2012年1月至2015年2月期间,小分子激酶抑制剂类药物迎来爆发式发展,共有15种新药获得审批。截至2016年12月底,共有31种小分子激酶抑制剂类药物获得审批,同时还有大量的化合物处于临床或临床前研究中。除此之外,科研人员还解析了超过5000种的蛋白激酶或蛋白激酶-抑制剂复合体的晶体结构,且超过五分之一的人类蛋白激酶具有明确的小分子抑制剂。因此,小分子激酶抑制剂已成为药物研发的一个热点领域。
蛋白激酶尽管在一级序列上有所差异,但在三维结构上却具有高度的保守性,特别是在催化活性结构域附近。该区域存在一个β-折叠构成的N-lobe区域及α-螺旋构成的C-lobe区域,而ATP结合在两者构成的沟状区,也是很多激酶抑制剂的结合位点。活性位点附近还存在一条Activation-Loop,通常末端存在一个保守的Asp-Phe-Gly (DFG)结构基序(图2A)。
图2 Kinase structure and different types of reversible small-molecule kinase inhibitor
根据结合模式的不同,激酶抑制剂可分为不可逆及可逆两大类。前者指化合物通过与Cys反应形成共价键结合在ATP结合位点上,从而封闭ATP的结合空间,该过程具有不可逆转性。后者根据结合口袋区域及DFG基序构象的不同,可分为四种主要的不同亚型(图2B)。类型Ⅰ为ATP竞争性抑制剂,结合与活性形式激酶DFG基序上的Asp残基。类型Ⅱ抑制剂结合与非活性状态的激酶中,其上DFG基序上的Asp残基朝向分子外侧。而类型Ⅲ的抑制剂结合在ATP附近别构
位点上,但同ATP结合口袋没有相互作用。类型Ⅳ抑制剂结合在远离ATP结合
位点的别构作用区域。还有些激酶抑制剂,如双底物类抑制剂,可以统一划分在类型Ⅴ里面,作用模式与上述四类有所不同。
图3 Small molecular kinase inhibitors approved by FDA in 2001-2016
在获批的31中小分子激酶抑制剂类药物中(图3),绝大多数为酪氨酸激酶抑制剂,还有些属于丝氨酸/苏氨酸激酶抑制剂,只有2014年七月获批的Idelalisib 属于脂激酶类抑制剂。根据靶点蛋白及药物属性的不同,分类整理如下:
1. FDA批准的可逆NRTK(非受体型酪氨酸激酶)抑制剂类药物
图4 Reversible NITK inhibitors
2. FDA批准的可逆RTK(受体型酪氨酸激酶)抑制剂类药物
图5 Reversible RTK inhibitors-1
图6 Reversible RTK inhibitors-2
3. FDA批准的不可逆蛋白激酶抑制剂类药物
图7 Inreversible protein kinase inhibitor
4. FDA批准的丝氨酸/苏氨酸激酶抑制剂类药物
图8 Serine/Threonine kinase inhibitors
5. FDA批准的脂激酶抑制剂类药物
图9 Lipid kinase inhibitor
挑战与展望
在过去的15年里,基于蛋白激酶的药物发现取得了巨大进步。相比于GPCR,膜通道与转运蛋白及蛋白酶等传统药物靶点领域,激酶抑制剂代表了一类年轻而又充满活力的药物发现空间,并取代GPCR成为癌症领域最火热的细胞治疗靶点。尽管在短短十五年时期内已有31种药物获得批准,但在2016年,近五年的快速增长势头没能继续延续。激酶小分子抑制剂类药物研究领域仍面临诸多挑战。
首先,人体内激酶家族中只有少数成员获得了详尽研究。绝大多数抑制剂研究集中于酪氨酸激酶及类酪氨酸激酶家族,如CDK、MAPK、GSK3、CMGC、PKA、PKG及PKC等。这一不平衡还体现在现有获批药物数量上,针对BCR-Abl、ErbBs 及VEGFRs三类酪氨酸激酶开发的药物占到了总数的三分之二以上。而在另一分类体系中,脂激酶只有一种抑制剂类药物上市,尽管这类酶的抑制剂早在20世纪90年代就早已有报道,且开展了很多临床及临床前研究。以上现状表明,人体激酶组中的很多成员还处于被冷落状态。我们需要开发出新型的研究方法或筛选探针,以便更好的揭示这些激酶的作用机制,并有效开发其作为药物靶点的潜力。令人鼓舞的是,最近几年有数个激酶成员的抑制剂类药物首次获得批准,如2013年MEK抑制剂Trametinib、BTK的抑制剂Ibrutinib及2015年获批的CDK抑制剂Palbociclib。
其次,尽管激酶的梯级调控信号调节着众多的生理过程,如炎症反应、中枢神经系统异常、心血管疾病、糖尿病及癌症等,但现有获批药物超过90%以上集中在癌症治疗领域。针对激酶的小分子抑制剂类药物应用领域亟待拓展。目前,Tofacitinib已被批准用于关节炎治疗。即便是在肿瘤治疗领域,也有很多问题有待进一步深入研究,如肿瘤的耐药性问题以及同其他药物的联合用药等。
第三,现有的很多激酶抑制剂药物存在较多相似性,大多是在已批准药物基础上设计优化而成,如针对ErbB的五种抑制剂均包含相同的核心结构模块。从这个角度讲,现有药物的结构多样性不够丰富,亟需增加药物研发初始阶段高通量筛选(HTS)所用化合物库的结构多样性。而天然产物库,通常包含不同于绝大多数
化学合成抑制剂库的药效团及分子骨架,有望成为拓展HTS库结构多样性的新资源。
第四,具有新的作用机制及特异性的激酶抑制剂类药物有待开发。由于激酶ATP 结合口袋区域附近结构的保守型,绝大多数抑制剂为可逆性抑制剂。这也导致了绝大多数小分子抑制剂存在不止一个作用靶点分子,导致脱靶现象以及副作用的产生。与之相随,具有绝对选择性的抑制剂分子极为稀少。未来工作中,我们需要探索具有新型作用机制的抑制剂分子。而激酶抑制剂的选择性则是一个略带争议的特性。早期研究中,具有交叉抑制活性或广谱选择性的抑制剂是肿瘤学研究的得力方法。而当前,选择性抑制剂更适合于肿瘤治疗的理论逐步被广泛认同。研究结论表明,激酶抑制剂类药物并不需要绝对的选择性,而是要有适当的选择性以便在药效与毒性间达到某个平衡点。
本文所引用资料:
1. Small Molecule Kinase Inhibitors as Anti-Cancer Therapeutics. Mini-Reviews in Medicinal Chemistry, 2012, 12, 399-411
2. Kinase inhibitors and monoclonal antibodies in oncology: clinical implications. Nature Reviews Clinical Oncology, 2016,13,209–227
3. Tyrosine Kinase Inhibitors: Views of Selectivity, Sensitivity and Clinical Performance.
2013,53,161-185
4. Small-molecule kinase inhibitors: an analysis of FDA-approved drugs. Drug Discov Today. 2016Jan;21(1):5-10
5. FDA-approved small-molecule kinase inhibitors. Trends in Pharmacological Sciences 2015,36,422-439
6. https://www.360docs.net/doc/be16390697.html,/Drugs/default.htm
7. https://www.360docs.net/doc/be16390697.html,/scripts/cder/daf/index.cfm
8. 部分药物信息查询自药渡网-药物数据。
肿瘤靶向药物分类(20210111211612)
肿瘤靶向药物分类 1 / 8
Science: 盘点13 种常见的肿瘤抗体靶向药物1、西妥昔单抗(爱必妥) 靶点:EGFR 2 / 8
肿瘤类型:结直肠癌、头颈部肿瘤 适应症:KRAS 野生型、EGFR表达的转移性结直肠癌。联合FOLFIRI 时可作为一线;联合伊立替康治疗那些单用伊立替康化疗难治的病人;单药治疗就是针对那些奥沙利铂和伊立替康为主的化疗已经失败了,或者对伊立替康不耐受的。 头颈部鳞状细胞癌。联合放疗可作为局部晚期的初始治疗;联合铂类为主的治疗再加上5-FU 可作为复发或转移性疾病的一线治疗;如果单药用呢,就适合那些铂类治疗已经失败了的复发或转移性的疾病。 2、帕尼单抗(Vectibix ) 靶点:EGFR 肿瘤类型:结直肠癌 适应症:在氟尿嘧啶、奥沙利铂和伊立替康为基础的方案中已经失败了,KRAS 野生型、EGFR表达的mCRC 3、曲妥珠单抗(赫赛汀) 靶点:HER2 肿瘤类型:乳腺癌、胃癌 3 / 8
适应症:HER2 过表达淋巴结阳性或阴性乳腺癌的辅助治疗。作为治疗方案的一部分,包括阿霉素,环磷酰胺以及紫杉醇或多西他赛;也可以联合多西他赛和卡铂;在蒽环类为基础的治疗之后可以单药使用。 HER2 过表达转移性乳腺癌。联合紫杉醇一线使用;单药治疗适用那些已经接受过一种或多种方案的转移性疾病。 HER2 过表达转移性胃癌或食管胃结合部癌,之前未接受过针对转移性疾病的治疗,可联合顺铂和卡培他滨或5-FU 。 4、帕妥珠单抗(Pejeta ) 靶点:HER2 肿瘤类型:乳腺癌 适应症:HER2阳性转移性乳腺癌,之前未接受过抗HER2 治疗或化疗,联合曲妥珠单抗和多西他赛使用。 5、T-DM1 (Kadcyla ) 4 / 8
肿瘤分子靶向药物简介-历史及上市药物
肿瘤的靶向药物选择一一国内外已经上市的分子靶向(MTT)药物… 一、靶向药物(targeted medicine )简介 靶向药物是目前最先进的用于治疗癌症的药物,是随着当代分子生物学、细胞生物学的发展产生的高科技药物。靶向药物与常规化疗药物最大的不同在于其作用机理:常规化疗药物通过对细胞的毒害发挥作用,由于不能准确识别肿瘤细胞,因此在杀灭肿瘤细胞的同时也会殃及正常细胞,所以产生了较大的毒副作用。而靶向药物是针对肿瘤基因开发的,它能够识别肿瘤细胞上由肿瘤细胞特有的基因所决定的特征性位点,通过与之结合(或类似的其他机制),阻断肿瘤细胞内控制细胞生长、增殖的信号传导通路,从而杀灭肿瘤细胞、阻止其增殖。由于这样的特点,靶向药物不仅效果好,而且副作用要比常规的化疗方法小得多。靶向药物可以分为以下几类: (一)小分子药物 小分子药物通常是信号传导抑制剂,它能够特异性地阻断肿瘤生长、增殖过程中所必需的信号传导通路,从而达到治疗的目的。例如诺华制药生产的格列卫(Gleevec ,通用名Imitinib )、阿斯利康生产的易瑞沙(Iressa ,通用名Gefitinib )均属此类; (二)细胞凋亡诱导药物 通过特异性地诱导肿瘤细胞凋亡,达到治疗的目的。如美国千年制药公司生产的Velcade (通 用名bortezomib )、Genta 公司生产的Genasense(oblimersen ); (三)单克隆抗体 例如赫塞汀(Herceptin,通用名Trastuzumab),用于治疗HER2基因阳性(过量表达)的乳腺癌。这类药物是通过抗原抗体的特异性结合来识别肿瘤细胞的。 除上述列举的已经进入临床使用的靶向药物外,另外还有多种靶向药物正在开发中。 二、肿瘤的靶向药物上市历史回顾: ■白血病费城染色体开启靶向治疗之门 早在I960年,美国费城的研究者发现慢性髓性白血病(CML患者中存在一个染色体异常。数年后,研究者发现这是9 号和22 号染色体长臂易位的结果。由于这个染色体异常首先在费城(Philadelphia )发现,故命名为费城(Ph)染色体。该染色体也成为了40年后 上市的CML靶向治疗的靶点。2001年,首个被证实可对抗费城染色体分子缺陷的药物一一伊马替尼以FDA史上最快的速度(仅经过3个月评审)获批上市,自此成为CML勺标准治疗,使CML成为一种可控制的慢性病。 第2个治疗CML的靶向药物是达沙替尼,2006年被FDA批准用于伊马替尼不耐受或耐药的CML2010年其适应证扩展至早期CML的初始治疗。同年,尼洛替尼获批用于CML2012 年,伯舒替尼(bosutinib )和普纳替尼(ponatinib )陆续获批治疗CML。 ■肺癌从EGFF到VEGF ALK 1987年,研究者首次证实肿瘤细胞上的受体一一表皮生长因子受体(EGFR在非小细 胞肺癌的生长和扩散中发挥重要作用。短短6年之后,首个靶向EGFR勺非小细胞肺癌治疗 药物EGFR酪氨酸激酶抑制剂(TKI)吉非替尼获FDA批准,次年同类药物厄洛替尼获批。在 我国,自主研发的埃克替尼于2011 年用于临床。 以血管内皮生长因子(VEGF为靶点的贝伐珠单抗于2006年获FDA批准与标准化疗联 合,作为不可手术的非鳞癌、已发生肺内或肺外播散,或已复发非小细胞肺癌的初始治疗。 2011年,靶向间变性淋巴瘤激酶(ALK)通路药物克唑替尼(crizotinib )获准用于ALK
肿瘤靶向药物分类
肿瘤靶向药物分类
1、西妥昔单抗(爱必妥)靶点:EGFR
肿瘤类型:结直肠癌、头颈部肿瘤 适应症:KRAS野生型、EGFR表达的转移性结直肠癌。联合FOLFIRI时可作为一线;联合伊立替康治疗那些单用伊立替康化疗难治的病人;单药治疗就是针对那些奥沙利铂和伊立替康为主的化疗已经失败了,或者对伊立替康不耐受的。 头颈部鳞状细胞癌。联合放疗可作为局部晚期的初始治疗;联合铂类为主的治疗 再加上5-FU可作为复发或转移性疾病的一线治疗;如果单药用呢,就适合那些铂类治疗已经失败了的复发或转移性的疾病。 2、帕尼单抗(Vectibix ) 靶点:EGFR 肿瘤类型:结直肠癌 适应症:在氟尿嘧啶、奥沙利铂和伊立替康为基础的方案中已经失败了,KRAS 野生型、EGFR表达的mCRC 3、曲妥珠单抗(赫赛汀) 靶点:HER2 肿瘤类型:乳腺癌、胃癌
适应症:HER2过表达淋巴结阳性或阴性乳腺癌的辅助治疗。作为治疗方案的一部分,包括阿霉素,环磷酰胺以及紫杉醇或多西他赛;也可以联合多西他赛和卡铂;在蒽环类为基础的治疗之后可以单药使用。 HER2过表达转移性乳腺癌。联合紫杉醇一线使用;单药治疗适用那些已经接受过一种或多种方案的转移性疾病。 HER2过表达转移性胃癌或食管胃结合部癌,之前未接受过针对转移性疾病的治疗,可联合顺铂和卡培他滨或5-FU。 4、帕妥珠单抗(Pejeta) 靶点:HER2 肿瘤类型:乳腺癌 适应症:HER2阳性转移性乳腺癌,之前未接受过抗HER2治疗或化疗,联合曲妥珠单抗和多西他赛使用。 5、T-DM1 (Kadcyla) 靶点:HER2 肿瘤类型:乳腺癌
抗癌药物分类
1.传统抗肿瘤药物 抗恶性肿瘤药物按作用机制分类: 干扰核酸生物合成的药物 ?抗嘌呤药:即嘌呤核苷酸合成抑制剂,如巯嘌呤、硫鸟嘌呤、喷司他丁等。 ?抗嘧啶药:主要靠抑制嘧啶的生物合成而起到抗瘤作用,如:氟尿嘧啶。 ?抗叶酸药:为二氢叶酸还原酶抑制剂,如甲氨蝶呤。 ?核苷酸还原酶抑制剂,如羟基脲。 ?DNA多聚酶抑制剂,如阿糖胞苷。 破坏DNA结构和功能的药物,烷化剂、丝裂霉素、顺铂、丙卡巴肼等可与DNA交叉联结;博莱霉素靠产生自由基破坏DNA结构。 嵌入DNA中干扰转录DNA的药物,如放线菌素类、柔红霉素、阿霉素等。 影响蛋白质合成的药物,如门冬酰胺酶、紫杉醇、秋水仙碱、长春花生物碱类等。 影响体内激素平衡的药物,如雌激素、孕激素和肾上腺皮质激素等。
2.新型抗肿瘤药物 传统抗肿瘤药物都是通过影响DNA 合成和细胞有丝分裂而发挥作用的,这些肿瘤药物的作用比较强,但缺乏选择性,毒副作用也比较大。人们希望能提高抗肿瘤药物的靶向性,高度选择地打击肿瘤细胞而不伤害正常组织。 随着生命科学学科的发展,有关肿瘤发生和发展的生物学机制逐渐被人们所认识,抗肿瘤药物的研究开始走向靶向合理药物设计的研究途径,产生了一些新的高选择性药物。 药物分类及作用机制: 靶向药物。从抗肿瘤药物靶向治疗的角度看,可将其分为三个层次: 第一层次:把药物定向地输入到肿瘤发生的部位,如临床上已采用的介入治疗,这是器官水平的靶向治疗,亦称为被动靶向治疗。 第二个层次:利用肿瘤细胞摄取或代谢等生物学上的特点,将药物定位到要杀伤的肿瘤细胞上,即细胞靶向,它带有主动定向的性质。 如利用瘤细胞抗原性质的差异,制备单克隆抗体与毒素、核素或抗癌物的偶联物,定向地积聚在肿瘤细胞上,进行杀伤,效果较好。 第三个层次:分子靶向,利用瘤细胞与正常细胞之间分子生物学上的差异,包括基因、酶、信号传导、细胞周期、细胞融合、吞饮及代谢上的不同特性,将抗癌药定位到靶细胞的生物大分子或小分子上,抑制肿瘤细胞的生长增殖,最后使其死亡。 血管抑制剂药物的发展。肿瘤生长必须有足够的血液供应,在癌发展和转移的过程中新的血管生长是必要的条件。新的血管生成涉及到多种环节,例如在血管内皮基底膜降解时金属蛋白酶活性增加。血管内皮细胞增殖、重建新生血管及形成新的基底膜时有许多生长调节因子参与,包括纤维生成因子(FGF)、血管内皮细胞生长因子(VEGF)、血小板源性生长
小分子靶向药物简述题库
小分子靶向药物简述 摘要:根据肿瘤细胞中分子的生物学特征与正常细胞中分子生物学特征的区别而研发的药物统称为分子靶向药物,是随着当代分子生物学、细胞生物学的发展产生的高科技药物。靶向药物治疗癌症,不仅效果好,而且副作用要比常规的化疗方法小得多。使用靶向药物的治疗方法称为靶向治疗(targeted therapy)。靶向药物(targeted medicine)是随着当代分子生物学、细胞生物学的发展产生的高科技药物,是目前(2012年)最先进的用于治疗癌症的药物,它通过与癌症发生、肿瘤生长所必需的特定分子靶点的作用来阻止癌细胞的生长。 关键词:药物靶向治疗 正文 一、作用机制 靶向药物与常规化疗药物最大的不同在于其作用机理:常规化疗药物通过对细胞的毒害发挥作用,由于不能准确识别肿瘤细胞,因此在杀灭肿瘤细胞的同时也会殃及正常细胞,所以产生较大的毒副作用。而靶向药物是针对肿瘤基因开发的,它能够识别肿瘤细胞上由肿瘤细胞特有的基因所决定的特征性位点,通过与之结合(或类似的其他机制),阻断肿瘤细胞内控制细胞生长、增殖的信号传导通路,从而杀灭肿瘤细胞、阻止其增殖。由于这样的特点,靶向药物不仅效果好,而且副作用要比常规的化疗方法小得多。使用靶向药物的治疗方法称为“靶向治疗”(targeted therapy)。分子靶向药物通过阻断肿瘤细胞或相关细胞的信号转导,来控制细胞基因表达的改变,而产生抑制或杀死肿瘤细胞。 二,代表药物 1. 具有靶向性的表皮生长因子受体(EGFR)阻断剂,如吉非替尼(Gefitinib,Iressa, 易瑞沙);埃罗替尼(Erlotinib, Tarceva) ZD1839(Iressa)可以增加PDD、CBP、Taxol、Docetaxel及ADM等药物的抑瘤效果,但不增加Gemzar的抑瘤作用;OSI-774(Tarceva, erlotinib)也是一种表皮生长因子受体-酪氨酸激酶( EGFR-TK)拮抗剂,属小分子化合物。2002年9
肿瘤靶向药物分类
肿瘤靶向药物分类 一、单克隆抗体 靶点抗体名称药物名称适应证 EGFR Cetuximab 西妥昔单抗Erbitux爱必妥结肠直肠癌, 头 颈部癌 Panitumumab帕尼单抗Vectibix 直肠结肠癌 HER2 Trantuzumab 曲妥珠单抗Herceptin 赫赛汀 乳腺癌 Pertuzumab帕妥珠单 抗 Perjeta 乳腺癌ado-trastuzumab Kadcyla 乳腺癌 VEGFR Bevacizumab 贝伐珠单抗 Avastin 阿瓦斯汀 直肠结肠癌 老年黄斑病 Ranibizumab雷珠单抗Lucentis 老年黄斑病Aflibercept阿柏西普Eylea 老年黄斑病 CD20 Rituximab 利妥昔单抗Rituxan, Mabther 美罗华 非霍奇金淋巴瘤 Libritumomab 替伊莫单抗 Zevalin 非霍奇金淋巴瘤Tositumomab 托西莫单抗 Bexxar 非霍奇金淋巴瘤ofatumumab Arzerra 淋巴瘤 TNF-a Infliximab 英夫利昔单抗Remicade 类风湿性关节炎 等免疫疾病 Adalimumab阿达木单 抗 Humira 关节炎 Etanercept依那西普Enbrel 恩利脊椎炎. Certolizumab赛妥珠单 抗 Cimzia Crohn病 Golimumab戈利木单抗Simponi 类风湿性关节 炎、银屑病关节 炎和强直性脊柱 炎 B-cell-activating Factor belimumab贝利单抗Benlysta 红斑狼疮CD3 receptor Muromonab-CD3莫罗 单抗 Ortholone(OKT3) 抑制排斥反应 CD33 Gemtuzumab 吉姆单抗Mylotarg 急性复发性髓性 白血病 CD11a Efalizumab依法珠单抗Raptiva 牛皮癣 CD15 fanolesomab Neutrospec 阑尾炎诊断CD30 brentuximab Adcetris 霍奇金淋巴瘤IL-1βCanakinumab Ilaris 佩林周期关联综 合征的治疗IL-12/23 P40 ustekinumab STELARA 牛皮癣 IL-2Rα receptor (CD25) Basiliximab 巴利昔单抗Simulect 抑制排斥反应IL-6 receptor tocilizumab托珠单抗Actemra 风湿关节炎 (RA) CTLA-4 Ipilimumab易普单抗Yervoy 晚期黑色素瘤
肿瘤小分子靶向药物分类
肿瘤小分子靶向药物分类 肿瘤小分子靶向药物分类 如今肿瘤的治疗手段多元化,其中靶向治疗为较新兴的治疗方式,由于毒副作用较小,疗效较突出,使得靶向治疗的成本也相对高昂。分子靶向药物是在分子生物学、分子遗传学理论基础上出现的新药, 因其精确的靶向治疗作用,相对于传统化疗药物有很多优势, 形成了一门治疗肿瘤的新领域,为肿瘤的治疗提供了一种不良反应较小的方法。近20 年来,随着医学科学的发展,大量以肿瘤细胞水平表达为靶点的新的抗肿瘤药物不断问世,并逐渐走向临床, 主要包括细胞信号转导分子抑制剂、新生血管抑制剂、靶向端粒酶抑制剂以及针对肿瘤耐药的逆转剂。攻击肿瘤的靶点有多方面, 目前研究较成熟的主要有肿瘤细胞表面的靶点(抗原或抗体), 如细胞膜分化相关抗原(CD13,CD20,CD22,CD33,CD52,CD117 等),细胞信号转导分子如表皮生长因子(EGF及其受体(EGFR和血管内皮生长因子(VEGF及其受体上的酪氨酸激酶,以及法尼基转移酶,基质金属蛋白酶等。分子靶向药物目前尚无统一的分类方法。根据作用靶点不同,可分为以下 4 类。 ?蛋白激酶细胞的分化信号传导因子中, 含有大量的蛋白激酶家族。在细胞信号传导过程中, 蛋白酪氨酸激酶十分重要, 它可催化ATP 上的磷酸基转移到许多重要蛋白质酪氨酸残基上使其磷酸化, 导致传导支路的活化, 影响细胞生长、增殖和分化,
而许多肿瘤细胞中酪氨酸激酶活性异常升高。超过50% 的癌基因及其产物具有蛋白酪氨酸激酶活性, 它们的异常表达将导致肿瘤的发生。此外, 该酶的异常表达还与肿瘤转移、肿瘤新生血管生成、肿瘤对化疗耐药有关。研究能阻断或修饰由信号传导失常引起疾病的选择性蛋白激酶抑制剂, 被认为是有希望的药物开发途径。目前, 已经发现了一些蛋白激酶抑制剂和针对不同蛋白激酶ATP结合位点的小分子治疗剂,并已 进入临床研究,如酪氨酸激酶抑制剂吉非替尼、厄洛替尼等及法尼基转移酶抑制剂安卓健等。 ?肿瘤血管生成因子正负调控子的平衡控制着肿瘤血管的生成,由此促进肿瘤的生长和转移,开发血管生成抑制剂是肿瘤研究最为活跃的领域之一。临床试验中的血管生成抑制剂有以下4 类。 ①调节基质反应,抑制基底膜降解的药物:Marimastat、BMS-275291等。基质蛋白酶(MMP )是一种蛋白水解酶,可使细胞外基质降解,它在肿瘤浸润、转移和血管形成过程中发挥关键作用。基质蛋白酶抑制剂(MMPI)可以通过抑制金属蛋白酶起到抗肿瘤生长与转移的作用。BMS-275291 是一种MMPI, 它与化疗联合用于晚期非小细胞肺癌的治 疗,目前已进入U /川期临床试验;Col-3是MMP-2 和MMP-9 抑制剂(I / U 期临床);AE941 是MMP-2、MMP-9 和MMP-12 抑制剂,它可以封闭VEGF和它受体的结合汕期临床试验治疗多发性骨髓瘤,川期临床试验用于肾癌和非小细胞肺癌的治疗。 ②直接抑制内皮细胞的药物:沙立度胺(Thalidomide)、烟曲霉素衍生物
肿瘤分子靶向治疗概述
肿瘤分子靶向治疗概述 肿瘤分子靶向治疗是指利用肿瘤细胞与正常细胞分子之间生物学的差异,以肿瘤的原 癌基因产物或其信号传导通路为治疗的靶点,通过单克隆抗体或酶抑制剂来阻断信号传导通 路,从而达到抑制肿瘤生长的目的。分子靶向治疗药物分为针对特定细胞标志物的单克隆抗 体、信号传导抑制剂、抗血管形成药物和针对某些细胞遗传学标志或癌基因产物的药物。 一、分子靶向治疗 (1)分子靶向治疗的概念 利用肿瘤组织或细胞素具有的特异性结构分子作为靶点,使用某些能与这些靶分子特异 性结合的抗体、配体等达到直接治疗或导向治疗目的的一大类治疗手段。 (2)分子靶向治疗代表药物种类 1、单克隆抗体曲妥珠单抗(Herceptin,赫赛汀)、利妥昔单抗(rituximab,美罗华)、西妥昔单抗 (IMC-C225,Erbitux,爱比妥)等。 2、信号传导抑制剂(小分子化合物类)吉非替尼(Iressa,易瑞沙)、厄洛替尼(Tarceva,特罗 凯)、甲磺酸伊马替尼(STI-571, Glivec )、拉帕替尼(Lapatinib )等。 3、抗血管形成药物贝伐单抗(Avastin,阿瓦斯汀)、恩度(Endostar,YH-16 )。 二、分子靶向治疗前的评估要点 1、评估患者及家属对疾病的认识程度,对诊断、预后的反应,经济状况,社会支持系统是 否良好。 2、评估患者精神状态、生命体征、重要脏器的功能状态、是否过敏体质、有无过敏史。 3、评估药品包装是否完好无损、有效期、药品有无浑浊、沉淀,储存设备是否安全。 4、评估抢救药品、设备是否齐全。备好心电监护仪、氧气、输液泵、抢救车等。 三、分子靶向治疗一般护理措施 1、用药前测生命体征(可使用心电监护仪) 2、备好抢救药品、设备。 3、用药前30分钟遵医嘱予解热镇痛药(如消炎痛口服)、抗组胺药(如非那根肌注)、糖 皮质激素(如地塞米松静推)
抗癌靶向药物研究
抗癌靶向药物研究 摘要:抗癌靶向药物制剂能使药物选择性地与靶组织在细胞或亚细胞水平上发生反应,使药物能够可控性地分布,并于靶区持续缓慢地释放药物,有效降低其对正常组织的毒副作用,从而提高化疗疗效。通过大量文献,从靶向治疗设计模式、靶向制剂的分类、抗癌靶向药物载体及影响药物靶向性的因素等方面进行探讨。发现尽管靶向制剂广泛应用于临床尚需时日,但它们对于克服肿瘤治疗中的毒副作用,从而提高疗效具有不可忽视的作用。 关键词:药物靶向;靶向给药系统;癌症治疗;靶向药物载体 前言 化疗经历了半个多世纪的不断发展和完善,已成为恶性肿瘤综合治疗的重要手段之一。但化疗的疗效却一直处于较低的水平,其原因在于化疗药物用量大,大多缺乏药理活性的专一性,对癌组织及正常组织均产生严重的毒副作用,患者在用药期间发生变态反应和产生多重耐药性(MDR),被迫停药,贻误治疗时机。为了提高抗癌药物的疗效,克服以上不足,药物靶向治疗在提高化疗药物疗效,降低毒副作用方面具有广阔前景[1]。大约一个世纪前Paul Ehrlich提出靶向治疗的概念,即在特定的导向机制作用下,将药物输送到特定靶器官从而充分发挥治疗作用。这类药物载体系统被称为“神奇子弹”(magic bullet)[2],它是由药物、导向和载体3部分构成。应用这种靶向制剂的主要优点有:减少用药剂量,降低对机体的毒副作用;持续产生药效,长时间保持靶目标的有效药物浓度。我们着重探讨了靶向治疗设计模式、靶向制剂的分类、抗癌靶向药物载体、及影响药物靶向性的因素等。 一、靶向治疗设计模式 靶向制剂系指一类能使药物浓集于靶器官、靶组织、靶细胞且疗效高、毒副作用小的靶向给药系统,为第四代药物剂型,且被认为是抗癌药的适宜剂型。靶向药物的原理是,通过药物的主要成分选择性地与靶组织在细胞或亚细胞水平上发生反应,使药物能够可控性地分布。理论上说,靶向药物系统通过以下一个或两个过程来提高化疗效果:1)尽可能使传递的药物分子部分特有地与癌细胞发生反应,而对正常的细胞仅有较小或没有毒副作用;2)使药物优先分布于癌细胞。在靶向药物的临床及实验研究中,主要研究的几种靶向设计模式有[3]: 1)靶向给药。将药物直接用于靶区,以提高靶组织的药物浓度。在脑部肿瘤的靶向治疗中,可以将药物直接注射人脑室,但是由于需要进行外科手术,使患者易受感染。这是最简单的靶向治疗方法,但是存在着技术困难使其应用受到很大限制。 2)在泄漏的脉管,药物被动聚集。研究发现,在某些特定的环境中,血管壁会发生泄漏。在泄漏区,增加的血管渗透能力能使大小合适的微粒从脉管中渗出,并聚集在缝隙空间中。如果微球负载药物,则药物微球将被带至泄漏区,微球的载体经生物降解而释放药物。 3)基于在靶区的反常pH值或温度的物理靶向,如在肿瘤或发炎组织。在发炎区域伴随有酸中毒和过高热,这使得利用某些在较低pH值或较高温度刺激响应的药物载体分解,释放药物成为可能。目前pH依赖型释药系统主要通过用pH敏感材料进行包衣的方法来实现,不同的pH敏感材料,其溶解度、衣膜厚度不同。Khan[4]等把一定比例德国Rohm公司生产的产品Eudragit S和Eudragit L制成共聚物,作
分子靶向药物分子量大小分类,作用机制,临床运用
福建医科大学基础临床 ——恶性肿瘤靶向分子治疗 3,分子靶向治疗药物按分子量大小可分为哪两类,以抗EGFR为例说明两类药物的作用机制,临床运用等方面的差别 第一种答案: 3.1 EGFR的单克隆抗体(mAbs)直接作用于EGFR的细胞外配体结合区,阻滞配体与EGFR的结合,抑制生长因子激活细胞有丝分裂信号的下传,抑制肿瘤细胞增殖。这类抗体主要有:西妥昔单抗(Cetuximab,Erbitux IMC C225嵌和型单抗)[8]、曲妥珠单抗(Trastuzumab)[9]、ABX EGFR(人源化单抗)[10]和EMD72000(人化的单克隆抗体)等。 3.2 EGFR的小分子抑制物这些小分子可逆的与ATP竞争结合EGFR胞内区激酶催化位点,抑制信号的下传达到抗肿瘤作用。此类已经进行临床研究的小分子化合物有:ZD1839(易瑞沙)[11]、OSI774(它赛瓦)[12]、CI1033(PD183805)、PKI 166等。 第二种答案:随着针对实体肿瘤治疗的分子靶点研究的深入,目前已经可以通过多种途径抑制这些靶点:一种是利用单克隆抗体等主要作用于胞外途径的大分子物质(相对分子质量为150000)与靶点结合,阻断胞外信号分子与靶点的结合;另一种是利用小分子抑制物(相对分子质量通常为500)直接进入细胞内封闭受体,干扰细胞内信号的传递。 目前用于EGFR靶向性治疗肿瘤的药物主要分为两类:EGFR单克隆抗体和小分子化合物酪氨酸激酶拮抗剂。酪氨酸激酶拮抗剂主要为小分子喹啉类化合物,能够竞争性抑制ATP 与EGFR胞内酪氨酸激酶结构域的结合,进而影响酪氨酸残基磷酸化,抑制EGFR下游的信号转导。酪氨酸激酶拮抗剂的抗EGFR单克隆抗体治疗肿瘤进展临床疗效有很大的个体差异,使治疗剂量的确立存在困难。EGFR单克隆抗体是与内源性配体竞争结合EGFR,通过抑制酪氨酸激酶的激活、促进EGFR内化等作用产生抗肿瘤效应。目前已有3种抗EGFR 单克隆抗体上市,与其他化疗药相比,这些抗体作用特异性强,副作用小,在临床上取得了较好的疗效。 补充:临床 单克隆抗体的特点是:理化性状高度均一、生物活性单一、与抗原结合的特异性强,应用于医学很多领域。 1.检验医学诊断试剂 ①病原微生物抗原、抗体的检测;
常用化疗药分类
CCSC是周期特异性药物,特异性地杀伤处于特定时相的肿瘤细胞,需等肿瘤细胞处于对应时相才有效,故应慢滴。 2. 化疗药物给药剂量按体表面积计算(文生氏公式) 体表面积(m2)=0.0061 X 身高(cm)+0.128X 体重(kg)-0.1529 工作中计算体表面积:以身高1.6m,体重60公斤,体表面积为1.6m2,做调整 3. 肿瘤病人治疗后,无复发,生存率》5年,算治愈 4. 联合化疗方案药物成原则 a两种以上作用机制不同的药物组成 b.周期非特异性药物和不同时相的周期特异性药物配合 c各药的毒性不相重复 d.—般3?4个药物最好,临床上一般2-3个药合用,4个药合用一般用于复发的肿瘤患者或者难治性的血液病患者, 5化疗药物的器官毒性 ADR (多柔比星,阿霉素):心脏毒性 BLM (博来霉素):肺纤维化 DDP (顺铂):肾毒性 L-OHP (奥沙利铂)、VCR (长春新碱)、PTX (紫杉醇):神经毒性 BCNU (卡莫司汀):肝毒性
6.化疗分为 a诱导化疗:又称新辅助化疗,实施局部治疗方法(如手术或放疗)前所做的全身化疗,目的是使肿块缩小、及早杀灭看不见的转移细胞,以利于后续的手术、放疗等治 疗。对于早期和晚期肿瘤患者不采用新辅助化疗的方法。 b.辅助化疗:手术治疗和放疗的后,杀灭手术无法清除的微小病灶,减少复发,提高生 存率。 c姑息化疗:对于手术后复发、转移或就诊时不能切除的肿瘤病人,目的并不是彻底地消灭肿瘤,而在于能够平稳地控制肿瘤的进展,缓解患者的痛苦,延长其生命。这时的化疗称作“姑息化疗”。 7.常用细胞周期特异性药物 S期特异性药物: 抗叶酸类:甲氨蝶呤(MTX,胸腺嘧啶、嘌呤)、培美曲塞(PEM,胸腺嘧 啶、嘌呤,)、雷替曲塞(胸腺嘧啶)、六甲蜜胺(嘧啶)抗嘧啶类:氟尿嘧啶(5-FU)、卡培他滨(CAPE,希罗达,5-FU前体药)、 替加氟(FT207, 5-FU衍生物)、替吉奥(替加氟+ 吉美嘧啶+奥替拉西钾)、抗代谢类 优福定(替加氟+尿嘧啶)、卡莫氟(HCFU,5-FU衍生物)、 阿糖胞苷(Ara-c)、吉西他滨(GEM,作用机制同Ara-c)、安 西他滨(Ara-c衍生物) 抗嘌呤类:6毓嘌呤(6-MP)、硫唑嘌呤(体内转化6-巯嘌呤起作用)、 氟达拉滨(Ara-A,阿糖腺苷类似物,抗病毒类)、硫鸟嘌呤 (6-TG)、喷他司丁(DCF,新的抗代谢药,本品是从链霉素菌
靶向型的药物可以分为三类
PH敏感性磁靶向硅基载药材料的研究 摘要PH敏感性磁靶向硅基材料是一类对外界环境的刺激响应较敏感,同时兼有靶向性的智能响应性材料,由于其具有多种潜在的用途而引起广泛的关注。本文综述了具有不同结构的PH敏感性磁靶向硅基材料在载药、释药方面的研究进展,主要包括PH敏感性磁靶向实心硅、介孔硅、中空核壳结构磁性材料的制备及药物可控释放方面的应用。 关键词PH敏感性磁靶向硅基材料可控释放 肿瘤是威胁人类健康的重大疾病, 抗肿瘤药物对正常组织又有一定的毒副作用[1],因此抗肿瘤药物递送及可控释放系统的研发已成为目前医药领域的热点方向。人体患恶性肿瘤的病变部位PH一般呈弱酸性(6.0左右)[2],PH敏感性材料可使药物选择性的在肿瘤部位释放,从而减少药物对正常组织部位的损害,为肿瘤患者提供了一条安全有效的疗法,因此,PH敏感性材料所具有的智能可控释放性能在医药领域具有潜在的利用价值。 靶向型的药物可以分为三类:被动靶向型药物;主动靶向型药物;刺激靶向型药物。被动靶向型药物是一般类型的抗肿瘤药物最常采用的治疗机制,他们主要通过渗透和滞留效应(EPR)[3],从肿瘤部位血管渗出,积累在肿瘤组织,药物在血液中循环的时间越长,到达肿瘤部位的机会就越大,在肿瘤部位积累的量也越大,可以有效的杀伤肿瘤细胞而对正常细胞危害性小。这种药物还可利用肿瘤部位酸性环境,设计一种PH控制响应性的药物,从而达到药物的控制释放。主
动靶向型药物依据受体配体结合的方式进行药物靶向型运输,如在药物载体上接上叶酸,药物就可以被靶向型的主动运输到有叶酸配体的细胞表面,使得药物的运输更准确。刺激靶向型药物是通过外在施加一种辅助作用如光、热、磁场等作用使药物靶向运输到肿瘤部位,磁性介孔硅基材料就属于这种刺激靶向型药物载体。基于以上三种靶向型机制,目前通过不同的材料如介孔材料、碳纳米管等已成功设计合成了靶向纳米颗粒。 磁性纳米粒子易氧化,比表面积较高,具有强烈的聚集倾向,难以直接应用。采用无定型SiO2对Fe3O4磁性纳米粒子进行表面包覆,SiO2包覆层增加了其化学稳定性,同时SiO2的无毒性和表面羟基的存在提高了其生物相容性[4],拓宽了磁性纳米粒子在生物[5]、催化[6]等领域的应用。硅基材料具有高的稳定性,表面易修饰,生物相容性好的特点,使其广泛的应用于生物医学[7],通过对硅表面修饰,可以有效的防止磁性纳米粒子的聚集,增强其稳定性。 PH敏感性磁性硅基材料主要是将PH响应性聚合物链段吸附或化学键键连在无机硅载体表面形成的,PH响应性系统在近几年受到了广泛的关注。PH响应性磁靶向硅基材料不仅能减少药物在血液循环时的泄漏,同时也可以增加药物载药量[8],进而双重提高药物对肿瘤细胞的杀伤作用。本文以不同结构的硅基材料为分类标准综述了具有PH敏感性磁靶向硅基材料在载药、释药方面的研究进展。 1 PH敏感性的磁性实心硅纳米载药材料 [9]Ali等[10]使用硅烷化试剂APTS对磁性实心硅MNP进行表面氨基
肿瘤分子靶向药物简介-历史及上市药物
肿瘤的靶向药物选择——国内外已经上市的分子靶向(MTT)药物... 一、靶向药物(targeted medicine)简介 靶向药物是目前最先进的用于治疗癌症的药物,是随着当代分子生物学、细胞生物学的发展产生的高科技药物。靶向药物与常规化疗药物最大的不同在于其作用机理:常规化疗药物通过对细胞的毒害发挥作用,由于不能准确识别肿瘤细胞,因此在杀灭肿瘤细胞的同时也会殃及正常细胞,所以产生了较大的毒副作用。而靶向药物是针对肿瘤基因开发的,它能够识别肿瘤细胞上由肿瘤细胞特有的基因所决定的特征性位点,通过与之结合(或类似的其他机制),阻断肿瘤细胞内控制细胞生长、增殖的信号传导通路,从而杀灭肿瘤细胞、阻止其增殖。由于这样的特点,靶向药物不仅效果好,而且副作用要比常规的化疗方法小得多。靶向药物可以分为以下几类: (一)小分子药物 小分子药物通常是信号传导抑制剂,它能够特异性地阻断肿瘤生长、增殖过程中所必需的信号传导通路,从而达到治疗的目的。例如诺华制药生产的格列卫(Gleevec,通用名Imitinib)、阿斯利康生产的易瑞沙(Iressa,通用名Gefitinib)均属此类; (二)细胞凋亡诱导药物 通过特异性地诱导肿瘤细胞凋亡,达到治疗的目的。如美国千年制药公司生产的Velcade(通用名bortezomib)、Genta公司生产的Genasense(oblimersen); (三)单克隆抗体 例如赫塞汀(Herceptin,通用名Trastuzumab),用于治疗HER2基因阳性(过量表达)的乳腺癌。这类药物是通过抗原抗体的特异性结合来识别肿瘤细胞的。 除上述列举的已经进入临床使用的靶向药物外,另外还有多种靶向药物正在开发中。 二、肿瘤的靶向药物上市历史回顾: ■白血病费城染色体开启靶向治疗之门 早在1960年,美国费城的研究者发现慢性髓性白血病(CML)患者中存在一个染色体异常。数年后,研究者发现这是9号和22号染色体长臂易位的结果。由于这个染色体异常首先在费城(Philadelphia)发现,故命名为费城(Ph)染色体。该染色体也成为了40年后上市的CML靶向治疗的靶点。2001年,首个被证实可对抗费城染色体分子缺陷的药物——伊马替尼以FDA史上最快的速度(仅经过3个月评审)获批上市,自此成为CML的标准治疗,使CML成为一种可控制的慢性病。 第2个治疗CML的靶向药物是达沙替尼,2006年被FDA批准用于伊马替尼不耐受或耐药的CML,2010年其适应证扩展至早期CML的初始治疗。同年,尼洛替尼获批用于CML。2012年,伯舒替尼(bosutinib)和普纳替尼(ponatinib)陆续获批治疗CML。 ■肺癌从EGFR到VEGF、ALK 1987年,研究者首次证实肿瘤细胞上的受体——表皮生长因子受体(EGFR)在非小细胞肺癌的生长和扩散中发挥重要作用。短短6年之后,首个靶向EGFR的非小细胞肺癌治疗药物EGFR酪氨酸激酶抑制剂(TKI)吉非替尼获FDA批准,次年同类药物厄洛替尼获批。在我国,自主研发的埃克替尼于2011年用于临床。 以血管内皮生长因子(VEGF)为靶点的贝伐珠单抗于2006年获FDA批准与标准化疗联合,作为不可手术的非鳞癌、已发生肺内或肺外播散,或已复发非小细胞肺癌的初始治疗。
分子靶向药物分类
分子靶向药物分类 导读:我根据大家的需要整理了一份关于《分子靶向药物分类》的内容,具体内容:很多人都听说过靶向药物,但是分子靶向药你又知道有哪些吗,是什么?下面是我为你整理的的相关内容,希望对你有用!一替伊莫单抗(泽娃灵) Ibritumomab tuixet... 很多人都听说过靶向药物,但是分子靶向药你又知道有哪些吗,是什么?下面是我为你整理的的相关内容,希望对你有用! 一 替伊莫单抗(泽娃灵) Ibritumomab tuixetan(Zevalin) 承认时间:2008年1月。 用途:恶性淋巴瘤。 作用:搜索带有CD20标志物的蛋白细胞(B细胞淋巴瘤),阻止其生长,消灭肿瘤细胞。 二 伊马替尼(格列卫) Imatinib(Glivec) 由日本Novartis Pharma开发的分子靶向药。 用途:以针对治疗慢性髓系白血病和消化道间质瘤被承认使用。 三 依维莫司 Everolimus 用途:手术无法切除,或转移的肾细胞肿瘤。 作用:抑制mTOR信号通路,防止肿瘤细胞分裂生长。
四 厄洛替尼 Erlotinib 用途:不能切除的复发/恶化的非小细胞肺癌。 作用:阻碍酪氨酸激酶的活动,抑制肿瘤细胞的增长。 五 吉非替尼(艾瑞沙) Gefitinib 在世界上,首先被日本承认使用的分子靶向药物。非常缺乏对此种药物副作用的认识,依然被投入使用,导致患者发生间质性肺炎,相继死亡的问题。 六 吉姆单抗奥佐米星 Gemtuzumab ozogamicin 利用基因替换产生的单克隆抗体,和抗生物质细胞毒药物刺孢霉素相结合形成的抗癌药物。 用途:复发或较难治疗,CD33抗原阳性的急性髓系白血病。 七 索坦(舒尼替尼) Sutent 用途:消化道间质瘤(GIST)和肾癌。 作用:以VEGF血管内皮生长因子(VEGF关系着肿瘤血管的生成)和PDGF 成长因子受体(PDGF关系着肿瘤细胞的生长)等目标为靶点。 八 西妥昔单抗(爱必妥) Cetuximab 承认时间2008年7月。
肿瘤靶向药物分类
肿瘤靶向药物分类 靶点抗体名称药物名称适应证 EGFR Cetuximab 西妥昔单抗Erbitux爱必妥结肠直肠癌, 头 颈部癌 Panitumumab帕尼单抗Vectibix直肠结肠癌 HER2Trantuzumab 曲妥珠单抗Herceptin 赫赛汀 乳腺癌 Pertuzumab帕妥珠单抗Perjeta乳腺癌ado-trastuzumab Kadcyla乳腺癌 VEGFR Bevacizumab 贝伐珠单抗 Avastin 阿瓦斯汀 直肠结肠癌 老年黄斑病 Ranibizumab雷珠单抗Lucentis老年黄斑病Aflibercept阿柏西普Eylea老年黄斑病 CD20Rituximab 利妥昔单抗Rituxan, Mabther 美罗华 非霍奇金淋巴瘤 Libritumomab 替伊莫单抗 Zevalin非霍奇金淋巴瘤 Tositumomab 托西莫单抗 Bexxar非霍奇金淋巴瘤ofatumumab Arzerra淋巴瘤 TNF-a Infliximab 英夫利昔单抗Remicade类风湿性关节炎 等免疫疾病 Adalimumab阿达木单 抗 Humira关节炎 Etanercept依那西普Enbrel 恩利脊椎炎. Certolizumab赛妥珠单 抗 Cimzia Crohn病 Golimumab戈利木单抗Simponi类风湿性关节 炎、银屑病关节 炎和强直性脊柱 炎 B-cell-activating Factor belimumab贝利单抗Benlysta红斑狼疮CD3 receptor Muromonab-CD3莫罗 单抗 Ortholone(OKT3)抑制排斥反应 CD33Gemtuzumab 吉姆单抗Mylotarg急性复发性髓性 白血病 CD11a Efalizumab依法珠单抗Raptiva牛皮癣CD15fanolesomab Neutrospec阑尾炎诊断CD30brentuximab Adcetris霍奇金淋巴瘤IL-1βCanakinumab Ilaris佩林周期关联综 合征的治疗IL-12/23 P40ustekinumab STELARA牛皮癣
