分子原子粒子的关系
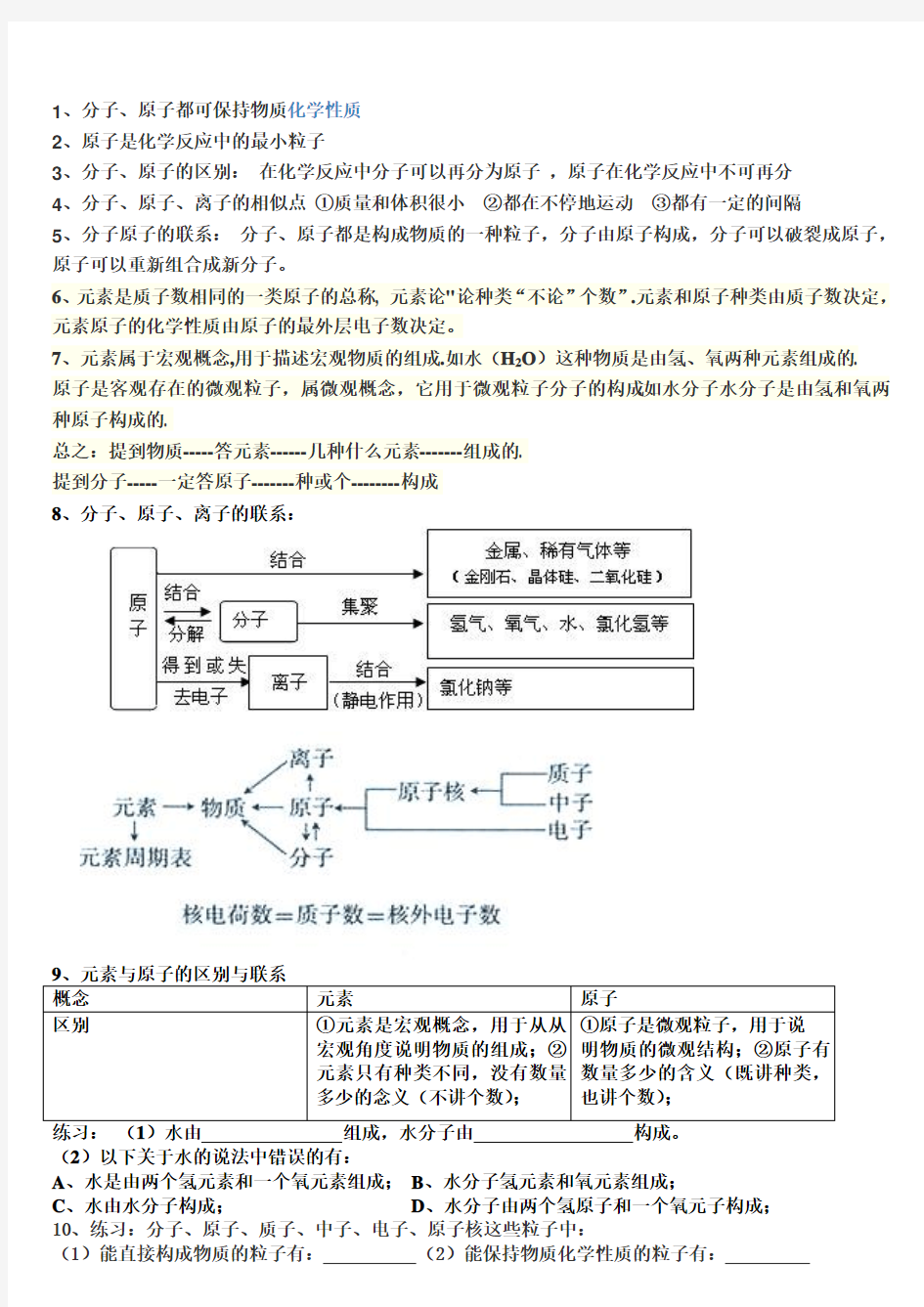

1、分子、原子都可保持物质化学性质
2、原子是化学反应中的最小粒子
3、分子、原子的区别:在化学反应中分子可以再分为原子,原子在化学反应中不可再分
4、分子、原子、离子的相似点①质量和体积很小②都在不停地运动③都有一定的间隔
5、分子原子的联系:分子、原子都是构成物质的一种粒子,分子由原子构成,分子可以破裂成原子,原子可以重新组合成新分子。
6、元素是质子数相同的一类原子的总称, 元素论"论种类“不论”个数”.元素和原子种类由质子数决定,元素原子的化学性质由原子的最外层电子数决定。
7、元素属于宏观概念,用于描述宏观物质的组成.如水(H2O)这种物质是由氢、氧两种元素组成的.
原子是客观存在的微观粒子,属微观概念,它用于微观粒子分子的构成.如水分子水分子是由氢和氧两种原子构成的.
总之:提到物质-----答元素------几种什么元素-------组成的.
提到分子-----一定答原子-------种或个--------构成
8、分子、原子、离子的联系:
)水由组成,水分子由构成。
(2)以下关于水的说法中错误的有:
A、水是由两个氢元素和一个氧元素组成;
B、水分子氢元素和氧元素组成;
C、水由水分子构成;
D、水分子由两个氢原子和一个氧元子构成;
10、练习:分子、原子、质子、中子、电子、原子核这些粒子中:
(1)能直接构成物质的粒子有:(2)能保持物质化学性质的粒子有:
(3)显示电中性的粒子有:(4)带正电荷的的粒子有:
(5)带负电荷的粒子有:(6)决定原子质量大小的粒子是:
12.下列关于原子、分子的叙述中正确的是( )
A.分子是保持物质化学性质的惟一粒子B.化学变化中分子可分,原子也可分
C.原子是化学变化中的最小微粒D.分子的大小及质量都比原子大
13、数字的意义:
①元素符号前的数字表示几个某原子。如2H中的“2”表示2个氢原子。
②化学式前的数字表示几个某分子。如2H2O中的“2”表示2个水分子。
③元素符号右下角数字表示一个某分子或离子中有几个某原子。如CO2中的“2”表示1个二氧化碳分子中有2个氧原子。
④元素符号右上角的数字表示一个某离子中带几个单位的正或负电荷。如Fe3+中的“3”表示1个铁离子带3个单位的正电荷。
⑤元素符号正上方数字表示某元素的化合价。如Fe表示铁元素的化合价是+3。
14、用化学用语填空:
①、二个钾原子________,②、2个铜原子,③氦气____④两个氮分子___;⑤八个氧分子__ ______;⑥3个氢分子,⑦2个铵根离子;⑧3个硫酸根离子;⑨4个氢氧根离子;⑩3个铝离子,⑾3个铁离子,⑿3个亚铁离子,⒀写出氯化铁的化学式并标出该化合物中铁元素的化合价;⒁磷的五价氧化物;⒂氧化铜中铜为+2价,⒃氧化镁中镁元素的化合价为正二价. 15、写出下列化学符号中数字“2”的涵义:
①2Mg_________________________②_______________________③Mg2+___________________________
④H2O_________________________⑤O2__________________________⑥3Fe2+___________________________
九年级化学分子和原子教学反思
九年级化学分子和原子教学反思 化学是初中学习的难点,关于九年级化学分子和原子的教学反思有哪些呢?接下来是为大家带来的关于九年级化学分子和原子教学反思,希望会给大家带来帮助。 分子和原子的概念是初中化学进入微观世界的第一节课,也是最难理解的一节课。今天第一节课顺利讲解了分子与原子的概念及化学变化的实质,感觉效果较好,特记录如下: 多媒体教学给我们传统教学带来前所未有的好处,但是有的时候 很多老师往往局限于多媒体而忽视清晰条理板书所带来的效果。分子与原子很多老师用多媒体动画演示化学变化的微观过程,感觉效果不错。课之前,我也做了非常好的课件,但是上课前,我准备还是不用课件讲了,因为这样会分散学生的注意力,因为我们的学生上课时走神的较多。完全集中精力去听课是这节课成功的关键,我用板书画出来的分子和原子把水的蒸发和水的电解讲解的淋漓尽致,同时我也把以后要用的C60分子模型在这里分析了“分子是由原子构成的”,学生也听得非常入神,能够完全配合老师的讲解内容,从多个侧面让学生去感觉、去体会、去认知、去学习“分子是保持物质化学性质的最小粒子,原子是化学变化中的最小粒子,”明白“分子、原子、物质间的关系:物质是由分子或者原子构成的,分子是由原子构成的通过画出来的分子和原子能够很好的分析了物质化学变化的实质,这样一
总结,学生完全掌握和理解了,整体效果很好! 九年级化学分子和原子教学反思(二)我们都知道,保持物质化学性质的基本粒子有三种;;分子、原子、离子。教学中先出现分子,然后才陆续出现原子和离子。当教学中出现了原子、离子之后,就必须向学生提出:保持物质化学性质的微粒除了分子之外,还有原子和离子这两种微粒。而每当这时,学生就很容易将这三种微粒进行比较。这对初中学生而言,他们的微观想象能力是有限的,所以好多学生理解起来就产生了障碍。例如:有的学生会问:“老师,分子是保持物质化学性质的最小粒子,那原子呢?”这时,我就要用许多相关的内容去给他们解释。可很多时候学生听后,从他们的表情中我就能看出来:他们并没有完全听懂。因为对于初中学生而言,他们刚刚接触化学知识,所以想让他们理解透彻,那真是一件很难的事情。况且现在的农村教学,还没有达到能把课件制作、网络教学带到课堂去帮助学生们“想象”的程度。 其实,我认为,对于分子、原子、离子这三种微粒,只有当它们直接构成物质时,才能保持这种物质的化学性质。根本不能把它们放在一起进行无关的大小比较,还给学生在一定程度上造成了理解上的障碍。因此,我仍赞同以前的旧教材(三年制初中教材)的说法:分子是保持物质化学性质的一种微粒。这种说法最恰当不过了,因为保持物质的化学性质的微粒除了分子之外,还有原子、离子呢!这样,学生理解起来也容易接受了。 “原子”的定义是:原子是化学变化中的最小粒子。
人教版初三化学分子和原子教案
第三单元课题1 分子和原子 (参考课时:2课时) 1 教学目标 1.1 知识与技能: ①认识物质是由分子、原子等微小粒子构成的。 ②认识分子是保持物质化学性质的最小粒子。 ③通用微粒的观点解释某些常见的现象。 1.2过程与方法: ①学习运用日常现象与课本理论相结合的方法,用课本理论来解释日常现象。 ②充分发挥学生的空间想象力。 ③学生运用比较、分析、归纳等方法对实验所得信息进行加工。 1.3 情感态度与价值观: ①对学生进行科学态度教育和辩证地看问题的思想方法教育。 ②逐步提高抽象思维的能力、想象力和分析、推理能力。 ③渗透物质的无限可分的辩证唯物主义的观点及科学态度和科学方法的教育。 2 教学重点/难点/易考点 2.1 教学重点 ①分子和原子概念的形成。 ②理解物质是由分子、原子等微小粒子构成的。 2.2 教学难点 ①建立微观粒子运动的想象表象,并初步体会它与宏观物体运动的不同点。 ②如何理解原子是化学变化中的最小粒子? ③分子和原子间的区别和联系。 2.3教学易考点 ①分子的性质特点? ②分子和原子有哪些共同点和不同点? ③利用分子的性质特点,解释生活中的各种相关现象。
3 专家建议 4 教学方法 创设情境——引入情境——进行实验——思考练习 5 教学用具 实验仪器:三个50ml烧杯,一个200ml烧杯,胶头滴管,量筒,温度计,玻璃棒。 实验样品:浓氨水溶液,酚酞溶液、酒精溶液、品红溶液。 6 教学过程 6.1 第一课时 在上课之前,以创设情境的方式开始本堂课的教学。可以向学生们设置一些问题情境,例如:1.把一瓶香水带进教室,放在讲台上,打开瓶塞,同学们为什么会闻到香味? 2.糖放入水中为什么会不见了? 3.衣柜中的樟脑片为什么不翼而飞了?4. 湿衣服为什么经太阳晒会变干? 其实,这些问题在很久以前就引起了一些学者的探究兴趣,他们经过反复的实验和探究,提出了物质都是由于不连续的微小粒子组成的设想。并用这一没想来解释上述问题。那么,事实是不是如此呢?这些微小粒子到底是什么呢?科学事实证明,这些微小粒子就是我们本课题将要学习的分子和原子。 板书:课题1 分子和原子 本节课我们先来学习第一个问题:分子的存在及其特点。 一、分子的存在及其特点 请大家仔细观察以下实验…… 向盛水的小烧杯中加入少量品红,静置,观察发生的现象。 为什么品红能在水中扩散呢?(提示学生用科学家提出的设想解释) 如果物质都是由不连续的粒子组成的,那么品红也不例外,组成品红的微小粒子向水小运动,就出现了品红向水中扩散的现象。 科学技术的进步早已证明,物质确实是由微小的粒子如分子、原子等构成的。现在我们通过先进的科学仪器不仅能够直接观察到一些分子和原子,还能移走原子。 1.分子是真实存在的 现在我们已经知道了分子是真实存在的,那么它有哪些特点呢?
《分子和原子》测试题
课题1 《分子和原子》练习题 一、选择题。(每题2分,共22题,共44分) 1. 下列关于原子的说法正确的是() A. 原子是构成物质的最小粒子 B. 原子是不能再分的最小粒子 C. 原子是保持物质化学性质上的最小粒子 D. 原子是化学变化中的最小粒子 2. 下列关于分子、原子的说法,正确的是( ) A. 分子可以再分而原子不能再分 B. 分子一定比原子大 C. 在化学变化的前后,分子和原子的种类保持不变 D. 分子能构成物质,而原子也能直接构成物质 3. 原子和分子的根本区别是( ) A. 大小和质量不同 B. 是否能保持物质的性质 C. 分子能直接构成物质而原子不能 D. 化学变化中分子可再分,而原子不能再分 4. 下列叙述中正确的是( ) A. 氧分子是保持氧气性质的最小粒子 B. 氯酸钾中含有氧分子,故加热时能放出氧气 C. 氮气和氧气混合后,它们的化学性质都会改变 D. 氮分子是保持氮气化学性质的最小粒子 5. 能说明分子在化学反应中可以再分为原子的事实是() A. 氧化汞制氧气 B. 用自来水制蒸馏水 C. 分离液态空气得到氧气和氮气 D. 碘升华为碘蒸汽 6. 下列关于分子和原子的说法错误的是() A. 分子是构成物质的一种粒子 B. 原子是化学变化中的最小粒子 C. 分子都是由两个原子构成的,分子都是由相同的原子构成的 D. 原子可构成分子,原子也可直接构成物质 7.下列说法正确的是() A.分子是保持物质性质的一种微粒 B.由分子构成的物质发生化学变化时,分子本身没有改变 C.同种分子构成的物质一定是纯净物D.纯净物是不含有任何杂质的物质 8. 下列能说明在化学变化中分子可分而原子不可分的是() A. 水受热变成水蒸气 B. 水在通电条件下生成氢气和氧气 C. 品红扩散 D. 酒精温度计能指示出温度高低 9. 距地球15~35km处有一处臭氧层,关于臭氧的叙述不正确的是() A. 臭氧是一种单质 B. 臭氧和氧气的性质完全相同 C. 臭氧和氧气混合后形成的是混合物 D. 臭氧转化为氧气,发生的是化学变化 10.关于氧气、液态氧、固态氧,下列说法:①它们的物理性质不同②它们的化学性质相同③它们的化学性质不同④它们由同种分子构成⑤它们为不同的物质。其中正确的是() A. ①②④ B. ①③④ C. ①②④ D. ②④⑤ 11. 以下物质中,不是由原子直接构成的物质是() A. Mn B. 汞 C. Fe D. 水 12. 氯化氢、氯酸钾、氯气三种物质中都含有() A. 氯原子 B. 氯离子 C. 氯分子 D. 氯元素 13. 下列有关分子的说法中错误的是() A. 酒精的挥发是由于酒精分子不断的运动而扩散到空气里去的缘故 B. 相同体积的冰和水含有相同数目的水分子 C. 从空气中分离得到的氧气分子和高锰酸钾分解得到的氧气分子性质相同 D. 1体积的水与1体积的无水酒精混合后总体积小于2体积,是因为分子间有间隔
初三化学_分子和原子练习题及答案
初三化学_分子和原子练习题及答案 集团标准化小组:[VVOPPT-JOPP28-JPPTL98-LOPPNN]
一、选择题: 1. 能闻到花香的原因是() A、分子有质量 B、分子间有间隔 C、分子在不断运动 D、分子体积小 2. 对分子的叙述,正确的是() A、分子是构成物质的惟一粒子 B、由分子构成的物质,保持物质性质的是分子 C、同种物质的每一个分子的化学性质都相同 D、分子的大小会随着物质体积的增大而变大 3. 下列变化中,构成物质的分子本身发生变化的是() A、糖溶于水 B、衣箱中樟脑丸不久不见了 C、工业上蒸发液态空气制氧气 D、红磷燃烧 4. 一壶水烧开后,壶盖被顶开,这是因为() A. 水分子变大了 B. 水分解成氢气和氧气 C. 水由液态变成气态,体积膨胀 D. 构成物质的粒子数目增多 5、最早发现电子的科学家是() A. 汤姆生 B. 道尔顿 C. 拉瓦锡 D. 阿伏加德罗 6、分子和原子的主要区别是() A. 分子是构成物质的微粒,原子不是构成物质的微粒 B. 分子质量都大于原子质量 C. 分子永恒运动,原子在分子中是不运动的 D. 分子在化学反应中可分,原子在化学反应中不能再分 7. 保持水的化学性质的粒子是() A. 氢原子 B. 氧分子 C. 氢分子 D. 水分子 8、下列关于物质的构成,叙述错误的是() A. 氯酸钾分子由钾原子、氯原子、氧原子构成 B. 氧分子由氧原子构成,氧原子由原子核和核外电子构成 C. 氧原子核由带正电荷的中子和不带电荷的质子构成 D. 水分子由氢原子和氧原子构成 9. 下列物质中,肯定是由一种分子(或原子)构成的物质是() A、水 B、纯净物 C、混合物 D、糖水 10. 已知某原子的原子核所带正电荷数为A,该原子核内有B个质子和C个中子,核外有D个电子,则() A. A=B=C B. B=C=D C. A=C=D D. A=B=D 13. 1999年度诺贝尔化学奖获得者哈迈德·泽维尔开创了“飞秒(10-15S)化学”的新领域,使运用激光谱技术观测化学反应时分子中原子的运动成为可能,你认为该技术不能观测到的是() A. 氧分子的不规则运动 B. 氧原子结合成氧分子的过程 C. 氧分子分解成氧原子的过程 D. 氧原子内部的质子、中子、电子的运动 14. 下列符号能表示两个氧原子的是() A. O 2 B. 2O C. 2O2- D. 2O 2 15. 下列物质中,含有氧分子的是() A. O 2B. H 2 O C. CO 2 D. SO 2 16. 2008年9月27日,我国航天员翟志刚进行了首次太空行走。在此次活动中需要“人造空气”来供航天员呼吸,这种“人造空气”中含有体积分数为70%的氮气、20%以上的氧气、还有二氧化碳。下列关于“人造空气”的说法中,不正确的是() A. “人造空气”比空气中的氮气含量低 B. “人造空气”中供给航天员呼吸的是氧气 C. “人造空气”中的氧气和空气中的氧气化学性质相同 D. 氮气对航天员呼吸没有任何作用,因此“人造空气”可以不需要氮气 17.下图表示物质分子的示意图。图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示单质的是()
分子和原子及原子练习题
分子和原子及原子的结构知识点总结 知识点一分子 1、分子是构成物质的一种微粒,表示的是一种微观概念,大部分物质是由分子构成的。(有些物质直接由原子构成) 2、分子的定义:分子是保持物质化学性质的最小(一种)微粒。 3、分子的性质 ①分子很小:质量和体积都很小,肉眼是无法看到的 ②分子总是在不断的运动着:温度升高运动速度加快。 ③分子间有间隔:一般来说气体分子间的间隔大,固体、液体分子间的间隔较小,因此气体可以压缩。 ④同种物质的分子性质相同,不同种物质的分子性质不同。 ⑤分子由原子构成,不同种物质的分子,原子构成不同,可分三种情形: a、构成分子的原子种类不同: b、构成分子的原子种类相同,但个数不同: c、构成分子的原子种类、个数都相同,但排列顺序不同(高中学习) 4、分子理论的应用: (1)用分子观点解释物理变化和化学变化。 物理变化:没有新分子生成的变化 由分子构成的物质 化学变化:分子本身发生变化,有新分子生成的变化。 (2)用分子观点解释混合物和纯净物: 混合物:由不同种分子构成的物质。纯净物:由同种分子构成的物质。
知识点二原子 1、定义:原子是化学变化中的最小粒子(用化学方法不能再分) 2、原子的性质 (1)原子的体积和质量都很小。(2)原子在不断的运动(3)原子间有一定的间隔 (4)同种物质的原子性质相同,不同种物质的原子性质不同。 3、化学变化的实质:在化学变化中,分子分解成原子,原子重新组合成新的分子。 注意:化学变化前后分子的种类一定改变,数目可能改变,原子的种类和数目一定不变。 注意:分子一定比原子大吗? 答:不一定! 金属单质 (如:Fe 、Cu 、Al 、Hg ) 5、由原子直接构成的物质 非金属固态单质 (如:C 、P 、S 、Si ) 稀有气体 (氦、氖、氩、氪、氙、氡 ) 6、原子的构成: 质子 (带 正 电荷) 体积很小,约占原子体积 的几千亿分之一 原子核(带正电)
分子、原子、离子及元素的关系
分子、原子及元素练习题 一、选择题 1、下列物质中含有氧分子的是() A.水 B.液氧 C.氧化汞 D.二氧化碳 2、下列关于水的组成叙述,正确的是() A.水是由氧气和氢气组成 B.水是由氢分子和氧原子构成 C.水是由氢元素和氧元素组成 D.水是由两个氢原子和一个氧原子构成
3、新装修的房屋常有一股异味,利用分子的性质解释该现象,最合理的是() A.分子在不断运动 B.分子的质量很小 C.分子间有间隙 D.分子的体积很小 4、“墙脚数枝梅,凌寒独自开,遥知不是雪,为有暗香来。”诗人在远处就能闻到梅花香味的原因是() A.分子很小 B.分子是可分的 C.分子间有一定的间隙 D.分子是在不断运动的. 5、原子的质量主要集中在() A.质子 B.中子 C.电子 D.原子核 6、居里夫人在1898年从几吨含铀的废料中提炼出0.3g镭。镭原子的核电荷数为88,相对原子质量为226,下列说法关于镭原子的说法中错误的是() A.质子数为88 B.中子数为88 C.电子数为88 D.质子数与中子数之和为226 7、某营养品说明书上标明:每片含钙200mg、铁4mg、锌5mg,这里所标示的钙、铁、锌是指() A.原子 B.元素 C.分子 D.离子 8、下列能决定元素元素化学性质的是() A.电子数 B.中子数 C.最外层电子数 D. 质子数. 9、2005年10月12日,我国载有两名航天员的“神舟6号”飞船在长征2号F捆绑式大推力火箭的运载下,进入太空。火箭的燃料是偏二甲肼(化学式为C2H8N2),下列关于偏二甲肼组成的叙述正确的是() A.由2个碳元素、4个氢分子以及1个氮分子组成 B.由碳、氢、氧三种元素组成 B. C.由2个碳原子、8个氢原子、2个氮原子构成 D.组成元素碳、氢氧的质量比为1: 4:1 10、关于氧气和铁的构成,下列说法中正确的是() A.由氧元素和铁元素构成 B.由氧分子和铁原子构成 C.由氧原子和铁原子构成 D.由氧分子和铁分子构成 11、下列说法中错误的是() A.水是由氢元素和氧元素组成的 B.原子是构成物质的一种基本微粒 C.由同种元素组成的纯净物叫做单质 D.含有氧元素的化合物就是氧化物 12.下列各组物质中,都是由分子构成的是() A.水、二氧化碳 B.氧气、铝 C.铜、食盐 D.氢气、氦气 13、一定量的单质某气体其体积随压强和温度的变化的原因是() A.气体分子个数发生变化 B.气体分子本身大小发生变化 C.气体分子间的间隔发生变化 D.构成分子的原子个数发生变化 14、向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验说明①分子处于不断运动之中; ②分子大,原子小;③分子可以再分,原子不能再分;④分子间有一定的间隔;() A. ①② B. ②③ C. ①③ D.①④ 15、下列关于分子、原子、离子的说法中,错误的是() A.在化学反应中分子能再分,原子不能再分 B.分子、原子、离子都能构成物质 C. 分子、原子都能保持所构成的物质的性质 D.水这种物质是由氢、氧两种原子直接构成的 16、下列叙述中,正确的是() A.氧分子的保持氧气化学性质的最小粒子 B.氮分子是保持氮气物理性质的一种粒子 C.液态空气是由空气分子构成的物质 D.氮气和氧气混合后,它们的化学性质都会改变 17、保持水化学性质的最小粒子是() A.氢原子和氧原子 B.氢分子和氧原子 C.水分子 D.水原子 18、用分子的观点分析下列变化,属于化学变化的是() A.一种物质的分子运动到另一种物质的分子中间去了 B.分子运动的速度变慢了 C.分子改变了,由一种分子变成了另一种分子 D.分子间的间隔变大了 19、下列现象不能用分子运动论解释的是() A.把两块表面干净平滑的铝片压紧就不容易将它们拉开 B.氧化汞受热分解生成汞和氧气 C.医院里充满了药味 D.在室内,同样表面积的热水比冷水蒸发的快 20、下列说法正确的是()
课题1 分子和原子练习题
课题1 《分子和原子》巩固练习 7.18 姓名 一、选择题。(下列各题只有一个正确答案,请将正确答案的番号填入题后括号内) 1. 下列关于原子的说法正确的是() A. 原子是构成物质的是小粒子 B. 原子是不能再分的最小粒子 C. 原子是保持物质化学性质上的最小粒子 D. 原子是化学变化中的最小粒子 2. 下列关于分子、原子的说法,正确的是( ) A. 分子可以再分而原子不能再分 B. 分子能构成物质,而原子也能直接构成物质 C. 在化学变化的前后,分子和原子的种类保持不变 D. 分子一定比原子大 3. 原子和分子的根本区别是( ) A. 大小和质量不同 B. 是否能保持物质的性质 C. 分子能直接构成物质而原子不能 D. 化学变化中分子可再分,而原子不能再分 4. 下列叙述中正确的是( ) A. 氧分子是保持氧气性质的最小粒子 B. 氯酸钾中含有氧分子,故加热时能放出氧气 C. 氮气和氧气混合后,它们的化学性质都会改变 D. 氮分子是保持氮气化学性质的最小粒子 5. 能说明分子在化学反应中可以再分为原子的事实是() A. 氧化汞制氧气 B. 用自来水制蒸馏水 C. 分离液态空气得到氧气和氮气 D. 碘升华为碘蒸汽 6. 下列关于分子和原子的说法错误的是() A. 分子是构成物质的一种粒子 B. 原子可构成分子,原子也可直接构成物质 C. 分子都是由两个原子构成的,分子都是由相同的原子构成的 D. 原子是化学变化中的最小粒子7.下列说法正确的是() A.分子是保持物质性质的一种微粒 B.由分子构成的物质发生化学变化时,分子本身没有改变 C.同种分子构成的物质一定是纯净物 D.纯净物是不含有任何杂质的物质 8. 下列能说明在化学变化中分子可分而原子不可分的是() A. 水受热变成水蒸气 B. 水在通电条件下生成氢气和氧气 C. 品红扩散 D. 酒精温度计能指示出温度高低 9. 距地球15~35km处有一处臭氧层,关于臭氧的叙述不正确的是() A. 臭氧是一种单质 B. 臭氧和氧气的性质完全相同 C. 臭氧和氧气混合后形成的是混合物 D. 臭氧转化为氧气,发生的是化学变化 10. 关于氧气、液态氧、固态氧,下列说法:①它们的物理性质不同②它们的化学性质相同③它们的化学性质不同④它们由同种分子构成⑤它们为不同的物质。其中正确的是() A. ①②④ B. ①③④ C. ①②④ D. ②④⑤ 11. 下列有关分子的说法中错误的是() A. 酒精的挥发是由于酒精分子不断的运动而扩散到空气里去的缘故 B. 相同体积的冰和水含有相同数目的水分子 C. 从空气中分离得到的氧气分子和高锰酸钾分解得到的氧气分子性质相同 D. 1体积的水与1体积的无水酒精混合后总体积小于2体积,是因为分子间有间隔 12. 下列说法中,正确的是() A. 化学反应中,分子的种类改变,但分子的数目不变 B. 电解水产生氢气和氧气,所以水中含有氢气和氧气 C. 分子能构成物质,有些原子也能直接构成物质 D. 氧气是由两个氧原子构成的 1
秋新人教版化学九上课题1《分子和原子》word学案
秋新人教版化学九上课题1《分子和原子》word学案 学习目标: 1.知识与技能 认识分子、原子的存在,了解其性质,明白得其概念。 2.过程与方法 学习运用比较、分析、归纳等方法对实验所得信息进行加工,能运用课本理论来说明日常现象。 3.情感态度与价值观 逐步提高抽象思维的能力,渗透物质无限可分的辩证唯物主义观点及认识物质的科学态度和科学方法。 【课前预习】 1 、构成物质的差不多微粒有哪些?构成水和氧气的最小微粒分别是什么? 2、分子是保持物质( )性质的( )粒子。 3、原子是()中的最小微粒。 4、分子的性质 (1)分子的体积和质量都 (2)分子总是在不停地_________,温度升高,分子运动速率 (3)分子间有___________,同一种物质的分子在固、液、气态时,分子间的间隔,温度升高,间隔。 【课内探究】 一、自主探究:依照课前预习以及课本内容,解决下列问题: 1、分子的概念 摸索感悟:水蒸发与水通电分解有什么本质区别? 用分子的观点说明物质的变化:物质在发生物理变化时,分子,发生化学变化时,分子, 分子是保持物质的最小粒子。? 摸索感悟:分子能保持物质的物理性质吗? 2.分子的构成:如1个水分子由构成。 3.定义原子是中的最小粒子。 4.分子与原子的关系 (1)区别:化学变化时,可分,不可分。 (2)联系:是由构成的。 (3)相同点:①质量、体积都②都在不停地 ③微粒间都有④同种微粒性质,不同种微粒性质 ⑤分子、原子都能够直截了当构成。 5.化学变化的微观说明 反应物的分子分解结合集合生成物。但有的物质直截了当由构成。以氧化汞受热分解为例:加热氧化汞时,分解为和,每2个构成1个氧分子,许多
初三化学分子和原子练习题
课题2 分子和原子 达标自查 1.物质在不同条件下的三态变化,主要是由于()。 A.分子的大小发生了变化 B.分子的质量发生变化 C.分子之间的间隔发生了变化 D.分子的形状发生变化 2.分子和原子的主要区别是()。 A.分子大、原子小 B.分子的质量大,原子的质量小 C.分子可直接构成物质,原子则要先构成分子后再构成物质 D.在化学变化中分子可再分,原子则不能再分 3.下列变化能证明分子在化学反应中可分的是()。 A.铁矿石磨成粉末 B.碘受热升华 C.加热水有水蒸气生成 D.加热氧气汞生成汞和氧气 4.构成二氧化碳气体的分子与构成液态二氧化碳的分子具有()。 A.相同的质量 B.不同的质量 C.相同的化学性质 D.不同的化学性质 5.下列有关分子的说法中错误的是()。 A.酒精的挥发是由于酒精分子不断的运动而扩散到空气里去的缘故 B.相同体积的冰和水含有相同数目的水分子 C.从空气中分离得到的氧气分子和高锰酸钾分解得到的氧气分子性质相同 D.1体积的水与1体积的无水酒精混合后总体积小于2体积,是因为分子间有间隔 6.在电解水的过程中,发生变化的粒子是,保持不变的粒子是和,生成的新粒子是和。该实验证明,在化学反应中 可再分,而则不能再分。 7.盛酒精、汽油的瓶子为什么要塞紧瓶塞? 能力提高 8.下列说法中,正确的是()。 A.化学反应中,分子的种类改变,但分子的数目不变 B.电解水产生氢气和氧气,所以水中含有氢气和氧气 C.分子能构成物质,有些原子也能直接构成物质 D.氧气是由两个氧原子构成的 9.由分子参加的化学反应,反应前后一定发生变化的是()。 A.分子种类 B.分子数目 C.原子种类 D.原子数目 10.运用分子的观点解释: (1)为什么人们常把湿衣服晾在太阳晒着的地方?
初三化学 分子和原子练习题及答案
分子和原子练习题及答案 一、选择题: 1. 能闻到花香的原因是() A、分子有质量 B、分子间有间隔 C、分子在不断运动 D、分子体积小 2. 对分子的叙述,正确的是() A、分子是构成物质的惟一粒子 B、由分子构成的物质,保持物质性质的是分子 C、同种物质的每一个分子的化学性质都相同 D、分子的大小会随着物质体积的增大而变大 3. 下列变化中,构成物质的分子本身发生变化的是() A、糖溶于水 B、衣箱中樟脑丸不久不见了 C、工业上蒸发液态空气制氧气 D、红磷燃烧 4. 一壶水烧开后,壶盖被顶开,这是因为() A. 水分子变大了 B. 水分解成氢气和氧气 C. 水由液态变成气态,体积膨胀 D. 构成物质的粒子数目增多 5、最早发现电子的科学家是() A. 汤姆生 B. 道尔顿 C. 拉瓦锡 D. 阿伏加德罗 6、分子和原子的主要区别是() A. 分子是构成物质的微粒,原子不是构成物质的微粒 B. 分子质量都大于原子质量 C. 分子永恒运动,原子在分子中是不运动的 D. 分子在化学反应中可分,原子在化学反应中不能再分 7. 保持水的化学性质的粒子是() A. 氢原子 B. 氧分子 C. 氢分子 D. 水分子 8、下列关于物质的构成,叙述错误的是() A. 氯酸钾分子由钾原子、氯原子、氧原子构成 B. 氧分子由氧原子构成,氧原子由原子核和核外电子构成 C. 氧原子核由带正电荷的中子和不带电荷的质子构成 D. 水分子由氢原子和氧原子构成 9. 下列物质中,肯定是由一种分子(或原子)构成的物质是() A、水 B、纯净物 C、混合物 D、糖水 10. 已知某原子的原子核所带正电荷数为A,该原子核内有B个质子和C个中子,核外有D个电子,则() A. A=B=C B. B=C=D C. A=C=D D. A=B=D 13. 1999年度诺贝尔化学奖获得者哈迈德·泽维尔开创了“飞秒(10-15S)化学”的新领域,使运用激光谱技术观测化学反应时分子中原子的运动成为可能,你认为该技术不能观测到的是() A. 氧分子的不规则运动 B. 氧原子结合成氧分子的过程 C. 氧分子分解成氧原子的过程 D. 氧原子内部的质子、中子、电子的运动 14. 下列符号能表示两个氧原子的是() A. O2 B. 2O C. 2O2- D. 2O2 15. 下列物质中,含有氧分子的是() A. O2 B. H2O C. CO2 D. SO2 16. 2008年9月27日,我国航天员翟志刚进行了首次太空行走。在此次活动中需要“人
初三化学分子和原子教学反思
初三化学分子和原子教学反思 在初中化学的学习中,对于初级阶段、启蒙阶段的初中学生而言,如何给“分子、原子”下一个更好的定义,能够帮助他们去更容易理解、接受这些微观粒子,是很必要的。下面是我为大家收集的初三化学分子和原子教学反思,望大家喜欢。 初三化学分子和原子教学反思一 1、在这节课的教学中,我感觉最难的就是举例子,既要举能够反映微观世界的还要保证这个例子能使学生对于微观世界的特征长期有印象。 2、由于本课属于微观世界,所以对学生来说非常抽象,学生难以懂得分子和原子真正的涵义,如何激发他们的兴趣是我在进行这堂课之前必须好好思量的。当然经过实际教学,仍有一部分同学还是不能理解物质的宏观和微观。 3、在教授本课时,我觉得还应加大实验力度,让同学们通过实验大胆猜想。例如除了书上品红的实验外,还可以做红墨水在水中运动的实验、蔗糖溶解的实验、将10ml水和10ml酒精混合的实验。 4、在本课的教学中,还应该化难为易,让学生们热爱化学,懂得如何学习化学。 初三化学分子和原子教学反思二 分子和原子的概念是初中化学进入微观世界的第一节课,也是最难理解的一节课。今天第一节课顺利讲解了分子与原子的概念及化学变化的实质,感觉效果较好,特记录如下: 多媒体教学给我们传统教学带来前所未有的好处,但是有的时候很多老师往往局限于多媒体而忽视清晰条理板书所带来的效果。分子与原子很多老师用多媒
体动画演示化学变化的微观过程,感觉效果不错。课之前,我也做了非常好的课件,但是上课前,我准备还是不用课件讲了,因为这样会分散学生的注意力,因为我们的学生上课时走神的较多。完全集中精力去听课是这节课成功的关键,我用板书画出来的分子和原子把水的蒸发和水的电解讲解的淋漓尽致,同时我也把以后要用的C60分子模型在这里分析了“分子是由原子构成的”,学生也听得非常入神,能够完全配合老师的讲解内容,从多个侧面让学生去感觉、去体会、去认知、去学习“分子是保持物质化学性质的最小粒子,原子是化学变化中的最小粒子,”明白“分子、原子、物质间的关系:物质是由分子或者原子构成的,分子是由原子构成的通过画出来的分子和原子能够很好的分析了物质化学变化的实质,这样一总结,学生完全掌握和理解了,整体效果很好! 初三化学分子和原子教学反思三 我们都知道,保持物质化学性质的基本粒子有三种——分子、原子、离子。教学中先出现分子,然后才陆续出现原子和离子。当教学中出现了原子、离子之后,就必须向学生提出:保持物质化学性质的微粒除了分子之外,还有原子和离子这两种微粒。而每当这时,学生就很容易将这三种微粒进行比较。这对初中学生而言,他们的微观想象能力是有限的,所以好多学生理解起来就产生了障碍。例如:有的学生会问:“老师,分子是保持物质化学性质的最小粒子,那原子呢?”这时,我就要用许多相关的内容去给他们解释。可很多时候学生听后,从他们的表情中我就能看出来:他们并没有完全听懂。因为对于初中学生而言,他们刚刚接触化学知识,所以想让他们理解透彻,那真是一件很难的事情。况且现在的农村教学,还没有达到能把课件制作、网络教学带到课堂去帮助学生们“想象”的程度。
分子原子粒子的关系
1 、分子、原子都可保持物质化学性质 2、原子是化学反应中的最小粒子3?、分子、原子的区别: 在化学反应中分子可以再分为原子,原子在化学反应中不可再分4?、分子、原子、离子的相似点①质量和体积很小②都在不停地运动③都有一定的间隔 5、分子原子的联系: 分子、原子都是构成物质的一种粒子,分子由原子构成,分子可以破裂成原子,原子可以重新组合成新分子。 6、元素是质子数相同的一类原子的总称,元素论"论种类“不论”个数”.元素和原子种类由质子数决定,元素原子的化学性质由原子的最外层电子数决定。 7、元素属于宏观概念,用于描述宏观物质的组成.如水(H2O)这种物质是由氢、氧两种元素组成的. 原子是客观存在的微观粒子,属微观概念,它用于微观粒子分子的构成.如水分子水分子是由氢和氧两种原子构成的. ?总之:提到物质-----答元素------几种什么元素-------组成的. 提到分子-----一定答原子-------种或个--------构成 8、分子、原子、离子的联系: 概念元素原子 区别①元素是宏观概念,用于从从 宏观角度说明物质的组成;② 元素只有种类不同,没有数量 多少的念义(不讲个数);①原子是微观粒子,用于说 明物质的微观结构;②原子有数量多少的含义(既讲种类,也讲个数); 水由组成,水分子由构成。 (2)以下关于水的说法中错误的有: A、水是由两个氢元素和一个氧元素组成;B、水分子氢元素和氧元素组成; C、水由水分子构成; D、水分子由两个氢原子和一个氧元子构成; 10、练习:分子、原子、质子、中子、电子、原子核这些粒子中:?(1)能直接构成物质的粒子有:
(2)能保持物质化学性质的粒子有: (3)显示电中性的粒子有: (4)带正电荷的的粒子有: ?(5)带负电荷的粒子有: (6)决定原子质量大小的粒子是: (7)在同一种原子里数目一定相等是粒子是: (8)在化学反应中,一定发生化学变化的是: 答案:1、分子、原子2、分子、原子3、分子、原子4、质子、原子核、5、电子6、原子核?7、质子、电子8、分子 11.原子是由位于中心的和核外构成,原子核是由和构成。 12.下列关于原子、分子的叙述中正确的是( )?A.分子是保持物质化学性质的惟一粒子 B.化学变化中分子可分,原子也可分?C.原子是化学变化中的最小微粒D.分子的大小及质量都比原子大 13、数字的意义: ①元素符号前的数字表示几个某原子。如2H中的“2”表示2个氢原子。?②化学式前的数字表示几 个某分子。如2H O中的“2”表示2个水分子。 2 中的“2”表示1个二氧化碳分 ③元素符号右下角数字表示一个某分子或离子中有几个某原子。如CO 2 子中有2个氧原子。?④元素符号右上角的数字表示一个某离子中带几个单位的正或负电荷。如Fe3+中的“3”表示1个铁离子带3个单位的正电荷。?⑤元素符号正上方数字表示某元素的化合价。如Fe 表示铁元素的化合价是+3。 14、用化学用语填空: ①、二个钾原子________,②、2个铜原子,③氦气____ ④两个氮分子___;⑤八个氧分 子________;⑥3个氢分子,⑦2个铵根离子;⑧3个硫酸根离子;⑨4个氢氧根离子;⑩3个铝离子,⑾3个铁离子,⑿3个亚铁离子,⒀写出氯化铁的化学式并标出该化合物中铁元素的化合价;⒁磷的五价氧化物;⒂氧化铜中铜为+2价,⒃氧化镁中镁元素的化合价为正二价. 15、写出下列化学符号中数字“2”的涵义: ①2Mg_________________________②_______________________③Mg2+_______ ____________________?④H2O_________________________⑤O2__________________________⑥3Fe2+___________________________
初中化学原子、分子、离子讲义
原子、分子、离子 知识点1:原子核外电子的排布 1、核外高速运动的电子是按能量由低到高,离核由近至远的顺序分层排布的 核外电子的运动状况: 电子层数:一二三四五六七…… 电子能量:逐渐升高 离核距离:逐渐增大 2、原子结构示意图:
核电荷数=质子数=电子数 相对原子质量≈质子数+中子数 3、元素周期表 元素:具有相同核电荷数(即质子数)的一类原子的总称 元素周期表与原子结构的关系: ①同一周期的元素原子的电子层数相同,电子层数=周期数 ②同一族的元素原子的最外层电子数相同,最外层电子数=主族数 4、原子的最外层电子数与元素的分类及化学性质的关系 最外层电子数得失电子元素性质 金属元素一般<4易失活泼
①元素的化学性质决定于原子的最外层电子数。 ②原子最外层电子数为8(氦为2)的结构称为稳定结构。 说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2) 最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构) 知识点2:离子的形成 1、定义:带电的原子或原子团叫离子. (原子团:常作为一个整体参加反应的原子集团) 2、分类: (1)阳离子:带正电荷的离子(原子失电子) (2)阴离子:带负电荷的离子(原子得电子) 3、离子的表示方法: (1)离子符号:(离子符号歪戴帽,先写数字后写号)Na+、Cl-、O2-、2Mg2+ Mg2+——表示镁离子(一个镁离子) 2Mg2+:小2表示每个镁离子带两个单位的正电荷,大2表示两个镁离子 离子符号表示的意义:表示离子(或一个离子) 离子符号前面的化学计量数(系数)表示离子的个数; (2)离子结构示意图:(特点:最外层稳定结构) 阳离子:质子数>电子数 阴离子:质子数<电子数
2019版人教版第一册第四章 第一节 原子结构与元素周期表 第三课时 核素练习题
第四章第一节原子结构与元素周期表 第三课时核素练习题 一、单选题 1.下列核素中,中子数和质子数相等的是( ) ①18O;②12C;③26Mg;④40K;⑤32S A.①②B.②⑤C.只有④D.③④ 【答案】B 【解析】 【分析】 【详解】 ①18O的质子数8,中子数为18-8=10,故①错误; ②12C的质子数6,中子数为12-6=6,故②正确; ③26Mg的质子数12,中子数为26-12=14,故③错误; ④40K的质子数19,中子数为40-19=21,故④错误; ⑤32S的质子数16,中子数为32-16=16,故⑤正确; 中子数和质子数相等的是②⑤,故选B。 2.合成新物质是研究化学的主要目的之一。意大利科学家最近合成了一种新型的氧分子O4下列关于O4的说法中,正确的是( ) A.O4是一种新型的化合物B.1个O4分子由两个O2分子构成 C.O4和O2互为同素异形体D.O4和O2可通过氧化还原反应实现转化 【答案】C 【解析】 【分析】 【详解】 A. O4是单质,不是化合物,A错误; B. 1个O4分子由4个O原子子构成,B错误; C. O4和O2是氧元素的不同单质,故互为同素异形体,C正确; D. O4和O2之间的转化过程中元素化合价不变,故通过非氧化还原反应实现转化,D错误; 答案选C。 3.某种元素原子的质量是ag,12C原子的质量是bg,N A是阿伏加德罗常数的值,下列说法不正确的是() A.由已知信息可得N A=12 b
B .Wg 该原子中含有 W a 个该原子 C .Wg 该原子的物质的量一定是A W aN mol D .该原子的摩尔质量是aN A g 【答案】D 【解析】 【分析】 【详解】 A .一个12C 原子的质量为bg ,A N 个12C 原子的质量为12g ,可得A 12 b N =,故A 正确; B .一个该原子的质量是ag ,则Wg 该原子的原子数目为 W a ,故B 正确; C .该原子的摩尔质量为1 A a g mol N -?,Wg 该原子的物质的量为 A W mol a N ,故C 正确; D .摩尔质量的单位是1g mol -?',故D 错误; 综上所述,答案为D 。 4.近年来我国政府强化了对稀土元素原料的出口管制,引起了美、日等国家的高度关注与不满。所谓“稀土元素”是指镧系元素及第五周期ⅢB 族的钇(39Y),它们被称为“工业味精”。它们在军工生产、高科技领域中有极为重要的作用,下列有关“稀土元素”的说法正确的是 ( )。 A .它们的原子核外均有5个电子层 B .它们的原子最外层均含有3个电子 C .它们均是金属元素 D .76Y 、80Y 中子数不同,化学性质不同 【答案】C 【解析】 【分析】 【详解】 A .镧系元素属于第六周期,而周期序数等于电子层数,则原子核外有6个电子层,选项A 错误; B .过渡元素最外层电子均只有1-2个,选项B 错误; C .过渡元素均为金属元素,选项C 正确; D .76Y 、80Y 互为同位素,化学性质几乎相同,选项D 正确; 答案选C 。 5.下列说法正确的是( )
最新第二章细胞的化学组成第一节细胞中的原子和分子一word版本
第二章细胞的化学组成第一节细胞中的原子和分子一、;1、细胞中含量最多的6种元素是C、H、O、N、P;统一性:组成生物体的化学元素种类,在无机自然界都;1、水:(1)含量:是活细胞中含量是最多的物质;自由水:是以游离形式存在,可以自由流动的水;(在代谢旺盛的细胞中,自由水的含量一般较多);结合水:是与其他物质相结合的水;(1)存在形式:离子(2)作用;①与蛋白 第二章细胞的化学组成第一节细胞中的原子和分子一、组成细胞的原子和分子 1、细胞中含量最多的6种元素是C、H、O、N、P、S。 2、组成生物体的基本元素:C元素。 3、生物界与非生物界的统一性和差异性 统一性:组成生物体的化学元素种类,在无机自然界都可以找到,没有一种元素是生物界特 有的。差异性:组成生物体的化学元素在生物体和自然界中含量相差很大。二、细胞中的无机化合物:水和无机盐 1、水:(1)含量:是活细胞中含量是最多的物质。(2)形式:自由水、结合水 自由水:是以游离形式存在,可以自由流动的水。作用有①良好的溶剂;②参与细胞内生化 反应;③物质运输;④维持细胞的形态 (在代谢旺盛的细胞中,自由水的含量一般较多) 结合水:是与其他物质相结合的水。作用是组成细胞结构的重要成分。(结合水的含量增多,可以使植物的抗逆性增强) 2、无机盐 (1)存在形式:离子(2)作用 ①与蛋白质等物质结合成复杂的化合物。②参与细胞的各种生命活动。 (如Mg2+是构成叶绿素的成分、PO43-是合成核苷酸原料、Fe2+是构成血红蛋白的成分、I-是构成甲状腺激素的成分。 第二节细胞中的生物大分子一、糖类 1、元素组成:由C、H、O 3种元素组成。 2、分类 附:二糖与多糖的水解产物:蔗糖→1葡萄糖+1果糖麦芽糖→2葡萄糖乳糖→1葡萄糖+ 1半乳糖淀粉→麦芽糖→葡萄糖纤维素→纤维二糖→葡萄糖糖原→葡萄糖 3、功能:糖类是生物体维持生命活动的主要能量来源。 4.糖的鉴定:原理: (1)淀粉:遇碘液变蓝色,这是淀粉特有的颜色反应。 (2)还原性糖(单糖、麦芽糖和乳糖):与斐林试剂反应,可以产生砖红色沉淀。(3)斐林
分子原子粒子的关系
1、分子、原子都可保持物质化学性质 2、原子是化学反应中的最小粒子 3、分子、原子的区别:在化学反应中分子可以再分为原子,原子在化学反应中不可再分 4、分子、原子、离子的相似点①质量和体积很小②都在不停地运动③都有一定的间隔 5、分子原子的联系:分子、原子都是构成物质的一种粒子,分子由原子构成,分子可以破裂成原子,原子可以重新组合成新分子。 6、元素是质子数相同的一类原子的总称, 元素论"论种类“不论”个数”.元素和原子种类由质子数决定,元素原子的化学性质由原子的最外层电子数决定。 7、元素属于宏观概念,用于描述宏观物质的组成.如水(H 2 O)这种物质是由氢、氧两种元素组成的. 原子是客观存在的微观粒子,属微观概念,它用于微观粒子分子的构成.如水分子水分子是由氢和氧两种原子构成的. 总之:提到物质-----答元素------几种什么元素-------组成的. 提到分子-----一定答原子-------种或个--------构成 8、分子、原子、离子的联系: 概念元素原子 区别①元素是宏观概念,用于从从 宏观角度说明物质的组成;② 元素只有种类不同,没有数量 多少的念义(不讲个数); ①原子是微观粒子,用于说 明物质的微观结构;②原子有 数量多少的含义(既讲种类, 也讲个数); 组子由构成。 (2)以下关于水的说法中错误的有: A、水是由两个氢元素和一个氧元素组成; B、水分子氢元素和氧元素组成;
C、水由水分子构成; D、水分子由两个氢原子和一个氧元子构成; 10、练习:分子、原子、质子、中子、电子、原子核这些粒子中: (1)能直接构成物质的粒子有:(2)能保持物质化学性质的粒子有: (3)显示电中性的粒子有:(4)带正电荷的的粒子有: (5)带负电荷的粒子有:(6)决定原子质量大小的粒子是: (7)在同一种原子里数目一定相等是粒子是:(8)在化学反应中,一定发生化学变化的是:答案:1、分子、原子2、分子、原子3、分子、原子4、质子、原子核、5、电子6、原子核 7、质子、电子8、分子 11. 原子是由位于中心的和核外构成,原子核是由和 构成。 12. 下列关于原子、分子的叙述中正确的是 ( ) A.分子是保持物质化学性质的惟一粒子 B.化学变化中分子可分,原子也可分 C.原子是化学变化中的最小微粒 D.分子的大小及质量都比原子大 13、数字的意义: ①元素符号前的数字表示几个某原子。如2H中的“2”表示2个氢原子。 O中的“2”表示2个水分子。 ②化学式前的数字表示几个某分子。如2H 2 ③元素符号右下角数字表示一个某分子或离子中有几个某原子。如CO 中的“2”表示1个二氧化碳分 2 子中有2个氧原子。 ④元素符号右上角的数字表示一个某离子中带几个单位的正或负电荷。如Fe3+中的“3”表示1个铁离 子带3个单位的正电荷。 ⑤元素符号正上方数字表示某元素的化合价。如Fe表示铁元素的化合价是+3。 14、用化学用语填空: ①、二个钾原子________,②、2个铜原子,③氦气____④两个氮分子___;⑤八个 氧分子__ ______;⑥3个氢分子,⑦2个铵根离子;⑧3个硫酸根离子;⑨4个氢氧根离子;⑩3个铝离子,⑾3个铁离子,⑿3个亚铁离子,⒀写出氯化铁的化学式并标出该化合物中铁元素的化合价;⒁磷的五价氧化物 ;⒂氧化铜中铜为+2价,⒃氧化镁中镁元素的化合价为正二价 . 15、写出下列化学符号中数字“2”的涵义: ①2Mg_________________________②
