材料科学与工程导论课后习题答案

第一章 材料与人类
1.为什么说材料的发展是人类文明的里程碑?
材料是一切文明和科学的基础,材料无处不在,无处不有,它使人类及其赖以生存的社会、环境存在着紧密而有机的联系。纵观人类利用材料的历史,可以清楚地看到,每一种重要材料的发现和利用,都会把人类支配和改造自然的能力提高到一个新的水平,给社会生产和人类生活带来巨大的变化。
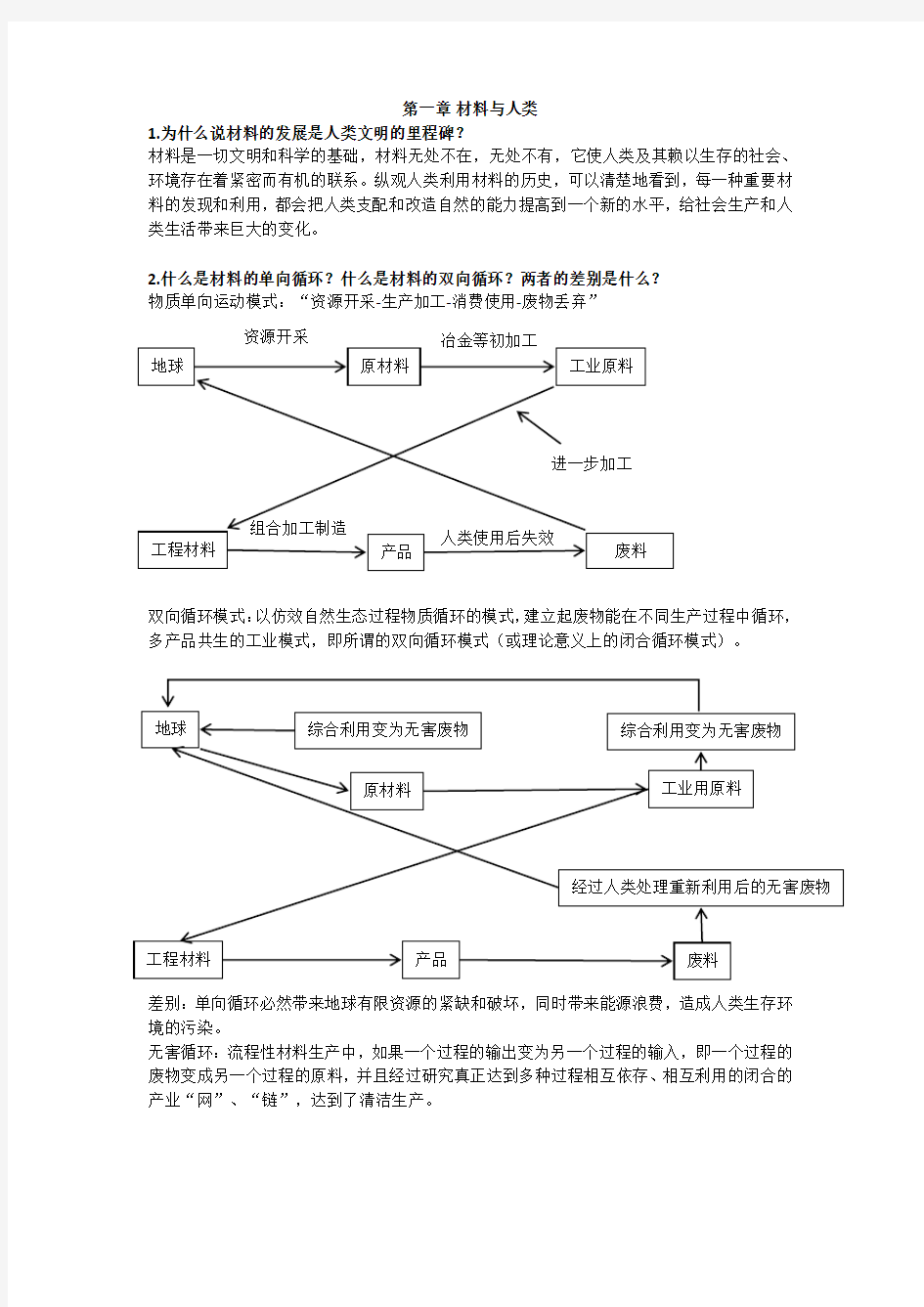
2.什么是材料的单向循环?什么是材料的双向循环?两者的差别是什么?
物质单向运动模式:“资源开采-生产加工-消费使用-废物丢弃”
双向循环模式:以仿效自然生态过程物质循环的模式,建立起废物能在不同生产过程中循环,多产品共生的工业模式,即所谓的双向循环模式(或理论意义上的闭合循环模式)。
差别:单向循环必然带来地球有限资源的紧缺和破坏,同时带来能源浪费,造成人类生存环境的污染。
无害循环:流程性材料生产中,如果一个过程的输出变为另一个过程的输入,即一个过程的废物变成另一个过程的原料,并且经过研究真正达到多种过程相互依存、相互利用的闭合的产业“网”、“链”,达到了清洁生产。
地球
原材料 工业原料 废料 产品 工程材料 资源开采 冶金等初加工 进一步加工 人类使用后失效 组合加工制造 地球 综合利用变为无害废物 综合利用变为无害废物 废料 工业用原料 原材料
产品 工程材料 经过人类处理重新利用后的无害废物
3.什么是生态环境材料?
生态环境材料是指同时具有优良的使用性能和最佳环境协调性能的一大类材料。这类材料对资源和能源消耗少,对生态和环境污染小,再生利用率高或可降解化和可循环利用,而且要求在制造、使用、废弃直到再生利用的整个寿命周期中,都必须具有与环境的协调共存性。因此,所谓环境材料,实质是赋予传统结构材料、功能材料以特别优异的环境协调性的材料,它是材料工作者在环境意识指导下,或开发新型材料,或改进、改造传统材料,任何一种材料只要经过改造达到节约资源并与环境协调共存的要求,它就应被视为环境材料。
4.为什么说材料科学和材料工程是密不可分的系统工程?
材料科学与工程的材料科学部分主要研究材料的结构与性能之间所存在的关系,即集中了解材料的本质,提出有关的理论和描述,说明材料结构是如何与其成分、性能以及行为相联系的。而另一方面,与此相对应,材料工程部分是在上述结构-性能关系的基础上,设计材料的组织结构并在工程上得以实施与保证,产生预定的种种性能,即涉及到对基础科学和经验知识的综合、运用,以便发展、制备、改善和使用材料,满足具体要求。两者只是侧重点不同,并没有明显的分界线,一般在使用材料科学这一术语时,通常都包含了材料工程的许多方面;而材料工程的具体问题的解决,毫无疑问,都必须以材料科学作为基础与理论依据,所以材料科学与材料工程是一个整体。
5.现代材料观的六面体是什么?怎样建立起一个完整的材料观?
材料科学与工程研究材料组成、性能、生产流程和使用效能四个要素,构成四面体。
成分、合成与加工、结构、性能及使用效能连接在一起组成一个六面体。
6.什么是材料的使用效能?
指材料在使用条件下的表现,如使用环境、受力状态对材料特征曲线以及寿命的影响。效能往往决定着材料能否得到发展和使用。
7.试讲一下材料设计与选用材料的基本思想与原则?
材料设计是应用已知理论与信息,预报具有预期性能的材料,并提出其制备合成方案。材料设计可根据设计对象所涉及的空间尺度划分为显微结构层次、原子分子层次和电子层次设计,以及综合考虑各个层次的多尺度材料设计。
从工程角度,材料设计是依据产品所需材料的各项性能指标,利用各种有用信息,建立相关模型,制定具有预想的微观结构和性能的材料及材料生产工艺方法,以满足特定产品对新材料的需求。
选材原则:1)胜任某一特定功能;2)综合性能比较好;3)材料性能差异定量化;4)成本、经济与社会效益;5)与环境保护尽可能地一致,即对环境尽可能友好。
选材思想:设计-工艺-材料-用户最佳组合的结果
第二章工程材料概述
工程材料分为:金属材料、陶瓷材料、聚合物材料、复合材料以及不宜归入上述四类的“其他材料”。
1.什么是黑色金属?什么是有色金属?
黑色金属主要是指钢铁和其他铁基合金,以及铬、锰及其合金,以其他金属为基的合金称为有色金属或称为非铁合金。二者总称为金属材料。
2.碳钢和合金钢如何分类?
含碳量不同:w(C)<0.25% 低碳钢;w(C)=0.25%~0.55% 中碳钢;w(C)>0.55% 高碳钢;
用途:结构钢:制造各种金属构件和机械零件;工具钢用来制造各种刃具、模具和量具;质量等级:普通碳素钢、优质碳素钢、高级优质碳素钢(杂质元素或缺陷程度不同)
P14 各种牌号
合金钢用途分类:合金结构钢、合金工具钢和特种性能钢(特殊钢)
按化学成分分类,可分为锰钢、铬钢、铬镍钢等。
合金元素的质量分数:低合金钢(合金质量分数低于5%)、中合金钢(5%~10%)和高合金钢(大于10%)
热处理后显微组织分类:珠光体钢、贝氏体钢、铁素体钢等
特殊钢主要包括各类不锈钢,其他还有耐热钢、抗氧化钢、耐磨钢
3.铸铁材料是怎样分类的?应用时怎样选择?
铸铁是碳的质量分数大于2.11%的铁碳合金,同时含有较多的Si、Mn和其他一些杂质元素,为了提高铸铁的性能,加入一定量的合金元素,称之为合金铸铁。同钢相比,铸铁熔炼简便,成本较低,具有优良的铸造性能、很高的耐磨性、良好的减震性能和切削加工性能,且缺口敏感性低等特点。因此铸铁广泛用于机械、冶金、石化、交通、建筑、国防等领域。
白口铸铁室温组织的碳全部或绝大部分以化合物渗碳体Fe3C存在,断口呈银白色,称白口铸铁。性能硬而脆,难以加工,很少应用。
灰口铸铁碳全部或大部分以片状石墨形式存在,组织中没有硬脆的莱氏体。断口呈暗灰色。价格低廉,容易切削加工,可用于制造汽缸、泵体、支座以及机床床身等。
球墨铸铁石墨为球状的铸铁综合力学性能好,可用于制造一些重要的机器零件,如曲轴、凸轮轴、齿轮等。
可锻铸铁碳以团絮状石墨形式存在。高强度铸铁,制造一些形状复杂,承受冲击载荷的薄壁小件。
蠕墨铸铁组织为钢基体上分布着蠕虫状石墨。制造工作温度较高或是具有较大温度梯度的零件,如大型柴油机汽缸盖、制动盘、排气管、钢锭模、金属型等。
合金铸铁分为耐磨铸铁:制造机床导轨、汽车发动机缸套等零部件。
耐蚀铸铁主要用于化工部门、造船部门使用的管道、阀门、泵类等零件。
4.铜合金在工程中怎样应用?
纯铜的机械性能较低,为满足制作工程结构的要求,加入不同的合金元素制成铜合金,实现固溶强化、时效强化和过剩相强化,从而提高其性能。
黄铜(Cu—Zn合金)、青铜(Cu—Sn合金)、白铜(Cu—Ni合金)。
5.钛合金为什么耐蚀?钛合金主要应用在那些领域?
钛在大气中极易形成氧化钛薄膜,因此在很多介质中有极高的抗腐蚀性,特别在海水中不腐蚀。
广泛应用于航空、航天领域以及大量民用工程,如高尔夫球具、人造关节、牙齿等。
6.环境材料的内涵是什么?
具有优良性能、与环境相协调、有利于环保的一类材料。
分为天然材料(如木制材料等)、循环再生材料、低环境负荷材料以及环境功能材料。
7.陶瓷材料是如何分类的?
陶瓷可定义为经过高温处理所合成的无机非金属材料。
传统陶瓷按用途可分为日用陶瓷、建筑陶瓷等。
现代陶瓷按性能和应用范围又可分为结构陶瓷、工具陶瓷、功能陶瓷等。
8.什么是结构陶瓷、工具陶瓷、功能陶瓷?试列举各自典型材料及主要应用。
结构陶瓷:作为结构部件的特种陶瓷
1.氧化铝陶瓷
是一种以Al2O3为主要成分的陶瓷,其中Al2O3的质量分数在45%以上。根据Al2O3的质量分数大小又可分为75瓷、95瓷、99瓷,它们的质量分数分别是75%、95%、99%。75瓷属于刚玉-莫来石瓷,95、99瓷属于刚玉瓷。刚玉瓷的性能最佳,但生产工艺复杂,成本高。刚玉-莫来石瓷性能较差,但成本低。
优点:1)很高的机械性能和介电性能2)耐高温;3)化学稳定性好,耐酸碱,且高温下也不会氧化;4)优良的电绝缘性能,特别是高频下的电绝缘性能好。
缺点:脆性大,不能承受冲击载荷,且抗热震性差,不能承受突然的环境温度变化。
氧化铝陶瓷应用:纺织用的导线器及火箭用的导流罩,氩弧焊机的气体罩、喷砂用的喷嘴、熔化金属的坩埚、高温热电偶套管、火花塞。
2.氮化硅陶瓷
氮化硅是六方晶系的晶体,有α-Si3N4和β-Si3N4两种。反应烧结的氮化硅是以α-Si3N4为主晶相;热压烧结的氮化硅以β-Si3N4为主晶相
性能:1)良好的化学稳定性,除HF以外,耐各种无机酸和碱溶液复试,也能抵抗熔融非铁金属的侵蚀;
2)优异的电绝缘性能;
3)硬度高,耐磨性好,摩擦系数小,且本身具有自润滑性;
4)热膨胀系数小,优异的抗高温蠕变性能,抗热震性能好
应用:高温轴承;测量铝液热电偶套管的理想材料;冶金和热加工工业的广泛应用。
3.碳化硅陶瓷
性能:1)高温强度大;2)常温硬度高,耐磨性好;3)耐蚀性强,与各种酸都不起作用;4)导热能力强
应用:1)火箭尾喷管的喷嘴;2)燃气轮机叶片,轴承;3)高温下热交换器,如核燃料的包封材料;4)耐磨,可制作各种泵的密封圈。
4.六方氮化硼
性能:1)良好的导热性和热稳定性;2)良好的电绝缘性,高温介电强度高;3)良好的化学稳定性;4)硬度低,自润滑性
应用:1)理想的高温绝缘和散热材料,热电偶套管,半导体散热绝缘零件;2)耐热耐腐蚀,制成高温构件,如火箭燃烧室内衬;3)粉状六方氮化硼可作耐高温、高载荷、耐腐蚀的润滑剂,在玻璃和金属成型中做脱模剂。
工具陶瓷
1.硬质合金:又称粘结碳化物,它是由金属粘结相和碳化物硬质相组成的粉末冶金材料,也属于复合材料。其中硬质相主要成分是WC、TiC,其次是TaC、NbC、VC等。粘结金属用铁族金属及其合金,以钴为主。
成分与性能
碳化物硬质相是硬质合金的骨架,起坚硬耐磨的作用,Co作为粘结相,使材料具有一定的强度和韧性,随着含Co量的增加,硬度下降,而强韧性增加。粗加工选用Co高的合金,精加工选用Co低的合金。
三类普通硬质合金:YT类适合加工韧性材料;YG类适合加工硬脆材料;YW类都可以,万能硬质合金。
性能:与工具钢相比,室温硬度较高,热硬性好,耐磨性好,刀具切削效率高。
由于硬度太高,性脆,很难机械加工,因而普通硬质合金常制备成刀片,镶在刀上使用。应用:刀具材料低钴(w(Co)<10%)普通硬质合金用于车刀、铣刀、转头;
矿山工具中钴(w(Co)=10%~25%)普通硬质合金主要用于制作中硬和硬岩冲击回转钻进钻头;低钴硬质合金用于制作地质和石油钻探中的旋转钻进钻头。
模具和量具中钴普通硬质合金用于制作拉伸模、拉拔模等;高钴硬质合金可用于制作冲击负荷较大的挤压模、冷镦模、冲压模等。
高硬度的结构件,如喷嘴、轴承;在尖端技术方面,火箭头,人造卫星返回大气层防燃烧的遮板等。
2.金刚石
性能:自然界硬度最高,极高弹性模量,导热率最高,极好的绝缘性,电子和空穴的迁移率高,掺入硼可制造半导体;热敏、透红外光等物质性质及良好的耐蚀性。
应用:刀具、工具、结构、功能材料
3.立方碳化硼
性能:很高的硬度、抗压强度、热稳定性、化学惰性和极好的导热性。
应用:刀具,模具,也可制成拉丝模、散热片,中子遮蔽窗口和高温半导体。
9.功能陶瓷是怎样定义的?
通过光电磁力热、化学、生物化学等作用后,具有特殊功能的陶瓷。
10.高聚物材料是怎样分类的?
11.塑料有哪些特性?热塑性塑料主要有哪几种?热固性塑料主要有哪几种?
12.什么是橡胶?它是怎样分类的?
13.合成纤维有哪些特性?主要用途是什么?
14.胶黏剂有哪些作用?涂料有哪些用途?
15.复合材料是怎样分类的?
复合材料是由两种或两种以上物理和化学性质不同的物质组成的一种多相固体材料。
按基体材料种类分:树脂基复合材料;金属基复合材料;无机非金属基复合材料
按增强材料形状和分布分:连续长纤维增强复合材料;短纤维、晶须增强复合材料;颗粒强化复合材料;弥散强化复合材料;积层结构复合材料;多组分的纤维、颗粒混杂复合材料。按复合效果分:力学复合材料;功能复合材料
16.复合材料的主要特点有哪些?
具有高的比强度和比模量;良好的抗疲劳性能和破损安全性;减振性能好;高温性能得到改善;独特的设计与制造。
17.树脂基复合材料有哪些性能?玻璃钢的应用有哪些特点?
18.金属基复合材料的类型有哪些?它是什么特点?
低温金属基复合材料:铝、镁合金;中温金属基复合材料:钛基复合材料;高温金属基复合材料:镍合金
特点:比非金属基复合材料的力学性能高,特别是在强度方面;具有良好的高温性能;比非金属基复合材料的非轴向和横向性能好;具有良好的导电性,导热性,可以避免静电聚集和减小构件的温差;具有类似金属的焊接性能,并能进行局部强化;金属基复合材料的密度要比非金属基复合材料大。
19.C/C复合材料的性能特点是什么?应用范围是什么?
优点:优良的抗热震性;优良的抗烧蚀性能;具有一定的强度和刚度;良好的化学稳定性缺点:碳在高温时易氧化,垂直于纤维方向的强度较低,材料中的孔隙率较高,材料的生产周期长,制造成本高,性能难以把握。
应用:航天航空领域(航天飞机的机翼前缘);医学领域(人造关节)
第三章工程材料的基本性能
1.材料的弹性模量E的工程含义是什么?它和零件的刚度有何关系?
材料在弹性变形阶段,应力(б)与应变(ε)成正比关系,两者的比值成为弹性模量,记为E,且E=б/ε
表征材料对弹性变形的抗力。其值越大,材料产生一定量的弹性变形所需要的应力越大,故工程上也称E为材料的刚度,主要取决于材料的本性,反映了材料内部原子间结合键的强弱,而材料的组织变化对弹性模量无明显影响。
零件刚度的大小取决于零件的几何形状和材料的弹性模量
一般来说,刚度与弹性模量是不一样的,弹性模量是物质组分的性质,而刚度是固体的性质;也就是说弹性模量是物质微观的性质,而刚度是物质宏观的性质。
2.试说明以下符号的意义:①бe:弹性极限,材料发生弹性变形的最大应力。
②бs(б0.2):屈服强度,在拉伸过程中,出现载荷不增加而试样还继续伸长的现象称为屈服,材料开始屈服时所对应的应力称为屈服应力,或称屈服强度,以бs表示。其表征材料发生明显塑性变形时的抗力。
③бb:抗拉强度,材料开始发生“颈缩”的应力。相当于断裂时的应力。
④бf:试样发生断裂时的应力值
⑤δ:延伸率
⑥ψ:断面收缩率
⑦αK :冲击总功A k 除以缺口处试样的截面积,表示冲击韧性。
⑧б-1:堆成交变应力的疲劳强度。
夏氏冲击实验能够简单迅速地评定材料的韧性,所以至今仍然被广泛地使用。缺点:由于是缺口试样,所以不能真实反映带裂纹的构件的脆断情况;对于评价材料的温度脆化倾向,冲击韧性只能用于具有明显延性脆性转折的材料;由于加载速度、试样或工件几何因素等的影响,冲击试验最好用于材料的比较和选择,而不能作为设计的标准。
3.比较布氏、洛氏、维氏硬度的应用范围,并简要说明它们各自的优缺点。
优缺点、应用范围
布氏硬度:具有较高的测量精度,因其压痕面积大,比较真实地反映出材料的平均性能,但不能测定高硬度材料。铸铁和钢、有色金属
洛氏硬度:操作迅速、简便,可由表盘上直接读出硬度值;压痕小,可测量较薄工件的硬度。缺点是精度较差,硬度值波动较大。很硬的材料、黄铜、低强度钢、高强度钢,较硬的材料 维氏硬度:测定材料范围广泛,很软或很硬的都可以;准确度高;但是测试手续较繁。 硬材料及一般材料
4.评定材料高温力学性能的常用指标有哪些?如何表示它们?
蠕变极限:是以在给定温度T (℃)下和规定的试验时间t (h )内,使试样产生一定蠕变伸长量的应力作为蠕变极限,用符号t T /δσ(MPa )表示,例如MPa 600500/3.0900
=σ表示材料在900℃,500小时内,产生0.3%变形量的应力为600MPa
持久强度:表征材料在高温载荷长期作用下抵抗断裂的能力,以试样在给定温度T (℃)经规定时间t (h )发生断裂的应力作为持久强度,用符号)(MPa t T σ表示。例如MPa 700600800=σ,表示材料在800℃,经600小时断裂的应力为700Mpa 。
5.通常描述材料的电、磁、热性能的主要指标有哪些?主要影响因素是什么?
表征材料电性质的物理量有:电阻R 、电阻率ρ、电导率б和电阻温度系数αt 电阻R 与被 测试测试样的几何形状和尺寸有关A
L R ρ=,表示对于一定的材料,若长度越长,横截面积越小,则电阻越大
温度和材料的加工工艺过程等因素对材料的电阻率产生影响。金属中,温度越高,电阻率越高。杂质元素增大电阻率,塑性变形增大电阻率
相对磁导率μr 、磁化率χ和磁化强度M 是描述材料磁性的参数。
为了描述材料磁性的强弱和磁化状态,常用磁化强度M 来表示,即单位体积内的总磁矩。 磁化强度M 和磁场强度H 的比值称为磁化率,记为χ;磁感应强度B 与磁场强度H 的比值称为磁导率,记为μ。定义μr=μ/μ0为相对磁导率
热容(材料种类有关,陶瓷大,金属小)、线膨胀系数和热导率表示热性能。
线膨胀系数表示材料的热膨胀性,其含义是温度上升1度,单位长度的伸长量。与原子间结合力有关,结合力越大,线膨胀系数越小,以共价键和离子键为主的材料的热膨胀性最小,金属居中,而具有范德瓦尔键的热膨胀性最大。
金属的热导率比较强
6.理解以下重要的术语和基本概念:导体、半导体、绝缘体、超导体、电导率、电阻率、磁化、磁化率、磁化强度、抗磁性、顺磁性、铁磁性、软磁材料、硬磁材料、热容、热导率、线膨胀系数、化学腐蚀、电化学腐蚀、氧化等。
导体:导体(conductor)是指电阻率很小且易于传导电流的物质。
半导体(semiconductor),指常温下导电性能介于导体(conductor)与绝缘体(insulator)之间的材料。
绝缘体的定义:不容易导电的物体叫做绝缘体。
超导是指导电材料在温度接近绝对零度的时候,物体分子热运动下材料的电阻趋近于0的性质。“超导体”是指能进行超导传输的导电材料。零电阻和抗磁性是超导体的两个重要特性。电导率,物理学概念,指在介质中该量与电场强度之积等于传导电流密度,也可以称为导电率。
电阻率是用来表示各种物质电阻特性的物理量。某种物质所制成的原件(常温下20°C)的电阻与横截面积的乘积与长度的比值叫做这种物质的电阻率。电阻率与导体的长度、横截面积等因素无关,是导体材料本身的电学性质,由导体的材料决定,且与温度有关。
一些物体在磁体或电流的作用下会显现磁性,这种现象叫做磁化。
磁化率,表征磁介质属性的物理量。常用符号cm表示,等于磁化强度M与磁场强度H之比。
磁导率英文名称:magnetic permeability 表征磁介质磁性的物理量。表示在空间或在磁芯空间中的线圈流过电流后、产生磁通的阻力、或者是其在磁场中导通磁力线的能力、其公式μ=B/H 、其中H=磁场强度、B=磁感应强度,常用符号μ表示,μ为介质的磁导率,或称绝对磁导率。
磁化强度:定义为媒质微小体元ΔV内的全部分子磁矩矢量和与ΔV 之比。
抗磁性(diamagnetism)是指一种弱磁性。组成物质的原子中,运动的电子在磁场中受电磁感应而表现出的属性。外加磁场使电子轨道动量矩绕磁场进动,产生与磁场方向相反的附加磁矩,故磁化率k抗为很小的负值(10-5—10-6量级)。因此,所有物质都具有抗磁性。顺磁性(paramagnetism)是指材料对磁场响应很弱的磁性。如用磁化率k=M/H 来表示(M 和H分别为磁化强度和磁场强度),从这个关系来看,磁化率k是正的,即磁化强度的方向与磁场强度的相同,数值为10-6—10-3量级。
铁磁性,是指物质中相邻原子或离子的磁矩由于它们的相互作用而在某些区域中大致按同一方向排列,当所施加的磁场强度增大时,这些区域的合磁矩定向排列程度会随之增加到某一极限值的现象。
软磁材料的定义:当磁化发生在Hc不大于100A/m,这样的材料称为软磁体。典型的软磁材料,可以用最小的外磁场实现最大的磁化强度。
磁性材料按照磁化后去磁的难易程度,可分为软磁性材料和硬磁性材料。磁化后容易去掉磁性的物质叫软磁材料,不容易去磁的物质叫硬磁材料。一般来讲软磁性材料剩磁较小,硬磁性材料剩磁较大。
热容的标准定义是:“当一系统由于加给一微小的热量δQ而温度升高dT时,δQ/dT 这个量即是该系统的热容。”(GB3102.4-93),通常以符号C表示,单位J/K。
热导率是指当温度垂直向下梯度为1℃/m时,单位时间内通过单位水平截面积所传递的热量。
线膨胀系数:物理名词,有时也称为线弹性系数(linear expansivity),表示材料膨胀或收缩的程度。
化学腐蚀:金属与接触到的物质直接发生氧化还原反应而被氧化损耗的过程。
电化学腐蚀就是金属和电解质组成两个电极,组成腐蚀原电池。
氧化(oxidation):狭义地,氧元素与其他的物质元素发生的化学反应,称其为氧化,也是一种重要的化工单元过程。广义的氧化,指物质失电子(氧化数升高)的过程。
第四章材料的原子结构和原子结合键
1.材料结构的具体涵义是什么?他们与性能的关系如何?
从材料学角度,材料结构从宏观到微观,即按研究的尺度大致可分为四个层次—宏观组织结构、显微组织结构、原子(分子)排列结构和原子中的电子结构。
材料的性能由其内部结构决定;原子中的电子状态和运动规律与固体材料的结构和性质有密切的联系,而原子间相互作用和聚集状态则进一步决定着材料的行为与性能。
2.从原子外层电子相互作用角度,说明各种结合键的具体特征。
P82 离子键:金属原子失去最外层电子给卤族原子,这样形成一个正离子和一个负离子,异种离子互相吸引离子键就是这种库伦引力,然而异种离子相吸导致的靠近并不能无限持续下去,靠近到一定程度,会由于电子轨道重叠引起的斥力达到一个平衡。由于离子电荷引起的力并不限制在一个方向上,故离子键不具有方向性,即键的大小在环绕离子的所有方向上相等,进而导致离子键材料很稳定,具有高度的对称性。又由于离子键的稳定,其材料熔点高,硬度高,脆性大和膨胀系数小,一般情况下,离子晶体没有自由电子,故为电和热的绝缘体。
共价键结合的相邻原子共同占有其部分价电子,使每个原子的最外层电子处于满壳层状态,将相邻原子结合起来,这种结合键称为共价键。
由于两个自旋方向相反的电子结合可使它们的自旋能量之和为零,达到稳定状态,于是已成对的电子不能再与其他原子中的电子结合成对,即共价结合的原子所能形成键的数目有一最大值,故共价键具有饱和性。
共价键是借共享电子结合的,按量子力学观点,共价键的形成是靠相邻原子外层未满壳层电子云的重叠,重叠越多,所形成的共价键就越稳定,故电子云重叠的方向是确定的,故有方向性。
固态(或液态)金属中外壳层电子的能量最高,而且最外层电子一般为1~2个或最多3个,由于原子间的相互作用,这些电子倾向于离开自身原子成为公有化的自由电子。这时价电子不再与任何一个特定的原子有特殊的关系,而是在金属正离子之间自由地运动,成为与若干离子实相关的电子,从而把金属原子结合起来,这就是金属键。金属键没有饱和性和明显的方向性。由于价电子可以随意运动,所以金属键材料有良好的导电导热性能;还由于各种金属键的结合能相差很大,故各种金属的强度、熔点相差很大。
范德瓦尔斯键和氢键:非常微弱,只有在很低的温度,才会液化和凝固
3.原子间有哪两种相互作用?材料为何具有一定的体积?
吸引力和排斥力p78
4.说明三大类材料的键性及与其性质的关系。(理解p85)
金属:金属键高的热传导系数和电导率是因为有些电子是非局域的、并可在三维方向移动,因此它们能够很快地输运电荷和热能。
不透明,易抛光出光泽,是由这些非局域电子对光频电磁振动的响应而引起的,这也是某些电子部分地独立于母体原子的另一结果
塑性好是因为金属键每一个正离子都是等同的,这样在某一局部地区,一群正离子在破坏了它们的键合后滑移到一个新的位置上,又可重新键合起来。
陶瓷:离子键离子键结合能大,材料硬脆;根据组成元素的自然倾向,金属元素放出外层电子给非金属原子,并保留在其中,这就是绝缘体,又是良好的热绝缘体;金属正离子与非金属负离子之间产生了强的吸引力。每个正离子被负离子所包围,反过来也一样,为了使正负离子分离,通常需要相当大的能量,因此陶瓷材料能抗机械力、抗热和抗化学作用。
共价键键性很强,若要使电子运动及产生电流,必须破坏共价键,这就需要施加高温或高电压,因此共价键材料的力学行为是脆性的,其电学行为如同绝缘体而不是导体
高分子材料
塑料的导电性和导热性很有限,这是因为全部热能必须依靠原子振动从热区传到冷区,这比金属中发生的自由电子传导能量的过程要缓慢得多;能够承受变形是因为,虽然主链内具有脆性的共价键,但是链与链的结合则是很弱范的德瓦尔斯键,只要分子键彼此滑动时,范德瓦尔斯键逐步发生局部破裂,所以就可以产生很大的变形;不耐热是因为一定程度的热扰乱虽不会损伤链内的共价键,却对分子链间的范德瓦尔斯键造成破坏。
5.分析控制原子配位因素的具体内容和它们对原子的空间排列所产生的影响。(p88 理解)共价:具体地说,围绕一个原子的共价键数取决于原子的价电子数目,也可称为共价配位。和原子的有效堆积共价结合时限制因素是最大配位数,离子键结合时则是最小半径比(达到尽可能接近,又不引发较大斥力的平衡状态),金属由于没有饱和性和明显的方向性,一般都可以达到最密堆积
6.试分析弹性模量E的微观表达式的涵义及其意义。
晶体的弹性模量只代表原子间结合键的刚性,是一个仅反映原子间结合能大小的指标,故它是稳定的材料性质。
7.试对比金刚石与石墨,为何它们的性质如此截然不同?
金刚石是纯共价键晶体,有极高硬度,对电、热的绝缘性很好,具有三维立体结构。石墨却是层状结构,为六方排列的层(或片),尽管石墨层内有强大的共价键,但是层与层之间确实很弱的范德瓦尔斯键,而且层间距大,所以层与层间易相对滑动,可用作润滑材料。
第五章固体材料中原子的排列与缺陷
1.材料中按原子排列的秩序,共有哪三种情况。分析与聚集态材料对应的情况。
无序、短程有序和长程有序
若材料中仅存在短程有序排列,称其为非晶体或无定形材料,有时也称之为玻璃态或玻璃。原子具有长程有序排列的材料即为晶体材料。
2.绘示意图说明材料从液体固体的凝固方式有哪几种。其实际方式的主要影响因素及主要判据是什么?其内在原因是什么?
一种是自然冷却形成晶体,另一种是快速冷却形成非晶体。
冷速;转变成玻璃态的温度T g和结晶温度T m的间隔,间隔越小,越容易转变为非晶态
判据:若为长程有序则为晶体,短程有序则为非晶体。
3.三大类材料的结晶倾向如何?原因何在?
金属晶体:面心立方、体心立方、密排六方这是因为金属键具有无方向性的性质,且每个阵点只有一个原子的缘故
陶瓷材料一般是离子晶体,也有的是共价晶体适应键型、离子尺寸差别和原子价引起的种种限制
4.晶体的周期性结构如何进行几何描述?晶体结构与空间点阵的相互关系如何?
在探讨晶体结构时,可以把结构设想为在所有方向上都能延伸到无穷远处。原子在空间中分布规律性的基本定义就是空间点阵的基本定义。以几何点代替具体的粒子就是空间点的阵列,如果每一个阵点都具有相同的环境,阵点在三维空间的分布就形成了一个空间点阵
空间点阵是晶体结构的几何抽象
5.三大类材料原子空间排列的主要倾向如何?并简要分析其原因。
6.掌握三种最简单晶体结构的特征(晶胞原子数、致密度、配位数、密排面与密排方向等)。
晶胞原子数致密度配位数密排面密排方向
面心立方 4 0.74 12 {111}<110>
体心立方 2 0.68 8 无<111>
密排六方 4 0.74 12 (0001)
(0002)<1120>或<100><110>
7.陶瓷材料的结构特性是什么?是如何构造起来的?了解陶瓷材料比较简单的几种晶体结构。
大多数陶瓷材料是金属与非金属元素之间的化合物所构成的多晶固体材料,它们的原子键结合方式是部分或整个是离子键。大多数陶瓷材料都是由离子键构成的离子晶粒,也有由共价键组成的共价晶体。构成离子晶体基本质点之一的非金属元素的原子半径大,它们的原子排列可以是各种不同的晶系,从而组成离子晶体的骨架,金属原子直径小,它藏在非金属原子的间隙之中,这样可形成配位四面体或八面体
金刚石型立方结构、氯化钠和氯化铯结构、晶态氧化硅
8.晶体中存在哪几种不完整性?它们的主要意义何在?
点缺陷:在三维空间中各方向上的尺寸很小,故又称零维缺陷,如空位、间隙原子、杂质原子、色心等。
点缺陷:杂质原子
共价晶体中的置换杂质,通常引起并存的电子缺陷,从而明显地改变材料的导电性。
例如,半导体材料鍺(四价)中含有五价砷或三价镓,在键合轨道上会多出一个自由电子或电子空穴,两类电子缺陷都可以运动,因此导电率增加。
离子晶体也允许置换杂质,但条件是保持电中性。
例如Ca2+置换了两Na+离子,却只占据一个位置。于是,这种杂质创造了另一种称为阳离子空位的缺陷。它对离子晶体的电学性质有影响,加电场时,阳离子空位会反复地与相邻阳离子交换位置而产生电流。当然在这种情况下,导电相当于带正电荷阳离子的运动。
点缺陷:空位与自间隙原子
空位是晶体中没有被占据的原子位置,而自间隙原子是晶体本身的原子占据了间隙位置。产生空位原因:晶体中原子热振动,一些原子的动能大大超过给定温度下的平均动能而离开原来的位置,造成原位置原子的空缺。温度升高,凝固过程中的塑性变形以及高能粒子辐射
也促进空位的形成。
自间隙原子分为三种:当一个原子离开点阵正常位置(从而产生一个空位)并挤入一个间隙位置时所产生的一对点缺陷称为弗兰克尔缺陷;肖脱基缺陷,即正负离子空位;正负自间隙原子呈中性
点缺陷周围的点阵畸变提高了金属的强度,其他材料的点缺陷直接影响导电等性质。另一方面,点缺陷(如空位)的一个非常重要的特点是它们能够与相邻原子交换位置而运动,这使得在较高温度时可以在固态中进行迅速迁移,即进行扩散。
线缺陷:在三维空间中两个方向尺寸很小,而另一个方向上尺寸较大,故又称一维缺陷,位错就是这种缺陷。从晶体塑性变形角度,当晶体的一部分相对于另一部分在切应力作用下进行相对运动或滑移时,晶体的已滑移部分与未滑移部分的交界线即为位错。
对晶体材料的许多现象与行为,如金属的相变、扩散、再结晶、蠕变与断裂等起着重要作用。
面缺陷:在三维空间中一个方向尺寸很小,另两个方向尺寸较大,故又称二维缺陷,如晶界、亚晶界、相界、层错、孪晶界、有序畴界、生长层、胞壁、磁畴界等。
细化晶粒,增大界面面积是强化金属、陶瓷材料的重要强化手段;界面还往往是相变的发源地,界面与表面又是原子扩散的快速通道;晶界对于透明陶瓷的透光性能有很大应先,晶粒细小,尺寸接近均一、晶界处无杂质是透明陶瓷获得高度透光性的重要条件。
体缺陷:在三维空间中三个方向上尺寸较大,故又称三维缺陷,如沉淀相、夹杂物、空洞等。
9.举例说明材料中原子排列是如何影响材料的行为与性能的。
金属密度大,是因为金属键无方向性,可以达到密排堆积,而聚合物及陶瓷是共价键或离子键,不可以达到密排,且组成它们的原子(C、H、O)较轻,所以密度较小。
在离子和共价晶体中,结合键的性质常对力学性能起着更重要的作用,而原子排列的影响成为次要;金属晶体中,晶体结构因素对力学性能则起着重要作用。
高聚物中链结构对其性能影响?
1)高聚物由于分子量很大,是由数量巨大的原子化学键合而成,其与低分子物质相比有一定的机械强度。
2)高聚物主链上的原子以共价键结合,纵向延伸即成长链,长链是柔软的,可以任意弯折,多条长链的聚合,使长链之间具有相互作用,使得强度提高,柔性下降。
3)非晶态聚合物中相邻的分子链靠范德瓦尔斯力凝固起来的,比较弱,所以熔点,强度低;若链与链之间是共价键合,即交联,聚合物的强度会提高。
1)链状硅酸盐的链内离子键结合,使材料具有较高的硬度和强度,但是链与链之间的结合没有链内原子间的结合那样强,故受力后容易断裂,即平行于硅酸盐链方向的破坏。有时链间是由分子链和离子键共同结合的,常呈细长纤维状形态,则易以纤维状进行分离。
2)层状结构的硅酸盐,由于层与层之间结合很弱(分子键),很容易发生断裂。云母易剥裂成片,滑石具有润滑性,它们都与这种结构排列有关。
3)网状结构则是硅—氧四面体以三维方向相互结合的结果。实际上它是分子式为(SiO2)的巨大分子,由于其共价键的空间立体网络,因此具有高硬度
n
4)若为玻璃态,则硅酸盐材料也会具有非晶的一些性质,如各向同性。
位错会阻碍晶体的塑性变形,由于陶瓷材料键合特点,位错阻力特别大,故又脆又硬。
第六章固体材料热力学状态:自由能、相图、相与组织
1.影响材料系统自由能的两大因素是什么?对于材料系统产生什么具体影响?
温度:在某温度下存在的相相对于其他相来说都是自由能最低的。自由能数值的相对大小决定了任一相的稳定性。
成分:它是各个组元的相对质量分数,与化学势息息相关,反应都是向降低化学势的方向进行。
2.试分析自由能曲线与材料相图的关系。
由已知的自由能-成分曲线可以将相图作出来。通过热力学计算作出各温度下的自由能-成分曲线。再根据公切线法则,找出平衡相的成分,然后综合画在一张温度-成分坐标图上,即得到相图。自由能-成分相图还可用来判断和估算与各种反应相对应的自由能变化。
3.分析材料相图的含义和工程意义。
相图亦称为状态图或平衡图,是用几何的方式来描述处于平衡状态(非平衡态一般不适用)下材料的成分、相和外界条件的相互关系。
相图主要用于金属材料与陶瓷材料领域。相图是研究这些材料中各种微观结构及其变化规律的有效工具,它简练地描绘了平衡条件下的材料状态,为冶金及材料工作者提供了有益的资料。
工程意义:1)随着科学技术的发展,各行业对材料的要求也越来越高,实际材料很少是纯元素的,而是由多种元素组成,要弄清楚组元间的组成规律,了解什么成分在什么条件下形成什么相,因而相平衡关系的研究就成为使用和研制材料的理论基础.
2)合金在加工、处理之后的组织状况也可用相图作为分析依据或参考资料。
3)在科研及生产实践中,相图是研制新材料、正确选择和制定合金的熔炼、铸造、压力加工和热处理工艺,还有陶瓷材料的烧结工艺,以及进行材料各种状态金相分析的重要工具。
4.试分析相与组织两者概念上的差异与相互间的联系。
组元是组成材料最基本、独立的物质,组元可以是纯元素,也可以是稳定化合物。金属材料的组元多为纯元素,陶瓷材料的组元多为化合物。
材料中具有同一化学成分且结构相同的均匀部分叫相。
材料内部的宏观与微观形貌称为组织,这些组织一般可借助仪器直接观察到。
组织是与相有密切联系的概念,它实际上是指各个晶粒或各种相所形成的图案(形态或形貌)。在不同条件下,相的晶粒大小、形态及分布会有所不同,从而材料内部会呈现不同的微观形貌。因而同样的相可以形成不同的组织。
5.陶瓷材料与金属材料都有哪些主要组成相,说明它们的性质与作用。
金属材料中有固溶体和化合物两类基本组成相。
置换固溶体:溶质原子取代溶剂晶格某些结点上的溶剂原子而形成的固溶体。当溶质原子与溶剂原子的直径、电化学性质比较接近时,一般形成置换固溶体;可以为有限或者无限固溶体。
间隙固溶体:溶质原子进入溶剂晶格中的间隙位置而形成的固溶体。当溶质原子直径远小于溶剂原子时,一般形成间隙固溶体。溶解度小,为有限固溶体
固溶体的强度、硬度高于其溶剂组元,产生了强化效果。塑形、韧性变化不大。因而固溶体
具有较好的综合机械性能(一定的强度及很好的塑性),良好的塑性成形性能,常作为金属结构材料中的基本组成相(基体)。
化合物是金属材料中组元之间相互作用而生成的新相,其晶体结构与溶剂、溶质均不同。分类:
化合物可以是金属原子与某些非金属原子形成的化合物,也可以是组元金属与金属之间的形成的化合物,称为金属间化合物。
金属材料中可能出现的化合物按它们的结构又可分为间隙化合物、正常价化合物、电子相化合物。
金属材料中的化合物的熔点、硬度较高、脆性较大,这是因为除金属键外,它们之中尚含相当成分的离子键或共价键,但如果它以较少数量与韧性的固溶体适当搭配,可以作为强化相。因此,合理控制合金中化合物的数量、尺寸、分布,可以极大地改善合金性能。
陶瓷材料有晶相、玻璃相、气相
晶相是陶瓷材料的基本组成部分;组成陶瓷晶相的晶体通常有三类:氧化物(如氧化铝、氧化钛等);氧酸盐(如硅酸盐、钛酸盐等);非氧化合物(金属碳化物、氮化物、硼化物)。晶相进一步可分为主晶相、次晶相、第三晶相等,材料的性质主要由主晶相决定。
玻璃相是陶瓷烧结时各组成物和杂质产生一系列物理化学反应后所形成的液相冷却而形成的。玻璃相为非晶态,排列无序,低熔点固体。
作用主要为将分散的晶相粘结起来;降低烧结温度与改善工艺性;抑制晶体长大以及提高陶瓷材料的致密程度。
缺点:由于其组成不均匀,会使材料的物化性质不均匀;玻璃相的机械强度比晶相低一些,热稳定性也差一些,在较低温度下便开始软化;玻璃相过多,陶瓷的熔点也降低。
气相是指陶瓷空隙中的气体,也就是陶瓷组织内部残留下来的孔洞。会降低陶瓷的强度。
6.归纳单相、多相组织形貌特点。
单相中球状晶粒很少,等轴晶是晶粒完全填满空间而同时保持最小的晶界总面积,除了等轴晶,还有片状、柱状、枝状的。
两相合金的组织状态与性能:是指组成合金的相(类型与性质)、各相的相对量、相的形状及分布特征等。
两相合金中第二相的分布与形状
两个相各自成为等轴晶粒,这一般是在两个相均是固溶体且数量较多的情况下产生的,这时两者均匀地分布在一起,合金的机械性能是两个相或两种“组织”性能的加权平均值,合金总的性能通常是具有一定的强度、较好的塑性、韧性。另一方面,如果第二相是化合物,而且体积百分数较大,则会使合金显示出极大的脆性,甚至无工业应用价值。在更多情况下,较少数量的第二相以球状、点状或短片状等均匀地分布在固溶体的晶粒内,这时尽管化合物的数量并不很多,但它将起强化基体相的作用,从而提高材料的机械强度。但与此同时,材料的塑性、韧性必将下降。
第七章固体材料的动力学过程:激活、扩散及相关的材料行为
1.动力学方法可在材料中处理哪几方面的问题?动力学过程的三原理是什么?
1)研究制备和处理材料的过程;2)合金性能表征的过程;3)使用材料的过程
1)沿着能量降低的方向发生;2)遵循阻力最小的途径进行;3)过程的结果是适者生存。
2.何为亚稳态?举例分析亚稳态的性质。
亚稳态:在热力学上虽然不稳定,但由于某种原因而能暂时或长期存在的状态。 要转入稳定的状态,必须获得必要的附加的能量来越过一定的能垒。
3.写出玻尔兹曼分布和阿伦尼乌斯定律的表达式?分析决定反应速度的主要因素。 玻尔兹曼分布:)/exp(/KT q N N T -=材料中原子数N (具有大于q 的能量)与N T (材料中原子总数)之比等于exp (-q/KT )。显然温度越高,N/N T 越大;q 越大,N/N T 就越小。 决定反应速率的主要因素是任一时刻下能量具有等于和大于激活能Q 的原子数目,这个数目是由材料的能量分布来决定的,遵循麦克斯韦—玻尔兹曼定律。
阿伦尼乌斯定律:)/exp(KT Q A V -=,A 表示与温度无关的速度常数,R 为气体常数,V 为反应速率,Q 是激活能。
原子间的反应速率取决于参与反映的原子中能量为Q 或更高的原子数目。阿尼乌斯定律适用于任何热激活的反应,其速度取决于Q 和T 。
4.写出Fick 第一定律与第二定律。说明如何进行一般的工业应用。
菲克第一定律:x
C D J ??-= 即扩散通量J 与该截面处的浓度梯度成正比。D 为扩散能力,常称扩散系数,负号表示扩散从高浓度向低浓度进行。
菲克第一定律适用于在各区域浓度不随时间而改变情况下所发生的扩散(称稳态扩散或稳定扩散)
菲克第二定律:??
????????=??x C D x t C ,式中t C ??表示浓度随时间的变化率。可见,非稳态扩散条件下,浓度随时间的变化正比于浓度梯度的变化,而不是浓度梯度本身。由此可推知,在开始扩散时,浓度梯度变化较大,故浓度随时间变化较快,越到后来,这个变化就越慢,所以材料通过扩散达到均匀化,需要很长时间。
工业应用:将低碳钢通过渗碳达到某种较高浓度水平,或将带有成分偏析的铸件处理到某一相对比较均匀的程度。
5.原子扩散的主要机制是什么?各自的应用范围、激活能及扩散的快慢如何?
空位扩散机制是扩散原子跳入空位,同时有空位移动与之配合。实现空位机制的条件是扩散原子的近邻应当有空位,同时空位周围的原子还必须具有超过能垒的能量。
这种扩散的激活能由原子跳动激活能和空位形成能两部分组成。
在体心立方金属(自扩散)和合金置换固溶体(互扩散)中,空位机制扩散占主导地位。在许多面心立方、密排六方金属或合金,以及离子化合物和氧化物中也常有这种扩散。
间隙扩散:在间隙固溶体中,晶体结构中存在小的间隙原子,这些溶质原子尺寸较小而易动,该原子从一个间隙位置跳到另一个间隙位置的扩散即为间隙扩散。这一机制不需要空位,而
且相比之下溶剂原子的扩散可以忽略。
激活能就是溶质原子发生跳动时所需的额外能量,因而必然比空位机制要小。
扩散速度是间隙扩散大于空位扩散
应用范围:C在γ-Fe或α-Fe中就是这种机制。
6.扩散系数D与激活能Q及温度T的关系如何?与阿伦尼乌斯定律有何关系,并举二、三例说明扩散的工业应用。
温度越高,D越大,即扩散速度越大
激活能越大,扩散速度越慢。
半导体的掺杂、钢件表面渗碳
7.试分析离子晶体、共价晶体和聚合物中扩散的特点。
离子晶体:1)不同于金属和合金,原子可以运动并进入附近的任何点阵空位或间隙位置,,离子材料的扩散离子只能进入具有同样电荷的位置。
2)与金属相比,离子材料的扩散激活能高而扩散速率低,而且其扩散过程远比金属中复杂3)阳离子扩散系数比阴离子大。
4)大多数离子晶体的扩散是按空位进行的,也有少部分是间隙扩散
影响扩散的缺陷来自1)本征点缺陷2)掺杂点缺陷
共价晶体:扩散和互扩散仍以空位机制为主
特点:方向性的键合使共价晶体的扩散激活能高于熔点相近的金属的激活能。
应用:半导体的掺杂是扩散在工业上的应用。
8.说明相变的条件、生核方式及固态相变的一般特点。
相变的结果产生了一个与起始相性质大为不同的相,所产生的相通常具有与原始相不同的晶体结构。
条件:相变的产生需要相对于平衡温度有一定的过热过冷程度;相变之后自由能降低
生核方式:均匀形核:晶核在母相的微小体积中直接地自发形成。
不均匀形核:晶核在母相中依附于未溶的杂质表面或型壁而形成的。
固态相变特点:1)仍然是生核与长大的过程。固态反应非常缓慢,并经受较大的热滞后,实际上很少真正达到平衡状态;
2)在非自发形核方面,除了外来颗粒以外,母相固态结构上的特点给形核带来催化作用,如点缺陷、线缺陷及面缺陷以及局部的高应变区;
3)转变时在总的能量项中,除了表面能项,还要包括应变能项;
4)可以由总的体积变化引起,也可以由于相界面上原子键合的局部不适应所引起;
5)新旧相之间倾向于有一定的位向关系;
6)允许转变过程经过一个或多个亚稳相,因而常形成过渡点阵。
9.归纳固态相变的主要类型及特点。
晶粒长大:原子运动跨越晶界,扩散距离短,晶体结构不变,而且没有新的晶粒生成,不需形核时间,反应速率对温度很敏感,是晶界曲率的函数,随着晶粒长大,反应速率降低,晶粒长大驱动力是晶界面积的减少。
再结晶:生成无应变的晶粒,驱动力是晶体内部的储存能,成分不变,晶体结构不变,新晶粒在原先变形晶粒的塑性变形区形成,所需时间遵循阿尼乌斯规律。
多晶型转变:有新相生成,驱动力是新旧两相体积自由能差,转变只需要很小的原子移动,但仍需破坏原先的结合键,使原子重排。
固溶与析出:固溶是将一个本来存在的相,溶解在母相中而使其消失,原子大量地扩散。析出则是一个新相从过饱和固溶体中分离出来,同样需要原子的大量扩散。这两个反应是彼此相反的。
共析反应:冷却时反应将一个中间成分的单相变为两个相,这两个相的化学成分位于共析成分的两侧,需要原子的扩散。
马氏体转变与回火转变:
马氏体转变是由于一个或多个原子面相对于其相邻面的剪切而造成的多晶型变化,无扩散。马氏体的形成温度比共析温度低得多,转变时由于切变作用造成的,所有原子同时移动,且单个原子偏离它以前邻近原子的距离不大于十分之一纳米。
马氏体是体心正方结构,又硬又脆。
在温度低于共析温度时,只要有足够的时间,这种碳在Fe中的过饱和固溶体将继续向更稳定的铁素体和渗碳体转变:M(马氏体)α+渗碳体(回火马氏体)。这个过程工业上称为回火。
回火马氏体组织:在α相上分布这许多弥散的碳化物颗粒,其韧性比亚稳态马氏体高很多。
10.分析相变动力学曲线(C曲线)的形状特征,并分析其原因。
TTT曲线(C曲线):测定在不同温度时从转变开始到结束以及达到不同的转变量所经历的时间,作成“温度-时间-转变量”曲线,简称TTT曲线。
由于开始转变时量很小而不易确定,故通常以一定的转变量,例如1%作为转变开始转变线,而在其之前所经历的时间称为孕育期。当过冷度增大时,相变驱动力Δgv增加而扩系数D 降低,当温度降低较少时,Δgv起主导作用,原子从旧相转变为新相的速率随过冷度增大而增大,当温度降低甚多时,由于D值显著减小,扩散因素占主导地位,从而转变速率随着过冷度增大而减小,因此在一居中温度转变速率最大,所以在C曲线上看到,在中间温度转变时间最短,速度最快。
11.分析等轴晶是如何形成的?其他形状晶粒有无可能形成?条件如何?
第八章工程材料强化与韧化的主要途径
1.晶体和非晶体物质塑性变形的机理有什么不同?
材料在外力作用下发生变形,如果卸载后变形不能完全消失,这种不可恢复的变形就称为塑性变形。塑性变形的主要特点是,卸载后材料会留下一定的残余变形或永久变形;应力和应变不再成线性关系。
塑性变形分为晶体的塑性流动和非晶态物质的粘性流动,塑性流动的主要机理是滑移,滑移是原子面按照晶体学上有规律的方式相互滑动。粘性流动一般发生于流体,是原子或分子小集团自由置换其相邻集团的位置,非晶体材料也以粘性流动方式产生永久变形,而在晶体中
一般不存在这种调换的自由。
2.材料的理论强度与实际强度之间有什么差别?分析造成这种差别的原因。
晶体的实际强度就是实验测得的单晶体的临界分切应力,而理论强度则是按完整晶体刚性滑移模型计算出的强度。
按照完整晶体刚性滑移模型,晶体滑移时晶体各部分是作为刚体而相对滑动的,基于这一模型以及原子间作用力正弦近似假定,可以推导出使完整晶体滑移面上所有原子同时滑移的临界切应力,计算出完整晶体的剪切强度约为切变弹性模量的1/6,这是一个很大的数值;但是,只有无缺陷的完整晶体才能发生刚性滑移,即滑移面上所有原子将同时滑移,而实际晶体往往存在缺陷,因此,晶体的实际滑移过程并不是晶体的一部分相对于另一部分的刚性滑移,这种实际滑移要比刚性滑移容易进行,从而造成晶体的实际强度远低于其理论强度。
3.分析位错与晶体强度的关系。
一种是要尽可能地减少晶体中的位错密度,使其接近于完整晶体,或者说制成无缺陷的完整晶体,使金属实际强度接近于理论强度;另一种是尽量增大晶体中的位错密度,并且尽可能地给运动着的位错设置阻碍,以及抑制位错源的活动。
4.Cu、Au等金属的屈服强度较低,而α—Fe、Cr等金属的强度较高,造成这种差别的主要原因是什么?
因为Cu、Au等金属是面心立方晶体,而α—Fe、Cr等金属是体心立方晶体,面心立方晶体的滑移方向多于体心立方晶体,所以位错在面心立方晶体上移动时受到的阻力较小,因此造成屈服强度上的差别。
5.指出晶体材料的基本强化途径。
冷变形强化、固溶强化、细晶强化、第二相强化、复合强化
6.比较固溶强化与第二相强化的机理有什么不同。
固溶强化:合金元素溶于金属基体中形成固溶体而使金属强度、硬度升高的现象,称为固溶强化。
机理:一是溶质原子的溶入使固溶体的晶格发生畸变,从而产生附加的应力场,阻碍位错的运动;二是溶质原子常常被吸附在位错线的附近,降低了位错的能量状态。
第二相强化:材料通过基体中分布有细小弥散的第二相质点而产生强化的方法,称为第二相强化或分散强化。
机理:当移动的位错与第二相质点相遇时,受到质点的阻挡,位错线无法穿过这些硬质点,位错只有绕着它发生弯曲、随着外加应力的增大,位错线受阻部分的弯曲加剧,以至绕着粒子的位错线在左右两边相遇,于是正负号位错彼此抵消,形成包围粒子的位错环,位错线的其余部分则越过粒子继续移动。这样第二相硬颗粒构成了位错运动的阻碍,同时也增加了位错线的长度,从而提高了合金的屈服强度。此为绕过机制,有时位错线可以直接通过第二相,则称切割机制,也产生强化效果。
7.分析韧性断裂过程。发生韧性断裂后,断口形式与材料本身的性质有什么关系?
韧性断裂通常发生在具有良好的塑性和韧性的金属上,其断裂方式是穿晶断裂。在断裂部件上往往可以观察到大量的变形,包括颈缩现象。变形是在断裂之前发生的。通常,韧性断裂起因于单纯的过载,即材料受到了过高应力。
三个阶段:试样拉伸产生明显塑性变形之后,某处出现颈缩,由于缩颈的几何形状会引起三向拉应力,最大轴向拉应力位于试样中心,在此拉应力作用下,试样中心开始产生微孔;微孔在试样中心长大和聚合,从而在中心形成圆片状裂纹,这裂纹沿着垂直于拉应力作用的方向往外伸展;裂纹到试样边缘以大约和拉伸轴成45°的方向迅速扩展,直到最后剪切断开这最后阶段造成一个剪切唇,剪切唇与拉伸轴约呈45°,相应于剪切应力方向。
发生韧性断裂后形成的断口根据材料本身力学性能的不同有三种典型的断口形式:1)为纯度极高的纯铝拉伸时的断口,这是直到最后一点截面皆以颈缩的形式破断的纯颈缩断口;2)纯度不高的铜拉伸时的双杯型断口;3)低碳钢拉伸时常见的杯锥型断口;对于低强度的金属和合金,拉伸试件的断口往往表现为杯锥断口、双杯断口和纯破裂断口。
8.用Griffith理论解释发生脆性断裂时,实际断裂强度低于理论断裂强度的原因。
由于固体内部本来就存在着某种微裂纹;材料的脆性断裂就是由裂纹的形成与随后的扩展两个阶段组成,根据Griffith理论,这些预存裂纹对于任何微塑性的,也就是永久变形能力很小的材料,都有损强度。特别是那种长度方向与作用应力垂直的裂纹,会在裂纹端部引起极为严重的应力集中,从而使该处的实际局部应力达到材料的理论强度。
9.影响脆性断裂的因素主要有哪些?
温度:温度对材料的脆性有很大影响,温度越高,韧性越好,温度越低则越脆。温度对脆性的影响程度与材料的结构有着密切的关系。
化学成分:合金元素在强化金属的同时也会降低金属的塑性,强化效果越显著,塑性下降越多,脆性断裂的可能性越大;杂质元素会显著增加金属的脆性。
组织和晶粒度:脆性组织越多,脆性越高;晶粒越细小,材料强度、塑韧性均会提高。
应力分布:材料上一点的最大拉应力σmax与最大剪应力分量τmax的比值用来做为分析是否容易发生脆性断裂的根据。比值越大,材料的脆性越大,越容易发生脆性断裂。
环境:材料工作在特殊的环境和介质中,会增加对脆性断裂的敏感性,使其在较低载荷下发生脆性断裂。
10.细化晶粒在提高材料强度的同时也提高韧性,为什么?在生产中有哪些实际的应用。
晶粒越细小,晶界面积越增加,位错密度也增大,从而强度升高。同时,与细晶伴生的晶内滑移带短,位错塞积群的应力集中效应不如粗晶显著,此外,细晶粒的变形不均匀现象有所缓和等,这些均有助于韧性的改善。
应用:孕育铸铁、铝硅基铸造铝合金都是通过专门的处理方法,通过增加液态金属结晶过程中的非自发生核数目或促使液体过冷来细化组织的;在合金渗碳钢和合金工具钢中,通过加入强烈碳化物形成元素,以阻止加热时晶粒长大,从而获得细晶组织。
11.指出提高陶瓷材料强度及增韧的主要途径。
制造微晶、高密度、高纯度的陶瓷;消除表面缺陷,可有效地提高材料的实际强度和韧性;在陶瓷表面引入压应力,可提高材料的强韧性;细化晶粒;复合增韧;相变增韧
12.分析陶瓷材料相变增韧的机理。
相变引起的体积膨胀,需要消耗大量的功和能,使裂纹尖端的应力松弛了;体积膨胀会促使裂纹闭合,阻止裂纹的扩展。
13.比较表面化学热处理与表面淬火热处理在金属材料表面强化和表面改性方面的作用机
理。
表面化学热处理是将工件放在含有欲渗元素的特定介质中,通过加热、保温、冷却的方法,使介质中某些元素渗入工件表面并向内扩散,以改变表层的化学成分和组织,从而使工件表面具有与内部不同的特殊性能的一种表面强化及表面处理方法。
表面淬火热处理:表层快速加热淬火是以很快的速度对工件进行加热,使工件表层温度迅速升到AC3以上,进行奥氏体化,而心部温度仍在AC1以下,然后将其急冷淬火,得到心部为铁素体与珠光体之混合组织,表层为马氏体组织。马氏体回火后可得到合适的硬度、强度、而心部的混合组织有较高的韧性和塑性。
14.综合分析和论证工程材料强化和韧化的意义、可行性、主要途径和机理。
第九章工程材料的制备
1.矿石于冶炼前为什么要进行预处理?有哪些预处理方法?作用是什么?
从矿山直接开采出来的矿石称为原矿,原矿所含有用矿物的成分往往波动很大,有时会伴有大量无价值的矿物,即脉石,而且粒度相差也很悬殊。因此大部分矿石无论从物理性质还是化学性质来看,都不能达到直接进行冶炼的要求,必须进行各种预处理,以提高经济性和冶炼产品的质量。预处理的主要作用是提高入炉矿石的品质,增加入炉料的熟料比,使高炉多用或全部使用烧结矿或球团矿,保持入炉料干净,缩小原料粒度上的差距。
预处理办法
选矿:是不改变原矿石中有用矿物成分而除去脉石,提高原矿石中有用矿物的品味,同时去除有害杂质,为下一步冶炼提供高品位、杂质少的优质原料的过程;
干燥和煅烧:为了节约冶炼工序中的热能,便于矿石的搬运和向炉内供料等作业,防止水分引起的反应性能降低等目的;
焙烧:是把矿石加热到比熔化温度低200~300度,以改变矿石的化学组成,除去原料中的有害杂质,回收有用元素,同时还可以使矿石组织疏松,便于破碎和提高矿石的还原性的工艺过程;
粉矿造块:为了充分利用各种资源和便于冶炼操作,将粉矿、精矿粉以及其他含铁粉料再进行加工处理,制成人造富矿块的生产工艺叫做粉矿造块。
2.简述钢铁的生产过程。
钢铁生产过程首先是由铁矿石冶炼成生铁,炼成的生铁一部分用于铸造,还有一部分再通过进一步冶炼成为钢。炼成的钢除少量直接浇注成铸件外,绝大部分都先铸成钢锭,然后将钢锭经过轧制、挤压、拉拔等方法制成各种钢材,如板材、型材、管材等。
3.简要分析炼铁的原理,简述炼铁过程。
炼铁的过程就是从铁矿石中还原铁的过程。在这个过程中,以铁矿石为基本原料,以石灰石等为溶剂,以焦炭为燃料,按一定比例投入炼铁高炉,经过冶炼生成铸造生铁、炼钢生铁以及铁合金等。
炼铁过程:1)炉体内部发生焦炭与氧的完全燃烧生成CO2的过程使炉体内部达到高温,与此同时,炉顶发生焦炭与氧的不完全燃烧生成CO,同时高温下CO2会与焦炭反应生成CO,这就给铁矿石的还原造成了气氛;
2)铁的氧化物经过CO和焦炭的逐级还原,形成夹渣生铁水;
3)之后通过造渣过程将还原出来的铁与各种杂质分离,同时控制生铁成分达到一定要求。
材料科学基础Ι_课程教学大纲
材料科学基础Ι课程教学大纲 一、课程说明 (一)课程名称、所属专业、课程性质、学分; 课程名称:材料科学基础 所属专业:材料物理,材料化学 课程性质:专业基础课 学分:8 (二)课程简介、目标与任务; 课程简介: 本课程是材料学科本科生的一门专业基础课。它的主要任务是使学生对材料的生产、科研、应用以及它的过去、现在和未来有初步了解,以及对材料科学与工程有一个较全面而又概括的了解同时,使学生掌握较完整全面的材料科学基础知识。本课程的覆盖面较宽,要介绍工程材料的结构与性能,生产制备,科研和应用的概况,材料的发展历史,目前状况和发展趋势。各章节除介绍有关材料的基本知识外,尽可能反映该领域的新成果、新发展及其在新技术中的应用。用必要的例子生动地描述出该领域的基本情况、动态和趋势。从这个意义上说,它不是一门传统的导论课,而是学生掌握材料科学基础知识的基础课。它让学生了解这一领域的基础、现状和前景。课程对材料研究的若干方法也做一些简介。 目标与任务: 通过本课程教学,使学生对材料科学基础知识以及材料的生产过程有一个较全面、较概括的了解;对当前材料科学研究的前沿有初步了解;培养学生对材料科学的兴趣。初步掌握各类工程材料的基本概念,包括组织结构、性能、生产过程和应用等;初步了解材料科学的研究前沿以及我校材料学科的科研工作简况。 (三)先修课程要求,与先修课与后续相关课程之间的逻辑关系和内容衔接; 本课程是材料专业的专业基础课,本课程的学习需要学生具备高等数学、大学物理、大学化学作基础,同时又是材料专业的专业课(如金属材料学、陶瓷材料学、高分子材料、功能材料等)的基础。 (四)教材与主要参考书。 1. W.D. Callister, Jr., Materials Science and Engineering: An Introduction,6th edition, John Wiley and Sons, Inc., New York,2003.
“材料科学与工程导论”——课程教学大纲
北京工业大学 “材料科学与工程导论”——课程教学大纲 英文名称:Introduction to Materials Science and Engineering 课程编号:0000274 课程类型:学科基础必修课 学时:32 学分:2.0 适用对象:材料类本科生 先修课程:大学物理、高等数学、工程力学 使用教材及参考书: [1] 许并社,材料科学概论,北京工业大学出版社,2002 [2] 冯端、师昌绪、刘治国,材料科学导论,化学工业出版社,2002 [3] 张钧林、严彪、王德平、袁华,材料科学基础,化学工业出版社,2006 [4] 周达飞,材料概论,化学工业出版社,2001 [5] William D. Callister, David G. Rethwisch, Fundamentals of Materials Science and Engineering: An Integrated Approach, John Wiley & Sons INC, 2008 [6] 美国国家研究委员会,90年代的材料科学与材料工程,航空工业出版社,1992 [7] 李恒德、师昌绪,中国材料发展现状及迈入新世纪对策,山东科学技术出版 社,2002 一、课程性质、目的和任务 《材料科学与工程导论》是面向材料学院二年级本科生开设的专业基础必修课。其目的是使学生了解材料科学在经济社会发展中的作用以及材料科学与工程学的形成与学科发展趋势。以材料“四要素”及其相互关系为中心,使学生建立从材料设计、组织控制、制备加工到性能评价与工程应用的概念体系,在掌握材料共性规律与特点的基础上,使学生理解材料科学与工程内涵,学会分析材料问题的方法。以案例的形式,介绍典型金属及无机非金属的结构与功能材料的研究规律,强化学生对“四要素”的理解。 二、课程教学内容及要求
材料科学基础习题与答案
第二章思考题与例题 1. 离子键、共价键、分子键和金属键的特点,并解释金属键结合的固体材料的密度比离子键或共价键固体高的原因 2. 从结构、性能等方面描述晶体与非晶体的区别。 3. 何谓理想晶体何谓单晶、多晶、晶粒及亚晶为什么单晶体成各向异性而多晶体一般情况下不显示各向异性何谓空间点阵、晶体结构及晶胞晶胞有哪些重要的特征参数 4. 比较三种典型晶体结构的特征。(Al、α-Fe、Mg三种材料属何种晶体结构描述它们的晶体结构特征并比较它们塑性的好坏并解释。)何谓配位数何谓致密度金属中常见的三种晶体结构从原子排列紧密程度等方面比较有何异同 5. 固溶体和中间相的类型、特点和性能。何谓间隙固溶体它与间隙相、间隙化合物之间有何区别(以金属为基的)固溶体与中间相的主要差异(如结构、键性、性能)是什么 6. 已知Cu的原子直径为A,求Cu的晶格常数,并计算1mm3Cu的原子数。 7. 已知Al相对原子质量Ar(Al)=,原子半径γ=,求Al晶体的密度。 8 bcc铁的单位晶胞体积,在912℃时是;fcc铁在相同温度时其单位晶胞体积是。当铁由bcc转变为fcc时,其密度改变的百分比为多少 9. 何谓金属化合物常见金属化合物有几类影响它们形成和结构的主要因素是什么其性能如何
10. 在面心立方晶胞中画出[012]和[123]晶向。在面心立方晶胞中画出(012)和(123)晶面。 11. 设晶面(152)和(034)属六方晶系的正交坐标表述,试给出其四轴坐标的表示。反之,求(3121)及(2112)的正交坐标的表示。(练习),上题中均改为相应晶向指数,求相互转换后结果。 12.在一个立方晶胞中确定6个表面面心位置的坐标,6个面心构成一个正八面体,指出这个八面体各个表面的晶面指数,各个棱边和对角线的晶向指数。 13. 写出立方晶系的{110}、{100}、{111}、{112}晶面族包括的等价晶面,请分别画出。 14. 在立方晶系中的一个晶胞内画出(111)和(112)晶面,并写出两晶面交线的晶向指数。 15 在六方晶系晶胞中画出[1120],[1101]晶向和(1012)晶面,并确定(1012)晶面与六方晶胞交线的晶向指数。 16.在立方晶系的一个晶胞内同时画出位于(101),(011)和(112)晶面上的[111]晶向。 17. 在1000℃,有W C为%的碳溶于fcc铁的固溶体,求100个单位晶胞中有多少个碳原子(已知:Ar(Fe)=,Ar(C)=) 18. r-Fe在略高于912℃时点阵常数a=,α-Fe在略低于912℃时a=,求:(1)上述温度时γ-Fe和α-Fe的原子半径R;(2)γ-Fe→α-Fe转变时的体积变化率;(3)设γ-Fe→α-Fe转变时原子半径不发生变化,求此转变时的体积变
新材料科学导论期末复习题(有答案版)
一、填空题: 1.材料性质的表述包括力学性能、物理性质和化学性质。 2.化学分析、物理分析和谱学分析是材料成分分析的三种基本方法。 3.材料的结构包括键合结构、晶体结构和组织结构。 4.材料科学与工程有四个基本要素,它们分别是:使用性能、材料的性质、制备/加工和结构/成分。 5.按组成和结构分,材料分为金属材料,无机非金属材料,高分子材料和复合材料。 6.高分子材料分子量很大,是由许多相同的结构单元组成,并以共价键的形式重复连接而成。 7.复合材料可分为结构复合材料和功能复合材料两大类。 8.聚合物分子运动具有多重性和明显的松弛特性。 9.功能复合材料是指除力学性能以外,具有良好的其他物理性能并包括部分化学和生物性能的复合材料。如有 光,电,热,磁,阻尼,声,摩擦等功能。 10.材料的物理性质表述为光学性质、磁学性质、电学性质和热学性质。 11.由于高分子是链状结构,所以把简单重复(结构)单元称为链节,简单重复(结构)单元的个数称为聚 合度。 12.对于脆性的高强度纤维增强体与韧性基体复合时,两相间若能得到适宜的结合而形成的复合材料,其性能显示 为增强体与基体的互补。(ppt-复合材料,15页) 13.影响储氢材料吸氢能力的因素有:(1)活化处理;(2)耐久性(抗中毒性能); (3)抗粉末化性能;(4)导热性能;(5)滞后现象。 14.典型热处理工艺有淬火、退火、回火和正火。 15.功能复合效应是组元材料之间的协同作用与交互作用表现出的复合效应。复合效应表现线性效应和非线性效 应,其中线性效应包括加和效应、平均效应、相补效应和相抵效应。 16.新材料发展的重点已经从结构材料转向功能材料。 17.功能高分子材料的制备一般是指通过物理的或化学的方法将功能基团与聚合物骨架相结合的过程。功能高 分子材料的制备主要有以下三种基本类型: ①功能小分子固定在骨架材料上; ②大分子材料的功能化; ③已有功能高分子材料的功能扩展; 18.材料的化学性质主要表现为催化性能和抗腐蚀性。 19.1977年,美国化学家MacDiarmid,物理学家Heeger和日本化学家Shirakawa首次发现掺杂碘的聚乙炔具有金 属的导电特性,并因此获得2000年诺贝尔化学奖。 20.陶瓷材料的韧性和塑性较低,这是陶瓷材料的最大弱点。 第二部分名词解释
《材料科学基础》课程简介
《材料科学基础》课程简介 1、课程代码 2、课程名称 材料科学基础 3、授课对象 金属材料工程专业本科生 4、学分 3.5 5、修读期 第4学期 6、课程组负责人 彭志方教授、雷燕讲师 7、课程简介 材料科学基础是材料科学与工程专业一级学科公共主干专业课。本课程将系统、全面地介绍材料基础理论知识,诸如材料的结合键、材料的晶体结构、晶体结构缺陷、材料的相结构与相图、材料的凝固、材料中的扩散,材料的塑性变形与强化、材料的亚稳态。本课程着眼于材料基本问题、从金属材料的基本理论出发,将高分子聚合物材料、陶瓷材料、复合材料等结合在一起,使学生能把握材料的共性,熟悉材料的个性。通过理论教学与实验教学,使学生不仅能掌握基本理论,善于分析和解决问题,同时也培养学生的动手能力、验证理论、探索新知识的能力。本课程也是材料科学与工程专业的技术基础课,它为该专业学生的后续课程,如材料加工成型、材料热处理、材料的性能、工程材料学、材料测试、材料的近代研究方法、计算机在材料科学中的应用等提供基础。 8、实践环节学时与内容或辅助学习活动 材料科学基础综合实验1周 9、课程考核 布置课后作业,作为平时成绩,占30%。 期末考试为闭卷考试,卷面考试成绩占70%。 10、指定教材 石德珂,材料科学基础,机械工业出版社,2006 11、参考书目 [1] 物理冶金基础,冶金工业出版社,唐仁正,1997 [2] 材料科学基础,哈尔滨工业大学出版社,赵品,谢辅洲,孙文山.,2000 [3] 材料科学基础,清华大学出版社,潘金生等,1998 [4] 金属学,上海科技出版社,胡庚祥,钱苗根.,1980 12、网上资源
材料科学基础课后习题
1.作图表示立方晶体的晶面及晶向。 2.在六方晶体中,绘出以下常见晶向 等。 3.写出立方晶体中晶面族{100},{110},{111},{112}等所包括的 等价晶面。 4.镁的原子堆积密度和所有hcp金属一样,为。试求镁单位晶胞的 体积。已知Mg的密度,相对原子质量为,原子半径r=。 5.当CN=6时离子半径为,试问: 1)当CN=4时,其半径为多少? 2)当CN=8时,其半径为多少? 6.试问:在铜(fcc,a=)的<100>方向及铁(bcc,a=的<100>方向,原 子的线密度为多少? 7.镍为面心立方结构,其原子半径为。试确定在镍的 (100),(110)及(111)平面上1中各有多少个原子。 8.石英的密度为。试问: 1)1中有多少个硅原子(与氧原子)? 2)当硅与氧的半径分别为与时,其堆积密度为多少(假设原子是 球形的)?
9.在800℃时个原子中有一个原子具有足够能量可在固体内移 动,而在900℃时个原子中则只有一个原子,试求其激活能(J/原 子)。 10.若将一块铁加热至850℃,然后快速冷却到20℃。试计算处理前后空 位数应增加多少倍(设铁中形成一摩尔空位所需要的能量为104600J)。 11.设图1-18所示的立方晶体的滑移面ABCD平行于晶体的上、下底面。 若该滑移面上有一正方形位错环,如果位错环的各段分别与滑移面各边平行,其柏氏矢量b∥AB。 1)有人认为“此位错环运动移出晶体后,滑移面上产生的滑移台 阶应为4个b,试问这种看法是否正确?为什么? 2)指出位错环上各段位错线的类型,并画出位错运动出晶体后, 滑移方向及滑移量。 12.设图1-19所示立方晶体中的滑移面ABCD平行于晶体的上、下底面。 晶体中有一条位错线段在滑移面上并平行AB,段与滑移面垂直。位错的柏氏矢量b与平行而与垂直。试问: 1)欲使段位错在ABCD滑移面上运动而不动,应对晶体施加 怎样的应力? 2)在上述应力作用下位错线如何运动?晶体外形如何变化? 13.设面心立方晶体中的为滑移面,位错滑移后的滑移矢量为 。 1)在晶胞中画出柏氏矢量b的方向并计算出其大小。 2)在晶胞中画出引起该滑移的刃型位错和螺型位错的位错线方 向,并写出此二位错线的晶向指数。
材料科学基础课程教学大纲
材料科学基础课程教学大纲 一、课程说明 (一)课程名称、所属专业、课程性质、学分 课程名称:材料科学基础 所属专业:材料化学 课程性质:专业基础课 学分:4学分(72学时) (二)课程简介、目标与任务、先修课与后续相关课程 课程简介: 本课程是材料专业的一门重要的专业理论基础课。本课程围绕材料化学成分、组织结构、加工工艺与使用性能之间的关系及其变化规律,系统介绍材料的晶体结构、晶体缺陷、弹塑性变形及回复和再结晶、材料中的扩散、结晶与凝固、材料中的相变、相结构与相图等内容及其相互联系。 目标与任务: 学习本课程的目的是为了使学生认识材料的本质,了解金属、无机非金属材料的化学成分、热加工工艺、组织结构与性能之间的关系及其变化规律,为以后学习和工作中如何控制材料的化学成分和生产工艺以提高材料的性能、改进和发展各种热加工工艺以及合理地选材打下系统而坚实的理论基础。 先修课与后续相关课程: 先修课:数学、物理、化学、物理化学等。 后续相关课程:其他相关专业课程。 (三)教材与主要参考书。 教材: (1) 石德柯,材料科学基础,机械工业出版社,第二版。 (2) 胡赓祥,蔡珣,材料科学基础,上海交通大学出版社,第二版。 主要参考书: (1) 赵品,材料科学基础教程,哈尔滨工业大学出版社,年第二版。 (2) 刘智恩,材料科学基础,西北工业大学出版社,年第二版。
二、课程内容与安排 绪论1学时 第一章材料结构的基本知识 第一节原子结构 第二节原子结合建 第三节原子排列方式 第四节晶体材料的组织 第五节材料的稳态与亚稳态结构 (一)教学方法与学时分配 讲授,1学时。 (二)内容及基本要求 主要内容: 【掌握】:熟悉金属键、离子键、共价键、范德华力和氢键的定义、特点。 【了解】:了解原子结构及键合类型;掌握物质的组成、原子的结构、电子结构和元素周期表; 【一般了解】:对什么是材料科学、材料的结构与内部性能之间的关系等知识进行概论。 第二章晶体结构 第一节晶体学基础 第二节纯金属的晶体结构 第三节离子晶体的结构 第四节共价晶体的结构 (一)教学方法与学时分配 讲授,10学时。 (二)内容及基本要求 主要内容: 【重点掌握】:熟悉晶体的特点、空间点阵、晶胞、晶系和布拉菲点阵,晶向和晶面的表示方法,晶体的对称性。 【掌握】:掌握材料的结合方式、晶体学基础、三种典型的金属晶体结构,致密度和配位数,点阵常数和原子半径,晶体的原子堆垛方式和间隙,多晶型性。
材料科学与工程导论课后习题答案-杨瑞城-蒋成禹
第一章 材料与人类 1.为什么说材料的发展是人类文明的里程碑? 材料是一切文明和科学的基础,材料无处不在,无处不有,它使人类及其赖以生存的社会、环境存在着紧密而有机的联系。纵观人类利用材料的历史,可以清楚地看到,每一种重要材料的发现和利用,都会把人类支配和改造自然的能力提高到一个新的水平,给社会生产和人类生活带来巨大的变化。 2.什么是材料的单向循环?什么是材料的双向循环?两者的差别是什么? 物质单向运动模式:“资源开采-生产加工-消费使用-废物丢弃” 双向循环模式:以仿效自然生态过程物质循环的模式,建立起废物能在不同生产过程中循环,多产品共生的工业模式,即所谓的双向循环模式(或理论意义上的闭合循环模式)。 差别:单向循环必然带来地球有限资源的紧缺和破坏,同时带来能源浪费,造成人类生存环境的污染。 无害循环:流程性材料生产中,如果一个过程的输出变为另一个过程的输入,即一个过程的废物变成另一个过程的原料,并且经过研究真正达到多种过程相互依存、相互利用的闭合的产业“网”、“链”,达到了清洁生产。 地球 原材料 工业原料 废料 产品 工程材料 资源开采 冶金等初加工 进一步加工 人类使用后失效 组合加工制造 地球 综合利用变为无害废物 综合利用变为无害废物 废料 工业用原料 原材料 产品 工程材料 经过人类处理重新利用后的无害废物
3.什么是生态环境材料? 生态环境材料是指同时具有优良的使用性能和最佳环境协调性能的一大类材料。这类材料对资源和能源消耗少,对生态和环境污染小,再生利用率高或可降解化和可循环利用,而且要求在制造、使用、废弃直到再生利用的整个寿命周期中,都必须具有与环境的协调共存性。因此,所谓环境材料,实质是赋予传统结构材料、功能材料以特别优异的环境协调性的材料,它是材料工作者在环境意识指导下,或开发新型材料,或改进、改造传统材料,任何一种材料只要经过改造达到节约资源并与环境协调共存的要求,它就应被视为环境材料。 4.为什么说材料科学和材料工程是密不可分的系统工程? 材料科学与工程的材料科学部分主要研究材料的结构与性能之间所存在的关系,即集中了解材料的本质,提出有关的理论和描述,说明材料结构是如何与其成分、性能以及行为相联系的。而另一方面,与此相对应,材料工程部分是在上述结构-性能关系的基础上,设计材料的组织结构并在工程上得以实施与保证,产生预定的种种性能,即涉及到对基础科学和经验知识的综合、运用,以便发展、制备、改善和使用材料,满足具体要求。两者只是侧重点不同,并没有明显的分界线,一般在使用材料科学这一术语时,通常都包含了材料工程的许多方面;而材料工程的具体问题的解决,毫无疑问,都必须以材料科学作为基础与理论依据,所以材料科学与材料工程是一个整体。 5.现代材料观的六面体是什么?怎样建立起一个完整的材料观? 材料科学与工程研究材料组成、性能、生产流程和使用效能四个要素,构成四面体。 成分、合成与加工、结构、性能及使用效能连接在一起组成一个六面体。 6.什么是材料的使用效能? 指材料在使用条件下的表现,如使用环境、受力状态对材料特征曲线以及寿命的影响。效能往往决定着材料能否得到发展和使用。 7.试讲一下材料设计与选用材料的基本思想与原则? 材料设计是应用已知理论与信息,预报具有预期性能的材料,并提出其制备合成方案。材料设计可根据设计对象所涉及的空间尺度划分为显微结构层次、原子分子层次和电子层次设计,以及综合考虑各个层次的多尺度材料设计。 从工程角度,材料设计是依据产品所需材料的各项性能指标,利用各种有用信息,建立相关模型,制定具有预想的微观结构和性能的材料及材料生产工艺方法,以满足特定产品对新材料的需求。 选材原则:1)胜任某一特定功能;2)综合性能比较好;3)材料性能差异定量化;4)成本、经济与社会效益;5)与环境保护尽可能地一致,即对环境尽可能友好。 选材思想:设计-工艺-材料-用户最佳组合的结果 第二章工程材料概述 工程材料分为:金属材料、陶瓷材料、聚合物材料、复合材料以及不宜归入上述四类的“其他材料”。 1.什么是黑色金属?什么是有色金属?
(完整版)材料科学基础练习题
练习题 第三章晶体结构,习题与解答 3-1 名词解释 (a)萤石型和反萤石型 (b)类质同晶和同质多晶 (c)二八面体型与三八面体型 (d)同晶取代与阳离子交换 (e)尖晶石与反尖晶石 答:(a)萤石型:CaF2型结构中,Ca2+按面心立方紧密排列,F-占据晶胞中全部四面体空隙。 反萤石型:阳离子和阴离子的位置与CaF2型结构完全相反,即碱金属离子占据F-的位置,O2-占据Ca2+的位置。 (b)类质同象:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质相似的其它离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性和晶体结构变化的现象。 同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。 (c)二八面体型:在层状硅酸盐矿物中,若有三分之二的八面体空隙被阳离子所填充称为二八面体型结构三八面体型:在层状硅酸盐矿物中,若全部的八面体空隙被阳离子所填充称为三八面体型结构。 (d)同晶取代:杂质离子取代晶体结构中某一结点上的离子而不改变晶体结构类型的现象。 阳离子交换:在粘土矿物中,当结构中的同晶取代主要发生在铝氧层时,一些电价低、半径大的阳离子(如K+、Na+等)将进入晶体结构来平衡多余的负电荷,它们与晶体的结合不很牢固,在一定条件下可以被其它阳离子交换。 (e)正尖晶石:在AB2O4尖晶石型晶体结构中,若A2+分布在四 面体空隙、而B3+分布于八面体空隙,称为正尖晶石; 反尖晶石:若A2+分布在八面体空隙、而B3+一半分布于四面体空 隙另一半分布于八面体空隙,通式为B(AB)O4,称为反尖晶石。 3-2 (a)在氧离子面心立方密堆积的晶胞中,画出适合氧离子位置 的间隙类型及位置,八面体间隙位置数与氧离子数之比为若干?四 面体间隙位置数与氧离子数之比又为若干? (b)在氧离子面心立方密堆积结构中,对于获得稳定结构各需何 种价离子,其中: (1)所有八面体间隙位置均填满; (2)所有四面体间隙位置均填满; (3)填满一半八面体间隙位置; (4)填满一半四面体间隙位置。 并对每一种堆积方式举一晶体实例说明之。 解:(a)参见2-5题解答。1:1和2:1 (b)对于氧离子紧密堆积的晶体,获得稳定的结构所需电价离子 及实例如下: (1)填满所有的八面体空隙,2价阳离子,MgO; (2)填满所有的四面体空隙,1价阳离子,Li2O; (3)填满一半的八面体空隙,4价阳离子,TiO2; (4)填满一半的四面体空隙,2价阳离子,ZnO。 3-3 MgO晶体结构,Mg2+半径为0.072nm,O2-半径为0.140nm,计算MgO晶体中离子堆积系数(球状离子所占据晶胞的体积分数);计算MgO的密度。并说明为什么其体积分数小于74.05%?
材料科学基础课后习题答案
《材料科学基础》课后习题答案 第一章材料结构的基本知识 4. 简述一次键和二次键区别 答:根据结合力的强弱可把结合键分成一次键和二次键两大类。其中一次键的结合力较强,包括离子键、共价键和金属键。一次键的三种结合方式都是依靠外壳层电子转移或共享以形成稳定的电子壳层,从而使原子间相互结合起来。二次键的结合力较弱,包括范德瓦耳斯键和氢键。二次键是一种在原子和分子之间,由诱导或永久电偶相互作用而产生的一种副键。 6. 为什么金属键结合的固体材料的密度比离子键或共价键固体为高? 答:材料的密度与结合键类型有关。一般金属键结合的固体材料的高密度有两个原因:(1)金属元素有较高的相对原子质量;(2)金属键的结合方式没有方向性,因此金属原子总是趋于密集排列。相反,对于离子键或共价键结合的材料,原子排列不可能很致密。共价键结合时,相邻原子的个数要受到共价键数目的限制;离子键结合时,则要满足正、负离子间电荷平衡的要求,它们的相邻原子数都不如金属多,因此离子键或共价键结合的材料密度较低。 9. 什么是单相组织?什么是两相组织?以它们为例说明显微组织的含义以及显微组织对性能的影响。 答:单相组织,顾名思义是具有单一相的组织。即所有晶粒的化学组成相同,晶体结构也相同。两相组织是指具有两相的组织。单相组织特征的主要有晶粒尺寸及形状。晶粒尺寸对材料性能有重要的影响,细化晶粒可以明显地提高材料的强度,改善材料的塑性和韧性。单相组织中,根据各方向生长条件的不同,会生成等轴晶和柱状晶。等轴晶的材料各方向上性能接近,而柱状晶则在各个方向上表现出性能的差异。对于两相组织,如果两个相的晶粒尺度相当,两者均匀地交替分布,此时合金的力学性能取决于两个相或者两种相或两种组织组成物的相对量及各自的性能。如果两个相的晶粒尺度相差甚远,其中尺寸较细的相以球状、点状、片状或针状等形态弥散地分布于另一相晶粒的基体内。如果弥散相的硬度明显高于基体相,则将显著提高材料的强度,同时降低材料的塑韧性。 10. 说明结构转变的热力学条件与动力学条件的意义,说明稳态结构和亚稳态结构之间的关系。 答:同一种材料在不同条件下可以得到不同的结构,其中能量最低的结构称为稳态结构或平衡太结构,而能量相对较高的结构则称为亚稳态结构。所谓的热力学条件是指结构形成时必须沿着能量降低的方向进行,或者说结构转变必须存在一个推动力,过程才能自发进行。热力学条件只预言了过程的可能性,至于过程是否真正实现,还需要考虑动力学条件,即反应速度。动力学条件的实质是考虑阻力。材料最终得到什么结构取决于何者起支配作用。如果热力学推动力起支配作用,则阻力并不大,材料最终得到稳态结构。从原则上讲,亚稳态结构有可能向稳态结构转变,以达到能量的最低状态,但这一转变必须在原子有足够活动能力的前提下才能够实现,而常温下的这种转变很难进行,因此亚稳态结构仍可以保持相对稳定。 第二章材料中的晶体结构 1. 回答下列问题: (1)在立方晶系的晶胞内画出具有下列密勒指数的晶面和晶向: 32)与[236] (001)与[210],(111)与[112],(110)与[111],(132)与[123],(2 (2)在立方晶系的一个晶胞中画出(111)和(112)晶面,并写出两晶面交线的晶向指数。 解:(1)
材料科学基础部分习题
晶体结构 1、解释下列概念 晶系、晶胞、晶胞参数、空间点阵、米勒指数(晶面指数)、离子晶体的晶格能、原子半径与离子半径、配位数、离子极化、同质多晶与类质同晶、正尖晶石与反正尖晶石、反萤石结构、铁电效应、压电效应. 2、(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求出该晶面的米勒指数;(2)一晶面在x、y、z轴上的截距分别为a/ 3、b/2、c,求出该晶面的米勒指数。 3、在立方晶系的晶胞中画出下列米勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与[111],(322)与[236],(257)与[111],(123)与[121],(102),(112),(213),[110],[111],[120],[321] 4、写出面心立方格子的单位平行六面体上所有结点的坐标。 5、已知Mg2+半径为0.072nm,O2-半径为0.140nm,计算MgO晶体结构的堆积系数与密度。 6、计算体心立方、面心立方、密排六方晶胞中的原子数、配位数、堆积系数。 7、从理论计算公式计算NaC1与MgO的晶格能。MgO的熔点为2800℃,NaC1为80l℃, 请说明这种差别的原因。 8、根据最密堆积原理,空间利用率越高,结构越稳定,金钢石结构的空间利用率很低(只有34.01%),为什么它也很稳定? 9、证明等径圆球面心立方最密堆积的空隙率为25.9%; 10、金属镁原子作六方密堆积,测得它的密度为1.74克/厘米3,求它的晶胞体积。 11、根据半径比关系,说明下列离子与O2—配位时的配位数各是多? r o2-=0.132nm r Si4+=0.039nm r K+=0.133nm r Al3+=0.057nm r Mg2+=0.078n m 12、为什么石英不同系列变体之间的转化温度比同系列变体之间的转化温度高得多? 13、有效离子半径可通过晶体结构测定算出。在下面NaCl型结构晶体中,测得MgS 和MnS的晶胞参数均为a=0.52nm(在这两种结构中,阴离子是相互接触的)。若CaS(a=0.567nm)、CaO(a=0.48nm)和MgO(a=0.42nm)为一般阳离子——阴离子接触,试求这些晶体中各离子的半径。
材料科学与工程导论重点
《材料科学与工程》期末复习题 一、填空题(每空 1 分,共 24 分) 1.根据材料的化学组成,材料可以分为金属材料、无机非金属材料、高分子材料、复合材料。 2.生态环境材料的三要素为先进性、环境协调性、舒适性。 3.生态环境材料可分为原料无害化材料、绿色环境过程材料、可循环利用材料、高资源生产率材料。 4.按照断口颜色分,铸铁可以分为灰铸铁、白口铸铁和马口铸铁。 5.按照化学类型,贮氢合金可以分为AB5型、AB2型、AB型、A2B型。 6.减震合金的分类:孪晶型、铁磁性型、位错型、复相型、复合型。 7.常用的硬度测试方法:布氏硬度法、洛氏硬度法、维氏硬度法、显微维氏硬度、肖氏硬度 法。 8.按研究的尺度,材料的结构可以分为四个层次:宏观组织结构、显微组织结构、原子(分子)排列结构和原子中的电子结构。 9.塑性变形方式:位错运动、孪晶、蠕变、粘滞性流动。 10.选矿的主要方法有:手工选矿法、重力选矿法、磁选法、浮选法、联合选矿法。 11.从工艺角度看,冶炼可以分为火法冶炼、湿法冶炼、电冶炼。 二、判断题:(所给的是正确表述)(每题1 分,共6 分) 1.用洛氏硬度的三种表示方法 HRC、HRB、HRA 表示出来的硬度无法比较。 2.σmax/гmax 越大,脆性越大。 3.刃型位错的位错线与滑移方向垂直,螺旋位错的位错线与滑移方向平行。 4.位错属于线缺陷。 5.防锈铝合金,不可以采用热处理强化,而是采用冷加工变形硬化。 6.冷变形温度比淬火温度高。 7.工业高纯铝,数字越大,纯度越高。 8.固溶体的晶质类型跟溶剂保持一致。 三、简答题:(每题4 分,共16 分,8 选4) 1.什么是生命周期评价方法? 答:是用数学物理方法结合实验分析对某一过程、产品或事件的资料、能源消耗、废物排放、环境吸收和消耗能力等环境负担性进行评价、定量该过程、产品或事件的环境合理性及环境负荷量的大小。 2.传统陶瓷与现代陶瓷的区别? 答:
材料科学基础课后答案
8.计算下列晶体的离于键与共价键的相对比例 (1)NaF (2)CaO (3)ZnS 解:1、查表得:X Na =,X F = 根据鲍林公式可得NaF 中离子键比例为:21 (0.93 3.98)4 [1]100%90.2%e ---?= 共价键比例为:%=% 2、同理,CaO 中离子键比例为:21 (1.00 3.44)4 [1]100%77.4%e ---?= 共价键比例为:%=% 3、ZnS 中离子键比例为:2 1/4(2.581.65)[1]100%19.44%ZnS e --=-?=中离子键含量 共价键比例为:%=% 10说明结构转变的热力学条件与动力学条件的意义.说明稳态结构与亚稳态结构之间的关系。 答:结构转变的热力学条件决定转变是否可行,是结构转变的推动力,是转变的必要条件;动力学条件决定转变速度的大小,反映转变过程中阻力的大小。 稳态结构与亚稳态结构之间的关系:两种状态都是物质存在的状态,材料得到的结构是稳态或亚稳态,取决于转交过程的推动力和阻力(即热力学条件和动力学条件),阻力小时得到稳态结构,阻力很大时则得到亚稳态结构。稳态结构能量最低,热力学上最稳定,亚稳态结构能量高,热力学上不稳定,但向稳定结构转变速度慢,能保持相对稳定甚至长期存在。但在一定条件下,亚稳态结构向稳态结构转变。 第二章 1.回答下列问题: (1)在立方晶系的晶胞内画出具有下列密勒指数的晶面和晶向: (001)与[210],(111)与[112],(110)与 [111],(132)与[123],(322)与[236] (2)在立方晶系的一个晶胞中画出(111)和 (112)晶面,并写出两晶面交线的晶向指数。 (3)在立方晶系的一个晶胞中画出同时位于(101). (011)和(112)晶面上的[111]晶向。 解:1、 2.有一正交点阵的 a=b, c=a/2。某晶面在三个晶轴上的截距分别为 6个、2个和4个原子间距,求该晶面的密勒指数。 3.立方晶系的 {111}, 1110}, {123)晶面族各包括多少晶面?写出它们的密勒指数。 4.写出六方晶系的{1012}晶面族中所有晶面的密勒指数,在六方晶胞中画出[1120]、[1101]晶向和(1012)晶面,并 确定(1012)晶面与六方晶胞交线的晶向指数。 5.根据刚性球模型回答下列问题: (1)以点阵常数为单位,计算体心立方、面心立方和密排六方晶体中的原子半径及四面体和八面体的间隙半径。 (2)计算体心立方、面心立方和密排六方晶胞中的原子数、致密度和配位数。 6.用密勒指数表示出体心立方、面心立方和密排六方结构中的原子密排面和原子密排方向,并分别计算这些晶面和晶向上的原子密度。 解:1、体心立方 密排面:{110}21 14 1.414a -+? = 密排方向:<111> 11.15a -= 2、面心立方
材料科学与工程导论样本
材料科学与工程导论 1 本课程的基本概念: 材料科学虽然是一门基础科学, 可是它涉及到诸如本课程的基本概念: 表面物理学、表面化学、金属学、陶瓷学、高分子学、传热学、传质学等多个学科的理论; 同时也与信息科学、生命科学、深海和深空科学等现代科学技术紧密相连。 1.1材料与人类文明一、材料与人类文明发展( 历史贡献) --石器时代、铜器时代、铁器时代、钢铁时代、合成材料时代、复合材料时代…… 陶器( china) 1.陶器出現是人类跨入新石器时代的重要标志之一, 2.据当前已知的考古资料, 中国的陶器制作至少已80 以上的历史。 青铜: 第一种合金 1.青铜, 古称金或吉金, 是红铜与其它化学元素( 锡、镍、铅、磷等) 的合金。 2.史学上所称的”青铜时代”是指大量使用青铜工具及青铜礼器的时期。 3.到春秋战国時期, 齐国工匠总结科技经验写成的《考工记》一书中, 提出了「金有六齐」, 这是世界科技史上最早的冶铜经验总结。 二、材料与人类现代文明 --材料是发展高科技的先导和基石 ( 一) 支撑人类现代文明大厦的四大支柱技术 1.材料科学与技术 2.生物科学与技术 3.能源科学与技术 4.信息科学与技术 * 其中材料是基础! 材料的应用: 计算机与材料; 飞机和材料;复合科学材料能源。 ( 二) 新能源材料则是指实现新能源的转化和利用以及发展新能源技术中所要用到的关键材料。 1.主要包括储氢电极合金材料为代表的镍氢电池材料;
2.嵌锂碳负极和LiCoO2正极为代表的锂离子电池材料、燃料电池材料; 3.Si 半导体材料为代表的太阳能电池材料; 4.铀、氘、氚为代表的反应堆核能材料等。 1.2 材料科学概论 化学成分不同的材料其性能也不相同。但对于同一成分的材料, 经过不同的加工工艺也能够使其性能发生极大的变化。*可见, 除化学成分外, 材料内部的结构和组织状态也是决定材料性能的重要因素。 *材料科学与工程( MSE ) 四要素:材料的合成与制备;成分与组织结构;材料特性;服役行为与使用寿命。 * 性能: 工程材料的性能主要是指材料的使用性能和工艺性能。 一使用性能: 材料的使用性能是指在服役条件下, 能保证安全可靠工作所必备的性能, 其中包括材料的力学性能、物理性能和化学性能。 ①力学性能:主要包括工程材料的强度、硬度、塑性、韧性、蠕变和疲劳性能。 ②物理性能:主要包括工程材料的熔点、密度以及电、磁、光和热性能。 ③化学性能:是指工程材料在环境作用下的耐腐蚀和抗老化性能。 ( 一) 、力学性能——材料在外加载荷( 外力或能量) 作用下或载荷环境因素( 温度、介质和加载速率) 联合作用下表现出来的行为。 -主要是指材料在力的作用下抵抗变形和开裂的性能。 机械设计中应首先考虑材料的力学性能。通俗地讲力学性能决定了在多大和怎样形式的载荷条件下而不致于改变零件几何形状和尺寸的能力。 指标:弹性、塑性、韧性、强度、硬度和疲劳强度等。1、材料的强度(strength)—材料所能承受的极限应力。 物理意义:材料在载荷作用下抵抗变形和破坏的能力。 抗拉强度、抗压强度、抗弯强度、抗剪强度、抗扭强度等。公式: σ=P/F o 单 位: 单位: MPa(MN/mm 2 ) ( 1) 屈服强度σs( yield strength) 和条件屈服强度σ0.02
材料科学基础课后习题答案第二章
第2章习题 2-1 a )试证明均匀形核时,形成临界晶粒的△ G K 与其临界晶核体积 V K 之间的关系式为 2 G V ; b )当非均匀形核形成球冠形晶核时,其△ 所以 所以 2-2如果临界晶核是边长为 a 的正方体,试求出其厶G K 与a 的关系。为什么形成立方体晶核 的厶G K 比球形晶核要大? 解:形核时的吉布斯自由能变化为 a )证明因为临界晶核半径 r K 临界晶核形成功 G K 16 故临界晶核的体积 V K 4 r ; G V )2 2 G K G V b )当非均匀形核形成球冠形晶核时, 非 r K 2 SL G V 临界晶核形成功 3 3( G ;7(2 3cos 3 cos 故临界晶核的体积 V K 3(r 非)3(2 3 3cos 3 cos V K G V 1 ( 3 卸2 3 3cos cos )G V 3 3(書 (2 3cos cos 3 ) G K % G K 与V K 之间的关系如何? G K
G V G v A a3G v 6a2 3 得临界晶核边长a K G V
临界形核功 将两式相比较 可见形成球形晶核得临界形核功仅为形成立方形晶核的 1/2。 2-3为什么金属结晶时一定要有过冷度?影响过冷度的因素是什么?固态金属熔化时是否 会出现过热?为什么? 答:金属结晶时要有过冷度是相变热力学条件所需求的, 只有△ T>0时,才能造成固相的自 由能低于液相的自由能的条件,液固相间的自由能差便是结晶的驱动力。 金属结晶需在一定的过冷度下进行,是因为结晶时表面能增加造成阻力。固态金属熔 化时是否会出现过热现象,需要看熔化时表面能的变化。如果熔化前后表面能是降低的, 则 不需要过热;反之,则可能出现过热。 如果熔化时,液相与气相接触,当有少量液体金属在固体表面形成时,就会很快覆盖 在整个固体表面(因为液态金属总是润湿其同种固体金属 )。熔化时表面自由能的变化为: G 表面 G 终态 G 始态 A( GL SL SG ) 式中G 始态表示金属熔化前的表面自由能; G 终态表示当在少量液体金属在固体金属表面形成 时的表面自由能;A 表示液态金属润湿固态金属表面的面积;b GL 、CSL 、CSG 分别表示气液相 比表面能、固液相比表面能、固气相比表面能。因为液态金属总是润湿其同种固体金属,根 据润湿时表面张力之间的关系式可写出:b SG 》6GL + (SL 。这说明在熔化时,表面自由能的变 化厶G 表w o ,即不存在表面能障碍,也就不必过热。实际金属多属于这种情况。如果固体 16 3 3( G v )2 1 32 3 6 2 (G v )2 b K t K 4 G V )3 G V 6( 4 G v )2 64 3 96 3 32 r K 2 ~G ?, 球形核胚的临界形核功 (G v )2 (G v )2 (G v )2 G b K 2 G v )3 16 3( G v )2
《材料科学与工程概论》复习思考题1剖析
《材料科学与工程概论》复习思考题 一、名词解释 1.磁化曲线:磁感应强度或磁化强度与外加磁场强度的关系曲线称为磁化曲线。 2.磁滞效应及磁化曲线:磁感应强度的变化总是落后于磁场强度的变化,这种效应称为磁滞效应。由于磁滞效应的存在,磁化一周得到一个闭合回线,称为磁滞回线。 3.磁致伸缩:铁磁性物质在外磁场作用下,其尺寸伸长(或缩短),去掉外磁场后,其又恢复原来的长度,这种现象称为磁致伸缩现象(或效应)。 4. 硅酸盐材料:化学组成为硅酸盐类的材料称为硅酸盐材料,也称为无机非金属材料。 5. 水泥:水泥是一种粉末状的谁硬性胶凝材料,加入适量水拌合后成为塑性浆体,既能在空气中硬化又能在水中硬化,并可将砂、石、纤维和钢筋等材料牢固地念接起来,成为有较高强度的石状体,是建造高楼大厦、桥梁隧道、港口码头等工程的主要材料。 6. 复合材料:将两种或两种以上的单一材料复合可获得新的材料,这些新的材料保留了原有材料的优点,克服和弥补了各自的缺点,并显示出一些新的特性,这就是复合材料。 7. 合金:由一种金属跟另一种或几种金属或非金属所组成的具有金属特性的物质叫合金。 8. 晶体:由结晶物质构成的、其内部的构造质点(如原子、分子)呈平移周期性规律排列的固体。长程有序,各向异性。 9. 晶粒:结晶物质在生长过程中,由于受到外界空间的限制,未能发育成具有规则形态的晶体,而只是结晶成颗粒状称晶粒。 10.晶界:结构相同而取向不同晶粒之间的界面。在晶界面上,原子排列从一个取向过渡到另一个取向,故晶界处原子排列处于过渡状态。晶粒与晶粒之间的接触界面叫做晶界。 11.高分子材料:由相对分子质量较高的化合物构成的材料,包括橡胶、塑料、纤维、涂料、胶粘剂和高分子基复合材料等。 12.
材料科学与工程专业导论课认识和感受
材料科学与工程专业导论课认识和感受 作为一名材料科学与工程专业的本科生,专业导论课是学习本专业的最先接触的一门专业知识课程。材料科学与工程专业导论课由几位杰出的本领域的老师讲授,在此过程中,我们对本专业有了整体而细致地了解,而且还能在一定程度上激发我们对本专业的学习兴趣,它的关键在于课业比较系统的了解材料科学领域的研究方向和研究内容,同时,这门课还有着培养学生学习材料科学相关知识的兴趣的作用。 进入材料科学与工程专业导论的学习已经有一段时间了,经历这个阶段,有了对这个专业知之甚少到现在有所了解的转变。通过王金玉等老师专业导论课对于本专业细致讲解,让我们颇为真实地感受了材料的魅力,引起我们的广泛兴趣。老师们从材料和人类与社会各个方面的联系作为出发点,深切地指出材料在人类生活,社会发展,科技进步以及文化等各个方面的重要意义和作用。 材料科学与工程专业是研究材料成分、结构、加工工艺与其性能和应用的学科。在现代科学技术中,材料科学是国民经济发展的三大支柱之一。主要专业方向有金属材料、无机非金属材料、高分子材料,材料加工等。过去,现在和将来,材料在整个人类发展过程始终扮演着十分重要的作用。材料是人类文明的物质基础和先导,是人类认识自然和改造自然的工具,是直接推动社会发展的动力。材料的发展及其应用是人类社会文明和进步的重要里程碑。没有材料科学的发展,就不会有人类社会的进步和经济的繁荣。人类社会的发展历程,是以材料为主要标志的。某一种新材料的问世及其应用,往往会引起人类社会的重大变革,“新材料”的发现和使用伴随着人类的文明进程。比如中国古代,人们往往把人类历史分为石器、青铜器和铁器时代。陶瓷材料的发明和应用,创造了新石器时代的仰韶文化,后来在制陶技术的基础上又发明了瓷器。这是陶瓷材料发展的一次飞跃,瓷器的出现已成为中华民族文化的象征之一,对世界文化产生过深远的影响。再如,人们在大量地烧制陶瓷的实践中,熟练地掌握了高温加工技术,利用这种技术来烧炼矿石,逐渐冶炼出铜及其合金青铜。可以说这是人类社会最早出现的金属材料,它使人类社会从新石器时代转入到青铜器时代。中国商代的司母戊大方鼎和四羊方尊都是古代青铜材料制品的代表。 在近代社会,上个世纪70年代以来,人们把信息、材料和能源作为社会文明的支柱。80年代又把新材料、信息技术和生物技术并列为新技术革命的重要标志。进入21世纪,以纳米材料、超导材料、光电子材料、生物医用材料及新能源材料等为代表的新材料技术。 创新显得更为异常活跃,新材料诸多领域正面临着一系列新的技术突破和重大的产业发展机遇。材料科学与工程学导论着眼于材料科学的基本问题、共性问题,将金属材料、无机非金属材料、高分子材料紧密结合在一起,使学生在初步把握材料共性的同时了解材料的个性。现代材料科学技术的发展,促进了金属、非金属无机材料和高分子材料之间的密切联系,从而出现了一个新的材料领域——复合材料。复合材料以一种材料为基体,另一种或几种材料为增强体,可获得比单一材料更优越的性能。复合材料作为高性能的结构材料和功能材料,不仅用于航空航天领域,而且在现代民用工业、能源技术和信息技术方面不断扩大应用。材料是人类进化最重要的动力,任何工程技术都离不开材料的设计和制造工艺,一种新材料的出现,必将支持和促进当时世界文明的发展和技术的进步。从人类的出现到二十一世纪的今天,人类的文明程度不断提高,材料及材料科学也在不
