高一化学必修二知识点梳理
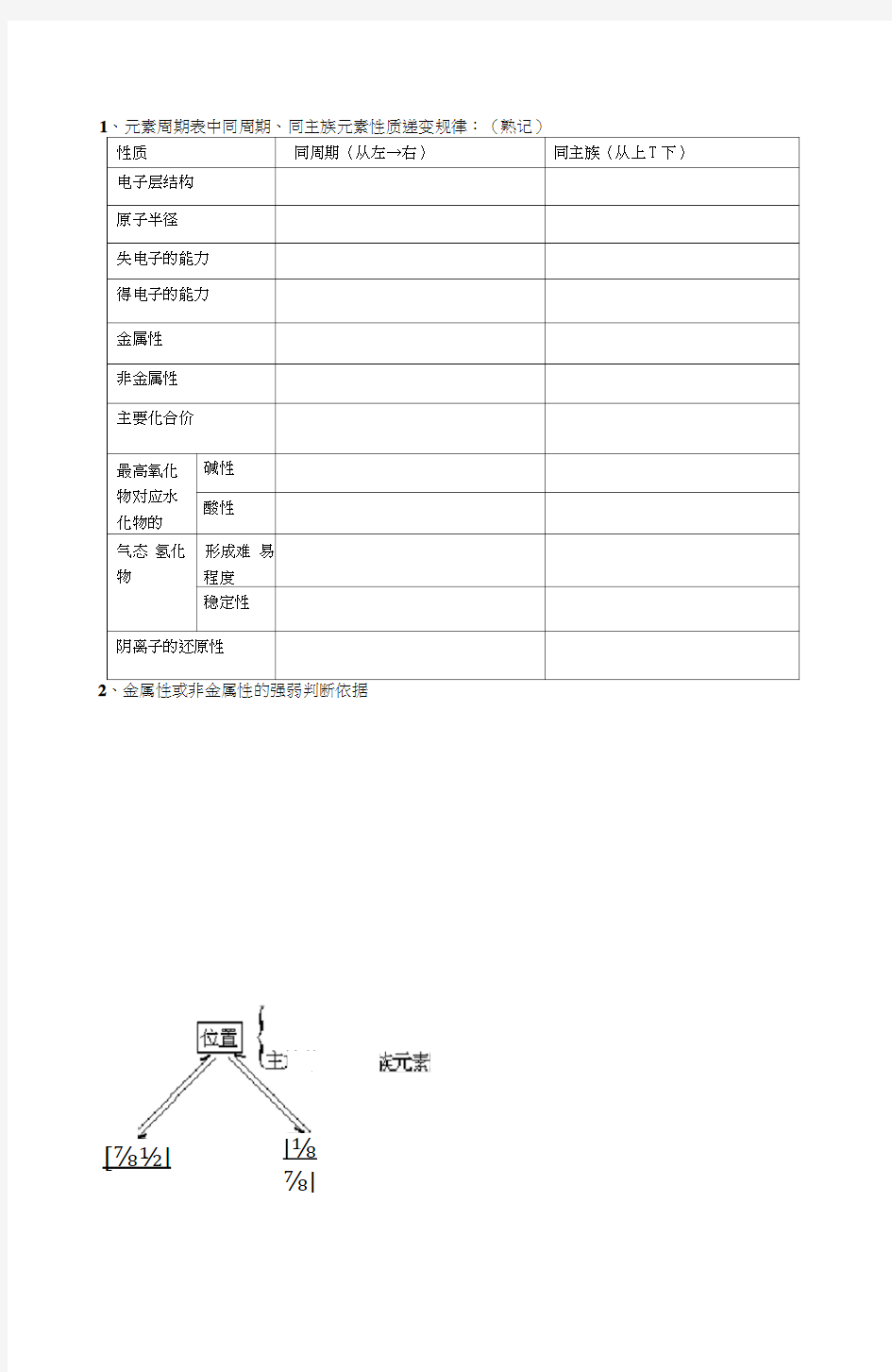

性质同周期(从左→右)同主族(从上T下)电子层结构
原子半径
失电子的能力
得电子的能力
金属性
非金属性
主要化合价
最高氧化物对应水化物的碱性酸性
气态氢化物形成难易程度
稳定性
阴离子的还原性
[??∣∣?
?∣
周期侗厨期主族元秦半径从左至右依次诚小,)
科依朋大。)
礙正价(妣、F)
化呷?≡ (韭金属)
1①与水或酸的反应能±
金属性②最高价氧化物的水化物的碱性
]③萱换何晡子的氧化性非金属性①气态氢化物
濮定性4 b吐疑制氧化物的水化物的酸It
子的宓性
3.
认其观察卜?表,填空并画出金属与非金属的交界线,标出其附近的元素符号。
1.预测未知物的位置与性质
2.寻找所需物质
在_______________ 能找到制造半导体材料,如_________________________ :
在_______________ 能找到制造农药的材料,如________________________
在_______________ 能找到作催化剂,耐高温,耐腐蚀的合金材料。
同周期:
金属单质与酸或水反应剧烈程度降低,非金属单质越来越易与氢气化合金属单质还原性减弱,非金属单质氧化性增强最高价氧化物对应水化物碱性减弱,酸性增强
元素金属性减弱,非金属性增强
失电子能力减弱,得电子能力增强
核对外层电子的吸引増强变小,
电子层数相同,核电荷数递增
同主族:
金属单质与酸或水反应剧烈程度增强,非金属单质越来越难与氢气化合金属单质还原性増强,非金属单质氧化性减弱最高价氧化物对应水化物碱性增强,酸性减弱
元素金属性增强,非金属性减弱
失电子能力增强,得电子能力减弱
核对外层电子的吸引减弱
电子层数递增,I?变大
x、Y、Z为三种短周期元素,原子序数依次递增,X、Z位于同主族,X、Y位于同周期, 由它们构成的物质可以发生以下转化:
(1)Z的元It符号是__________ : X在周期表中的位置_____________________ Y2的化学式
是____________________________________
(2)反应②的化学方程式为 ____________________________________________
(3) XY2的电子式_______________ ,
(4〉ZY2与N i lOH溶液反应的离子方程式
O
非
金
属
性
逐
渐
_______
WA VA 非金属
杵?逐渐
金屈件?逐
渐
有A、臥C、D、E五种短周期元素,它们的原子序数依次增大,A的单质和它的一种氧化物是工业生产上常用的还原剂?B的最外层电子数是次外层的3倍;0.1molC的单质能从酸溶液中置换出2.24L标准状况下的氢气;又知B、C、D所形成的简单离子的电子层结构相同,B 和E是同主族的元素。请回答下列问题:
(1)请依次写出A. C> E三种元素的元素符号:_________ ________________
(2)E的单质在空气中燃烧所生成物质的化学_____________
(3)请写出A的最高价氧化物的电子________________ :
(4)请写出D的最高价氧化物与氢氧化钠溶液反应的离子方程式
三、化学键
1、离子键:
A .相关概念
离子化合物:大多数盐、强典型金属氧化物
C.离子化合物形成过程的电子式的表示(NaCl, Na2O, MgCl2, CaO, NaOH, Na2O2, NH4C1)
2、共价键:
A ?相关概念
B?共价化合物:只有非金属的化合物(除了饮盐)
C?共价化合物形成过程的电子式的表示(NH3, CH4, CO2, H2O2)
D .极性键与非极性键
3、化学键的概念和化学反应的本质
4、化学键
(1)化学键是指:_______________________________________________ o
(2)化学反应的实质是指: __________________________________________
(3)离子键与共价键比较
(4)非极性共价犍与极性共价键比较
非金属单质?如HJ 共价化合物,?I H 2O 2
(∣?例)
■
离子化合物,如Na=Ch (特例)
? ?
?阴、阳离子的电子层结构相同 (想到10. 18电子微粒) ?原电池(想到氧化还原)
? 物质推断(特征的物质如…-1: 1; 1: 2; 1: 3的组成情况、特征的反应如双重的 氧化
产物氮的.硫的、钠的、周期表中的特殊位置等)
一. 化学能与热能
1、 化学反应中能量变化的主要原因:化学键的断裂和形成?
2、 化学反应吸收能量或放出能量的决定因素:反应物和生成物的总能量的相对大小 a. 吸热反应:反应物的总能量小王生成物的总能童 b. 放热反应:反应物的总能量大壬生成物的总能童
3、 化学反应的一大特征:化学反应的过程中总是伴随着證量变化,通常表现为热量变化 .常见的放热反应:
A .所有燃烧反应;
B ?中和反应*
C ?大多数化合反应;D.活泼金属跟水或酸反应; E.物质的缓慢氧化
5、常见的吸热反应: A ?大多数分解反应;
B. C+CO 2=^=2CO
H 2+C U O=C U ÷H 2O
C+ H 2O=C0+H 2
氯化钱与八水合氢氧化顿的反应。
6、中和热:酸与碱发生中和反应生成InU )I H2O (液态〉时所释放的热童.
二、化学能与电能 r Γ :
1"T I
1、原电池: Zn
∏
∏
(1) 槪念 (2) 工作原理:
a.负极:失电子(化合价升离),发生氧化反应 b ?正极:得电子(化合价降低),发生还原反应
(3) 原电池的构成条件:关键是能自发进行的氧化还原反应冃好电础?
19.如右图,在锌、铜和稀硫酸组成的原电池中,负极发生的反应是 A 、 Zn-2e~ =Zn2+ B ? Cu-2e - ==Cu2+ C. 2H÷+2e-=H2 t D? Cu2++2c—-CU
存在范围 共价化合物?如g
离子化合物,?J NaOH. K 2SO 4. NH 4Cl
稀 H 2SO 4
一、化学反应速率
化学反应速率的概念:
二、影响化学反应速率的因素
⑴决定化学反应速率的主要因素:反应物自身的性质(内因)
(2)外因A控制变童)
a.浓度
b?温度
c.催化剂
d.固体表面积
f.其他光、反应物的状态、溶剂
有气体参加的反应,压强等
三.化学反应的限度
1、可逆反应的櫃念和特点
2、绝大多数化学反应都有可逆性,只是不同的化学反应的限度不同;相同的化学反应,不同的条件下其限度也可能不同人化学反应限度的概念:
一定条件下,当一个可逆反应进行到正反应和逆反应的速率相等,反应物和生成物
的浓度不再改变,达到表面上静止的一种“平衡状态”,这种状态称为化学平衡状态,简称化学平衡,这就是可逆反应所能达到的限度。
可逆反应达到平衡状态的标志:反应混合物中各组分浓度保持不变正反应速率=逆反应速率消耗A的速率=生成A的速率例.下面关于化学反应的限度的叙述中,正确的是
A.化学反应的限度都相同
B.可以通过改变温度控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,反应即停止
在一定条件下,对于密闭容器中进行的町逆反应A(g) + 3B(g) == 2C(g),卜列说法屮, 能说明这一反应己经达到化学平衡状态的是
A?主成C的速率与C分解的速率相等
B.A、BV C的浓度相等
C.单位时间生成n molA,
同时生成3n mol B
D.A、E、C的分子数之比为1 :3 :2
下列关于化学反应限度的说法中正确的是( )
A.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度
?.当一个可逆反应达到平衡状态时,那么这个反应的正向反应速率和逆向反M速率相等
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D?化学反应的限度不可以通过改变条件而改变
某反应是吸热反应,且所吸收的热能由外部热源(如酒精灯)提供,提供的热能主要起到的作用。
可逆反应H2(g)+I2(g)=== 2HI(g)?到平衡状态时的标志是
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2. I2. Hl的浓度相等
D?I?在混合气体中的体积分数与H2在混合气体中的体积分数相等
甲烷
一、甲烷的元素组成与分子结构:CH4 正四面体
二、甲烷的物理性质
三、甲烷的化学性质
1、甲烷的氧化反应(燃烧)
实验现象:
反应的化学方程式:
2、甲烷的取代反应
