肿瘤免疫治疗行业研究报告

目录
第一部分抗肿瘤药物免疫治疗 (2)
1.1 细胞因子:抗肿瘤辅助治疗主要手段 (2)
1.2 多肽类药物成国内主流抗肿瘤辅助用药 (3)
1.3 中药免疫治疗药物—国内抗肿瘤市场特色产品 (3)
1.4 免疫检查点抑制剂:免疫治疗未来核心所在 (3)
第二部分细胞治疗:肿瘤免疫治疗的第二途径 (5)
2.1 传统非特异性细胞治疗 (5)
2.2 特异性细胞治疗 (7)
第三部分PD-1:肿瘤免疫治疗的“新宠” (11)
3.1 PD-1抗体让免疫功能重启 (11)
3.2 并非对所有肿瘤都有效 (11)
3.3 综合免疫治疗将是未来方向 (12)
一、抗肿瘤药物免疫治疗
根据治疗方式对肿瘤细胞或组织是否具有特异性,我们将药物免疫治疗总体分为非特异性和特异性药物免疫治疗两部分。非特异性药物免疫治疗没有特别明确的免疫细胞靶点,是从整体上提高人体免疫力从而达到缓解肿瘤症状的药物,又称免疫调节剂;而特异性药物具有明确的靶点与机制,能通过激活或者抑制明确靶点来实现免疫系统对肿瘤的免疫激活。
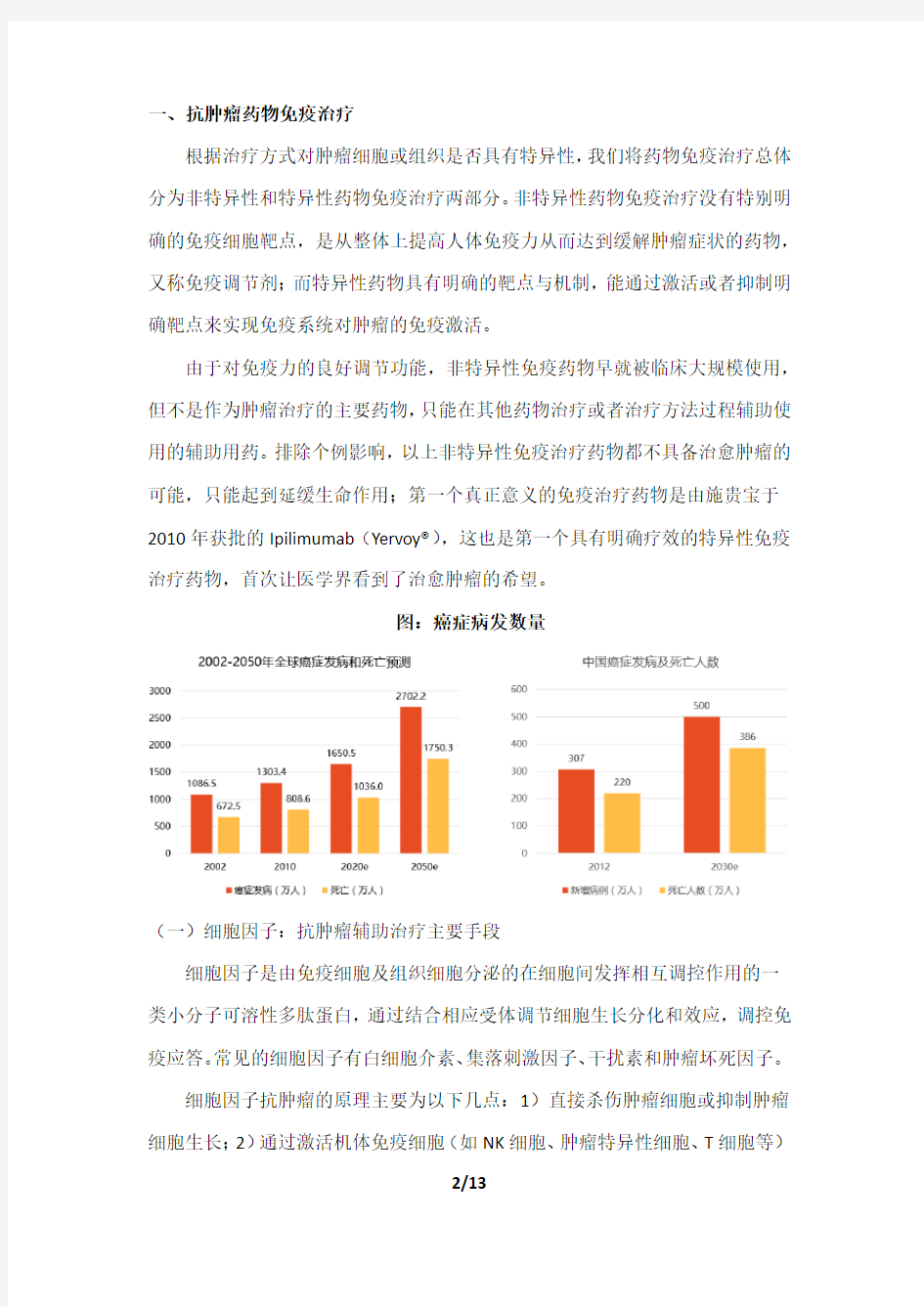
由于对免疫力的良好调节功能,非特异性免疫药物早就被临床大规模使用,但不是作为肿瘤治疗的主要药物,只能在其他药物治疗或者治疗方法过程辅助使用的辅助用药。排除个例影响,以上非特异性免疫治疗药物都不具备治愈肿瘤的可能,只能起到延缓生命作用;第一个真正意义的免疫治疗药物是由施贵宝于2010年获批的Ipilimumab(Yervoy?),这也是第一个具有明确疗效的特异性免疫治疗药物,首次让医学界看到了治愈肿瘤的希望。
图:癌症病发数量
(一)细胞因子:抗肿瘤辅助治疗主要手段
细胞因子是由免疫细胞及组织细胞分泌的在细胞间发挥相互调控作用的一类小分子可溶性多肽蛋白,通过结合相应受体调节细胞生长分化和效应,调控免疫应答。常见的细胞因子有白细胞介素、集落刺激因子、干扰素和肿瘤坏死因子。
细胞因子抗肿瘤的原理主要为以下几点:1)直接杀伤肿瘤细胞或抑制肿瘤细胞生长;2)通过激活机体免疫细胞(如NK细胞、肿瘤特异性细胞、T细胞等)
杀伤肿瘤细胞;3)通过抑制肿瘤细胞的转移,控制肿瘤的发展;4)作为放疗、化疗的辅助手段,维持机体的正常功能。例如TNF-α和LT可直接杀伤肿瘤细胞,IFN-γ和IL-4可抑制多种肿瘤细胞生长;IL-2、IL-15、IL-1、IFN-γ等可诱导CTL
细胞和NK细胞杀伤活性;IFN-γ可诱导肿瘤细胞表达MHCI类和II类分子,增强机体对肿瘤细胞的免疫应答。
(二)多肽类药物成国内主流抗肿瘤辅助用药
多肽类抗肿瘤免疫药物主要是指胸腺肽类药物,对人体免疫系统具有明显促进作用。胸腺肽是胸腺产生的一种蛋白质和多肽激素,是一种生物反应调节因子,能促进淋巴细胞成熟,调节和增强人体免疫机制,在临床上具有抗衰老、抗病毒复制、抗肿瘤细胞分化的作用。胸腺肽是混合物,其中包含多种有效成分,目前最为人熟知的是胸腺生成素Ⅱ和胸腺肽α1。胸腺肽系列药物主要有胸腺肽、胸腺五肽及胸腺肽α1(胸腺法新)三种,胸腺肽制剂在我国临床应用已有20多年的历史,主要成分为健康小牛等动物的胸腺组织提取物。由于各种制剂的生产工艺,标准不同,产品质量及临床疗效也有较大的差异。
(三)中药免疫治疗药物—国内抗肿瘤市场特色产品
中药是国内药物免疫治疗重要组成部分,通过免疫作用发挥抗肿瘤机制的中成药主要包括参芪扶正注射液、康艾注射液和艾迪注射液,主要作用机制为增强机体免疫功能、抑制肿瘤血管生成和诱导肿瘤细胞凋亡。我们认为:中药抗肿瘤药物由于成分相对复杂,中药注射剂政策风险相对较大,抗肿瘤效果较弱,只能在抗肿瘤过程中以辅助用药的形式存在,难以成为主流抗肿瘤药物,且市场仅仅局限于国内,打开国际市场难度较大。
(四)免疫检查点抑制剂:免疫治疗未来核心所在
所谓免疫检查点(immunecheckpointinhibitors),可以简单定义为T细胞表面抑制其激活并参与免疫反应的信号通路。肿瘤细胞与正常细胞相比具有许多遗传性以及表观遗传性改变,理论上可以提供足够数量的抗原,被免疫系统识别区
分,进而引发抗肿瘤免疫反应。但是肿瘤相关的免疫抑制使得肿瘤抗原难以引发有效的抗肿瘤免疫。在有效的抗肿瘤免疫过程中,T细胞作为核心的执行者,首先被T细胞受体(Tcellreceptor,TCR)介导的抗原识别信号激活,同时众多的共刺激信号和共抑制信号精细调节T细胞反应的强度和质量,这些抑制信号即为免疫检查点。免疫检查点存在的作用是一方面参与维持对自身抗原的免疫耐受,避免自身免疫性疾病,另一方面避免免疫反应的过度激活对组织造成的损伤。肿瘤细胞可以通过免疫检查点,抑制T细胞激活,从而逃避免疫杀伤。因此,通过不同的策略增强T细胞的激活对肿瘤免疫治疗具有重要意义,其中针对免疫检查点的阻断是增强T细胞激活的有效策略之一,也是近些年抗肿瘤药物开发最热门靶点。
图:中国抗肿瘤药物治疗市场发展趋势
二、细胞治疗:肿瘤免疫治疗的第二途径
过继细胞免疫治疗(AdoptiveCellTransferTherapy,ACT)是指通过对自体免疫细胞进行体外激活和扩增,然后将其重新输回肿瘤患者体内,并辅以合适的生长因子,促使其发挥杀伤杀死肿瘤细胞的功能。目前,过继性免疫治疗已经成为肿瘤免疫治疗的主要方式之一。过继细胞免疫治疗ACT主要包括非特异性疗法LAK、CIK、DC、NK和特异性TIL、TCR、CAR。
图:免疫治疗的发展历程
(一)传统非特异性细胞治疗
1.CIK细胞
CIK细胞(cytokineinducedkiller,细胞因子诱导的杀伤细胞)是单个核细胞在CD3单抗和多种细胞因子(包括IFN-γ,IL-2等))的作用下培养获得的一群以CD3+CD56+细胞为主要效应细胞的异质细胞群,既具有T淋巴细胞强大的抗肿瘤活性,又具有NK细胞的非MHC(主要组织相容性抗原)限制性肿瘤杀伤能力,因此又被称为NK样T淋巴细胞(NKT细胞)。
2.DC-CIK细胞
DC-CIK细胞治疗是指利用树突状细胞(DC细胞)和细胞因子诱导的杀伤细胞(CIK细胞)两种细胞联合治疗肿瘤。将DC和CIK细胞结合起来,培养双克隆免疫细胞,具备更强大的抗肿瘤特性,能清除体内不同部位的微小残留病灶,防止肿
瘤复发与转移。DC-CIK细胞免疫治疗技术是继手术治疗、放疗、化疗后,被世界认可的第四种治疗癌症的方式,同时也被称为21世纪有望完全战胜癌症的治疗手段。由于其安全性高、无毒副作用的优点,更是被称为肿瘤学科的“绿色生物疗法”。
DC细胞被称为寻找肿瘤细胞的雷达,能够在体内随着血液全身各处主动搜索、识别肿瘤细胞,并把信息传递给免疫活性细胞,促使其激活和大量增殖。CIK 细胞被称为杀伤肿瘤细胞的精确导弹,该细胞对肿瘤细胞的精确识别杀伤能力很强,尤其对手术后或放化疗后的患者治疗效果显著,能清除残留的微小的转移病灶,防止肿瘤细胞的扩散和复发,并能提高机体免疫力。DC与CIK联合应用可以起到1+1>2的治疗效果。
DC-CIK细胞治疗的优点包括:(1)安全性:利用人体自身细胞杀死肿瘤细胞,无毒副作用;(2)针对性:DC细胞识别抗原,直接吞噬肿瘤细胞,CIK细胞非特异性杀伤肿瘤细胞;(3)全面性:重建和提高患者全身的机体免疫功能,全面识别、搜索、杀伤肿瘤细胞,有效防止肿瘤的复发和转移;(4)持久性:启动机体免疫系统,恢复机体免疫功能,持久杀伤肿瘤细胞;(5)彻底性:提高机体免疫能力,彻底清除体内残留肿瘤细胞和微小转移病灶;(6)适应症广:有效治疗大多数实体肿瘤,并能消灭对放、化疗不敏感及转移的肿瘤细胞。
3.NK细胞
NK细胞是自然杀伤性细胞,是人体免疫系统的第一道防线,与机体的抗肿瘤和免疫调节功能密切相关,能广泛识别、迅速溶解、杀伤、摧毁癌细胞,对肿瘤转移和复发的元凶—肿瘤干细胞具有显著的杀伤作用。NK细胞对肿瘤的天然杀伤活性既不需要预先由抗原致敏,也不需要抗体参与,且无MHC限制。
DC细胞好比“侦察兵”,能够主动搜索和识别癌细胞,CIK就像“导弹”,精准杀伤癌细胞;那么NK细胞就是“特种部队”,具备执行杀伤肿瘤干细胞这一特殊任务的能力。同时,NK细胞能够抑制癌细胞附近新血管的生成,从而限制
癌细胞生长所需要的养分进而限制肿瘤生长,从源头上防止肿瘤复发和转移。
NK细胞主要通过以下机制杀伤肿瘤细胞:(1)产生大量的细胞因子,如IFN-y、TNF-a、GM-CSF、IL-3、M-CSF等,调节巨噬细胞、DC细胞、T细胞、B细胞及内皮细胞等细胞的免疫活性;(2)释放穿孔素、颗粒酶,穿孔素在肿瘤细胞表面穿孔,然后使颗粒酶进入肿瘤细胞内诱导其凋亡;(3)通过表面IgGFc受体介导,识别杀伤与IgG抗体特异性结合的肿瘤或病毒感染的靶细胞;(4)表达诱导细胞凋亡的蛋白(fasl)和肿瘤坏死因子相关凋亡诱导配体(trail),使肿瘤细胞进入程序性凋亡状态。
NK细胞对各个阶段的恶性胶质瘤,恶性黑色素瘤、恶性淋巴瘤、肾癌、肺癌、食道癌、肝癌、结肠癌、乳腺癌、卵巢癌等多种恶性实体瘤均有较好的疗效。
4.LAK细胞
LAK细胞(lymphokine-activatedkillercell)即淋巴因子激活的杀伤细胞,是一种外周血淋巴细胞在体外经淋巴因子白介素-2(IL-2)激活3~5天而扩增为具有广谱抗瘤作用的杀伤细胞。LAK有广谱抗瘤作用,且LAK与IL-2合用比单用IL-2效果好。
LAK细胞杀伤肿瘤的机制主要包括:(1)通过肿瘤表面的细胞分子识别并直接杀灭肿瘤细胞;(2)IFN-γ、TNF-α等细胞因子间接杀伤肿瘤细胞。
LAK细胞不仅能杀伤对NK细胞敏感的肿瘤细胞,而且对NK细胞不敏感的各种自体和同种异体的新鲜实体瘤细胞也有杀伤作用,对正常细胞却没有损伤作用。因此,LAK细胞具有NK细胞和细胞毒牲T细胞无可比拟的杀伤效应,在肿瘤免
疫治疗中具有重要地位。
LAK细胞对多数晚期癌症,尤其是对肾癌、黑色素瘤、结直肠癌及非霍奇金金氏淋巴瘤等具有较好的疗效。
(二)特异性细胞治疗
相比传统的非特异性细胞治疗,当前市场研究热点是特异性细胞治疗,主要
有TCR与CAR-T细胞治疗两种。这两种治疗技术均用到基因工程技术,即通过基因工程技术将肿瘤特定抗原的受体导入到T细胞表面,使得改造后的T细胞具有识别肿瘤细胞能力。
图:免疫治疗分类图谱
1.TCR细胞治疗
TCR疗法是将患者体内的普通T细胞分离出来,利用基因工程技术引入新的基因,使转基因T细胞表达能够识别癌细胞的TCR,回输到患者体内从而杀死肿瘤细胞的治疗方法。TCR是T细胞表面的特异性受体,与CD3结合形成TCR-CD3复合物,通过识别并结合MHC呈递的抗原从而激活T细胞,促进T细胞的分裂与分化。TCR的作用机制是向普通T细胞中引入新的基因,使得新的T细胞能够表达TCR从而有效识别肿瘤细胞,引导T细胞杀死肿瘤细胞。TCR疗法在黑色素瘤治疗上取得了突破性进展,同时也在肝癌、乳腺癌、卵巢癌等治疗中取得了一定的成效。
TCR细胞治疗的优点是可以获得各类肿瘤抗原特异性受体从而治疗各种肿瘤,缺点是会攻击带有与肿瘤相同抗原的正常细胞,并且插入的TCR与体内MHC
特异性结合难度大,导致实际肿瘤特异性结合能力不强,在临床应用中还需要进一步改进。
2.肿瘤疫苗:艰难中前进
肿瘤疫苗简介
肿瘤疫苗(tumorvaccine)即是利用肿瘤细胞或肿瘤抗原物质诱导机体的特异性细胞免疫和体液免疫反应,以调节机体免疫功能,达到治疗肿瘤的目的。
疫苗传统上以预防感染性疾病为主,如乙肝疫苗和HPV疫苗通过减少肝炎和宫颈炎的发生,降低肝癌和宫颈癌发生。而当前研发的肿瘤疫苗以治疗性为主,通过特异激活机体的体液和细胞免疫,杀伤肿瘤细胞,其优势在于一旦获得成功,可以产生长期的免疫记忆细胞,消除肿瘤微小残留病和减少复发。
肿瘤疫苗的作用机理是在呈递细胞存在下通过肿瘤抗原刺激体内T细胞从而“驯化”其对肿瘤产生免疫杀伤作用,肿瘤抗原的形式包括蛋白、多肽、质粒DNA或病毒编码产物(病毒也有直接的溶瘤作用),特异性的抗体也可以作为某些B细胞恶性肿瘤的疫苗。
3.CAR-T:PD-1抗体领域外的最热点
CAR-T,全称是ChimericAntigenReceptorT-CellImmunotherapy,即嵌合抗原受体T细胞,这是一个出现了很多年但近几年才被改良使用到临床上的新型细胞疗法。和普通免疫细胞治疗类似,它的基本原理就是利用病人自身的免疫细胞来清除癌细胞,但是具有更高的肿瘤免疫特异性,能对肿瘤细胞产生长期的特异性免疫作用。
图:CAR-T临床试验登记新增数量对比
从技术层面讲,CAR-T技术是将能识别某种肿瘤抗原的抗体的抗原结合部与CD3-ζ链或FcεRIγ的胞内部分在体外偶联为一个嵌合蛋白,通过基因转导的方法转染患者的T细胞,使其表达嵌合抗原受体(CAR)。患者的T细胞被“重编码”后,在体外大量培养增殖后生成大量肿瘤特异性的CAR-T细胞,将这种改造后的T细胞重新输入患者体内对肿瘤细胞及组织进行免疫治疗。
CAR技术自1989年起,经过三代演进:第一代只有T细胞刺激因子,没有共刺激因子;第二代只有单个共刺激因子;第三代才有两个共刺激因子。这些改进都是基于一系列临床试验,对CAR的有效性有显着提高。
三、PD-1:肿瘤免疫治疗的“新宠”
(一)PD-1抗体让免疫功能重启
当免疫系统启动,淋巴细胞充分活化后,细胞膜上会逐步表达一些特殊的“刹车”蛋白,这些“刹车”蛋白为活化的淋巴细胞传入抑制性信号,让活化的细胞逐渐静息下来,防止免疫系统过度活化造成免疫损伤。PD-1就是T淋巴细胞膜上的一种重要“刹车”蛋白。
癌细胞也会产生一些特殊的蛋白,他们是通过接触诱导T淋巴细胞产生各种“刹车”蛋白的,其中就包括PD-1蛋白。当淋巴细胞上提早表达PD-1蛋白后,淋巴细胞就不能活化来发挥抗癌作用,这是癌细胞突破免疫监督的“魔宝”之一。免疫学家发现,当用PD-1抗体把T淋巴细胞上的PD-1“刹车”功能阻断后,淋巴细胞就能恢复活力,重新启动杀伤肿瘤的能力。
PD-1抗体药物自2014年上市以来,成为国际上最受关注的抗癌药物。当前,国际上的大型制药企业也逐步从小分子化学药物的研制转向大分子抗体药的研发方向,尤其是抗“刹车”蛋白抗体药,更成为国际药厂角逐的重地。最近,已有PD-1抗体药在国内上市,还有几十种国内外同类产品陆续完成临床试验即将上市。
(二)并非对所有肿瘤都有效
癌细胞是人体中的正常细胞受环境影响不断突变形成的。癌细胞在体内往往要经过数年的潜伏,躲开免疫系统的监督,才能发展壮大,形成临床可见的肿瘤。而肿瘤一旦形成,则会反客为主,对免疫系统形成压制。肿瘤异常狡猾,会生成多种反制手段,给多种免疫细胞绑上“刹车”,让它们不能启动活化而丧失抗肿瘤能力。PD-1就是肿瘤给杀伤性淋巴细胞绑上的一种“刹车”。通过PD-1抗体的阻断,淋巴细胞的刹车松开,会重新获得杀伤肿瘤的能力。但有些肿瘤患者的淋巴细胞上装的刹车不是PD-1,或者不只是PD-1这一种,因此,使用PD-1抗体就没有效果。
从目前国外公开报道的临床效果看,PD-1抗体在非小细胞肺癌和黑色素瘤上的显效率约40%。而从中国患者自发使用PD-1抗体治疗的非官方疗效统计看,PD-1抗体对多种实体瘤的显效率约20%左右。不同人种的淋巴细胞上形成的刹车种类和结构差异可能是造成PD-1抗体效果不同的原因。即便在显效的这些案例中,也多在1年左右又会形成对PD-1抗体的耐药。
临床试验也只是告诉我们一种方法的安全性和有效性的基本数据。依目前临床试验的安全性和有效性,PD-1抗体还不能作为一线药物普遍在实体瘤治疗中应用。
(三)是否适合用要先做免疫组化
当前PD-1抗体使用的一个主要指征是通过免疫组化判断肿瘤浸润性淋巴细胞是否表达PD-1,有表达的患者临床显效率会更高。没有检测到PD-1表达而使用PD-1抗体却有效果,很可能是检测方法不完善而出现的假阴性。
肿瘤要通过与浸润淋巴细胞的直接接触,通过PDL1配体与PD-1结合而抑制淋巴细胞的功能。除免疫组化明确显示PD-1表达的患者外,那些极晚期或不再适合常规疗法的复发转移患者,在经济条件允许的前提下,尝试PD-1抗体治疗还是有必要的。没有临床可见肿瘤的患者,可能不太适合直接应用PD-1抗体治疗。目前,临床专家和免疫学正在努力探索,不断积累经验,以期精确判断适合PD-1抗体治疗的人群和治疗时机。
PD-1抗体应用后,某些患者体内的淋巴细胞会出现过度激活现象,对自身器官组织发生攻击,形成免疫损伤。目前公开报道及临床使用中已发现PD-1使用后会造成皮疹,腹泻(胃肠道损伤)、心肌炎和间质性肺炎等。如果认知不到位,医学处理不及时,甚至会造成病人死亡。PD-1抗体使用引起的免疫损伤的认知和救治也会随着临床实践不断深入,经验也越来越多。
(三)综合免疫治疗将是未来方向
PD-1抗体虽然上市了,从疗效和耐药性上看,我们不能指望仅靠PD-1抗体
就能将肿瘤彻底治愈。虽然如此,PD-1抗体药物却给了我们很多启示,让我们沿着免疫治疗的方向走下去。
图:中国免疫治疗产业图谱
PD-1抗体治疗成功带给我们的启示:
1.以往的多数免疫治疗方法,显现效果有限,临床专家总把免疫治疗归为可有可无的“辅助治疗”。但PD-1抗体的成功让医学界相信,单靠激活免疫系统,提升免疫力,就能有效绞灭肿瘤。
2.PDL1或PD-1表达而治疗却无效的案例提示,PD-1“刹车”的四维结构可能会有差异,东西方人种的差异会造成疗效差异。从中国人基因中克隆改造的抗体,可能更适合中国人使用。
3.免疫系统的工作方式是协同作战,PD-1协同其他免疫激活剂的使用(即综合免疫治疗),将是未来肿瘤免疫治疗领域重点探讨的方向。
4.寻找不同的“刹车”,制造不同的抗体,针对不同的癌症个体,将是21世纪抗肿瘤免疫药物研发的重要方向之一。
5.PD-1抗体药物与以往批准上市的抗肿瘤抗体药物不同。以往的抗体药多针对肿瘤本身或血管内皮细胞,与常规化疗多有联合效应。而PD-1抗体的效应机理却大不相同,理论上不适合与化疗药物联合使用,而在化疗前使用更有价值。
肿瘤免疫治疗新方法
自体细胞免疫疗法 CIK (cytokine-induced killer,中文名:[自体细胞免疫疗法]多种细胞因子诱导的杀伤细胞) 是将人外周血单个核细胞在体外用多种细胞因子(如抗CD3单克隆抗体、IL-2和IFN-γ等)共同培养一段时间后获得的一群异质细胞。由于该种细胞同时表达CD3+和CD56+两种膜蛋白分子,故又被称为NK细胞样T淋巴细胞,兼具有T淋巴细胞强大的抗瘤活性和NK细胞的非MHC限制性杀瘤优点。因此,应用CIK细胞被认为是新一代抗肿瘤过继细胞免疫治疗的首选方案。CIK细胞中的效应细胞CD3+和CD56+细胞在正常人外周血中极其罕见,仅1%—5%。[1] CIK特点 CIK细胞中的效应细胞CD3+CD56+细胞在正常人外周血中极其罕见,仅1%~5%,在体外经多因子培养28~30天,CD3+CD56+细胞迅速增多,较培养前升幅可达1000倍以上。实验证明,扩增出的CD3+CD56+细胞来源于CD3+CD56-T细胞,而非 CD3-CD56+NK细胞。同时发现在CD3+CD56-的T 细胞中,除 CD4-CD8-T细胞外,其余三种T 细胞亚群(CD4-CD8+、CD4-CD8-、CD4+CD8+)均可通过体外多因子培养而获得CD56分子的表达,
而由于CD4+CD8+细胞和CD4-CD8-细胞在正常人外周血中含量极低而间接提示此CD3+CD56+细胞绝大多数来源于外周血中 CD4-CD8+T细胞。而由于CD4-CD8-T细胞在培养1个月后有近56%的T 细胞同时表达CD56和CD3,表明其也是CIK细胞的重要来源。比较CD3+CD56+CIK细胞中表达CD8+和CD8-,的两群细胞其杀瘤活性没有显著性差异,提示CIK细胞的细胞毒性与CD3CD56表达成相关趋势,而与CD8的表达未表现出相关性。 杀伤原理 CIK细胞能够通过三种途径杀灭肿瘤细胞和病毒感染细胞: ①CIK细胞对肿瘤细胞和病毒感染细胞的直接杀伤:CIK细胞可以通过不同的机制识别肿瘤细胞,释放颗粒酶/穿孔素等毒性颗粒,导致肿瘤细胞裂解。 ②CIK细胞释放的大量炎性细胞因子具有抑瘤杀瘤活性:体外培养的CIK细胞可以分泌多种细胞因子,如IFN-γ、TNF-α、IL-2等,不仅对肿瘤细胞有直接抑制作用,还可通过调节机体免疫系统反应性间接杀伤肿瘤细胞。 ③CIK细胞能够诱导肿瘤细胞的凋亡:CIK细胞在培养过程中表达FasL(Ⅱ型跨膜糖蛋白)通过与肿瘤细胞膜表达的Fas(Ⅰ型跨膜糖蛋白)结合,诱导肿瘤细胞凋亡。 CIK细胞发挥作用的三种途径
肺癌免疫治疗的进展
!!作者单位""##M )#北京$首都医科大学附属北京同仁医院呼吸内科 肺癌免疫治疗的进展 白!澎!综述!张沪生!王毓洲!审校 !!!摘!要"!近年来随着分子生物学和免疫学理论及实验技术的发展$逐步形成了手术,放疗,化疗和免疫治疗的综合治疗模式&肺癌的免疫治疗主要分为" 非特异性主动免疫治疗$特异性主动免疫治疗$抗肿瘤抗体及其导向治疗$过继性免疫治疗$抗肿瘤的细胞因子疗法及基因治疗& !关键词"!肺肿瘤) 免疫治疗!!肺癌是目前在全世界范围内发病率及死亡率均居于首位的恶性肿瘤$全球每年新发现肺癌患者超过"千万$占全世界新发现恶性肿瘤患者的"$J @[&仅$###年就有")##万人死于肺癌&由于以手术,化疗和放疗为主的综合治疗的疗效不能令人满意$寻找治疗肺癌的其它方法就成为人们研究的焦点&随着分子生物学和免疫学理论及科研技术的发展$免疫治疗再次引起了人们浓厚的兴趣$并逐渐成为肿瘤综合治疗的一个重要组成部分&本文仅对近年来在肺癌免疫治疗方面的研究状况作一综述&!!机体抗肿瘤免疫机制及肿瘤免疫治疗概述 很早以前人们就注意到$机体的免疫功能与肿瘤的发生,发展有着密切的关系&当宿主免疫力低下或受到抑制时$肿瘤的发生率明显增加&抗肿瘤免疫反应可分为细胞免疫和体液免疫两种$而细胞免疫占主导地位&免疫监视理论认为$正常机体每天都会有少量细胞发生恶变$而机体的免疫系统则在自然杀伤细胞,巨噬细胞,:细胞,P 细胞及其产生的相应抗体$以及某些细胞因子的作用下$通过细胞免疫和体液免疫两条途径将这些恶变细胞清除&但机体的免疫监视作用是有限的&当机体在致癌因素的作用下$ 大量细胞发生恶变时$免疫监视系统不能及时将其完全清除$而肿瘤细胞又可通过抗原调变,分泌封闭因子及免疫抑制因子或使机体逐渐对其产生免疫耐受等途径来逃避机体的免疫监视$使肿瘤得以在体内进一步发展& 肿瘤免疫治疗学的发展已有"##多年的历史&最初$人们发现患有感染性疾病的肿瘤患者$其预后往往要好于不伴有感染性疾病的肿瘤患者$并由此联想到这种现象有可能与免疫刺激有关&以后$人们又逐步观察到机体的某些抗癌免疫反应,机体对 肿瘤的免疫监视作用$并发现个别肿瘤有自发消退的情况$ 因而认识到肿瘤与免疫有密切的关系&早年人们采用非特异性免疫刺激剂来治疗肿瘤$取得了初步效果&自$#世纪M #年代以来$生物技术$特别是细胞工程和基因工程技术的发展$使肿瘤的免疫治疗得到了飞速进展$ 并逐步形成了手术,放疗,化疗和免疫治疗的综合治疗模式&而免疫治疗作为肿瘤综合治疗的内容之一$具备其特有的优势"首先$即使是类似于复杂蛋白质中单个氨基酸改变这种极其微小的变化也可以被免疫系统识别$并且免疫系统可对自体正常成分,异己成分及病变成分加以区别$因此不会产生化疗,放疗等疗法引起的强烈的甚至是致死性的毒副作用&其次$免疫系统可对常规方法不能发现和根除的肿瘤细胞隐匿性微转移灶加以清除$因此免疫治疗作为肿瘤患者术后辅助 治疗措施$其前景是乐观的*"+ &目前认为$ 免疫疗法能清除少量播散的肿瘤细胞$而对于实体瘤作用有 限*$ +& %!肺癌的免疫治疗 %+!!非特异性主动免疫治疗!许多物质#主要是微生物及其制剂%可以刺激网状内皮系统活性$非特异性的增强免疫功能&非特异性主动免疫治疗就是通过这些物质的刺激$以增强机体的抗肿瘤免疫功能&这种方法不依赖于肿瘤抗原的识别$也不受&类主要组织相容性复合体#BF O <&%限制&自$#世纪!#年代以来$ 卡介苗,短小棒状杆菌等相继应用于临床&随着时间的推移$不断有新的微生物制剂得到研究和应用&日本学者采用溶链菌制剂#X V <>)$%雾化吸入法治疗支气管肺泡癌$取得了很好的效果$进入肺泡内的X V <>)$在局部激活了肺泡内的巨噬细胞$诱导抗肿瘤细胞毒活性并产生多种细 胞因子#如S Y <$,:&A <(等%*)+&1 9Q 9G 3,3等将"!$#个手术切除原发灶后的非小细胞肺癌 #&1O Y O %患者随机分为两组$分别给予X V <>)$辅 ! "$!国外医学呼吸系统分册$##>年E 月第$>卷增刊!1-0,%-57*.1I 5A 3.-*4+B -C10*$26+J $##>$K 38J $>$16778 万方数据
【ASCO 2017】“热议话题:肿瘤突变负荷(TMB)与免疫治疗”
【ASCO 2017】“热议话题:肿瘤突变负荷(TMB)与免疫 治疗” 蔡修宇教授:免疫检查点抑制剂开辟了肿瘤治疗的新时代,但对于生物标记物的寻找在一定程度上限制了其疗效。既往研究证实TMB升高与疗效呈正相关。您怎么看待这个问题?Siraj Ali 教授:TMB的定义非常重要,它指的是一份肿瘤样本中,所评估基因的外显子编码区每兆碱基中发生置换和插入/缺失突变的总数。TMB是如何真正起作用的呢?我们知道,体细胞的突变可转录/表达于在RNA/蛋白水平,产生新的抗原,蛋白片段或多肽段等,这些新的蛋白被自身免疫系统识别为非自身抗原,激活T细胞,引起免疫反应。因此,当每兆碱基中累积的基因变异数目增多时,就可以产生很多新的抗原。目前,在很多研究中都证实TMB和肿瘤新生抗原与免疫检查点抑制剂的疗效是相关的。蔡修宇教授:韩教授对此的观点如何?韩宝惠教授:TMB是本次大会讨论的热门话题。TMB是在预测肿瘤疗效及筛选获益人群方面的新尝试,与传统免疫治疗以及PD-L1的检测是互补的关系,甚至在未来具有更大的优势。要把TMB与驱动基因的概念区分开来。针对突变型患者,驱动基因用来预测靶向药物疗效是有效的,我们之所以讨论TMB,其原因在于其对于野生型驱动基因的患者指导免疫治疗具有重要作用。今年
ASCO会议上有大量关于TMB的报道,弥补了之前PD-L1检测的缺陷,我认为TMB的应用前景非常好。但目前尚无中国人TMB和疗效之间相关性的数据。 Section 2:2017 ASCO TMB研究进展蔡修宇教授:请两位专家对摘要1972中关于非小细胞肺癌患者检测TMB的相关内容发表评论。Siraj Ali 教授:摘要1972是关于NSCLC中BRAF基因融合检测的。如刚刚韩教授所言,目前NSCLC 可以分为驱动基因阳性和野生型两类。对于驱动基因阳性的患者,如EGFR突变和ALK融合的NSCLC,这类患者的TMB 通常较低,因为这类癌症中已经存在一个优势基因,所以整体的TMB较低。而TMB高的患者,驱动基因多为阴性。1972这一摘要中检测了NSCLC中的BRAF融合,我们知道BRAF 是一个重要的驱动基因,所以研究中BRAF融合的患者,TMB较低。目前,驱动基因阳性的患者,更适合接受靶向治疗,如BRAF融合的患者,可能从BRAF或MEK抑制剂的联合治疗中获益。对于驱动基因阴性,且TMB高的患者,更可能从免疫治疗中获益。此外,我们也注意到驱动基因的优势人群多为年轻,非吸烟,患者;而TMB高的患者特征正好与之相反。韩宝惠教授:此项研究中在1800余例患者的分析中发现,BRAF这一罕见基因,除了突变还可能存在融合现象,与BRAF突变可能有不同的治疗策略。BRAF融合的发生率较低,约0.2%,且这类患者的TMB较低,这些
肿瘤的免疫治疗现状及发展方向
World Journal of Cancer Research 世界肿瘤研究, 2019, 9(3), 98-103 Published Online July 2019 in Hans. https://www.360docs.net/doc/cf2983308.html,/journal/wjcr https://https://www.360docs.net/doc/cf2983308.html,/10.12677/wjcr.2019.93014 The Current Strategies and Developing Directions of Tumor Immunotherapy Yuwei Hu1, Yuan Tan1, Yanzhu Yao1, Yuting He1, Yu Xiong1, Qiongwen Liang1, Yingxi Shi1, Huozhen Hu2* 1School of Medicine UESTC, Chengdu Sichuan 2College of Life Science, Sichuan University, Chengdu Sichuan Received: Jul. 2nd, 2019; accepted: Jul. 19th, 2019; published: Jul. 26th, 2019 Abstract With the continuous development of oncology, immunology and molecular biology, tumor immuno-therapy and transformation research have made great achievements, bringing revolutionary changes to the anti-tumor treatment models. The development potential of immunotherapy is huge, and it will become a key weapon for precision medicine in the future, but it also faces many challenges. This re-view will discuss the current strategies and development directions of immunotherapy from specific and non-specific tumor adoptive immunotherapy, immunological checkpoint blockade (ICIs) etc. Keywords Tumor, Immunotherapy, Adoptive Cellular Immunotherapy, Tumor Vaccine, Immune Checkpoint 肿瘤的免疫治疗现状及发展方向 胡雨薇1,谭源1,姚妍竹1,何雨婷1,熊雨1,梁琼文1,时樱溪1,胡火珍2* 1电子科技大学医学院,四川成都 2四川大学生命科学学院,四川成都 收稿日期:2019年7月2日;录用日期:2019年7月19日;发布日期:2019年7月26日 摘要 随着肿瘤学、免疫学及分子生物学等学科的不断发展,肿瘤免疫治疗及转化研究也取得了巨大的成就,为抗肿瘤治疗模式带来了革命性的改变。免疫治疗发展潜力巨大,今后也将成为精准医疗的关键武器,但目前也面临着诸多挑战。本文将从特异性的及非特异性的肿瘤过继免疫治疗、免疫检验点阻断(ICIs)等几个方面来论述免疫治疗的现状及发展方向。 *通讯作者。
肿瘤免疫治疗进展
肿瘤免疫治疗CAR-T技术商业研发的进展 纽约辉瑞公司和巴黎Cellectis公司日前宣布,在肿瘤领域针对某些选择性肿瘤目标,进行全球战略性合作,开发嵌合性抗原受体的T细胞(CAR-T)免疫疗法。Cellectis公司的CAR-T技术平台提供了一个专利的,异基因途径的(利用单一供者来源的T细胞,经基因工程改造后产生的CAR-T,可用于多个病人)CAR-T疗法,这种方法不同于其他的自体来源的CAR-T方法(改造患者自身的T细胞针对肿瘤靶细胞进行治疗)。 根据协议条款,辉瑞公司在肿瘤治疗领域中,针对由辉瑞选定的15种肿瘤具有开发和商业化CAR-T疗法的独家权利。两家公司共同合作负责进行临床前研究,辉瑞公司将负责对于辉瑞选定肿瘤目标中的任何CAR-T疗法进行开发和商业化。此外,该协议也提出了Cellectis公司选定的总共12种肿瘤CAR-T目标。两家公司将共同对4种Cellectis选定的肿瘤CAR-T疗法进行临床前研究,Cellectis 公司对于其余8种肿瘤CAR-T进行独立的研发工作。Cellectis公司将负责对自己选定的肿瘤CAR-T疗法进行临床开发和商业化。辉瑞对Cellectis选定的4项肿瘤CAR-T有优先取舍权。 在合作协议范围内,Cellectis将接收8千万美元的预付款,
并接收用于辉瑞公司选定的CAR-Ts和Cellectis选定的4种CAR-Ts 的研究和开发成本资金。Cellectis有资格获得每项辉瑞产品开发,监管和里程碑性商业进展中的高达1.8亿美元的支付款。Cellectis 也有资格在任何辉瑞商品化产品的净销售额中提成。此外,辉瑞将通过一项股市协议,经由新发行的每股9.25欧元的股票,购买约10%的Cellectis资本,目前协议正待Cellectis股东批准。 Cellectis公司希望将在美国开放一个据点以便能与辉瑞公司的科研人员更加密切的合作。两家公司的结盟,提供了辉瑞所具有的最先进疗法的开发能力,也提供了一个仅有的机会来促进开发最好的CAR-T疗法这一创新性工作。这种CAR-T疗法将可能改变癌症治疗的现有方式。 Cellectis的CEO认为Cellectis的CAR-T技术平台,比其它T 细胞受体基因工程途径更具有真正的优势,而Cellectis与辉瑞的合作,为利用人自体免疫系统对抗癌症,实现该技术全部潜力迈出了重要的一步。辉瑞公司研发总裁认为,这项着眼于肿瘤免疫治疗领域的重要合作,是建立在Cellectis公司先进的基因编辑与细胞工程能力和辉瑞最前沿的癌症生物治疗平台基础上的合作。结合Cellectis的技术创新和科学潜力,加上辉瑞在肿瘤免疫治疗领域的深厚经验,这种强强联合的操作,创建了一个世界级的伙伴关系,
肿瘤免疫治疗新进展_宗金宝
第十一届全国免疫学学术大会 447467 / PS2-010 共载11种免疫分子的PLGA微粒式人工抗原提呈细胞的 制备及其抗肿瘤作用研究 张雷 Khawar Ali Shahzad 许涛万昕汪礼敏裴伟亚沈传来 东南大学医学院 病原生物学与免疫学系 210009 目的:在磁珠或胶乳微球表面共展现pMHC分子和共刺激分子的非细胞性人工抗原提呈细胞(aAPC)是特异性免疫疗法的新策略。但其不可生物降解性阻碍了体内应用。聚乳酸-羟基乙酸共聚物(PLGA)具有生物降解和相容性,是被FDA批准的药物递送常用材料。本研究以PLGA微粒为载体共载11种免疫分子,制备多功能式人工抗原提呈细胞(MaAPC),验证其表面共吸附能力和包裹缓释特征;探讨其体外扩增肿瘤抗原特异性T细胞和体内抑瘤生长的能力。 方法:复乳溶剂挥发法制备内部包裹IL-2、IL-15、CCL21、anti-CTLA-4和anti-PD-1的PLGA微粒,EDC/NHS法使其表面功能化后联合共价吸附H-2Kb/TRP2180-188二聚体、H-2Db/gp10025-33二聚体、anti-CD28、anti-4-1BB、anti-CD2以及抗吞噬分子CD47-Ig,制备MaAPC;在体外,与C57BL/6鼠脾细胞共培养,流式检测TRP2和gp100抗原特异性CTL比例;尾静脉注射MaAPC至黑色素瘤皮下载瘤鼠体内,流式监测外周血,脾脏和肿瘤组织中抗原特异性CTL的频率变化,观察肿瘤生长进度。 结果:PLGA微粒对5种免疫分子的包裹率均在65%以上,均可缓慢释放,28天累积释放率大于80%。其表面对其他6种免疫分子也可有效共吸附,各分子间吸附干扰效应较小;在体外,MaAPC与C57BL/6鼠脾细胞共培养7天后使TRP2和gp100特异性CTL的比例分别提高至71%和68%;在体内,MaAPC输注可有效提升载瘤鼠外周血和脾脏中TRP2和gp100抗原特异性CTL的频率,显著提高肿瘤组织中抗原特异性CTL的浸润,明显抑制皮下瘤生长速度。 结论:PLGA微粒既可表面展现又可包裹缓释常见免疫分子,是理想的aAPC载体。共载11种免疫分子的MaAPC是一种新的、可生物降解的特异性主动免疫生物制剂。 关键词:PLGA,人工抗原提呈细胞,抗原特异性T细胞,抗肿瘤主动免疫 447594 / PS2-011 肿瘤免疫治疗新进展 宗金宝张晓春 青岛大学附属医院 266003 肿瘤免疫学治疗的方法种类繁多,已与现代生物高科技技术结合,发展成为继手术、化疗和放疗之后的第四种肿瘤治疗模式-肿瘤免疫治疗。以检查点抑制剂为代表的免疫疗法和嵌合抗原受体T细胞(Car-T)细胞和Car-NK细胞免疫疗法的成功运用使肿瘤免疫学得以复苏,改变了传统的免疫治疗方法。抗CTLA-4抗体是第一个临床应用有效的免疫检查点阻断药物。抗CTLA-4阻断抗体能够提升抗肿瘤免疫反应和长期生存的免疫力,使已经长成的肿瘤消退,促进了其在临床肿瘤治疗中的发展。PD-1阻断不仅影响T细胞在淋巴组织的活化,而且影响T细胞在表达PD-1配体的组织和肿瘤中的反应,减轻肿瘤微环境中的免疫抑制。嵌合抗原受体T细胞(Chimeric antigen receptor T-Cell,Car-T)免疫治疗,Car-T免疫治疗方法,可以特异性地识别 肿瘤相关抗原,最终达到治愈肿瘤的目的。目前,Car-T细胞治疗技术在国际上还处于临床试验阶段,国内还
肿瘤免疫治疗进展
癌症免疫疗法近几年27大进展事件 癌症免疫疗法是一种针对人体免疫系统而非直接针对肿瘤的疗法,其已有30多年历史,它治疗的是人体免疫系统而非直接针对肿瘤。Science认为,癌症研究界在2013年经历巨变,因为酝酿了数十年的癌症免疫疗法终于确定了它的潜力,在临床试验中表现出令人鼓舞的效果。本文中小编盘点了癌症免疫疗法近几年27大进展事件!* M$ [ N" C% | 1.默沙东免疫疗法Keytruda黑色素瘤一线治疗击败百时美Yervoy% g# {" v: H% u; ~; C; |0 n 默沙东近日在黑色素瘤免疫竞赛中取得伟大胜利。在一项头对头III期研究(KEYNOTE-006)中,该公司PD-1免疫疗法Keytruda (pembrolizumab)用于晚期黑色素瘤一线治疗时,疗效显著优于百时美施贵宝(BMS)免疫疗法Yervoy(ipilimumab,易普利姆)。这对于百时美不断增长的免疫专营权而言是一记重拳。目前,Keytruda已获FDA批准用于既往经Yervoy治疗的晚期黑色素瘤以及既往经一种BRAF抑制剂治疗的晚期黑色素瘤。这种二三线治疗,在很大程度上限制了Keytruda的患者群体。而此次Keytruda在初治晚期黑色素瘤一线治疗中击败Yervoy,将为默沙东带来更大的市场。 d( `' ]; H4 t+ D 截至目前,Keytruda是首个在晚期黑色素瘤一线治疗中与标准护理药物相比表现出生存优势的PD-1免疫疗法。默沙东共研发首席Roger Perlmutter在公布这个消息时暗示,该公司有意重新建立黑色素瘤的临床治疗标准。根据官网信息,Keytruda不仅延缓了癌症的恶化,也延长了患者的生命,达到了无进展生存期(PFS)和总生存期(OS)2个主要终点。独立数据监测委员会(IDMC)审查后认为,这些数据已经足够好,建议终止该项III期研究。详细的数据将在今年4月18-22日举行的美国癌症研究协会(AACR)年会上公布。# o, Q7 L: x) j 2.同病不同命?为何患者对肿瘤免疫疗法反应不一?. c* k) N% h9 u 经过数年的努力,肿瘤免疫疗法已经被公认成为新一代对抗肿瘤的利器。然而,在临床研究中科学家经常遇到一些癌症患者对肿瘤药物没有响应的状况。这一问题甚至已经严重影响了这类药物研发的进程甚至推广。& N; M0 F; h, } 研究发现,肿瘤细胞可以通过激活一种名为PD-1的受体来逃避人体免疫系统的监控。而最近火得无以复加的PD-1药物则正是针对这一问题,使得这些“逍遥法外”的肿瘤细胞重新纳入免疫系统的监控并进而被清除。 FDA最近批准了一系列此类PD-1药物用于治疗黑色素瘤,而其中nivolumab则成为首个被批准用于治疗肺癌的PD-1药物。然而,现有的临床研究显示,只有20%-30%的肺癌患者才能对此类药物出现反应。7 t0 l/ u, }7 S( [/ R / R: o9 h2 J) c 3.肿瘤免疫疗法再探华尔街底线,AduroIPO融资8600万美元) l+ Y! ~ K# n 最近几年,肿瘤免疫疗法在生物医药领域可谓是火得一塌糊涂。而这种趋势甚至影响到了资本市场。众多的生物医药公司都竞相开发肿瘤免疫疗法,并通过IPO获得了华尔街资本家的大力支持。而就在本周,Aduro医药公司再次向市场提交了IPO申请,计划融资8600万美元,此举也可检验经过数年的狂轰乱炸,华尔街的投资家是否仍然对肿瘤免疫疗法热情不减。7 O9 }( T6 R T8 Y3 {& 当然,敢从华尔街的金融大鳄钱包里掏钱,Aduro公司自非泛泛之辈。公司目前正在开发的肿瘤免疫疗法药物CRS-207结合肿瘤疫苗GVAX联合治疗方案刚刚发布了积极的临床研究数据结果。美国FDA此前也授予公司这项疗法突破性药物认证。 目前,该疗法正处于治疗胰腺癌的临床二期研究阶段,并有望在2016年上半年公布研究数据。事实上,早在去年十月份,医药巨头强生公司就已经看到了这种疗法的前景。强生公司和Aduro公司签订了合作开发这种肿瘤免疫疗法的协议,包括了3000万美元的预付款和高达10亿美元之多的里程碑奖金。由此可见强生公司对这一疗法的期待之情。$ R' Y2 h3 `( G" N% [" u1 v+ n 4.cell report:交叉呈递——肿瘤免疫疗法潜在药物靶点3 l, x1 v# T: ]2 \ 早期我们认为树突状细胞(DC,抗原呈递细胞的一种)的主要作用是激活CD4+T细胞。CD4+T细胞作为一类辅助性的免疫细胞,在后天免疫的许多方面具有非常重要的作用。但后来的一系列研究逐渐揭示了DC也具有直接激活CD8+T细胞的能力(即交叉呈递cross-presentation)。* C( }' \2 S7 `" U4 d( l* e 简单介绍一下两类T细胞分别被激活的机制:CD4+的激活需要受到抗原呈递细胞表面MHC-II-抗原复合体的刺激。它的生成依赖于DC等抗原呈递细胞对外界抗原物质的吞噬与消化,并且在内涵体中与空载的MHC-II分子组装,形成成熟的复合体运送到分子表面;CD8+的激活依赖于MHC-I-抗原复合体的刺激,MHC-I在各类细胞中均有表达,而且一般情况下在外界抗原物质通过"主动"的方式进入胞浆中,进而进行一系列消化与处理,最终在内质网中与空载的MHC-I进行组装,最终运送到细胞表面。 : u; W) Y, A; E! b! K
肝癌免疫治疗的研究现状及进展
肝癌免疫治疗的研究现状及进展 摘要】肝癌是我国常见的恶性肿瘤之一。其发生与肿瘤的免疫逃逸密切相关。 随着免疫学和分子生物学的发展,免疫治疗已成为研究热点,并开始应用于临床,显示出广阔的应用前景。本文从主动免疫治疗和过继免疫治疗两个方面综述了肝 癌免疫治疗的现状和进展。 【关键词】肝癌免疫治疗 肝癌是我国最常见的恶性肿瘤之一。目前治疗方法主要有手术切除、化疗栓塞、射频治疗、生物反应调节剂治疗等。放化疗最大的缺点是无特异性杀伤作用,副作用大,易对机体造成继发性损伤,即使是根治性手术也只能解决局部问题, 复发转移率高,预后差。研究表明,肿瘤的发生发展与机体免疫系统密切相关, 免疫逃逸是主要原因之一。如何打破免疫耐受,激活肿瘤的杀伤功能是肿瘤免疫 治疗的主要方向。目前,肝癌的免疫治疗有多种策略。 1 主动免疫 主动免疫是指利用肿瘤细胞的特异性抗原诱导机体产生特异性免疫,从而主 动杀伤肿瘤细胞。目前,肝癌的主动免疫包括树突状细胞疫苗、肿瘤细胞疫苗和 异种重组甲胎蛋白疫苗。 1.1树突状细胞疫苗 树突状细胞(DC)是体内功能最强的抗原提呈细胞。DC最重要的功能是激活静息T细胞。由于许多肿瘤患者缺乏功能性DC,不能刺激抗原特异性T细胞反应,因此在体外诱导功能性DC对于主动免疫治疗具有重要意义。目前,大多数实验 都是利用细胞因子或转录因子激活,或热休克蛋白和肿瘤细胞负载DC制备DC疫苗,然后将这些致敏DC疫苗回流体内,诱导机体产生有效的肿瘤免疫排斥反应。MAGE-1在肝癌中的表达率高达80%,提示MAGE-1可作为肝癌免疫治疗的靶点。吴鸣宇等MAGE-1肽负载DC体外诱导高特异性抗癌免疫应答。肿瘤睾丸抗原(Tumor testis antigen,CT)是20世纪90年代发现的一种肿瘤特异性抗原,除 睾丸外,在正常组织中不表达,但在多种肿瘤组织中高表达。肿瘤睾丸抗原NY-ESO-1是CT抗原中免疫原性最强的抗原。结果表明,NY-ESO-1在肝癌组织中的表达率较高(30%-40%)。张文敏等。用原核表达纯化的NY-ESO-1蛋白肽攻击DC,体外诱导特异性CTL对肝癌细胞的杀伤作用。结果表明,融合蛋白肽刺激DC可 有效刺激T细胞增殖,诱导CTL的产生。 1.2 甲胎蛋白(AFP)多肽疫苗 AFP不仅是肝癌诊断的标志物之一,而且是肝癌免疫治疗的潜在靶点。甲胎 蛋白多肽疫苗是一种刺激肝癌特异性免疫反应的疫苗。巴特菲尔德等人。报道10 例Ⅲ-Ⅳ期肝癌患者用甲胎蛋白肽休克DC疫苗治疗。6例AFP特异性T细胞增多,6例AFP特异性T细胞合成IFN-γ的比例增加。提示AFP靶向疫苗具有免疫活性。 1.3 肝癌肿瘤疫苗 肝癌疫苗是通过物理、化学和生物因素的处理,改变或消除自身或同种肝癌 细胞的致瘤性,保持免疫原性,输入体内,刺激机体产生特异性免疫应答。Yang 等人。结果表明,H22全细胞疫苗可诱导肝癌小鼠产生特异性免疫应答,明显延 长小鼠的存活时间。 2 过继免疫治疗 ATT是一种将具有抗瘤活性的免疫细胞诸如:LAK、TIL、CTL细胞、细 胞因子诱导的杀伤细胞(CIK细胞),转移给肿瘤患者的被动免疫治疗方法.
2020版免疫检查点抑制剂治疗恶性肿瘤的PETCT评价专家共识(全文)
2020版免疫检查点抑制剂治疗恶性肿瘤的PET/CT评价专家共识 (全文) 【摘要】 免疫检查点抑制剂(ICIs)是恶性肿瘤治疗领域的重大突破,但由于其作用机制使然,出现了假性进展、超进展等特殊肿瘤应答模式,对临床治疗决策和疗效评价带来了困难与挑战。2017年,欧洲核医学年会根据已公布的临床试验数据,报道了应用F-FDG PET/CT评价肿瘤免疫治疗反应、判读免疫相关不良反应的优势。在中国,自2013年正式开始ICIs的临床研究以来,已有大量的研究数据产生,如何在肿瘤ICIs治疗中合理、规范地应用PET/CT成为亟待解决的临床和科学问题。鉴于此,由中华医学会核医学分会PET学组牵头,针对PET/CT检查规范、ICIs治疗后PET/CT 图像解读、疗效评价标准等内容,在结合文献、专家经验和委员会成员内部讨论的基础上,最终达成此共识,以期带动相应领域的技术普及与推广。【主题词】 恶性肿瘤;免疫检查点;PET/CT;专家共识 肿瘤免疫治疗是恶性肿瘤治疗领域的重大突破。2016年2月4日发布的美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)恶性肿瘤研究进展年报将免疫治疗评为2015年恶性肿瘤研究的最大进展。目前,肿瘤免疫治疗较成功的领域和研究的热点主要集中在免疫检查
点抑制剂(immune checkpoints inhibitor, ICIs)。免疫检查点是人体免疫系统中起保护作用的分子,正常情况下通过抑制T细胞分化增殖来调控免疫平衡。肿瘤组织过度表达免疫检查点分子,抑制T细胞活化增殖或诱导T细胞凋亡,导致免疫抑制性肿瘤微环境形成,使肿瘤细胞逃避机体的免疫监控和杀伤。目前,最受关注的ICIs包括细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4, CTLA-4)抑制剂和细胞程序性死亡受体1(programmed cell death-1, PD-1)/细胞程序性死亡受体配体1(programmed cell death-ligand 1, PD-L1)抑制剂等。目前,ICIs已经获批临床应用的恶性肿瘤包括恶性黑色素瘤、非小细胞肺癌、肾细胞癌、膀胱癌、头颈鳞癌、霍奇金淋巴瘤、胃癌、肝癌等。 然而,由于ICIs的作用机制不同,与既往的治疗手段(化疗、放疗、分子靶向治疗等)相比,肿瘤的治疗反应模式多样,除了出现延迟应答、假性进展、超进展等现象,还可能出现免疫相关不良事件 (immune-related adverse events, irAEs),对临床治疗决策和疗效评价带来了困难与挑战。尽管新的实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST),如免疫相关疗效评价标准(immune-related response criteria, irRC)、免疫相关实体瘤的疗效评价标准(immune-related RECIST, irRECIST)、实体肿瘤免疫疗效评价标准(immune response evaluation criteria in solid tumors, iRECIST)等应用于肿瘤免疫治疗,以避免误判假性进展等特殊治疗反应
肿瘤免疫治疗的研究进展
肿瘤免疫治疗的研究进展 摘要】近几年,对于癌症的研究不断增多,将免疫治疗应用在抗肿瘤治疗过程 中受到了广泛关注,要结合免疫治疗的应用机制以及机体免疫反应调节通路等特点合理性提升治疗效果。本文简要分析了免疫治疗的内涵,并对目前肿瘤免疫治疗的研究新进展予以讨论,仅供参考。 【关键词】肿瘤免疫治疗;研究进展;单克隆抗体;新生抗原 蔡尚,田野,徐波[1]等在研究中指出,肿瘤免疫治疗目前已经成为了癌症研 究的热点,如何有效进行疗效的评价需要结合临床试验等进行多元化分析,从而搭建更加系统化的研究平台。 1肿瘤免疫治疗的内涵 肿瘤免疫治疗是基于肿瘤免疫学的治疗机制,在激发并且调动人体免疫系统的基础上,强化肿瘤微环境抗肿瘤免疫力水平,一定程度上控制并且杀死肿瘤细胞。需要注意的是,肿瘤免疫学治疗方法不断增多,和现代生物科技技术的融合也是必然趋势,尽管在近代医学研究中对免疫系统的研究机制进行了全面深入的分析,但是依旧存在一些应用问题,其中,免疫治疗存在无法预测治疗结果以及患者反应的问题。特别是一些新的生物标志物,对疗效的评估以及耐药研究都将成为未来医学研究的重点。 2肿瘤免疫治疗的研究进展 为了进一步推动肿瘤免疫治疗的发展,相关学者也在不断研究和创新,旨在建立更加系统化的新型治疗机制,提高患者的治愈水平。 2.1单克隆抗体 宋征,马璟[2]在研究中指出,近几年单克隆抗体成为了癌症治疗中重要的组成部分,尤其是在研究人员全面开展癌细胞和正常细胞差异化分析工作的基础上,新型单克隆抗体附加到药物中能有效提升作用疗效,发挥单克隆抗体安全性治疗优势。值得一提的是,单克隆抗体本身组成成分是蛋白质,为了避免治疗效果不良,研发新型药物处理方式较为关键。其中,将不同抗体进行部分组合,形成双特异性抗体,使得一部分附着在癌细胞上,另一部分则附着在免疫细胞上,建立免疫应答,从而提升单克隆抗体的治疗效果。 2.2新生抗原 针对恶性肿瘤的免疫治疗方式主要集中在细胞因子、疫苗接种以及免疫检查点抑制剂等方面,而新生抗原能借助检查点抑制剂疗法提高治疗效果。陈弟,唐超,姚瑜[3]等在研究中指出,美国食品药品监督管理局在2011年批准了靶向程序性细胞死亡受体的单抗,并且对免疫检查点抑制剂进行了科学化规范,但是这种药品的实际治疗效果仅为10%到30%,加之药品价格较为昂贵,受众面存在一定的局限性。基于此,对于相应药品的研究进程也在不断深入,新生抗原能作为预测免疫检查点抑制剂的重要指标,借助分析新生抗原数量以及质量就能对CD8+T细胞的肿瘤浸润时间进行分析,从而合理性完善对应的治疗方案。另外,高克隆性新生抗原负荷也能作为分析免疫相关基因的标准,一般而言,肿瘤突变负荷较高的患者体内新生抗原负荷会随之增加,进而就会造成特异性CD8+T细胞和CD4+T 细胞发生细胞免疫反应,关注基因组层面有效对免疫环境进行分析,从而合理性预测免疫治疗效果,提升用药的针对性和实效性。 除此之外,过继细胞疗法也是目前较为常见的治疗方案,主要是将肿瘤特异
肿瘤免疫治疗的研究现状及应用
综 述 Zongshu 《中外医学研究》第17卷 第22期(总第426期)2019年8月- 184 - Chinese and Foreign Medical Research Vol.17, No.22 August , 2019 *基金项目:2017年度皖南医学院省级大学生创新创业训练计划项目(项目编号:201710368173) 2018年度皖南医学院国家级大学生创新创业计划项目(项目编号:201810368020) ①皖南医学院 安徽 芜湖 241000 肿瘤免疫治疗的研究现状及应用 * 王贝茹① 张思远① 魏陈秋① 【摘要】 与以往通过常规手术、放疗、化疗不同,肿瘤免疫治疗是一种通过激活机体自身免疫系统来对抗肿瘤的治疗方式。近年来,抗肿瘤免疫因其疗效显著而备受瞩目。目前,抗肿瘤免疫治疗已包括多种治疗策略,主要有免疫检查点抑制疗法、过继免疫细胞治疗、肿瘤疫苗等多种治疗手段,是较为经典且值得深入研究的科研方向。因此,本文对临床应用较为经典的肿瘤免疫疗法的研究现状及应用加以概括和评述。 【关键词】 免疫治疗; 免疫检查点抑制; 过继免疫细胞疗法; 肿瘤疫苗 doi:10.14033/https://www.360docs.net/doc/cf2983308.html,ki.cfmr.2019.22.079 文献标识码 A 文章编号 1674-6805(2019)22-0184-03 The Current Situation and Application of Anti-tumor Immunotherapy/WANG Beiru,ZHANG Siyuan,WEI Chenqiu/.//Chinese and Foreign Medical Research,2019,17(22):184-186 【Abstract】 Different from conventional surgery,radiotherapy and chemotherapy,tumor immunotherapy is a method of anti-tumor therapy by activating the body ’s autoimmune system.In recent years,anti-tumor immunity has attracted much attention because of its remarkable effect.At present,anti-tumor immunotherapy has included a variety of treatment strategies,including immunological checkpoint inhibition therapy,adoptive immune cell therapy,tumor vaccine and other treatment methods,which is a more classical and worthy of further research direction.Therefore,the research current situation and application of classical tumor immunotherapy in clinic are summarized and reviewed. 【Key words】 Immunotherapy; Immune checkpoint inhibitors; Adoptive immunotherapy; Tummor vaccine First-author ’s address:Wannan Medical College,Wuhu 241000,China 近年来,恶性肿瘤的发病率逐年提高,对人类的健康产生威胁。传统的治疗方法首要包括手术、放疗、化疗,但这三种治疗方式除直接杀伤肿瘤细胞以外,也对人体的正常组织细胞造成难以控制的损伤,使得肿瘤患者在治疗过程中要承受很大的痛苦,且治疗效果欠佳。因此,许多国内外医学和科研工作者在孜孜不倦地寻求一种新的治疗方法来弥补传统治疗上的不足。随着近代生物化学、医学免疫学、细胞分子生物学等有关学科理论和应用的迅速发展,肿瘤免疫治疗的临床应用得到了深入研究,为肿瘤患者的治疗带来新的希望。而应用当前的肿瘤免疫疗法主要包括靶向免疫检查点治疗、过继性免疫细胞疗法以及肿瘤疫苗等多种方法[1]。因肿瘤免疫治疗手段具有较高的疗效性和安全性,其已经成为国内外肿瘤治疗领域当中颇具研究前景的方向之一。本文就经典抗肿瘤免疫疗法的研究现状及应用进行综述,以期能够为相关研究提供新的思路。1 肿瘤免疫治疗的研究现状 肿瘤免疫治疗是指通过激活机体的细胞免疫系统和体液免疫系统的内在能力,从而直接靶向攻击肿瘤细胞,达到控制肿瘤发展和杀灭肿瘤的目的。借此,肿瘤免疫治疗成为继手术治疗,放疗和化疗之后的一种新型治疗方法[2]。这种疗法同时联合手术、放疗、化疗等治疗手段可以明显提高恶性肿瘤患者的存活率,在实践中呈现出常规放化疗方法无可比拟的优势。 美国科学家詹姆斯·艾利森(James P Allision)和日本免疫学 家本庶佑(Tasuku Honjo)教授在2018年被授予诺贝尔生理学或医学奖,以表彰他们在癌症免疫治疗方面所做出的贡献,他们的研究发现创立了癌症疗法的一个全新理念,给肿瘤患者带来了生存的希望[3]。目前,肿瘤免疫治疗在黑色素瘤、卵巢癌、结直肠癌、肺癌等恶性肿瘤的治疗中都已经取得了重大突破[4-5]。 近年来,随着国际上肿瘤免疫治疗水平的快速发展,我国也随之进入了研究抗肿瘤免疫治疗的热潮[6]。在国内应用于临床的肿瘤免疫疗法中,主要有:抗体靶向治疗药物、肿瘤疫苗、过继免疫细胞疗法等治疗手段。但由于我国起步较晚,肿瘤免疫治疗水平与国外相比仍有较大进步空间。例如:针对免疫检查点的靶向治疗目前尚缺乏与之相关的临床数据,过继免疫细胞回输治疗规模几乎均局限于实验室层面,而对于肿瘤疫苗相关的临床研究仍亦缺乏大量的能够佐以证明的临床研究数据[7];另外,对于如何增强肿瘤疫苗的免疫原性、如何制备同时激活CD4+T 细胞与CD8+T 细胞的肿瘤疫苗、如何克服肿瘤的免疫逃逸、如何结合不同的免疫效应细胞以获得高效免疫应答等[8],都是肿瘤免疫治疗急需解决的问题。2 肿瘤免疫治疗的主要分类2.1 免疫检查点治疗 通过阻断肿瘤免疫检查点的方法是近年来治疗癌症较为有效的策略之一,现已经成为肿瘤研究和治疗领域的热点。随着免疫学等相关学科研究的逐渐发展,人们发现T 细胞表面具有许多的共刺激分子和共抑制分子,共同精准调控T 细胞的活化[9]。靶向免疫检查点治疗的基本原理就是通过采用共抑制分子或配体的拮抗剂以及其他药物来阻断信号通路,解除肿瘤患者的免疫抑制,进而刺激细胞毒性T 细胞的活化,增强其杀伤肿瘤细胞的能力[10]。在2018年诺贝尔医学奖得主发现免疫检查点疗法以前,其临床发展的进展都不大,但是目前关于“免疫
免疫超进展
免疫治疗超进展 近年来,以抗PD-1/PD-L1单抗为代表的免疫检查点抑制剂在多种瘤种中均表现出不错的疗效,在治疗领域中的地位日益重要。 由于免疫治疗独特的作用机制,肿瘤对免疫治疗的反应也与传统治疗不尽相同。部分患者接受免疫治疗后会出现影像先进展再缓解的现象,也就是所谓的“假性进展”,这一现象促进了iRECIST评价标准的诞生,用于免疫治疗疗效的评估。也有部分患者在免疫治疗后出现肿瘤快速进展现象,称为“超进展”,不过,超进展也不是免疫治疗所特有,化疗和靶向治疗也有超进展的报道。
超进展的定义 在2016年欧洲肿瘤内科学会年会(ESMO)会议上,免疫超进展的研究首次被报道,当时一份不太显眼的壁报提出“Paradoxical progressive disease”(PPD)这一概念,并使用肿瘤生长速率(TGR)>50%来定义PPD,TGR则主要通过免疫治疗前后CT扫描测量的肿瘤大小改变,以及发生这些变化所用时间来进行计算。随后古斯塔夫·鲁西研究院的Champiat
团队明确提出了超进展(HPD)这一概念,在这之后,很多学者都对超进展现象进行了报道,并将其定义进行补充和完善。 目前,比较全面的超进展定义如下,在免疫治疗后肿瘤进展满足以下三个条件:①在免疫治疗中,肿瘤进展时间小于两个月;②肿瘤负荷相比于基线期增长超过50%;③免疫治疗后肿瘤生长速度超过之前速度2倍以上。 超进展的发生率及预后 超进展的发生率在不同的肿瘤类型及不同报道中有较大差异,目前报道在4%~29%之间,该差异除了与瘤种有关,可能还与研究中超进展的定义不同有关。非小细胞肺癌(NSCLC)免疫治疗超进展发生率最大样本量的研究,来自古斯塔夫·鲁西研究院的Ferrara团队,该团队回顾分析了法国8家中心的406例免疫治疗患者,发现NSCLC患者免疫治疗超进展的发生率为14%(56/406),是化疗组患者超进展发生率的3倍(5%,3/59)。 目前研究显示,超进展患者生存期更短。法国Ferrara的回顾性研究显示,HPD患者预后更差,中位总生存(OS)3.4个月,与非HPD患者的6.2个月相比,差异有统计学意义(P=0.003);而在化疗组的59例患者中,未发现HPD患者与非HPD有生存差别,也可能因为样本量少。来自韩国的一项研究分析了263例免疫单药患者,该研究首次分析了普通疾病进展(PD)患者与HPD患者预后的不同,在99例PD患者中,55例发生HPD,PD患者(除去HPD)中位OS 205天, HPD患者中位OS仅为50 天。其他研究也报道了相似结果。
