基础生化实验内容 2012版

实验一、考马斯亮蓝G-250法测定可溶性蛋白质含量
【实验目的】
学习、掌握考马斯亮蓝G-250法测定蛋白质含量的原理和方法。
【实验原理】
考马斯亮蓝G-250在游离状态下呈红色,与蛋白质结合则呈现蓝色。染料的最大吸收从465nm变为595nm,蛋白质-染料复合物在595nm具有很大的光吸收值,蛋白质测定的灵敏度较高,最低检出量为1ug蛋白质。本方法操作简便快捷,灵敏度高,测定范围1-1000ug。
【实验材料、仪器及试剂】
1.材料:新鲜的植物材料
2.仪器:722分光光度计,天平,离心机,研钵,容量瓶,试管,移液管,漏斗
(1)标准牛血清蛋白质溶液:0.1mg/ml
(2)考马斯亮蓝G-250溶液:
【实验步骤】
1.样品的提取:准确称取鲜样2克,用2ml蒸馏水在冰浴中研成匀浆,转移到25ml容量瓶中并定容。在8000rpm冷冻离心10min,取上清液待测。
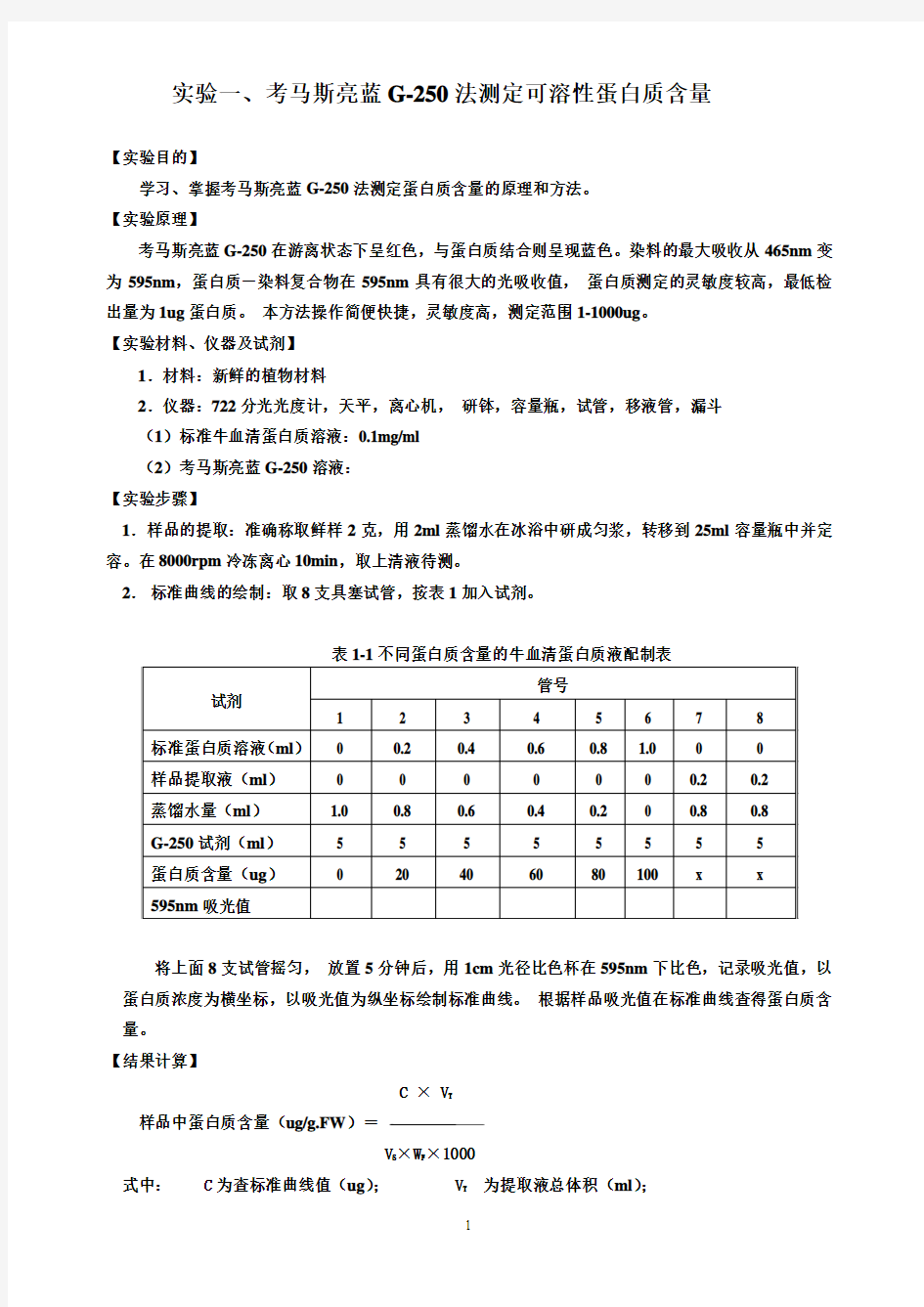
2.标准曲线的绘制:取8支具塞试管,按表1加入试剂。
将上面8支试管摇匀,放置5分钟后,用1cm光径比色杯在595nm下比色,记录吸光值,以蛋白质浓度为横坐标,以吸光值为纵坐标绘制标准曲线。根据样品吸光值在标准曲线查得蛋白质含量。
【结果计算】
C × V T
样品中蛋白质含量(ug/g.FW)=
V S×W F×1000
式中: C为查标准曲线值(ug);V T为提取液总体积(ml);
V S 为测定时加样量(ml); W F为样品鲜重(g)。
实验二植物激素的酶联免疫吸附测定法(ELISA)免疫测定是利用抗原、抗体特异性反应而建立的,根据可视化方法的不同可分为:酶联免疫、放射免疫、荧光免疫、化学发光免疫测定、生物发光免疫测定、浊度免疫测定法等。由于酶联免疫吸附分析法(Enzyme-linked Immunosorbent Assays, 简称ELISA)具有灵敏性、特异性高,且方便、快速、安全、成本低廉的特点,而日益被广泛应用于植物激素测定。目前,几大类植物激素IAA,ABA, GA3、GA4、iPA、ZR、DHZR等都建立了相应的ELISA方法并有试剂盒出售。
植物激素的酶联免疫检测方法有两种形式,一种是在固相载体上包被抗体(直接法),另一种是包被抗原(间接法)。
直接法利用游离抗原和酶标抗原与吸附的抗体进行竞争。间接法利用游离抗原和吸附抗原与游离抗体进行竞争。
间接法的原理可用下式表示:
Ab+H+HP=AbH+AbHP
其中Ab表示抗体,H表示游离激素,HP表示吸附在板上的激素-蛋白质复合物。根据质量作用定律,当该反应体系中Ab及HP的量确定时,游离H越多,结合物AbH形成的就越多,而AbHP形成的就越少,即结合在板上的抗体就越少,通过酶标二抗检测结合物AbHP的多少,就可以确定游离H量的多少。
材料、试剂及设备
1 材料
各种新鲜植物材料
2 仪器设备
研钵,冷冻离心机,台式快速离心浓缩干燥器或氮气吹干装置,酶联免疫分光光度计,吸水纸,恒温箱,冰箱,酶标板(40孔或96孔),可调微量液体加样器(10μl,40μl,200μl,1000μl),带盖瓷盘(内铺湿纱布)。
3 试剂
(1) 磷酸盐缓冲液(PBS):称取8.0g NaCl, 0.2g KH2PO4 , 2.96g Na2HPO4 ·12H2O,用量筒加1 000 ml蒸馏水,pH为7.5。
(2) 样品稀释液:500 ml PBS中加0.5 ml Tween-20,0.5g明胶(稍加热溶解)。
(3) 底物缓冲液:称取5.10g C6H8O7·H2O(柠檬酸), 18.43g Na2HPO4·12H2O,用量筒加1 000ml 蒸馏水,再加1 ml Tween-20,pH为5.0。
(4) 洗涤液:1000ml PBS加1mlTween-20。
(5) 终止液:2mol/L H2SO4。
(6)提取液:80%甲醇,内含1 mmol/L BHT(二叔丁基对甲苯酚,为抗氧化剂,先用甲醇溶解BHT,再配成80%的浓度))。
操作步骤
1.样品中激素的提取
(1)称取0.5-1.0g新鲜植物材料(若取样后材料不能马上测定,用液氮速冻半小时后,保存在-20℃的冰箱中),加2ml样品提取液,在冰浴下研磨成匀浆,转入10ml试管,再用2ml提取液分次将研钵冲洗干净,一并转入试管中,摇匀后放置在4℃冰箱中。
(2)4℃下提取4h,3500转/min离心8min, 取上清液。沉淀中加1ml提取液,搅匀,置4℃下再提
取1h,离心,合并上清液并记录体积,残渣弃去。
(3)上清液过C-18固相萃取柱。具体步骤是: 80%甲醇(1ml)平衡柱→上样→收集样品→移开样品后用100%甲醇(5ml)洗柱→100%乙醚(5ml)洗柱→100%甲醇(5ml)洗柱→循环。
(4)将过柱后的样品转入5ml塑料离心管中,真空浓缩干燥或用氮气吹干,除去提取液中的甲醇,用样品稀释液定容(一般1g鲜重用2ml左右样品稀释液定容,测定不同激素时还要稀释适当的倍数再加样)。
2.样品测定(本指南所用的量是按一块96孔板计算的)
竞争:即加标准物、待测样和抗体。
加标样及待测样:取适量所给标样用样品稀释液配成:IAA,ABA, ZR标准曲线的最大浓度为100ng/ml,GA的最大浓度为50ng/ml,JA-ME 的最大浓度为200ng/ml。然后再依次2倍稀释8个浓度(包括0ng/ml )。将系列标准样加入96孔酶标板的前两行,每个浓度加2孔,每孔50μl,其余孔加待测样,每个样品重复两孔,每孔50μl。
加抗体:在5ml样品稀释液中加入一定量的抗体(最适稀释倍数见试剂盒标签,如稀释倍数是1:2000,就要加2.5μl的抗体),混匀后每孔加50μl,然后将酶标板加入湿盒内开始竞争。
竞争条件37℃左右0.5h。
洗板:将反应液甩干并在报纸上拍净。第一次加入洗涤液后要立即甩掉。然后再接着加第二次。共洗涤四次。
加二抗:将适当的酶标二抗加入10ml样品稀释液中(比如稀释倍数1:1000就加10μl),混匀后,在酶标板每孔加100μl,然后将其放入湿盒内,置37℃下,温育0.5h。
洗板:方法同竞争之后的洗板。
加底物显色:称取10-20mg邻苯二胺(OPD)溶于10ml底物缓冲液中(小心勿用手接触OPD),完全溶解后加4μl 30% H202混匀(显色液要现用现配),在每孔中加100μl,然后放入湿盒内,当显色适当后(肉眼能看出标准曲线有颜色梯度,且100ng/ml孔颜色还较浅),每孔加入50μl 2mol/L硫酸终止反应。
比色:在酶联免疫分光光度计上依次测定标准物各浓度和各样品490nm处的OD值。
结果计算:
用于ELISA结果计算最方便的是logit曲线。曲线的横坐标用激素标样各浓度(ng/ml)的自然对
数表示,纵坐标用各浓度显色值的logit值表示。Logit值的计算方法如下:
B/B0 B
Logit(B/B0)=ln———— =ln————
1-B/B0 B0-B
其中B0是0ng/ml孔的显色值,B是其它浓度的显色值。
待测样品可根据其显色值的logit值从图上查出其所含激素浓度(ng/ml)的自然对数,再经过反对数即可知其激素的浓度(ng/ml)。
求得样品中激素的浓度后,再计算样品中激素的含量(ng/g·fw)。
实验三酶的特异性、温度、pH对酶活性的影响
(一)酶的特异性
【实验原理】
酶具有高度的特异性,一种酶只能催化一种化合物或某一类化合物,如淀粉酶,只能催化淀粉水解,而不能使蔗糖水解。本实验以唾液淀粉酶分别对淀粉及蔗糖的不同作用,来说明酶的特异性。【实验试剂】
1.唾液淀粉酶的制备:用烧杯取蒸馏水或自来水,含于口中,1-2分钟后,吐入50mL烧杯中,备用。2.0.3%NaCl的0.5%淀粉液
3.0.5%蔗糖液
4.Benedict试剂
A、取CuSO417.3g溶于100mL热蒸馏水中,冷后稀释至150mL;
B、取柠檬酸钠173g及Na2CO3(无水)100g,加水600mL加热使之溶解,冷后稀释至850mL;
C、将A液缓慢注入B液中,混匀备用。(可长期保存)。
【实验步骤】
1.取试管两支,一支加入0.5%淀粉液2mL,另一支加入0.5%蔗糖液2mL;
2.于两支试管中各加入制备好的唾液1mL;
3.将两支试管同时放入37℃恒温水浴箱中保温;
4.15分钟后,取出两试管,各加入Benedict试剂1mL;
5.将两试管同时放入沸水中煮沸6分钟;
6.取出两试管,观察记录颜色的变化,并注意有无红色沉淀产生,为什么?
(二)温度对酶活性的影响
【实验原理】
酶促反应同一般化学反应一样都需要在一定的温度下进行,使酶促反应速度最大时的温度称为此酶的最适温度,低于此温度,酶促反应速度缓慢,高于最适温度,酶蛋白变性失活。本实验以入唾液淀粉酶在不同温度下分解淀粉为例,说明温度对酶活性的影响。
【实验试剂】
1.唾液淀粉酶的制备:用烧杯取蒸馏水或自来水,含于口中,1-2分钟后,吐入50mL烧杯中,备用。2.0.3%NaCl的0.5%淀粉液
3.KI-I溶液
【实验步骤】
1.取三支试管并编号,同时各加入5mL0.5%淀粉液及1mL唾液混匀;
2.将管1、管2、管3同时分别放入冰浴,37℃水浴,沸水浴中;
3.15分钟后,取出各管,分别加入碘液数滴,观察并记录各管颜色变化,并解释此现象。
(三)pH对酶活性的影响
【实验原理】
在一定条件下,酶活性最高时的pH值称为最适pH,偏离此pH,酶活性就会有所下降,不同酶的最适pH不同。例如,胃蛋白酶的最适pH为1.5-2.5,胰蛋白酶的最适pH为8等。
本实验以入唾液淀粉酶(最适pH6.8)在不同pH条件下水解淀粉为例,说明pH对酶活性的影响。【实验试剂】
1.唾液淀粉酶的制备:用烧杯取蒸馏水或自来水,含于口中,1-2分钟后,吐入50mL烧杯中,备用。2.pH1.5溶液:取0.2M Na2HPO4·2H2O溶液41.2mL加入0.1M柠檬酸38.8mL,然后用浓HCl调至pH1.5左右;
2.pH6.8溶液:取0.2M Na2HPO4·2H2O溶液61.8mL加入0.1M柠檬酸溶液18.2mL;
3.pH9.8溶液:取0.2M Na2HPO4·2H2O溶液77.8mL加入0.1M柠檬酸溶液2.2mL,然后用0.1N NaOH 调至pH9.8。
【实验步骤】
1.取试管3支并编号,如下表加入各试剂;
2.3支试管同时放入37℃恒温水浴箱内保温;
3.15分钟后,取出3支试管,分别加入碘试剂数滴,每加1滴,注意摇匀,观察并记录颜色变化。
实验四淀粉酶活性的测定
【实验目的】
本实验的目的在于掌握分别测定这两种淀粉酶的方法。
【实验原理】
淀粉酶水解淀粉生成的麦芽糖,可用3,5—二硝基水杨酸试剂测定。由于麦芽糖能将3,5—二硝基水杨酸还原生成3-氨基-5-硝基水杨酸的显色基团,在一定范围内其颜色的深浅与糖的浓度成正比,
故可求出麦芽糖的含量。以麦芽糖的毫克数表示淀粉酶活性的大小。
【实验材料、仪器和试剂】
1.实验材料:萌发的小麦(芽长1厘米左右)
2. 仪器:722分光光度计,天平,离心机,水浴锅,研钵,容量瓶,试管,移液管,三角瓶,漏斗
3. 试剂:1%淀粉溶液,0.4N N a O H,,PH5.6的柠檬酸缓冲液,3,5一二硝基水杨酸,麦芽糖标准液,【操作步骤】
1. 酶液的提取:称取2克萌发的小麦种子(芽长1厘米左右),置研钵中加一克石英砂,磨成匀浆倒入50毫升容量瓶中,用蒸馏水稀释至刻度,摇匀,离心6000转/分钟,取上清液备用。
2. a-及β-淀粉酶总活性的测定:取上述酶液2~6毫升,放入容量瓶中,用蒸馏水稀释至100毫升(稀释程度视酶活性大小而定)。混合均匀后,取4支试管,2支为对照,2支为测定管,各加入稀释之酶液1毫升及1毫升Ph5.6之柠檬酸缓冲液。以下步骤重复a-淀粉酶测定的第(4)及(5)的操作,同样准备糖的测定。
3. 酶促反应液的制备:取4只试管标号,按下表加入试剂: (反应时间要准确!!!)
4. 标准麦芽糖及酶水解液中麦芽糖含量的测定;按下表加入试剂
将上表中试剂加完后,充分混匀,放入沸水浴中准确煮沸5分钟,取出冷却,用蒸馏水稀释至25毫升,用分光光度计在520um波长下进行比色,记录消光值,以消光值为纵坐标,以麦芽糖含量为横坐标绘制标准曲线;将酶水解液测定的消光值在麦芽糖标准曲线中查出麦芽糖含量,然后进行结果计算。【结果与计算】
(a+β)-淀粉酶总活性[麦芽糖(毫克)/鲜重(克)/ 分钟]
= (B-B’)×样品稀释总体积
样品重(克)×C
B一(a+β)-淀粉酶共同水解淀粉生成的麦芽糖量
B一(a+β)-淀粉酶的对照管中麦芽糖量
C一比色时所用样品液毫升数
实验五植物材料中维生素C含量的测定(染料滴定法)
【实验目的】
本实验要求学生掌握染料滴定法测定维生素C的原理和方法
【实验原理】
维生素C在体内是一种较强的还原剂,利用染料2,6-二氯酚靛酚作氧化剂,可将还原态的维生素C氧化成脱氢维生素C,而染料本身还原成无色的衍生物。2,6-二氯酚靛酚在酸性条件下呈红色。在滴定终点之前,滴下的2,6-二氯靛酚立即被还原成无色。当溶液从无色转变成微红色时,即为滴定终点。
【实验材料、仪器和试剂】
1.实验材料:水果或蔬菜
2.仪器:天平,微量滴定管,研钵,容量瓶,移液管,三角瓶,漏斗
3.试剂:(1)2%草酸(2)0.001N2,6-二氯酚靛酚钠溶液
【操作步骤】
1.样品的处理和提取:称取4.0克新鲜样品,置研钵中,加5毫升2%草酸,研成匀浆。通过漏斗将样品提取液转移到50毫升时瓶中。残渣再用2%草酸提取2~3次,提取液及残渣一并转入量瓶中最后以2%草酸定容。摇匀,过滤,滤液待测。
2.空白、样品的测定:吸取滤液10毫升,放入50毫升三角瓶中,立即用2,6-二氯酚靛酚钠溶液滴定到出现明显的粉红色在15秒内不消失为止。记录所用滴定液体积。(再重复二次)3.测定:取2%草酸10毫升,放入别一50毫升三角瓶内,用2,6-二氯酚靛酚钠滴定到终点,记录染料用量。(平行两份)
【结果与计算】
(V1-V2)×K×V
X= ————————————×100
W×V3
式中:
X:100克样品所含维生素C毫克数(毫克/100克)
W:称取样品重(克)
V1:滴定样品所用染料毫升数
V2:滴定空白所用染料毫升数
V3:样品测定时所用滤液毫升数(即10毫升)
V:样品提取液稀释之总体积(即50毫升)
K:1毫升染料液所能氧化维生素C之毫克数,可由标定算出。
实验六血红蛋白凝胶过滤层析
【实验目的】
通过本实验学习凝胶过滤层析的操作技术,掌握凝胶过滤层析的原理及其应用。
【实验原理】
凝胶过滤(gel filtration)是一种利用凝胶按照分子大小分离物质的层析方法,又称分子筛层析(molecularsieve chromatography)或排阻层析(exclusion chromatography)。
1.凝胶介质
目前常用于凝胶过滤的的凝胶类介质主要有4大类,即葡聚糖凝胶,商品名(Sephardex)、琼脂糖凝胶,商品名(Sepharose)和聚丙烯酰胺凝胶,商品名(bio-gel )和琼脂糖-聚丙烯酰胺混合凝胶等层析介质。它们都是不溶于水的高聚物,内部有很微细的多孔网状结构。以Sephardex为例,它是由一定平均分子量的葡聚糖与环氧氯丙烷交联生成的高聚物,网眼的大小由葡聚糖的分子量与环氧氯丙烷的用量来控制。葡聚糖的分子量越大、环氧氯丙烷用量越大,则交联度越大,凝胶的网眼越小。Sephadex有很强的亲水性,在水或缓冲液中能吸水膨胀。交联度越大,网眼越小,吸水量也越少。实际工作中常用每克干胶吸水量(mL)的10倍(G值)表示葡聚糖凝胶的交联度,可根据被分离物质分子的大小和工作目的,选择适合的凝胶型号。
2.凝胶过滤的原理
凝胶过滤层析(凝胶过滤)是把样品加到充满凝胶颗粒的层析柱中,然后选择适当的缓冲液进行洗脱。凝胶本身是一种分子筛,凝胶颗粒有一定得孔径,它可以把待分离样品按分子大小不同进行分离,好像过筛,可以把大颗粒与小颗粒分开。但这种过筛与普通的筛子不同。凝胶过滤的主要装置是填充有凝胶颗粒的层析柱。
将凝胶颗粒在适宜溶剂中浸泡,使其充分吸收膨胀,然后装入层析柱中,加入欲分离的混合物,然后在用同一溶剂洗脱,在洗脱过程中颗粒直径接近和大于凝胶颗粒网孔直径的大分子,不能进入凝胶颗粒中的静止相,只能留在凝胶颗粒之间的流动相中,因此先流出层析柱;反之,小分子则可自由出入凝胶颗粒,因而流速慢以至最后流出柱外,从而使样品中分子大小不同的物质得到分离。
本实验利用凝胶过滤的特点,先向层析柱中加入FeSO2溶液,形成一个还原带,然后加入血红蛋白样品(血红蛋白与高铁氰化钾的混合液)。由于血红蛋白分子量大,在凝胶床中流速快,当其流经还原带时,褐色的高铁血红蛋白立即变为紫红色的亚铁血红蛋白。亚铁血红蛋白继续下移,与缓冲液溶解的O2结合,形成鲜红色的氧合血红蛋白。铁氰化钾是小分子量化合物,呈黄色带远远地落在后边。
这样,就可以形象直观地观察到凝胶过滤的分离效果。
3.凝胶过滤的优点及用途
凝胶过滤的操作条件温和,适于分离不稳定的化合物;凝胶颗粒不带电荷,不与被分离物质发生反应,因而溶质回收率接近100%;而且设备简单、操作方便、分离效果好、重现性强,凝胶柱可反复使用。所以,凝胶过滤常用于测定相对分子质量、脱盐、蛋白质等大分子的分离纯化。
【实验仪器及试剂】
1.仪器:层析柱(ФLcm x 40cm)、真空泵、真空干燥器、抽滤瓶、恒温水浴
2.试剂:
(1)磷酸缓冲液(PH 7.0):称取Na2HPO4·2H2O 2.172g,NaH2PO4·2H2O 1.076g,溶于蒸馏水中,定容至1000mL。
(2)Na2HPO4-EDTA-Na2溶液:称取 2.69g EDTA-Na2,3.56gNa2HPO4·2H2O,加蒸馏水溶解并定容至100mL。
(3)40m mol/L FeSO4溶液:称取FeSO4·7H2O 1.11g溶于100mL水中(用时现配)。
(4)Sephadex G-2 5
(5)固体铁氰化钾〔K3Fe(CN)6)
(6)抗凝血
【实验步骤】
1.凝胶溶胀:取10g SePhadex G-25,加200mL蒸馏水充分溶胀(在室温下约需6小时或在沸水浴中溶胀5小时)。待凝胶溶胀平衡后,用倾泻法除去细小颗粒,再加入与凝胶等体积的pH 7.0磷酸缓冲液,在真空干燥器中减压除气,准备装柱。
2.装柱:将层析柱垂直固定,旋紧柱下端的螺旋夹,在柱内加入少量磷酸缓冲液或直接把处理好的凝胶连同适当体积的缓冲液用玻棒搅匀,然后边搅拌边倒入层析柱中,同时开启螺旋夹,控制一定流速。最好连续装完凝胶,若分次装入,需用玻棒轻轻搅动柱床上层凝胶,以免出现界面影响分离效果。装柱后形成的凝胶床至少长30cm,使胶床表面保持2-3cm液层。
注意:整个操作过程中凝胶必须处于溶液中,不得暴露于空气,否则将出现气泡和断层,应当重新装住。
3.平衡:继续用磷酸缓冲液洗脱,调整缓冲液流速,平衡20-30分钟。
4.样品制备:
(1)取1m鸡的抗凝血放入小烧杯中,加5mL pH7.0的磷酸缓冲液,再加入27.5 mg K3Fe(CN)6固体,用玻棒搅动使其溶解,即得褐色的高铁血红蛋白溶液。
(2)吸取lmL FeSO4溶液和lmL EDTA-Na2-NaHPO4溶液,于小烧杯中混匀。(注意:还原剂混合液要新鲜配制,尽可能缩短其与空气接触的时间)。
5.上样:旋开层析柱上端旋扭,待胶床上部的缓冲液几乎全部进入凝胶(即缓冲液液面与胶床平面相切)时,立即加入0.4mL上述混合液,待其进入胶床表面仅留约lmm液层时,加入0.5mL 缓冲液,再当胶床表面仅留约lmm液层时,吸取0.5mL血红蛋白样品溶液,小心地注入层析柱胶床面中央,注意切勿冲动胶床。慢慢打开螺旋夹,待大部分样品进入胶床、床面上仅有lmm
液层时,用乳头滴管加入少量缓冲液,使剩余样品进入胶床,然后用液管小心加入3~5cm高的洗脱缓冲液。
6.洗脱:继续用磷酸缓冲液洗脱,调整流速,使上下流速同步保持每分钟约6滴。
7.凝胶的回收:实验完毕用洗脱液把柱内有色物质洗脱干净,保留凝胶柱重复使用或回收凝胶。
【实验结果】
(1)观察并记录实验现象。
实验七过氧化物酶同工酶聚丙烯酰胺凝胶电泳
【实验目的】
(1)使学生掌握聚丙烯酸徽凝胶垂直板电泳的原理和操作技术;学会从植物材料(小麦幼苗)
分离过氧化物酶同工酶。(2)根据酶的生物化学反应,通过染色方法显示出酶的不同区带,签定
小麦幼苗过氧化物酶同功酶。
【实验原理】
同工酶是催化同一种化学反应,但其酶蛋白本身的分子结构组成却有所不同的一组酶。同工
酸与生物的遗传、生长发育、代谢调节及抗性等都有一定关系,测定同工酶在理论上和实践上都
具有重要的意义。本实验测定的过氧化物酶是植物体内普遍存在的、活性较高的一种酶,它与植
物的光合、呼吸作用以及生长素的氧化等有关;在植物生长发育过程中它的活性不断发生变化。
因此,测定过氧化物酶的生物活性或其同工酶可以了解某一时期植物体内代谢的变化。
1.电泳
带电粒子在电场中向与其自身带相反电荷的电极移动,这种现象称为电泳。多年来,电泳作
为一项有效的分析、分离和制备技术发展很快,在生产、科研和医疗工作中得到了广泛应用。利
用电泳技术分离、分析蛋白质、酶、核酸等生物大分子,有较高的分利率,目前已成为生物科学
研究中必不可少的手段之一。
2.电泳具有的特点
①凡是带电物质均可应用某一电泳技术进行分离,并可进行定性或定量分析②样品量极少
③设备简单④操作简便⑤分辨率高⑥便于观察、记录和保存。
3.聚丙烯酰胺凝胶的合成及特点
聚丙烯酰胺凝胶电泳(polyacrylamid gel electrophoresis, PACE)是以聚丙烯酸胺凝胶作为载体的一种区带电泳。这种凝胶是由丙烯酰胺单体(Acrylamide,Acr)和交联剂N,Nˊ_甲叉双丙烯酰胺N,Nˊ一Methylene bisacrylamide,Bis),在引发剂和催化剂的作用下聚合而成的。
化学聚合的引发剂是过硫酸铵(Ap)在形成中提供自由基,通过自由基传递,使丙烯酰胺成为自由基,发动聚合反应。催化剂是四甲基乙二胺(Tetramethyl ethylenediamine, TEMED)则可加快引发剂释放自由基的速度,具体反应是过硫酸铵在水溶液中形成一个过硫酸自由基,此自由基可以激活TEMED,TEMED作为一个电子载体提供一个未配对电子将丙烯酰胺单体转换化成丙烯酰胺自由基经反应多聚物聚合成网状结构的凝胶状,其网状孔径大小由聚合条件及单体浓度决定。
光聚合以核黄素(即V B2)作为引发剂,需要强光照射反应液和有痕量氧存在下进行。核黄素经光
解形成无色基,无色基被氧再氧化成自由基,从而引起聚合作用。
聚丙烯酰胺凝胶的质量主要由凝胶浓度和交联度决定。每100毫升凝胶溶液中含有的单体(Acr)和交联剂(Bis)总克数称为凝胶浓度,用T%表示。凝胶溶液中,交联剂(Bis)占单体(Ac r)和交联剂(Bis)总量的百分数称为交联度,用C%表示。改变凝胶浓度(T%)和交联度(C%),可获得不同密度、粘度、弹性、机械强度和孔径大小的凝胶,以便适应各种样品的分离。
4.聚丙烯酸胺凝胶电泳的装置
电泳仪由两部分组成,即稳压稳流直流电源和缓冲液贮存系统(电泳槽)。板状电泳槽是目
前使用最多的电泳槽,凝胶在两块平行的玻璃板中间,因而称板状电泳(slabelectrophoresis)。
板状电泳最大的优点是包括标准相对分子质量蛋白质在内的多个样品可以在同一块凝胶上在相同
的条件下进行电泳,便于利用各种鉴定方法,直接比较各样品的区带,保证结果的准确可靠;还
可以进行双向电泳。另外,板状电泳易散热,其结果便于照相和制干胶。板状电泳槽有垂直板和
水平板电泳槽。
【实验材料、仪器及试剂】
1.材料:小麦幼苗
2.仪器:电泳仪一套(稳压电源及圆盘电泳槽)、高速冷冻离心机(10000r)、电冰箱、量筒、烧杯、注射器、注射针头、玻璃板2块、样品瓶、染色槽、移液管、离心管、试管架、玻璃棒等。
3.试剂:琼脂糖、HCl 、TEMED 、Tris 、Acr 、Bis、过硫酸铵、核黄素、甘氨酸、蔗糖溴酚蓝、联苯胺(贮液配制见附表)。
【实验步骤】
1.凝胶的制备
(1)将贮液由冰箱取出,待于室温平衡后再配制工作表液。
(2)安装玻璃板
(3)按下表比例配制分离胶:
表10-2配制分离胶比例
(4)制板:选取洗净烘干的玻璃板垂直放入制胶玻璃架上。玻璃板底部封闭,封闭的方法根据具体条件而定。
(5)灌分离胶:1、2号液和重蒸水放一烧杯,3号液放另一烧杯。然后小心混合两杯溶液,用长滴管取混合的溶液。沿板壁加入胶液距矮玻璃板上端2cm再加水至矮玻璃板。刚加过水可看出界面,后逐渐消失,等在看出界面时,表明分离胶已聚合。再静置20-30分钟,倒出水层,(正常情况10min 开始聚合,应控制在30min~1h内聚合完成)。
(6)浓缩胶的制备:按下表比例配制浓缩胶。
表10-3配制浓缩胶比例
(7)灌浓缩胶:将4、5、和蔗糖放在一烧杯,核黄素单放一烧杯。灌胶高度约2厘米,再加上梳子,然后置日光灯下聚合20分钟,待浓缩胶变成乳白色,聚合即告完成,去掉梳子。
2.样品的制备
称取小麦幼苗茎部0.5g,放入研钵内,加pH8.0提取液1毫升,于冰水浴中研成匀浆,然后以2毫升提取液分几次洗入离心管,在高速离心机上以8000r 离心10分钟,倒出上清液,以等量40%蔗糖及1滴溴酚蓝混合,留作点样用。
3.点样、装槽
(1)点样:加样前先把凝胶板旁边的密封胶条除去,请勿将凝胶板拉坏或产生气泡。用微量注射器按顺序从凝胶板顶部加样,每个凝胶孔加15~20ul样品,稀溶液最多可加150~200ul。加样时,微量注射器的针头伸入凝胶孔的内部,但针头不要碰到胶面,缓缓加入,因样品比重较大,因此样品液自动沉降在胶面上平铺成一层。
(2)装槽:装内、外槽电极缓冲液,将稀释10倍的电极缓冲液约500 mL放入内、外槽。
(3)电泳:在槽的一端缓慢加入电极缓冲液,不要把凝胶孔的样品冲掉。槽内的空隙完全充满电极缓冲液,不要产生气泡。按正负极接通电源,打开电泳仪(仔细观察正负极的变化)。对于垂直柱型电泳,电流控制在1~2mA/管,电泳2~3min后再升到3~5mA/管,太高的电流强度会造成产热量
大,使分离失效。如果高温对样品不利,可降低电流,延长时间,或进行有效的冷却。对于垂直板型电泳,一般是,样品进胶前电流控制在15~20mA,大约15~20min;样品进入凝胶以后,再将电流调至40~50mA,保持电流强度不变。待指示染料迁移至下沿约0.5cm处停止电泳,需2---3 h。
(4)剥胶和固定:将玻璃板放入装满水的染色槽内,用5mL注射器装满水,安上10cm细针头,沿板壁内侧插入,边前进,边注水;将短板玻璃撬开,再用水缓慢冲击凝胶,直到凝胶从玻璃板上脱离。
(5)固定:放到盛有pH4.7的乙酸缓冲液的指形管中浸泡10min。
加入染色液。染色2--4h以上或过夜。
(6)染色及脱色:倒去乙酸冲液,加联苯胺淹没整个胶柱,于室温下显色20min,即得到过氧化物酶同工酶的红褐色酶谱。倒掉染色液,重新加入7%的乙酸溶液,于日光灯下观察记录酶谱,绘图或照相。
生物化学实验课教学大纲
生物化学实验课教学大纲 课程编码: 学时: 学分: 可成熟型:独立设课 开课单位:生命科学学院 先修课程:动物学、植物学、无机及分析化学、有机化学等 一、实验性质 生物化学专业实验是配合生物化学理论教学而设置的一门基础课程,分为基础实验、综合实验与创新实验。实验按照一学期进行设置,主要实验设置为生化基础实验和部分创新、综合实验。基础实验可使学生更好地掌握基本理论和基本实验技术,一般实验在学时内完成;综合实验要求学生运用所学知识解决实际问题,培养学生分析问题解决问题的能力;创新实验由学生自己动手查阅资料,拟定具体实验方案,提倡学生多思多问,有利于学生创新意识的培养,加强了收集信息、分析问题解决问题的能力。实验室全天开放。 二、实验教学目的和要求 生物化学专业实验是配合生物化学理论教学而设置的一门基础课程,通过实验课的教学,力求使学生能够对生物化学的基本理论和概念有更加深刻的认识,激发学生对探索生物化学规律的浓厚兴趣。更为重要的是,在实验过程中培养学生观察问题、分析问题和解决问题的能力,锻炼学生的实际操作能力。 三、实验项目名称和学时分配
四、实验项目具体内容 生物化学实验技术 实验项目一:皂化价的测定 实验目的:使用酸碱滴定法通过脂肪皂化价来推断分子量。 主要仪器:电子天平、水浴锅、冷凝管、酸碱滴定管。 教学方式:讲授、操作。 预习要求:预习滴定分析法的基本原理,熟悉实验操作基本流程。 实验项目二:凯氏定氮法测定蛋白质含量 实验目的:掌握使用基本滴定原理和方法测定蛋白质含量和凯氏定氮仪的使用。 主要仪器:凯氏定氮仪、电子天平、通风橱、电炉、酸碱滴定管。
教学方式:讲授、操作。 预习要求:预习“滴定分析的计算”章节内容,熟悉凯氏定氮法的基本原理。 实验项目三:的含量测定 实验目的:用滴定法测定并掌握水果和蔬菜中维生素的测定方法。 主要仪器:电子天平、研钵、移液管、酸碱滴定管。 教学方式:讲授、操作。 预习要求:预习“滴定分析的计算”和“标准溶液”章节内容。 实验项目四:蒽酮比色法定糖 实验目的:学习分光光度计的原理合使用方法。掌握总糖定量测定的操作方法。 主要仪器:可见光分光光度计、电子天平、水浴锅。 教学方式:讲授、操作。 预习要求:预习分光光度法基本原理,了解分光光度计的基本构造。 实验项目五:血清总胆固醇的测定 实验目的:学习用分光光度法测定血清中总胆固醇(脂肪)含量及标准曲线的制作。 主要仪器:可见光分光光度计、电子天平、水浴锅。 教学方式:讲授、操作。 预习要求:预习分光光度法基本原理及其定量和定性的基本方法。 实验项目六:考马斯亮兰染色法测蛋白质 实验目的:学习利用染色方法提高蛋白质消光系数,以提高分光光度法检测灵敏度。 主要仪器:可见光分光光度计、电子天平、水浴锅。 教学方式:讲授、操作。 预习要求:预习分光光度法基本原理及其定量和定性的基本方法。 实验项目七:紫外吸收法测定蛋白质核酸含量 实验目的:学习利用紫外分光光度法对生物大分子进行定量分析度。 主要仪器:紫外可见分光光度计、电子天平。 教学方式:讲授、操作。 预习要求:预习紫外分光光度计相关内容及其定量和定性的基本方法。 实验项目八:血清丙氨酸氨基移换酶测定 实验目的:学习利用比色法测定酶的活性。 主要仪器:分光光度计、冰箱、电子天平、水浴锅。 教学方式:讲授、操作。 预习要求:预习“酶活力及其动力学数据的测定”章节。 实验项目九:大蒜酶的提取及酶活力和含量测定
基础生物化学实验.
生物化学实验 实验基本原理 1 有效数字计算(结合电子天平的应用等) 加减法: 进行数字加减时,最后结果所保留的小数点后的位数应与参与运算的各数中小数点后位数最少者相同,其尾数“四舍五入”。如:0.124+1.2345+12.34=13.6979,应取13.70。 乘除法: 进行数字乘除时,最后结果的有效数字应与参与运算的各数中有效数字位数最少者为准,而与小数点的位数无关,其尾数“四舍五入”。如:1.23×0.12=0.1476,应取0.15。 2 误差分析 误差为实验分析的测定值与真实值之间的差值。误差越小,测定值越准确,即准确度越高。误差可用绝对误差和相对误差表示。 绝对误差= 测定值- 真实值 相对误差= 绝对误差÷真实值×100% 一般用相对误差表示结果的准确度,但因真实值是并不知道的,因此实际工作中无法求出分析的准确度,只得用精确度来评价分析的结果。 3 偏差分析(结合“可溶性蛋白或赖氨酸实验”要求掌握) 精确度表示在相同条件下,进行多次实验的测定值相近的程度。一般用偏差来衡量分析结果的精确度。偏差也有绝对偏差和相对偏差两种表示方法。 绝对偏差= 单次测定值- 算术平均值(不计正负号) 相对偏差= 绝对偏差÷算术平均值×100%
例如:分析某一材料糖含量,共重复测定5次,其结果分别为:16.1%,15.8%,16.3%,16.2%,15.6%,用来表示精确度的偏差可计算如下: 分析结果算术平均值个别测定的绝对偏差(不计正负) 16.1% 0.1% 15.8% 0.2% 16.3% 16.0% 0.3% 16.2% 0.2% 15.6% 0.4% 平均绝对偏差=(0.1%+0.2%+0.3%+0.2%+0.4%)÷5 = 0.2% 平均相对偏差= 0.2÷16.0×100% = 1.25% 在实验中,有时只做两次平行测定,这时就应用下式表达结果的精确度: 两次分析结果的差值÷平均值×100% 4 实验结果的表述:实验结果可用列表法(“影响酶作用的因素”常用)和作图法(综合实验用)表示。 第1章分光光度技术 分光光度技术是光学(光谱)分析技术的一种,它是利用物质的特征吸收光谱来对不同物质进行定性和定量分析的一项技术。我们将重点介绍紫外光-可见光分光光度法。 一、紫外光-可见光分光光度法的基本原理 1、讨论的波长范围:200~400nm的紫外光区和400~760nm的可见光区。 人肉眼可见的光线称可见光,波长范围在400~760nm;
生物化学实验报告
生物化学实验报告 动物营养研究所 树润 2015.10.12 猪血中超氧化物歧化酶(SOD)的分离纯化及活性测定一.实验目地 1.通过实验了解活性物质的分离提取。 2.了解超氧化物歧化酶的基本功能与应用。 二.实验原理 超氧化物歧化酶是一种酸性蛋白,是唯一以自由基为底物 的酶,具有清除自由基的功能酶,在酶分子上共价连接金属辅 基,因此它对热、PH、以及某些理化性质表现出异常的稳定性。 该酶首次从牛红细胞中分离得到,是一种蓝色含铜蛋白,之后, 研究发现该蛋白酶具有催化氧发生歧化反应的能力,因此将其 命名为超氧化物歧化酶1-2。超氧化物歧化酶是一种能专一地清 除超氧离子自由基(O2-)的金属酶,它具有抗衰老、抗辐射、 抗炎抗癌等作用,因而在医药(如关节炎、红斑狼疮等疾病的 治疗3)、化妆品(有防晒抗炎效果4)、食品工业(SOD灵芝菌5 等)等方面具有了广泛的应用前景。 超氧化物歧化酶是广泛存在于生物体的一种金属酶, 可催化超氧阴离子自由基(O2-)与H+发生歧化反应, 生成H2O2和 O2。SOD催化下述反应:2H++2O2-→H2O2+O2。
超氧化物歧化酶按照它所含金属离子的不同,可分为 Cu-Zn-SOD、Mn-SOD、Fe-SOD等三种。Cu-Zn-SOD为二聚体,呈 蓝绿色;Mn-SOD呈紫红色;Fe-SOD呈黄褐色。 SOD提取、纯化制备方法各异, 常用方法有经典的溶剂沉淀法、盐析法、超滤法和层析法等6-7。本实验采用有机溶剂沉淀法8以新鲜猪血为原料,从中提取SOD并进行纯化。酶活力测定可用以下方法:邻苯三酚自氧化法9、黄嘌呤氧化酶法、NBT光还原法、化学发光法、肾上腺素自氧化法、亚硝酸法等。 该实验SOD酶活性采用邻苯三酚自氧化法测定,酶活性单 位定义为:每毫升反应液中,每分钟抑制邻苯三酚自氧化速率 达50%的酶量定义为一个酶单位。 样品中蛋白质含量用考马斯亮蓝G-250法测定。考马斯亮 蓝G-250在游离状态下呈红色,与蛋白质结合呈现蓝色。在一 定围,溶液在595nm波长下的光密度与蛋白质含量成正比,可 用比色法测定,测定围1-1000μg。 三.实验试剂与器材 1.实验试剂 ACD抗凝剂、0.9%Nacl、丙酮、95%乙醇、氯仿、考马斯 亮蓝G-250、50mmol/L pH8.3磷酸缓冲液、10mmol/L EDTA钠盐 溶液、3mmol/L邻苯三酚溶液等 2.实验器材
【华南理工大学2012年考研专业课真题】生物化学与分子生物学2012
878 华南理工大学 2012年攻读硕士学位研究生入学考试试卷(请在答题纸上做答,试卷上做答无效,试后本卷必须与答题纸一同交回) 科目名称:生物化学与分子生物学 适用专业:微生物学;生物化学与分子生物学;生物医学工程;生物医学工程(专硕) 本卷满分:150分共页一、是非题(每题2分,答对得2分,答错倒扣2分,不答得0分,共20分) 1.核苷酸在水溶液中,其碱基都是顺式的构象。 2.蛋白质对波长280nm的光有最大的吸光值,而核酸对波长260nm的光有最大的 吸光值。 3.在低盐浓度下,蛋白质的溶解度随着盐浓度的升高而增大。 4.转录的过程中,以负链的DNA为模板转录成mRNA。 5.DNA聚合酶I在DNA复制过程中以5’‐3’的方向合成新的DNA链;翻译的过程中 核糖体沿着mRNA 3’‐5’的方向前进;蛋白质合成方向是N端到C端。 6.解旋酶(helicase)是拓扑异构酶的一种。 7.真核生物的所有mRNA都含有poly(A)结构 8.ATP、NAD、RNA、乙酰CoA都含有糖残基 9.在PH7.0的缓冲液中,二肽Ala-Glu向电场的阴极泳动 10.原核细胞的tRNA和rRNA分子受到广泛加工,而mRNA则很少进行修饰 二、问答题(130分) 1.糖是细胞能量的主要来源,也是构成细胞的重要成分(共24分) 1)请写出糖酵解和三羧酸循环的过程(12分) 2)cAMP、ATP、乙酰辅酶A、NADH对以上过程的调节起什么作用(4分) 3)细菌中的LPS和肽聚糖的结构是什么,起什么作用(4分) 4)糖蛋白是膜蛋白的重要组成,参与细胞信号传导等功能。糖蛋白中的糖与蛋白的连接方式是怎样的?(4分) 2.蛋白质是生物呈现不同性状的主要因素。(28分) 1)阐述蛋白质的一、二、三、四级结构,并阐述维系这些结构的主要相互作用力。 (12分) 2)阐述你知道的蛋白纯化方法及原理(8分) 3)如何预测或者检测蛋白质的高级结构(8分)
动物生物化学实验教学改革的研究
动物生物化学实验教学改革的研究 摘要:依据高校教育改革的深入和创新素质教育的全面推进,针对动物生物化学实验教学实际情况,进行了改革探索研究。主要通过大学生研究训练计划(SRP)项目和毕业论文于实验教学中的实施,使之互相影响并促进动物生物化学实验教学改革,其旨是发挥实验教学的作用,提高学生创新和实践能力,为国家培养合格人才。 关键词:动物生物化学实验教学 SRP 毕业论文改革 《动物生物化学》实验课程是动物医学和动物科学专业的重要基础课,既具有基础性,又具有前沿性,是研究生命活动变化规律的学科,对验证和巩固动物生物化学理论知识,掌握动物机体内发生的生物化学机制并且运用动物生物化学实验原理和方法来诊断、治疗和预防疾病等都有非常重要的作用,目前的动物生物化学实验教学模式只是注重理论课程内容的复证,同时也在响应国家要求培养适应创新型高水平创新人才的号召,进行动物生物化学实验的优化组合,更新替换陈旧实验内容,对本科生开放一些实验室,虽然起到了一定的作用,但还是不能满足于学生主动性和创造性的全面发挥。因此,本实验室针对动物生物化学实验课程进行
了更深层次的改革探索,首先将动物生物化学实验教学从以前的理论教学中分离出来成为一门独立的32学时的实验课程,对以前的实验项目进行大幅度删减,替换一些重复的和与学生创新性结合不紧密的实验项目,增加了适应学生创新和实践思维发展的综合设计性的大实验,同时把大学生训练计划(SRP)项目和学生毕业论文纳入到实验教学中,使两者相互促进提高并融为一体,影响且促进实验教学进行相应改革,一方面可以满足理论课程需求并且使之提高,另一方面也提高了低年级农科类本科学生的专业兴趣及创新和动手能力,对学生今后走向工作岗位,胜任相关工作与独立开展科学研究都具有非常重要的作用。基于此,本文就动物生物化学实验课程的教学改革实践进行了探索性的分析。 一、加强大学生训练计划(SRP)项目于实验课中实施,促进实验教学改革 为提高学生创新和实践的能力,使SRP项目融入实验教学课堂,首先使大学生实践训练计划(SRP)项目的内容与实验课进行有机结合,通过SRP项目的实施推动动物生物化学实验课程教学发生相应调整改革,大学生训练计划(SRP)项目的启动实施要求动物生物化学实验课程进行相应的改革从以下几方面陈述。 首先,改变以前课前教师为主体,准备好实验所需的试剂、器材和实验所需要的设备,然后在学生动手做实验前,
基础生化实验-蛋白质纯化
蛋白质纯化
一、目的: 利用金属亲和性管柱(metal affinity column)来大量纯化带有affinity tag的基因重组蛋白。 二、原理: 由于六个Histidine 所组成的His Tag (metal affinity tag)可与Ni2+ bind,所以利用基因重组技术在表现的蛋白质加上His Tag,再以金属亲和性管柱 (Ni-NTA) (此His- tag序列可与带二价正电的阳离子相螯和)及liquid chromatography来大量纯化蛋白质。 三、试剂与器材: 1.loading(binding) buffer (10mM imidazole,0.3M NaCl,50Mm Tris-HCl Ph7) ?细菌回溶成为蛋白质的载体以保持活性 2.wash buffer (20mM imidazole,0.3M NaCl,50Mm Tris-HCl,Ph7) 3.elution buffer (20mM EDTA,0.3M NaCl,50Mm Tris-HCl,Ph7) 上课补充: ?蛋白质很脆弱,需要在特殊的buffer里。
四、仪器与设备: FPLC(速液相色谱仪) 五、步骤: 1.将管柱架在铁架上,把亲和性胶体悬浮装填于管柱内。 2.以2~3倍CV loading buffer清洗管柱后,注入蛋白质样本。 3.以wash buffer梳洗,2到3倍column体积。 4.用wash buffer和elution buffer进行线性梳洗,并收集流出液体,以 FPLC UV monitor上的OD280数据读取样品流出与否,并观察冲离液之 曲 线图。 上课补充: ?胞内型分泌需要用超音波破菌,因为会放热所以要放在冰中使用。 ?线性梳洗为加入elution buffer会有颜色变化会把镍离子跟imidazole冲 洗掉,剩下胶体溶液。 ?其中imidazole和Histidine类似也会和镍离子结合所以会竞争,可拿来 洗涤蛋白质。(可详见问题一及补充资料2) 六、问题:
生物化学实验内容
《生物化学实验》内容 课程类型:制药工程专业必修 实验总学时:32课时 开设实验项目数:8个 适用对象:2017制药工程1、2班 实验教师:段志芳 一、实验目标及基本要求 生物化学实验是一门独立的实验课程,培养学生生物化学实验基本操作技能、实验数据处理能力、分析问题解决问题的能力和实事求是的科学态度。 二、实验内容
三、成绩 包括实验时的表现(实验出勤、安全卫生、操作对错、损坏器皿情况等,占50%)及实验报告的完成情况和完成质量(占50%),每个实验按总分为100分为满分进行打分,共8个实验,总评取平均值。 四、要求 (1)实验过程中同组人可以配合进行; (2)实验报告独立完成,同组人数据相同,不得抄袭他组数据;(3)实验过程若出现失误应向老师汇报后再进行重做; (4)对实验结果进行简单的分析. 实验一植物组织中可溶性总糖的提取 一、实验目的 1. 掌握可溶性总糖的概念和性质。 2. 掌握可溶性总糖提取的基本原理。
3.掌握溶解、过滤、洗涤、定容等基本操作技术。 二、实验原理 可溶性糖是指易溶于水的糖,包括绝大部分的单糖、寡糖,常见的有葡萄糖、果糖、麦芽糖和蔗糖等。它们在植物体内可以充当能量的储存、转移的介质、结构物质和功能分子如糖蛋白的配基。总糖主要指具有还原性的葡萄糖、果糖、戊糖、乳糖和在测定条件下能水解为还原性的单糖的蔗糖、麦芽糖以及可能部分水解的淀粉。可溶性总糖提取方法包括:热水提取法、酶提取法、超声波提取法等。其溶于热水,不溶于60%以上乙醇,所以用热水提取、乙醇沉淀除去部分醇溶性杂质。本实验利用可溶性糖溶于水的特性,将植物磨碎,用热水将组织中的可溶性糖提取出来,结合实验二得到总糖浓度,已知溶液体积和原料重量,可以求出总糖含量。 三、实验用品 1.仪器设备:电子天平(精确到0.0g,配称量纸若干);可控温电 加热板或电炉或电热套或水浴锅均可。可共用。 2.玻璃器皿:研钵1套;100mL锥形瓶1个;25mL量筒1个;玻 璃棒1根;100mL烧杯2个;胶头滴管1支;过滤装置1套(铁架台1台+铁圈1个+玻璃漏斗1个+100mL容量瓶1个+洗瓶1个); 不锈钢刮勺1个;剪刀1把。此部分为每组所用,集中到小框里,放置各实验台上。 3.药品试剂:新鲜植物叶片;蒸馏水。 4.其他:9cm滤纸若干(与玻璃漏斗配套);纸巾若干;标签纸若
638生物化学2012
青岛大学2012年硕士研究生入学考试试题 科目代码: 638 科目名称:生物化学(共 6 页) 请考生写明题号,将答案全部答在答题纸上,答在试卷上无效 一、单项选择题(36分,每题1分) 1、测得生物样品每克含氮0.04克,每100克该样品蛋白质含量应是: A. 6.25克 B. 12.5克 C. 25克 D. 2.5克 E. 125克 2、在280m波长附近具有最大光吸收峰的氨基酸是: A.丝氨酸B.谷氨酸C.蛋氨酸D.色氨酸E.精氨酸3、稳定蛋白质分子中α-螺旋和β-折叠的化学键是: A.肽键B.二硫键C.盐键D.氢键E.疏水作用4、通常不存在RNA中,也不存在DNA中的碱基是: A.腺嘌呤B.黄嘌呤C.鸟嘌呤D.胸腺嘧啶E.尿嘧啶5、下列关于DNA双螺旋结构模型的叙述正确的是: A.由两条完全相同的多核苷酸链绕同一中心轴盘旋成双螺旋 B.一条链是左手螺旋,另一条链为右手螺旋 C.A+G与C+T的比值为1 D.A+T与G+C的比值为1 E.两条链的碱基间以共价键相连 6、下列几种DNA分子的碱基组成比例各不相同,哪一种DNA的解链温 度(Tm)最低。 A. DNA中A+T含量占15% B. DNA中G+C含量占70% C. DNA中G+C含量占40% D. DNA中A+T含量占60% E. DNA中G+C含量占25% 7、酶促反应中决定酶特异性的是: A.作用物的类别 B.酶蛋白 C.辅基或辅酶 D.催化基团 E.金属离子 8、丙二酸对琥珀酸脱氢酶的抑制效应是: A. Vmax降低,Km不变 B. Vmax降低,Km降低 C. Vmax不变,Km增加 D. Vmax不变,Km降低 E. Vmax降低,Km增加 9、酶的活性中心是指:
《生物化学实验》课程教学大纲
《生物化学实验》课程教学大纲 【课程编号】 【英文名称】Experiments of Biochemistry 【课程学时】48 【适用专业】生物技术、生物工程 一、本实验课程的教学目的和课程性质 生物化学实验是生物技术和生物工程专业学生的必修专业基础课,是一门理论性和实用性很强的课程。本实验课程的教学目的是通过对实验室基本操作规范、大分子物质性质鉴定、比色测定、大分子物质的分离和提纯、电泳分离等方面的理论和实践教学进一步加深和巩固学生对生物化学理论知识的学习,培养学生的实验技能,有效地提高学生的动手能力,为今后的科研工作打下基础。 二、本实验课程的基本要求 通过生物化学实验的教学,使学生达到如下要求: 1.在实验过程中将生物化学的理论知识进一步验证、巩固、扩充和提高。 2.学会正确使用有关生化仪器,了解和掌握生化实验室的基本操作规范。 3.培养学生在进行生物学实验时的实验过程、结果分析、实验设计和动手实验的能力,培养和提高学生的实验操作技能。 4.掌握包括蛋白质、核酸、酶、维生素、脂类和代谢各方面实验方法和技能,掌握离心、滴定、比色、层析、电泳等各种生物化学实验技术。 5.培养学生学习兴趣、重视实践、探索进取、吃苦耐劳、团结合作的精神。。 6.培养科研能力和科学素质,使学生具有严格的科学学风和发现、分析、解决问题的初步能力。 三、本实验课程与其它课程的关系 本实验课程上承《无机化学实验》、《分析化学实验》和《有机化学实验》,下续《植物生理学实验》、《遗传学实验》、《分子生物学实验》等课程,因此生物化学实验的学习是学生进行其他生物学实验的前奏,是今后开展生物学方面实验和研究的基础。 四、实验课程理论教学内容安排(共安排6学时) 第一部分生物化学实验室的基本操作规范(1.0学时) 【目的要求】 1、了解实验的生物学性质和化学性质。 2、了解实验室的基本操作规范和实验误差的控制。 3、了解生物样品的制备方法。 【教学内容】了解生物化学实验的基本操作规范及准确测定的方法。 第一节实验室基本操作规范 第二节准确测量的方法 第三节普通生物样品的制备方法
生化实验基本原理及技术
生物化學實習 1 緒論 (一) 原理 1. 光依據其波長來分類: (1) 200nm~400nm 短波屬於紫外光 (2) 400nm~700nm 可見光波長 (3) 700nm~900nm 長波屬於近紅外光 2. 光通過溶液時,特定波長的光被吸收,眼睛察覺到的是沒有被吸收的波長。 核黃素會吸收450nm 的光,紅光與黃光會通過溶液而被肉眼所見。
第一單元 生化實驗基本原理及技術 2 圖1-1光譜儀 光譜儀可用來鑑定及定量純或不純的溶液中所含有的特定化合物,主要原理是基於兩個物理定律:1.柏朗定律;2.比爾定律 。 1. 柏朗定律:每單位厚度溶液其吸收入射光的比率為定值,被溶液吸收的入射光量與入射光強度無關。被每單位厚度溶液吸收的入射光比率為定值,每一單位厚度溶液若吸收10%的光,則光經過每一單位厚度溶液時,其強度即減少10%。 I =I 0 ? e -αι I :穿透光強度 I 0:入射光強度 α :溶液吸光係數 ι:光路徑長度 柏朗定律中以對數為底轉換公式,將吸光係數α轉換成比例常數K → log 10 I 0 / I =K ι log 10 I 0 / I = 吸光值(absorbance ;A) 或光密度值(optical density ; OD)
生物化學實習 3 2. 比爾定律:光經過吸光物質所產生的吸光值,與溶液中每單位面積所含的吸光物質數目成比例。 比爾定律描述比例常數K 與待測吸光溶液中溶質的濃度有關。 K =εc ε:消光指數 c :吸光物質濃度 I = I 0? 10-εc ι log 10 I 0 / I = A =log 1010εc ι= εc ι 當ι(光路徑長度)=1 cm 時 log 10 I 0 / I = A =log 1010εc = εc 特定溶質在特定波長下,消光係數ε為一常數。因此,當吸光物質的濃度變成兩倍,於相同的光路徑下,被吸收的光量也會變成兩倍。 圖1-2 22 μM 溶於0.1M 磷酸鈉,pH 7.06,1公分 光路徑(light path)的條件下測定 波長 吸 光 值
生物化学第二版答案
生物化学第二版答案
生物化学第二版答案 【篇一:医学生物化学答案】 【篇二:生物化学2010-2011-第二学期-a-答案】 ass=txt>第1 页(共12 页) 年级:09 课程号:1403010140 冈崎片段 dna复制过程中,2条新生链都只能从5’端向3’端延伸,前导链连续合成,滞后链分段合成,这些分段合成的新生dna片段称冈崎片段,细菌冈崎片段长度1000-2000核苷酸,真核生物冈崎片段长度 100-200核苷酸。 1.(√)蛋白质在低于其等电点的溶液环境中解离为带有净正电荷的状态。 3.(√)凯氏定氮法都可以用来测定氨基酸、肽和蛋白质等物质的含量,但是双缩 脲试剂法不能测定氨基酸含量。 去氨基。 机体代谢产生的二氧化碳和氨。 6.(√)酶的变构调节是指酶分子的空间结构受到效应分子的影响而发生一定改变, 从而使酶的活性增强或减弱,其一级结构不受影响。
a.精氨酸b.组氨酸c.酪氨酸d.亮氨酸 3.( b )利用蛋白质分子量的差异进行分离的方法是: a.等电点沉淀b.凝胶过滤层析 c.离子交换层析d.吸附层析 4.( b )在鸟氨酸循环中,中间代谢物中会出现的氨基酸有:a.脯氨酸和苏氨酸b.瓜氨酸和精氨酸 c.酪氨酸和缬氨酸d.鸟氨酸和赖氨酸 5.( d )下列过程不能脱去氨基的是: a.联合脱氨基作用b.氧化脱氨基作用 c.嘌呤核甘酸循环d.转氨基作用 第4 页(共12 页) ―― ―― ― ― ― ― ― :名― 姓― ― ―
线 ― ― ― ――:号―学― ― ― ― ― ― 订 ― ― ― ― ― :业――专― ―
生物化学试验教学大纲-湖北大学生命科学学院
湖北大学 生物化学实验 (课程代码) 实验教学大纲 (第2版) 生命科学学院 生化教研室 2010年7月
前言 课程名称:生物化学实验学时:64 适用专业:生物科学、生物技术、生物工程课程性质:必修 一、实验课程简介 生物化学实验课程是生命科学本科实验教学的一个重要组成部分,实验性质有基础性、综合性、设计(创新)性三层次,实验项目数共25个,按照学时要求完成必做与选做实验。在实验过程中要求学生自己动手,独立观察并完成实验报告,注重培养学生创新思维与能力。 二、课程目的 通过实验教学可以加强学生对生物化学基本知识和基本理论的理解,掌握现代生物科学与技术的实验原理与技能;同时,通过实验培养学生独立观察、思考和分析问题、解决问题和提出问题的能力,养成实事求是、严肃认真的科学态度,提高学生的科学素养以及敢于创新的开拓精神。 三、考核方式及成绩评定标准 生物化学实验课程考核采用笔试与操作能力二种方式; 期末成绩评定标准为:平时成绩60%;笔试10%;操作能力30% 。 四、实验指导书及主要参考书 1.陈均辉等,《生物化学实验》科学出版社,2003年4月第三版 2.蒋立科等,《生物化学实验设计与实践》高等教育出版社,2007年10月第1版 五、实验项目 实验项目一览表
实验类型:演示性、验证性、综合性、设计性、其它 实验一蛋白质及氨基酸呈色反应与甲醛滴定法测定氨基氮(3课时)实验类型:验证性 实验目的: 学习几种常用的鉴定蛋白质与氨基酸的方法,掌握甲醛滴定法测定氨基酸含量的原理和操作要点。 实验内容: 1、茚三酮反应: (1)取两支试管分别加入蛋白质和氨基酸溶液1ml,再各加0.5ml0.1%茚三酮水溶液,混匀,沸水浴加热1-2min,观察颜色由粉色变紫红再变蓝。 (2)在一小块滤纸上滴上一滴0.5%Gly溶液,风干后,再在原处滴上一滴0.1%的印三酮乙醇溶液,在微火旁烘干显色,观察紫红斑点的出现。 2、黄色反应:
基础生化实验 第三个实验 双缩脲
基础生化实验--双缩脲法测定蛋白质含量 双缩脲法测定蛋白质含量(考核实验) 一、教学目的与要求: ①加强对蛋白质的有关性质的认识; ②掌握双缩脲法测定蛋白质含量的原理和方法; ③对学生所学进行综合的测试。 二、教学实验原理: 蛋白质含有两个以上的肽键,因此有双缩脲反应。在碱性溶液中蛋白质与Cu2+形成紫红色络合物,其颜色的深浅与蛋白质的浓度成正比,而与蛋白质的分子量氨基酸成分无关,因此利用此进行比色测定蛋白质含量。 在一定条件下,未知样品的溶液与标准蛋白质溶液同时反应,并于540—560nm下比色,可以通过标准蛋白质的标准曲线求出未知的蛋白质浓度,标准蛋白溶液可以用结晶的牛(或人)血清白蛋白、卵清蛋白或酪蛋白粉末配制。 除-CONH-有此反应外,-CONH2-,-CH2-,NH2-,-CS-CS-NH2,等基团亦有此反应。 三、考核主要内容 1、标准曲线的制作 取6支干净的试管,按0→5编号,然后按下表依次加入试剂,充分混匀,在室温下放置半小时,以管为空白,在550nm波长处测定消光值(OD),以各管蛋白质含量(毫克)横坐标,OD值为坐标,画出标线。 编号0 1 2 3 4 5 蛋白质标准液(毫升)0 0.2 0.4 0.6 0.8 1.0 蒸馏水(毫升) 1.0 0.8 0.6 0.4 0.2 0 双缩脲试剂(毫升) 4.0 4.0 4.0 4.0 4.0 4.0 2、样品测定:取样品液1.0 ml,同法进行,测其OD值,对照标准曲线求得未知液蛋 白质浓度。 3、分光光度计的使用:规定每组在10min以内全部完成操作(共测6支管);同时注意 操作是否规范。
4、成绩的计算:此次的实验占30%(包括平时的表现及实验报告的完成情况和完成质 量),平时的五次实验共占70%,每次实验按总分为5分为满分进行打分,总评折合 成百分制。 四、实验注意事项: ①标准样品的浓度为:10μg/ml; ②实验过程中不得过问他人,同组人可以配合进行; ③实验报告在课堂上独立完成,同组人数据相同,不得抄袭他人数据,一 旦发现以零分处理; ④实验过程若出现失误应向老师汇报后再进行重做; ⑤对实验结果进行简单的分析. 一、实验目的: 1.掌握分光光度计的使用方法。 2.掌握标准管法测物质含量的方法。 3.掌握双缩脲法测定蛋白质含量的方法。 二、实验原理: 双缩脲是由两分子尿素缩合而成的化合物,在碱性溶液中与硫酸铜反应生成紫红色络合物,此反应即为双缩脲反应。含有两个或两个以上肽键的化合物都具有双缩脲反应。蛋白质含有多个肽键,在碱性溶液中能与Cu2+络合成紫红色化合物。其颜色深浅与蛋白质的浓度成正比,可以用比色法进行测定。双缩脲法最常用于需要快速但并不需要十分精确的测定。 三、试剂和器材 (一)试剂: 1.标准蛋白溶液(5mg/ml):准确称取已定氮的酪蛋白(干酪素或牛血清白蛋白)用0.05mol/L氢氧化钠溶液配制,冰箱存放备用。 2.双缩脲试剂:溶解1.5g硫酸铜晶体(CuSO4·5H2O)和6.0g酒石酸钾钠晶体 NaKC4H4O6·4H2O)溶于500ml蒸馏水中,在搅拌下加入300ml10%氢氧化钠溶液,用水稀释到1000ml,贮存于内壁涂以石蜡的瓶内。此试剂可长期保存。
2012生物化学总复习题
是非题 1.DNA是生物遗传物质,RNA则不是。 2.同种生物体不同组织中的DNA,其碱基组成也不同。 3.酶促反应的初速度与底物浓度无关。 4.酶有几种底物时,其Km值也不相同。 5.三羧酸循环中的酶本质上都是氧化酶。 7.三羧酸循环提供大量能量是因为经底物水平磷酸化直接生成ATP。 10.甘油不能作为糖异生作用的前体。 12. 糖酵解过程中,因葡萄糖和果糖的活化都需要ATP,故ATP浓度高时,糖酵解速度加快。 13. 蛋白质中所含的必需氨基酸的含量越高,其营养价值越高。 14. 尿素的生成发生在细胞的胞浆中。 15. 氨在血液中主要是以谷氨酰胺和丙氨酸的形式运输。 17.从热力学上讲,葡萄糖的船式构象比椅式构象更稳定。 18.T.Cech从自我剪切的RNA中发现了有催化活性的RNA,称之为核酶。 19、生物膜的不对称性仅指膜蛋白的定向排列,膜脂可做侧向扩散和翻转扩散,在双分子层中的分布是相同的。 20.构成天然蛋白质的氨基酸,其D-构型和L-型普遍存在。 21、组成蛋白质的二十种氨基酸都有旋光性。 22.β-折叠是主肽链相当伸展的结构,因此它仅存在于某些纤维状蛋白质中。 23.蛋白质的亚基(或称为亚单位)和肽是同义词。 24.功能蛋白质分子中,只要个别氨基酸残基发生改变都会引起生物功能的丧失。 25.变构效应是蛋白质及生物大分子普遍的性质,它有利于这些生物大分子功能的调节。 26.重金属盐对人畜的毒性,主要是重金属离子会在人体内与功能蛋白质结合引起蛋白质变性所致。 27. 测定酶活力时,底物的浓度不必大于酶的浓度。 28.当底物处于饱和水平时,酶促反应的速度与酶浓度成正比。 1.解偶联剂可抑制呼吸链的电子传递。 29.电子通过呼吸链时,按照各组分的氧化还原电势依次从还原端向氧化端传递。30.TCA中底物水平磷酸化直接生成的是ATP。 31. L-谷氨酸脱氢酶不仅可以使L-谷氨酸脱氨基,同时也是联合脱氨基作用不可缺少的重要酶。 32. 脱氧核糖核苷酸是通过核糖核苷二磷酸还原生成的,NADH作为这一反应的还原力。 33. 诱导酶是指当特定诱导物存在时产生的酶,这种诱导物往往是该酶的产物。 35.ADP的磷酸化作用对电子传递起限速作用。 36. 鸡蛋清可用作铅中毒或汞中毒的解毒剂。 38、磷酸己糖旁路的重要的生理意义在于提供磷酸戊糖和NADPH。 1肠道细菌对不被消化的蛋白质所起的作用,称为腐败作用。其本质是细菌本身的代谢过程,以有氧代谢为主。 39.氨基酸的碳骨架可由糖分解代谢过程中的α-酮酸或其它中间代谢物提供,反过来过剩的氨基酸分解代谢中碳骨架也可通过糖异生途径合成糖。 40.大多数脱氧核苷酸的合成是在NDP的基础上进行的。
基础生化实验内容2012版
实验一、考马斯亮蓝G-250法测定可溶性蛋白质含量 【实验目的】 学习、掌握考马斯亮蓝G-250法测定蛋白质含量的原理和方法。 【实验原理】 考马斯亮蓝G-250在游离状态下呈红色,与蛋白质结合则呈现蓝色。染料的最大吸收从465nm变为595nm,蛋白质-染料复合物在595nm具有很大的光吸收值,蛋白质测定的灵敏度较高,最低检出量为1ug蛋白质。本方法操作简便快捷,灵敏度高,测定范围1-1000ug。 【实验材料、仪器及试剂】 1.材料:新鲜的植物材料 2.仪器:722分光光度计,天平,离心机,研钵,容量瓶,试管,移液管,漏斗 (1)标准牛血清蛋白质溶液:0.1mg/ml (2)考马斯亮蓝G-250溶液: 【实验步骤】 1.样品的提取:准确称取鲜样2克,用2ml蒸馏水在冰浴中研成匀浆,转移到25ml容量瓶中并定容。在8000rpm冷冻离心10min,取上清液待测。 2.标准曲线的绘制:取8支具塞试管,按表1加入试剂。 将上面8支试管摇匀,放置5分钟后,用1cm光径比色杯在595nm下比色,记录吸光值,以蛋白质浓度为横坐标,以吸光值为纵坐标绘制标准曲线。根据样品吸光值在标准曲线查得蛋白质含量。【结果计算】 C × V T 样品中蛋白质含量(ug/g.FW)= V S×W F×1000 式中: C为查标准曲线值(ug); V T为提取液总体积(ml); V S 为测定时加样量(ml); W F为样品鲜重(g)。
实验二植物激素的酶联免疫吸附测定法(ELISA)免疫测定是利用抗原、抗体特异性反应而建立的,根据可视化方法的不同可分为:酶联免疫、放射免疫、荧光免疫、化学发光免疫测定、生物发光免疫测定、浊度免疫测定法等。由于酶联免疫吸附分析法(Enzyme-linked Immunosorbent Assays, 简称ELISA)具有灵敏性、特异性高,且方便、快速、安全、成本低廉的特点,而日益被广泛应用于植物激素测定。目前,几大类植物激素IAA,ABA, GA3、GA4、iPA、ZR、DHZR等都建立了相应的ELISA方法并有试剂盒出售。 植物激素的酶联免疫检测方法有两种形式,一种是在固相载体上包被抗体(直接法),另一种是包被抗原(间接法)。 直接法利用游离抗原和酶标抗原与吸附的抗体进行竞争。间接法利用游离抗原和吸附抗原与游离抗体进行竞争。 间接法的原理可用下式表示: Ab+H+HP=AbH+AbHP 其中Ab表示抗体,H表示游离激素,HP表示吸附在板上的激素-蛋白质复合物。根据质量作用定律,当该反应体系中Ab及HP的量确定时,游离H越多,结合物AbH形成的就越多,而AbHP形成的就越少,即结合在板上的抗体就越少,通过酶标二抗检测结合物AbHP的多少,就可以确定游离H量的多少。 材料、试剂及设备 1 材料 各种新鲜植物材料 2 仪器设备 研钵,冷冻离心机,台式快速离心浓缩干燥器或氮气吹干装置,酶联免疫分光光度计,吸水纸,恒温箱,冰箱,酶标板(40孔或96孔),可调微量液体加样器(10μl,40μl,200μl,1000μl),带盖瓷盘(内铺湿纱布)。 3 试剂 (1) 磷酸盐缓冲液(PBS):称取8.0g NaCl, 0.2g KH2PO4 , 2.96g Na2HPO4 ·12H2O,用量筒加1 000 ml蒸馏水,pH为7.5。 (2) 样品稀释液:500 ml PBS中加0.5 ml Tween-20,0.5g明胶(稍加热溶解)。 (3) 底物缓冲液:称取5.10g C6H8O7·H2O(柠檬酸), 18.43g Na2HPO4·12H2O,用量筒加1 000ml 蒸馏水,再加1 ml Tween-20,pH为5.0。 (4) 洗涤液:1000ml PBS加1mlTween-20。 (5) 终止液:2mol/L H2SO4。 (6)提取液:80%甲醇,内含1 mmol/L BHT(二叔丁基对甲苯酚,为抗氧化剂,先用甲醇溶解BHT,再配成80%的浓度))。 操作步骤 1.样品中激素的提取 (1)称取0.5-1.0g新鲜植物材料(若取样后材料不能马上测定,用液氮速冻半小时后,保存在-20℃的冰箱中),加2ml样品提取液,在冰浴下研磨成匀浆,转入10ml试管,再用2ml提取液分次将研钵冲洗干净,一并转入试管中,摇匀后放置在4℃冰箱中。 (2)4℃下提取4h,3500转/min离心8min, 取上清液。沉淀中加1ml提取液,搅匀,置4℃下再提
生物化学实验报告
实验一糖类的性质实验 (一)糖类的颜色反应 一、实验目的 1、了解糖类某些颜色反应的原理。 2、学习应用糖的颜色反应鉴别糖类的方法。 二、颜色反应 (一)α-萘酚反应 1、原理糖在浓无机酸(硫酸、盐酸)作用下,脱水生成糠醛及糠醛衍生物,后 者能与α-萘酚生成紫红色物质。因为糠醛及糠醛衍生物对此反应均呈阳性,故此反应不是糖类的特异反应。 2、器材 试管及试管架,滴管 3、试剂 莫氏试剂:5%α-萘酚的酒精溶液1500mL.称取α-萘酚5g,溶于95%酒精中,总体积达100 mL,贮于棕色瓶内。用前配制。 1%葡萄糖溶液100 mL 1%果糖溶液100 mL 1%蔗糖溶液100 mL 1%淀粉溶液100 mL %糠醛溶液100 mL 浓硫酸 500 mL 4、实验操作 取5支试管,分别加入1%葡萄糖溶液、1%果糖溶液、1%蔗糖溶液、1%淀粉溶液、%糠醛溶液各1 mL。再向5支试管中各加入2滴莫氏试剂,充分混合。倾斜试管,小心地沿试管壁加入浓硫酸1 mL,慢慢立起试管,切勿摇动。 观察记录各管颜色。 (二)间苯二酚反应 1、原理 在酸作用下,酮醣脱水生成羟甲基糠醛,后者再与间苯二酚作用生成红色物质。此反应是酮醣的特异反应。醛糖在同样条件下呈色反应缓慢,只有在糖浓度较高或煮沸时间较长时,才呈微弱的阳性反应。实验条件下蔗醣有可能水解而呈阳性反应。 2、器材 试管及试管架,滴管 3、试剂 塞氏试剂:%间苯二酚-盐酸溶液1000 mL,称取间苯二酚0.05 g溶于30 mL 浓盐酸中,再用蒸馏水稀至1000 mL。 1%葡萄糖溶液100 mL 1%果糖溶液100 mL 1%蔗糖溶液100 mL 4、实验操作
生化大实验实验报告材料
生化大实验 实验报告 姓名: 学号: 专业: 班级: 实验班级: 单位: 指导老师:
实验1 多酚氧化酶(PPO)的分离提取 一、实验原理: 多酚氧化酶(PPO)能够通过分子氧氧化酚或多酚形成对应的醌,它是植物组织广泛存在的一种含铜氧化酶,位于质体、微体,可参与植物生长、分化、种皮透性及植物抗性的调节,属于末端氧化酶的一种。 植物受到机械损伤和病菌侵染后,PPO催化酚与O2氧化形成为醌,使组织形成褐变,以便损伤恢复,防止或减少感染,提高抗病能力。醌类物质对微生物有毒害作用,所以受伤组织一般这种酶的活性就会提高。另外,多酚氧化酶也可以与细胞其他底物氧化相偶联,起到末端氧化酶的作用。 蛋白质在不同浓度的盐溶液中的的溶解度不同,通过向溶液中加入适量的固体硫酸铵来调节粗提液的盐浓度从而可以将PPO蛋白从体系中析出,且大分子蛋白质不能通过透析膜。 二、实验目的: 通过本项实验,学习和了解蛋白质的提取、分离的基本原理和方法,掌握相关的仪器设备的正确使用的方法,以及蛋白质的提取分离的系统技术。 三、材料与试剂: 1.材料:马铃薯(两小组共称200g) 2.试剂:0.03M磷酸缓冲液pH 6.0(含0.02M巯基乙醇,0.001M EDTA,5%甘油,1%的聚乙烯吡咯烷酮)配制是配x10倍的浓缩液1000ml;固体硫酸铵;0.03M磷酸缓冲液pH 6.0(含0.02M巯基乙醇,0.001M EDTA,0.005M MgCl2) 3.设备:试管与试管架;烧杯、玻璃棒;移液管、滴管等;试剂瓶;透析袋;过滤纱布;植物组织匀浆机;pH计和pH试纸;高速冷冻离心机; 四、操作步骤: 1.两小组共称取200g土豆削皮后切成小块,加入300ml缓冲液A,两者按1:1(W/V)比例匀浆1min; 2.用两层纱布将所得的浆液过滤; 3.将匀浆滤液装入200ml的离心管10000rpm离心5min; 4.上清液两组平分,每组150ml,加36.45g硫酸铵固体搅拌均匀后10000rpm离心5min; 5.取上清液定容至150ml,加入30.75g硫酸铵固体搅拌均匀后10000rpm离心8min,倒掉上清液得粗酶沉淀,用并加入10ml 0.03M磷酸缓冲液B复溶沉淀3-5min; 6.将所得溶液倒入透析袋中,用0.02M的KCl溶液透析至无硫酸铵根离子。 五、结果和分析: 实验所得的初酶液颜色为浅黄色,颜色浅,主要是实验过程中特别是匀浆以前速度较快酚类被氧化的少,从而最大程度的保留了PPO的活性;经过一个夜晚的透析,得到了澄清的略带黄色的液体,这样就为进一步的柱层析提供了优良材料。 六、讨论与结论: 1. 本实验在匀浆阶段应尽量快速,防止酚类充分暴露在空气中被氧化; 2.实验材料马铃薯在削皮前一定要清洗干净; 3.加入硫酸铵固体时一定要小心缓慢,同时伴有玻璃般的搅拌,在溶解蛋白的过程中避免溶液局部盐离子浓度过大,使蛋白变性,并注意用量的计算,第二步加入的时候起点浓度是40%而不是0,否则会加入过量,影响实验的结果; 4.透析时,提前检查透析袋是否完整,避免透析时出现孔洞导致样品丢失。
2012生物化学复习思考题答案
2012生物化学复习思考题答案
生物化学复习思考题 一、是非题 1. 一种氨基酸在水溶液中或固体状态时都是以两性离子形式存在的。对 2. 亮氨酸的非极性比丙氨酸大。对,由侧链基团决定 3. 肽键能自由旋转。错,肽键有部分双键性质 4. 蛋白质表面氢原子之间形成氢键。错,氢键一般保藏在蛋白质的非极性内部 5. 从热力学上讲,蛋白质最稳定的构象是最低自由能时的结构。对 6. 用凝胶过滤柱层析分离蛋白质时总是分子量小的先下来,分子量大的后下来。错,相反 7. 变性后的蛋白质分子量发生改变。错,只是高级结构改变一级结构不变 8. 同工酶是一组功能与结构相同的酶。功能相同但结构不同 9. 酶分子中形成活性中心的氨基酸残基在一级结构上位置并不相近,而在空间结构上却处于相近位置。对 10. Km值随着酶浓度的变化而变化。错 11. 酶的最适温度是酶的特征常数。错,不是酶
的特性常数 12. 核苷中碱基和糖的连接一般是C——C连接的糖苷键。错,C-N连接 13. 在DNA变性过程中,总是G——C对丰富区先融解分开,形成小泡。错,是A-T对先分开 14. 核酸变性时,紫外吸收值明显增加。对,增色效应 15. tRNA上的反密码子与mRNA上相应的密码子是一样的。错,是互补配对的 16. 双链DNA中的每条链的(G+C)%含量与双链的(G+C)%含量相等。对 17. 对于生物体来说,核酸不是它的主要能源分子。对,核酸是信息分子 18. 降解代谢首先是将复杂的大分子化合物分解为小分子化合物。对 19. 磷酸己糖旁路能产生ATP,所以可以代替三羧酸循环,作为生物体供能的主要途径。错,其主要功能是产生NADPH和5-磷酸核糖 20. 酶的竞争性抑制剂可增加Km值而不影响Vm。对 21. 在糖的有氧氧化中,只有一步属于底物磷酸
