地塞米松对骨髓基质细胞生物学特性的影响

地塞米松对骨髓基质细胞生物学特性的影响
魏宽海 裴国献 郑 磊 王 前 金 丹 胡罢生
【摘 要】 目的 探讨地塞米松对体外培养的骨髓基质细胞增殖和分化等生物学特性的影响。方法 取4~6周龄新西兰兔双侧股骨骨髓3m l,体外分离,培养至第3代骨髓基质细胞,分别用地塞松浓度为0、10-10、10-9、10-8、10-7和10-6mo l L的培养基,作用2、4及6天后,测定骨髓基质细胞的分裂增殖能力和碱性磷酸酶活性。结果 地塞米松对骨髓基质细胞的增殖起抑制作用,并随地塞米松浓度的升高而增强,其浓度大于10-8mo l L后抑制作用越显著。地塞米松在抑制增殖的同时,可显著增强骨髓基质细胞的碱性磷酸酶活性,浓度越高作用也越显著,但超过10-8mo l L后各浓度的作用效果无显著差别;这种作用随时间的延长而增强,至6天时与对照组相比可增强2~4倍。结论 地塞米松抑制骨髓基质细胞的增殖,但可促进其分化为成骨细胞,浓度为10-8mo l L较合适。
【关键词】 组织工程 骨髓基质细胞 地塞米松 增殖 分化
THE EFFECTS OF D EXA M ETHAS ONE ON B I OLOGI CAL CHARACTER ISTI CS OF B ONE M ARR OW STR OM AL CELL S W E I K uan2ha i,P E I Guo2x ian,ZH EN G L ei,et a l.D ep a rt m en t of O rthop ed ics and T raum a tology,N anf ang H osp ita l,the F irst M ilita ry M ed ica l U n iversity.Guang z hou Guang d ong,P.R.Ch ina 510515
【Abstract】 Objective To investigate the effects of dexam ethasone on the p ro liferati on and differen tiati on of bone m arrow strom al cells(M SC).M ethods M SC w ere iso lated and cu ltu red in v itro.A fter treatm en t w ith differen t concen trati on s of dexam ethasone(0,10210,1029,1028,1027and1026mo l L),the p ro liferati on and alkaline pho sphatase(AL P)activity of M SC w ere m easu red to evaluate the effect of dexam ethasone on the b i o logical characteristics of M SC.Results D exam ethasone inh ib ited cell p ro liferati on.W ith the increase of concen trati on of dexam ethasone,the effect w as enhanced,w h ich w as mo re sign ifican t w hen the concen trati on of dexam ethasone w as over1028mo l L.A t the sam e ti m e,dexam ethasone p romo ted the activity of AL P.T h is effect w as enhanced w ith the increase of concen trati on of dexam ethasone,bu t the alterati on w as s m all w hen the concen trati on of dexam ethasone w as over1028mo l L.T he effects increased w ith the ti m e.T he activity of AL P w as enhanced2to4 ti m es w ith the dexam ethasone fo r6days.Conclusion D exam ethasone inhab it the p ro liferati on of M SC,w h ile induce them to differen tiate in to o steob lasts.T he app rop riate concen trati on of dexam ethasone w as10-8mo l L.
【Key words】 T issue Engineering Bone m arrow strom al cells D exam ethasone P ro liferati on D ifferen tiati on
Founda tion ite m s:N ati onal Basic Science R esearch and D evelopm en t Gran ts(973)(G1999054308);N ati onal N atu ral Science Foundati on of Ch ina(39970743)
用骨组织工程的方法修复骨缺损克服了以往方法的一些不足[1]。骨组织工程中种子细胞的选择与培养是最基本的环节,其来源有骨、骨外膜、骨髓和骨外组织。综合相比之下,以骨髓为最优[2]。但骨髓基质细胞(bone m arrow strom al cells,M SC)具有多向分化潜能,为了提高其成骨效率,有必要选择合适的培养条件,以促进M SC分裂增殖并定向分化为成骨细胞。为此设计进行实验,观察地塞米松对M SC增殖与分化特性的影响,以期建立一种理想的M SC体外培养体系。
1 材料与方法
111 主要仪器与试剂
基金项目:国家重点基础研究发展规划(973):组织工程的基本科学问题(G1999054308);国家自然科学基金资助项目(39970743)作者单位:第一军医大学南方医院创伤骨科(广州,510515) 倒置相差显微镜(O lym p u s),752紫外分光光度计(上海),B i o2rad450型酶联免疫检测仪(U SA),R PM I1640、96孔培养板(Gibco),胎牛血清(四季青生物制品公司),胰蛋白酶、T riton2100、M T T、二甲亚砜、牛血清白蛋白、考马斯亮蓝G2250 (天象人生物制品公司),地塞米松、维生素C (Sigm a),碱性磷酸酶试剂盒(南京建成生物工程研究所)。
112 方法
11211 M SC的培养 取4~6周健康新西兰大白兔,双侧股部剪毛,碘酒、酒精消毒后,用16号骨穿针自股骨大转子部穿入骨髓腔,注射器抽吸双侧股骨骨髓共3m l,混入无血清的1640培养基反复抽吸吹打。离心、过滤网,经4号针头反复抽吸,制成单细胞悬液。加入315m l含15%FB S的培养基,以
?
2
3
2
?Ch inese J R eparative and R econstructive Surgery,2001,V o l15(4)
3×106单个核细胞 m l 的细胞数接种入培养瓶中,
在37℃、5%CO 2及饱和湿度条件下培养,5天后半量换液,以后2~3天半量换液一次。待细胞汇合成单层后,用0125%胰蛋白酶消化,进行传代培养,常规2~3天半量换液。
11212 细胞增殖测定 将传至第3代的细胞以5×103 孔密度接种于96孔培养板,每孔加入15%
血清培养基200Λl ,在37℃、5%CO 2及饱和湿度条件下培养。24小时细胞完全贴壁吸去培养基,分别加入不同浓度的无血清诱导培养基200Λl ;地塞米松浓度分别为0(对照组)、10-10、10-9、10-8、10-7和10-6m o l L (实验组),每组5孔,于第2、4及6天用M T T 法分析M SC 的存活和增殖能力。
11213 细胞分化测定 细胞接种及处理同上,分别
于第2、4及6天用考马斯亮蓝法测细胞总蛋白质,检测细胞碱性磷酸酶(alkaline p ho sp hatase ,AL P )活性,计算平均每毫克蛋白质的AL P 活性。113 统计学处理方法
使用SPSS 统计软件对数据进行方差分析。组间t 检验,P 值<0105为有显著性差异。
2 结果
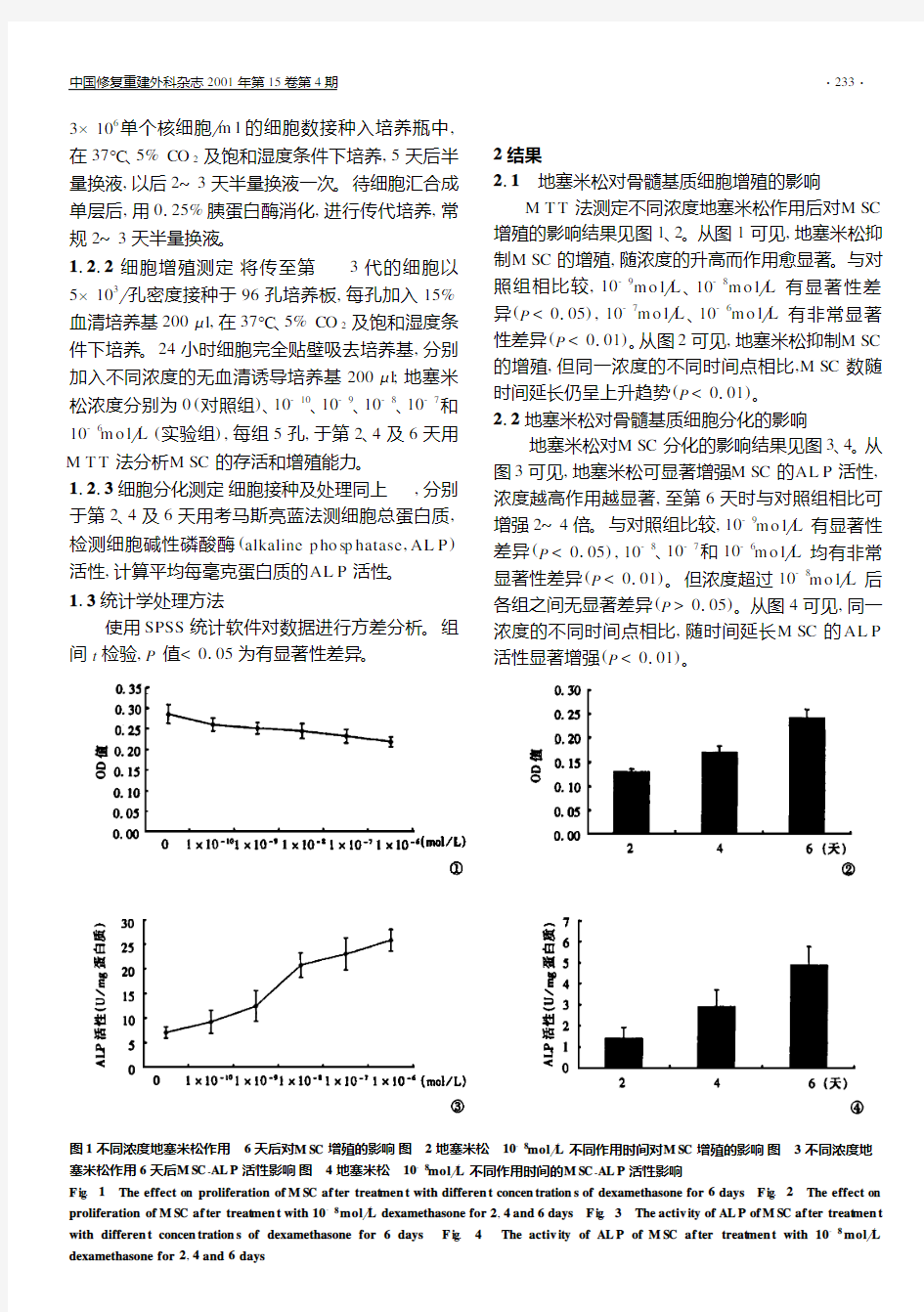
211 地塞米松对骨髓基质细胞增殖的影响
M T T 法测定不同浓度地塞米松作用后对M SC
增殖的影响结果见图1、2。从图1可见,地塞米松抑
制M SC 的增殖,随浓度的升高而作用愈显著。与对照组相比较,10-9m o l L 、10-8m o l L 有显著性差异(P <0105),10-7m o l L 、10-6m o l L 有非常显著性差异(P <0101)。从图2可见,地塞米松抑制M SC 的增殖,但同一浓度的不同时间点相比,M SC 数随时间延长仍呈上升趋势(P <0101)。
212 地塞米松对骨髓基质细胞分化的影响地塞米松对M SC 分化的影响结果见图3、4。从图3可见,地塞米松可显著增强M SC 的AL P 活性,浓度越高作用越显著,至第6天时与对照组相比可增强2~4倍。与对照组比较,10-9m o l L 有显著性差异(P <0105),10-8、10-7和10-6m o l L 均有非常显著性差异(P <0101)。但浓度超过10-8m o l L 后各组之间无显著差异(P >0105)。从图4可见,同一浓度的不同时间点相比,随时间延长M SC 的AL P 活性显著增强(P <0101)
。
图1 不同浓度地塞米松作用6天后对M SC 增殖的影响 图2 地塞米松10-8mol L 不同作用时间对M SC 增殖的影响 图3 不同浓度地塞米松作用6天后M SC -AL P 活性影响 图4 地塞米松10-8mol L 不同作用时间的M SC -AL P 活性影响
F ig .1 The effect on proliferation of M SC af ter treat men t with differen t concen tration s of dexamethasone for 6days F ig .2 The effect on proliferation of M SC af ter treat men t with 10-8mol L dexamethasone for 2,4and 6days F ig .3 The activ ity of AL P of M SC af ter treat men t with differen t concen tration s of dexamethasone for 6days F ig .4 The activ ity of AL P of M SC af ter treat men t with 10-8mol L
dexamethasone for 2,4and 6days
?
332?中国修复重建外科杂志2001年第15卷第4期
3 讨论
将组织工程方法应用于临床修复骨缺损已成为
趋势。组织工程学的全过程包括种子细胞的选择和培养、种子细胞和生物材料复合后联合培养、复合体植入体内三个步骤。其中,以种子细胞的获取和培养无疑是基础和最为重要的环节。理想的骨组织工程学种子细胞应具备下列特点:①取材容易,对机体的损伤小;②在体外培养过程中具有较强的传代繁殖能力并易定向分化为成骨细胞;③植入机体后能适应受区的环境并保持成骨活性。目前,作为种子细胞的成骨细胞有四种来源,即骨、骨外膜、骨髓和骨外组织。综合相比之下,以骨髓为最优[2]。骨髓分造血和基质两大系统,其成骨能力来源于基质系统。M SC 称作成纤维细胞集落形成单位,它具有多向分化潜能,可向成骨细胞、软骨细胞、脂肪细胞、网状细胞和肌细胞等多方向转化[3]。由于M SC 的多向分化性,因此有必要探索最佳的体外培养条件,从而使
M SC 多量、
稳定地向成骨细胞转化,以利于新生骨组织的产生。而在这一过程中,物理(电、磁、电磁、力)、化学(酸碱度、离子、化学物质)和生物(激素、因子、维生素)许多因素发挥着作用,对此进行深入研究是必要的[4~6]
。
我们的实验结果发现,地塞米松对M SC 的增殖起显著的抑制作用,这种作用随地塞米松浓度的升高而增强,特别是大于10-8m o l L 后其抑制作用越发显著。地塞米松在抑制增殖的同时,可显著增强M SC 的AL P 活性,浓度越高作用也越显著,但超过10-8
m o l L 后各浓度之间的作用效果无显著差别;
地塞米松的这种促进M SC 2AL P 活性的作用在2天
后即可表现出来,并随作用时间的延长促进作用也越明显,至第6天时与对照组相比可增强2~4倍。AL P 是成熟成骨细胞的标志性酶之一,在体外钙化中起着关键性作用,即没有AL P 活力,钙化就不会
发生,其主要机制在于AL P 能够水解有机磷酸酶,使局部PO +4浓度升高,并可破坏钙化抑制剂,从而启动钙化[7]。地塞米松抑制M SC 的增殖,但却增强AL P 活性,促进向成骨细胞转化,是M SC 体外成骨
的必须成份。地塞米松的这种作用是由于骨细胞是
糖皮质激素的靶细胞[8],地塞米松对其分化时的基因表达有一定的调节引导作用。
通过该实验我们认为,在骨组织工程学中M SC 体外培养时,培养基中地塞米松浓度取10-8m o l L 是适宜的,此浓度对M SC 增殖的抑制作用相对较小,并可显著增强细胞内的AL P 活性,从而促进M SC 定向分化为成骨细胞。
4 参考文献
1
V acanti CA ,V acanti JP .T issue 2engineered cartilage and bone by m eans of cell transp lantati on using synthetic bi odegradable po lym er m atrics .C lin P last Surg ,1994;21(3):4452魏宽海,裴国献.组织工程化骨组织中成骨细胞来源的选择.国外医学创伤与外科基本问题分册,1998;19(3):155
3Beresfo rd JN .O steogenic stem cells and the strom al system of bone and m arrow .C lin O rthop ,1989;240:270
4
W ang Q ,Zhong S ,Q uyang J ,et al .O steogenesis of electrically sti m ulated bone cells m ediated in part by calcium i ons .C lin O rthop ,1998;348:259
5V ilam itjana 2Am edee J ,Barelle R ,Rouais F ,et a l .H um an bone m arrow strom al cells exp ress an o steoblastic pheno type in culture .In V itro Cell D ev B i o l A ni m (Am ),1993;29(9):699
6郑 磊,王 前,魏宽海,等.碱性成纤维细胞生长因子对成骨细胞粘附特性影响的实验研究.中国修复重建外科杂志,2000;14
(5):305
7W lodarsk i KH .P roperties and o rigin of o steoblasts .C lin
O rthop ,1990;252:276
8
Cheng SL ,Yang JW ,R ifas L ,et a l .D ifferentiati on of hum an bone m arrow o steogenic strom al cells in vitro :Induci on of the o steoblast pheno type by dexam ethasone .Endocrino logy ,1994;134(1):277
(收稿:1999212229 二次修回:2001203212)
全军第四次手外科学术会议征文通知
经全军显微外科专业委员会手外科专业组研究决定:于2002年5月16日~18日(15日报到,19日撤离)在浙江省杭州市召开全军第四次手外科学术会议,会议将讨论手外科领域基础研究及临床应用研究等方面的新进展、新业务、新技术及临床经验总结等。望全军骨科、显微外科及手外科各界同道踊跃投稿,并将论文全文及500字摘要各一份寄青岛海军401医院全军手外科中心方光荣副主任收,邮编266071,截稿日期:2002年1月30日,会议有关事宜将另行通知。
全军显微外科专业委员会
手外科专业组
2001205214
?432?Ch inese J R eparative and R econstructive Surgery ,2001,V o l 15(4)
骨髓间质干细胞分离培养的经验总结
骨髓间充质干细胞经验总结 2003年8月,为给大家提供一个网上交流干细胞研究经验的平台,我们干细胞版设立了骨髓间充质干细胞培养讨论区,经过近三个月的讨论学习,我们既学习丰富了自己的知识体系,也对间充质干细胞尤其是分离培养方面有了更为翔实的认识,为了大家阅读的方便,我们决定把本版中的相关内容,同时参考部分书目和文献,做一总结。 一、骨髓间充质干细胞的分离 目前常用的分离MSC的方法有全骨髓法和密度梯度离心法,全骨髓法即根据干细胞贴壁特性,定期换液除去不贴壁细胞,从而达到纯化MSC的目的。密度梯度离心法即根据骨髓中细胞成分比重的不同,提取单核细胞进行贴壁培养。随着对MSC表面抗原认识的深入,有人利用免疫方法如流式细胞仪法、免疫磁珠法等对其进行分离纯化,但经过流式或磁珠分选后的细胞出现了增殖缓慢等一些问题,加之耗费较大和技术的难度,在某种程度上限制了这些方法的广泛应用。 1.直接培养法(全骨髓培养法) 1987年,Friedenstein等发现在塑料培养皿中培养的贴壁的骨髓单个核细胞在一定条件下可分化为成骨细胞、成软骨细胞、脂肪细胞和成肌细胞,而且这些细胞扩增20-30代后仍能保持其多向分化潜能,这类细胞即为骨髓间充质干细胞(BMSC),其工作对今后MSC 的研究具有重要意义,不仅证实了骨髓MSC的存在,而且创建了一种体外分离和培养MSC 的简便可行的方法,得到了广泛的应用。 culture-spirit采用直接贴壁法,24-36小时首次换液,换液时用PBS洗两次,7-10天传第一代,以后2-3天传代。培养基采用Hyclone的DMEM/F-12(1:1),血清是天津TBD的FBS(顶级),得到了较好的培养结果。 布兰卡根据自己培养大鼠MSC的经验,详细介绍了实验步骤: (1)接种后60-80分钟,换液去除悬浮细胞 (2)原代培养24h,48h各换液一次 (3)观察细胞情况,在原代培养7天左右时,如观察到成片的典型形态的细胞,在瓶底用Marker笔标记,0.25%胰酶消化,镜下观察控制,约5-10分钟(室温太低时应放置到孵箱中),加入全培养基终止消化,瓶体朝上,吸管轻轻吹打4-8分钟,尤其是标记部位。不要用力吹打,以免把贴壁较牢的成纤维细胞,上皮样细胞吹打下来 (4)传代到新瓶中,加入少量培养基,孵箱静置20-30分钟后,MSC大多牢固贴壁。瓶底朝上,轻轻吹打,丢弃悬浮以及贴壁不牢的细胞(大多是上皮样细胞),加入全培养基开始传代培养,如观察仍有较多杂细胞,可重复上述步骤。 (5)经上述处理后,原代的那瓶细胞仍有一些MSC生长,可继续按原代培养,如观察到MSC的克隆,仍可按上述步骤纯化处理。 (6)原代或传代的细胞如观察的少量成片的杂细胞,可直接镜下瓶底标记后,超净台里用长吸管尖端机械刮除,吸出去掉。 菊花与刀用的是全骨髓培养法,直接用含10%的FBS培养基冲洗大鼠的股骨和胫骨,为了避免冲起许多气泡应缓慢冲,冲的次数不应太多。冲洗后不用离心直接接种在培养瓶里,48h~72h后首次换液,一般7~10天可传代。 天之饺子介绍的小鼠MSC的分离方法:取6w小鼠的股骨和胫骨,直接用含培养基冲出骨髓,一定要尽量把干垢端的骨髓冲干净。冲洗后不离心直接接种在培养瓶里,24-48h后去悬浮,再接下来的每3-4天换液一次,直到需要传代。 2. 密度梯度离心法 裴雪涛等用比重为1.073g/ml的percoll分离(400g×20min)人骨髓MSCs,取界面处细
骨组织工程中骨髓基质细胞的研究进展.
作者单位:第四军医大学口腔医学院颌面外科,西安(710032 作者简介:刘彦普(1956-,河北人,副主任医师. 骨组织工程中骨髓基质细胞的研究进展 RESEARCH PR OGRESS ON BONE MARR OW MATRIC CE LL IN BONE TISSUE PR OJECT 刘彦普,钱奇春,杨维东 中图分类号:R322.7文献标识码:A 文章编 号:100524979(20020320229204 种子细胞研究是骨组织工程学的重要内容。理想的骨种子细胞应具备以下特点:①取材容易,损伤小;②易定向分化为成骨细胞,传代繁殖力强;③适应性强,植入机体后能保持成骨活性。目前,作为骨组织工程的种子细胞有4种来源:骨、骨外膜、骨髓、骨外组织。这些来源各有优缺点,其中骨髓来源的骨髓基质细胞(b one m arrow strom al cell ,BMSC 具有来源广泛、取材方便、生长稳定、增殖快、定向分化力强、易于接种成活等优点,在骨组织工程中显示出良好的应用前景。1BMSC 的成骨潜能 骨髓基质是骨髓腔中为造血干细胞提供结构和功能支持的结缔组织,由基质细胞和细胞间基质构成。骨髓成骨能力主要来源于BMSC 中的成纤维细胞集落形成单位(colony forming unit fibroblast ,CFU 2F ,它具有多向分化潜能,在特定培养条件下可转化成多种间充质细胞,如成纤维系细胞、成骨系细胞、软骨细胞、脂肪细胞、肌肉细胞和内皮细胞等[1]。Mani 2atopoulos [2]等首次观察到鼠BMSC 在体外培养条件下 具有形成钙化的骨样组织的能力,X 线衍射分析表明 钙化物具有与骨组织类似的羟基磷灰石结构,免疫组织化学显示BMSC 产生I 型胶原,骨钙素(osteocalcin ,OC 与骨涎蛋白表达阴性。Benayahu [3]等将BMSC 体外
骨髓基质干细胞及其应用的研究进展(一)
骨髓基质干细胞及其应用的研究进展(一) 【摘要】骨髓间充质干细胞(mesenchymalstemcells,MSCs),又称骨髓基质干细胞,是骨髓中非造血实质细胞的干细胞,具有高度的自我复制能力和多向分化潜能,可分化成多种细胞。【关键词】骨髓干细胞 骨髓间充质干细胞(mesenchymalstemcells,MSCs),又称骨髓基质干细胞,是骨髓中非造血实质细胞的干细胞,具有高度的自我复制能力和多向分化潜能,可分化成多种细胞。近来研究表明它可以向三个胚层的多种组织分化,如来源于外胚层的神经元、神经胶质细胞等,MSCs移植为脑缺血患者开辟了一种新的治疗方法。本文对MSCs移植治疗脑缺血的研究综述。 1骨髓基质细胞的生物学特性 1.1目前发现至少存在3种形态的MSCs。Colter等从培养的人骨髓细胞中分离出MSCs后,发现来自单细胞的克隆中除了含有小的梭形和大的扁平MSCs外,还有一种非常小的圆形细胞,这种小圆形细胞有更强的折光性,它们比大的MSCs能更快分裂、增殖,并且有更强的多向分化潜能,当将MSCs放在不同的微环境内时,它们可相应地分化为成骨细胞、软骨细胞、脂肪细胞或成肌细胞等1-3]。MSCs具有多向分化的潜能,MSCs经静脉途径或局部注射移植到不同的组织时,MSCs即可在相应的组织内分化形成该类组织细胞3,4]。 1.2MSCs的易粘附、易贴壁生长,易增殖特性使得它们经过数次换液和传代后得到分离、纯化3]。 2骨髓基质细胞在体外诱导分化为神经元和胶质细胞 最近研究发现,在特定的实验条件下可将人、大鼠及小鼠等的MSCs在体外诱导分化为神经元样和胶质细胞样细胞,SanchozRamos等发现,表皮生长因子(epidermalgrowthfactor,EGF)或脑源性营养因子(brain-derivedneuotroficfactor,BDNF)可诱导人及小鼠的少数MSCs分化为神经元样及胶质细胞样细胞,它们表达神经前体细胞的标志物巢素蛋白(nestin)及其RNA、神经元标记物神经元特异性核蛋白(neuronspecificnuclearprotein,NeuN)、星形胶质细胞标记物胶质原纤维酸性蛋白(glialfibrillaryacidicprotein,GFAP)。将人或小鼠的MSCs与胚胎大鼠中脑或纹状体神经元共培养时,部分MSCs分化为NeuN阳性的神经元样细胞及GFAP阳性的星形胶质细胞样细胞,因此,除了可能通过营养因子和细胞因子传递信号外,细胞与细胞的直接接触还可能在MSCs的分化中发挥重要作用5]。 3MSCS移植治疗局灶性脑缺血的可行性及原理 3.1供体与受体 MSCs移植治疗脑缺血多为同种异体移植,如Brazelton等6]采用的供体鼠为成熟转基因大鼠,鼠龄8~10w,受体鼠为致死量放疗后的相同鼠龄的大鼠,移植的为新鲜未经培养的MSCs。有些学者将供体鼠化疗(5-氟尿嘧啶,150mg/kg,腹部注射)2d后取其骨髓进行体外培养3代,移植前72h加BrdU进行标记,受体鼠亦为相同鼠龄相同体重的同种鼠7]。Zhao等8]的研究中,hMSCs来自于10~35岁的健康志愿者,hMSCs转染了增强的绿色荧光蛋白基因,经26代培养后移植入成熟雄鼠体重(230~250g),结果未出现免疫排斥反应,说明MSCs具有相当大的免疫反应调节能力。上述研究中,或是供体经化疗或是受体经放疗或是MSCs经多次传代培养以降低免疫活性,从而减少移植物抗宿主反应的发生。 3.2MSCs在脑内有迁移能力 Kopen等将小鼠MSCs注入新生小鼠侧脑室后12d,发现MSCs已迁移至前脑、小脑,而且不破坏脑组织结构,其迁移方式与出生后早期的神经发育过程相同,提示MSCs的行为类似神经前体细胞9]。 3.3目前MSCs移植治疗局灶性脑缺血的途径有3种:脑立体定向移植,经颈内动脉注射移植及经静脉注射移植
小鼠骨髓基质细胞使用说明
小鼠骨髓基质细胞 小鼠骨髓基质细胞产品说明: 为使客户能尽快开展实验,派瑞金发货的原代细胞均处于对数生长期,且每次发货为汇合率达到70%的细胞,收到细胞后即可开展实验。 派瑞金提供的小鼠骨髓基质细胞取自新鲜的组织,按照标准操作流程分离培养。研发的小鼠骨髓基质细胞完全培养基能提供细胞最佳的生长条件,降低杂细胞污染,保证不同批次间细胞质量的稳定。 同时,派瑞金还建立了严格的细胞鉴定流程,所提供的原代细胞均需经过细胞类型特异性标记物、细胞形态学等检测,保证细胞纯度在90%以上;同时也需经过微生物检测,保证不含有HIV、HBV、HCV、支原体、真菌及其他类型的细菌。 小鼠骨髓基质细胞注意事项: 1. 收到细胞后首先观察细胞瓶是否完好,培养液是否有漏液、浑浊等现象,若有上述现象发生请及时和我们联系。 2. 仔细阅读细胞说明书,了解细胞相关信息,如细胞形态、所用培养基、血清比例、所需细胞因子等。 3. 请客户用相同条件的培养基用于细胞培养。培养瓶内多余的培养基可收集备用,细胞传代时可以一定比例和客户自备的培养基混合,使细胞逐渐适应培养条件;建议使用派瑞金的完全培养基。 4. 建议客户收到细胞后前3天各拍几张细胞照片,记录细胞状态。 5. 该细胞只能用于科研,不得用于临床应用。 小鼠骨髓基质细胞其他相关小鼠原代细胞: 小鼠小肠粘膜上皮细胞小鼠大隐静脉平滑肌细胞 小鼠肺微血管内皮细胞小鼠冠状动脉平滑肌细胞 小鼠肺血管平滑肌细胞小鼠大隐静脉内皮细胞 小鼠Ⅱ型肺泡上皮细胞小鼠冠状动脉内皮细胞 小鼠气管上皮细胞小鼠骨细胞 小鼠气管平滑肌细胞小鼠滑膜细胞 小鼠肺成纤维细胞小鼠骨骼肌细胞 小鼠支气管上皮细胞小鼠表皮细胞 小鼠支气管成纤维细胞小鼠真皮成纤维细胞 小鼠肺大静脉平滑肌细胞小鼠破骨细胞 小鼠肺大动脉平滑肌细胞小鼠皮肤肥大细胞
骨髓间充质干细胞研究进展(一)
骨髓间充质干细胞研究进展(一) 【摘要】骨髓间充质干细胞是干细胞领域的研究热点之一。虽然近几年来有关间充质干细胞的研究已取得了很大进展,但仍有很多问题有待进一步解决。本文主要对间充质干细胞的生物学特性、以及免疫耐受性、分化和促修复、间充质干细胞的标记等问题进行综述。 【关键词】骨髓间充质干细胞分化标记 骨髓间充质干细胞,BMSCs)是骨髓内除造血干细胞(hematopoieticstemcells,HSC)之外的另一类干细胞,是骨髓造血微环境的重要组成部分,在体内外均具有支持和调控造血的作用。因其比较容易贴壁和形成成纤维样的克隆,因此也称成纤维细胞集落形成单位(Colonyformingunitfibroblast,。又由于它们来自骨髓的支持结构,并作为滋养层支持造血干细胞的生长,因此也有人称其为骨髓基质细胞(Bonemarrowstromalcells,BMSCs)。 1骨髓MSCs的生物学特性 不同物种的BMSCs体外培养的形态学特征大致相同,主要表现为梭形、纺锤形,少数为多角形。目前,BMSCs的分离方法主要有以下几种:(1)全骨髓培养,是将无菌抽取的骨髓加入培养液制成细胞悬液并培养,原代培养培养物以造血细胞成分居多,为利于BMSCs的贴壁生长,可采用DMEM和胎牛血清培养。BMSCs对营养要求高,胎牛血清终浓度为10%~20%,有人认为红细胞会随着换液而逐渐被自然去除,对BMSCs影响不大。细胞融合后以1:2比例传代,3~4天换液一次〔1〕;(2)离心培养法,是根据骨髓中细胞成分比重的不同,采用离心分离法提取单核细胞进行培养。在新鲜无菌的骨髓抽取物中加入抗凝培养液稀释1500~2000r/min离心20~30min,采集交界处的单核细胞层,PBS洗涤2~3次后,加入培养液接种培养;(3)细胞表面分子标记分选法,主要是根据BMSCs的细胞表面分子特征来分离。一般采用流式细胞仪、免疫磁珠或免疫沉积法来进行分选。但由于目前仍未找到BMSCs 特异性的细胞表面标记物〔2〕该法较少采用。影响BMSCs扩增的主要因素:(1)血清:血清对大量扩增BMSCs起着重要的作用,不同浓度的血清对培养BMScs纯度的影响亦较大,常用10%~20%的胎牛血清培养BMSCs;(2)接种密度:BMSCs的体外扩增速度与其接种密度也有关,一般认为较低密度种植有益于增殖。高密度接种后细胞生长较慢其原因可能是由于细胞间的接触抑制,或细胞释放到培养基中的因子影响了BMSCs的生长;(3)细胞因子:一些细胞因子对于维持BMSCs增殖和未分化状态亦十分重要;(4)动物种属:一般认为BMSCs的生长特性相似,但也有资料显示BMSCs生长特点有种属差异〔3〕。 2间充质干细胞移植后的免疫耐受性 在移植治疗中,一般情况下,移植物会引起宿主的免疫排斥反应。但对于间充质干细胞来说却不是这样。实验表明间充质干细胞可以抑制T细胞的增殖从而导致免疫耐受〔4~7〕。T 细胞与其它细胞的相互作用可以通过混和淋巴细胞反应来观察。被标记的T细胞与其它细胞混合后,如果可以引起T细胞的免疫反应,则可以观察到T细胞的增殖现象。但当把间充质干细胞与T细胞混合后却观察不到T细胞的增殖反应,而且这种现象并不是由于T细胞凋亡或其它的有害作用引起的。因为在去除间充质干细胞后,这些T细胞仍然可以对其它物质进行反应。此外,使用趋化膜将两种细胞分隔开培养后,间充质干细胞对T细胞的抑制作用依然存在,表明这种抑制作用可能通过某种可溶性的小分子起作用。另外,除了未分化的间充质干细胞可以抑制T细胞的增殖外,实验也表明,随着干细胞的分化,其抗原性并没有随之增加〔8〕。总之,间充质干细胞可以通过某种机制抑制T细胞的成熟来逃避免疫系统的清除。也暗示间充质干细胞可能在机体免疫系统的调节及骨髓中各种干细胞未分化状态的维持方面起作用。 3促组织修复和细胞分化 骨髓间充质干细胞(BMSCs)是存在于骨髓组织中的一类成体干细胞(adultstemcells,AS),在一
骨髓基质干细胞临床研究进展
2009年2月第6卷第4期 骨髓基质干细胞临床研究进展 ?研究进展? 钦斌1。蔡建平2‘ (1.南京中医药大学2002级中西医结合七年制研究生,江苏南京210029;2.无锡市中医院,江苏无锡214000) 【摘要】随着细胞研究的发展,骨髓基质干细胞的临床应用越来越受到重视。本文对骨髓基质干细胞的生物学特性、取材、分离、培养、临床前期研究成果和面临的问题进行了综述。 【关键词】骨髓基质干细胞;生物学特性;取材;分离;培养;临床应用 【中图分类号】R329.2【文献标识码】A【文章编号】1673--7210(2009)02(a)一011—02 1867年.Cohnheim首先提出了骨髓内含有骨髓基质干细胞(MSCs)的观点;而Frieden—stein于1966年首先发现。它是骨髓基质的组成成分。能分化为成骨细胞、软骨细胞和脂肪细胞。骨髓是由造血干细胞和非造血干细胞组成的器官,非造血干细胞(即MSCs)由骨前体细胞、软骨前体细胞、脂肪前体细胞、神经细胞和肌细胞前体细胞组成.因此。MSCs是由骨髓组织干细胞或前体细胞和躯体组织干细胞组成的成分及功能复杂的细胞群体『I】。许多年来,MSCs基础研究和临床应用的前期研究取得了重大进展.但是仍有许多问题尚待解决。 1细胞形态 MSCs具有3种细胞形态:①梭形细胞;②巨大扁平细胞;③体积非常小的球形细胞1"21。 2生物学特性 MSCs有以下生物学特性:①自我更新能力。MSCs在体内具有很强的自我更新能力,是传代细胞131。②很强的黏附性。体外培养收集细胞时MSCs容易与骨髓基质分离形成细胞悬液,体外低密度培养时MSCs迅速黏附。反复冲洗可与非黏附的造血干细胞分离嘲。③可塑性。MSCs具有可塑性.即具有多向分化的潜能。骨髓脂肪细胞株在体内可分化为真正的骨组织[41,骨髓网状细胞在体内可转变为脂肪细胞。在适宜的微环境下,MSCs可分化为成骨细胞、软骨细胞、脂肪细胞、肌细胞、星形细胞、少突树突细胞及神经细胞等.而且能跨胚层分化,属于不同胚层的MSCs或前体细胞还能分化成与本身组织不相关的其他胚层组织.如骨髓中存在成肌细胞前体细胞,神经干细胞能重新分化成造血细胞.骨髓细胞分化为神经细胞和肝细胞[5--11。④快速增殖形成克隆的能力。MSCs能迅速产生单细胞源克隆。而且这些克隆均来源于单细胞克隆一克隆形成单位成纤维细胞(CFU—F)隆71。⑤可移植性。MSCs具有自我更新能力和可塑性。因此具备了可以移植的前提条件。一些临床前期研究表明MSCs移植可治疗某些疾病。3生物学特性的改变 MSCs在体内骨髓微环境下生长并保持特有的生物学特 【作者简介】钦斌(1983-),男,江苏无锡人,南京中医药大学2002中西医结合七年制研究生。 。通讯作者性,但经体外适宜环境条件下培养后,许多生物学特性发生改变。①“归巢”能力丧失。大多数研究表明,原代MSCs体外培养并输注移植后。在受体中不能检测到或只能部分检测到供体的MSCs嗍。②分化潜能丧失。MSCs体外培养后.有的失去分化成脂肪细胞的能力.有的失去分化成软骨细胞和成骨细胞的能力19.t01。③细胞形态异质性丧失。原代MSCs具有细胞形态的异质性,但经过一定时间的体外培养(传代3次)。形态的异质性逐渐丧失,细胞形态主要为巨大扁平细胞flll。 ④细胞融合入或核融合。当人MsC8与热休克损伤的上皮细胞共同培养时。部分细胞直接转化成上皮细胞而与其他细胞或上皮细胞融合变成双核细胞且表达上皮细胞表面抗原¨21。细胞融合人或核融合的机制和生物学意义目前尚未明确。 4细胞的采集和培养 MSCs的取材一般采用骨髓穿刺法,操作方便。刨伤小。可反复取材而不影响细胞活力及机体功能。分离骨髓基质细胞的方法主要有三种:贴壁筛选法、密度梯度离心法和流式细胞分选术(flowcytometer.FCM)。贴壁筛选法经济方便但纯化程度有限,有待进一步改进。密度梯度离心法得到的细胞纯度可达95%t13】。流式细胞分选术可根据MSCs与造血细胞的表面标记的不同。用带有荧光标记的抗体从混合细胞群中获取高纯度的MSCs。BioWhittakerIne.用表面分子CDl05、CDl66、CD29、CD44阳性和CDl4、CD34、CD45阴性筛选法得到几乎完全纯化的MSCs[t,q。 静态单层培养法是目前较为经典的细胞培养方法。这种方法简便易操作,成本低廉;缺点是培养细胞数量受培养器皿底面积限制,且不符合体内的生理环境。随着骨组织工程的研究。构建功能性组织工程骨已成为理想目标.进而对种子细胞的培养提出了更高的要求。生物反应器的使用使得MSCs的体外动态培养环境更接近于体内.从而使种子细胞功能形状等各方面更加完善。有研究表明,运用灌流式生物反应器不但可以进行多组织培养.而且还可以获得4.22x107/ml的细胞密度,长时间培养仍能保持细胞的多分化特性嗍。 MSCs体外培养需要种子数量较大。使用常规的培养方法往往需要长时间培养、多次传代才能完成。微载体培养法旧 CHINAMEDICALHERALD巾一医嚣导■” 万方数据
骨髓基质干细胞及其应用的研究进展
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 骨髓基质干细胞及其应用的研究进展骨髓基质干细胞及其应用的研究进展( 作者: 张秀云发表时间: 2019 年 11 月 ) 【摘要】骨髓间充质干细胞(mesenchymal stem cells,MSCs),又称骨髓基质干细胞,是骨髓中非造血实质细胞的干细胞,具有高度的自我复制能力和多向分化潜能,可分化成多种细胞。 【关键词】骨髓干细胞骨髓间充质干细胞(mesenchymal stem cells, MSCs),又称骨髓基质干细胞,是骨髓中非造血实质细胞的干细胞,具有高度的自我复制能力和多向分化潜能,可分化成多种细胞。 近来研究表明它可以向三个胚层的多种组织分化,如来源于外胚层的神经元、神经胶质细胞等, MSCs 移植为脑缺血患者开辟了一种新的治疗方法。 本文对MSCs 移植治疗脑缺血的研究综述。 1 骨髓基质细胞的生物学特性 1.1 目前发现至少存在 3 种形态的 MSCs。 Colter 等从培养的人骨髓细胞中分离出 MSCs 后,发现来自单细胞的克隆中除了含有小的梭形和大的扁平 MSCs 外,还有一种非常小的圆形细胞,这种小圆形细胞有更强的折光性,它们比大的 1 / 9
MSCs 能更快分裂、增殖,并且有更强的多向分化潜能,当将 MSCs 放在不同的微环境内时,它们可相应地分化为成骨细胞、软骨细胞、脂肪细胞或成肌细胞等。 MSCs 具有多向分化的潜能,MSCs 经静脉途径或局部注射移植到不同的组织时, MSCs 即可在相应的组织内分化形成该类组织细胞。 1.2 MSCs 的易粘附、易贴壁生长,易增殖特性使得它们经过数次换液和传代后得到分离、纯化。 2 骨髓基质细胞在体外诱导分化为神经元和胶质细胞最近研究发现,在特定的实验条件下可将人、大鼠及小鼠等的MSCs 在体外诱导分化为神经元样和胶质细胞样细胞,Sanchoz Ramos 等发现,表皮生长因子(epidermal growth factor,EGF)或脑源性营养因子(brain-derived neuotrofic factor, BDNF)可诱导人及小鼠的少数 MSCs 分化为神经元样及胶质细胞样细胞,它们表达神经前体细胞的标志物巢素蛋白(nestin)及其 RNA、神经元标记物神经元特异性核蛋白(neuron specific nuclear protein,NeuN)、星形胶质细胞标记物胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)。 将人或小鼠的 MSCs 与胚胎大鼠中脑或纹状体神经元共培养时,部分 MSCs 分化为 NeuN 阳性的神经元样细胞及 GFAP 阳性的星形胶质细胞样细胞,因此,除了可能通过营养因子和细胞因子传递信号外,细胞与细胞的直接接触还可能在 MSCs 的分化中发挥重要作用。 3 MSCS 移植治疗局灶性脑缺血的可行性及原理
地塞米松对骨髓基质细胞生物学特性的影响
地塞米松对骨髓基质细胞生物学特性的影响 魏宽海 裴国献 郑 磊 王 前 金 丹 胡罢生 【摘 要】 目的 探讨地塞米松对体外培养的骨髓基质细胞增殖和分化等生物学特性的影响。方法 取4~6周龄新西兰兔双侧股骨骨髓3m l,体外分离,培养至第3代骨髓基质细胞,分别用地塞松浓度为0、10-10、10-9、10-8、10-7和10-6mo l L的培养基,作用2、4及6天后,测定骨髓基质细胞的分裂增殖能力和碱性磷酸酶活性。结果 地塞米松对骨髓基质细胞的增殖起抑制作用,并随地塞米松浓度的升高而增强,其浓度大于10-8mo l L后抑制作用越显著。地塞米松在抑制增殖的同时,可显著增强骨髓基质细胞的碱性磷酸酶活性,浓度越高作用也越显著,但超过10-8mo l L后各浓度的作用效果无显著差别;这种作用随时间的延长而增强,至6天时与对照组相比可增强2~4倍。结论 地塞米松抑制骨髓基质细胞的增殖,但可促进其分化为成骨细胞,浓度为10-8mo l L较合适。 【关键词】 组织工程 骨髓基质细胞 地塞米松 增殖 分化 THE EFFECTS OF D EXA M ETHAS ONE ON B I OLOGI CAL CHARACTER ISTI CS OF B ONE M ARR OW STR OM AL CELL S W E I K uan2ha i,P E I Guo2x ian,ZH EN G L ei,et a l.D ep a rt m en t of O rthop ed ics and T raum a tology,N anf ang H osp ita l,the F irst M ilita ry M ed ica l U n iversity.Guang z hou Guang d ong,P.R.Ch ina 510515 【Abstract】 Objective To investigate the effects of dexam ethasone on the p ro liferati on and differen tiati on of bone m arrow strom al cells(M SC).M ethods M SC w ere iso lated and cu ltu red in v itro.A fter treatm en t w ith differen t concen trati on s of dexam ethasone(0,10210,1029,1028,1027and1026mo l L),the p ro liferati on and alkaline pho sphatase(AL P)activity of M SC w ere m easu red to evaluate the effect of dexam ethasone on the b i o logical characteristics of M SC.Results D exam ethasone inh ib ited cell p ro liferati on.W ith the increase of concen trati on of dexam ethasone,the effect w as enhanced,w h ich w as mo re sign ifican t w hen the concen trati on of dexam ethasone w as over1028mo l L.A t the sam e ti m e,dexam ethasone p romo ted the activity of AL P.T h is effect w as enhanced w ith the increase of concen trati on of dexam ethasone,bu t the alterati on w as s m all w hen the concen trati on of dexam ethasone w as over1028mo l L.T he effects increased w ith the ti m e.T he activity of AL P w as enhanced2to4 ti m es w ith the dexam ethasone fo r6days.Conclusion D exam ethasone inhab it the p ro liferati on of M SC,w h ile induce them to differen tiate in to o steob lasts.T he app rop riate concen trati on of dexam ethasone w as10-8mo l L. 【Key words】 T issue Engineering Bone m arrow strom al cells D exam ethasone P ro liferati on D ifferen tiati on Founda tion ite m s:N ati onal Basic Science R esearch and D evelopm en t Gran ts(973)(G1999054308);N ati onal N atu ral Science Foundati on of Ch ina(39970743) 用骨组织工程的方法修复骨缺损克服了以往方法的一些不足[1]。骨组织工程中种子细胞的选择与培养是最基本的环节,其来源有骨、骨外膜、骨髓和骨外组织。综合相比之下,以骨髓为最优[2]。但骨髓基质细胞(bone m arrow strom al cells,M SC)具有多向分化潜能,为了提高其成骨效率,有必要选择合适的培养条件,以促进M SC分裂增殖并定向分化为成骨细胞。为此设计进行实验,观察地塞米松对M SC增殖与分化特性的影响,以期建立一种理想的M SC体外培养体系。 1 材料与方法 111 主要仪器与试剂 基金项目:国家重点基础研究发展规划(973):组织工程的基本科学问题(G1999054308);国家自然科学基金资助项目(39970743)作者单位:第一军医大学南方医院创伤骨科(广州,510515) 倒置相差显微镜(O lym p u s),752紫外分光光度计(上海),B i o2rad450型酶联免疫检测仪(U SA),R PM I1640、96孔培养板(Gibco),胎牛血清(四季青生物制品公司),胰蛋白酶、T riton2100、M T T、二甲亚砜、牛血清白蛋白、考马斯亮蓝G2250 (天象人生物制品公司),地塞米松、维生素C (Sigm a),碱性磷酸酶试剂盒(南京建成生物工程研究所)。 112 方法 11211 M SC的培养 取4~6周健康新西兰大白兔,双侧股部剪毛,碘酒、酒精消毒后,用16号骨穿针自股骨大转子部穿入骨髓腔,注射器抽吸双侧股骨骨髓共3m l,混入无血清的1640培养基反复抽吸吹打。离心、过滤网,经4号针头反复抽吸,制成单细胞悬液。加入315m l含15%FB S的培养基,以 ? 2 3 2 ?Ch inese J R eparative and R econstructive Surgery,2001,V o l15(4)
自体骨髓基质干细胞移植联合EPO治疗脊髓损伤的研究
自体骨髓基质干细胞移植联合EPO治疗脊髓损伤的研究 目的:探讨自体骨髓基质干细胞(MSCs)移植联合促红细胞生成素(EPO)对大鼠脊髓损伤(SCI)治疗的效果。方法:培养与纯化骨髓基质干细胞。80只SD大鼠制备脊髓损伤模型,随机分为4组:干细胞移植组、EPO组、联合组和对照组。采用BBB法进行运动能力评分和组织切片观察来评定修复情况。结果:三个实验组与对照组相比,差异具有统计学意义(P<0.05),三个实验组均可明显促进大鼠运动功能和损伤后组织结构的恢复,其中联合组效果更显著。结论:骨髓基质干细胞移植联合EPO具有促进大鼠脊髓损伤后神经功能的修复。 脊髓损伤(spinal cord injury,SCI)是一种常见的神经系统损伤,其致残率和病死率均较高。目前,脊髓损伤在临床治疗后神经功能的恢复效果不甚理想[1-5],急需改进,所以,脊髓损伤的治疗一直是医学研究的热点问题[6-7]。骨髓基质干细胞(MSCs)具有高度增殖和向多种细胞分化的潜能,可分化为对神经递质敏感且具有神经电生理特性的细胞,还可以产生多种神经生长因子促进受损的神经纤维修复,移植后可促进脊髓损伤的修复[8],而且可以自体移植,因此骨髓基质干细胞是治疗脊髓损伤的理想种子细胞[9-10]。促红细胞生成素(erythropoietin,EPO)是一种由肾脏产生的内分泌激素,一直作为治疗贫血的药物而应用于临床。随着人们对EPO研究的深入,EPO已被证实是一种新型的神经保护和营养因子,具有神经营养和神经保护作用[11]。本实验将骨髓基质干细胞和促红细胞生成素联合应用于脊髓损伤大鼠,探讨骨髓基质干细胞和促红细胞生成素联合应用是否有协同效应。 1 材料与方法 1.1 实验材料和设备成年雄性SD大鼠80只,体重200~240 g;8周龄雄性SD大鼠4只,体重约100 g(均由哈尔滨医科大学动物试验中心提供)。二氧化碳细胞培养箱(德国Heraeus公司),倒置相差显微镜(日本奥林帕斯公司),低温离心机(德国Heraeus公司),单人双面净化工作台(苏州净化)超纯水净化器(美国Millipore公司),DMEM培养基,Percoll分层液。 1.2 实验方法 1.2.1 建立脊髓损伤模型与分组8周龄的SD大鼠用于骨髓基质干细胞的分离、培养和纯化。成年SD大鼠水合氯醛麻醉后,俯卧位固定,找到T10棘突,向上和向下5 cm范围内进行剪毛消毒。沿正中线切一3 cm长的切口,暴露椎旁肌肉,用玻璃分针剥离肌肉,用骨钳咬除棘突和椎板,形成方形骨窗,暴露T10脊髓,用脊髓损伤打击器打击制成SCI模型。造模的标准是:脊髓出现出血、水肿、后肢迟缓性瘫痪和尾巴痉挛性摆动。冲洗切口后局部使用青霉素,以防感染,缝合后放回鼠笼喂养。按随机的方式将80只SCI模型的大鼠分为对照组、骨髓基质干细胞应用组、促红细胞生成素应用组和联合应用组,每组20只。对照组每只鼠在脊髓损伤前1 d经腹腔注射相同量的生理盐水。骨髓基质干细胞治疗组将每只鼠采取尾静脉注射的方法在脊髓损伤后给予第3代培养的骨髓基质干细
人骨髓基质细胞向成骨细胞分化过程中差异表达基因的筛选
生理学报 Acta Physiologica Sinica , August 25, 2006, 58 (4): 370-376 https://www.360docs.net/doc/d211405397.html, 370 研究论文 Received 2006-03-30 Accepted 2006-06-02 This work was supported by the National Natural Science Foundation of China (No. 30400251). * Corresponding author. Tel: +86-10-62179164; Fax: +86-10-62173457; E-mail: jmchun@https://www.360docs.net/doc/d211405397.html, 人骨髓基质细胞向成骨细胞分化过程中差异表达基因的筛选 刘美玲,石心泉,周万灏,刘洪文,李 东,贾孟春* 国家人口计划生育委员会科学技术研究所,北京 100081 摘 要:为了探讨人骨髓基质细胞(bone marrow stromal cells, BMSCs)向成骨细胞分化过程中差异表达的基因,本实验采用体外培养人BMSCs ,诱导向成骨细胞分化。分别选取培养12和21 d 的细胞作为驱动方(driver)和实验方(tester),进行抑制消减杂交,构建cDNA 消减文库,将挑选出的阳性克隆与GenBank 人基因库中已公布的核酸序列进行同源性比较分析。结果表明,从培养21 d 的BMSCs 中,筛查出5个差异基因,与人基因库中已知基因的同源性分别达到90%以上。有兴趣的是,核心蛋白聚糖和Bax inhibitor 1在培养21 d 的BMSCs 中差异表达。RT-PCR 检测显示,核心蛋白聚糖基因在培养21d 的细胞中高表达,而在12 d 的细胞中未检测到表达;Bax inhibitor 1基因在培养21 d 细胞中的表达明显高于12 d 的细胞。关键词:骨髓基质细胞;成骨细胞;核心蛋白聚糖;基因中图分类号:R 329 Screening differentially expressed genes in human bone marrow stromal cells at defined stage of differentiation LIU Mei-Ling, SHI Xin-Quan, ZHOU Wan-Hao, LIU Hong-Wen, LI Dong, JIA Meng-Chun * National Population Research Institute for Family Planning, Beijing 100081, China. Abstract: To screen differentially expressed genes involved in osteogenic differentiation of human bone marrow stromal cells (BMSCs)at defined stages, subtractive cDNA library was established by means of suppression subtractive hybridization. The BMSCs cultured for 12 and 21 d were used as driver and tester, respectively. A subtract library was successfully constructed and five positive clones were selected from the library. Sequencing analysis and homology comparison showed that the five clones differentially expressed in BMSCs cultured for 21 d were at least 90% homologous with the known genes in human GenBank. It was interestingly found that the osteogenic BMSCs cultured for 21 d differentially expressed decorin and Bax inhibitor 1. RT-PCR was performed to confirm the differentially expressed genes. The results showed that the expression of Bax inhibitor 1 was significantly higher in the cells of 21-day than that of 12-day, while the expression of decorin was only detected in the cells of 21-day.Key words: bone marrow stromal cells; osteoblast; decorin; gene 正常骨量的维持需要骨祖细胞不断提供足够的成骨细胞,而正常骨转换中所需要的成骨细胞来源于骨髓基质细胞(bone marrow stromal cells, BMSCs)。BMSCs 是骨髓基质的一种间充质细胞,它能产生骨祖细胞系。BMSCs 具有多向分化潜能,在一定的诱导条件下可向脂肪细胞、肌细胞、软骨细胞,甚至神经细胞等分化[1,2]。定向分化的骨祖细胞首先增 殖并分化为前成骨细胞,同时表达I 型胶原和碱性磷酸酶(alkaline phosphatase, ALP)。I 型胶原的合成在细胞增殖期占主导地位,并与细胞的进一步分化有很大的关系。随后前成骨细胞分化为早期的成骨细胞并表达骨桥蛋白(osteopontin, OPN),同时具有了骨基质形成的能力。最终,分化成熟的成骨细胞开始骨钙素(osteocalcin, OC)的表达,并进一步分化
实验设计-骨髓基质细胞系的建立
小鼠骨髓细胞群细胞系的建立 一、实验目的: 1) 通过培养小鼠骨髓基质细胞,建立小鼠骨髓基质细胞系 2) 了解细胞培养的一般步骤和注意事项,培养无菌操作意识 二、实验原理: 细胞培养:多细胞生物,以细胞分裂的方式产生新的细胞,用来补充体内衰老和死亡的细胞。移植到体外后,只要条件适合,依然保持着分裂增殖的能力。利用这个原理,将小鼠骨髓基质细胞移植到体外培养。通过一定的纯化方法,从原代细胞得到传代细胞,经过若干代中,部分细胞发生遗传物质的变化成为无限传代的性质,分离得到细胞系。 培养细胞纯化:由于上皮细胞和成纤维细胞对胰蛋白酶的耐受性不同,成纤维细胞先脱壁,利用此道理,采用多次差别消化法将上皮细胞核成纤维细胞分离而达到纯化的目的 三、材料:实验小白鼠 四、药剂及配制:
五、仪器器材: (1)培养皿×3、500ml烧杯×1、棉花、医用解剖器材(剪刀、镊子、解剖刀)、10ml注射器、4号针头、离心管若干、三角瓶若干、25ml卡式瓶若干、滴管、精密pH试纸、0.22μm微孔滤膜、血球细胞计数板、标签纸、油性笔、冻存管(2)超净工作台、CO2培养箱、高速离心机、高压灭菌锅、显微镜、水浴锅、-86℃冰箱
2、无菌工作室及其内物品的消毒灭菌(1)超净工作台 检查超净工作台是否正常;用之前用沾了75%酒精的脱脂棉擦拭,再开30min的紫外照射(2)小件物品 用牛皮纸(报纸)将小件物品(如镊子、解剖刀等)包裹好放进饭盒里,放进灭菌锅,其他物品也一并放入蒸汽灭菌锅内,95KPa、121℃下灭菌30min (3)其他仪器灭菌 3、试剂配制(如上表) 4、器材准备 5、注意: 1) 使用高压灭菌锅时注意正确使用方法,以免引起危险 2) 超净工作室和工作台必须清理干净,以免引起细胞污染 浸泡 ?用5%的盐酸溶液浸泡过夜 刷洗 ?用足量的洗衣粉反复刷洗,将瓶壁上的残渍洗干净 浸酸 ?将干燥后的器皿用重络酸钾溶液(重络酸钾120g:浓硫酸200ml:蒸馏水 1L)浸泡过夜 冲洗 ?将浸酸后的玻璃器皿用自来水冲洗,然后用蒸馏水,最后干燥、待用 第二部分原代培养 器材:解剖刀、剪刀、镊子、平皿、注射器、离心机、血球计数板、15ml离心管×4、培养瓶×2,冰块 试剂:乙醚、D-Hank’s溶液、生理盐水仪器:超净工作台、离心机、显微镜步骤: 1.取样 1) 超净工作台上的物品:灭菌后的解剖刀、剪刀、镊子、注射器、平皿、冰块 2) 将小鼠用乙醚麻醉后引颈处死(用培养皿盛),在盛有75%酒精的烧杯中浸 泡5min。在超净工作台上分离双侧股骨(培养皿下置冰块),在含生理盐水的50mm2玻璃平皿中去除股骨周围肌肉组织(皿下置冰块)。 3) 剪去骺端。用10mL注射器抽取食量D-Hank’s液冲洗骨髓腔,将骨髓冲入 培养瓶。
小鼠骨髓间充质干细胞的目前干细胞培养难点
干细胞培养基的选择 研究背景: 小鼠骨髓间充质干细胞的目前干细胞培养难点。小鼠的骨髓基质细胞成分复杂,间充质干细胞比率低,分离培养有一定的难度。广东医学院的博士研究生陈博士在培养过程中就遇到该问题。他曾成功饲养成人和大鼠骨髓间充质干细胞。但新近培养的小鼠间充质干细胞状态就很差。按照自己的分析:细胞培养操作没有问题,培养条件也不错,试剂来源可靠。问题应该出现在培养基配方上。陈博士以原来的骨髓间充质干细胞培养基为基础,按照导师的提点,修改了配方,但细胞不好不坏。为此他做了两次正交,结果缺总不理想,细胞状态并不稳定。陈博士为此焦头烂额,担心下一步的实验无法进行。经朋友介绍找到百恩维公司的技术支持。 解决方案: 百恩维的干细胞技术专家了解了陈博士的情况,培养技术、取材和试剂来源等,觉得不存在大问题;问题主要的原因是培养基的成分配比。建议陈博士重新配制培养基或使用现成的完全培养基。陈博士为了加快实验进度,直接选用了百恩维小鼠骨髓间充质干细胞培养基。 选用产品:小鼠间充质干细胞培养基(Catalog No.BW110014) 实施步骤: 1、使用百恩维的小鼠间充质干细胞培养基,进行原代的取材; 2、同样时间下,百恩维的培养基的MSC细胞状态明显优于自己配置的培养液; 3、经过传代,细胞的状态和增殖能力都很好; 4、成功获得了足够进行下一步实验所需的mouse MSC。 结果分析:细胞状态良好,成梭状、紧密分布,大小较均匀。目前已经传至20代。对于这次走的弯路,陈博士感慨良多。要高效的完成课题实验,就需要转变观念,合理利用和整合现有的各个优势资源,快速达到实验目标。 案例分析:目前成功的间充质干细胞培养液主要包含DMEM+FBS+谷氨酰胺+双抗。其中FBS的品牌和批次对细胞都会有不同的影响;无菌技术不成熟的新手,或者无菌条件不完善的实验室,最好使用双抗。最后,各成分的配比也有较大影响:大部分间充质干细胞适用低糖,加约10%的FBS等等,对不以寻找配方为目的的干细胞研究人员,我们建议直接使用经过不断优化和严格质量检测的百恩维干细胞培养基,提高科研效率。
