食源性致病菌检验标准操作程序

食源性致病菌检验标准操作程序
福建省疾病预防控制中心
二〇一二年十一月
一、生物样本检验标准操作程序
(一)粪便样本的保存、运送和检测
表1 粪便样本的保存、运送和检测培养条件
培养基目标病原体温度
细菌标本保
存和运送
1. Cary-Blair 所有食源性致病菌室温
增菌液 1. 改良磷酸盐缓冲液小肠结肠炎耶尔森氏菌 4 ℃
2. mEC增菌肉汤EHEC O157:H7/STEC 37 ℃
3. Preston肉汤弯曲菌微需氧42 ℃
4. SBG增菌液沙门氏菌37 ℃
5. 3%氯化钠碱性蛋白胨水弧菌37 ℃
选择性分离平板1. Mac平板EPEC、STEC、ETEC、EIEC、
EAEC、志贺氏菌
37 ℃
2. XLD平板志贺氏菌37 ℃
3. mCCD平板弯曲菌微需氧42 ℃
4. 耶尔森氏菌选择性平板小肠结肠炎耶尔森氏菌25 ℃
5. 科玛嘉O157:H7显色平板EHEC O157:H7 37 ℃
6. 科玛嘉沙门氏菌显色平板沙门氏菌37 ℃
7. 科玛嘉弧菌显色平板
TCBS平板
弧菌37 ℃
病毒标本 1. 采便盒轮状病毒、诺如病毒、札如
病毒、星状病毒、腺病毒
-20 ℃以下
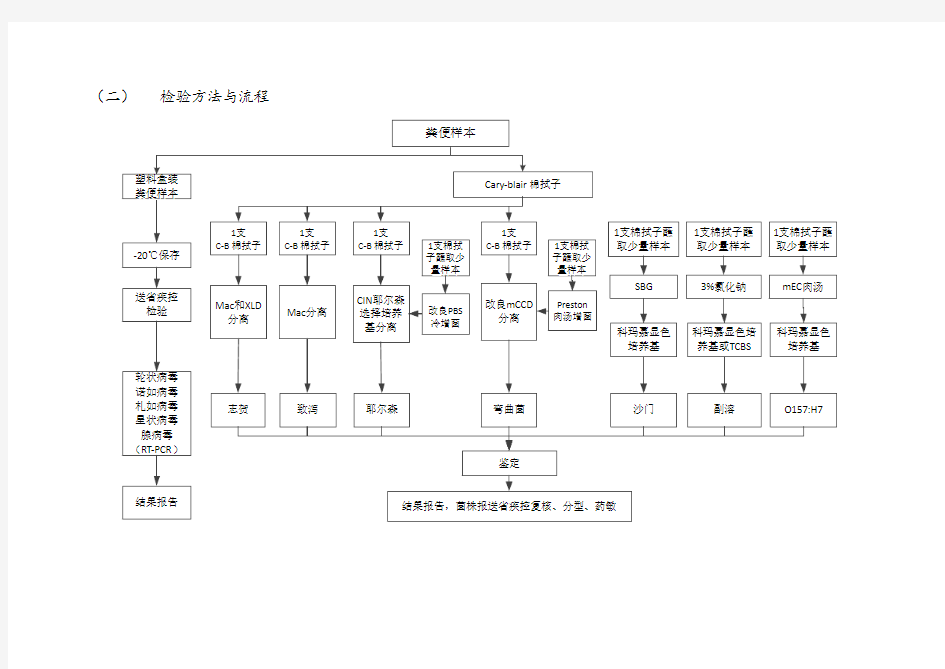
(二)检验方法与流程
(三)沙门氏菌和志贺氏菌检测操作程序
1 范围
本程序规定了粪便标本中沙门氏菌(Salmonella)和志贺氏菌(Shigella)的检验方法。
2 检验程序
沙门氏菌和志贺氏菌检验程序见图1。
图1 沙门氏菌和志贺氏菌检验程序
3 操作步骤
3.1 标本收集
标本包括新鲜的或转移至Cary-Blair运送培养基的粪便或肛拭子。最优标本是转移至Cary-Blair运送培养基的粪便拭子。肛拭子不是最佳标本,仅在病人无粪便标本时采用。肛拭子收集后应当目测,需要在拭子上明显见到粪便。
所采集的标本尽快检验,放入Cary-Blair运送培养基中的标本应在冷藏条件下24 h内送检。新鲜的粪便标本置于清洁、干燥、无肥皂或消毒液残留的容器中,冷藏条件下8 h 内送检。
3.2 分离培养
3.2.1 直接分离培养
新鲜粪便:无菌拭子采集少量粪便,尽量从可见血或黏液的部位收集;新鲜拭子在XLD 和MAC一区划线;以1 μL无菌接种环或接种针划线分离。在标本中再插入一个清洁的无菌拭子,将拭子放入SBG增菌液。轻拧管盖。注意:拭子表面有一层标本即可,不可将过量的标本放入SBG增菌液。
肛拭子:操作程序同新鲜粪便。
转移至Cary-Blair运送培养基的粪便拭子:轻搅混合标本;拭子在XLD和MAC一区划线;以1 μL无菌接种环或接种针划线分离;在标本中再插入一个清洁的无菌拭子,将拭子放入SBG增菌液。轻拧管盖。注意:拭子表面有一层标本即可,不可将过量的标本放入SBG增菌液。
平板36 ℃±1 ℃培养18 h~24 h。
3.2.2 增菌培养
增菌液于36 ℃±1 ℃培养18 h~24 h,采用上述方法于科玛嘉沙门氏菌显色平板上划线分离,36 ℃±1 ℃培养18 h~24 h。
3.3 菌落特征
3.3.1 选择性平板上可疑菌落的特征见表1。
表1沙门氏菌属和志贺氏菌属在不同选择性琼脂平板上的菌落特征
选择性琼脂平板
沙门氏菌
(大多数)
伤寒沙门氏菌志贺氏菌属
MAC琼脂菌落光滑、无色,直
径2 mm~3 mm XLD琼脂菌落呈红色,直径2
mm~4 mm
科玛嘉显
色培养基
紫色或酒红色紫色或酒红色
3.4 纯培养
挑取3个或以上可疑菌落,划线接种5%羊血琼脂平板,36 ℃±1 ℃培养18 h~24 h。
3.5 初步鉴定
可疑菌落接种TSI琼脂,赖氨酸脱羧酶培养基、动力-靛基质-鸟氨酸琼脂(MIO)、西蒙氏柠檬酸盐琼脂和尿素琼脂。沙门氏菌属和志贺氏菌属生化反应初步鉴别见表2。
表2沙门氏菌属和志贺氏菌属生化反应初步鉴别表
挑取5%羊血琼脂平板上的菌落,进行沙门氏菌和志贺氏菌的血清学鉴定,设盐水对照。
3.7 确定鉴定
刮取5%羊血琼脂平板上的单个菌落,进行系统生化鉴定。
4 结果与报告
报告粪便标本中检出沙门氏菌或志贺氏菌。
5 菌株的保存和上送
培养物穿刺接种半固体培养基,轻拧管盖,36 ℃±1 ℃培养24 h,盖紧管盖。如果需要长期保存菌株,将0.7 mL 脑心浸液肉汤6 h~12 h培养物和0.3 mL 灭菌甘油加入灭菌菌种管,立即放置-70 °C保存。按照方案要求定期上送。
(四)致泻大肠埃希氏菌检测操作程序
1 范围
本程序规定了粪便标本中致泻大肠埃希氏菌(Diarrheagenic Escherichia coli)的检验方法。
2 操作步骤
2.1 标本收集
标本包括新鲜的或转移至Cary-Blair运送培养基的粪便或肛拭子。最优标本是转移至Cary-Blair运送培养基的粪便拭子。肛拭子不是最佳标本,仅在病人无粪便标本时采用。肛拭子收集后应当目测,需要在拭子上明显见到粪便。
所采集的标本尽快检验,放入Cary-Blair运送培养基中的标本应在冷藏条件下24 h内送检。新鲜的粪便标本置于清洁、干燥、无肥皂或消毒液残留的容器中,冷藏条件下8 h
内送检。
2.2 直接分离培养
新鲜粪便:无菌拭子采集少量粪便,尽量从可见血或黏液的部位收集;新鲜拭子在MAC 一区划线;以1 μL无菌接种环或接种针划线分离。
肛拭子:操作程序同新鲜粪便。
转移至Cary-Blair运送培养基的粪便拭子:轻搅混合标本;拭子在MAC一区划线;以1 μL无菌接种环或接种针划线分离。
平板36 ℃ 1 ℃培养18 h~24 h。
2.3 菌落特征
挑取5个可疑大肠埃希氏菌菌落(粉红色、突起、光滑、湿润)直接保存半固体菌种管;采用PCR检测特异毒力基因方法鉴别5种致泻大肠埃希氏菌。
3 多重PCR鉴定
3.1 标准菌株
标准菌株一览表见表3。
表3标准菌株一览表
菌株名称标准号来源
EPEC CMCC 44155 中国食品药品检定研究院
STEC 具有stx1、stx2毒力基因中国疾病预防控制中心传染病所ETEC CMCC 44815 中国食品药品检定研究院
EIEC CMCC 44825 中国食品药品检定研究院
EAEC 042血清型中国疾病预防控制中心传染病所大肠埃希氏菌ATCC 25922 WHO
3.2 引物合成
多重PCR引物序列见表4。
表4五种致泻大肠埃希氏菌目的基因引物序列
目标菌目标基因引物序列片段大小(bp)
EPEC、STEC escV–F 5′-ATT CTG GCT CTC TTC TTC TTT ATG GCT G-3′544 escV–R 5′-CGT CCC CTT TTA CAA ACT TCA TCG C-3′
EPEC bfpB–F 5′-GAC ACC TCA TTG CTG AAG TCG-3′910 bfpB–R 5′-CCA GAA CAC CTC CGT TAT GC-3′
STEC stx1A–F 5′-CGA TGT TAC GGT TTG TTA CTG TGA CAG C-3′244 stx1A–R 5′-AAT GCC ACG CTT CCC AGA ATT G-3′
stx2A–F 5′-GTT TTG ACC ATC TTC GTC TGA TTA TTG AG-3′324
stx2A–R 5′-AGC GTA AGG CTT CTG CTG TGA C-3′
ETEC Elt–F 5′-GAA CAG GAG GTT TCT GCG TTA GGT G-3′655 Elt–R 5′-CTT TCA ATG GCT TTT TTT TGG GAG TC-3′
estIa–F 5′-CCT CTT TTA GYC AGA CAR CTG AAT CAS TTG-3′157
estIa–R 5′-CAG GCA GGA TTA CAA CAA AGT TCA CAG-3′
estIb–F 5′-TGT CTT TTT CAC CTT TCG CTC-3′171
estIb–R 5′-CGG TAC AAG CAG GAT TAC AAC AC-3′
EIEC invE–F 5′-CGA TCA AGA ATC CCT AAC AGA AGA ATC AC-3′766 invE–R 5′-CGA TAG ATG GCG AGA AAT TAT ATC CCG-3′
EAEC astA–F 5′-TGC CAT CAA CAC AGT ATA TCC G-3′102 astA–R 5′-ACG GCT TTG TAG TCC TTC CAT-3′
aggR–F 5′-ACG CAG AGT TGC CTG ATA AAG-3′400
aggR–R 5′-AAT ACA GAA TCG TCA GCA TCA GC-3′
Pic–F 5′-AAA TGT CAG TGA ACC GAC GAT TGG-3′1111
Pic–R 5′-AGC CGT TTC CGC AGA AGC C-3′
通用uidA–F 5′-AAA GTG TGG GTC AAT AAT CAG GAA GTG-3′1487 uidA–R 5′-ATG CCA GTC CAG CGT TTT TGC-3′
3.3 标本处理
刮取营养平板上的过夜新鲜培养物1环~2环,至装有 1 mL0.85%灭菌生理盐水的Eppendorf管内,混匀。4 ℃~8 ℃,12 000 r/min离心15 min,弃去上清。沉淀加入100 μL
灭菌去离子水中,混匀。100 ℃煮沸12 min,12 000 r/min离心5 min,上清即为PCR扩增
模板,可直接用于PCR反应。
3.4 多重PCR
五种致泻大肠埃希氏菌目的基因多重PCR扩增加样体系见表5。PCR反应条件:预变
性94 ℃ 5 min。变性94 ℃30 s,复性63 ℃30 s,延伸72 ℃ 1.5 min,30个循环。最
后72 ℃延伸5 min。
表5五种致泻大肠埃希氏菌目的基因多重PCR扩增加样体系
试剂加样体积(μL)
dH2O 8.3
10×PCR Buffer 2.5
25 mM MgCl2 2.5
2.5 mM dNTPs
3.0
25 μM escV–F 0.4
25 μM escV–R 0.4
25 μM bfpB–F 0.1
25 μM bfpB–R 0.1
25 μM stx1A–F 0.2
25 μM stx1A–R 0.2
25 μM stx2A–F 0.4
25 μM stx2A–R 0.4
25 μM elt–F 0.1
25 μM elt–R 0.1
25 μM estIa–F 0.4
25 μM estIa–R 0.4
25 μM estIb–F 0.2
25 μM estIb–R 0.2
25 μM invE–F 0.2
25 μM invE–R 0.2
25 μM astA–F 0.4
25 μM astA–R 0.4
25 μM aggR–F 0.2
25 μM aggR–R 0.2
25 μM pic–F 0.2
25 μM pic–R 0.2
25 μM uidA–F 0.2
25 μM uidA–R 0.2
3 U/μL Taq酶0.7
DNA模板 2.0
3.5 检测结果的判定
取5 μL PCR扩增产物在2%琼脂糖凝胶上电泳。根据特异性核酸条带大小和数目判断致泻大肠埃希氏菌的种类。见图2。
图2 种致泻大肠埃希氏菌目的基因多重PCR扩增片段
注:图中标示EPEC、EHEC(STEC)、ETEC、EIEC、EAEC的泳道为反应体系中仅存在相应的一种模板和12对引物同时扩增后出现的片段,而MIX泳道为将五种致泻大肠埃希氏菌混合后与12对引物同时扩增后出现的片段。
4 血清学鉴定
4.1 挑取PCR扩增阳性菌种,营养平板分离,36 ℃±1 ℃培养过夜。
4.2 根据PCR鉴定结果,用相应致病大肠血清O多价、单价、K、H诊断血清进行血清玻片凝集试验进行诊断。见表6。
表6常见致泻大肠埃希氏菌的O血清群及血清型
婴幼儿腹泻成人和儿童腹泻
EPEC ETEC EIEC STEC EAEC
O20O26O44O6:K15:H16O8:K40:H9O28ac O157:H7O9:K99
O55O86O111O8:K25:H9O8:H47:H-O112O26:K62:H11O101:K99 O114 O119O125O11:H27O15:H11O124O111
O126 O127 O128O20:H-O25:K7:H42O136O103
O142O158O25:K98:H-O27:H7O143O145
O27:H20O63:H12O144O104
O73:H45O78:H11O152
O78:H12O85:H7O164
O114:H21O115:[H51]1)
O127:H12O128:H7
4.3 报告血清学实验结果。
5 生化鉴定
5.1 对PCR阳性、血清学可分型及不可分型菌株进行系统生化鉴定。
5.2 报告最终鉴定结果。
6 菌株保存和上送
4 ℃或室温保存的半固体培养基保菌菌种至少2套(穿刺接种后36 ℃培养过夜即可)或30%甘油肉汤冻存管-70 ℃保存菌株至少2套。按照要求定期上送。
(五)大肠埃希氏菌O157:H7检测操作程序
1 范围
本程序规定了粪便标本中大肠埃希氏菌O157:H7(Escherichia coli O157:H7)的检验方法。
2 检验程序
大肠埃希氏菌O157:H7检验程序见图3。
图3 大肠埃希氏菌O157:H7检验程序
3 操作步骤
3.1 标本收集
标本包括新鲜的或转移至Cary-Blair运送培养基的粪便或肛拭子。最优标本是转移至Cary-Blair运送培养基的粪便拭子。肛拭子不是最佳标本,仅在病人无粪便标本时采用。肛拭子收集后应当目测,需要在拭子上明显见到粪便。
所采集的标本尽快检验,放入Cary-Blair运送培养基中的标本应在冷藏条件下24 h内送检。新鲜的粪便标本置于清洁、干燥、无肥皂或消毒液残留的容器中,冷藏条件下8 h 内送检。
3.2 增菌培养
增菌液采用添加20 mg/L新生霉素的改良EC肉汤(mEC)。将采集的一支便拭子1:10
接种于6 mL mEC肉汤,36 ℃±1 ℃恒温摇床增菌培养6 h(如无摇床,36 ℃±1 ℃恒温增菌培养9 h~12 h)。
3.3 大肠埃希氏菌O157:H7胶体金试纸快速筛查
3.3.1 将胶体金试纸从袋中取出,平放于洁净、干燥的工作台上,编号;
3.3.2 用加样器吸取样品增菌液150 μL,加入检测卡一端的加样孔;
3.3.3 2 min~20 min内读取结果。阴性样品在视窗上部出现一条单一的红色对照线,这表明试剂已正确流动且检测过程已发生。阳性样品将显示两条红色带,这表明检出O157抗原。如果红色条带出现,实验失败,应考虑重做。
3.4 免疫磁珠集菌
将O157胶体金试纸呈阳性的mEC增菌肉汤,进行免疫磁珠集菌。
3.4.1 取下磁铁板,将编好号的1.5 mL的Eppendorf离心管,置入Dynal MPC-M架上。
3.4.2 轻柔混匀抗O157免疫磁珠(反复颠倒,直到管底沉淀完全消失),吸取抗O157
免疫磁珠,置入每只编号的Eppendorf离心管中20 μL。
3.4.3 取胶体金试纸阳性增菌培养物1 mL,加入上述对应的Eppendorf离心管中。盖紧盖子。轻轻颠倒混匀。
3.4.4 置于Dynal MX3旋转培养器上,室温下,旋转30 min(如果没有旋转器,可人工旋转)。
3.4.5 将磁铁板插入Dynal MPC-M管架中,反复颠倒数次,将抗O157免疫磁珠吸附沉淀在Eppendorf离心管壁上。吸去上清(包括残留在管盖上的液体),并弃掉。
3.4.6 将磁铁板从Dynal MPC-M架抽出。每只Eppendorf离心管中加入1 mL PBS-Tween20(PH7.4),轻轻颠倒混匀,重新悬浮免疫磁珠。
3.4.7 重复3.4.5~3.4.6步骤
3.4.8 重复3.4.5步骤。
3.4.9 用50 μL PBS-Tween20 重新悬浮免疫磁珠细菌混合物。
3.5 接种选择性平板
将50 μL免疫磁珠细菌混合物用接种环划线或L棒涂布分别接种于O157:H7科玛嘉显色平板或山梨醇麦康凯平板(SMAC)各一块,36 ℃±1 ℃培养18 h~24 h;
在SMAC平板上O157:H7菌落应为扁平、透明或半透明、表面光滑湿润、不发酵山梨醇乳白色菌落,极少部分迟缓发酵山梨醇,呈红色。边缘光滑,直径约2 mm。在O157:H7科玛嘉显色培养基上呈淡紫色或紫红色菌落。
3.6 初步鉴定
对疑似菌落染色为革兰阴性杆菌者,在上述平板挑取疑似菌落10~20个,转种克氏双糖(KIA)培养基,36 ℃±1 ℃培养16 h~20 h。如其生长性状为葡萄糖(+)、乳糖(+)、产气(+)、硫化氢(-)者。
3.7 诊断血清凝集试验
可疑菌株可用大肠埃希氏菌O157抗血清和O157单克隆抗体进行玻片凝集,凝集强度达(+++),再用H7抗血清凝集鉴定。同时设盐水做对照。上述,冷冻,真空抽干,并于真空状态下封口保存。若患者不能自然排除O157:H7与肠杆菌科的某些菌种存在抗原交叉现象,例如:弗劳地柠檬酸杆菌、赫尔曼埃希氏菌、沙门氏菌、小肠结肠炎耶尔森氏菌等,一般可通过单克隆抗体解决,但弗劳地枸椽酸杆菌与O157:H7的O抗原交叉反应用单克隆抗体也无法辨别,只可通过检测O抗原编码基因鉴别。
3.8 API 20E生化鉴定试剂盒
采用API 20E生化鉴定试剂盒进行鉴定,生化反应编码:大多为5144172,极少数为1144172或5144162。
4 菌株保存和定期上送
4 ℃或室温保存的半固体培养基保菌菌种至少2套(穿刺接种后36 ℃培养过夜即可)或30%甘油肉汤冻存管-70 ℃保存菌株至少2套。按照方案要求定期上送。
5 多重PCR毒力基因鉴定
PCR扩增O157、H7编码基因,并且检测stx1、stx2、hly、eae毒力基因。典型的造成人类感染的大肠埃希氏菌O157:H7为O157+、H7+,并且携带志贺毒素、溶血素与粘附抹平因子:stx1+、stx2+、hly+、eae+,我国大部分O157:H7菌株不携带stx1,为stx1-、stx2+、hly+、eae+。
多重PCR各对引物序列见表7。
表7多重PCR毒力基因鉴定的引物
目标基因引物序列片段大小(bp)
180 stx1 F 5'-ATA AAT CGC CAT TCG TTG ACT AC-3'
R 5'-AGA ACG CCC ACT GAG ATC ATC-3'
255 stx2 F 5'-GGC ACT GTC TGA AAC TGC TCC-3'
R 5'-TCG CCA GTT ATC TGA CAT TCT-3'
384 eaeA F 5'-GAC CCG GCA CAA GCA TAA GC-3'
R 5'-CCA CCT GCA GCA ACA AGA GG-3'
534 hlyA F 5'-GCA TCA TCA AGC GTA CGT TCC-3’
R 5'-AAT GAG CCA AGC TGG TTA AGC T-3’
259 rfb O157 F 5'-CGG ACA TCC A TG TGA TAT GG-3’
R 5'-TTG CCT A TG TAC AGC TAA TCC-3’
5.1 模板DNA提取:用热裂解法,将纯化的可疑菌株接种5 mL营养肉汤,36 ℃±1 ℃培养6 h或过夜,10 000 r/min离心5 min,弃上清;加入1 mL生理盐水,震荡分散细菌,10 000 r/min离心5 min,弃上清;沉淀加100 μL无菌蒸馏水,重新震荡悬浮后置100 ℃水浴10 min;
10 000 r/min离心5 min,上清用于PCR扩增。阳性和阴性对照分别为我们保存的产志贺氏毒素1和2的大肠埃希氏菌O157:H7和不具备上述6种基因的大肠埃希氏菌,同法制备。
5.2 多重PCR反应体系:模板DNA提取液5 μL,10×PCR 缓冲液5 μL,分别加终浓度1.5 mMMgCl2,0.2 mM dNTP,每种引物500 nM,Taq DNA聚合酶1.5 μL,最后加无菌蒸馏水至总体积50 μL。
5.3 多重PCR反应条件:除变性温度由95 ℃改为94 ℃和增加最后72 ℃延伸外,均按Paton法。1~10循环,94 ℃1 min变性;65 ℃2 min退火;72 ℃1.5 min延伸。11~25循环,94 ℃1 min;60 ℃2 min;72 ℃ 1.5 min。26~35循环,94 ℃1 min;65 ℃ 2 min;
72 ℃2.5 min。最后72 ℃10 min。
5.4 扩增产物用含EB(0.5 μg/mL)的2%琼脂糖电泳,阳阴性对照正常,紫外灯下观察结果,照相记录。
(六)副溶血性弧菌检验操作程序
1 范围
本程序规定了粪便标本中副溶血性弧菌(Vibrio parahaemolyticus)的检验方法。
2 检验程序
副溶血性弧菌检验程序见图4。
3 操作步骤
3.1 标本收集
标本包括新鲜的或转移至Cary-Blair运送培养基的粪便或肛拭子。最优标本是转移至Cary-Blair运送培养基的粪便拭子。肛拭子不是最佳标本,仅在病人无粪便标本时采用。肛拭子收集后应当目测,需要在拭子上明显见到粪便。
所采集的标本尽快检验,放入Cary-Blair运送培养基中的标本应在室温条件下24 h内送检。新鲜的粪便标本置于清洁、干燥、无肥皂或消毒液残留的容器中,室温条件下8 h 内送检。
3.2 分离培养
新鲜粪便:无菌拭子采集少量粪便,将拭子放入3%氯化钠碱性蛋白胨水。轻拧管盖。注意:拭子表面有一层标本即可,不可将过量的标本放入碱性蛋白胨水。
肛拭子:操作程序同新鲜粪便。
转移至Cary-Blair运送培养基的粪便拭子:轻搅混合标本;将拭子放入3%氯化钠碱性蛋白胨水。轻拧管盖。注意:拭子表面有一层标本即可,不可将过量的标本放入碱性蛋白胨水。
碱性蛋白胨水于36 ℃±1 ℃培养12 h~16 h,于TCBS平板或科玛嘉弧菌显色培养基平板上划线分离,36 ℃±1 ℃培养18 h~24 h。
3.3 菌落特征
典型的副溶血性弧菌在TCBS上呈圆形、半透明、表面光滑的绿色菌落,用接种环轻触,有类似口香糖的质感,直径2 mm~3 mm。从培养箱取出TCBS平板后,应尽快(不超过1 h)挑取菌落或标记要挑取的菌落。典型的副溶血性弧菌在科玛嘉弧菌显色培养基上呈圆形、半透明、表面光滑的粉紫色菌落,直径2 mm~3 mm。
3.4 纯培养
挑取3个或以上可疑菌落,划线接种3%氯化钠胰蛋白胨大豆琼脂平板,36 ℃±1 ℃培养18 h~24 h。
3.5 初步鉴定
3.5.1 氧化酶试验:挑选纯培养的单个菌落进行氧化酶试验,副溶血性弧菌为氧化酶阳性。
3.5.2 挑取纯培养的单个可疑菌落,转种3%氯化钠三糖铁琼脂斜面并穿刺底层,36 ℃
±1 ℃培养24 h观察结果。副溶血性弧菌在3%氯化钠三糖铁琼脂中的反应为底层变黄不变黑,无气泡,斜面颜色不变或红色加深,有动力。
3.5.3 嗜盐性试验:挑取纯培养的单个可疑菌落,分别接种0%、6%、8%和10%不同氯化钠浓度的胰胨水,36 ℃±1 ℃培养24 h,观察液体混浊情况。副溶血性弧菌在无氯化钠和10%氯化钠的胰胨水中不生长或微弱生长,在6%氯化钠和8%氯化钠的胰胨水中生长旺盛。
3.6 确定鉴定
刮取3%氯化钠胰蛋白胨大豆琼脂平板上的单个菌落,进行系统生化鉴定试剂盒鉴定。
4 血清学分型
4.1 制备:接种两管3%氯化钠胰蛋白胨大豆琼脂试管斜面,36 ℃±1 ℃培养18 h~24 h。用含3%氯化钠的5%甘油溶液冲洗3%氯化钠胰蛋白胨大豆琼脂斜面培养物,获得浓厚的菌悬液。
4.2 K抗原的鉴定:取一管上述制备好的菌悬液,首先用多价K抗血清进行检测,出现凝集反应时再用单个的抗血清进行检测。用蜡笔在一张玻片上划出适当数量的间隔和一个对照间隔。在每个间隔内各滴加一滴菌悬液,并对应加入一滴K抗血清。在对照间隔内加一滴3%氯化钠溶液。轻微倾斜玻片,使各成分相混合,再前后倾动玻片1 min。阳性凝集反应应可以立即观察到。
4.3 O抗原的鉴定:将另外一管的菌悬液转移到离心管内,121 ℃高压1 h。高压后4 000 r/min离心15 min,弃去上层液体,沉淀用生理盐水洗三次,每次4 000 r/min离心15 min,最后一次离心后留少许上层液体,混匀制成菌悬液。用蜡笔将玻片划分成相等的间隔。在每个间隔内加入一滴菌悬液,将O群血清分别加一滴到间隔内,最后一个间隔加一滴生理盐水作为自凝对照。轻微倾斜玻片,使各成分相混合,再前后倾动玻片1 min。阳性凝集反应应可以立即观察到。如果未见到与O群血清的凝集反应,将菌悬液121 ℃再次高压1 h 后,重新检测。如果仍旧为阴性,则培养物的O抗原属于未知。根据表8报告血清学分型
结果。
表8副溶血性弧菌的抗原
5 PCR毒力基因鉴定
PCR法检测tdh(耐热直接溶血素基因)和trh(TDH相关溶血素基因)毒力基因,引物序列见表9。
5.1 模板DNA提取:自TCBS或科玛嘉弧菌显色平板上挑取3个可疑菌落,划线含3%氯化钠的胰蛋白胨大豆琼脂平板。纯化菌株在含3%氯化钠的脑心浸液肉汤中36 ℃±1 ℃过夜生长,10 000×g离心10 min。沉淀用无菌生理盐水洗涤2次,重新悬浮于双蒸水中,煮沸10 min。细菌裂解物立即用于PCR或-20 ℃保存备用。
5.2 PCR反应体系中包括含DNA的细菌裂解物2 μL,20 μmol/L的引物贮存液各1 μL,dNTP 贮存液(各种dNTP的浓度为2.5 mmol/l)1 μL,Taq聚合酶0.3 μL(TaKaRa),10×PCR缓冲液5 μL,总体积50 μL。
5.3 反应体系94 ℃预变性5 min。PCR的循环条件见表9。反应体系72 ℃再延伸5 min。所有反应均设立阳性对照和阴性DNA对照。PCR产物在2%的琼脂凝胶中120 V电泳,EB 染色,照相。
5.4 PCR产物在2%的琼脂凝胶中120 V电泳,EB染色,照相。
表9鉴定致病性副溶血性弧菌的引物
目标基因引物序列片段大小
(bp)PCR条件循环
次数
tdh基因TDH-1: 5′-AGC TTC CAT CTG TCC CTT TT-3′TDH-2: 5′-ATT ACC ACT ACC ACT CTC A TA-3′434 94 ℃1 min
55 ℃1 min
72 ℃1 min
30
trh基因R2: 5′-GGC TCA AAA TGG TTA AGC G-3′R6: 5′-CAT TTC CGC TCT CAT ATG C-3′250 94 ℃1 min
55 ℃1 min
30
72 ℃1 min
6 结果与报告
当检出的可疑菌落生化性状符合表10要求时,报告粪便标本中检出副溶血性弧菌。副溶血性弧菌主要性状与其他弧菌的鉴别见表11。
7 菌株的保存和上送
培养物穿刺接种3%氯化钠半固体培养基,轻拧管盖,36 ℃±1 ℃培养24 h,盖紧管盖。也可以在动力试验培养基24 h培养物上加入一层灭菌矿物油。室温贮存培养物,不要冷藏。如果需要长期保存菌株,将0.7 mL 3%氯化钠脑心浸液肉汤6 h~12 h培养物和0.3 mL 灭菌甘油加入灭菌菌种管,立即放置-70 °C保存。按照方案要求定期上送。
表10副溶血性弧菌的生化性状
1 范围
本程序规定了粪便标本中小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)的检验方法。
2 检验程序
小肠结肠炎耶尔森氏菌检验程序见图5。
图5 小肠结肠炎耶尔森氏菌检验程序
3 操作步骤
3.1 标本收集
标本包括新鲜的或转移至Cary-Blair运送培养基的粪便或肛拭子。最优标本是转移至Cary-Blair运送培养基的粪便拭子。肛拭子不是最佳标本,仅在病人无粪便标本时采用。肛拭子收集后应当目测,需要在拭子上明显见到粪便。
所采集的标本尽快检验,放入Cary-Blair运送培养基中的标本应在冷藏条件下24 h内送检。新鲜的粪便标本置于清洁、干燥、无肥皂或消毒液残留的容器中,冷藏条件下8 h
内送检。
3.2 分离培养
3.2.1 直接分离培养
新鲜粪便:无菌拭子采集少量粪便;新鲜拭子在CIN耶尔森氏菌选择性平板一区划线;以1 μL无菌接种环或接种针划线分离。在标本中再插入一个清洁的无菌拭子,将拭子放入改良PBS增菌液。轻拧管盖。注意:拭子表面有一层标本即可,不可将过量的标本放入改良磷酸盐增菌液。
肛拭子:操作程序同新鲜粪便。
转移至Cary-Blair运送培养基的粪便拭子:轻搅混合标本;拭子在CIN耶尔森氏菌选择性平板一区划线;以1 μL无菌接种环或接种针划线分离;在标本中再插入一个清洁的无菌拭子,将拭子放入改良磷酸盐增菌液。轻拧管盖。注意:拭子表面有一层标本即可,不可将过量的标本放入改良PBS增菌液。
平板25 ℃培养24 h~48 h。
3.2.2 增菌培养
取约1 g粪便标本接种于10 mL改良磷酸盐缓冲液,于4 ℃分别增菌培养7 d、14 d和21 d后取增菌培养物转种CIN耶尔森氏菌选择性平板,25 ℃培养24 h~48 h。
3.3 菌落特征
典型的小肠结肠炎耶尔森氏菌在CIN耶尔森氏菌选择性培养基上呈较小的湿润菌落,直径约1 mm~2 mm。中心呈深玫瑰红色,凸起较尖锐,周围有明显透明环,称“公牛眼”。
3.4 纯培养
挑取3个或以上可疑菌落,划线接种营养琼脂平板,25 ℃培养24 h。
3.5 初步鉴定
3.5.1 糖分解试验:挑取可疑菌落接种改良克氏双糖斜面(用甘露醇取代乳糖),25 ℃培养24 h~48 h。挑选斜面/底层均变黄(A/A),不产H2S,不产气(可能有微量气体,小泡,但不会将培养基顶裂或顶起)的菌株进一步鉴定。
3.5.2 尿素分解试验:刮取斜面上大量菌苔,浓厚接种于尿素培养基,震荡均匀,25 ℃培养2 h~4 h,变红色者为尿素酶阳性,进一步检测动力。菌量少及其他未变色的菌株观察至24 h。
3.5.3 动力试验:将尿素酶阳性菌株接种于2管半固体,分别置于25 ℃与36 ℃±1 ℃培养24 h。选取26 ℃动力(+)且36 ℃±1 ℃动力(-)的菌株,进行系统生化鉴定。
3.6 确定鉴定
刮取胰蛋白胨大豆琼脂平板上的单个菌落,进行系统生化鉴定。
4 血清学分型
使用致病性菌株常见血清型(我国一般为O:3、O:8、O:9型)的特异性单克隆抗体进行玻片凝集,进行血清分型。
5 PCR毒力基因鉴定
PCR法检测小肠结肠炎耶尔森氏菌ail(粘附侵袭位点基因)、ystA(耐热性肠毒素A)、ystB(黏附素基因)、virF(毒力因子基因)毒力基因,引物序列见表12。O:3血清型菌株rfbC扩增结果为阳性(rfbC+)。典型的致病性菌株的毒力基因的分布为ail+、ystA+、yadA+、virF+、ystB-。传统意义上的致病性菌株不携带ystB,非致病性菌株不携带ail、ystA、yadA、virF。
5.1 自营养琼脂平板上挑取适量菌苔(200 μL枪头尖大小),悬浊于100 μL超纯水,-80℃或液氮速冻30 min(-20 ℃冷冻延长时间也可)后迅速沸水浴20 min~30 min,12 000 r/min 离心5 min,取上清液用做模板。小肠结肠炎耶尔氏森菌能产生一种耐热DNA酶,水煮不能使其失活。因此,水煮模板应尽快使用(一般不要超过7 d;如果是扩增ystA等小片段,最好使用新鲜制备模板,可信度较高),-20 ℃保存,并且避免反复冻融。
5.2 PCR反应体系中包括含DNA的细菌裂解物2 μL,20 μmol/l的引物贮存液各1 μL,dNTP 贮存液(40 mmol/μL)1.6 μL,5 U/μL的Taq聚合酶0.2 μL,含Mg2+的10×PCR缓冲液2 μL,总体积20 μL。
5.3 反应体系94 ℃预变性5 min。PCR的循环条件见表12。反应体系72 ℃再延伸5 min。
5.4 所有反应均设立阳性对照和阴性DNA对照。PCR产物在2%的琼脂凝胶中120 V电泳,EB染色,照相。
表12鉴定小肠结肠炎耶尔森氏菌毒力基因的引物
目的基因引物序列片段大小
(bp)
PCR条件循环次数
ail Ail-F: 5′-TAA TGT GTA CGC TGC GAG-3′Ail-R: 5′-GAC GTC TTA CTT GCA CTG-3′351 94 ℃15 s
57 ℃30 s
72 ℃30 s
25
ystA YstA-F: 5′-ATC GAC ACC AAT AAC CGC TGA G-3′YstA-R: 5′-CCA ATC ACT ACT GA CTT CGG CT-3′79 94 ℃15 s
61 ℃30 s
72 ℃30 s
25
ystB YstB-F: 5′-GTA CAT TAG GCC AAG AGA CG-3′YstB-R: 5′-GCA ACA TAC CTC ACA ACA CC-3′146 94 ℃15 s
61 ℃30 s
72 ℃30 s
25
yadA YadA-F: 5′-CTT CAG ATA CTG GTG TCG CTG T-3′YadA-R: 5′-ATG CCT GAC TAG AGC GAT ATC C-3′849/759* 94 ℃15 s
60 ℃30 s
72 ℃30 s
25
virA VirF-F: 5′-GGC AGA ACA GCA GTC AGA CAT A-3′VirF-R: 5′-GGT GAG CAT AGA GAA TAC GTC G-3′561 94 ℃15 s
63 ℃30 s
72 ℃30 s
25
rfbC RfbC-F: 5′-CGC ATC TGG GAC ACT AAT TCG-3′
RfbC-R: 5′-CCA CGA ATT CCA TCA AAA CCA CC-3′405 94 ℃15 s
55 ℃30 s
72 ℃30 s
25
注:*表示O:8血清型小肠结肠炎耶尔森氏菌扩增产物片段大小。
6 结果与报告
报告粪便标本中检出或未检出小肠结肠炎耶尔森氏菌。
7 菌株的保存和上送
食品致病菌检测
食品致病菌快速检测技术 时间:2004-05-11 10:24:00 来源:食品商务网 沙门氏菌、李斯特氏菌、大肠杆菌O157、弯曲杆菌等食物致病菌已成为危害食品安全的头号杀手。如何快速而准确地检测这些致病菌,是有效遏制这些杀手、确保食品安全的首要任务。 常规食品微生物检测方法包括反复增菌、菌落分离及多种生化和血清学鉴别实验,不仅步骤复杂,而且耗费时间,难以适应飞速发展的现代食品生产和流通领域。因此为了确保食品的安全性,开发快速检测致病菌的方法非常重要。 随着生物、化学、材料科学以及计算机领域的进步,新的快速检测和识别方法层出不穷,这些方法主要包括微量生化试剂盒、抗原-抗体检测、DNA检测,以及常规检测的改进方法。微量生化试剂盒主要用于食品微生物的纯培养的生化鉴别上,与常规方法原理相同。一般是特别针对肠道菌或非肠道菌(如弯曲杆菌、李斯特氏菌、厌氧菌、非发酵性G-菌和G +菌)而设计,采用鉴别某种微生物的多种微量培养基及底物,其结果可人工识读;如结合自动保温、监测并记录设备,再与计算机中储存的数据库比较而自动鉴别的话,则可进行多样品大规模快速检测。 DNA检测方法包括应用探针、PCR技术和噬菌体技术,这些检测方法已商品化。探针检测一般是检测rRNA,因其rRNA在细菌中的高拷贝数,无须扩增,检测灵敏。PCR技术是用小片段的 DNA探针或引物,与特异性模板杂交,并用Taq酶扩增。几次循环后,PCR可以在2h 内扩增单拷贝DNA到1百万倍,所以从理论上说无须增菌培养。但由于食品和培养基中存在的抑制剂,可能阻止引物连接和减低扩增效率,所以在检测食品时,还是需要在检测前先进行增菌培养。应用噬菌体对其宿主的高度专一性的特点,进行食品致病菌的检测的实例就是沙门氏菌的检测,其中所使用的噬菌体经过基因工程改造而携带有可检测标记。如有沙门氏菌存在,此噬菌体将标记带给宿主并表达,从而被检出。 抗体检测方法是利用抗原-抗体的高度专一性结合的特点。由于反应简单和易操作,现已开发了许多方法用于食品检测。最简单的是乳胶凝集(LA),此法采用抗体包埋的有颜色的乳胶珠或胶体金颗粒,用于从食品中分离的纯培养的快速血清学识别或分型,LA的改良方法是反向被动乳胶凝集(RPLA),法常用于检测食品萃取液中的毒素。例如,食品中金黄色葡萄球菌即可采用此法检出:葡萄球菌的表面存在A蛋白,具有种属特异性,该A 蛋白能与人及多种哺乳动物的免疫球蛋白IgG的Fc段结合,因此可采用IgG包埋的乳胶颗粒,结合血浆纤维蛋白原与凝集因子的凝集反应,来检测金葡菌的有无。 酶联免疫分析(ELISA)是食品病原菌检测最常用的抗体分析方法。常设计成“三明治夹心”实验:固体基质上连接抗体,用来捕获增菌培养物中的抗原,与酶相连的第二抗体用于检测。塑料微孔板的侧壁、涂抹棒等检测用具常作为固体基质。在食品微生物检测的国家标准中,金葡菌肠毒素即是采用此法检出的。 免疫沉淀或免疫层析也是采用“夹心法”,但是没有采用酶连接物,而是用耦联在有色乳胶珠或胶体金上的抗体来检测。该方法简便易行,无须洗涤或操作,在获得增菌样品后,短短十来分钟即可完成。现已商品化的李斯特氏菌检测试剂盒即采用此方法。 此外,用含脱水培养基的一次性板卡,以替代传统的琼脂平板;用荧光法检测细菌ATP,以快速在线检测细菌总数;将生色物质和荧光物质加入到培养基内,以快速检测特征酶活力———这些方法,在食品微生物的快速检测中都已成为常用方法。 快速方法的优点是可从大量食品样品中快速筛选某致病菌或毒素。但要注意的是,快速
(完整版)检验方法验证标准操作规程
标准操作规程STANDARD OPERATING PROCEDURE 目的:建立检验方法验证标准操作规程,规范验证操作。 适用范围:所有检验方法的验证。 责任者:质量保证部、质量控制部 程序: 1、检验方法验证的基本内容 检验方法验证的基本内容包括方案的起草及审批,检测仪器的确认.适用性验证(包括准确度试验、精密度测定.线性范围试验、专属性试验等)和结果评价及批准四个欠的方面。它的基本内容可以用下图表示。 2、检验方法验证的基本步骤 首先是制定验证方案,然后对大型精密仪器进行确认,最关键的一步是检验方法的适用性试验,最后是检验方法评价及批准。 2.1验证方案的制定 检验方法的验证方案通常由质量验证小组提出。根据产品的工艺条件、原辅料化学结构、中间体、分解产物查阅有关资料,提出规格标准,确定检查项目,规定杂质限度,即为质量标准草案。根据质量标准草案确定检查和试验范围,对检验方法拟定具体操作步骤,最后经有关标题检验方法验证标准操作规程共7页第1页 制定人颁发部门GMP办公室编号: SOP--F—004 分发部门质量验证小组、质量保证部新订√替代 审核人批准人生效日期年月日
人员审批方可实施。 2.2大型精密仪器的确认 分析测试中所用的检测仪器一般可分为三类 (1)普通仪器:崩解仪,折光仪、分析天平、酸度计、溶点测定仪、电导仪等: (2)较精密仪器:旋光仪、永停滴定仪、费休氏水分测定仪、自动滴定仪、药物溶出度仪、可 共7页第2页见分光光度计、电泳仪等; (3)大型精密仪器:紫外分光光度计、红外分光光度计、气相色谱仪、高效液相色谱仪、薄层扫描仪等。 为了保证分析测试数据准确可靠,每台检测仪器在投入正式使用之前都应进行确认。检测仪器的确认是检验方法验证的基础,应在其它验证试验开始之前首先完成。检测仪器确认工作内容应根据仪器类型。技术性能而定,通常包括:安装确认、校正、适用性预试验和再确认。2.2.1安装确认 同工艺验证中机械设备一样,仪器安装确认的土要内容包括如下各点: (1)要登记仪器名称.型号。生产厂商的编号、生产日期.生产厂商名称,企业内部的固定资产设备登记号及安装地点; (2)收集汇编和翻译仪器使用说明书和维修保养手册; (3)检查并记录所验收的仪器是否符合厂方规定的规格标准: (4)检查并确保有该仪器的使用说明书。维修保养手册和备件清单: (5)检查安装是否恰当,气、电及管路连接是否符合要求; (6)制定仪器标准操作规程(SOP)和维修保养制度,建立使用记录和维修记录; (7)制定清洗规程;. (8)明确仪器设备技术资抖(图纸,手册,备件清单、各种指南及该机器设备有关的其它文件)的专管人员及存放地点。 除上面提到的内容外,在安装确认方案中对仪器的性能用途应有一概述并记录维修服务单位名称。联系人、电话号码、传真号、银行帐号等,以利于日后的维修保养活动,这对大型精密仪器尤为重要。对于仪器来说,安装确认中的一项重要内容是功能试验。这项工作在安装结
显色培养基在几种食源性致病菌快速检测中的应用
显色培养基在几种食源性致病菌快速检测中的应用 显色培养基是一种鉴定微生物的快速检测技术,它的原理是通过在培养基中加入微生物自身代谢生产的酶,根据相应显色底物反应的颜色对菌种进行判断与鉴定。显色培养基较传统培养基具有灵敏度高、特异性大的优点,是一种新型的分离培养。大肠杆菌显色培养基、沙门氏菌培养基、金黄色葡萄球菌显色培养基、弧菌显色培养基、李斯特菌显色培养基等这几种食源性致病菌已经有效、广泛应用于食品、环境卫生、医药等领域,取得了一定的成效。但显色培养基尚还存在一些假阳(阴)等问题,这就影响了检测的结果,因此还需要进一步的研究。 标签:显色培养基;食源性致病菌;快速检测;应用 随着人们生活水平逐渐的提高和近年来一系列食品安全问题的出现,食品的安全问题越来越受到人们的重视。食品安全问题与微生物密切相关,微生物可造成食品环境的污染,因此,微生物的检测技术已经成为检测食品安全问题的重要工具。微生物传统的检测方法耗时长,操作步骤繁琐,已经不能满足当今食品、环境卫生、医药等领域检测的需要。研究各种新型微生物的检测技术,提高检测的效率是有效预防和控制各种微生物感染的有效措施[1]。本文就显色培养基在大肠杆菌显色培养基、沙门氏菌培养基、金黄色葡萄球菌显色培养基、弧菌显色培养基、李斯特菌显色培养基等食源性致病菌快速检测中的应用进行研究总结。显色培养基的原理是通过在培养基上加入微生物自身代谢产生的酶的底物,底物是由发色基团和微生物可代谢物质组成,为无色,但在特异性酶作用下游离出发色基团并显示一定颜色,直接观察菌落颜色,对菌种做出鉴定,减少了对菌株进行纯培养和进一步生化鉴定的步骤[2]。 1 几种食源性致病菌应用显色培养基快速检测的近况 1.1 显色培养基在大肠杆菌应用的研究研究表明,绝大多数的大肠杆菌具有β-D-葡萄糖苷酸酶(β-D-Gud),利用β-葡萄糖醛酸酶分解底物,使色源游离出来显色而区分大肠杆菌和其它的细菌。沙门菌、志贺氏菌和耶尔森氏菌不能产生β-D-Gud,因此可以利用β-D-Gud底物有效检测大肠杆菌。底物被β-D-Gud 水解后产生显色物质使菌落呈现特殊的蓝色或黄色。显色酶的底物通常是苯酚的衍生物,如有o (p)-硝基酚、p-硝基苯酚、羟基吲哚、5-溴- 4-氯- 3-吲哚、5-溴-6-氯-3-吲哚、6-氯-3-吲哚、N-甲基吲哚、5-碘-3-吲哚等的化合物[3]。 1.2 显色培养基在沙门氏菌应用的研究沙门氏菌是一类重要的食源性致病菌,它能够产生辛酯酶,除沙雷氏菌属外,其它各属细菌不具备这一功能,因此可以鉴别沙门氏菌属和其它肠菌科细菌。根据这一原理,以丙烯乙二醇和5-溴-4-氯-3-吲哚-B-D半乳糖吡喃糖苷酸(X-GAL)为底物来检测沙门氏菌,沙门氏菌能水解乙二醇产酸,但不能水解X-GAL,在培养基上产生特殊的红色菌落。这种显色方法具有敏感性高、特异性高的特点,操作步骤较为简单、检测效率高[4]。 1.3 显色培养基在金黄色葡萄球菌应用的研究金黄色葡萄球菌是食源性致
检验项目标准操作规程(SOP)
检验项目标准操作规程(SOP) - 1 - 检验标本的采集 一、标本的正确采集 标本采集必须符合 2个条件,即必须满足检测结果正确性的各项要求和检测结果必须 能真实地反映检验对象当前病情,避免干扰因素的存在。 二、标本的贮存 标本采集后尽快送至实验室,若不能及时送检,已采集的标本要按检验规定的贮存条 件,如室温、冰浴、温浴或防腐贮存,将标本直立置于稳定、干燥、避光、密闭的环境中, 避免振摇,以免标本遗洒或溶血影响检测结果。 三、标本的运送 必须保证运送后标本所分析的结果与刚采集标本后分析的结果一致。 四、标本的签收 临床工作人员从口才采集标本并将标本从临床运送到实验室及实验室人员接收临床标 本,均应按标准化要求进行,做到认真核对,包括标本来源、标本属
性、检查项目、标本采 集和运送是否合乎要求等,标本送出人员和标本接收人员都要做认真的记录并签字存档。 五、标本的处理 1、实验室接收标本后应及时正确地予以处理,否则会影响检测结果的准确性。 2、如果取血后未尽快转送或分离血清、血浆,血清与血块簪时间接触可发生变化。 3、实验室接收标本后处理应注意事项: (1)、时间:实验室接收标本后应尽快予以分类和离心。①、促凝标本应尽早处理,可在采血5-15分钟后离心;②抗凝标本可采血后立即离心;③非抗凝(无促凝)标本采血30-60分钟后离心; ④抗凝全血标本(全血细胞分析、ESR等)不需要离心。 (2)、温度:一般标本为室温(最好是22-25℃)放置;冷藏标本(对温度依赖性分析物)应保持在2-8℃直到温度控制离心。 (3)、采血管放置:应管口(盖管塞)向上,保持垂直立位放置。(4)、采血管必须封口:管塞移去后会使血PH改变,影响检测结果,封口可以减少污染、蒸发、喷洒和溢出等。 六、分析前的可变因素 1、生物因素:可引起所检测物质在体内的变化,此种变化与检测方法无关,分为可变的和固定的生物因素。
检验方法验证标准操作规程
标准操作规程 STANDARD OPERATING PROCEDURE 目的:建立检验方法验证标准操作规程,规范验证操作。 适用范围:所有检验方法的验证。 责任者:质量保证部、质量控制部 程序: 1、检验方法验证的基本内容 检验方法验证的基本内容包括方案的起草及审批,检测仪器的确认.适用性验证(包括准确度试验、精密度测定.线性范围试验、专属性试验等)和结果评价及批准四个欠的方面。它的基本内容可以用下图表示。 2、检验方法验证的基本步骤 首先是制定验证方案,然后对大型精密仪器进行确认,最关键的一步是检验方法的适用性试验,最后是检验方法评价及批准。 2.1验证方案的制定 检验方法的验证方案通常由质量验证小组提出。根据产品的工艺条件、原辅料化学结构、中间体、分解产物查阅有关资料,提出规格标准,确定检查项目,规定杂质限度,即为质量标准草案。根据质量标准草案确定检查和试验范围,对检验方法拟定具体操作步骤,最后经有关人员审批方可实施。 2.2大型精密仪器的确认 分析测试中所用的检测仪器一般可分为三类 (1)普通仪器:崩解仪,折光仪、分析天平、酸度计、溶点测定仪、电导仪等: (2)较精密仪器:旋光仪、永停滴定仪、费休氏水分测定仪、自动滴定仪、药物溶出度仪、可
见分光光度计、电泳仪等; (3)大型精密仪器:紫外分光光度计、红外分光光度计、气相色谱仪、高效液相色谱仪、薄层扫描仪等。 为了保证分析测试数据准确可靠,每台检测仪器在投入正式使用之前都应进行确认。检测仪器的确认是检验方法验证的基础,应在其它验证试验开始之前首先完成。检测仪器确认工作内容应根据仪器类型。技术性能而定,通常包括:安装确认、校正、适用性预试验和再确认。2.2.1安装确认 同工艺验证中机械设备一样,仪器安装确认的土要内容包括如下各点: (1)要登记仪器名称.型号。生产厂商的编号、生产日期.生产厂商名称,企业内部的固定资产设备登记号及安装地点; (2)收集汇编和翻译仪器使用说明书和维修保养手册; (3)检查并记录所验收的仪器是否符合厂方规定的规格标准: (4)检查并确保有该仪器的使用说明书。维修保养手册和备件清单: (5)检查安装是否恰当,气、电及管路连接是否符合要求; (6)制定仪器标准操作规程(SOP)和维修保养制度,建立使用记录和维修记录; (7)制定清洗规程;. (8)明确仪器设备技术资抖(图纸,手册,备件清单、各种指南及该机器设备有关的其它文件)的专管人员及存放地点。 除上面提到的内容外,在安装确认方案中对仪器的性能用途应有一概述并记录维修服务单位名称。联系人、电话号码、传真号、银行帐号等,以利于日后的维修保养活动,这对大型精密仪器尤为重要。对于仪器来说,安装确认中的一项重要内容是功能试验。这项工作在安装结束,检查合格后即可着手进行。仪器功能试验足在不使用样品的前提下,确认仪器达到设计要求,也可认为是空载试验。例如气相色谱仪的程序升温设定后能否按设定程序执行,溶出仪转速能否达到规定的性能要求。紫外分光光度计的吸收度与透光率的转换是否符合要求。高效液相色谱仪高压泵过压保护是否起作用等,这是检查仪器安装后能达到规定的性能指标。对普通仪器进行的功能试验比较简单,有的除仪器校正外,没有其它特殊的功能试验要做,如酸度计,电导仪,折光仪等。不同的仪器有不同的技术标准,应根据仪器使用说明书的要求进行试验。 2.2.2校正 校正是仪器确认及检验方法验证中的一个重要环节,应当在验证试验以前进行校正。紫外分光光度计校正包括波长校正、吸收度测试、准确度测试、杂散光检查。 气相色谱仪与高效液相色谱仪均要求做系统适用性试验。在规定的色谱条件下测定色谱柱的最小理论塔板数。分离度和拖尾因子,并规定变异系数应不大于2%。 对于化学检验中使用的计量仪器包括容量瓶、移液管、滴定管、分析天平亦均应校正。
牛奶中三种常见食源性致病菌快速检测方法的建立
牛奶中三种常见食源性致病菌快速检测方法的建立食源性疾病是全球最重要的公共卫生问题之一,导致食源性疾病的有病原微生物、寄生虫及其代谢产物、天然毒素以及化学性有毒有害物质等等。微生物引起的食源性疾病是全球食品安全面临的最重要挑战之一。 在发达国家70%~80%的细菌性食物中毒是由沙门氏菌引起的,在我国甚至 达到90%;引起沙门氏菌中毒的食品中,蛋类、奶类等动物性产品约占90%,沙门氏菌生存能力较强,可在乳制品中生存几个月。单增李斯特菌广泛存在于自然界中,且在冷藏温度4℃下依然能够生长,引起单增李斯特菌食物中毒的食品主要有: 奶及奶制品、肉制品、水产品、蔬菜及水果,其中以乳制品最为常见,单增李斯特菌能够给高风险人群带来严重的感染性疾病。 志贺氏菌又称痢疾杆菌,是引起人类细菌性痢疾中最为常见的食源性致病菌,该菌也是食品卫生相关法规及标准中要求必须检测的项目之一。本文以牛奶中常见的食源性致病菌单增李斯特菌、沙门氏菌和志贺氏菌为目标菌种,利用环介导等温扩增技术和高分辨率熔解曲线技术建立了多重LAMP检测体系和多重 HAND-HRM检测体系,结果如下:1.针对单增李斯特菌溶血素蛋白(hly)基因、沙门氏菌侵袭蛋白A(invA)基因和志贺氏菌侵袭性质粒抗原H(ipaH)序列的高度保守序列设计引物,通过引物筛选分别建立了三种食源性致病菌的LAMP反应体系。 进一步经过引物筛选,及对影响反应效率和特异性的镁离子浓度、甜菜碱浓度、引物浓度进行优化,建立了多重LAMP反应体系。对多重LAMP反应体系进行特异性和灵敏度检测。 在特异性检测中含有目标菌的模板出现扩增,空白对照和非目标菌均未发生特异性扩增,提示该多重LAMP反应体系特异性强。在灵敏度检测中单增李斯特菌
食品中常规致病菌快速检测(恒温扩增芯片法)
食品中常规致病菌快速检测(恒温扩增芯片法) 1范围 本标准规定了食品中沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157:H7、阪崎肠杆菌、副溶血性弧菌、志贺氏菌和侵袭性大肠埃希氏菌的快速检测方法。 本标准适用于食品中沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157:H7、阪崎肠杆菌、副溶血性弧菌、志贺氏菌和侵袭性大肠埃希氏菌的快速检测。 2术语与定义 下列术语和定义适用于本文件。 2.1 微流控芯片microfluidic chip 利用微加工技术,在硅、石英玻璃或高分子材料等基质上加工出各种微细结构,如管道、反应池、微泵、微阀等功能单元,进行样品的处理和分子的微系统。 3设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 3.1冰箱:2℃~5℃、-20℃±5℃。 3.2恒温培养箱:36℃±1℃。 3.3均质器。 3.4漩涡震荡仪。 3.5电子天平:感量0.1g。 3.6水浴锅:能升温至95℃。 3.7高速离心机:12000rpm/分钟。 3.8瞬时离心机。 3.9生物安全柜。 3.10微型分光光度计。 3.11恒温扩增仪。 3.12微流控芯片。 3.13低速离心机。 3.14微量移液器。 3.15无菌离心管:1.5ml、200ul。 3.16无菌吸管:50ml。 3.17锥形瓶:容量1000ml、500ml。 3.18量筒:容量500ml。 3.19擦镜纸。
4 培养基和试剂 4.1食源性致病菌加强型培养基:配置方法见附录A 中A.1。4.2适用型核酸提取试剂盒。 4.3生理盐水:配置方法见附录A 中A.2。 4.4 适用型核酸检测试剂盒(生物芯片法):碟式芯片结构示意图,见图 1。 图1 碟式芯片结构示意图 5 检测程序 食品中常规致病菌的快速检测程序,见图2。 样本前处理 25g (mL )样品+225mL 食源性共増菌培养基36℃±1℃,16h ~20h 取100ul 共増菌培养液收集菌体,提取核酸浓度范围50pg/ul~50ng/ul 配置反应体系,上芯片上机 芯片离心 样本
005二氧化钛检验标准操作规程
二氧化钛检验标准操作规程 1范围 本标准建立了辅料二氧化钛的检验标准操作规程。 本标准适用于辅料二氧化钛的检验。 2规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款 《中华人民共和国药典》 2010年版二部 《微生物限度检查检验标准操作规程》编号 《二氧化钛质量标准》编号 3 职责 质量部、生产部对实施本标准负责 4操作规程 4.1试剂与试药 盐酸、硝酸、稀硫酸、无水硫酸钠、硫酸溶液(25→100)、过氧化氢试液、锌粒、硫酸铵、0.5mol/L 盐酸溶液、稀硫酸、氨试液、标准砷溶液、稀醋酸、酚酞指示液、硫酸肼、溴化钾、氯化钠、碳酸钠、浓过氧化氢溶液、乙二胺四醋酸二钠滴定液(0.05mol/L)、甲基红指示液、20%氢氧化钠溶液、乌托品、甲基酚橙溶液、锌滴定液(0.05mol/L)、乙二胺四醋酸二钠滴定液(0.05mol/L)。 4.2仪器与设备 砷盐测定装置、扁形称量瓶、铂坩锅、烧杯、试管、纳氏比色管、坩锅、干燥箱、高温电阻炉、滴定管、铁架台、三角锥形型瓶、定量滤纸、天平、铂坩锅、恒温培养箱、干燥器。 4.3检验项目 4.3.1性状 4.3.1.1 操作方法
取适量试样置于50mL烧杯中,在自然光下观察色泽和组织状态,闻其气味。再分别用水、盐酸、硝酸或稀硫酸溶解。 4.3.1.2记录 记录本品性状、气味和溶解情况。 4.3.1.3结果判断 本品为白色粉末;无臭,无味。在水、盐酸、硝酸或稀硫酸中不溶。判为符合规定。 4.3.2鉴别 4.3.2.1操作方法 取本品约0.5g,加无水硫酸钠5g与水10ml,混匀,加硫酸10ml,加热煮沸至澄清冷却,缓缓加硫酸溶液(25→100)30ml,用水稀释至100ml,摇匀,照下述方法试验。 (1)取溶液5ml,加过氧化氢试液数滴,观察现象。 (2)取溶液5ml,加锌粒数颗,放置45分钟后,观察现象。 4.3.2.2记录 记录所观察到的现象。 4.3.2.3结果判断 (1)显橙红色;(2)溶液显紫蓝色。判为符合规定。 4.3.3检查 4.3.3.1 酸碱度 4.3.3.1.1操作方法 取本品5.0g,加水50ml时溶解,滤过,精密量取续滤液10ml,加溴麝香草酚蓝指示液0.1ml;如显蓝色,加盐酸滴定液(0.01mol/L)1.0ml,应变为黄色,如显黄色,加氢氧化钠滴定液(0.01mol/L)1.0ml,应变为蓝色。 4.3.3.1.2记录 记录溶液颜色变化。 4.3.3.1.3结果判断 取续滤液10ml,加溴麝香草酚蓝指示液0.1ml;如显蓝色,加盐酸滴定液(0.01mol/L)1.0ml,应变为黄色,如显黄色,加氢氧化钠滴定液(0.01mol/L)1.0ml,应变为蓝色。判为符合规定。 4.3.3.2 水中溶解物 4.3.3.2.1操作方法 取本品10.0g,加硫酸铵0.5g,加水150ml,加热煮沸5分钟,冷却,用水稀释至200ml,摇匀,用双层定量滤纸滤过,精密量取续滤液100ml,蒸干,在600℃炽灼至恒重,计算遗留的残渣。
检验项目标准操作规程
一 生物安全制度 1、医务人员 1 每1-2年做体检一次 并接受乙肝疫苗接种。 2 每1—2年检查乙肝病毒抗原抗体水平 发现乙型肝炎者应进行隔离治疗。 3 检验人员进入实验室应穿好工作服 不允许在实验室进食和吸烟。 4 检验人员在工作前后和被污染后 应用肥皂和流水清洗 必要时由消 毒液浸泡双手 每季度抽查检验人员的手 并做细菌培养一次。 2、环境消毒隔离 1 实验室应分为清洁区和操作区 清洁区要注意保护不受污染。操作有 气溶胶可能的标本应配置生物安全柜及其它防护设置 如紫外线灯 排气 扇等操作区的工作台及地面每日用消毒液擦拭一次 有污染时随时消毒 每周大扫除一次。 2 采血室每日操作前用清水擦拭操作台一次 采血结束用消毒液擦拭操 作台、桌子和地面一次 紫外线每日照射消毒一次 每月空气细菌培 养一次 紫外线强度定期测定。并做记录。 3、各种检验标本的收集 送检必须用相应指定的容器留取 不得外溢污染。 4、静脉及末稍采血 应严格执行消毒隔离措施 静脉抽血做到一人一针一筒一巾一带一消毒 所用止血带及纸垫每日消毒 末稍采血一人一片一管 杜绝交叉污染。 5、一次性医用器具包括采血针 注射器、尿杯、血红蛋白微量吸血吸管 应严格做好领发登记 注射器先浸泡消毒后由供应室一对一调换 统一处 理 其余一次性器具浸泡消毒后装入污物袋送焚烧炉焚烧。 6、检验人员在进行静脉抽血时应严格遵守无菌操作技术 操作前必须洗手必须戴好帽子与口罩 操作台和手被污染时应用肥皂和流水认真洗手 必要 时用消毒液浸泡双手 酒精、碘酒瓶每周更换消毒两次。 7、凡是肝炎病人和透析病人的血液标本及疑有黄疸的血标本 都视为肝炎的污染标本 应贴上红色危险标记 放在规定区域内 引起警惕和防止扩大 污染面。 8、溢出试管外的血液 应立即用碘酒棉签擦拭干净 注意防止玻璃碎片刺伤手 并注意试管有无破裂。 9、当针头和碎玻璃刺伤手时,用流水冲洗,挤出血水,应立即用碘酒消毒局部。 10、实验室操作时应戴上手套。吸取标本 离心振荡等应严格按操作规程 防止自身和实验室受污染。 11、已检查标本与容器分别浸泡于施康1号消毒液(2000mg/L)中两小时后 标本倾弃 一次性容器送焚烧 重复使用的经清洗消毒和灭菌后再使用 均 要有记录。有毒化学试剂和放射性试剂使用后要经无害化处理 防止污染 环境。 12、菌种、毒种按《传染病防治法》进行管理。 13、三级医院必须设置清洁区 污染区 操作有气溶胶可能的标本应配置生物安全柜及其它防护设置 如紫外线灯 排气扇等。
各项护理操作流程图及评分标准
九病区护理操作流程图与评分标准 一、备用床 (一)备用床流程图 ↓ 移开床旁桌20cm,椅放于床尾 ↓ 湿扫床褥→头尾掉换翻转床褥,卷放于床尾椅上→翻转床垫→铺好床褥↓ 对齐中线→展开大单→先床头后床尾再中间铺好近侧大单→转至对侧同 法铺好 ↓ 被套放于床头展开铺于床上→打开开口→“S”形放入棉被→角线吻合铺 平套好→系带 ↓ 棉被两侧与床沿平齐向内折,床尾塞入床垫下 ↓ 套好枕套→角、线吻合→开口背门→放置床头棉被上。 ↓
(二)备用床考核评分标准 操作所用时间7min 成绩 评分标准: ①本操作以100分计算,80分达标。 ②一般情况下,扣分以2分为单位,即凡有错误或出现漏掉某程序并影响下一程序时、动作没有达到轻稳、操作未节力、清洁物品落地、操作过程中用手触摸头面部、辅助动作等,每次扣2分。但严重违反操作规程,如没有翻转褥垫、棉被
二、暂空床 (一)暂空床流程图 ↓ 移开床旁桌20cm,椅放于床尾 ↓ 湿扫床褥→头尾掉换翻转床褥,卷放于床尾椅上→翻转床垫→铺好床褥↓ 对齐中线→展开大单→先床头后床尾再中间铺好近侧大单→必要时铺橡胶单及中单,橡胶单上缘距床头45~50cm,中单完全覆盖橡胶单→ 转至对侧同法铺好 ↓ 被套放于床头展开反铺 ..于床上→棉被对齐被套封口处放好并展开→从床头卷向床尾翻出铺平→系带 ↓ 棉被两侧与床沿平齐向内折,床尾塞入床垫下,再四折于床尾↓ 套好枕套→角、线吻合→开口背门→放置床头大单上。 ↓
(二)暂空床考核评分标准 姓名操作所用时间8min 成绩 ①本操作以100分计算,80分达标。 ②一般情况下,扣分以2分为单位,即凡有错误或出现漏掉某程序并影响下一程序时、动作没有达到轻稳、操作未节力、清洁物品落地、操作过程中用手触摸头面部、辅助动作等,每次扣2分。但严重违反操作规程,如没有翻转褥垫、棉被里外不平等,则按不达标处理。 ③超时者每超过1分钟扣2分。
食源性致病菌快速检测方法研究报告
食源性致病菌快速检测方法研究报告 发表时间:2011-05-13T14:13:40.207Z 来源:《中外健康文摘》2011年第5期作者:高友中 [导读] 目的应用酶联免疫吸附实验(ELISA)快速检测奶类及肉类制品中沙门菌。 高友中(湖南省岳阳县疾病预防控制中心 414100) 【中图分类号】R446.1 【文献标识码】A 【文章编号】1672-5085 (2011)5-0106-02 【摘要】目的应用酶联免疫吸附实验(ELISA)快速检测奶类及肉类制品中沙门菌。方法样品经增菌后,用ELISA法及国标法对样品中的沙门菌进行初步检测,并比较ELISA法检测结果与国标法灵敏性、特异性、符合率。结果检测200份奶类制品和肉制品,经ELISA法检测阳性率为8.3%,国标法阳性率为6.7%。ELISA法敏感性、特异性分别为100%、97%,与国标法符合率达99.3%。结论 ELISA法可快速、方便的对食品中沙门菌的污染情况进行初步检测,灵敏度高、特异性好,与国标法符合率高。适用于食品中沙门菌的初步检测。 【关键词】奶制品肉制品沙门菌 ELISA 沙门菌为常见的引起食源性疾病爆发的病原菌,在我国微生物性食物中毒中一直位居首位,而受沙门菌污染的奶、肉制品为造成人类感染的主要来源,因此沙门菌一直为医疗卫生、食品卫生及商检部门重点检验对象之一[1]。本研究采用ELISA法检测奶、肉制品中沙门菌,并与国标法进行比较研究,现报道如下: 1 材料与方法 1.1实验材料 奶、肉制品分别来自本市8家不同超市,包括70份奶及奶制品样本,60份肉及肉制品样本。取样均采取随机抽样的方法进行。每份样品250ml或250g,经无菌包装后置冷链保存送实验室检测。 缓冲蛋白胨水,氯化镁孔雀绿增菌液,四硫酸钠煌绿增菌液,亚硒酸盐胱氨酸增菌液,亚硫酸铋琼脂,DHL琼脂,HE琼脂,WS琼脂,SS琼脂,三糖铁琼脂,蛋白陈水、靛基质试剂,尿素琼脂(pH7.2),氰化钾(KCN)培养基,氨基酸脱梭酶试验培养基,糖发酵管,ONPG培养基,半固体琼脂,丙二酸钠培养基,沙门氏菌因子血清。均按国标相关规定进行。 ELISA相关试剂均购自试剂公司。 1.2实验方法 样品按国标法相关规定预先增菌。样品处理后于36°C培养4h,转种于100ml氯化镁孔雀绿增菌液中,42°C18-24h,另取10ml转种于亚硒酸盐胱氨酸增菌液中,36°C18-24h。 ELISA法简要步骤如下:特异性抗沙门菌单克隆抗体包被,加入待见样品检测。显色于酶标仪上读取OD值。 国标法简要步骤如下:经增菌后,划线接种于亚硫酸铋琼脂平板和EHL琼脂平板。36°C培养18-24h,观察菌落生长情况。挑选可疑菌落接种于三糖铁琼脂,鉴别反应结果。如出现异常结果,按国标相关规定选择补做甘露醇和山梨醇试验,ONPG等。 1.3数据分析 参考田素娟[1]等的方法进行。即利用检验通用的计算方法,并国标法比较实验的敏感性、特异性、符合率。 2 结果 2.1ELISA及国标法检测结果 用ELISA法同步检测份奶、肉制品的沙门菌污染情况,采用国标法进一步验证,结果见表1。 表1沙门菌污染情况检测 2.2ELISA法与国标法敏感性、特异性、符合率计算结果 表2ELISA法与国标法比较 3 讨论 3.1常规检测沙门菌方法 目前,沙门菌常用检测方法有:(1)酶快速反应检测技术。包括快速酶促反应显色培养基及自动化微生物分析仪两种方法。VITEK AMS自动微生物检测系统对细菌鉴定是基于细菌的微量生化反应,可鉴定405种细菌。(2)以免疫学为基础的检测技术。包括酶联免疫吸附实验(ELISA);免疫磁分离技术,如王海明[2]等报道的使用抗沙门氏菌免疫磁珠经增菌后于VITEK全自动生化鉴定仪和荧光PCR分子检测确认;免疫胶体金技术等。(3)以核酸为基础的检测技术,如杨俊超[3]等报道的使用实时荧光定量PCR与常规PCR比较研究,其敏感性、特异性均较好;依赖PCR的DNA指纹图谱技术;随机引物扩增DNA多态性(RAPD);基因内重复性一致序列(ERIC)的扩增;多重PCR检测技术;NASBA;基因芯片技术等。 3.2本研究采用检测方法 本研究采用ELISA法快速检测奶及奶制品、肉及肉制品中沙门菌的污染情况。其敏感性、特异性较高,且与国标法符合率较高。一般24h 之内可以出检测结果。其不足之处在于:(1)不能定量检测沙门菌的含量,只能做定性分析,即是否存在沙门菌污染,但不能测得污染量的大小。后续研究考虑通过设置标准沙门菌对照(蛋白含量已知)的情况下,设立不同稀释度,然后比较样品各组OD值,用统计软件作出标准曲线,进而推算出沙门菌含量。(2)检测结果不太稳定,有可能出现假阳性结果。ELISA实验普遍存在抗体效价下降很快的通病,如
检验项目标准操作规程(SOP)
检验项目标准操作规程(SOP -1 -检验标本的米集 一、标本的正确采集 标本米集必须符合 2个条件,即必须满足检测结果正确性的各项要求和检测结果必须能真实地反映检验对象当前病情,避免干扰因素的存在。 二、标本的贮存 标本采集后尽快送至实验室,若不能及时送检,已采集的标本要按检验规定的贮存条 件,如室温、冰浴、温浴或防腐贮存,将标本直立置于稳定、干燥、避光、密闭的环境中, 避免振摇,以免标本遗洒或溶血影响检测结果。 三、标本的运送 必须保证运送后标本所分析的结果与刚采集标本后分析的结 果一致。 四、标本的签收 临床工作人员从口才采集标本并将标本从临床运送到实验室及实验 室人员接收临床标 本,均应按标准化要求进行,做到认真核对,包括标本来源、标本属
性、检查项目、标本采集和运送是否合乎要求等,标本送出人员和标本接收人员都要做认真的记录并签字存档。 五、标本的处理 1、实验室接收标本后应及时正确地予以处理,否则会影响检测结果的准确 性。 2、如果取血后未尽快转送或分离血清、血浆,血清与血块簪时间接触可发生变化。 3、实验室接收标本后处理应注意事项: (1)、时间:实验室接收标本后应尽快予以分类和离心。①、促凝 标本应尽早处理,可在米血5-15分钟后离心;②抗凝标本可米血后立即离 心;③非抗凝(无促凝)标本采血30-60分钟后离心; ④抗凝全血标本(全血细胞分析、ESF等)不需要离心。 (2)、温度:一般标本为室温(最好是22-25 C)放置;冷藏标本(对温度依赖性分析物)应保持在2-8 C直到温度控制离心。 (3)、采血管放置:应管口(盖管塞)向上,保持垂直立位放置。 (4)、采血管必须封口:管塞移去后会使血PH改变,影响检测结果, 封口可以减少污染、蒸发、喷洒和溢出等。 六、分析前的可变因素 1、生物因素:可引起所检测物质在体内的变化,此种变化与检测方法无 关,分为可变的和固定的生物因素。 2、干扰因素:在收集和分析标本过程中,干扰因素常导致分析结果与被测物真实浓度不符。 七、标本采集的基本原则
操作技能操作流程及评分标准
胃肠减压操作流程 准备 操作者准备:着装规范,戴口罩、手套 评估:患者病情、意识状态、鼻孔、口咽部、合作程度、治疗计划、插胃管长度(用皮尺量)、解释、问二便 用物准备:胃管、无菌止血钳1把、弯盘、纱布2块、石蜡油、棉签、胶布、必要时备压舌板及开口器、别针、皮尺、听诊器、打奶器、电筒、治疗巾、小胶单、手套、温开水、负压引流袋 量长度 前额发际至剑突与脐连线中点 垫单 颌下垫单 协助患者取合适体位 检查并清洁鼻孔、戴手套 润滑 插管 插管至咽部(约14~16cm时),嘱患者做吞咽动作 如插管不畅即检查胃管是否盘曲口腔 如呛咳应拔管休息片刻再插 如出现恶心、须暂停片刻,嘱患者做深呼吸,缓解后再插 判断 抽胃液 看有无气泡冒出 听气过水声 固定 接负压器 妥善固定,防止胃管脱出 保持负压及保持胃管通畅、脱手套 整理用物、交代注意事项 观察及护理 观察胃液颜色、量 观察腹部体征(腹胀、呕吐、腹痛症状是否减轻) 口腔护理bid,更换负压器qd 记录 记录胃液颜色、量 记录腹部体征 拔管准备 备弯盘、松节油、棉签、纱布、手套 解释 拔管 置弯盘与患者颌下,除去胶布 戴手套 分离负压袋、将胃管尾端反折,用纱布包裹近鼻孔处的胃管,拔出胃管
脱手套 漱口、清洁胶布痕 整理 整理床单位 协助患者取舒适体位 整理用物、分类处置 洗手、记录 备注 1.检查通畅:q2h由近端向远端挤压胃管,检查胃管是否盘曲在口腔里,必要时予温 开水20~30ml冲洗胃管或调整胃管位置(胃手术除外) 2.昏迷患者插管时去枕,插至约15cm时托起头部使下颌靠近胸骨柄。 3.成人负压袋持完全负压状态。 4.婴幼儿必要时用注射器抽吸。
PCR技术在快速检测食源性致病菌中的作用
龙源期刊网 https://www.360docs.net/doc/d44820472.html, PCR技术在快速检测食源性致病菌中的作用 作者:庄璐 来源:《现代食品·上》2017年第05期 摘要:现阶段,我国正以飞快的速度发展,食品微生物检测也由传统的培养方法向分子 水平过渡。通过对聚合酶链式反应(PCR)技术的研究分析可知,可以利用这种先进的快速检测技术来检验食品中的食源性致病菌,本文归纳总结了几种不同的PCR技术,旨在提供一些关于食品微生物的快速监测技术。 关键词:PCR技术;食源性致病菌;检测;应用 Abstract:China is developing at a fast pace and the detection of food microorganisms is also moving from the traditional cultivation method to the molecular level. Based on the polymerase chain reaction (PCR) for certain research analysis, can be verified in food borne pathogens using rapid detection technology which is advanced, this paper summarizes several different PCR technology,aims to provide some food on microbial monitoring technology. Key words:PCR technology; Foodborne pathogenic bacteria; Detection; Application 中图分类号:R155.5 改革开放以来,我国现代科学技术以惊人的速度发展,人们的生活水平也在逐渐提高,最直接的结果就是人们越来越重视食品,有着越来越高的要求,但近年来,食品安全问题一直威胁着人们的生命健康,这一问题已经受到了人类的高度重视。2007年,在某些速冻食品中检 测出致病菌;在我国经常提到的地沟油事件层出不穷;让人们谈虎色变的三鹿奶粉事件等,每一件事情都在提醒着人们食品安全问题的重要性和严重性。其中,微生物检测是衡量食品卫生质量的重要指标之一,因此,研究食品微生物检测的快速检测技术具有十分重要的意义。 1 传统的食源性致病菌检测方法 1.1 增菌 致病菌在食品中有着较低的污染水平,所以要以增菌或增菌的步骤为前提来根据国家标准检测食品致病菌,前增菌的实质就是把处于濒死状态的致病菌放在无选择性的培养基中,使其恢复活力,而增菌与之不同,增菌是利用选择性培养基,目的是让微生物大量繁殖,这样就会抑制其他细菌,从而为下一步的分离培养奠定基础。 1.2 分离培养
检验标准操作规程
1.目的 规范检验操作。 2.适用范围 检验操作。 3.责任者 化验员。 4.规程: 4.1检验 4.1.1 按化验品种的检验规程。准备好化验需要的仪器、试液、标准滴定液及其它必需品。如果有规定的化验周期,就应在规定期限内完成化验,无规定化验周期的,也应及时化验,确保生产的正常进行。 4.1.2 严格按检验规程进行操作,不得修改检验方法。如果检验方法有问题,应通知质管部经理分析原因,如修改则应按文件管理制度办理。 4.1.3在需较长时间使用仪器(如培养箱或干燥箱)时,可将“运行中”的状态标志挂在仪器上,待仪器使用完毕后,及时取下。精密仪器应填写仪器使用记录,并按相应的SOP检查并校验仪器。定期检定仪器,只有在其正常运行时才能使用仪器。如果仪器不正常,使用人应及时挂上相应的状态标志,直到问题解决为止。使用完仪器后,填写仪器使用记录,并由使用人做好仪器的清洁卫生,换上“清洁待用”的标志牌。 4.1.4除含量、浸出物及规定需做两份平行化验外,其它检测项目通常做一份即可。如果平行化验数据超出方法中规定的偏差要求(但在合格限内),应报告质管部经理。一般情况下需要再做一次化验(即无法判断误差原因时需做的再次化验)。 4.1.5 化验完毕后应及时清洗使用过的仪器,以备下一个化验员使用。所有的玻璃器具都应在使用后及时冲洗掉实验样品,以免样品干燥后难以清洗,然后将其清洗。对易挥发物品进行处理和化验时,应在通风橱内进行。应使用适当的方法处理挥发性和有毒物品。 4.1.6 样品化验结束后,化验员应填写检验记录并签字,记录应由QC负责人审核并签字。如果样品符合规定,就在记录单上填写“符合标准规定”,如不合格,另一化验员应重新检验,如确实不 合格,则填写“不符合标准规定”。如QC负责人要求重新取样进行化验,在化验新样品的同时应再复验一次原样品,如化验结果被证实是正确的,QC负责人应做出出报的决定,并打好检验报告书报给QA审核签发。如果第二次化验结果与第一次不符,应排除化验员的检验误差及其他可能产生的检验误差,对该物料做出处理意见。
食源性致病菌及其检测技术的调查
食源性致病菌及微生物检测技术的调查报告 目录 前言 (2) 1 食源性致病菌概述 (2) 1.1 食源性致病菌的定义及种类 (2) 1.2 食源性致病菌对人体健康的影响 (3) 1.3 食源性致病菌引起的食品安全问题 (3) 1.3.1 国际情况 (3) 1.3.2 国内情况 (3) 1.3.3 食源性疾病不断上升的原因 (5) 2 国内外的食品微生物标准检验体系 (5) 2.1 国外主要食品微生物检测体系 (6) 2.2 国内主要食品微生物检测体系 (6) 2.3 常见食源性致病菌检测执行标准 (6) 2.4 国标中致病菌常规检测方法流程 (7) 3 微生物检测技术的发展现状 (8) 3.1 常规微生物快速检测技术现状——传统计数改良法 (8) 3.2 常规微生物快速检测技术现状——快速检测微生物数量的新方法 (10) 3.2.1 ATP生物荧光法 (10) 3.2.2 检测微生物产生的CO2量的方法 (10) 3.2.3 电化学方法(电导率法或电阻抗法) (10) 3.2.4 颜色变化 (11) 3.2.5 流式细胞技术 (11) 3.2.6 热量法 (12) 3.2.7 放射测量法 (12) 3.3食源性致病菌快速检测方法 (12) 3.3.1 显色培养基法 (12) 3.3.2 免疫学方法 (13) 3.3.3分子生物学检测方法 (15) 4 小结 (16)
前言 近年来我国食品安全频频出现问题,食品安全问题已经成为生活中不可不谈的话题。 同时食品引发的中毒事故频发,媒体曝光度增加,消费者对食品安全的重视程度与日俱增,国家也加大了食品安全问题的整顿和监管力度。根据国家食品药品监管总局法制司19日发布的通知,国务院已将《食品安全法》修订工作列入2013年立法计划。 影响我国食品安全的最主要因素是微生物污染和化学性物质污染,而由病原微生物引 起的食源性疾病是影响食品安全的最主要的因素之一。化学污染监管,将进入长期化和制 度化;食源性疾病,这一食品安全隐患因微生物性食物中毒事件屡次发生,它也不会再继 续“潜伏”。在由卫生部、工业和信息化部、商务部、工商总局、质检总局、粮食局和食品药品监管局联合制订的《2013年国家食品安全风险监测计划》中,对食品微生物及其致病因子、食源性疾病监测制定了全面而详细的监控计划。食源性疾病逐渐也引起越来越多专家、学者的广泛关注,中国疾病预防控制中心的陈君石院士、刘秀梅教授等在多个场合多 次倡议重视微生物引起的食源性疾病。在这样的社会背景下,我国食源性致病菌检测链条 的发展有着巨大的空间。快速而准确检测出被称为“头号杀手”的食品致病菌,是确保食 品安全的首要任务。 1 食源性致病菌概述 1.1 食源性致病菌的定义及种类 我国食品卫生微生物检验项目包括一般性检验项目和致病菌两大类。一般检验项目包括菌落总数、大肠菌群、霉菌和酵母等指标。 食源性致病菌,指在食品的加工和流通过程中引入的病原菌,这些病原菌在食品中存活、生长代谢引起食物的变质和破坏,同时有些病原菌分泌有毒物质,直接或间接导致人患病。常见细菌性食物中毒的病原微生物有:致病性大肠杆菌(特别是出血性大肠杆菌O157:H7);沙门氏菌属;志贺氏菌;致病性弧菌(包括:霍乱弧菌、副溶血性弧菌);金黄色葡萄球菌及其肠毒素;近年来发现导致细菌性食物中毒的微生物越来越多,包括单核增生李斯特菌、空肠弯曲菌等。 我国对菌落总数(包括霉菌酵母菌)和大肠菌群限量标准只规定最大限量,致病菌规定“不得检出”。
