常见杂环名称及结构式
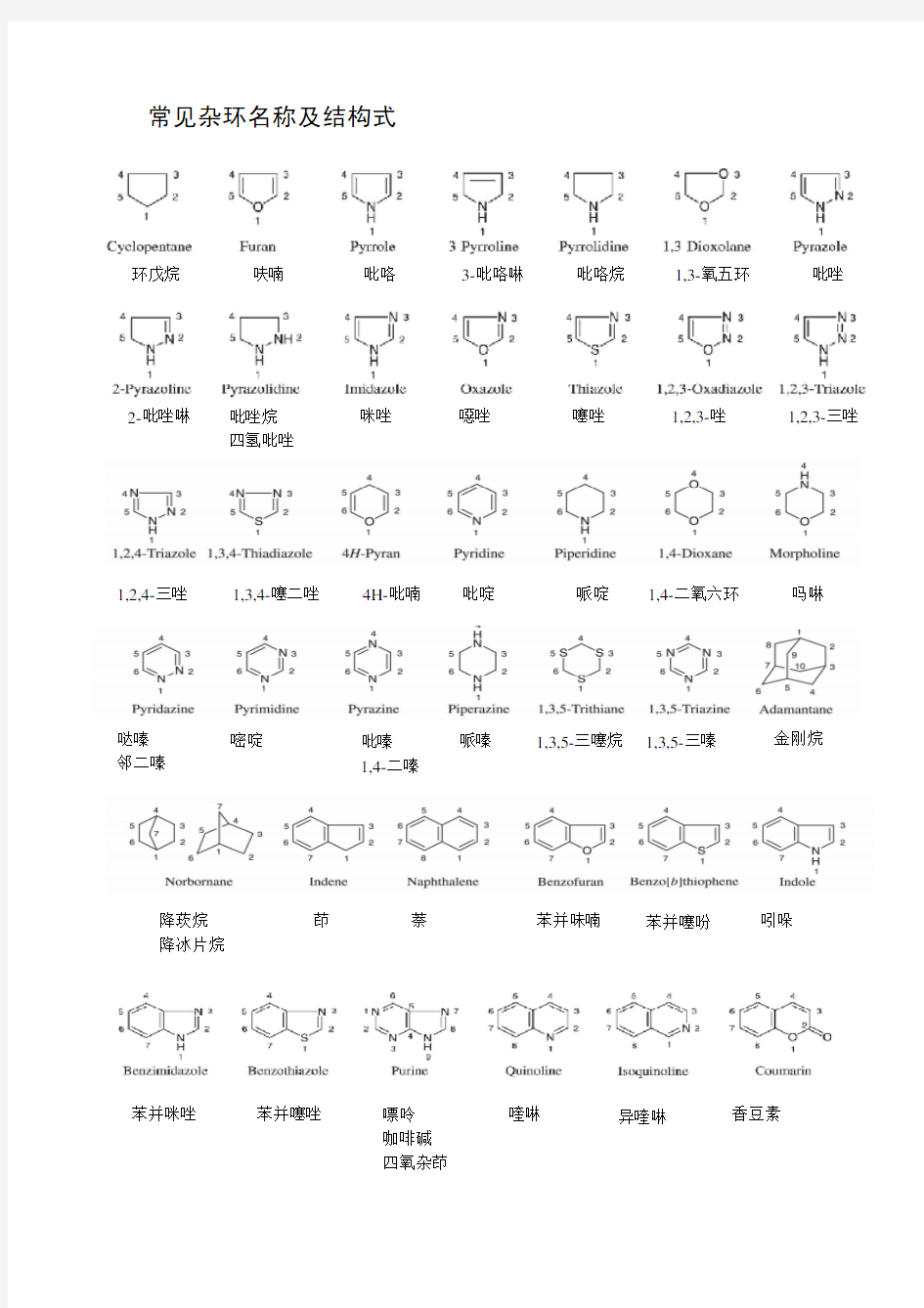

常见杂环名称及结构式
环戊烷 呋喃 吡咯 3-吡咯啉 吡咯烷 1,3-氧五环 吡唑 2-吡唑啉 吡唑烷
四氢吡唑 咪唑 噁唑 噻唑 1,2,3-唑 1,2,3-三唑
1,2,4-三唑 1,3,4-噻二唑 4H-吡喃 吡啶 哌啶 1,4-二氧六环 吗啉 哒嗪
邻二嗪 嘧啶 吡嗪 1,4-二嗪 哌嗪 1,3,5-三噻烷 1,3,5-三嗪 金刚烷
降莰烷
降冰片烷 茚 萘 苯并味喃 苯并噻吩 吲哚
苯并咪唑
苯并噻唑 嘌呤 咖啡碱
四氧杂茚 喹啉 异喹啉 香豆素
噌啉 1,2-二氮杂萘 喹喔啉 1,4-二氮杂萘 薁 芴 二苯咔喃 吩噻嗪 硫化二苯胺 黄酮 芘 吖啶 氮蒽 1,10-菲啰啉 邻菲啰啉 甾环 类固醇 咔唑 蒽 菲
常见有机化合物
常见有机化合物 (分值:30分,建议用时:25分钟) 选择题:本题10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.下列说法正确的是() A.分子式分别为C2H6O、C3H8O的有机物一定互为同系物 B.若有机物甲和乙是同分异构体,则甲和乙的化学性质相似 C.某有机物燃烧只生成物质的量之比为1∶2的CO2和H2O,说明其最简式为CH4 D.丙烯(CH2===CHCH3)易发生加成反应,一定条件下也可以发生取代反应D[A项,C2H6O、C3H8O可能为醇或醚,不一定互为同系物;B项,同分异构体的化学性质可能相似也可能不同;C项,该有机物可能含氧。] 2.下列关于常见有机物的说法正确的是() A.C3H6通入溴水中,溶液一定褪色 B.糖类、油脂、蛋白质均能发生水解反应 C.聚氯乙烯可用作生产食品包装材料的原料 D.分子式为C3H8O的有机物,只有2种能发生酯化反应 D[C3H6可能为,此物质通入溴水不反应,A错误;单糖不 发生水解,B错误;聚氯乙烯有毒,不能用于生产食品包装材料,C错误;C3H8O 相应的醇有2种,能发生酯化反应,D正确。] 3.有机化合物X是一种医药中间体,其结构简式如图所示。下列关于化合物X的说法不正确的是() A.分子式为C16H12O4 B.有两种含氧官能团 C.分子中所有碳原子一定处于同一平面内
D.在一定条件下能发生取代反应和加成反应 C[该有机物分子中有一个饱和碳原子与3个碳原子相连,由甲烷的正四面体结构可知其分子中所有的碳原子不会同时处于同一平面内。] 4.辣椒素是辣椒的活性成分,具有降血脂和胆固醇功能。辣椒素酯类化合物M的结构简式如图所示。下列说法正确的是() A.M属于芳香烃 B.M能发生水解、加成反应 C.M不能与钠反应 D.M的苯环上一氯代物有2种 B[M分子结构中含有苯环、酯基,能发生加成反应和水解反应,B项正确;M中含碳、氢、氧三种元素,它不属于烃类,A项错误;M含有羟基,能与钠反应,C项错误;M的苯环上有3种氢,苯环上的一氯代物有3种,D项错误。] 5.立方烷(C8H8)外观为有光泽的晶体。其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是() A.立方烷在空气中可燃,燃烧有黑烟产生 B.立方烷一氯代物有1种、二氯代物有3种、三氯代物也有3种 C.立方烷是苯(C6H6)的同系物、也是苯乙烯(C6H5—CH===CH2)的同 分异构体 D.八硝基立方烷完全分解可能只产生二氧化碳和氮气 C[立方烷属于烃,可以在空气中燃烧,其含碳量与苯相同,因此燃烧时有 黑烟产生,A项正确;为立体对称结构,一取代看点、二取代看线、三取代看面,故其一氯代物有1种、二氯代物有3种、三氯代物有3种,B项正确;立方烷与苯的结构不相似,不互为同系物,C项错误;八硝基立方烷的分子式为C8(NO2)8,完全分解时可能只产生CO2和N2,D项正确。] 6.苯乙烯的键线式为,下列说法正确的是() A.苯乙烯的同分异构体只有
药物化学相关药物母核大全杂环化合物
药物化学相关药物母核大全 杂环化合物
)
如何记忆药物的结构式 不要想着单纯、孤立地记结构式,因为——除非你的大脑是扫描仪,不然你记也记不住。那么,到底该怎样记化学结构式呢? 一、基本化学结构的掌握 药物化学结构无论多么复杂,都是由简单的链状、环状结构组合拼接而成的,因此如果丝毫不懂基本的化学结构及他们简单的连接规律,一上来就看药物结构式,无疑于看鬼画符,人脑又并非扫描仪,又何谈记忆呢!而药物结构式中最常见的就是杂环,学药物化学一定要熟记它们。 二、记忆结构式要按药物分类来记忆 通常同一类药物都有相同或相似的母核,比如青霉素类抗生素的基本母核是6-氨基青霉烷酸(6-APA)、头孢类是7-氨基头孢霉烷酸(7-ACA)、肾上腺皮质激素的甾环、肾上腺素能激动药的苯乙胺、喹诺酮类抗生素的喹诺酮等等。知道了这些基本结构,再看结构式就清晰多了。所以当面对一个结构式时,基本上可以先判断它的基本结构,确定它的分类,再结合它的特征基团借以区分和特别记忆。 三、根据特征基团进行与其它同类药物结构式的区别记忆 当记忆一个药物结构式时,不是孤立记忆,而应在熟悉了它的基本母核后,对比其它同类药物的结构式进区别记忆。如头孢氨苄与头孢克洛,它们的基本母核是一样的,区别在于头孢克洛3位上是氯而头孢氨苄3位是甲基,借以区分,更能清晰记忆,达到事半功倍的效果。 四、借助于通用名或化学名来记忆 如诺氟沙星中的“氟”字即指6位为氟,环丙沙星中的“环丙”也指其1位有环丙基。当记忆或区分这些化学结构式时,药物的名字起到很重要作用。而对它们的化学名的熟悉也可帮助你理清药物结构式的“来扰去脉”。由于执业药师考试都是选择题,所以只要记住它们的基本母核和特征基团及特征基团的大致取代位置也就能够选出正确答案了。 五、借助于其构效关系来记忆 药物化学结构的构效关系是药物化学的灵魂,所以说,不但构效关系本身非常重要,是需要考生熟记的,而且我认为熟悉构效关系也对于理清及掌握药物结构式具有非常重要作用。因此,且不要急切着想记下某个结构式,而应全面熟悉了其通用名、化学名、构效关系
有机物结构特点解析
第一章:认识有机化合物——考点二有机物的结构特点、同系物、同分异构体 知识点一:有机化合物中碳原子的成键特点 1.碳元素位于第二周期ⅣA族,碳原子的最外层有4个电子,很难得到或失去电子,通常以共用电子对的形式与其他原子形成共价键,达到最外层8个电子的稳定结构。 2.由于碳原子的成键特点,在有机物分子中,碳原子总是形成4个共价键,每个碳原子不仅能与氢原子或其他原子(如氧、氯、氮、硫等)形成4个共价键,而且碳原子之间可以形成单键(C—C)、双键(C =C)、三键(C≡C)。多个碳原子可以相互结合成长短不一的碳链,碳链也可以带有支链,还可以结合成碳环,碳链与碳环也可以相互结合,因此,含有原子种类相同,每种原子数目也相同的分子,其原子可能具有多种不同的结合方式,形成具有不同结构的分子。 要点解释:在有机物分子中,碳原子仅以单键与其他原子形成4个共价键,这样的碳原子称为饱和碳原子,当碳原子以双键或三键与其他原子成键时,这样的碳原子称为不饱和碳原子。 种类实例含义应用围 化学式CH4、C2H2 (甲烷)(乙 炔)用元素符号表示物质分子组成的式子。可反 映出一个分子中原子的种类和数目 多用于研究分子晶体 最简式(实验式)C6H12O6的 最简式为 CH2O ①表示物质组成的各元素原子最简整数比的 式子②由最简式可求最简式量 ①有共同组成的物质 ②离子化合物、原子晶体常用 它表示组成 电子式用小黑点等记号代替电子,表示原子最外层 电子成键情况的式子多用于表示离子型、共价型的物质 结构式①具有化学式所能表示的意义,能反映物质 的结构②表示分子中原子的结合或排列顺序 的式子,但不表示空间构型①多用于研究有机物的性质 ②能反映有机物的结构,有机反应常用结构式表示 结构简式(示性式)CH3—CH3 (乙烷) 结构式的简便写法,着重突出结构特点(官 能团) 同“结构式”① 球棍模型小球表示原子,短棍表示价键用于表示分子的空间结构 (立体形状)
2020届高考化学课标版二轮习题:考前冲刺 第10题 常见有机物的结构与性质
第10题 常见有机物的结构与性质 题组一 常见有机物的性质及应用 1.下列生活用品中主要由塑料制成的是( ) A.汽车轮胎 B.聚乙烯包装膜 C.尼龙书包 D.棉袜子 答案 B A 项,汽车轮胎主要是由橡胶制成的;B 项,聚乙烯为典型的热塑性塑料;C 项,尼龙为聚酯类合成纤维;D 项,棉袜子的主要成分为纤维素。 2.下列说法正确的是( ) A.可用金属钠除去乙醇溶液中的水 B.萃取碘水中的碘单质,可用乙醇作萃取剂 C.我国西周时发明的“酒曲”酿酒工艺,是利用了催化剂使平衡正向移动的原理 D.汽油中加入适量乙醇作汽车燃料,可节省石油资源,减少汽车尾气对空气的污染答案 D A 项,钠与乙醇、水都能发生反应;B 项,乙醇与水互溶,此处不能用乙醇作萃取剂; C 项,“酒曲”为酿酒工艺中的催化剂,可加快反应速率,与平衡移动无关; D 项,汽油中加入适量乙醇作汽车燃料,可减少石油的使用,因此可节省石油资源,乙醇中含氧元素,提高了汽油中的含氧量,使汽油燃烧更充分,减少了碳氢化合物、CO 等的排放,减少了汽车尾气对空气的污染。 3.有机反应类型较多,形式多样。下列反应中属于加成反应的是( )①2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑ ②CH 2 CH 2+H 2O C 2H 5OH ③(C 6H 10O 5)n (淀粉)+nH 2O nC 6H 12O 6(葡萄糖) ④ +3H 2 A.①② B.③④ C.①③ D.②④ 答案 D 反应①属于置换反应,反应③属于水解(或取代)反应。 4.生活中一些常见有机物的转化如图: 淀粉 C 6H 12O 6
下列说法正确的是( ) A.上述有机物中只有C6H12O6属于糖类物质 B.转化1可在人体内完成,该催化剂属于蛋白质 C.物质C和油脂类物质互为同系物 D.物质A和B都属于非电解质 答案 B 淀粉(转化1)在人体内淀粉酶作用下发生水解反应,最终转化为葡萄糖,葡萄糖在酒化酶的作用下转化成酒精,反应方程式为C6H12O 6 2C2H5OH+2CO2↑,且A可发生连续氧化反应,则A为C2H5OH,B为CH3COOH,C为 CH3COOC2H5。A项,淀粉、C6H12O6属于糖类物质;B项,淀粉属于多糖,在酶催化作用下水解最终生成葡萄糖,此处的酶属于蛋白质;C项,C为乙酸乙酯,油脂为高级脂肪酸甘油酯,含—COOC—的数目不同,结构不相似,不互为同系物;D项,乙酸可在水中发生电离,为电解质,而乙醇不能,乙醇为非电解质。 5.由下列实验事实得出的结论不正确的是( ) 实验事实结论 A 将乙烯通入溴的四氯化碳溶液,溶液最终 变为无色透明 生成的1,2-二溴乙烷无色可溶于四氯化碳 B 乙酸乙酯和氢氧化钠溶液混合共热后,混 合液不再分层 乙酸乙酯在氢氧化钠溶液中可完全水解 C 葡萄糖与新制氢氧化铜悬浊液混合共热后, 生成砖红色沉淀 葡萄糖是还原性糖 D 乙酸和乙醇都可与金属钠反应产生可燃性 气体 乙酸分子中的氢与乙醇分子中的氢具有相 同的活性 答案 D A项,乙烯与溴发生加成反应生成无色的1,2-二溴乙烷,可溶于四氯化 碳,因此溴的四氯化碳溶液褪色;B项,乙酸乙酯属于酯,在氢氧化钠溶液中加热发 生水解反应生成乙酸钠和乙醇,混合液不再分层;C项,新制氢氧化铜悬浊液和葡萄 糖共热产生砖红色沉淀(氧化亚铜),氢氧化铜被葡萄糖还原,葡萄糖表现还原性;D
常见物质的化学式、及基础知识
常见物质的化学式 1、单质:H2氢气O2氧气N2氮气C碳P磷S硫Fe铁Cu铜Hg汞 2、化合物 (1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷Fe2O3氧化铁Fe3O4四氧化三铁 CaO氧化钙MgO氧化镁CuO氧化铜ZnO氧化锌 FeO氧化亚铁MnO2二氧化锰Na2O氧化钠 (2)酸:HCl盐酸H2SO4硫酸HNO3硝酸 H3PO4磷酸H2CO3碳酸H2SO3亚硫酸 (3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙 Ba(OH)2氢氧化钡Cu(OH)2氢氧化铜Fe(OH)3氢氧化铁 Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁 (4)盐:NaCl氯化钠Na2CO3碳酸钠ZnCl2氯化锌CaCl2氯化钙KCl氯化钾Na2SO4硫酸钠CuSO4硫酸铜AgCl氯化银FeCl3氯化铁 FeCl2氯化亚铁AlCl3氯化铝FeSO4硫酸亚铁Fe2(SO4)3硫酸铁 ZnSO4硫酸锌CaCO3碳酸钙BaCl2氯化钡BaSO4硫酸钡 KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾 KNO3硝酸钾Cu(NO3)2硝酸铜Hg(NO3)2硝酸汞 NH4Cl氯化铵NH4NO3硝酸铵(NH4)2SO4硫酸铵 NH4HCO3碳酸氢铵NaHCO3碳酸氢钠Cu2(OH)2CO3碱式碳酸铜 (5)有机物:CH4甲烷C2H5OH乙醇(酒精) CH3OH甲醇CH3COOH乙酸(醋酸) CO(NH2)2尿素C6H12O6葡萄糖(C6H10O5)n淀粉
记忆性知识 一、常见物质的颜色的状态 1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH) 2、Na2CO 3、NaCl、无水CuSO4; 铁、镁为银白色(汞为银白色液态) 2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4、KMnO4为紫黑色 3、红色固体:Cu、Fe2O3、HgO、红磷 4、硫:淡黄色、 Cu2(OH)2CO3为绿色 5、溶液的颜色: 凡含Cu2+的溶液呈蓝色(如:CuSO4溶液、CuCl2溶液、Cu(NO3)2溶液); 凡含Fe2+的溶液呈浅绿色(如:FeSO4溶液、FeCl2溶液、Fe (NO3)2溶液); 凡含Fe3+的溶液呈棕黄色(如:Fe2(SO4)3溶液、FeCl3溶液、Fe (NO3)3溶液),其余溶液一般为无色。(高锰酸钾溶液为紫红色) 6、沉淀(即不溶于水的盐和碱): ①盐:白色↓:CaCO3、BaCO3(溶于酸) AgCl、BaSO4(也不溶于稀HNO3) 等 ②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余不溶性碱为白色。 二、常见物质的学名、俗名及化学式
书写有机化合物结构式的基本规则
书写有机化合物结构式的基本规则 一、原子团书写规则 一些常见原子团的名称和书写规则。 乙基:—CH2CH3,—C2H5,C2H5— 羧基:—COOH,HOOC—,—CO2H 醛基:—CHO,OHC— 卤原子:—Cl,Cl—,—Br,Br— 甲氧基:—OCH3,CH3O— 甲酯基:—COOCH3,CH3OOC— 二、直接结合规则 无论是原子团的书写,还是结构式的书写,遵守直接结合规则是重要的原则之一。所谓直接结合规则,就是说在写结构式时,应当把各个原子或原子团按照它们在分子中结合的方式和次序而连接起来。下面举一些结构式书写的例子,进一步说明该规则的应用。 想正确书写结构简式,首先得知道该物质的官能团及碳骨架,对各官能团的结构简式要比较明确,不能省的碳碳双键及碳碳三键要写好,书写完成后,本着以下原则检查,每个碳原子成四个键,氧原子成两个键,氮原子成三个键,氢原子成一个键。对于葡萄糖来说,要知道它是一种链状的多羟基醛,有一个醛基(-CHO),另外的五个碳上各有一个羟基(-OH),其余为氢原子,CH2OH—CHOH—CHOH—CHOH—CHOH—CHO或CH2OH(CHOH)4CHO都行,注意“2”和“4”都是右下角标。 1.省略“C-H”键(与氢原子相连的键一般都是可以省的,有时可以不省是为了使其结构更清晰易辨)CH3-CH2-CH2-CH=CH2 2.省略“C-C”键(但官能团不能省略如C=C,碳碳叁键)CH3CH2CH2CH=CH2 3.缩写某些原子团CH3(CH2)2CH=CH2 4.工业上常有一些不太规范的写法,如把CH2=CH2写成CH2CH2,这种习惯甚至在中学化学的某些资料中也偶有出现。但对于中学生,应按规范方式书写。 例1.苯和萘结构式的写法。 例2.环己烷结构式的写法。 例3.其它各类化合物结构式的写法。 烷烃:CH3CH2CH3(H3CCH2CH3)(丙烷) 烯烃:CH2=CH2(H2C=CH2)(乙烯) CH3CH=CH2(CH2=CHCH3)(丙烯) 炔烃:CH≡CH(HC≡CH)(乙炔)
有机化合物结构的表示方法
有机化合物结构的表示方法(拓展应用) 一.学习目标 学会用结构式、结构简式和键线式来表示常见有机化合物的结构 二.重点难点 结构简式表示有机化合物的结构 三.知识梳理 【练习】写出下列有机物的电子式 乙烷、乙烯、乙炔、乙醇、乙酸、乙醛 1. 结构式的书写 (1)结构式定义 (2)书写注意点 【练习】写出下列有机物的结构式 乙烷、乙烯、乙炔、乙醇、乙酸、乙醛 2.结构简式书写: (1)定义 (2)书写注意点 ①表示原子间形成单键的“—”可以省略 ②“C=C”和“C≡C”中的“=”和“≡”不能省略。但醛基、羰基、羧基可以简写为“-CHO”、“-CO-”、“-COOH” ③不能用碳干结构表示,碳原子连接的氢原子个数要正确,官能团不能略写,要注意官能团中各原子的结合顺序不能随意颠倒。 【练习】写出下列有机物的结构简式 乙烷、乙烯、乙炔、乙醇、乙酸、乙醛 3.键线式: 定义:将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有一个碳原子,称为键线式。每个交点、端点代表一个碳原子,每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数既是氢原子个数。 【练习】写出下列有机物的键线式 丙烷、丙烯、丙炔、丙醇、丙酸、丙醛
CH 3CH 2CH 2CH 3CH 3CHCH 2CH 3 3 CH 3CH CHCH 3 注意事项: (1)一般表示3个以上碳原子的有机物;弄清碳原子的杂化方式 (2)只忽略C-H 键,其余的化学键不能忽略; (3)必须表示出C=C 、C ≡C 键等官能团; (4)碳氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中氢原子)。 (5)计算分子式时不能忘记顶端的碳原子。 【小结】有机化合物结构的表示方法 电子式 结构式 结构简式 键线式 【过关训练】 C C C C H H H H _________________________、___________________________ C C C C Br H Br H H _______________________、___________________________ C C C C H H H H H H H H ____________________________、___________________________ 3.有机化合物的结构简式可进一步简化,如: 略 去碳 氢 元素短线替换 省略短线 双键叁键保留
初三化学常见物质的化学式
初三化学常见物质的化学式 1、单质:H2氢气O2氧气N2氮气C碳P磷S硫Fe铁Cu铜Hg汞 2、化合物 (1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫 P2O5五氧化二磷Fe2O3氧化铁Fe3O4四氧化三铁CaO氧化钙MgO氧化镁 CuO氧化铜ZnO氧化锌FeO氧化亚铁MnO2二氧化锰 Na2O氧化钠 (2)酸:HCl盐酸H2SO4硫酸HNO3硝酸H3PO4磷酸H2CO3碳酸H2SO3亚硫酸 (3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡Cu(OH)2 氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁 (4)盐:NaCl氯化钠Na2CO3碳酸钠ZnCl2氯化锌CaCl2氯化钙KCl氯化钾Na2SO4硫酸 钠 CuSO4硫酸铜AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝FeSO4硫酸亚铁 Fe2(SO4)3硫酸铁ZnSO4硫酸锌CaCO3碳酸钙BaCl2氯化钡BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾Cu(NO3)2硝酸铜Hg(NO3)2硝酸汞NH4Cl 氯化铵NH4NO3 硝酸铵(NH4)2SO4硫酸铵NH4HCO3碳酸氢铵NaHCO3碳酸氢钠Cu2(OH)2CO3碱式碳酸 铜 (5)有机物:CH4甲烷C2H5OH乙醇(酒精)CH3OH甲醇CH3COOH乙酸(醋酸)CO(NH2)2 尿素,葡萄糖:C6H12O6淀粉:(C6H10O5)n 初三化学必需的记忆性知识 一、常见物质的颜色的状态 1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH) 2、KClO 3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态) 2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色 3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色 4、溶液的颜色:凡含Cu2+的溶液呈蓝色(如:CuSO4溶液、CuCl2溶液、Cu(NO3)2溶液);凡 含Fe2+的溶液呈浅绿色(如:FeSO4溶液、FeCl2溶液、Fe (NO3)2溶液);凡含Fe3+的溶液呈棕 黄色(如:Fe2(SO4)3溶液、FeCl3溶液、Fe (NO3)3溶液),其余溶液一般为无色。(高锰酸 钾溶液为紫红色) 5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸) AgCl、BaSO4(也 不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余不溶性碱为白色。 二、常见物质的学名、俗名及化学式 化学式名称俗称化学式名称俗称
杂环化合物及生物碱教材
第十一章杂环化合物及生物碱 杂环化学是有机化学的一个重要组成部分。所有的有机化合物,从结构上可以分为两大类,即链状化合物和环状化合物。在环状化合物中,所有的“环节”原子都是碳原子组成的,称为环状化合物。如果在“环节”原子中除了碳原子以外,还含有一个或者多个非碳原子时,则称为杂环化合物。杂环化学就是研究杂环化合物的化学。 杂环化合物中的非碳“环节”原子称为杂原子。在有机化学中,周期表中碳以外的其他元素,通常被看成是杂原子,并用以构成杂环化合物。实际上,到目前为止,有些元素——如零族和第Ⅱ族元素等,还尚未发现由它们组成的、稳定的杂环化合物。另外,金属元素的原子也能参与构成环状结构的分子,然而这种分子的键型结构和物理、化学性质都与一般的化合物不同,通常把它们称作金属有机化合物,而不作为杂环化合物来讨论。 在杂环化合物中,各种不同的“环节”原子的排列组合方式和键合类型是多种多样的,所以如此构成的杂环化合物的数目是十分的惊人的。据统计,在现今已知的有机化合物中,杂环化合物的数量,占总数的65%以上。因此,杂环化合物在有机化学的各领域研究中都占有极其重要的地位。 杂环化合物不仅种类繁多,而且在自然界中分布较为广泛。具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料分子结构也含有杂环。杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器件、贮能材料等,尤其在生物界,杂环化合物几乎随处可见。 在此,就不对杂环化合物品种多样性、应用广泛性进行过多的陈述。以下将杂环化合物中具有代表的几种物质向读者进行简要的介绍。最常见的杂原子是氧、硫和氮。如: O O S S 呋喃四氢呋喃噻吩四氢噻吩
有机物结构表示方法
有机物结构的表示方法 1、结构简式书写:不能用碳干结构表示,碳原子连接的氢原子个数要正确,官能团不能略写,要注意官能团中各原子的结合顺序不能随意颠倒。 2、键线式:将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有一个碳原子,称为键线式。每个交点、端点代表一个碳原子,每一条线段代表一个共价键,每个碳原子有四条线段,用四减去线段数既是氢原子个数。注意事项: (1)一般表示3个以上碳原子的有机物; (2)只忽略C-H键,其余的化学键不能忽略; (3)必须表示出C=C、C≡C键等官能团; (4)碳氢原子不标注,其余原子必须标注(含羟基、醛基和羧基中氢原子)。 (5)计算分子式时不能忘记顶端的碳原子。 3、碳原子的成键方式与分子空间构型的关系 (1)当一个碳原子与其它4个原子连接时,这个碳原子将采取sp3杂化取向与之成键;当碳原子之间或碳原子与其它原子之间形成双键时,形成该双键的原子以及与之直接相连的原子处于同一平面上;当碳原子之间或碳原子与其它原子之间形成叁键时,形成该叁键的原子以及与之直接相连的原子处于同一平面上。(2)有机物的代表物基本空间结构:甲烷是正四面体结构(5个原子不在一个平面上);乙烯是平面结构(6个原子位于一个平
面);乙炔是直线型结构(4个原子位于一条直线);苯环是平面结构(12个原子位于一个平面)。 (3)杂化轨道理论:C原子的sp、sp2、sp3杂化 4、有机分子空间构型解题规律 规律Ⅰ:以碳原子和化学键为立足点,若氢原子被其它原子所代替,其键角基本不变。 规律Ⅱ:若两个平面型结构的基团之间以单键相连,这个单键可以旋转,则两个平面可能共面,但不是“一定”。 规律Ⅲ:若两个苯环共边,则两个苯环一定共面。 规律Ⅳ:若甲基与一个平面型结构相连,则甲基上的氢原子最多有一个氢原子与其共面。若一个碳原子以四个单键与其它原子直接相连,则这四个原子为四面体结构,不可能共面。同时,苯环对位上的2个碳原子及其与之相连的两个氢原子,这四原子共直线。 【基础训练】 1、请写出下列有机化合物的结构式、结构简式和键线式。
杂环化合物
第13章杂环化合物 本章重点介绍杂环化合物的分类和命名;五元杂环化合物的结构特点、芳香性、亲电取代反应,六元杂环化合物的结构特点、芳香性、亲核取代反应;五元、六元杂环化合物的衍生物及其生物活性;稠杂环化合物的结构特点等。 在环状有机化合物中,构成环系的原子除碳原子外,还含有一个或多个非碳原子时,叫做杂环化合物(heterocyclic compound);环上除碳以外的原子称为杂原子,常见的杂原子有氧、硫、氮等。大多数杂环化合物具有不同程度的芳香性,环也比较稳定。因此,杂环化合物是有机化合物中数量最庞大的一类,约占总数的三分之二以上。 自然界中最具有强烈生物活性的天然有机化合物,绝大多数正是杂环化合物。例如:对核酸(nucleic acid)的活性起决定作用的碱基就是嘌呤(purine)和嘧啶(pyrimidine)的衍生物。又如叶绿素(chlorophyll)、氨基酸(amino acid)、维生素(vitamin)、血红素(haeme)、核酸(nucleic acid)、生物碱(alkaloid)等,大多数都在生命的生长、发育、遗传和衰亡过程中起着关键作用。 在现有的药物中,杂环类化合物占了相当大的比重。它们应用于各种疾病和医疗领域,其数量之大和种类之多,是难以想象的,比如我们非常熟悉的青霉素(benzylpenicillin)、头孢菌素(先锋霉素cephalosporin)、喹喏酮(Quinolone)类以及治疗肿瘤的5–Fu(5–Fluorouracil)、喜树碱(comptothecin)、紫杉醇(Taxol)等,都是含有杂环的化合物。 内酯、交酯、环状酸酐、内酰胺性质上与相应的开链化合物相似,它们不列入杂环化合物中讨论。本章将着重讨论五元和六元具有芳香性的化合物。 你在学完本章后,应该能回答以下问题: 1.你能写出一些常见杂环化合物的结构和名称吗? 2.为什么吡咯有一定的酸性而吡啶却显碱性? 3.为什么吡啶可以任意比例溶于水,同时又能溶于其它有机化溶剂? 4.为什么吡啶既能起亲电取代反应又可进行亲核取代反应? 5.你能写出青霉素、头孢菌素、咖啡因、尼群地平、雷米封等常用药物的结构及英文名称吗?
常见有机化合物官能团
常见有机化合物官能团 1. 苯基 苯(benzene, C6H6)有机化合物,是组成结构最简单的芳 香烃,在常温下为一种无色、有甜味的透明液体,并具有强烈的芳香气味。可燃,有毒,为IARC 第一类致癌物。苯具有的环系叫苯环,是最简单的芳环。苯分子去掉一个氢以后的结构叫苯基,用Ph 表示。因此苯也可表示为PhH 2. 羟基羟基,又称氢氧基。是由一个氧原子和一个氢原子相连组成的一价原子团,化学式-OH。 在无机物中在无机物中,通常含有羟基的为含氧酸或其的酸式盐。含羟基的物质溶解于水会电离出氢离子,因此含羟基的物质水溶液多成偏酸性。 在有机物中在有机化学的系统命名中,在简单烃基后跟着羟基的称作醇,而糖类多为多羟基醛或酮。 羟基直接连在苯环上的称作酚。 具体命名见OH 原子团的命名注:乙醇为非电解质,不显酸 性。 羟基的性质 1. 还原性,可被氧化成醛或酮或羧酸
2. 弱酸性,醇羟基与钠反应生成醇钠,酚羟基与氢氧化钠反应生成酚钠 3. 可发生消去反应,如乙醇脱水生成乙烯 OH 原子团的命名此原子团在有机化合物中称为羟基,是醇( ROH )、酚(ArOH )等分子中的官能团;在无机化合物水溶液中以带负电荷的离子形式存在(OH-1 ),称为氢氧根。当羟基与苯环相连形成苯酚时,可使苯环致活,显弱酸性。再进基主要进入其邻位、对位。 羟基与氢氧根的区别在很多情况下,由于在示性式中,羟基和氢氧根的写法相同,因此羟基很容易和氢氧根混淆。 虽然氢氧根和羟基均为原子团,但羟基为官能团,而氢氧根为离子。而且含氢氧根的物质在水溶液中呈碱性,而含羟基的物质的水溶液则多呈偏酸性。氢氧根和羟基在有机化学上的共性是亲核性。 有机合成中羟基的保护羟基是有机化学中最常见的官能团之一,无论是醇羟基还是酚羟基均容易被多种氧化剂所氧化。因此在多官能团化合物 的合成过程中,羟基或者部分羟基需要先被保护,阻止它参与反应,在适当的步骤中再被转化。 3. 烃基
常见有机物结构式
有机结构 一、常见有机物结构式 (1) 1.烷 .................................................................................................................................................................. 1 2.环烷 .............................................................................................................................................................. 2 3.烯 .................................................................................................................................................................. 2 4.炔 .................................................................................................................................................................. 2 5.二烯 .............................................................................................................................................................. 2 6.芳香物 .......................................................................................................................................................... 2 7.醇 .................................................................................................................................................................. 3 8.酚 .................................................................................................................................................................. 3 9.醛 .................................................................................................................................................................. 3 10.酮 ................................................................................................................................................................ 3 11.羧酸 ............................................................................................................................................................ 4 12.酯 ................................................................................................................................................................ 4 13.糖 ................................................................................................................................................................ 4 14.氨基酸 ........................................................................................................................................................ 4 15.其它 ............................................................................................................................................................ 4 二、聚合反应 .. (4) 1.单烯加聚 ...................................................................................................................................................... 4 2.二烯加聚 ...................................................................................................................................................... 5 3.缩聚 .. (5) 一、常见有机物结构式 1.烷 C H H H H C H H H C H H H C H H H C H H H C H C H H H H H C H C H H H H H C H H C H C H H H H H C H H C H H CH 3CHCH 33 C CH 3 CH 2CH 3 CH 3 CH 3CH CH 3CH CH 3 CH C C H H Cl Cl Cl C H H Cl
有机化学 第十一章 杂环化合物和生物碱
第十一章杂环化合物和生物碱 杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。本章介绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提取方法和重要的生物碱。 第一节杂环化合物 环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构,则这种环状化合物叫做杂环化合物。组成杂环的原子,除碳以外的都叫做杂原子。常见的杂原子有氧、硫、氮等。前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。 杂环化合物种类繁多,在自然界中分布很广。具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。 杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器件、贮能材料等,尤其在生物界,杂环化合物几乎随处可见。
一、杂环化合物的分类和命名 为了研究方便,根据杂环母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大类。最常见的单杂环有五元环和六元环。稠杂环有芳环并杂环和杂环并杂环两种。另外,可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。 杂环化合物的命名在我国有两种方法:一种是译音命名法;另一种是系统命名法。 译音法是根据IUPAC 推荐的通用名,按外文名称的译音来命名,并用带“口”旁的同音汉字来表示环状化合物。例如: 呋喃 咪唑 吡啶 嘌呤 furan imidazole pyridine purine 杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子开始。含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并使其余杂原子的位次尽可能小;如果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。例如: O N N N N N N H N
常见化合物的元素组成
常见化合物的元素组成
各种化合物的元素组成 1 各种化合物的元素组成 糖类:C、H、O 脂肪:C、H、O 固醇:C、H、O 磷脂:C、H、O、N、P 蛋白质:C、H、O、N(P、S等) 核酸:C、H、O、N、P ATP:C、H、O、N、P 叶绿素:C、H、O、N、M、g 胡萝卜素:C、H 叶黄素:C、H、O NADH:C、H、O、N、P NADPH:C、H、O、N、P 2 说明: 2.1 糖类、脂肪、固醇和叶黄素的组成元素都只有CHO。 2.2 必修一:脂质的组成元素主要是CHO,有些脂质还含有P和N。磷酸的组成元素有N和P。
2.3 磷酸、核酸、ATP、NADH和NADPH都由C、H、O、N、P组成。 2.4 蛋白质一定含有C、H、O、N元素,有的还含有S、P等。如血红蛋白含有Fe、S,其化学式:C3032H4816O812N780S8Fe4。另外上述各种化合物都没有S,而蛋白质可能含有S,所以如果哪个有机物含有S,那么一般可以确定该物质是蛋白质,也就是说S是蛋白质的一种特殊元素。 2.5 叶绿素和类胡萝卜素的组成元素不同,叶绿素含Mg,类胡萝卜素不含Mg。 2.6 固醇的化学结构
2.7 叶绿素的化学式:叶绿素a C55H72O5N4Mg 叶绿素b C55H70O6N4Mg 叶绿素c1C35H30O5N4M 叶绿素c2C35H28O5N4Mg 叶绿素d C54H70O6N4Mg 叶绿素f C55H70O6N4Mg 2.8 叶绿素a的结构
2.9 叶绿素b、c、d 2.10 β-胡萝卜素的结构: 2.11 叶黄素:C40H56O2
14有机分子式和结构式的确定
专题十四有机物分子式和结构式的确定 专题新平台 【直击高考】 1.了解常见有机物的组成和结构,能够识别结构简式中各原子的连接次序。并能根据结构简式中各原子的连接次序的不同,确定其不同的化学性质。 2.能根据化学实验现象,结合化学反应推导并确定有机物的分子式及结构式(或结构简式)。 3.能根据实验现象、实验数据分析有机反应,确定其化学式及其结构。 4.综合应用有机化学知识,确定分子式及结构式,此类试题选择、填空均有,有时还涉及到有机化学计算,为高考化学中的常考题。 【难点突破】 1.方法与技巧 (1)如果两种有机物燃烧时耗氧量相同,则每增加1个氧原子,必须多2个氢原子,若增加2个氧原子,则应多4个氢原子,以此类推。或每增加1个碳原子,必须多2个氧原子,若增加2个碳原子,则应多4个氧原子,以此类推。 (2)如果有机物的通式可写成(CO)n H m的形式,则其完全燃烧的产物,通过Na2O2后,其增加的质量即为有机物的质量。 (3)常见的有机分子的空间构型有四面体型(CH4、CCl4等)、直线型(C2H2等)、平面型(C2H4、C6H6等),掌握其结构对推断复杂分子的结构非常重要。 (4)放大的有机结构(参见本专题训练4、8题),通常应用在有机小分子中,此类试题要求考生能将放大后的结构,根据题设要求回复到通常状态,然后对题中设问遂一化解。 (5)缩小的有机结构(如键线式),通常应用在较大或较复杂的有机物质中,此类试题要求考生能将缩小后的结构,根据题设要求回复到一般的结构简式,然后再对题中设问遂一分析,以此方可获得正确结果。 2.解题注意点 (1)组成有机物的元素虽然较少,但由于碳碳间可通过共价键连接,因而其物质种类较多。因此有关有机物组成的分析,必须依靠燃烧或其它的相关反应。 (2)有机结构的分析包括:空间结构的分析;结构简式的分析。 ①空间结构的分析:此类试题主要考查考生对原子共平面或共直线的分析与判断。在解题时,要注意将甲烷、乙烯、乙炔、苯等有机物的结构迁移到新的物质中。 ②结构简式的分析:要注意利用官能团的结构,来确定有机化学反应。 3.命题趋向 有机化学中分子式和结构式的考查,是高考中的重点和难点。随着考试内容与考试方式的改革,有关有机结构的考查形式也在不断地发生变化,如目前巳考查到顺反异构、手性异构。在此类试题面前,不少考生显得束手无策,唯有抓住信息,理清关系,方能正确作答。
第二十章 杂环化合物
第二十章 杂环化合物 杂环化合物和生物碱广泛存在于自然界中,在动植物体内起着重要的生理作用。本章介绍杂环化合物的分类、命名、结构特点、性质及重要的杂环化合物,生物碱的一般性质、提取方法和重要的生物碱。 环状有机化合物中,构成环的原子除碳原子外还含有其它原子,且这种环具有芳香结构,则这种环状化合物叫做杂环化合物。组成杂环的原子,除碳以外的都叫做杂原子。常见的杂原子有氧、硫、氮等。前面学习过的环醚、内酯、内酐和内酰胺等都含有杂原子,但它们容易开环,性质上又与开链化合物相似,所以不把它们放在杂环化合物中讨论。 杂环化合物种类繁多,在自然界中分布很广。具有生物活性的天然杂环化合物对生物体的生长、发育、遗传和衰亡过程都起着关键性的作用。例如:在动、植物体内起着重要生理作用的血红素、叶绿素、核酸的碱基、中草药的有效成分——生物碱等都是含氮杂环化合物。一部分维生素、抗菌素、植物色素、许多人工合成的药物及合成染料也含有杂环。 杂环化合物的应用范围极其广泛,涉及医药、农药、染料、生物膜材料、超导材料、分子器件、贮能材料等,尤其在生物界,杂环化合物几乎随处可见 第一节 杂环化合物的分类和命名 为了研究方便,根据杂环母体中所含环的数目,将杂环化合物分为单杂环和稠杂环两大类。最常见的单杂环有五元环和六元环。稠杂环有芳环并杂环和杂环并杂环两种。另外,可根据单杂环中杂原子的数目不同分为含一个杂原子的单杂环、含两个杂原子的单杂环等。 杂环化合物的命名在我国有两种方法:一种是译音命名法;另一种是系统命名法。 译音法是根据IUPAC 推荐的通用名,按外文名称的译音来命名,并用带“口”旁的同音汉字来表示环状化合物。例如: 呋喃 咪唑 吡啶 嘌呤 furan imidazole pyridine purine 杂环上有取代基时,以杂环为母体,将环编号以注明取代基的位次,编号一般从杂原子开始。含有两个或两个以上相同杂原子的单杂环编号时,把连有氢原子的杂原子编为1,并使其余杂原子的位次尽可能小;如果环上有多个不同杂原子时,按氧、硫、氮的顺序编号。例如: 2,5-二甲基呋喃 4 –甲基咪唑 4,5–二甲基噻唑 当只有1个杂原子时,也可用希腊字母编号,靠近杂原子的第一个位置是α-位,其次为β-位、γ-位等。例如: O N N N N H N N H N O H 3CC H3 N NH H 3CN S H3CH 3C1 2 3 4 5 5 4 3 1 5 4 3 2 1 α β γ α β O CHO N CH 3
