物质熔沸点的比较

物质熔沸点的比较
1、不同晶体类型的物体的熔沸点高低的一般顺序
原子晶体→离子晶体→分子晶体(金属晶体的熔沸点跨度大)
同一晶体类型的物质,晶体内部结构粒子间的作用越强,熔沸点越高。
2、原子晶体要比较其共价键的强弱,一般地说,原子半径越小,形成的共价键长越短,键能越大,其晶体熔沸点越高,如:金刚石→碳化硅→晶体硅。
3、离子晶体要比较离子键的强弱,一般地说,阴阳离子的电荷数越多,离子半径越小,则离之间的相互作用就越强,其离子晶体的熔沸点越高。如:MgO >Mgd2>Nad>Csd。
4、分子晶体组成和结构相似的物质,相对分子质量越大,熔沸点越高,如:O2>N2,HI>HBr>Hd;组成和结构不相似的物质,分子极性越大,其熔沸点越高,如Co>N2;在同分异构件,一般支链越多,其熔沸点越低,如沸点,正成烷>异成烷>新戌烷洁香烃及其衔生物的同分异构件,其熔沸点,高低顺序为:邻位>间位>对位化容物。
5、金属晶体中金属离子半径越小,离子电荷越多,其金属键越强,金属熔沸点就越高。
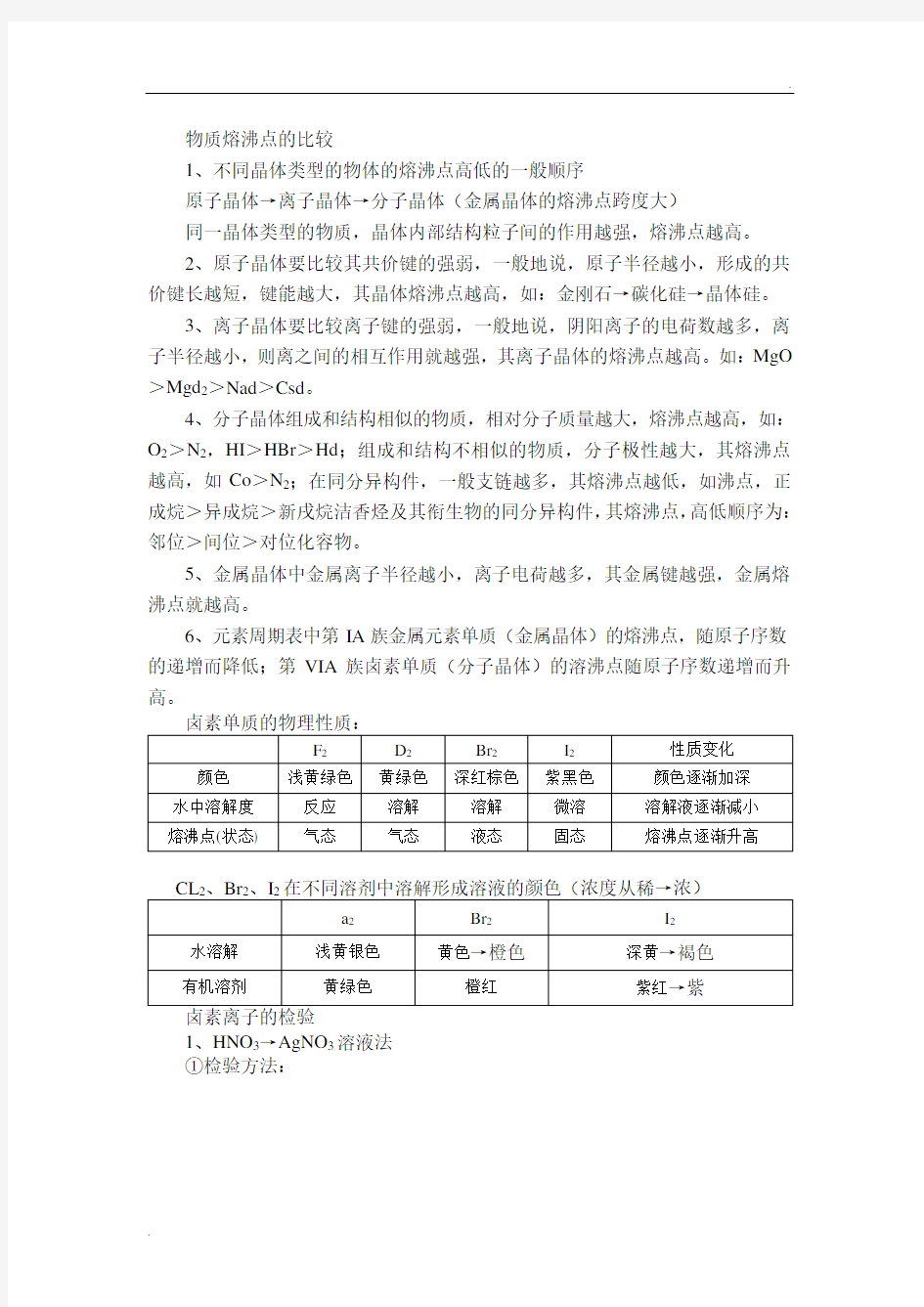
6、元素周期表中第IA族金属元素单质(金属晶体)的熔沸点,随原子序数的递增而降低;第VIA族卤素单质(分子晶体)的溶沸点随原子序数递增而升高。
1、HNO3→AgNO3溶液法
①检验方法:
表明存在cl
表明存在Br
表明存在I
②反应原理
反应①:Ag+d-=Agd↓反应②:Ag+Br-=AgBr↓反应③:Ag+I-=AgI↓
2、氯水—CdH法
①检验方法
加适量新朱子饱和氯水加Cll H 未知液混合液分层
振荡振荡
橙红色表明有Br-
有机层
紫红色表明有I-
②原理:
D2+2Br-=Br2+2a-
d2+2I-=I2+2d-,因Br2、I2在ccl4中的溶解度大于在水中的溶解度。
3、检验食盐是否加碘(1:Io3)的方法
①检验方法
变蓝:加碘盐
食盐
未变蓝:无碘盐
②反应原理:IO3-+SI-+6H+=3I2+3H2O(淀粉遇I2变蓝色)
常见的放热反应与吸热反应
一、放热反应
(1)燃烧都是放热反应;(2)中和反应都是放热反应;(3)化合反应都是放热反应;(4)置换风应多为放热反应;(5)生石灰与水的反应、铝热反应等。
二、吸热反应
(1)盐类的水解反应都是吸热反应;(2)弱电*质的电荷一般是吸热反应;(3)大多数分解反应都是吸热反应;(4)需要持续加热的反应,如:NH4d与C a CoA2,制NA3,A2还原C a O,配制C2H4。
注意区别反应的热效应与反应的条件。
化学反应中的能量变化主要表现为放热和吸热,反应是放热还是吸热,主要取决于反应物,生成物所具有的总能量的相对大小,放热反应和吸热反应在一定条件下都能发生。反应开始时需要持续加热的反应可能是吸热反应,也可能是放
热反应,反应的热量变化与反应发生是否需要加热,没有必然的联系。
盖斯定律
内容:化学反应的反应热只与反应体系的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。
判断晶体类型的方法:
金属氧化物(如:2O,Na2O2等)强碱(如:NadH、LiOH等)和绝大多数的盐类是离子晶体,大多数非金属单质(除金刚石、石墨、晶体硅外)、气态氢化物、非金属氯化物(除Sio2外),酸、绝大多数有机物(除有机盐外)是分子晶体,常见的原子晶体单质有金刚石、晶体硅、晶体硼等,常见的原子晶体化合物有碳化硅、二氧化硅等金属单质(除汞外)与合金是金属晶体。
物质溶沸点高低的比较规律
(2)卤素类推规律中的若干“例外”
卤素是典型的非金属元素,其性质有一定的规律性,但由于结构的差异性,在某些方面有一些“例外”,如:
①AgX难溶于水,但AgF易溶于水;C a X2易溶于水,但C a F2(俗名萤石)不溶于水。
②AgX一般为浅黄色或黄色,但AgC1为白色(AgF黄色,AgBr浅黄色,
Ag1黄色);AgX有感光性;
2
,但AgF无感光性。
③X2跟水反应:X2+H2O HX+HXO,但F2例外:
2F2 +H2O=4HF+O2(水作还原剂)
④在卤素的化合物中,只有氟无正价,无含氧酸。在氯的含氧酸中,高价的酸性强,低价的氧化性强,即:
酸性:HCIO4>HCIO3>HCIO2>HCIO;
氧化性:HCIO>HCIO2>HCIO3>HCIO4。
⑤HX随相对分子质量增大,分子间作用力增强,熔、沸点升高,但HF的熔、沸点反常(HF分子间易形成氢键)。
⑥在CI2、Br2、I2中,前都可把后者从它的非含氧酸盐溶液中置换出来,但F2例外,F2与CI2、Br2、I2的非含氧酸盐溶液作用时,会先与水发生剧烈反应。
⑦X2跟强碱反应:X2+2OH-X-+XO-+H2O,但F2例外;2F2+2OH-
2F-+OF2 +H2O。
⑧HX为强酸,且酸性:HI>HBr>HCI>HF,但HF是弱酸。
⑨X2及对应的氢卤酸不能与玻璃发生化学反应,但F2和氢氟酸例外,以腐蚀玻璃,因此制F2、HF时要在铅制器皿中进行,氢氟酸只能装在铅瓶或塑料瓶
中。
⑩X2可用对应的浓的氢卤酸与二氧化锰共热制取,但F2只能用电解法制取,
F2。
MnO2
MnX2+X2 +2H
2
O(X=CI、Br、I)
2KHF
22
+F2
制HCI:
NaCI(s)+H2SO4(浓)
NaHSO4+HCI
制HBr、HI不能用浓H2SO4,因HBr、HI皆易被浓硫酸氧化,故只能用非氧化性的浓磷酸与NaBr或NaI作用。
NaI+H3PO4(浓)NaH2PO4+HI
制:HF:CaF2+H2SO4(浓CaSO4+2HF (必须在铅制器皿中进行)
为什么制CO2时不能用稀H2SO4与CaCO3,制HF时却可用CaF2与浓H2SO4?两个反应均生成了微溶的CaSO4,为什么前者可阻止反应进行,后者却可以使反应进行呢?这是因为CaSO4溶于浓H2SO4生成Ca(HSO4)2,[CaSO4+ H2SO4(浓)Ca(HSO4)2]可使CaF2与浓H2SO4的反应继续进行。CaSO4不与稀硫酸反应,生成的CaSO4会覆盖在CaCO3表面,使反应停止。
⑿CI2、Br2分别在对应的可溶性氯化物和溴化物溶液中的溶解度因同离子效应而变小(因此可用排饱和食盐水的方法来收集氯气)。但碘例外,碘在碘化物中溶解度变大,这是因为有反应:I2+I- I3-(配制碘酒时加入KI以提高碘的溶解度)。
⒀卤素单质中,只有碘遇淀粉溶液变蓝。但碘的四氯化碳溶液遇淀粉并不变蓝。这是因为碘在四氯化碳中溶解度大,在水中溶解度小,四氯化碳中的碘不能被提取到淀粉溶液中,故不变蓝色。
⒁X2与变价金属铁反应生成FeX3,但I2例外:Fe+I2FeI2。从反应:2 Fe3+ +21- 2 Fe2+2知,氧化性Fe3+>I2FeI3。
⒂NH4Cl 3 +HCI ,但NH4I例外:2 NH4 3 + H2 +I2 。这是因为先生成的HI不稳定,继续分解所致。
例:比较各组热化学方程式中△H的大小关系。
A.S(s)+O2(g) SO2(g) △H1
S(g)+O2(g) SO2(g) △H2
△H1 △H2
B.CH4(g)+2O2(g) CO2(g)+2H2O(1) △H1
CH4(g)+2O2(g) CO2(g)+2H2O(g) △H2
△H1 △H2
C.4AI(s)+3O2(g) 2AI2O3(s) △H1
4Fe(s)+3O2(g) 2Fe2O3(s) △H2
△H1 △H2
D.煤作为燃料有2种途径:
途径1——直接燃烧:
C(s)+O2(g) CO2(g) △H1<0
途径2——先制水煤气:
C(s)+H2O (g) CO (g)+H2(g) △H2>0
再燃烧水煤气:
2CO(g)+O2(g) 2CO2(g) △H3<0
2H2(g)+O2(g) 2H2O (g) △H4<0
△H1、△H2、△H3、△H4的关系式是。
解析:A项中两式相减得:S(s) S(g);△H=△H1-△H2>0(固态硫变为硫蒸气是吸热过程),所以△H1>△H2(气态硫比固体硫燃烧放出的热量多);B项中两式相减得:2H2O(g) 2H2O(1);△H=△H1-△H2<0(水蒸气变为液态水是放热过程),所以△H1<△H2(生成液态水比生成水蒸气放出的热量多);C项中两式相减得:4AI(s)+2Fe2O3(s) 2AI2O3(s)+4Fe(s);△H=△H1-△H2<0(铝热反应很剧烈,是典型而熟悉的放热反应),所以△H1<△H2:D项中将途径2的后两个热化学方程式分别乘以1/2后与第一个热化学方程式相加得:C(s)+O2(g) CO2(g),△H2=1/2(△H3+△H4),即△H1=△H2+1/2(△H3+△H4),(两种途径的△H完全相同)。
