引物-生产及使用详解

武汉安基生物科技有限公司
引物-生产及使用详解
(一)引物的合成和纯化
1. 引物是如何合成的?
目前引物合成基本采用固相亚磷酰胺三酯法。DNA 合成仪有很多种,无论采用什么机器合成,合成的原理都相同,主要差别在于合成产率的高低,试剂消耗量的不同和单个循环用时的多少。安基生物公司采用的合成仪为最新引进的Dr.Oligo192高通量合成仪,效率高,合成量大,质量稳定。
亚磷酰胺三酯法合成DNA 片段,具有高效、快速的偶联以及起始反应物比较稳定的特点。该方法具有高效、快速的偶联以及起始反应物比较稳定的特点。主要是将DNA 固定在固相载体上完成DNA 链的合成的,合成的方向是由待合成引物的3'端向5'端合成的,相邻的核苷酸通过3'→5'磷酸二酯键连接。
固相亚磷酰胺三酯法合成引物的具体步骤如下: 第一步:将预先连接在固相载体CPG 上的活性基团被保护的核苷酸与三氯乙酸反应,脱去其5'-羟基的保护基团DMT,获得游离的5'-羟基。
第二步:合成DNA 的原料,亚磷酰胺保护核苷酸单体,与活化剂四氮唑混合,得到核苷亚磷酸活化中间体,它的3'端被活化,5'-羟基仍然被DMT 保护,与溶液中游离的5'-羟基发生缩合反应。
第三步:带帽(capping)反应,缩合反应中可能有极少数5'-羟基没有参加反应(少于2%),用乙酸酐和1-甲基咪唑终止其后继续发生反应,这种短片段可以在纯化时分离掉。
第四步:在氧化剂碘的作用下,亚磷酰形式转变为更稳定的磷酸三酯。 经过以上四个步骤,一个脱氧核苷酸被连接到固相载体的核苷酸上。再以三氯乙酸脱去它的5'-羟基上的保护基团DMT,重复以上步骤,直到所有要求合成的碱基被接上去。合成过程中可以观察TCA 处理阶段的颜色判定合成效率。 通过氨水高温处理,连接在CPG 上的引物被切下来,通过OPC、PAGE 等手段纯化引物,成品引物用C18浓缩,脱盐,沉淀。沉淀后的引物用水悬浮,测定OD260定量,根据定单要求分装。
2. DNA 合成粗产物中含有什么杂质?
主要是合成反应过程中产生的短片段以及脱保护基团时产生的铵盐。
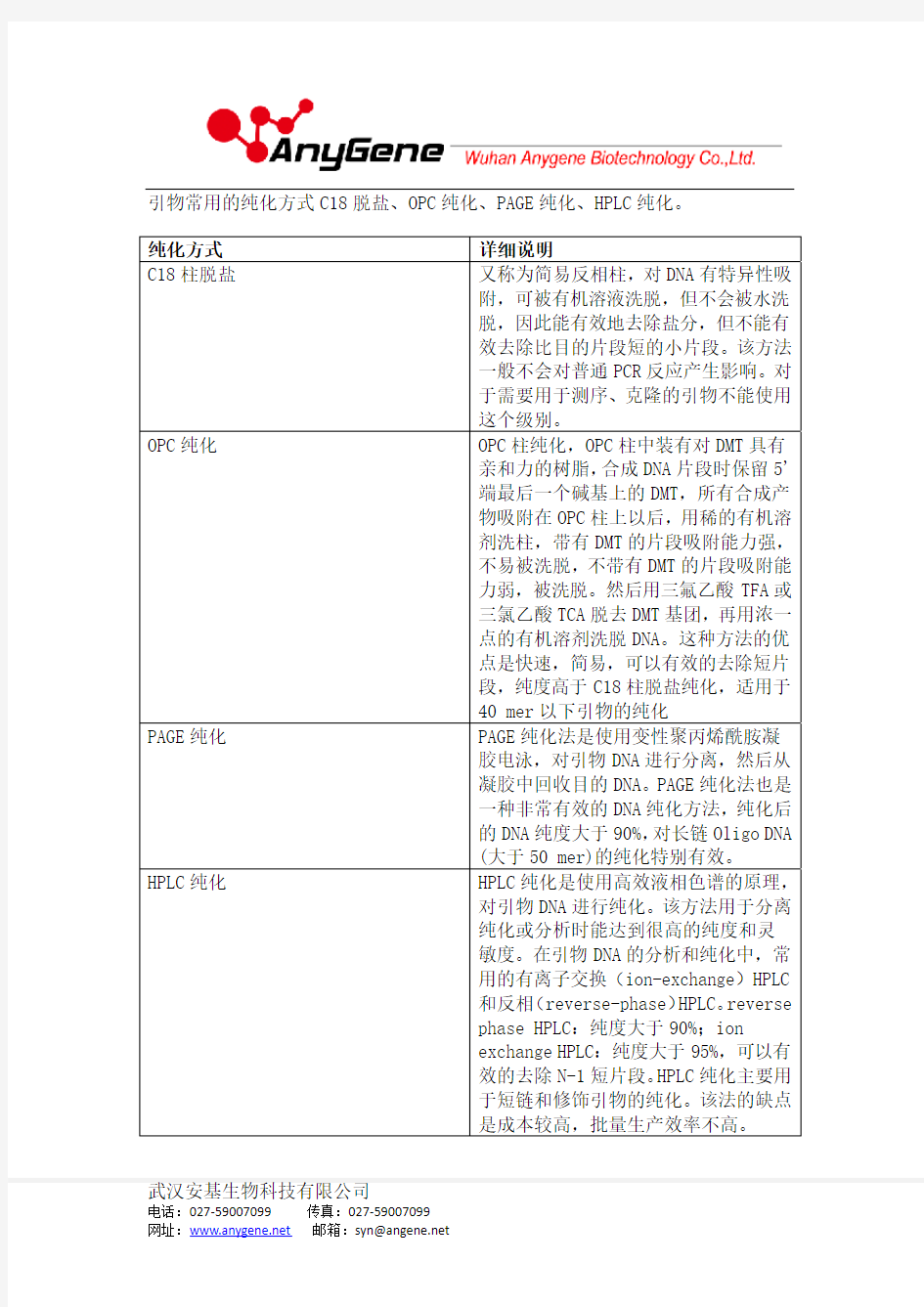
3. 引物纯化方式有哪些?
武汉安基生物科技有限公司
引物常用的纯化方式C18脱盐、OPC 纯化、PAGE 纯化、HPLC 纯化。 纯化方式 详细说明
C18柱脱盐
又称为简易反相柱,对DNA 有特异性吸附,可被有机溶液洗脱,但不会被水洗脱,因此能有效地去除盐分,但不能有效去除比目的片段短的小片段。该方法一般不会对普通PCR 反应产生影响。对于需要用于测序、克隆的引物不能使用这个级别。
OPC 纯化
OPC 柱纯化,OPC 柱中装有对DMT 具有亲和力的树脂,合成DNA 片段时保留5'端最后一个碱基上的DMT,所有合成产物吸附在OPC 柱上以后,用稀的有机溶剂洗柱,带有DMT 的片段吸附能力强,不易被洗脱,不带有DMT 的片段吸附能力弱,被洗脱。然后用三氟乙酸TFA 或三氯乙酸TCA 脱去DMT 基团,再用浓一点的有机溶剂洗脱DNA。这种方法的优点是快速,简易,可以有效的去除短片段,纯度高于C18柱脱盐纯化,适用于40 mer 以下引物的纯化
PAGE 纯化
PAGE 纯化法是使用变性聚丙烯酰胺凝胶电泳,对引物DNA 进行分离,然后从凝胶中回收目的DNA。PAGE 纯化法也是一种非常有效的DNA 纯化方法,纯化后的DNA 纯度大于90%,对长链Oligo DNA (大于50 mer)的纯化特别有效。
HPLC 纯化
HPLC 纯化是使用高效液相色谱的原理,对引物DNA 进行纯化。该方法用于分离纯化或分析时能达到很高的纯度和灵敏度。在引物DNA 的分析和纯化中,常用的有离子交换(ion-exchange)HPLC 和反相(reverse-phase)HPLC。reverse phase HPLC:纯度大于90%;ion exchange HPLC:纯度大于95%,可以有效的去除N-1短片段。HPLC 纯化主要用于短链和修饰引物的纯化。该法的缺点是成本较高,批量生产效率不高。
武汉安基生物科技有限公司
4. 引物纯化方式如何选择?
客户可根据实验需要,确定订购引物的纯化方式。 应用
引物长度要求 纯度级别要求
一般PCR 扩增
< 45 base OPC > 45 base
PAGE
诊断PCR 扩增 < 40 base OPC, PAGE DNA 测序 20 base 左右 PAGE
亚克隆,点突变等 根据实验需要 OPC, PAGE, HPLC 基因构建(全基因合成) 根据实验需要 PAGE 反义核酸 根据实验需要 PAGE
修饰引物 根据实验需要 PAGE, HPLC
5. 合成的引物5’端是否有磷酸化?
合成的引物5’端为羟基,没有磷酸基团。
6. 最长可以合成多长的引物?
引物越长,出现问题的概率就越大。除非有特殊需要,我们建议合成片段长度不要超过80 mer,按照目前的引物合成效率,80 mer 的粗产品,全长引物的百分比不会超过40%,后续处理还会丢失很多,因此最后的产量很低。安基生物最长可合成100 base 的引物。
7. 为何长链引物的收费要比短链引物要高?
在合成长链引物时,所需要的试剂比短链引物要多,尤其是长度大于90 base 的引物。由于成本的增加,从而导致价格较高。
8. 交付引物质量好坏的判断标准是什么?
合成的引物和您的定单序列一致,而不是能否扩增出您所需要的产物。
9. PCR 产物经过克隆以后测序发现引物区与合成序列不相符合,怎么办?
武汉安基生物科技有限公司
多数情况是PCR 过程和克隆过程中引入的错误。遇到这种情况,请您 1) 重新多挑取几个克隆测序,找到正确克隆的可能性更大 2) 可以要求我们重新免费合成引物。
10. 测序发现引物有突变是怎么回事?
引物合成是一种多步骤的化学反应,每一步的合成效率最高也就是99%,副产品不可避免。链越长,突变的频率累加起来就越高。在您PCR 扩增后克隆测序的时候,为了节约时间和提高成功率,我们有如下建议:
1)请您在检测到阳性克隆后准备2~3个阳性克隆子的菌液,尽量送测2个或以上克隆,这样成功率将大大提高,也节约很多时间;
2)也可以先送测1个克隆,其余两个克隆子的菌液在冰箱4度保存,一旦出现个别点突变或缺失,立即将余下的两个克隆送测;
3)这样得到正确的序列可能性将非常高,并且可以免去重新PCR、连接、克隆以及筛选的一系列实验操作,更省去了很多时间; 如您发现2~3个以上克隆都在引物区存在突变,经确认是由引物的原因引起的话,我们将会立即安排加急免费重合,并以最快的速度送到您的手里。 (二)引物的定量、保存和溶解
11. 如何确定需要合成多少OD 值的引物?
根据实验目的确定。一般PCR 扩增,20个碱基左右引物2 OD,可以做400次50 μl 标准PCR 反应。如果是做基因拼接或退火后做连接,1 OD 就足够了。
12. 如何测定引物的OD 值?
合成引物的OD 值是这样测定的:用紫外分光光度计,波长260 nm,石英比色杯,光程为1厘米,测定溶液的光密度。测定时溶液的光密度最好稀释到0.2-0.8之间。DNA 干粉用一定体积的水充分振荡溶解以后,用1 ml 水稀释测OD 值。需要根据稀释倍数换算出母液的OD 值。例如,验证2 OD 引物量是否准确,简单的做法是:加入1 ml 水,彻底溶解混匀后,取100 μl, 加入900 μl 水,用光径为1 cm 的石英比色杯,波长260 nm,此时光吸收的读数为0.2。
13. 如何通过OD 值计算引物的浓度?
安基生物的合成报告单和引物标签上都会标识OD 值与摩尔量。引物保存在高浓度的状况下比较稳定。溶解前您需要核对合成报告单和引物标签上的引物OD 值是否一致。如果不一致,请及时和我们联系。我们可以根据生产记录查到实际产量是多少。
武汉安基生物科技有限公司
根据国际统一标准: 1OD 引物干粉约为33微克; 引物的摩尔数(μmol) =质量数 / 引物分子量 =(OD 数×33)/引物分子量
如您拿到1管2 OD 的引物, 分子量是6565.3 引物的摩尔数(μmol) =(2×33)/6565.3 ≈0.010μmol=10 nmol
若您需要溶解为10μM (=10pmol/μl)的溶液,只需加入1 ml 无菌ddH 2O 或10 mM pH7.5 TE 缓冲液充分溶解即可。
14. 引物(含修饰)的分子量是如何确定的?
武汉安基生物生物科技有限公司所提供的Oligo 分子量均按照精确算法进行计算。
分子量计算公式:MW= A×313.21 + G×329.21 + C×289.18 + T×304.2 + M×301.2 +R×321.21 + W×308.71 + S×309.2 +Y×296.69 + K×316.71 + V×310.53 + H×302.2 + D×315.54 + B×307.53 + N×308.95 +16×Ns + 修饰基团分子量 - 61.96
公式中Ns 为硫代数目,硫代每个位置增加分子量16,其余字母均代表相应碱基的个数。兼并碱基分子量取相应碱基分子量的平均值,如
M=A/C=(313.21+289.18)/2 常用的兼并碱基代码:M=A/C R=A/G W=A/T S=G/C Y=C/T K=G/T V=A/G/C H=A/C/T D=A/G/T B=G/C/T N=A/G/C/T 常规修饰基团分子量
修饰基团 分子量 修饰基团 分子量 5’-Biotin 405.45 3’-TAMARA 623.60 5’-(6 FAM) 537.46 3’-Dabsyl 498.49 5’-HEX 744.13 3’-(6 FAM) 569.46 5’-TET 675.24 3’-Amino Modifier C3 153.07 5’-Cy5 533.63 3’-Amino Modifier C7 209.18 5’-Cy3
507.59
3’-Thiol Modifier C3
154.12
15. 如何保存引物?
引物合成后,经过一系列处理和纯化步骤,旋转干燥而成片状物质。没有溶解的引物非常稳定,-20 ℃下可保存2-3年,甚至更长。溶解后的引物-20 ℃下避免
武汉安基生物科技有限公司
反复冻融,可以保存至少半年以上。如果对实验的重复性要求较高,合成的OD 值较大,建议将溶解好的引物事先稀释为100 μmol/L 的储存液,分装数份保存于-20 ℃冰箱。使用前,将浓溶液稀释成工作液(10 pmol/ml 或20 pmol/ml)后进行实验。修饰荧光引物需要避光保存。
16. 引物在常温下运输,会降解吗?
不会降解,干燥的引物在常温至少可以稳定存放二周以上。而一般的运输时间通常都在1-3天,所以您收到的引物不会降解。
17. 如何溶解引物?
干燥后的引物质地非常疏松,开启瓶盖溶解之前最好在3000-4000转/分钟 的转速下离心1分钟,或管垂直向上在桌面上轻敲几次,将引物粉末收集到管底,防止开盖时引物散失。根据计算出的体积加入去离子无菌水或10 mM Tris pH 7.5缓冲液,室温放置几分钟,上下混匀振荡,离心将溶液收集到管底。溶解引物用的水一般不要用蒸馏水,因为有些蒸馏水的pH 值比较低(pH 4-5),引物在这种条件下不稳定。
我们的合成报告单给出了每管引物稀释为100 μmol/L(即100 pmol/μl)浓度的加水量,您可以根椐您的实验需要加入适量的无核酸酶的双蒸水(PH > 6.0)或TE 缓冲液(PH 7.5-8.0)。
18. 已经溶解的引物,为什么原先使用正常,而过一段时间再使用就不好了?
如果您溶解引物的水PH 过低或污染了菌或核酸酶,会使引物降解。使用时没有充分解冻混合,液体不均匀也可能会造成引物加入量不准确。建议分装引物,避免反复冻融,并使用10 mM Tris pH 7.5缓冲液溶解引物。还有一种可能性是引物没有问题,而是PCR 使用材料特别是模板的质量与先前使用的不完全一致。
19. 如何检测引物的纯度?
实验室常见方法是用PAGE 法。使用加有7 M 尿素的聚丙烯酰胺凝胶进行电泳,碱基数小于12个的引物用20%的胶,12-60个碱基的引物用16%的胶,大于60个碱基的引物用12%的胶。取0.2-0.5 OD 的引物,用尿素饱和液溶解或引物溶液中加入尿素干粉直到饱和,上样前加热变性(95 ℃,2 min)。加入尿素的目的一是变性,二是增加样品比重,容易加样。600 V 电压进行电泳,一定时间后(约2-3小时),剥胶,用荧光TLC 板在紫外灯下检测带型,在主带之下没有杂带,说明纯度是好的。(有时由于变性不充分,主带之上可能会有条带,乃是引物二级结构条带。)
武汉安基生物科技有限公司
20. 当引物的OD260/OD280小于1.8时,引物的纯度合格吗?
OD260/OD280的比值不能用来衡量引物的纯度。OD260/OD280的比值过低一般是由于引物中C/T 的含量比较高所致。下表是一个20 mer 同聚体引物的OD260/OD280的比值,清楚表明OD260/OD280的比值与引物的碱基组成密切相关。
碱基组成
OD260/OD280 5-AAAAAAAAAAAAAAAAAAAA-3 2.50 5-GGGGGGGGGGGGGGGGGGGG-3 1.85 5-CCCCCCCCCCCCCCCCCCCC-3 1.15 5-TTTTTTTTTTTTTTTTTTTT-3 1.14 5-AAAAAGGGGGTTTTTCCCCC-3
1.66
21. 同样的OD 用PAGE 检测,EB 染色为什么深浅不一?
通常可以用EB 染色的方法来判断双链DNA 的量(如质粒DNA),因为EB 是通过嵌入到核酸的双螺旋间而使其着色的。而合成的单链DNA,只有通过自身回折形成局部发夹环结构或链间形成部分双螺旋结构,才能被EB 染色。由于碱基组成不同,不同引物形成二级结构的可能性不同,EB 的染色程度也会有差异,比如Oligo(dT)等不形成二级结构,EB 染色效果就非常差。因此不能用EB 染色的方法来进行定量,而应用紫外分光光度计检测。
22. 进行PAGE 电泳时,长度完全一样的Oligo DNA 为什么泳带不在同一位置?
这种情况在Oligo DNA 越短时越容易发生,长链Oligo DNA 之间差别较小。主要有两个原因:
1) A、G、C、T 的组份不同,电泳速度不同; 2) DNA 的立体结构不同,电泳速度不同。
23. 能否使用Agarose 凝胶电泳分析合成的引物?
对引物进行电泳一定要使用变性PAGE 电泳。由于引物是单链DNA,容易形成复杂的立体结构,因此进行Agarose 电泳时,容易出现多条泳带或无条带的现象,更无法用Agarose 电泳进行定量了。
24. 有时候干燥后的引物呈黄褐色,这是DNA 的本身颜色吗?
合成的引物可能呈黄褐色,白色或者透明色,这与引物的碱基组成和合成的制备过程有关,序列中A 和G 含量多的以及OD 值大的引物通常呈黄褐色,所以呈黄褐色的引物不会对实验产生任何影响。
武汉安基生物科技有限公司
25. PCR 扩增不出来,跟引物有关吗?
基本上不是。当今发展出各色各样的PCR 扩增技术,各色各样的高温聚合酶,就是来解决PCR 扩增中遇到的扩不出,扩增效率低的问题。如槽式PCR 就是扩增那些拷贝数很低的基因片段。有些重复片段、GC 含量高的片段扩增,必须采用特殊扩增手段才能扩增出来。
扩增不出,主要是下列两种情况比较常见:
1) RT-PCR。很多基因通过常规RT-PCR 方法是很难扩增出来的。RT- PCR 成功的关键在于RT 反应的RNA 质量和目标基因在特定组织和细胞中的含量。
2) 从基因组中扩增。一般情况下,基因在基因组中都是单拷贝,基因组作为模
板需要严格控制用量。基因组DNA 过高,会影响反应体系中的Mg 2+
浓度和pH。
26. 合成的引物进行PCR 反应时无目的带,怎么办?
PCR 反应失败的原因很多,可以从以下几个方面考虑: 1) 引物和模板是否配对,同源性有多大?
2) 引物本身是否有立体结构,或者二条引物之间是否形成高次结构? 3) PCR 反应用试剂是否能正常工作? 4) PCR 仪是否工作正常? 5) PCR 反应条件是否合适?
如果一切正常,还无法解决问题时,我们可以免费为您重新合成引物一次。
27. PCR 扩增有很强的非特异条带,说明引物有污染吗?
不能。我们曾分析过一些非特异条带,测序发现在这些非特异性片段的两头至少可以发现一条引物序列。因此非特异性扩增一般是模板污染(如RNA 中污染基因组)或扩增条件不合适所致。
28. 如何将两条互补的单链退火形成双链?
用退火缓冲液(10 mM Tris,pH 7.5-8.0,50 mM NaCl,1 mM EDTA)溶解引物, 将要退火的引物等摩尔数混合,总体积不要超过500 μl,加热到95 ℃ 2 min,然后缓慢冷却至室温(低于30 ℃)即可。退火的产物可以放在4 ℃待用。
29. 引物片段退火后不能连接到载体上是什么问题?
连接反应需要引物的5’磷酸基团。如果需要将合成的引物退火直接连接相应的载体上,引物需要磷酸化。磷酸化的产物如果还不能连接载体上,需要检查载体
武汉安基生物科技有限公司
的酶切效果,需要改善引物退火的条件。siRNA 分子具有特殊的对称结构,退火的难度较大,退火时需要提高退火温度。
30. 引物设计的基本原则是什么?
引物设计的下列原则供您参考:
1) 引物最好在模板cDNA 的保守区内设计。 2) 引物长度一般在15-30碱基之间。
3) 引物GC 含量在40%-60%之间,Tm 值最好接近72 ℃。 4) 引物3′端要避开密码子的第3位。 5) 引物3′端不能选择A,最好选择T。 6) 碱基要随机分布。
7) 引物自身及引物之间不应存在互补序列。
8) 引物5′端和中间△G 值应该相对较高,而3′端△G 值较低。 9) 引物的5′端可以修饰,而3′端不可修饰。 10) 扩增产物的单链不能形成二级结构。 11) 引物应具有特异性。
31. 常用引物设计软件有哪些?
常用的软件有Oligo 6和Primer Premier 5.0。引物设计软件是根据引物设计的指导意见设计而成。其实,PCR 扩增的成败最关键的是反应模板的制备和反应条件的控制。引物设计软件的缺点是,有时判断为该基因没有一段区域满足标准引物的要求。
32. 文献上找到的引物和探针序列能否直接使用?
通常国外的文献可信度比较高,可直接使用;但为了保险起见,最好用blast 对引物探针的序列进行必要的验证;或者再进一步用引物设计软件对引物探针的二级结构和退火温度进行分析,这样更有利于您对整个实验的把握。
33. 如何计算引物的Tm 值?
Tm 值的概念: DNA 熔解温度,指把DNA 的双螺旋结构降解一半时的温度,亦即DNA 变性过程中,紫外吸收值达到最大值的50%时的温度称为 DNA 的解链温度(Tm)。
武汉安基生物采用以下方法计算Tm 值:
长度为20 mer 及以下的引物,Tm 计算公式为: Tm = 4℃(G + C)+ 2℃(A + T)。但这个公式只适用于14~20个碱基的引物,引物的TM 值还与引物长度、碱基组成、引物使用缓冲溶液的离子强度等有关。
武汉安基生物科技有限公司
对于更长的寡聚核苷酸,Tm 计算公式为: Tm = 0.41(% of GC) – 675/L + 81.5 注:L:引物碱基数;% of GC:引物GC 含量;% of GC = GC 个数/引物总碱基数
34. 常见的引物修饰的有哪些? 修饰
说明
磷酸化(Phosphorylation)
5'磷酸化可用于接头、克隆和基因构建以及连接酶催化的连接反应。3'磷酸化可抗3'外切酶消化的相关实验中,也用于阻止DNA 聚合酶催化的DNA 链延伸反应。
生物素(Biotin)
引物生物素标记,可用于非放射性免疫分析来检测蛋白质、胞内化学染色、细胞分离、核酸分离、杂交检测特异性的DNA/RNA 序列、离子通道构象变化等。 地高新(Digoxigenin)
地高新经由一个11个原子的间臂连接到脲嘧啶的C5位置,杂交的地高新探针可以由抗地高新抗体来检测。地高新标记的探针可用于各种杂交反应,如DNA-DNA 杂交(Southern blotting)、DNA-RNA 杂交(Northern blotting)、斑点杂交(Dot blotting)、克隆杂交、原位杂交以及酶联免疫分析(ELISA)。 内部氨基修饰
主要用C6-dT aminolinker 来加到胸腺嘧啶残基上来进行内部修饰。修饰后氨基与主链相距10个原子距离,可用于进一步的标记和酶连接(如碱性磷酸酶),目前提供内部氨基修饰介导的dT-Dabcyl、dT-Biotin 和dT-Digoxingenin 修饰。
5'氨基修饰
可用于制备功能化的寡核苷酸,广泛应用在DNA 芯片(DNA Microarray)和多重标记诊断系统。目前提供5' C6 氨基修饰和5' C12氨基修饰两种,前者可用于连接一些即便靠近寡核苷酸也不会影响其功能的化合物,后者用于亲和纯化基团的连接和一些荧光标记,尤其是当荧光可能会因标记太靠近DNA 链而被淬灭时。
武汉安基生物科技有限公司
3'氨基修饰
目前提供3' C6 氨基修饰。它可用于设计新的诊断探针和反义核苷酸,例如5'端可用高度敏感的32P 或荧光素标记的同时3'可用氨基修饰以进行其他的连接。此外,3'修饰可以抑制3'外切酶酶解,从而可用于反义实验。
巯基(Thiol)
5'-巯基在很多方面与氨基修饰类似。巯基可用于加附各种修饰如荧光标记物和生物素。例如可以在碘乙酸和马来酰亚胺衍生物存在下来制作巯基连接的荧光探针。5'的巯基修饰主要用5'巯基修饰单体(5'-Thiol-Modifier C6-CE Phosphoramidite 或Thiol-Modifier C6 S-S CE Phosphoramidite)。用
5'-Thiol-Modifier C6-CE 单体修饰后必须进行硝酸银氧化以去除保护基(trityl),而Thiol-Modifier C6 S-S CE 单体修饰后须用DTT 将二硫键还原成巯基。
间臂(Spacer)
Spacer 可为寡核苷酸标记提供必要的间隔以减少标记基团与寡核苷酸间的相互作用,主要应用于DNA 发夹结构和双链结构研究。C3 spacer 主要用于模仿核糖的3'和5'羟基间的三碳间隔,或“替代”一个序列中未知的碱基。3'-Spacer C3用于引进一个3'间臂从而阻止3'端外切酶和3'端聚合酶发挥作用。 Spacer 18 常用于引进一个强疏水基团。
硫代(Phosphorthioate)
硫代修饰的寡核苷酸主要用于反义实验中防止被核酸酶降解。您可以选择全硫代,但随着硫代碱基的增加,寡核苷酸的Tm 值会降低,为了降低这种这种影响,可以对引物两端2-5个碱基进行硫代修饰,通常可以选择5'和3'各3个碱基进行硫代修饰。
脱氧脲嘧啶(DeoxyUridine,dU)
脱氧脲嘧啶可以插进寡核苷酸来增加双链的熔点温度从而增长双链的稳定性。每个脱氧胸腺嘧啶被脱氧脲嘧啶替
武汉安基生物科技有限公司 代可以增长双链熔点温度1.7 ℃。
脱氧次黄嘌呤(deoxyInosine,dI) 脱氧次黄嘌呤是一个自然存在的碱基,
虽然不是真正意义上的通用碱基,但当
与其它碱基结合时,会比其它碱基错配
相对更稳定。脱氧次黄嘌呤与其它碱基
的结合能力为dI:dC > dI:dA > dI:dG >
dI:dT. 在DNA聚合酶的催化下,脱氧
次黄嘌呤首选与dC结合。
35. 为什么修饰引物的产量要比一般引物低,价格要高?
主要因为是修饰单体稳定性较差,偶联时间长,效率低,最后得到的产量自然低于一般的引物。修饰引物通常需要PAGE或HPLC纯化,纯化过程损失大。修饰引物使用的原料是一般引物原料的几百倍,所以产品的价格自然高。
图解blast验证引物教程
图解blast验证引物教程 1、进入网页:https://www.360docs.net/doc/d75620155.html,/BLAST/ 2、点击Search for short, nearly exact matches 3、在search栏中输入引物系列: 注:文献报道ABCG2的引物为5’-CTGAGATCCTGAGCCTTTGG-3’; 5’-TGCCCATCACAACATCATCT-3’ (1)输入方法可先输入上游引物,进行blast程序,同样方法在进行下游引物的blast程序。这种方法叫繁琐,而且在结果分析特异性时要看能与上游引物的匹配的系列,还要看与下游引物匹配的系列——之后看两者的交叉。 (2)简便的做法是同时输入上下游引物:有以下两种方法。输入上下游引物系列都从5’——3’。 A、输入上游引物空格输入下游引物
B、输入上游引物回车输入下游引物 4、在options for advanced blasting中: select from 栏通过菜单选择Homo sapiens【ORGN】Expect后面的数字改为10 5、在format中: select from 栏通过菜单选择Homo sapiens【ORGN】Expect后面的数字填上0 10
6、点击网页中最下面的“BLAST!” 7、出现新的网页,点击Format! 果。
(1)图形格式: 图中①代表这些序列与上游引物匹配、并与下游引物互补的得分值都位于40~50分 图中②代表这些序列与上游引物匹配的得分值位于40~50分,而与下游引物不互补 图中③代表这些序列与下游引物互补的得分值小于40分,而与上游引物不匹配 通过点击相应的bar可以得到匹配情况的详细信息。 (2)结果信息概要: 从左到右分别为: A、数据库系列的身份证:点击之后可以获得该序列的信息 B、系列的简单描述 C、高比值片段对(high-scoring segment pairs, HSP)的字符得分。按照得分的高低由大到小排列。得分的计算公式=匹配的碱基×2+0.1。举例:如果有20个碱基匹配,则其得分为40.1。 D、E值:代表被比对的两个序列不相关的可能性。【The E value decreases exponentially as the Score (S) that is assigned to a match between two sequences increases】。E值最低的最有意义,也就是说序列的相似性最大。设定的E值是我们限定的上限,E值太高的就不显示了 E、最后一栏有的有UEG的字样,其中: U代表:Unigene数据库 E代表:GEO profiles数据库 G代表:Gene数据库
引物保护碱基列表--百度文库
11月13日 引物合成的详解 4.需要什么级别的引物? 答:引物常用的纯化方式C18脱盐,OPC纯化,PAGE纯化,HPLC纯化。根据实验需要,确定订购引物的纯度级别。 应用引物长度要求纯度级别要求 一般PCR扩增<45 base OPC 一般PCR扩增>45 base PAGE 诊断PCR扩增< 40base OPC, PAGE DNA测序20base左右OPC 亚克隆,点突变等根据实验要求定OPC, PAGE,HPLC 根据实验要求定PAGE 基因构建(全基因合成) 反义核酸根据实验要求定PAGE PAGE, HPLC 修饰引物根据实验要求定 8.如何计算引物的浓度? 答:引物保存在高浓度的状况下比较稳定。引物一般配制成 10-50pmol/ul。一般情况下,建议将引物的浓度配制成50pmol/ul,加水的体积(微升)按下列方式计算:V (微升)= OD数*(乘)33 *(乘)*(乘)20000 / (除) 引物的分子量。引物的分子量可以从合成报告单上获得。如果需要配制成其他浓度,按上述公式换算。 注意:1 OD260= 33 ug/ml. 9.如何计算引物的Tm值? 答:引物设计软件都可以给出Tm,与引物长度、碱基组成、引物使用缓冲的离子强度有关。
长度为25mer以下的引物,Tm计算公式为:Tm = 4℃(G + C)+ 2℃(A + T) 对于更长的寡聚核苷酸,Tm计算公式为: Tm = 81.5 + 16.6 x Log10[Na+] + 0.41 (%GC) – 600/size 公式中,Size = 引物长度。 11.如何溶解引物? 答:干燥后的引物质地非常疏松,开盖前最好离心一下,或管垂直向上在桌面上敲敲,将引物粉末收集到管底。根据计算出的体积加入去离子无菌水或10mM Tris pH7.5缓冲液,室温放置几分钟,振荡助溶,离心将溶液收集到管底。溶解引物用的水一般不要用蒸馏水,因为有些蒸馏水的pH值比较低(pH4-5),引物在这种条件下不稳定。 12.如何保存引物? 答:引物合成后,经过一系列处理和纯化步骤,旋转干燥而成片状物质。引物在溶解前,室温状态下可以长期保存。溶解后的引物-20度可以长期保存。如果对实验的重复性要求较高,合成的OD数较大,建议分装,避免反复冻融。修饰荧光引物需要避光保存。 13.合成的引物5’端是否有磷酸化 答:合成的引物5’为羟基,没有磷酸基团。如果需要您可以用多核苷酸激酶进行5′端磷酸化,或者要求引物合成公司合成时直接在5′或3′端进行磷酸化,需要另外收费。 14.引物片段退火后不能连接到载体上是什么问题? 连接反应需要引物的5’磷酸基团。如果需要将合成的引物退火直接连
Blast本地化详细流程
Blast 2.4.0+本地化详细流程(基于Windows系统) 1.程序获得。从NCBI上下载Blast本地化程序,下载地址: ftp://https://www.360docs.net/doc/d75620155.html,/blast/executables/blast+/LATEST/ 64×安装版▲ 64×解压(绿色)版▲ 最好安装或解压到X盘根目录:如X:\blast,尽量简短,方便后边命令输入。 2.原始序列获得。方法1:找到转录组测序数据unigene数据库文件:unigene.fasta 或unigene.fa,若为unigene.fa则直接改后缀为.fasta即可。找到或修改后将数据库文件移动至Blast本地化程序目录“X:\blast\bin”。方法2:从NCBI中的ftp 库下载所需要库,链ftp://https://www.360docs.net/doc/d75620155.html,/blast/db/FASTA/,其中nr.gz为非冗余的数据库,nt.gz为核酸数据库,month.nt.gz为最近一个月的核酸序列数据。下载的month.nt.gz先用WINRAR解压缩,然后用makeblastdb.exe格式化。方法3:利用新版blast自带的update_blastdb.pl进行下载,这需要安装perl程序。 注释:上述三种方法各有优缺点,前两种下载速度较快,但是每次进行检索都需要对数据库进行格式化(转化成二进制数据),第三种方法下载速度较慢,但是NCBI 中已经格式化好的,在进行本地检索时不需再进行格式化,直接用即可。 3.用文本编辑器(txt文件改名字及后缀)创建一个ncbi.ini文件,文件包含下 面内容:[NCBI]Data="C:\blast\data\" 先新建TXT文件,然后改属性,将ncbi.ini文件存放到C:\Windows 4.将Blast本地化程序目录添加路径中(该步骤非必须,但会给以后的操作带来 方便),方法: a)右击我的电脑选择属性,选择高级,点击环境变量,设置环境变量 b)系统变量中,选择Path,点击“编辑”,在变量值的后面添加Blast本地化 程序所在路径,E:\blast 点击确定,将安装路径添加到path。 5.运行MS-DOC。打开DOC窗口(点击开始,选择运行,打开的输入框中输 入“CMD”,确定),访问Blast本地化程序所在文件夹,依次输入:(1)X: 回车;(2)cd blast\bin,回车。
NCBI中Blast序列比对小总结
NCBI中Blast可以用来进行序列比对、检验引物特异性Blast导航主页面主体包括三部分 BLAST Assembled Genomes选择你要对比的物种,点击物种之后即可进入对比页面Basic BLAST包含5个常用的Blast,每一个都附有简单介绍 Specialized BLAST是一些特殊目的的Blast,如Primer-BLAST、IgBLAST 根据需要做出选择 本学期学习了最基本的核苷酸序列的比对 点击Basic BLAST部分的nucleotide链接到一个新的页面,打开后的页面特征: 大体上包括三个部分 Enter Query Sequence部分可以让我们输入序列,其中的Job Title部分可以为本次工作命一个名字 Choose Search Set部分可以选择要与目的序列比对的物种或序列种类。 其中的Entrez Query可以对比对结果进行适当的限制。 Program Selection部分可以选择本次对比的精确度,种内种间等等。 其次Blast按钮下面有一个“Algorithm parameters”算法参数,可设置参数。 点击Blast后,出现的页面大体上包括四个部分 一.所询问和比对序列的简单信息 1.询问序列的简单信息——名称、描述、分子类型、序列长度 2.所比对数据库的名称、描述和所用程序 二.Graphic Summary——blast结果图形显示 相似度颜色图(黑、蓝、绿、粉红、红,相似度由低到高)三.Descriptions——blast结果描述区 1.到其他数据库的链接 2.描述以表格的形式呈现(以匹配分值从大到小排序) (1)Accession下程序比对的序列名称,点击相应的可以进入更为详细的map viewer (2)Descriptions下是对所比对序列的简单描述 接下来是5个结果数值: (3)Max score匹配分值,点击可进入第四部分相应序列的blast的详细比对结果 (4)Total score总体分值 (5)Query coverage覆盖率 (6)E value——E(Expect)值,表示随机匹配的可能性。 E值越大,随机匹配的可能性也越大。 E值接近零或为零时,具本上就是完全匹配了。 (7)Max ident——匹配一致性,即匹配上的碱基数占总序列长的百分数。 (8)Links——到其他数据库的链接。 四.各序列blast的详细比对结果 数据库中不同序列比对的详细结果,每一个结果大体上包括3部分 1.所比对序列的名称、简单描述、长度。到其他数据库的链接。
本地blast的详细用法∷柳城
本地blast的详细用法 Posted on 03 四月 2009 by 柳城,阅读 9,626 本地blast的详细使用方法 blast all -p blastn -i myRNA.fasta -d humanRNA.fasta -o myresult.blastout -a 2 -F F -T T -e 1e-10 解释如下: blastall: 这是本地化/命令行执行blast时的程序名字!(Tips:blastall直接回车就会给出你所有的参数帮助,但是英文的) -p: p 是program的简写,program在计算机领域中是程序的意思。此参数是指定要使用何种子程序,所谓子程序,就是针对不同的需要,如核酸序列和核酸序列进行比对、蛋白质序列和蛋白质序列进行比对、假设翻译后核酸序列于蛋白质序列进行比对,选择相应的子程序: blastn 是用于核酸对核酸 blastp 是蛋白质对蛋白质序列等等,一共5个自程序。 -i: i 是input的简写,意思是输入文件,就是你自己的要进行比对的序列文件(fasta格式) -d: d是database的简写,意思是要比对的目标数据库,在例子中就是humanRNA.fasta (别忘了要formatdb) -o: o是output的简写,意思是结果文件名字,这个根据你自己的习惯起名字,可以带路径,(上边两个参数-i -d 也都可以带路径) *注意以上4个参数是必须的,缺一不可,下面的参数是为了得到更好的结果自己可调的参数,如果你不加也没有关系,blastall程序本身会给一个默认值! -a: 是指计算时要用的CPU个数,我的机器有两个CPU,所以用-a 2,这样可以并行化进行计算,提高速度,当然你的计算机就一个CPU,可以不用这个参数,系统默认值为1,就是一个CPU -F: 是filter的简写,blastall程序中有对简单的重复序列和低复杂度的一些repeats过滤调,默认是T (注意以后的有几种参数就两个选项,T/F T就是ture,真,你可以理解为打开该功能; F就是false,假,理解为关闭该功能) -T: 是HTML的简写,是指blast结果文件是否用HTML格式,默认是F!如果你想用IE看,我建议用-T T -e: 是Expectation value,期望值,默认是10,我用的10-10! BLASTALL 用法 a.格式化序列数据库 格式化序列数据库— —formatdb formatdb简单介绍: formatdb处理的都是格式为 ASN.1和FASTA,而且不论是核苷酸序列数据库,还是蛋白质序列数据库;不论是使用Blastall ,还是Blastpgp,Mega Blast应用程序,这一步都是不可少的。 formatdb命令行参数: formatdb - 得到formatdb 所有的参数显示(见附录二)和介绍, 主要参数的说明:
一步一步教你使用 NCBI 查找DNA、mRNA、cDNA、Protein、promoter、引物设计、BLAST 序列比对等
一步一步教你使用NCBI 查找DNA、 mRNA、cDNA、Protein、promoter、引 物设计、BLAST 序列比对等 最近看到很多战友在论坛上询问如何查询基因序列、如何进行引物设计、如何使用 BLAST 进行序列比对……,这些问题在NCBI 上都可以方便的找到答案。现在我就结合我自 己使用NCBI的一些经历(经验)跟大家交流一下BCBI 的使用。希望大家都能发表自己的使 用心得,让我们共同进步! 我分以下几个部分说一下NCBI 的使用: Part one 如何查找基因序列、mRNA、Promoter Part two 如何查找连续的mRNA、cDNA、蛋白序列 Part three 运用STS 查找已经公布的引物序列 Part four 如何运用BLAST 进行序列比对、检验引物特异性 特别感谢本版版主,将这个帖子置顶! 从发帖到现在,很多战友对该帖给与了积极的关注,在此向给我投票的(以及想给我 投票却暂时不能投票的)各位战友表示真诚的感谢,谢谢各位战友! 请大家对以下我发表的内容提出自己的意见。关于NCBI 其他方面的使用也请水平较高 的战友给予补充 First of all,还是让我们从查找基因序列开始。 第一部分利用Map viewer 查找基因序列、mRNA 序列、 启动子(Promoter) 下面以人的IL6(白细胞介素6)为例讲述一下具体的操作步骤 1.打开Map viewer 页面,网址为:https://www.360docs.net/doc/d75620155.html,/mapview/index.html 在search 的下拉菜单里选择物种,for 后面填写你的目的基因。操作完毕如图所示:
NCBI在线BLAST使用方法与结果详解
N C B I在线B L A S T使用方法与结果详解 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
N C B I在线B L A S T使用方法与结果详解 BLAST(BasicLocalAlignmentSearchTool)是一套在蛋白质数据库或DNA数据库中进行相似性比较的分析工具。BLAST程序能迅速与公开数据库进行相似性序列比较。BLAST结果中的得分是对一种对相似性的统计说明。 BLAST采用一种局部的算法获得两个序列中具有相似性的序列。 Blast中常用的程序介绍: 1、BLASTP是蛋白序列到蛋白库中的一种查询。库中存在的每条已知序列将逐一地同每条所查序列作一对一的序列比对。 2、BLASTX是核酸序列到蛋白库中的一种查询。先将核酸序列翻译成蛋白序列(一条核酸序列会被翻译成可能的六条蛋白),再对每一条作一对一的蛋白序列比对。 3、BLASTN是核酸序列到核酸库中的一种查询。库中存在的每条已知序列都将同所查序列作一对一地核酸序列比对。 4、TBLASTN是蛋白序列到核酸库中的一种查询。与BLASTX相反,它是将库中的核酸序列翻译成蛋白序列,再同所查序列作蛋白与蛋白的比对。 5、TBLASTX是核酸序列到核酸库中的一种查询。此种查询将库中的核酸序列和所查的核酸序列都翻译成蛋白(每条核酸序列会产生6条可能的蛋白序列),这样每次比对会产生36种比对阵列。 NCBI的在线BLAST: 下面是具体操作方法 1,进入在线BLAST界面,可以选择blast特定的物种(如人,小鼠,水稻等),也可以选择blast所有的核酸或蛋白序列。不同的blast程序上面已经有了介绍。这里以常用的核酸库作为例子。 2,粘贴fasta格式的序列。选择一个要比对的数据库。关于数据库的说明请看NCBI在线blast数据库的简要说明。一般的话参数默认。 3,blast参数的设置。注意显示的最大的结果数跟E值,E值是比较重要的。筛选的标准。最后会说明一下。 4,注意一下你输入的序列长度。注意一下比对的数据库的说明。 5,blast结果的图形显示。没啥好说的。 6,blast结果的描述区域。注意分值与E值。分值越大越靠前了,E值越小也是这样。7,blast结果的详细比对结果。注意比对到的序列长度。评价一个blast结果的标准主要有三项,E值(Expect),一致性(Identities),缺失或插入(Gaps)。加上长度的话,就有四个标准了。如图中显示,比对到的序列长度为1405,看Identities这一值,才匹配到1344bp,而输入的序列长度也是为1344bp(看上面的图),就说明比对到的序列要长一
blast验证引物教程1
图解blast验证引物教程 ——以文献报道的人类的ABCG2的引物为例 1、进入网页:https://www.360docs.net/doc/d75620155.html,/BLAST/ 2、点击Basic BLAST中的nucleotide blast选项 3、完成2操作后就进入了Basic Local Alignment Search Tool界面 (1)在Enter Query Sequence栏中输入引物序列: 注:文献报道ABCG2的引物为5’-CTGAGATCCTGAGCCTTTGG-3’; 5’-TGCCCATCACAACATCATCT-3’ 简便的做法是同时输入上下游引物。输入上下游引物系列都从5’—3’。输入上游引物后,加上≥20个字母n,再输入下游引物,如下图:
(2)在Choose Search Set栏中: Database根据预操作基因的种属定了,本引物可选Human genomic + transcript或 Others (nr etc.)。本人倾向于选后者,觉得此库信息更多。如下图: (3)在Program Selection中:选择Somewhat similar sequences (blastn)项,如下图: (4)在此界面最下面:如下图 Show results in a new window项是显示界面的形式,可选可不选,在此我们选上了。关键要点击Algorithm parameters参数设置,进入参数设置界面。 4. 参数设置: (1)在General Parameters中:Expect thresshold期望阈值须改为1000,大于1000也可以; 在Word size的下拉框将数字改为7。如下图:
如何运用BLAST进行序列比对、检验引物特异性
序列比对,绝大多数战友都会想到BLAST,但BLAST的使用确实又是一个很大的难题,因为他的功能比较强悍,里面涉及到的知识比较多,而且比对结束后输出的结果参数(指标)又很多。如果把BLAST的使用详细的都讲出来,我想我发帖发到明天也发不完,更何况我自己也不是完全懂得BLAST的使用。所以我在这里也就“画龙点睛”——以比对核酸序列为例来给大家介绍一下BLAST的使用,也算是BLAST 的入门课程吧。请看帖的战友好好体会,如果你用心看,在看帖完毕之后BLAST 的基本使用(包括其他序列的比对)应该没有问题了。一、打开BLAST页面, 打开后如图所示: (缩略图,点击图片链接看原图)对上面这个页面进行一下必要的介绍: BLAST的这个页面主体部分(左面)包括了三部分:BLAST Assembled Genomes、Basic BLAST、Specialized BLAST。相信大家可以看懂这三个短语的意思,我就不多说了;我要说的是,可以认为这是三种序列比对的方法,或者说是BLAST的三条途径。 第一部分BLAST Assembled Genomes就是让你选择你要比对的物种,点击相应物种之后即可进入比对页面。 第二部分Basic BLAST包含了5个常用的BLAST,每一个都附有简短的介绍。 第三部分Specialized BLAST是一些特殊目的的BLAST,如IgBLAST、SNP等等,这个时候你就需要在Specialized BLAST部分做出适当的选择了。 总之,这是一个导航页面,它的目的是让你根据自己的比对目的选择相应的BLAST 途径。下面以最基本的核酸序列比对来谈一下BLAST的使用,期间我也会含沙射影的说一下其他序列比对的方法。 二、点击Basic BLAST部分的nucleotide blast链接到一个新的页面。打开后如图所示: =" width=640 height=462 title="Click to iew full 2.JPG (849 X 613)" border=0 align=absmiddle> 介绍一下上述页面: Enter Query Sequence部分是让我们输入序列的,你可以直接把序列粘贴进去,也可以上传序列,还可以选择你要比对的序列的范围(留空就代表要比对你要输入的整个序列)。Job Title部分还可以为本次工作命一个名字。 Choose Search Set部分是让我们选择要与目的序列比对的物种或序列种类(genome DNA、mRNA等等)。如果是人或老鼠的话,就可以直接选择了如果是其他物种就要选择“others”了,这时候网页会主动跳出一个下拉对话框和一个输入
本地Blast
本地Blast使用说明 一、软件的下载安装 1.1安装流程 建议安装在非系统盘,如将下载的 BLAST 程序安装到 E:\blast,生成bin、doc 两个子目录,其中 bin 是程序目录,doc 是文档目录,这样就安装完毕了。 1.2 设置环境变量 右键点击“我的电脑”-“属性”,然后选择“高级系统设置”标签-“环境变量”(图1),在用户变量下方“Path”随安装过程已自动添加其变量值,即“E:\Blast\bin”。此时点击“新建”-变量名“BLASTDB”,变量值为“E:\Blast\db”(即数据库路径,图2)。 二、查看程序版本信息 点击 Windows 的“开始”菜单下的“运行”,输入“cmd”调出 MS-DOS 命令行,转到 Blast 安装目录,输入命令“blastn -version”即可查看版本,若能显示说明本地blast 已经安装成功。 三、使用 3.1本地数据库的构建 下载所需的数据(Fasta格式),将X 放到E:\blast\db 文件夹下,然后调出MS-DOS 命令行,转到E:\blast\db 文件夹下运行以下命令:格式化
数据库,命令为: makeblastdb -in 数据库文件 -dbtype 序列类型(核酸:nul;蛋白:prot)-title database_title-parse_seqids -out database_name-logfile File_Name 格式化数据库后,创建三个主要的文件——库索引(indices),序列(sequences)和头(headers)文件。生成的文件的扩展名分别是:.pin、.psq、.phr(对蛋白质序列)或.nin、.nsq、.nhr(对核酸序列)。而其他的序列识别符和索引则包含在.psi和.psd(或.nsi 和.nsd)中。 3.2核酸序列相似性搜索 blastn -db database_name -query input_file -out output_file -outfmt "7 qacc sacc qstart qend sstart send length bitscore evalue pident ppos" 备注:qacc:查询序列Acession号;sacc:目标序列Acession号; qstart qend:分别表示查询序列比对上的起始、终止位置; sstart send:分别表示目标序列比对上的起始、终止位置; length:长度; bitscore:得分; evalue:E-Value值; pident:一致性; ppos:相似性 3.3 查看并获取目标序列: blastdbcmd -db refseq_rna -entry 224071016 -out test.fa 可以从数据库中提取gi号为224071016的序列,并且以fasta格式存入文 件 3.4蛋白质序列相似性搜索 Blastp -db database_name-query input_file -out output_file -outfmt "7 qacc sacc qstart qend sstart send length bitscore evalue pident ppos" 3.5 查看并获取目标序列:重复3.3
一步一步教你使用NCBI查找DNA、mRNA、cDNA、Protein、promoter、引物设计、BLAST序列比对等
一步一步教你使用 NCBI 查找DNA、mRNA、 cDNA、Protein、promoter、引物设计、BLAST 序列比对等 最近看到很多战友在论坛上询问如何查询基因序列、如何进行引物设计、如何使用 BLAST 进行序列比对……,这些问题在 NCBI 上都可以方便的找到答案。现在我就结合我自己使用 NCBI的一些经历(经验)跟大家交流一下 BCBI 的使用。希望大家都能发表自己的使 用心得,让我们共同进步! 我分以下几个部分说一下 NCBI 的使用: Part one 如何查找基因序列、mRNA、Promoter Part two 如何查找连续的 mRNA、cDNA、蛋白序列 Part three 运用 STS 查找已经公布的引物序列 Part four 如何运用 BLAST 进行序列比对、检验引物特异性 特别感本版版主,将这个帖子置顶! 从发帖到现在,很多战友对该帖给与了积极的关注,在此向给我投票的(以及想给我 投票却暂时不能投票的)各位战友表示真诚的感,各位战友! 请大家对以下我发表的容提出自己的意见。关于NCBI 其他方面的使用也请水平较高 的战友给予补充 First of all,还是让我们从查找基因序列开始。 第一部分利用Map viewer 查找基因序列、mRNA 序列、 启动子(Promoter) 下面以人的 IL6(白细胞介素 6)为例讲述一下具体的操作步骤 1.打开Map viewer 页面,网址为:https://www.360docs.net/doc/d75620155.html,/mapview/index.html 在 search 的下拉菜单里选择物种,for 后面填写你的目的基因。操作完毕如图所示:
20个测序常见的问题
20个测序常见的问题 1.为什么需要新鲜的菌液? 首先,新鲜的菌液易于培养,可以获得更多的DNA,同时最大限度地保证菌种的纯度。2.如何提供菌液? 如果您提供新鲜菌液,用封口膜封口以免泄漏;也可以将培养好的4~5ml菌液沉淀下来,倒去上清以方便邮寄。同时邮寄时最好用盒子以免邮寄过程中压破。 3.如何制作穿刺菌? 用灭菌过1.5ml或2ml离心管加入LB琼脂(7g/L)斜面凝固,用接种针挑取分散良好的单菌落穿过琼脂直达管底,不完全盖紧管盖适当温度培养过夜,然后盖紧盖子加封口膜,室温或4度保存。 4.PCR产物直接测序有什么要求? (1)扩增产物必须特异性扩增,条带单一。如果扩增产物中存在非特异性扩增产物,一般难以得到好的测序结果; (2)必须进行胶回收纯化; (3)DNA纯度在1.6—2.0之间,浓度50ng/ul以上。 5.为什么PCR产物直接测序必须进行Agarose胶纯化? 如果不进行胶纯化而直接用试剂盒回收,经常会导致测序出现双峰甚至乱峰,这主要是非特异性扩增产物或者原来的PCR引物去除不干净所导致。大多所谓的PCR“纯化试剂盒”实际上只是回收产物而不能起到纯化的作用的。对于非特异性扩增产物肯定无法去除,而且通常他们不能够完全去除所有的PCR引物,这会造成残留的引物在测序反应过程中参与反应而导致乱峰。 6.如何进行PCR产物纯化? PCR产物首先必须用Agarose胶电泳,将特异扩增的条带切割下,然后纯化。使用凝胶回收试剂盒回收,产物用ddH2O溶解。 7.PCR产物直接测序的好处? (1) PCR产物直接测序可以反映模板的真实情况; (2) 省去克隆的实验费用和时间; (3) PCR产物测序正确的片段进行下一步克隆实验使结果更有保障; (4) 混合模板进行PCR的产物直接测序可以发现其中的点突变。 8.对用于测序的质粒DNA的要求有哪些? 对测序模板DNA的一般要求:(1)DNA纯度要求高,1.6—2.0之间,不能有混合模板,也不能含有RNA,染色体DNA,蛋白质等;(2)溶于ddH2O中,溶液不能含杂质,如盐类,或EDTA等螯合剂,将干扰测序反应正常进行。 9.如何鉴定质粒DNA浓度和纯度? 我们使用水平琼脂糖凝胶电泳,并在胶中加入0.5ug/ml的EB(电泳缓冲液中不必加E,加一个已知浓度的标准样品。电泳结束以后在紫外灯下比较亮度,判断浓度和纯度。此方法可以更直接、准确地判断样品中是否含有染色体DNA、RNA等,也可以鉴别抽提的质粒DNA 的不同构型。 质粒DNA的3种构型是指在抽提质粒DNA过程中,由于各种原因的影响,使得超螺旋的共价闭合环状结构的质粒(SC)的一条链断裂,变成开环状(OC)分子,如果两条链发生断裂,就变成为线状(L)分子。这3种分子有不同的迁移率,通常,超螺旋型(SC)迁移速度最快,其次为线状(L)分子,最慢为开环状(OC)分子。使用紫外分光光度计检测,或者用溴乙锭-标准浓度DNA比较法只能检测抽提到的产物中的浓度,甚至由于抽提的质粒DNA中含有RNA、蛋白质、染色体DNA等因素的干扰,浓度检测的数值也是没有多少意义的。
图解blast验证引物教程1
图解blast 验证引物教程 ——以文献报道的人类的ABCG2的引物为例 1、 进入网页:https://www.360docs.net/doc/d75620155.html,/BLAST/ 2、 点击Basic BLAST 中的nucleotide blast 选项 3、 完成2操作后就进入了Basic Local Alignment Search Tool 界面 (1)在Enter Query Sequence 栏中输入引物序列: 注:文献报道ABCG2的引物为5’-CTGAGATCCTGAGCCTTTGG-3’; 5’-TGCCCATCACAACATCATCT-3’ 简便的做法是同时输入上下游引物。输入上下游引物系列都从5’— 3’。 输入上游引物后,加上≥20个字母n ,再输入下游引物,如下图: 生 物 秀
(2)在Choose Search Set 栏中: Database 根据预操作基因的种属定了,本引物可选Human genomic + transcript 或Others (nr etc.)。本人倾向于选后者,觉得此库信息更多。如下图: (3)在Program Selection 中:选择Somewhat similar sequences (blastn)项,如下图: (4)在此界面最下面:如下图 生物秀-专心做生物 w w w .b b i o o .c o m
Show results in a new window 项是显示界面的形式,可选可不选,在此我们选上了。关键要点击Algorithm parameters 参数设置,进入参数设置界面。 4. 参数设置: (1)在General Parameters 中:Expect thresshold 期望阈值须改为1000,大于1000也可以;在Word size 的下拉框将数字改为7。如下图: (2)Scoring Parameters 无须修改 (3)Filters and Masking 中,一般来说也没有必要改 5.点击最下面一栏的BLAST 按钮,如图: 6.点击BLAST 按钮后,跳转出现如下界面: 7. 等待若干秒之后,自动跳转出现显示BLAST 结果的网页。该网页用三种形式来显示blast 的结果。 生物秀-专心做生物 w w w .b b i o o .c o m
常用pGEX载体图谱
Rosetta系列的表达菌株可以提供T7 RNA聚合酶,它能表达PET系列载体上的外源基因。。。pGEX系列载体上的外源基因不需要T7 RNA聚合酶,普通的大肠杆菌经IPTG诱导即可表达 Tac启动子是一组由Lac和trp启动子人工构建的杂合启动子,受Lac阻遏蛋白的负调节,它的启动能力比Lac和trp都强。其中Tac 1是由Trp启动子的-35区加上一个合成的46 bp DNA片段(包括Pribnow 盒)和Lac操纵基因构成,Tac 12是由Trp的启动子-35区和Lac 启动子的-10区,加上Lac操纵子中的操纵基因部分和SD序列融合而成 蛋白标签:
pGEX4T1载体基本信息 出品公司: GE 别名: pGEX-4T-1, pGEX4T1, pGEX 4T 1 质粒类型: 大肠杆菌蛋白表达载体 表达水平: 高拷贝 启动子: Tac 克隆方法: 多克隆位点,限制性内切酶 载体大小: 4969 bp 5' 测序引物及序列: pGEX5': GGGCTGGCAAGCCACGTTTGGTG 3' 测序引物及序列: pGEX3': CCGGGAGCTGCATGTGTCAGAGG 载体标签: N-GST 载体抗性: Ampicillin 氨苄 备注: 复制子是pMB1 产品目录号: 27-4580-01 稳定性: 瞬时表达 Transient 组成型: 诱导表达 病毒/非病毒: 非病毒 pGEX4T1载体质粒图谱和多克隆位点信息 原核生物DNA复制起始点,是DNA链上独特的具有起始DNA复制功能的碱基序列。大肠杆菌的复制起
pGEX4T1载体简介 pGEX4T1载体序列 LOCUS pGEX-4T-1 4969 bp DNA circular SYN DEFINITION pGEX-4T-1 ACCESSION KEYWORDS SOURCE ORGANISM other sequences; artificial sequences; vectors. COMMENT This file is created by Vector NTI https://www.360docs.net/doc/d75620155.html,/ COMMENT VNTAUTHORNAME|https://www.360docs.net/doc/d75620155.html,| FEATURES Location/Qualifiers source 1..4969 /organism="pGEX-4T-1" /mol_type="other DNA" promoter 184..212 /label="tac_promoter" misc_feature 224..246 /label="M13_pUC_rev_primer" gene 258..977 /label="GST (variant)" /gene="GST (variant)" CDS 258..977 /label="ORF frame 3"
常见载体的测序引物
常见载体的测序引物: Primer of Vector: Vector:Primer(F);Primer(R) pACT T7 T3 pACT2 GAL4 AD pACT2-R pAS2-1 GAL4 BD pAS2-1.R pB42AD pB42ADF pB42ADR pBACPAK8 BAC1 BAC2 pBK-CMV T7 T3 PBS(SK/KS)/M13- M13F/T7 T3/M13R pBV220 PBV220F PBV220R pCAMBIA 1301(1300) P1 P2 pCAMBIA 2300 M13R(-48) M13F(-47) PCANTB5E S1/M13R S6 pCAT3-enhancer RVP3 此载体无反向引物pcDNA3.0 CMV-F/T7 SP6/BGH pcDNA3.1 T7 BGH pcDNA4 T7/CMV-F BGH pcDNA6 T7/CMV-F(J21025在T7前面)BGH pcDNAII T7 SP6 pCE2.1 M13F M13R pCEP4 pCEP-F EBV-R
pCF-T M13F M13R pCI T7(17Base)此载体无反向引物 pCI-neo T7(17Base)T3 pCMS-EGFP T7 T3 pCMV-3Tag-4A T3 /PFLAG-CMV-F T7 pCMV5 pCMV5F pCMV5R pCMV5-Flag pCMV5F pCMV5R pCMV-MYC/HA pCMV-F pCMV-R pCMV-Sport M13F/T7 SP6/M13R pCMV-Tag(KAN+) T3 T7 pCR2.1-TOPO M13F/T7 M13R pCR3.1 T7 BGH pCS2 SP6 T7 pDonar M13F M13R pDONR221 M13F M13R pDrive T7 SP6 pDRIveR(KAN+) T7 SP6 pDsRED1-C1 pDsRED-ex-C1-F pEGFP-N-3’(距离很近,一般不用) pDsRED2-C1(KAN+) pDsRED-ex-C1-F pEGFP-N-3’ pDSRED-N1(KAN+) pEGFP-N-5’ PDSRED-N-R pECFP-C pEGFP-C-5’ pECFP-C-3' pECFP-N1 pEGFP-N-5’ pEGFP-N-3’
NCBI中Blast种类及使用简介
NCBI中Blast种类及使用简介 NCBI中Blast种类简介 1. Blast Assembled Genomes 在一个选择的物种基因组序列中去搜索。 2.Basic Blast 2.1 nucleotide blast--- 用核酸序列到核酸数据库中进行搜索,包括3个程序 2.1.1 Blastn----核酸序列(n)到核酸序列数据库中搜索,是一种标准的搜索。 2.1.2 megablast----该程序使用“模糊算法”加快了比较速度,可以用于快速比较两大系列序列。可以用来搜索一匹ESTs序列和大的cDNA或基因组序列, 适用于由于测序或者其他原因形成的轻微的差别的序列之间的比较 2.1.3 discontiguous megablast----与megablast不同的是主要用来比较来自不同物种之间的相似性较低的分歧序列。 2.2 Protein Blast 2.2.1 Blastp ---蛋白质序列到蛋白质序列数据库中搜索,是一种标准的搜索。 2.2.2 psi-blast---位点特异迭代BLAST —用蛋白查询来搜索蛋白资料库的一个程式。所有被BLAST发现的统计有效的对齐被总和起来形成一个多次对齐,从这个对齐,一个位置特异的分值矩阵建立起来。这个矩阵被用来搜索资料库,以找到额外的显著对齐,这个过程可能被反复迭代一直到没有新的对齐可以被发现。 2.2.3 PHI-BLAST---以常规的表达模型为特别位置进行PSI - BLAST检索,找出和待查询序列具有一样的表达模型且具有同源性的蛋白质序列。 2.3 Translating BLAST 2.3.1 blastx----先将待查询的核酸序列按6 种读框翻译成蛋白质序列,然后将翻译出的蛋白质序列与NCBI 蛋白质序列数据库比较。 2.3.2 tblastn-----先将核酸序列数据库中的核酸序列按6 种读框翻译成
primer BLAST在线设计引物扩增未知菌种
进修生日志:primer BLAST在线设计引物扩增未知菌种 兰会华1整理屈平华2审校 1广西壮族自治区人民医院检验科, 2广东省中医院检验科 PCR的第一步就是引物设计。引物设计的好坏,直接影响PCR的结果。引物设计的软件很多,但是,多数时候是引物设计出来了,PCR也能扩增到目的条带,但非特异性的条带好几条,甚至比目的条带还要亮的,郁闷的有木有?再有,分离到一个新菌种,要扩增管家基因或蛋白基因,可引用参考文献的引物,却怎么也扩增不出来,泪奔的有木有?小编在这里给大家介绍利用细菌的全基因组序列,以primer BLAST在线设计引物和PCR扩增新菌种的方法,让您找到高大上的感觉。 一、实验目的:设计属特异性引物PCR扩增一未知菌弗朗西斯菌的sdhA基因 二、引物设计过程 (一)获得目的基因序列 1、进入NCBI,点击gemone,搜索待扩增菌的属名Francisella
2、点击search,结果得了相关菌种的全基因组序列。 2、点击其中的一个全基因组,如“广州弗朗西斯菌”
4. 全基因组1658482 bp,这么大。人海茫茫,该如何找到sdhA? 这时,可使用网页搜索功能,按热键Ctrl+F,再输入要查找基因名称“sdhA”,如上图。然后,就找到sdhA基因了。 请看,sdhA基因的位置在全基因组的第174351..176144之间哦(见下图)。 5. 再点击左侧的gene(上图),就得到了广州弗朗西斯菌1741bp的sdhA基因全序列,text文本保存。
(二)序列拼接,获得合并序列 如果要扩增的是一个已知的菌种,如广州弗朗西斯菌,那么,只要得到上面的引物,你就可以直接去设计引物了。但如果要扩增的是一个未知菌种呢?1个序列可不够;总之,你的序列得尽可能多,而且是完全不同的序列尽可能多;最好是弗朗西斯菌属内所有的已知的sdhA基因,甚至是与弗朗西斯菌亲缘关系相对较近的军团菌的sdhA基因当然,军团菌没有sdhA基因,这是后话。 小编最终只找了弗朗西斯菌属内8个sdhA基因。DNAMAN软件进行了序列拼接,Sequence,Sequence Assembly,加载序列文件。当然,为了防止序列差异过大,应该适当修改参数,如Identity 90%,应该修改为80%,甚至70%。 拼接后的序列,有除A、G、C、T外,还有Y、R、W等兼并碱基什么的。对了,要的就是这个结果。
Invitrogen中国测序通用引物序列
Invitrogen中国测序通用引物序列 引物名称序列(5'-3') M13R CAG GAA ACA GCT A TG ACC M13F TGT AAA ACG ACG GCC AGT M13F(-47) CGC CAG GGT TTT CCC AGT CAC GAC M13R(-48) AGC GGA TAA CAA TTT CAC ACA GGA M13(-96) CCC TCA TAG TTA GCG TAA CG SP6 A TT TAG GTG ACA CTA TAG T7 TAA TAC GAC TCA CTA TAG GG T7 terminator TGC TAG TTA TTG CTC AGC GG T3 A TT AAC CCT CAC TAA AGG GA pGEX-4T-5' GGG CTG GCA AGC CAC GTT TGG TG pGEX-4T-3' CCG GGA GCT GCA TGT GTC AGA GG GLp1 TGT A TC TTA TGG TAC TGT AAC TG GLp2 CTT TA T GTT TTT GGC GTC TTC CA RVp3 CTA GCA AAA TAG GCT GTC CC RVp4 GAC GA T AGT CA T GCC CCG CG pcDNA3.1R TAG AAG GCA CAG TCG AGG PinPoint primer CGT GAC GCG GTG CAG GGC G pCMV-F TCT AAA AGC TGC GGA A TT GT pCMV-R TCCAAACTCA TCAA TGTA TC pTRC99C-F: TTG CGC CGA CA T CA T AAC pTRC99C-R: CTGCGTTCTGA TTTAA TCTG pCEP-F: AGA GCT CGT TTA GTG AAC CG EBV-R : GTG GTT TGT CCA AAC TCA TC pIRES2-EGFP.P5’:GTA GGC GTG TAC GGT GGG AG pIRES2-EGFP.P3’: AAC GCA CAC CGG CCT TA T TC 3'AD: AGA TGG TGC ACG A TG CAC AG CMV -F CGC AAA TGG GCG GTA GGC GTG S1 CAA CGT GAA AAA A TT A TT A TT CGC S6 GTA AA T GAA TTT TCT GTA GTA GG 5`AOX1 GAC TGG TTC CAA TTG ACA AGC 3`AOX1 GCA AA T GGC A TT CTG ACA TCC α-Factor TAC TA T TGC CAG CA T TGC TGC GAL4 AD TAC CAC TAC AA T GGA TG pACT2-R GTGCACGA TGCACAGTTGAA pB42ADF: CCA GCC TCT TGC TGA GTG GAG A TG
