硫酸标准溶液配制记录
标准溶液配制记录
标准溶液‘配制’及‘标定’原始记录
标准溶液‘配制’及‘标定’原始记录 配制人:标定:复标:审核:
标准物质配制(标定)记录 编号: CHEC/QBG-075 名称:、配制方法: 使用天平型号编号室温℃、湿度%RH 配制:取定溶mL 标定:取份: ⑴⑵⑶⑷ 用溶液滴定,滴定消耗量(mL)V1= 、V2= 、V3= 、V4= 、V0= 。 标准溶液浓度计算公式:C= 计算结果():C1= C2= C3= C4= C = 相对偏差(%):S1= S2= S3= S4= 备注: 。 配制人:复核人: 配制日期:年月日有效期年月日
标准溶液配制记录 编号: CHEC/QBG-147 标准溶液名称:规格: 配制方法: 仪器名称: 溯源标准: 温度:℃、湿度:%RH 标准溶液拟配浓度: 配制或稀释过程: 配制日期:年月日有效期:年月日配制人:复核人:
0.1mol/L盐酸标准滴定溶液的标定 编号:JL/LJ-001-01 一、标定方法:GB/T5009.1-2003 二、使用仪器:AEL-200电子天平(仪器编号:JYB001)马弗炉(仪器编号: JYC009) 三、操作 1、量取9ml盐酸,加适量水并稀释至1000ml。混匀,待标定。 2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸 钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶 液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定 至溶液由绿色变为暗紫色。 四、记录和结果 1、计算公式:c(HCl)=m/[(V1-V2)×0.0530] 0.0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基 准无水碳酸钠的质量,g 配制人:复核人: 配制日期:复核日期:
标准溶液配制方法
中华人民共和国国家标准 UDC543.06:54—41 GB601—88 化学试剂 滴定分析(容量分析)用标准溶液的制备 Chemicalreagent Preparationsofstandardvolumetriesolutions 1主题内容与适用范围 本标准规定了滴定分析(容量分析)用标准溶液的配制和标定方法。 本标准适用于制备准确浓度之溶液,应用于滴定法测定化学试剂的主体含量及杂质含量,也可供其他的化学产品标准选用。 2引用标准 GB603化学试剂试验方法中所用制剂及制品的制备 GB6682实验室用水规格 GB9725化学试剂电位滴定法通则 3一般规定 3.1本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标 准。 3.2本标准中所用试剂的纯度应在分析纯以上。 3.3工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。3.4本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是 所用的试剂为分析纯以上试剂。 3.5本标准中所制备的标准溶液的浓度均指20c时的浓度。在标定和使用时,如 温度有差异,应只能附录A(补充件)补正。 3.6“标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4 平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。浓度值取四位有效数字。 3.7本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中 的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。 3.8制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。。 3.9配制浓度等于或低于0.02mol/L标准溶液时乙二胺四乙酸二钠标准滴定溶液 除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。 3.10碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。 3.11滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不 得超过两个月。
标准溶液的配制
硫酸铁铵标准溶液 配制:称取24g 硫酸铁铵(NH 4Fe(SO 4)2·12H 2O),置于500ml 烧杯中,加入100ml 水、 10ml 硫酸(3.10),加热溶解,取下,滴加0.1%高锰酸钾溶液至呈现微红色,加热煮沸分解过量的高锰酸钾。冷却,移入1L 容量瓶中,用水稀释至刻度,混匀。 标定:称取0.1000~0.1500g 二氧化钛(3.2)3份。以下按照5.3.1~5.3.4条进行。并 随同做空白试验。按式(2)计算试样中硫酸铁铵标准溶液对二氧化钛的滴定度: m T=V-V …………………………(2) 式中:T ––––硫酸铁铵标准溶液对二氧化钛的滴定度,g/ml; m 0––––称取二氧化钛的量,g; V ––––3份二氧化钛溶液所消耗硫酸铁铵标准溶液体积的平均值,ml; V 0––––空白试验所消耗硫酸铁铵标准溶液体积,ml; 1. 重铬酸钾标准溶液(0.0358mol/L): 称取1.7552g 预先在150~170℃烘2~3h 的重铬酸钾基准试剂,溶于适量水中,移入1000 ml 容量瓶中,用水稀释至刻度,混匀。(此溶液每ml 相当于2.0mg 铁)。 2. 锰标准溶液 称取1.0000g 纯锰(99.99%),用50ml 硫酸(1+3)溶解,移入1000ml 容量瓶中,用水稀释至刻度,混匀。此溶液1ml 含1mg 锰或1.291g 一氧化锰。 3. 亚砷酸钠–亚硝酸钠标准溶液 : 配制:称取2.5g 优级纯三氧化二砷(剧毒)溶于20ml 氢氧化钠溶液中(16%),用水稀释至500ml ,以酚酞溶液(1%)作指示剂,用硫酸溶液(1+1)中和至红色消失,再滴加10%碳酸钠至红色出现,加入1.75g 亚硝酸钠,并使其全部溶解,混匀。(浑浊应过滤)。用水稀释至4000ml ,充分混匀,贮存于棕色瓶中。此溶液约0.025N
盐酸标准溶液的配制和标定
盐酸标准溶液的标定 一.仪器与试剂 仪器:全自动电光分析天平 1台 (1)称量瓶 1只 (2)试剂瓶 1000ml 1个 (3)锥形瓶 250ml 3个 (4)酸式滴定管 50ml 1支 (5)量筒 50mL 1只 试剂: (1)0.1mol/L盐酸待标定溶液 (2)无水碳酸钠(固基准物) (3)溴甲酚绿-甲基红混合指示剂 二、步骤 0.1mol/L盐酸标准溶液的标定 1.标定步骤 用称量瓶按递减称量法称取在270~300℃灼烧至恒重的基准无水碳酸钠0.15~0.22g(称准至0.0002g),放入250ml锥形瓶中,以50ml蒸馏水溶解,加溴甲酚绿-甲基红混合指示剂10滴(或以25ml蒸馏水溶解,加甲基橙指示剂1~2滴),用0.1mol/L盐酸溶液滴定至溶液由绿色变为暗红色(或由黄色变为橙色),加热煮沸2分钟,冷却后继续滴定志溶液呈暗红色(或橙色)为终点。平行测定3次,同时做空白实验。以上平行测定3次的算术平均值为测定结果。 2.计算
式中: m—基准无水碳酸钠的质量,g; V 1 —盐酸溶液的用量,ml; V —空白试验中盐酸溶液的用量,ml; 52.99—1/2 Na 2CO 3 摩尔质量,g/mol C HCL —盐酸标准溶液的浓度,mol/L.
氢氧化钠溶液的标定 1、试剂: (1)0.1000mol/L氢氧化钠待标定溶液 (2)酚酞指示剂 2、仪器: (1)全自动电光分析天平 1台 (2)称量瓶 1只 (3)碱式滴定管(50mL) 1支 (4)锥形瓶(250mL) 3支 (5)烧杯(250mL) 2只 (6)洗瓶 1只 (7)量筒(50mL) 1只 3、测定步骤: 准确称取在110℃~120℃准确称取在110~120℃烘至恒重的基准邻苯二甲酸氢钾0.5~0.6g(称准至0.0002g),放入250ml三角瓶中,加入250ml的蒸馏水溶解,加酚酞指示剂2滴,用0.1mol/LNaOH溶液滴定至由无色变为红色30秒不褪色为终点,平行测定3次,同时作空白试验。 4、计算:C (NaOH)= 22 . 204 ) ( 1000 1 ? - ? V V m 式中:m—邻苯二甲酸氢钾的质量,g 1 V—NaOH溶液的用量,ml V—空白试验NaOH溶液的用量,ml 204.22 —邻苯二甲酸氢钾的摩尔质量,g/mol
标准溶液配制
溶液配制 标准溶液的配置与标定 一、1N、0.5N、0.1N硫酸标准溶液 1、配制 1N硫酸标准溶液 量取98%的浓硫酸280ml,慢慢倒入装有10L水瓶中,摇匀待标 0.5N硫酸标准溶液 量取98%的浓硫酸140ml,慢慢倒入装有10L水瓶中,摇匀待标 0.1N硫酸标准溶液 量取98%的浓硫酸28ml,慢慢倒入装有10L水瓶中,摇匀待标 2、标定 1)标定方法 1N硫酸标准溶液 吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 0.5N硫酸标准溶液 吸取10ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 0.1N硫酸标准溶液 吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%
甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。 2)计算 N=N1*V1/V 式中:V1-碳酸钠基准液用量 ml N1-碳酸钠基准液当量浓度 V-消耗硫酸标准溶液的用量 ml 二、10%、25% 10%硫酸溶液 量取98%的浓硫酸600ml,慢慢倒入装有10L水瓶中,摇匀待标25%硫酸溶液 量取98%的浓硫酸1600ml,慢慢倒入装有10L水瓶中,摇匀待标 2、标定 1)标定方法 10%硫酸溶液 吸取配制好的10%的硫酸溶液5ml于250ml三角烧瓶中,加入3D 甲基红指示剂,用1N的氢氧化钠标准溶液滴定,滴至由红色变为橙色即为终点。(消耗的氢氧化钠标准溶液应在10.85ml以上,方可达到10%浓度) 25%硫酸溶液 吸取配制好的25%的硫酸溶液5ml于250ml三角烧瓶中,加入3D 甲基红指示剂,用1N的氢氧化钠标准溶液滴定,滴至由红色变为橙
常用标准溶液的配制和标定
标准溶液的配制与标定 实训一氢氧化钠标准溶液的配制和标定 一、目的要求 1.掌握NaOH标准溶液的配制和标定。 2.掌握碱式滴定管的使用,掌握酚酞指示剂的滴定终点的判断。 二、方法原理 NaOH有很强的吸水性和吸收空气中的CO2,因而,市售NaOH中常含有Na2CO3。 反应方程式:2NaOH + CO2→Na2CO3+ H2O 由于碳酸钠的存在,对指示剂的使用影响较大,应设法除去。 除去Na2CO3最通常的方法是将NaOH先配成饱和溶液(约52%,W/W),由于Na2CO3在饱和NaOH溶液中几乎不溶解,会慢慢沉淀出来,因此,可用饱和氢氧化钠溶液,配制不含Na2CO3的NaOH溶液。待Na2CO3沉淀后,可吸取一定量的上清液,稀释至所需浓度即可。此外,用来配制NaOH溶液的蒸馏水,也应加热煮沸放冷,除去其中的CO2。 标定碱溶液的基准物质很多,常用的有草酸(H2C2O4?2H2O)、苯甲酸(C6H5COOH)和邻苯二甲酸氢钾(C6H4COOHCOOK)等。最常用的是邻苯二甲酸氢钾,滴定反应如下: C6H4COOHCOOK + NaOH →C6H4COONaCOOK + H2O 计量点时由于弱酸盐的水解,溶液呈弱碱性,应采用酚酞作为指示剂。 三、仪器和试剂 仪器:碱式滴定管(50ml)、容量瓶、锥形瓶、分析天平、台秤。 试剂:邻苯二甲酸氢钾(基准试剂)、氢氧化钠固体(A.R)、10g/L酚酞指示剂:1g酚酞溶于适量乙醇中,再稀释至100mL。 四、操作步骤 1.0.1mol/L NaOH标准溶液的配制 用小烧杯在台秤上称取120g固体NaOH,加100mL水,振摇使之溶解成饱和溶液,冷却后注入聚乙烯塑料瓶中,密闭,放置数日,澄清后备用。 准确吸取上述溶液的上层清液5.6mL到1000毫升无二氧化碳的蒸馏水中,摇匀,贴上标签。 2.0.1mol/L NaOH标准溶液的标定 将基准邻苯二甲酸氢钾加入干燥的称量瓶,于105-110℃烘至恒重,用减量法准确称取邻苯二甲酸氢钾约0.6000克,置于250 mL锥形瓶中,加50 mL无CO2蒸馏水,温热使之溶解,冷却,加酚酞指示剂2-3滴,用欲标定的0.1mol/L NaOH溶液滴定,直到溶液呈粉红色,半分钟不褪色。同时做空白试验。 要求做三个平行样品。
原子吸收标准溶液的配制
原子吸收常用的标准溶液配制方法 点击次数:1081 发布时间:2012-5-17 标准溶液的配备方法 钙元素符号-Ca 相对原子量 -40.08 仪器操作条件 波长 422.7nm 狭缝 0.4nm 灯电流 3.0毫安 燃烧器高度 8毫米 空气压力 0.3兆帕 乙炔压力 0.09兆帕 空气流量 7.0升/分 乙炔流量 1.5升/分 火焰类型氧化性兰色焰 钙Ca 标准溶液的配置 钙标准溶液浓度1000微克/毫升 称取经灼烧后的高纯氧化钙1.3992克,置于250毫升烧杯中,加入盐酸20毫升,低温加热溶解,冷却后移入1000毫升容量瓶中,用去离子水定容刻度,摇匀。此溶液1毫升=1000微克Ca。 或购置国家标准GBW(E)080261 1000微克/毫升Ca(基体5%盐酸) 标准系列与线性工作范围 配置每毫升含钙0.0, 1.0, 2.0,3.0,4.0,5.0微克2%盐酸溶液和0.2%氯化锶溶液。 钙标准使用液:吸取1毫升=1000微克钙标准溶液10.0毫升于100毫升容量瓶中,加入2毫升盐酸,用去离子水定容刻度,摇匀。此溶液1毫升=100微克钙。 氯化锶应为GR试剂 在仪器推荐条件下,标准曲线线性范围:0.0-5.0微克/毫升。 特征浓度 在仪器推荐条件下,钙的特征浓度约为:0.080微克/毫升(1%吸收)。 浓度为2微克/毫升的钙标准溶液,通常可获得0.110左右的吸光度值。 其他分析线
波长(nm) 狭缝(nm) 特征浓度之比 422.7 0.4 1.0 239.9 0.4 120 干扰及分析提示 据文献报道,在空气-乙炔焰中,铝、Be、硅、钛、钒、锆、磷酸盐、硫酸盐都会干扰钙的测定。将0.1-1%的镧或锶加进样品和标准中,能抑制上述干扰。硫酸、磷酸干扰钙的测定,测定时,样品和标准中酸的浓度应该一致,同样一份样品,酸的浓度不同所测吸光度值也不相同。要严格控制水和试剂空白,仪器喷雾系统注意防止沾污。钙有轻微的电离干扰。 试验表明,钙的吸光度与燃气和助燃气的比例、燃烧器的高度有关。在开始分析以前,应用该得标准溶液调节吸光度到最大,然后进行分析。 标准溶液的配备方法 镉元素符号-Cd 相对原子量—112.4仪器操作条件 波长228.8 nm 狭缝0.4 nm 灯电流 3.0毫安 燃烧器高度 6.5毫米 空气压力0.3兆帕 乙炔压力0.09兆帕 空气流量7.0升/分 乙炔流量 1.5升/分 火焰类型氧化性蓝色焰 镉 标准溶液的配置 镉标准溶液浓度1000微克/毫升 称取高纯镉(99.9%)0.1000克,置于250毫升烧杯中,加入10毫升盐酸,在低温电热板上加热溶解。移入100毫升容量瓶中,用去离子水定容刻度,摇匀。此溶液1毫升=1000微克镉。或购置国家标准GBW 08612 1000微克/毫升镉 (基体1%硝酸) 标准系列与线性工作范围 配置每毫升含镉0.0,0.2,0.4,0.6,0.8,1.0微克2%盐酸溶液。
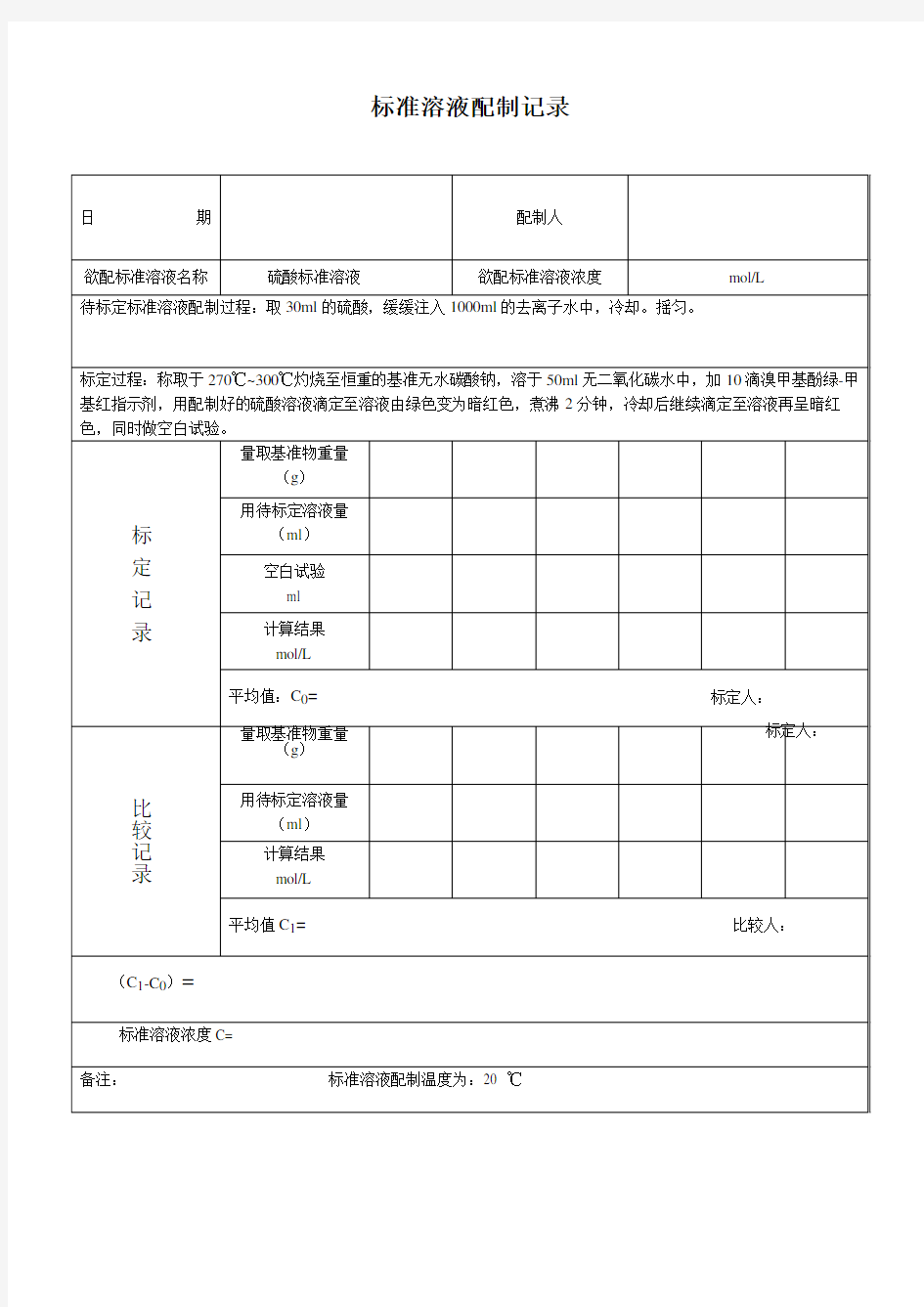
硫酸标准溶液的配制和标定
硫酸标准溶液的配制和标定 1.各浓度硫酸标准滴定溶液的配制 按表1所示,量取硫酸慢慢注入600mL烧杯内的400mL水中,混匀。冷却后转移入1L量瓶中,用水稀释至刻度,混匀。贮存于密闭的玻璃容器内。 表 1 量取硫酸体积 硫酸标准滴定溶液浓度 mol/L 配制1L硫酸溶液所需硫酸体积 mL 0.05 1.5 0.1 3.0 0.2 6.0 0.515.0 1.030.0 2.标定 按表2所示,准确称量已在270-300℃干燥过4h的基准无水碳酸钠分别置于250mL锥形瓶中,各加入蒸馏水50mL使其溶解,再加2滴甲基红指示液,用硫酸溶液滴定至红色刚出现,小心煮沸溶液至红色褪去,冷却至室温。继续滴定、煮沸、冷却,直至刚出现的微红色在再加热时不褪色为止。 表2 标定所需无水碳酸钠质量 无水碳酸钠质量硫酸标准滴定溶液浓度mol/L g 0.050.11±0.001 0.10.22±0.01 0.20.44±0.01 0.5 1.10±0.01 1.0 2.20±0.01 3.计算 硫酸标准滴定溶液浓度按式(1)计算:
c(1/2H2SO4)=m/0.05299×V 式中: c(1/2H2SO4)──硫酸标准滴定溶液之物质的量浓度,mol/L; m──称量无水碳酸钠质量,g; V──滴定用去硫酸溶液实际体积,mL; 0.05299──与1.00mL硫酸标准滴定溶液〔c(1/2H2SO4)=1.000mol/L〕 相当的以克表示的无水碳酸钠的质量。 4.精密度 做五次平行测定。取平行测定的算术平均值为测定结果。 五次平行测定的极差,应小于表3规定的容许差r。 表3硫酸标准滴定溶液标定的容许差 硫酸标准滴定溶液每月重新标定一次
标准溶液的配制
标准溶液的配制 二氧化硅标准贮存溶液:称取0.5000g预先在100℃灼烧2h并冷至室温的二氧化硅(99.99%)置于铂坩埚中,加5g无水碳酸钠,盖上坩埚盖并稍留缝隙,置于1000℃高温炉中熔融5-10min,取出,冷却。置于盛有300ml 沸水聚四氟乙烯烧杯中,低温加热浸出熔块至溶液清亮,用热水洗出坩埚及盖,冷却运载室温。移入500ml容量瓶中,用水稀释至刻度,摇匀,贮于塑料瓶中,此溶液1ml含1mg二氧化硅。 二氧化硅标准溶液:移取50.00ml二氧化硅标准贮存溶液,置于500ml 容量瓶中,用水稀释至刻度,摇匀,贮于塑料瓶中。此溶液1ml含1μg二氧化硅。 三氧化二铁标准贮存溶液:称取1.0000g预先在110℃烘2小时的三氧化二铁(99.99%),置于烧杯中,用少许水湿润,加入40ml盐酸(1+1),低温加热溶解至溶液清亮,冷至室温,移入1000ml容量瓶中,用水稀释至刻度,摇匀。此溶液1ml含1mg三氧化二铁。 三氧化二铁标准溶液:移取50.00ml三氧化二铁标准贮存溶液,置于500ml容量瓶中用水稀释至刻度,摇匀。此溶液1ml含100μg三氧化二铁。 氧化铝标准溶液:称取0.5293g金属铝(99.99%)于聚四氟乙烯烧杯中,加20ml水、10~15ml氢氧化钾溶液(40%),低温溶解,以盐酸(1+1)中和至沉淀出现,并过量20ml,加热煮沸1~2min至溶液清亮,冷却,移入1000ml容量瓶中,以水稀释至刻度,摇匀,此溶液1ml含1mg氧化铝。 二氧化钛标准贮存溶液:称取0.1000g预先在1000℃灼烧1小时的二氧化钛(光谱纯),置于铂坩埚中,加入5~8g焦硫酸钾熔融,熔融物用200ml 硫酸(1+9)加热溶解,溶液冷至室外温后,移入1000ml容量瓶中,用硫酸(5+95)稀释至刻度摇匀。此溶液1ml含100μg二氧化钛。 二氧化钛标准溶液:称取50.00ml二氧化钛标准贮存溶液,置于500ml 容量瓶中,用水稀释至刻度,摇匀。此溶液1ml含10μg二氧化钛。 氧化钙标准溶液:称取0.8923g预先在110℃烘1小时的碳酸钙(基准试剂)置于400ml烧杯中,加少量水盖上表面皿,沿杯嘴慢慢加入盐酸(1+1),加热溶解并煮沸冷至室温,移入1000ml容量瓶中用水稀释至刻度摇匀。此溶液1ml含0.5mg氧化钙。当取样量为1.7848g时溶液含氧化钙1mg/ml。
标准滴定溶液配制及标定原始记录 (2)
氢氧化钠标准滴定溶液配制及标定原始记录 依据标准GB/T601-2002 有效期:2个月 基准试剂名称:邻苯二甲酸氢钾 基准试剂摩尔质量(M ):204.22g/mol 仪 器、设 备 编 号 电热恒温干燥箱: 分析天平: 称量瓶: 100 mL 容量瓶: 10mL 刻度吸管: 1000 mL 容量瓶: 150 mL 三角瓶: 滴定管: 配 制 试剂称量(g ): 溶液体积(mL ): 溶液温度(℃): 配制日期: 操作类别 操作项目 标 定 操作序号 1 2 3 4 操作日期 溶液温度(℃) 基准试剂质量 m ﹙g ﹚ 滴定末数 V 1﹙mL ﹚ 空白修正 V 2﹙mL ﹚ 温度修正系数F ﹙ml/L ﹚ 溶液体积V ﹙mL ﹚ 溶液浓度C ﹙mol/L ﹚ 平均值﹙mol/L ﹚ 计算式: V=﹙V 1-V 2﹚×﹙1± 1000F ﹚ C=M ×V 1000×m =0.20422V m 备注:?每次滴定必须从“0”开始; ?温度修正系数F 值参见GB/T601-2002 附录A ; ?复校指标准滴定溶液超过有效期后再使用时进行的标定; ?计算时保留五位有效数字,平均值报出结果并保留四位有效数字。 配制人: 标定人:
硫酸标准滴定溶液配制及标定原始记 依据标准GB/T601-2002 有效期:3个月 基准试剂名称:无水碳酸钠 基准试剂摩尔质量(M ):52.994 g/mol 仪 器、设 备 编 号 实验电阻炉: 分析天平: 乳钵: 称量瓶: 50 ml 量筒: 1000 mL 容量瓶: 150 mL 三角瓶: 50mL 酸式滴定管: 配 制 试剂称量(g ): 溶液体积(mL ): 溶液温度(℃): 配制日期: 操作类别 操作项目 标 定 操作序号 1 2 3 4 操作日期 溶液温度(℃) 基准试剂质量 m ﹙g ﹚ 滴定末数 V 1﹙mL ﹚ 空白修正 V 2﹙mL ﹚ 温度修正系数F ﹙ml/L ﹚ 溶液体积V ﹙mL ﹚ 溶液浓度C ﹙mol/L ﹚ 平均值﹙mol/L ﹚ 计算式: V=﹙V 1-V 2﹚×﹙1± 1000F ﹚ C=M ×V 1000×m =0.052994V m 备注:?每次滴定必须从“0”开始; ?温度修正系数F 值参见GB/T601-2002 附录A ; ?复校指标准滴定溶液超过有效期后再使用时进行的标定; ?计算时保留五位有效数字,平均值报出结果并保留四位有效数字。 配制人: 标定人:
常用标准溶液配制方法
常用标准溶液配制方法
1
2一般规定 本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标准。 本标准中所用试剂的纯度应在分析纯以上。 工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。 本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是所用的试剂为分析纯以上试剂。 本标准中所制备的标准溶液的浓度均指20c 时的浓度。在标定和使用时,如温度有差异,应只能附录A(补充件)补正。 “标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。浓度值取四位有效数字。 本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。
制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。。 配制浓度等于或低于0.02mol/L 标准溶液时乙二胺四乙酸二钠标准滴定溶液除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。 碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。 滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不得超过两个月。 3标准溶液的制备和标定 4.1 氢氧化钠标准溶液(使用期:2个月) c(NaOH) = 1 mol/L c(NaOH) =0.5 mol/L c(NaOH) =0.1 mol/L 4.1.1 配制 称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。用塑料管吸下述规定体积的上层清夜,用无二氧化碳的水稀释至1000ml,摇匀。 c(NaOH) ,mol/L 氢氧化钠饱和溶
标准溶液的配制方法及基准物质
标准溶液的配制方法及基准物质 标准溶液是指已知准确浓度的溶液,它是滴定分析中进行定量计算的依据之一。不论采用何种滴定方法,都离不开标准溶液。因此,正确地配制标准溶液,确定其准确浓度,妥善地贮存标准溶液,都关系到滴定分析结果的准确性。配制标准溶液的方法一般有以下两种: 直接配制法 用分析天平准确地称取一定量的物质,溶于适量水后定量转入容量瓶中,稀释至标线,定容并摇匀。根据溶质的质量和容量瓶的体积计算该溶液的准确浓度。 能用于直接配制标准溶液的物质,称为基准物质或基准试剂,它也是用来确定某一溶液准确浓度的标准物质。作为基准物质必须符合下列要求: (1)试剂必须具有足够高的纯度,一般要求其纯度在%以上,所含的杂质应不影响滴定反应的准确度。 (2)物质的实际组成与它的化学式完全相符,若含有结晶水(如硼砂Na 2B 4 O 7 ?10H2O),其结晶水的数目也应与化学式完全相符。 (3)试剂应该稳定。例如,不易吸收空气中的水分和二氧化碳,不易被空气氧化,加热干燥时不易分解等。 (4)试剂最好有较大的摩尔质量,这样可以减少称量误差。常用的基准物质 有纯金属和某些纯化合物,如Cu, Zn, Al, Fe和K 2Cr 2 O 7 ,Na 2 CO 3 , MgO , K BrO 3 等,它们的含量一般在%以上,甚至可达% 。 应注意,有些高纯试剂和光谱纯试剂虽然纯度很高,但只能说明其中杂质含量很低。由于可能含有组成不定的水分和气体杂质,使其组成与化学式不一定准确相符,致使主要成分的含量可能达不到%,这时就不能用作基准物质。一些常用的基准物质及其应用范围列于表中。
表常用基准物质的干燥条件和应用
标准溶液配制和标定
1、氢氧化钠标准滴定溶液 1.1配制 称取110 g氢氧化钠,溶于100 ml无二氧化碳的水中,摇匀,注人聚乙烯容器中,密闭放置至溶液清亮。按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1 000MI,摇匀。 表1 1.2 标定 按表 2 的规定称取于 105℃--110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。同时做空白试验。 表2 氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按式(1)计算: m×1000 c(NaOH)= ------------- ( V1-V2)M 式中 : m—邻苯二甲酸氢钾的质量的准确数值,单位为克(9); V1 —氢氧化钠溶液的体积的数值,单位为毫升(mL);
V2 一空白试验氢氧化钠溶液的体积的数值,单位为毫升(mL); M一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)【M(KHC8H4O4)= 204.22 】 2、硫酸标准滴定溶液 2.1配制 按表3的规定量取硫酸,缓缓注人1 000 mL水中,冷却,摇匀。 表3 2.2标定 按表4的规定称取于270℃—300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50m l.水中,加5甲基红—亚甲基蓝指示剂(或滴澳甲酚绿一甲基红指示液),用配制好的硫酸溶液滴定至溶液由绿色变为紫色(绿色变为暗红色),煮沸2 min,冷却后继续滴定至溶液再呈紫色(暗红色)。同时做空白试验。 表4 硫酸标准滴定溶液的浓度[c(1/2H2SO4)],数值以摩尔每升(mol/L)表示 m×1000 c(1/2H2SO4)= ------------- ( V1-V2)M 式中: m—无水碳酸钠的质量的准确数值,单位为克(g); V1—硫酸溶液的体积的数值,单位为毫升(mL) ;
硫酸标准溶液配制与标定
硫酸标准溶液配制与标定 配制: 称取上述规定定量的于270-300℃灼烧至恒重的基准无水碳酸钠,称准至0.0001g。溶于50ml水中,加10滴溴甲酚绿-甲基红混合指示剂,用配好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同样做空白试验, 计算: C(1/2H2SO4)=m/[(V1-V2)*0.05299)] V1--------硫酸之用量,ml V2--------空白试验硫酸之用量,ml 0.05299-------于1.0000ml硫酸标准溶液相当的以克表示的无水碳酸钠的质量 比较方法: 量取30.00-35.00ml上述规定浓度的氢氧化钠标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配好的硫酸溶液滴定,近终点时加热至80度,继续滴定至溶液呈粉红色。 计算: C(1/2H2SO4)=v1*c1/v V1--------氢氧化钠标准溶液之用量,ml V----------硫酸之用量,ml C1----------氢氧化钠标准溶液之物质的量浓度,mol/l 氢氧化钠标准溶液的配制与标定 配制: 称取100g氢氧化钠,溶于100ml水中,摇匀,注入聚乙烯容器,密闭放置至溶液清亮,用塑料管虹吸下述规定体积的上层清液,注入1000ml无二氧化碳的水 称取上述规定的量于105-110℃烘至恒重的基准邻苯二甲酸氢钾,称准至0.0001g。溶于上述规定体积的无二氧化碳的水中,加2滴酚酞指示剂(10g/l),用配好的氢氧化钠溶液滴定至粉红色,同样作空白试验,
计算: C(NaOH)=m/[(V1-V0)*0.2042] V0------空白试验氢氧化钠溶液之用量,ml V1------氢氧化钠溶液之用量,ml 0.2042-----于1.00ml氢氧化钠标准溶液相当的以克表示的邻苯二甲酸氢钾的质量比较方法: 量取30.00-35.00ml上述规定浓度的盐酸标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配好的硫酸溶液滴定,近终点时加热至80度,继续滴定至溶液呈粉红色。 计算: C(NaOH)=v1*c1/v V1--------盐酸标准溶液之用量,ml V----------氢氧化钠溶液之用量,ml C1----------盐酸标准溶液之物质的量浓度,mol/l 盐酸标准溶液的配制与标定 配制: 称取上述规定定量的于270-300℃灼烧至恒重的基准无水碳酸钠,称准至0.0001g。溶于50ml水中,加10滴溴甲酚绿-甲基红混合指示剂,用配好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同样做空白试验, 计算: C(HCL)=m/[V1-V2)*0.05299)] V1--------盐酸之用量,ml V2--------空白试验盐酸之用量,ml 0.05299-------于1.0000ml盐酸标准溶液相当的以克表示的无水碳酸钠的质量 比较方法: 量取30.00-35.00ml上述规定浓度的氢氧化钠标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配好的硫酸溶液滴定,近终点时加热至80度,继续滴定至溶液呈粉红色。 计算: C(NaOH)=v1*c1/v V1--------氢氧化钠标准溶液之用量,ml V----------盐酸溶液之用量,ml C1--------氢氧化钠标准溶液之物质的量浓度,mol/l
标准溶液配制作业指导书-1
标准溶液的配制作业指导书 1.目的: 规范标准溶液配制活动、保证标准溶液(标准物质)准确、可靠,量值溯源稳定。 2.适用范围: 适用于技术中心检验测试用标准溶液(标准物质)的制备、标定、验证、有效期限的规定和标识等活动。 3.职责: 3.1配制人员:记录配制、稀释过程和数据;加贴标签; 3.2审核(复核)人员:检查配制过程符合性,计算有效性和结果准确性。 4.工作过程及要求 4.1基本要求 4.1.1方法选择:按照检验、测试、分析标准(方法)规定执行或按照国家标准(如GB/T601、GB/T602等)规定执行。 4.1.2制备标准溶液用水,应符合GB/T6682-92中二级水的规定,特殊项目、微量测定用元素标准溶液配制用水应符合GB/T6682-92中一级水的规定。 4.1.3配制标准溶液所用试剂的纯度应为基准剂试、高纯试剂、光谱纯试剂。 4.1.4所用分析天平的砝码需定期校正,滴定管、容量瓶及移液管使用已校正的。 4.1.5标定标准溶液所用的基准试剂应为容量分析工作基准试剂。 4.1.6制备标准溶液的浓度系指20℃时的浓度,在标定和使用时,如温度有差异,应按附表1进行补正。 4.1.7“标定”或比“较较”标准溶液浓度时,平行试验不得少于4次,平行测定结果的极差(即最大值和最小值之差)与平均值之比不得大于0.1%,结果取平均值。浓度值取四位有效数字。 4.1.8对规定用“标定”和“比较”两种方法测定浓度时不得略去其中任何一种,且两种方法测得的浓度值之差不得大于0.2%,以标定结果为准。 4.1.9制备的标准溶液浓度与规定浓度相对误差不得大于5%。 4.1.10配制浓度等于或低于0.02mol/L的标准溶液时,应现用现配。 4.1.11碘量法反应时,溶液的温度不能过高,一般在15-20℃之间进行。 4.1.12标准贮备液有效期为两个月。滴定分析用标准溶液在常温(15-25℃)下,保存时间一般不超过2个月。 4.1.13微量测定用工作液应用标准溶液逐级冲稀成所需工作液,每次吸取体积不得小于5ml。4.1.14微量测定所用标准溶液在常温(15-25℃)下保存期一般为2个月,有效期内出现混浊、沉淀或颜色有变化时,应重新制备。 4.2 配制方法 4.2.1滴定分析(容量分析)用标准溶液的制备按照检验、测试、分析标准(方法)规定执行或按GB/T601-2002执行 4.2.1.1直接配制法 用分子量求出欲配制的浓度质量。 在分析天平上准确称取一定量已干燥的基准物放入洁净的烧杯中溶于水,转入已校正的容量瓶中用水稀释至刻度,摇匀。 根据物质的重量,溶液的体积计算出其准确浓度。 配制标准溶液校核登记。
常用标准溶液配制方法
中华人民共和国国家标准 UDC 543.06:54 —41 GB 601—2002 化学试剂 滴定分析(容量分析)用标准溶液的制备 Chemical reagent Preparations of standard volumetrie solutions 1主题容与适用围 本标准规定了滴定分析(容量分析)用标准溶液的配制和标定方法。 本标准适用于制备准确浓度之溶液,应用于滴定法测定化学试剂的主体含量及杂质含量,也可供其他的化学产品标准选用。 2引用标准 GB 603 化学试剂试验方法中所用制剂及制品的制备 GB 6682 实验室用水规格 GB 9725 化学试剂电位滴定法通则 3一般规定 本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的标准。 本标准中所用试剂的纯度应在分析纯以上。 工作中所用的分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。
本标准中标定时所用的基准试剂为容量分析工作基准试剂;制备标准溶液是所用的试剂为分析纯以上试剂。 本标准中所制备的标准溶液的浓度均指20c时的浓度。在标定和使用时,如温度有差异,应只能附录A(补充件)补正。 “标定”或“比较”标准溶液浓度时,平行试验不得少于8次,两人各作4平行,每人4平行测定结果的极差与平均值之比不得大于0.1%。两人测定结果的差值与平均值之比不得大于0.1%,最终取两人测定结果的平均值。浓度值取四位有效数字。 本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中的任何一种,且两种方法测得的浓度值之差值与平均值之比不得大于0.2%,最终以标定结果为准。 制备的标准溶液与规定浓度之差不得超出规定浓度的+—5%。。 配制浓度等于或低于0.02mol/L 标准溶液时乙二胺四乙酸二钠标准滴定溶液除外,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。 碘量法反应时,溶液的温度不能过高,一般在15~20c之间进行滴定。 滴定分析(容量分析)用标准溶液在常温(15~25)下,保存时间一般不得超过两个月。 4标准溶液的制备和标定 4.1 氢氧化钠标准溶液(使用期:2个月) c(NaOH) = 1 mol/L c(NaOH) =0.5 mol/L c(NaOH) =0.1 mol/L 4.1.1 配制
溶液配制作业指导书
漳州雅色五金制造有限公司 页次 主题标准溶液配制技术指导书 批 准审 核 编 制 编号版本 制定部门电镀技术课生效日期 一、标准溶液的制备: 1、0.1N硫酸亚铁铵Fe(NH4)2(SO4)2?6H2O 1)配制:称取39.0g硫酸亚铁铵于800mL水中溶解后20mL浓硫酸以水稀释至1L。 2)标定: 取10 mL 0.1N K2Cr2O7溶液加10mL硫磷混酸加3滴PA酸指示剂,用硫酸亚铁铵标准溶液滴定到溶液为绿色。 3)计算: C硫酸亚铁铵=C重铬酸钾×V重铬酸钾/V硫酸亚铁铵 2、0.1N K2Cr2O7 配制:准确称取4.903g经140~150℃烘干至恒重的K2Cr2O7溶于200mL水中,完全溶解后,移至1L容量瓶中,以蒸馏水水稀释至刻度。 3、01N AgNO3标准溶液的配制与标定 1)配制:称取17.0000g AgNO3于500mL烧杯中,用不含CLˉ离子的蒸馏水溶解后,移至1L容量瓶中,稀释至刻度。 2)标定:准确称移基准试剂NaCl 0.12-0.15g,放入锥形瓶中,加50mL水溶解,加铬酸钠指示剂1Ml,在充分摇动下,用配好的AgNO3溶液滴定直至溶液微呈砖红色 为终点。 3)计算: C硝酸银=C氯化钠×V氯化钠/V硝酸银 4、0.1N Na2S2O3配制与标定 1) 配制:A称0.1g Na2S2O3预溶于500mL水中 B称25g Na2S2O3溶于A中,稀释到1L 2)标定: 移取0.1mol/L K2Cr2O7标准溶液10.00mL,于碘量瓶中,加25mL煮沸,冷却后的蒸馏
水,溶解后,加2g固体KI及10mL 20% H2SO4,盖上瓶塞摇匀后,于瓶口封以少量蒸馏水,于暗处放置10min,取出用水冲洗瓶塞及内壁,加150ml冷却蒸馏水,用待标定的 Na2S2O3溶液滴定至溶液由蓝色变为亮绿色即为终点. 3) 计算: C硫代硫酸钠=C重铬酸钾×V重铬酸钾/V硫代硫酸钠 5、EDTA的配制与标定 1)配制: 称取EDTA80g以水加热溶解冷却,稀释至1000mL,充分摇匀。 2)标定: A、Zn2+标准溶液的配制: 准确称取金属锌1.6g,置于小烧杯中,加入约10mL HCl(1+2),待Zn完全溶解后,以少量蒸馏水冲洗杯壁,定容至250mL。 B、吸取25mL Zn2+标液于250mL锥形瓶,加20mL水,滴定1:1 NH3·H2O至刚 出现浑浊,此时PH=8,加10mL缓冲液,加铬黑T 4滴,用EDTA标准溶液滴定至溶液由酒红色变为纯黑色。 4)计算: C EDTA=m锌/(V EDTA×M锌) 6、0.1N Hg(NO3)2的配制 准确称取1.623g Hg(NO3)2加稀HNO3至溶解后加水至1L。 7 标准硫酸(H2SO4)溶液 (1)配制:C(1/2H2SO4)=1mol/L,量取分析纯硫酸(ф=1.84g/cm3)30mL,慢慢倒如500ml 水中,冷却后稀释至1L C(1/2H2SO4)=O.1mol/L,量取分析纯硫酸(ф=1.84g/cm3)3mL,慢慢倒如 500ml水中,冷却后稀释至1L (2)标定: 以碳酸钠标定:称取在120℃干糙过的基准级无水碳酸钠1.6g(四位有效数 字),置于250ml烧杯中,加水120ml,搅拌使其溶解,加入甲基橙指示剂3-4滴 用配制好的硫酸滴定,至溶液由黄色刚变红色为终点 m C(1/2H2SO4)=v×0.05299
常用标准溶液的配制及标定
常用标准溶液的配制及标定 修订:段海报 一、EDTA标准溶液的配制与标定 1、EDTAD的配制 EDTA标准溶液,通常用EDTA二钠盐(乙二胺四乙酸二钠)配制。EDTA二钠盐含有两个结晶水(Na2H2Y·2H2O),在常温度下约为含0.3%的吸附水,在80℃干燥可去吸附水,在104-14℃干燥可失去结晶水,的无水EDTA二钠盐(Na2H2Y),以上统称EDTA。Na2H2Y分子量为336.25,EDTA配制时,通常是经过标定,因此,可直接称量配制。不同浓度的EDTA标准溶液的配制可按下表进行,称取EDTA(含水),溶于5L热水中,冷却后,用脱脂棉过滤,最后稀释至60L,混匀,放置1-3天后,进行标定。 EDTA标准溶液的配制对应表 EDTA标准溶液的浓度(mol)配制60L时需要的量(g)摩尔浓度 (mol) 0.09808 2196.0 0.01 201.6 2、EDTA标准溶液的标定 标定EDTA的基准物质,在可能的情况下,尽量采用采测元素的基准物质进行。在一般情况下,多采用光谱纯金属锌作
为标定的基准。以金属锌做基准物质时,金属表面的氧化层,要用干净的剪刀刮干净,或用3M盐酸洗净,再以二次水,乙醚或丙酮洗净,在100℃烘干5min。 金属锌原子质量=65.38 锌标液的配制 将金属锌粒(99.99%以上),先用1%的硝酸浸泡除去表面上的氧化膜至光亮,然后用水冲洗三次,再用少量无水乙醇洗涤三次,在105℃烘干。(不宜过久,以免又产生氧化膜,保存于磨口瓶中)。 配制0.09808M锌标准溶液 称取12.825g的锌粒于500ml的烧杯中,加水150ml,然后分数次加入120ml(1+1)硝酸,在电热板上低温加热溶解,并彻底赶出NO2,将体积浓缩到150ml,使溶液呈无色透明。取下来冷却,移入2L容量瓶中,稀释至刻度。 Zn标准溶液的配制对应表 Zn标液的浓度(mol) 所需金属锌 的质量 理论消耗硝酸(1+1)的量 (ml) 0.09808 12.825 120.0 0.01 1.308 12.24 按照下表的取样量,移取锌标准溶液于500ml锥形瓶中,加水约80ml,加入溴酚绿指示剂(0.1%)2滴,加氨水(1+1)至溶液刚好呈蓝色,加PH=5.5的HAc-NaAc溶液15ml,二
各种化学试剂标准溶液的配制
常用试剂的配制一、标准溶液的配制 1、硫酸(H 2SO 4 )溶液的配制: 1000mL浓度c(1/2H 2SO 4 )=0.1mol/L,即c(H 2 SO 4 )=0.05mol/L的硫酸溶液的配制: 取3mL左右的浓硫酸缓缓注入1000mL水中,冷却,摇匀。 新配制的硫酸需要标定,其标定方法如下: 称取于270-300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠0.2g,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。同时做空白试验(取50mL水,加10滴溴甲酚绿-甲基红指示液,同样用硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色)。计算公式为: 式中: m:无水碳酸钠的质量,g; V 1 :滴定时所用的硫酸的体积,mL; V 2 :空白滴定时所用的硫酸的体积,mL; M:无水硫酸钠的相对分子质量,g/mol,[M(1/2Na 2CO 3 )=52.994)]。 测定氨氮时,氨氮含量的计算: 式中: 氨氮:氨氮含量,mg/L; V 1 :滴定水样时所用的硫酸的体积,mL; V 2 :空白滴定时所用的硫酸的体积,mL; M:硫酸溶液的浓度,mol/L; V:水样的体积,mL。 2、重铬酸钾(K 2Cr 2 O 7 )溶液的配制 1000mL浓度c(1/6K 2Cr 2 O 7 )=0.2500mol/L,即c(K 2 Cr 2 O 7 )=0.0417mol/L的重铬酸钾溶液的配 制: 称取12.258g于120℃下干燥2h的重铬酸钾溶于水中,并移入容量瓶中,定容至1000mL,摇匀,备用。 3、硫酸亚铁铵标准溶液的配制:
