磷酸氢化六水合钴的晶体合成及结构表征

磷酸氢化六水合钴的晶体合成及结构表征*
刘海兴
(潍坊学院,山东潍坊261061)
摘要:通过水热合成法制得了配合物磷酸氢化六水合钴[Co(H2O)6]#H PO4#H2O,用X-射线单晶衍射方法对其进行了晶体结构解析,结果表明,该化合物为斜方晶系,晶胞为Pmn2,晶胞参数:a= 6.9412(8)!,b= 6.1490(7)!,c=11.2321(12)!,B=90.00b,V=479.40(9)!3,Z=2,Mr= 281.02,Dc= 1.947g/cm3,T=298(2)K,F(000)=290,L(M o K A)=1.997mm-1,R=0.0257和X R=0.0719,通过分子间氢键作用形成了稳定的分子结构。
关键词:磷酸氢化六水合钴;合成;晶体结构;表征
中图分类号:O641文献标识码:A文章编号:1671-4288(2009)06-0087-02
金属离子的水合与水解形态及其过程直接影响其活性和可迁移性[1],从微观角度研究重金属离子的水合与水解形态有助于认识其迁移、转化、生物可利用性和环境毒性等[2]。钴的配合物有一定的抗癌作用。本文采用水热合成法制得了配合物磷酸氢化六水合钴晶体,并对其结构进行了表征。
1实验部分
1.1试剂与仪器
2-乙酰基吡嗪,分析纯,百灵威化学试剂公司; Co Cl2,分析纯,上海化学试剂公司;其它试剂均为分析纯。Bruker SM ART CCD单晶衍射仪,德国布鲁克公司。
1.2磷酸氢化六水合钴的合成
混合物(0.04g CoCl2+0.04g2-乙酰基吡嗪+0.04g NaH2PO4),用20mL20%甲醇溶解,170 e水浴下反应10h,溶液冷却到室温并且过滤后,静置数天得红色棱状晶体。
1.3晶体结构的测定
选取大小为0.19mm@0.13mm@0.10m m 的单晶,在298(2)K下,在Br uker CCD Area De-tector X-射线单晶衍射仪上,用石墨单色化的M o K A辐射(0.07173nm)为光源,以X-2H扫描方式,在3.31b[H[25.03b范围内收集2091衍射数据,其中918个独立衍射点(R int=0.0209)用于结构分析和修正。晶体结构用SH ELXS-97程序[3]由直接法解出并进行修正。
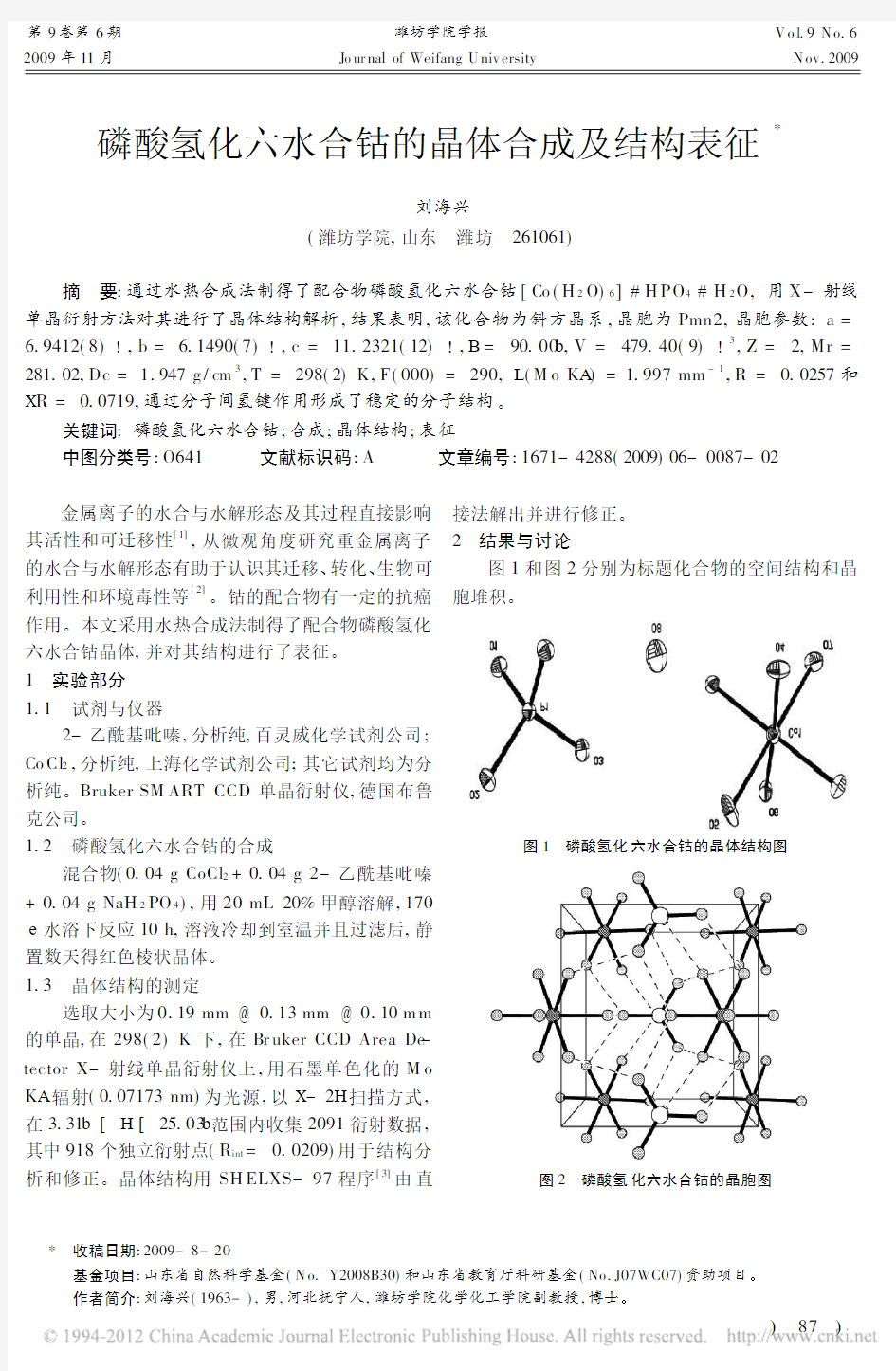
2结果与讨论
图1和图2分别为标题化合物的空间结构和晶
胞堆积。
图1磷酸氢化
六水合钴的晶体结构图
图2磷酸氢化六水合钴的晶胞图
)
87
)
第9卷第6期潍坊学院学报V o l.9N o.6 2009年11月Jo ur nal of Weifang U niv ersity N ov.2009
*收稿日期:2009-8-20
基金项目:山东省自然科学基金(N o.Y2008B30)和山东省教育厅科研基金(No.J07WC07)资助项目。
作者简介:刘海兴(1963-),男,河北抚宁人,潍坊学院化学化工学院副教授,博士。
表1标题化合物的部分键长
键名键长/!
Co(1)-O(4) 2.063(3)
Co(1)-O(6) 2.089(2)
Co(1)-O(5) 2.132(4)
Co(1)-O(7) 2.144(4)
P(1)-O(1) 1.536(2)
P(1)-O(3) 1.538(4)
P(1)-O(2) 1.546(3)
O(3)-H(3)0.8200
O(4)-H(4C)0.8500
O(5)-H(5)0.8500
O(6)-H(6C)0.8500
O(7)-H(7C)0.8501
O(8)-H(8C)0.8500表2标题化合物的部分键角
键角名称键角(b)
O(4)-Co(1)-O(6)177.19(12) O(4)-Co(1)-O(5)89.78(12) O(6)-Co(1)-O(5)88.85(11) O(4)-Co(1)-O(7)89.53(11) O(6)-Co(1)-O(7)91.81(10) O(5)-Co(1)-O(7)179.03(19) O(1)-P(1)-O(3)109.83(12) Co(1)-O(4)-H(4C)128.2
Co(1)-O(5)-H(5)124.7
Co(1)-O(6)-H(6D)116.5
Co(1)-O(7)-H(7C)131.9
主要键长和键角数据列于表1和表2。Co-O 键长范围是2.063~ 2.144!。较大的Co(1)-O (7)键长是2.144(4)!。O-Co-O键角范围是88.85~179.03b。较大的O(5)-Co(1)-O(7)键角是179.03(19)b。在该配合物中,中心离子Co处于六配位的八面体构型中,配位原子来自于水分子的6个O原子。H PO4-没有配位,但作为抗衡离子填充在空隙中,平衡电荷。配合物的晶格水分子、配位水分子及没有参加配位的H PO4-都参与了氢键的形成。依靠分子间氢键作用形成了稳定的分子结构。在晶体制备过程中,有机配体加的较少,虽然没有配位,但可能起到位阻等作用有利于晶体的形成。
)))))))))))))))))))))
参考文献:
[1]P retor ius P J,Linder P W.T he adso rptio n char acteristics of-manganese dio xide:a co llect ion o f diffuse double lay er co nstants for the adsor ption of H+,Cu2+,Ni2+,Zn2+,Cd2+and P b2+[J].Appl Geo chem,2001,16:1067-1082.
[2]Zhu M Q,Pan G.Q uantum chemical studies of mo no nuclear zinc species of hydratio n and hydr olysis[J].J Phys Chem A,2005,109:7648-7652.
[3]Scheldr ick GM.SHEL XS-97and SH EL XL-97[M].Germany:U niver sity o f Got tingen,1997.
Synthesis and Crystal Structure of Phosohate Hydride
Six Hydrated Cobalt
LIU Hai-xing
(Weifang University,Weifang261061,C hina)
Abstract:Pho sohate hydride six hydrated cobalt is prepared by hy dro thermal m ethod.T he crystal struc-ture of phosohate hydride six hy drated cobalt has been determ ined by X-r ay sing le cry stal diffraction. The result sho w s it is o rtho rhombic,Pmn2,a= 6.9412(8)!,b= 6.1490(7)!,c=11.2321(12)!,B =90b,V=479.40(9)!3,Z=2,Mr=281.02,Dc= 1.947g/cm3,T=298(2)K,F(000)=290,L (M o K A)= 1.997m m-1,R=0.0257and X R=0.0719.T he m olecular str ucture and packing ar e stab-i lized by the interm olecular hydrog en-bond interaction.
Keywords:phosohate hydride six hy drated cobalt,synthesis,crystal structure,characterization
(责任编辑:梁足培) )
88
)
潍坊学院学报2009年11月
8-取代喹哪啶的合成与晶体结构5页word文档
8-取代喹哪啶的合成与晶体结构 Synthesis and Crystal structure of 8-Substitued Quinaldine Wu Tian-Quan, Wang Jian-Hua, Shen Fang and Hu Ai-Xi * (1 College of Chemistry and Chemical Engineering, Hunan Univ,410082 Changsha, China;2 Department of biology technology&environment science, ChangSha College, changsha, 410003) Abstract: Five quinaldine derivatives were synthesized through the reaction of 2-substituted aniline and crotonaldehyde. We were investigated the effect of conditions on reaction. Their structure confirmed by 1HNMR and MS. Crystal structure of Ⅰa and Ⅰb have been determined by X-ray diffraction, The compound Ⅰa crystal belongs to orthorhombic system with space group Pca21 and cell parameters: a = 1.27961(9) nm, b = 0.50660(4)nm, c = 1.31181(9) nm, Z = 4,V = 850.38(11) nm3, Dx = 1.387 g/cm3, F(000)= 368, R1 = 0.0288, ωR2 = 0.0731,S = 1.01;The compound Ⅰb crystal belongs to monoclinic system with space group P21/c and cell parameters: a = 0.50440(17) nm,b = 13.467(4)nm, c = 13.391(4)nm, β = 97.678(4)°;Z = 4,V = 901.4(5) nm3, Dx = 1.636g/cm3,F(000) = 440, R1 = 0.0711, ωR2 = 0.1951,S = 1.09.The yields of 8-substituted quinaldine are higher than that of literature by using appropriate slovent and additives.
8-取代喹哪啶的合成与晶体结构
龙源期刊网 https://www.360docs.net/doc/d312432951.html, 8-取代喹哪啶的合成与晶体结构 作者:吴天泉王健华沈芳胡艾希 来源:《湖南大学学报·自然科学版》2010年第01期 摘要: 2-取代苯胺与巴豆醛反应合成了5种8-取代喹哪啶。讨论了反应因素对反应的影响,得到了较好的结果。8-取代喹哪啶的结构经1HNMR和MS分析确证,并用单晶X-射线衍射测 定了化合物Ⅰa和Ⅰb的晶体结构。化合物Ⅰa晶体属正交晶系,空间群为Pca21,晶胞参数为:a = 1.27961(9) nm, b = 0.50660(4) nm, c = 1.31181(9) nm, Z = 4,V = 850.38(11) nm3, Dx = 1.387g/cm3, F(000)= 368, R1 = 0.0288, ωR2 = 0.0731,S = 1.01;化合物Ⅰb晶体属单斜晶系,空间群为P21/c晶 胞参数为:a = 0.50440(17) nm, b = 1.3467(4) nm, c = 1.3391(4) nm, β = 97.678(4)°;Z = 4,V = 901.4(5) nm3, Dx = 1.636g/cm3,F(000)= 440, R1 = 0.0711, ωR2 = 0.1951,S = 1.09。选择合适溶剂和添加剂,反应收率较文献值有较大提高。 关键词 :8-取代喹哪啶;合成;晶体结构 中图分类号:TQ 253. 23文献标识码:A Synthesis and Crystal structure of 8-Substitued Quinaldine Wu Tian-Quan, Wang Jian-Hua, Shen Fang and Hu Ai-Xi * (1 College of Chemistry and Chemical Engineering, Hunan Univ,410082 Changsha, China;2 Department of biology technology&environment science, ChangSha College, changsha, 410003) Abstract: Five quinaldine derivatives were synthesized through the reaction of 2-substituted aniline and crotonaldehyde. We were investigated the effect of conditions on reaction. Their structure confirmed by 1HNMR and MS. Crystal structure of Ⅰa and Ⅰb have been determined by X-ray diffraction, The compound Ⅰa crystal belongs to orthorhombic system with space group Pca21 and cell parameters: a = 1.27961(9) nm, b = 0.50660(4)nm, c = 1.31181(9) nm, Z = 4,V = 850.38(11) nm3, Dx = 1.387 g/cm3, F(000)= 368, R1 = 0.0288, ωR2 = 0.0731,S = 1.01;The compound Ⅰb crystal belongs to monoclinic system with space group P21/c and cell parameters: a = 0.50440(17) nm,b = 13.467(4)nm, c = 13.391(4)nm, β = 97.678(4)°;Z = 4,V = 901.4(5) nm3, Dx = 1.636g/cm3,F(000) = 440, R1 = 0.0711, ωR2 = 0.1951,S = 1.09.The yields of 8-substituted quinaldine are higher than that of literature by using appropriate slovent and additives. Key words: 8-substitued quinaldine, synthesis, crystal structure 8-取代喹哪啶是一类重要的精细化工中间体[1~2],Dehnert等[3]以8-氨基喹哪啶为原料合成了颜料C.I P.Y138;Bray等[4]以8-卤代喹哪啶为原料合成了治疗疟疾的伯喹及氯喹类衍生
镁铝水滑石的合成组成分析及其晶体结构表征市场应用2
镁铝水滑石的合成、组成分析及其晶体 结构表征、市场应用 一、实验目的 1.本实验采用共沉淀法制备镁铝水滑石; 2.利用EDTA络合滴定法测定镁铝水滑石样品中Mg2+和Al3+的含 量; 3.热分析法确定镁铝水滑石样品中的结构水含量; 4.并通过红外、X粉末衍射表征晶体结构。 二、实验原理 1、合成材料 水滑石是一种层柱状双金属氢氧化物,是一类近年来发展迅速的阴离子型粘土因为具有特殊的结构和物理化学性质,如带电性质阴离子可交换性吸附性能催化性能等,其在催化剂催化剂载体污水处理剂医药医药载体等众多领域具有广泛的应用典型的水滑石Mg6Al2(OH)16CO3 4H2O是一种天然存在的矿物,天然存在的水滑石大都是镁铝水滑石,且其层间阴离子主要局限为CO32-但天然镁铝水滑石在世界范围内很有限,因而人工合成镁铝水滑石的研究和应用引起了人们的高度重视和关注 层状双金属氢氧化物(Layered double hydroxides,简称LDHs)是一类阴离子型粘土,又称类水滑石组成通式为:[M(II)1-xM(III)x(OH)2]x+Ax/nn-mH2O,M(II):二价金属离子,M(III):
三价金属离子,An-:阴离子,x=M(III)/[M(II)+ M(III)],0.2≤x≤0.33。 本实验采用共沉淀法制备镁铝水滑石;利用EDTA络合滴定法测定镁铝水滑石样品中Mg2+和Al3+的含量;热分析法确定镁铝水滑石样品中的结构水含量;并通过红外、X粉末衍射表征晶体结构。 2、共沉淀法 共沉淀法是制备水滑石的基本方法, 即以可溶性铝盐和镁盐与沉淀剂反应生成沉淀物,经过滤、洗涤、干燥后制得水滑石。根据投料方式不同可分为单滴法和双滴法。根据沉淀方式不同衍生出低过饱和沉淀法和高过饱和沉淀法。共沉淀法合成温度低,过程简单,制得的水滑石具有较高的均匀性、颗粒尺寸分布较窄且具有一定形貌。但由于反应各组分的沉淀速度和沉淀平衡浓度积不可避免地存在着差异,所以导致产品组成的局部不均匀性,而且沉淀物还需反复洗涤过滤, 才能除去混入的杂质离子。研究发现,共沉淀工艺条件与水滑石晶体的形貌、组成和粒径密切相关。老化温度过低, 晶体的形成
几种常见晶体结构分析
几种常见晶体结构分析文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话: E-mail : 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该 单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为1 4,面上 的微粒属于该单元中所占的份额为1 2,中心位置上(嚷里边)的微粒才完 全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。每个Na +周围与其最近且距离相等的Na +有12个。见图1。 图1 图2 NaCl
晶胞中平均Cl-个数:8×1 8 + 6× 1 2 = 4;晶胞中平均Na+个数:1 + 12×1 4 = 4 因此NaCl的一个晶胞中含有4个NaCl(4个Na+和4个Cl-)。 2.氯化铯晶体中每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,与一个Cs+距离最近且相等的Cs+有6个。 晶胞中平均Cs+个数:1;晶胞中平均Cl-个数:8×1 8 = 1。 因此CsCl的一个晶胞中含有1个CsCl(1个Cs+和1个Cl-)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4个C原子紧邻,因而整个晶体中无单 个分子存在。由共价键构成的最小环结构中有6个碳原 子,不在同一个平面上,每个C原子被12个六元环共用,每C—C键共6 个环,因此六元环中的平均C原子数为6× 1 12 = 1 2 ,平均C—C键数为 6×1 6 = 1。 C原子数: C—C键键数= 1:2; C原子数: 六元环数= 1:2。 2.二氧化硅晶体结构与金刚石相似,C被Si代替,C与C之间插 氧,即为SiO 2晶体,则SiO 2 晶体中最小环为12环(6个Si,6个O), 图3 CsCl 晶 图4 金刚石晶
无机材料科学基础___第二章晶体结构
第 2 章结晶结构 一、名词解释 1.晶体:晶体是内部质点在三维空间内周期性重复排列,具有格子构造的固体 2.空间点阵与晶胞: 空间点阵是几何点在三维空间内周期性的重复排列 晶胞:反应晶体周期性和对称性的最小单元 3.配位数与配位多面体: 化合物中中心原子周围的配位原子个数 成配位关系的原子或离子连线所构成的几何多面体 4.离子极化: 在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象5.同质多晶与类质同晶: 同一物质在不同的热力学条件下具有不同的晶体结构 化学成分相类似物质的在相同的热力学条件下具有相同的晶体结构 6.正尖晶石与反尖晶石: 正尖晶石是指2价阳离子全部填充于四面体空隙中,3价阳离子全部填充于八面体空隙中。 反尖晶石是指2价阳离子全部填充于八面体空隙中,3价阳离子一半填充于八面体空隙中,一半填充于四面体空隙。 二、填空与选择 1.晶体的基本性质有五种:对称性,异相性,均一性,自限性和稳定性(最小内能性)。 2.空间点阵是由 C 在空间作有规律的重复排列。( A 原子 B离子 C几何点 D分子)3.在等大球体的最紧密堆积中有面心立方密堆积和六方密堆积二种排列方式,前者的堆积方式是以(111)面进行堆积,后者的堆积方式是以(001)面进行堆积。 4.如晶体按立方紧密堆积,单位晶胞中原子的个数为 4 ,八面体空隙数为 4 ,四面体空隙数为 8 ;如按六方紧密堆积,单位晶胞中原子的个数为 6 ,八面体空隙数为 6 ,四面体空隙数为 12 ;如按体心立方近似密堆积,单位晶胞中原子的个数为 2 , 八面体空隙数为 12 ,四面体空隙数为 6 。 5.等径球体最紧密堆积的空隙有两种:四面体空隙和八面体空隙。一个球的周围有 8个四面体空隙、 6 个八面体空隙;n个等径球体做最紧密堆积时可形成 2n 个四面体空隙、 n 个八面体空隙。不等径球体进行堆积时,大球做最紧密堆积或近似密堆积,小球填充于空隙中。
水合2_苯甲酰基苯甲酸的合成及其晶体结构
第28卷第4期2006年7月 南 京 工 业 大 学 学 报 JOURNAL OF NANJ I N G UN I V ERSI TY OF TECHNOLOGY Vol .28No .4 July 2006 水合22苯甲酰基苯甲酸的合成及其晶体结构 刘 山1 ,曹展梅 1,2 ,王丹丹1,王克乐1,朱红军 1 (1.南京工业大学理学院,江苏南京210009;2.扬州教育学院生化系,江苏扬州225002) 摘 要:水合2苯甲酰基苯甲酸的晶体结构中一个不对称单元包含1分子2苯甲酰基苯甲酸和1分子水,分子式为C 14H 10O 3(H 2O )。具体测定结果如下:该晶体属于三斜晶系,P 21空间群,a =017751(2)n m,b =018377(2) n m,c =110037(2)n m,α=75157(3)°,β=83105(3)°,γ=86108(3)°,D c =11296g/c m 3 ,Z =2,F (000)=256,μ=01095mm -1 ,最终偏差因子分别为R =010545,wR =011460。X 射线衍射分析表明,分子之间通过相邻分子间形 成的O —H …O 氢键相连。水分子中的氧原子由于分子间的氢键作用,稳定性增加。关键词:2苯甲酰基苯甲酸;水合;合成;晶体结构3 中图分类号:O621 文献标识码:A 文章编号:1671-7643(2006)04-0057-04 22苯甲酰基苯甲酸是一类具有特殊结构单元 (延展性格子)的化合物的重要合成原料[1-4],同时 也是一些导电材料的重要合成原料[5-7] 。笔者将邻苯二甲酸酐与苯在无水氯化铝的作用下反应得到了 22苯甲酰基苯甲酸[8] ,并且得到了它的水合物的单晶(代码CCDC 273728)。然后用X 2射线衍射法对单晶结构进行了测定,测定结果为:其单晶结构是由1分子22苯甲酰基苯甲酸和1分子水构成,分子之间通过22苯甲酰基苯甲酸与水分子形成的分子间氢键(O —H …O )相连。水分子中的氧原子由于分 子间的氢键作用,稳定性增加。有文献报道[9] 该晶体属于三斜晶系,PT 空间群,而本实验中X 2射线衍射法测定结果表明该晶体属于三斜晶系,P 21空间群。 1 实验部分 1.1 仪器和药品 Ele mentar Vari o El Ⅲ型元素分析仪,Nonius CAD4型X 射线衍射仪; 邻苯二甲酸酐(AR ),K OH (AR ),A l Cl 3(AR ), 浓HCl (AR ),苯(AR )。 1.2 水合2苯甲酰基苯甲酸(Ⅰ)的合成及其单晶培养 在250mL 四口圆底烧瓶中加入邻苯二甲酸酐 910g 、无水A l Cl 3粉末15g 、苯150mL,在65~70℃ 范围加热搅拌3h 。然后将混合物倒入150mL 稀盐 酸溶液(浓盐酸与水体积比为1∶14)中。通过蒸汽蒸馏除去过量的苯,将粗产物溶于稀K OH 溶液中。过滤除去少量不溶杂质,再用盐酸使产物沉淀析出。最后过滤、干燥,收集白色沉淀,即为(Ⅰ)的粗产物。 将产物溶于水,静置3d 后,溶液中出现白色针状沉淀。将该沉淀溶于苯溶液中,置于室温下缓慢挥发,得到(Ⅰ)的单晶,合成路线见图1。水合2苯甲酰基苯甲酸C 14H 10O 3(H 2O )元素分析结果,计算值(质量分数):C,68185%;H,4195%;实验值(质量分数):C,68179%;H,4197%。 图1 化合物(Ⅰ)的合成路线 Fig .1 Synthesis r outine for compound (Ⅰ) 1.3 晶体结构测定 取约0140mm ×0130mm ×0120mm 大小的单晶放入毛细管中。使用Enraft Nonius CAD4型X 射 线衍射仪(Mo 靶,K α:λ=711073×10-3 n m )进行晶胞单元测定和数据收集。收集数据的条件为293 3收稿日期:2005-11-29 作者简介:刘 山(1980-),男,江苏江都人,硕士生,主要研究方向为精细有机合成; 朱红军(联系人),教授,E 2mail:zhuhj@njut .edu .cn
常见的金属晶体结构
第二章作业 2-1 常见的金属晶体结构有哪几种它们的原子排列和晶格常数有什么特点 V、Mg、Zn 各属何种结构答:常见晶体结构有 3 种:⑴体心立方:-Fe、Cr、V ⑵面心立方:-Fe、Al、Cu、Ni ⑶密排六方:Mg、Zn -Fe、-Fe、Al、Cu、Ni、Cr、 2---7 为何单晶体具有各向异性,而多晶体在一般情况下不显示出各向异性答:因为单晶体内各个方向上原子排列密度不同,造成原子间结合力不同,因而表现出各向异性;而多晶体是由很多个单晶体所组成,它在各个方向上的力相互抵消平衡,因而表现各向同性。第三章作业3-2 如果其它条件相同,试比较在下列铸造条件下,所得铸件晶粒的大小;⑴金属模浇注与砂模浇注;⑵高温浇注与低温浇注;⑶铸成薄壁件与铸成厚壁件;⑷浇注时采用振动与不采用振动;⑸厚大铸件的表面部分与中心部分。答:晶粒大小:⑴金属模浇注的晶粒小⑵低温浇注的晶粒小⑶铸成薄壁件的晶粒小⑷采用振动的晶粒小⑸厚大铸件表面部分的晶粒小第四章作业 4-4 在常温下为什么细晶粒金属强度高,且塑性、韧性也好试用多晶体塑性变形的特点予以解释。答:晶粒细小而均匀,不仅常温下强度较高,而且塑性和韧性也较好,即强韧性好。原因是:(1)强度高:Hall-Petch 公式。晶界越多,越难滑移。(2)塑性好:晶粒越多,变形均匀而分散,减少应力集中。(3)韧性好:晶粒越细,晶界越曲折,裂纹越不易传播。 4-6 生产中加工长的精密细杠(或轴)时,常在半精加工后,将将丝杠吊挂起来并用木锤沿全长轻击几遍在吊挂 7~15 天,然后再精加工。试解释这样做的目的及其原因答:这叫时效处理一般是在工件热处理之后进行原因用木锤轻击是为了尽快消除工件内部应力减少成品形变应力吊起来,是细长工件的一种存放形式吊个7 天,让工件释放应力的时间,轴越粗放的时间越长。 4-8 钨在1000℃变形加工,锡在室温下变形加工,请说明它们是热加工还是冷加工(钨熔点是3410℃,锡熔点是232℃)答:W、Sn 的最低再结晶温度分别为: TR(W) =(~×(3410+273)-273 =(1200~1568)(℃)>1000℃ TR(Sn) =(~×(232+273)-273 =(-71~-20)(℃) <25℃ 所以 W 在1000℃时为冷加工,Sn 在室温下为热加工 4-9 用下列三种方法制造齿轮,哪一种比较理想为什么(1)用厚钢板切出圆饼,再加工成齿轮;(2)由粗钢棒切下圆饼,再加工成齿轮;(3)由圆棒锻成圆饼,再加工成齿轮。答:齿轮的材料、加工与加工工艺有一定的原则,同时也要根据实际情况具体而定,总的原则是满足使用要求;加工便当;性价比最佳。对齿轮而言,要看是干什么用的齿轮,对于精度要求不高的,使用频率不高,强度也没什么要求的,方法 1、2 都可以,用方法 3 反倒是画蛇添足了。对于精密传动齿轮和高速运转齿轮及对强度和可靠性要求高的齿轮,方法 3 就是合理的。经过锻造的齿坯,金属内部晶粒更加细化,内应力均匀,材料的杂质更少,相对材料的强度也有所提高,经过锻造的毛坯加工的齿轮精度稳定,强度更好。 4-10 用一冷拔钢丝绳吊装一大型工件入炉,并随工件一起加热到1000℃,保温后再次吊装工件时钢丝绳发生断裂,试分析原因答:由于冷拔钢丝在生产过程中受到挤压作用产生了加工硬化使钢丝本身具有一定的强度和硬度,那么再吊重物时才有足够的强度,当将钢丝绳和工件放置在1000℃炉内进行加热和保温后,等于对钢丝绳进行了回复和再结晶处理,所以使钢丝绳的性能大大下降,所以再吊重物时发生断裂。 4-11 在室温下对铅板进行弯折,越弯越硬,而稍隔一段时间再行弯折,铅板又像最初一样柔软这是什么原因答:铅板在室温下的加工属于热加工,加工硬化的同时伴随回复和再结晶过程。越弯越硬是由于位错大量增加而引起的加工硬化造成,而过一段时间又会变软是因为室温对于铅已经是再结晶温度以上,所以伴随着回复和再结晶过程,等轴的没有变形晶粒取代了变形晶粒,硬度和塑性又恢复到了未变形之前。第五章作业 5-3 一次渗碳体、二次渗碳体、三次渗碳体、共晶渗碳体、共析渗碳体异同答:一次渗碳体:由液相中直接析出来的渗碳体称为一次渗碳体。二次渗碳体:从 A 中析出的渗碳体称为二次渗碳体。三次渗碳体:从 F 中析出的渗碳体称为三次渗碳体共晶渗碳体:经共晶反应生成的渗碳体即莱氏体中的渗碳体称为共晶渗碳体共析渗碳体:经共析反应生成的渗碳体即珠光体中的渗
第二章材料中的晶体结构
第二章材料中的晶体结构 基本要求:理解离子晶体结构、共价晶体结构。掌握金属的晶体结构和金属的相结构,熟练掌握晶体的空间点阵和晶向指数和晶面指数表达方法。 重点:空间点阵及有关概念,晶向、晶面指数的标定,典型金属的晶体结构。难点:六方晶系布拉菲指数标定,原子的堆垛方式。 §2.1 晶体与非晶体 1.晶体的定义:物质的质点(分子、原子或离子)在三维空间作有规律的周期性重复排列所形成的物质叫晶体。 2. 非晶体:非晶体在整体上是无序的;近程有序。 3. 晶体的特征 周期性 有固定的凝固点和熔点 各向异性 4.晶体与非晶体的区别 a.根本区别:质点是否在三维空间作有规则的周期性重复排列 b.晶体熔化时具有固定的熔点,而非晶体无明显熔点,只存在一个软化温度范围 c.晶体具有各向异性,非晶体呈各向同性(多晶体也呈各向同性,称“伪各向同性”) 5.晶体与非晶体的相互转化 思考题: 常见的金属基本上都是晶体,但为什么不显示各向同性? §2.2 晶体学基础 §2.2.1 空间点阵和晶胞 1.基本概念 阵点、空间点阵 晶格 晶胞:能保持点阵特征的最基本单元
2.晶胞的选取原则: (1)晶胞几何形状能够充分反映空间点阵的对称性; (2)平行六面体内相等的棱和角的数目最多; (3)当棱间呈直角时,直角数目应最多; (4)满足上述条件,晶胞体积应最小。 3. 描述晶胞的六参数 §2.2.2 晶系和布拉菲点阵 1.晶系 2. 十四种布拉菲点阵 晶体结构和空间点阵的区别 §2.2.3 晶面指数和晶向指数 晶向:空间点阵中各阵点列的方向。 晶面:通过空间点阵中任意一组阵点的平面。 国际上通用米勒指数标定晶向和晶面。 1.晶向指数的标定 (1)建立以晶轴a,b,c为坐标轴的坐标系,各轴上的坐标长度单位分别是晶胞边
常见典型晶体晶胞结构.doc
典型晶体晶胞结构1.原子晶体 (金刚石 ) 2.分子晶体
3.离子晶体 + Na - Cl
4.金属晶体 堆积模型简单立方钾型镁型铜型典型代表Po Na K Fe Mg Zn Ti Cu Ag Au 配位数 6 8 12 12 晶胞 5.混合型晶体——石墨 1.元素是Cu 的一种氯化物晶体的晶胞结构如图 13 所示,该氯化物的化学 式,它可与浓盐酸发生非氧化还原反应,生成配合物H n WCl 3,反应的化 学方程式为。 2.( 2011 山东高考)CaO 与NaCl 的晶胞同为面心立方结构,已知CaO 晶体密度为ag·cm-3,N A表示阿伏加德罗常数,则CaO 晶胞体积为cm3。 2.( 2011 新课标全国)六方氮化硼BN 在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚 石相当,晶苞边长为361.5pm ,立方氮化硼晶胞中含有______各氮原子、 ________各硼原子,立方氮化硼的密度是_______g ·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为N A)。
解析:描述晶体结构的基本单元叫做晶胞,金刚石晶胞是立方体,其中8 个顶点有8 个碳原子, 6 个面各有 6 个碳 原子,立方体内部还有 4 个碳原子,如图所示。所以金刚石的一个晶胞中含有的碳原子数= 8×1/8+6 ×1/2+4=8 ,因此立方氮化硼晶胞中应该含有 4 个 N 和 4 个 B 原子。由于立方氮化硼的一个晶胞中含有 4 个 4 25g 是,立方体的体积是(361.5cm)3,因此立方氮化硼的密度是 N 和 4 个 B 原子,其质量是 1023 6.02 g·cm-3。 3.( 4)元素金( Au )处于周期表中的第六周期,与Cu 同族, Au 原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu 原子处于面心, Au 原子处于顶点位置,则该合金中Cu 原子与 Au 原子数量之比为 _______;该晶体中,原子之间的作用力是________; ( 5)上述晶体具有储氢功能,氢原子可进入到由Cu 原子与 Au 原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为_____。 4.( 2010 山东卷)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心, O2-处于晶胞棱边中心,该化合物化学式为,每个 Ba2+与个 O2-配位。 5.(4) CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但 CaC2晶体中含有的中哑 铃形 C 22 的存在,使晶胞沿一个方向拉长。CaC 2晶体中1个 Ca 2 周围距离最近的 C 22 数目 为。 6.( 09 江苏卷 21 A )③在 1 个 Cu2O 晶胞中(结构如图所示),所包含的Cu 原子数目 为。
第二章 晶体结构
晶体结构分类方法
(B) 2.1 符号中的第一个大写字母表示结构的类型,后面的数字为第个大写字母表示结构的类型后面的数字为顺序号,不同的顺序号表示不同的结构,例如A1是铜型结 结构等。 构,B2是CsCl型结构等,C3是FeS 2
Pearson符号 它所属的布喇菲点阵类型(例如P、I、F、C等),第三个数 等) 字表示单胞中的原子数。 2.2 金属单质的晶体结构 在元素周期表中,共有70多种金属元素。
由于金属键不具有饱和性和方向性,使金属的晶体结构倾向配位数(
将用原子刚性球模型讨论每个单胞所含的原子数以及这些构中的间隙等。 2.2.1 面心立方结构 结构符号是A1,Pearson 符号是c F4。 原子坐标为0 0 0,0 1/2 1/2,1/2 0 1/2和1/2 1/2 0 每个晶胞含4个原子 最紧密排列面是{111},密排方向 是<110>。原子直径是a/2<110>的 长度,即 面心立方结构的晶胞体积为a 3, 晶胞内含4个原子,所以它的致密 度η为4 2a r =423443443 3 33? ??? ????×=×=ππηa r 每个原子有个最近邻原子,它的 配位数(CN )是12。 74 .062 ==πa a
面心立方结构的最密 排面是{111},面心立 方结构是以{111}最密 排面按一定的次序堆 垛起来的。 第一层{111}面上有两个 可堆放的位置:▲和▼位 可堆放的位置▲和▼位 置,在第二层只能放在一 种位置,在面上每个球和 下层3个球相切,也和上 层3个球相切。 第一层为A,第 二放在B 位置, 第三层放在C 位 置,第四层在 置第四层在 放回A位置。 {111}面 按…abcabc… 顺序排列,这 就形成面心立 方结构。
合金的晶体结构与结晶过程
第八节合金的晶体结构与结晶过程 一、基本概念 ●组成合金最基本的、独立的物质称为组元。 ●由两种或两种以上的组元按不同比例配制而成的一系列不同化学成分的所有合金,称为合金系。 ●相是指在一个合金系统中具有相同的物理性能和化学性能,并与该系统的其余部分以界面分开的部分。 ●组织是指用金相观察方法,在金属及其合金内部看到的涉及晶体或晶粒的大小、方向、形状、排列状况等组成关系的构造情况。 二、合金的晶体结构 根据合金中各组元之间的相互作用,合金中的晶体结构可分为固溶体、金属化合物及机械混合物三种类型。 (一)固溶体 ●合金在固态下一种组元的晶格内溶解了另一种原子而形成的晶体相,称为固溶体。 根据溶质原子在溶剂晶格中所占位置的不同,可将固溶体分为置换固溶体和间隙固溶体。 1.置换固溶体 ●溶质原子代替一部分溶剂原子,占据溶剂晶格的部分结点位置时,所形成的晶体相,称为置换固溶体。 按溶质溶解度的不同,置换固溶体又可分为有限固溶体和无限固溶体。 a) 置换固溶体 b) 间隙固溶体 图1-32 固溶体的类型 2.间隙固溶体 ●溶质原子在溶剂晶格中不占据溶剂晶格的结点位置,而是嵌入溶剂晶格的各结点之间的间隙内时,所形成的晶体相,称为间隙固溶体。 无论是置换固溶体,还是间隙固溶体,异类原子的插入都将使固溶体晶格发生畸变,增加位错运动的阻力,使固溶体的强度、硬度提高。这种通过溶入溶质原子形成固溶体,使合
金强度、硬度升高的现象称为固溶强化。固溶强化是强化金属材料的重要途径之一。 a)间隙固溶体 b)置换固溶体(大溶质原子) c)固溶体(小溶质原子) 图1-33 形成固溶体时产生的晶格畸变 (二)金属化合物 ●金属化合物是指合金中各组元之间发生相互作用而形成的具有金属特性的一种新相。 金属化合物具有与其构成组元晶格截然不同的特殊晶格,熔点高,硬而脆。 (三)机械混合物 ●由两相或两相以上组成的多相组织,称为机械混合物。 在机械混合物中各组成相仍保持着它原有晶格的类型和性能,而整个机械混合物的性能则介于各组成相的性能之间,并与各组成相的性能以及相的数量、形状、大小和分布状况等密切相关。 三、合金结晶过程 合金的结晶过程与纯金属一样,也是晶核形成和晶核长大两个过程。同时结晶时也需要一定的过冷度,结晶后形成由多晶体。合金的结晶过程中具有如下特点: (1)纯金属的结晶是在恒温下进行,只有一个结晶温度。而绝大多数合金是在一个温度范围内进行结晶的,一般结晶的开始温度与终止温度是不相同,一般有两个结晶温度。 (2)合金在结晶过程中,在局部范围内相的化学成分(即浓度)有差异,当结晶终止后,整个晶体的平均化学成分与原合金的化学成分相同。 (3)合金结晶后一般有三种情况:第一种情况是形成单相固溶体;第二种情况是形成单相金属化合物或同时结晶出两相机械混合物(如共晶体);第三种情况是结晶开始时形成单相固溶体,剩余液体又同时结晶出两相机械混合物(如共晶体)。 四、合金结晶冷却曲线 合金结晶过程比纯金属复杂得多,但其结晶过程仍可用结晶冷却曲线来描述。一般合金的结晶冷却曲线有以下三种形式:
第二章晶体结构
第二章 晶体结构 2.1 (1)证明:如图所示,六角层内最近邻原子间距为a ,而相邻两层间的最近邻原子间距为: ( )2 1 2 2 4 3 c a d +=, 当a d =时构成理想的密堆六角结构,此时有: ( )2 1 2 2 4 3 c a a +=, 由此解出,() 633.138 2 1==a c (2)解:(2)体心立方每个单胞包含2个基元,一个基元所占的体积为 23 c c a V = , 单位体积内的格点数为. 1 Vc 六角密堆积每个单胞包含6个基元,一个基元所占的体积为 3 2 1 222 23843436/323a a a c a c a a V s = ? ?? ???==???? ? ????= 因为密度不变,所以 s c V V 11=,即:3 3 2 22/a a c = nm a a c s 377.02 /6 1== nm a c s 615.0633.1== 2.2证明: 设简单六角布拉菲格子基矢如图示 :
∧ ∧∧ ∧ =+ = =z c a y a x a a x a a 321, 2 32 , 则其倒格子的三个基矢为 ()( )( ) ∧ ∧ ∧∧= == ?=???? ??-=?=z c b y a a a b y x a a a b ππ ππ ππ 223322233223 2133 211323 211 另知21,b b 的夹角为120度,且 a 34π= =,2313,b b b b ⊥⊥ 故简单六角布拉菲格子的倒格子仍为简单六角,倒格子的晶格常数分别为 a c 34, 2ππ,倒格 子相对于正格子绕c 轴旋转30度,(如图中标出321,,b b b 更清晰) 2.3 体心立方
1-2 常见的晶体结构及其原胞、晶胞
§1-2 常见的晶体结构及其原胞、晶胞 1) 简单晶体的简单立方(simple cubic, sc) 它所构成的晶格为布喇菲格子。例如氧、硫固体。基元为单一原子结构的晶体叫简单晶体。 其特点有: 三个基矢互相垂直(),重复间距相等,为a, 亦称晶格常数。其晶胞=原胞;体积= ;配位数(第一近邻数) =6。(见图1-7) 图1-7简单立方堆积与简单立方结构单元 2) 简单晶体的体心立方( body-centered cubic, bcc ) , 例如,Li,K, Na,Rb,Cs,αFe,Cr,Mo,W,Ta,Ba等。其特点有:晶胞基矢, 并且,其惯用原胞基矢由从一顶点指向另外三个体心点的矢量构成:(见图1-9 b) (1-2) 其体积为;配位数=8;(见图1-8)
图1-8体心立方堆积与体心立方结构单元 图1-9简单立方晶胞(a)与体心立方晶胞、惯用原胞(b) 3) 简单晶体的面心立方( face-centered cubic, fcc ) , 例如,Cu,Ag, Au,Ni,Pd,Pt,Ne, Ar, Xe, Rn, Ca, Sr, Al等。晶胞基矢, 并且每面中心有一格点, 其原胞基矢由从一顶点指向另外三个面心点的矢量构成(见图1-10 b): (1-3)
其体积=;配位数=12。,(见图1-10) 图1-10面心立方结构(晶胞)(a)与面心立方惯用原胞(b) 4) NaCl结构(Sodium Chloride structure),复式面心立方(互为fcc),配位数=6(图1-11 a)。 表1-1 NaCl结构晶体的常数 5) CsCl结构(Cesuim Chloride structure),复式简单立方(互为sc),配位数=8(图1-11 b)。 表1-2 CsCl结构晶体的常数
(完整版)常见晶胞模型
氯化钠晶体 (1)NaCl晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个 NaCl晶胞中每个Cl-等距离且最近的Na+(即Cl-配位数)为6个 (2)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4_个; 占有的Cl-4个。 (3)在该晶体中每个Na+周围与之最接近且距离相等的Na+共有12个; 与每个Na+等距离且最近的Cl-所围成的空间几何构型为正八面体 CsCl晶体(注意:右侧小立方体为CsCl晶胞;左侧为8个晶胞) (1)CsCl晶胞中每个Cs+等距离且最近的Cl-(即Cs+配位数) 为8个 CsCl晶胞中每个Cl-等距离且最近的Cs+(即Cl-配位数) 为8个,这几个Cs+在空间构成的几何构型为正方体。 (2)在每个Cs+周围与它最近的且距离相等的Cs+有6个 这几个Cs+在空间构成的几何构型为正八面体。 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的Cl- 1个。 CaF2晶体 (1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。 (2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个 (3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个; 占有的F-8个。 ZnS晶体: (1)1个ZnS晶胞中,有4个S2-,有4个Zn2+。 (2)Zn2+的配位数为4个,S2-的配位数为 4个。
Si O 金刚石 金刚石晶胞 金刚石晶胞分位置注释 (1)金刚石晶体 a 、每个金刚石晶胞中含有8个碳原子,最小的碳环为6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个C 结合,形成正四面体。键角109°28’ b 、每个碳原子被12个六元环共用,每个共价键被6个六元环共用 c 、12g 金刚石中有2mol 共价键,碳原子与共价键之比为 1:2 (2)Si 晶体 由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。将金刚石晶胞中的C 原子全部换成Si 原子,健长稍长些便可得到晶体硅的晶胞。 (3)某些非金属化合物【SiO 2、SiC (金刚砂)、BN (氮化硼)、Si 3N 4等】 例如SiC 将金刚石晶胞中的一个C 原子周围与之连接的4个C 原子全部换成Si 原子, 键长稍长些便可得到SiC 的晶胞。(其中晶胞的8个顶点和6个面心为Si 原子,4个互不相邻的立方体体心的为C 原子,反之亦可) a 、每个SiC 晶胞中含有 4 个硅原子,含有 4 个碳原子 b 、1mol SiC 晶体中有4 mol Si —C 共价键 (4)SiO 2 晶体:在晶体硅的晶胞中,在每2个Si 之间插入1个O 原子, 便可得到SiO 2晶胞。 a 、每个硅原子都采取sp 3杂化,与它周围的4个氧原子所形成的空间 结构为__正四面体_型,S iO 2晶体中最小的环为 12 元环 b 、每个Si 原子被 12 个十二元环共用,每个O 原子被 6 个 十二元环共用 c 、每个SiO 2晶胞中含有 8 个Si 原子,含有 16 个O 原子 d 、1mol Si O 2晶体中有 4 mol 共价键 (5)晶体硼 已知晶体硼的基本结构单元是由B 原子构成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个B 原子。通过观察图形及推算,可知此结构单元是由__12_个B 原子构成,其中B —B 键间的夹角是__60°__。假设将晶体硼结构单元中每个顶角均削去,余下部分的结构与C 60相同,则C 60由_12_个正五边形和_20个正六边形构成。
第二章晶体结构与晶体中的缺陷
内容提要:通过讨论有代表性的氧化物、化合物和硅酸盐晶体结构, 用以掌握与本专业有关的各种晶体结构类型。介绍了实际晶体中点缺陷分 类;缺陷符号和反应平衡。固熔体分类和各类固熔体、非化学计量化学化 合物的形成条件。简述了刃位错和螺位错。 硅酸盐晶体结构是按晶体中硅氧四面体在空间的排列方式为孤岛状、组群状、链状、层装和架状五类。这五类的[SiO4]四面体中,桥氧的数目也依次由0增加到4, 非桥氧数由4减至0。硅离子是高点价低配位的阳离子。因此在硅酸盐晶体中,[SiO4] 只能以共顶方式相连,而不能以共棱或共面方式相连。表2-1列出硅酸盐晶体结构类型及实例。 表2-1 Array硅酸 盐晶 体的 结构 类型
真实晶体在高于0K的任何温度下,都或多或少地存在着对理想晶体结构的偏离,即存在着结构缺陷。晶体中的结构缺陷有点缺陷、线缺陷、面缺陷和复合缺陷之分,在无机材料中最基本和最重要的是点缺陷。 点缺陷根据产生缺陷的原因分类,可分为下列三类: (1)热缺陷(又称本征缺陷) 热缺陷有弗仑克儿缺陷和肖特基缺陷两种基本形式。 弗仑克儿缺陷是指当晶格热震动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗仑克儿缺陷。 肖特基缺陷是指如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,而在原正常格点上留下空位,这种缺陷称为肖特基缺陷。 (2)杂质缺陷(非本征缺陷) (3)非化学计量化学化合物 为了便于讨论缺陷反应,目前广泛采用克罗格-明克(Kroger-Vink)的点缺陷符号(见表2-2)。 表2-2 Kroger-Vink缺陷符号(以M2+X2-为例)
工程材料习题集参考答案(第二章)汇编
习题集部分参考答案 2金属的晶体结构 思考题 1.晶体和非晶体的主要区别是什么? 答:晶体和非晶体的区别在于内部原子的排列方式。晶体内部的原子(或分子)在三维空间按一定规律作周期性排列,而非晶体内部的原子(或分子)则是杂乱分布的,至多有些局部的短程规律排列。因为排列方式的不同,性能上也有所差异。晶体有固定的熔点,非晶体没有,晶体具有各向异性,而非晶体则是各向同性。 2.何为各向异性? 答:各向异性是指晶体的某些物理性能和力学性能在不同方向上具有不同的数值。 3.为什么单晶体呈各向异性,而多晶体通常呈各向同性? 答:单晶体是原子排列方位完全一致的一个晶粒,由于在不同晶向上原子密度不同,原子间的结合力不同,因而导致在单晶体中的各个方向上性能差异。 对于多晶体中的任意一个晶粒来看,基本满足单晶体的特征,呈现各向异性,但是在多晶体系统中,单一晶粒的各向异性已经被周围其他位向的晶粒所“干扰”或“抵消”,整个多晶系统呈现其各向同性。 4.什么叫晶体缺陷?晶体中可能有哪些晶体缺陷?他们的存在有何实际意义? 答:晶体缺陷是指金属晶体中原子排列的不完整性。常见的晶体缺陷有点缺陷、线缺陷和面缺陷三类,它们都会造成材料的晶格畸变。 点缺陷是指呈点状分布的缺陷,包含有空位、间隙原子和置换原子等,它对材料中的原子扩散、固态相变,以及材料的物理性能(电阻、体积、密度)等都会产生重大影响。过饱和的点缺陷还可以提高材料的强度。 线缺陷是各种类型的位错。对材料的变形、扩散以及相变起着非常大的作用。特别它很好地解释了塑性变形的微观机理,使我们了解到滑移是借助于位错的运动来实现的。当位错密度不高的情况下,位错支持了滑移,材料的塑性很好,但是当位错密度达到了较高的水平时,位错间的相互作用会造成位错的彼此“纠缠”,使滑移运动受阻,这时表现出材料的塑性变形的抗力提高,材料的强度提高。 金属晶体中面缺陷主要有晶界、亚晶界、孪晶界和相界等。比如:晶界处原子的平均能量比晶内高,在高温时,晶粒容易长大。晶界和亚晶界均可提高金属的强度。单位体积中的晶粒数目越多,晶界面积越大,晶格畸变越严重,材料的强度越高,同时材料的塑性也较好(同样的变形量可以分散到更多的晶粒中去进行,说明材料可以承受更大的变形量)。
