离子液体与绿色化学讲解

https://www.360docs.net/doc/dc5397159.html,/cji/2002/045023rc.htm ,Apr. 1, 2002 Vol.4 No.5 P.23
Ionic Liquids in Green Chemistry
Yu Tianxiang, Zheng Qiong
(College of chemistry and Molecular Sciences , Wuhan University Wuhan 430072) Abstract The characteristic of ionic liquids and its application in chemical reaction were reviewed . Ionic liquids as green solvent can be performed widely in the future. Keywords Green Chemistry, Green Solvent, Ionic liquids
绿色化学中的离子液体
余天祥郑穹
(武汉大学化学与分子科学学院武汉 430072)
摘要本文评述了离子液体的一般性质及其在一系列化学反应中的应用,并且展望了它作为绿色溶剂的将来。
关键词绿色化学绿色溶剂离子液体
迄今,绝大多数化学反应都在分子溶剂中进行,如水和多数常见的有机溶剂。近年来一种新的溶剂-离子液体的出现引起了各国学者的关注。该溶剂在室温下是流质(也称为室温离子液),而组成是离子系列的,组成该溶剂至少有两种成份,即可变换的阳离子和阴离子。由于该溶剂可按利用者的需要或具某些特种性质而设计,所以又称之为“设计者溶剂”。离子液体既可作溶剂又可作催化剂,在该液体中进行反应的热力学和动力学与在普通溶剂中有所不同的,一般说来,离子液体对热稳定,不可燃,不挥发,不氧化,不爆炸,低毒性,故用于合成反应中是清洁友好的。已有的报导证明,离子液体增加了反应的活性、选择性及催化剂的稳定性等,更深地探索会发现一些新的不可预见的事物,激发人们聚焦于此的原因还在于人们一直倡导绿色化学和绿色合成。
离子液体的领域已有综述,它包括Welton [1],Wasserscheid 和Keim[2],以及Freemantle[3],特别是长期从事这一领域研究的Seddon等[4]。第一个常温
离子液体[EtNH
3][NO
3
](mp. 12 ℃)于1914年发现,但仅在上世纪七十年后才
有新的进展[5、6]。离子液体包括两大类:一类是简单的盐,由有机阳离子和阴离子组成,有机阳离子通常包括有季铵阳离子、季膦盐阳离子、杂环芳香化合物及天然产物的衍生物等,其中常见的是咪唑盐,如
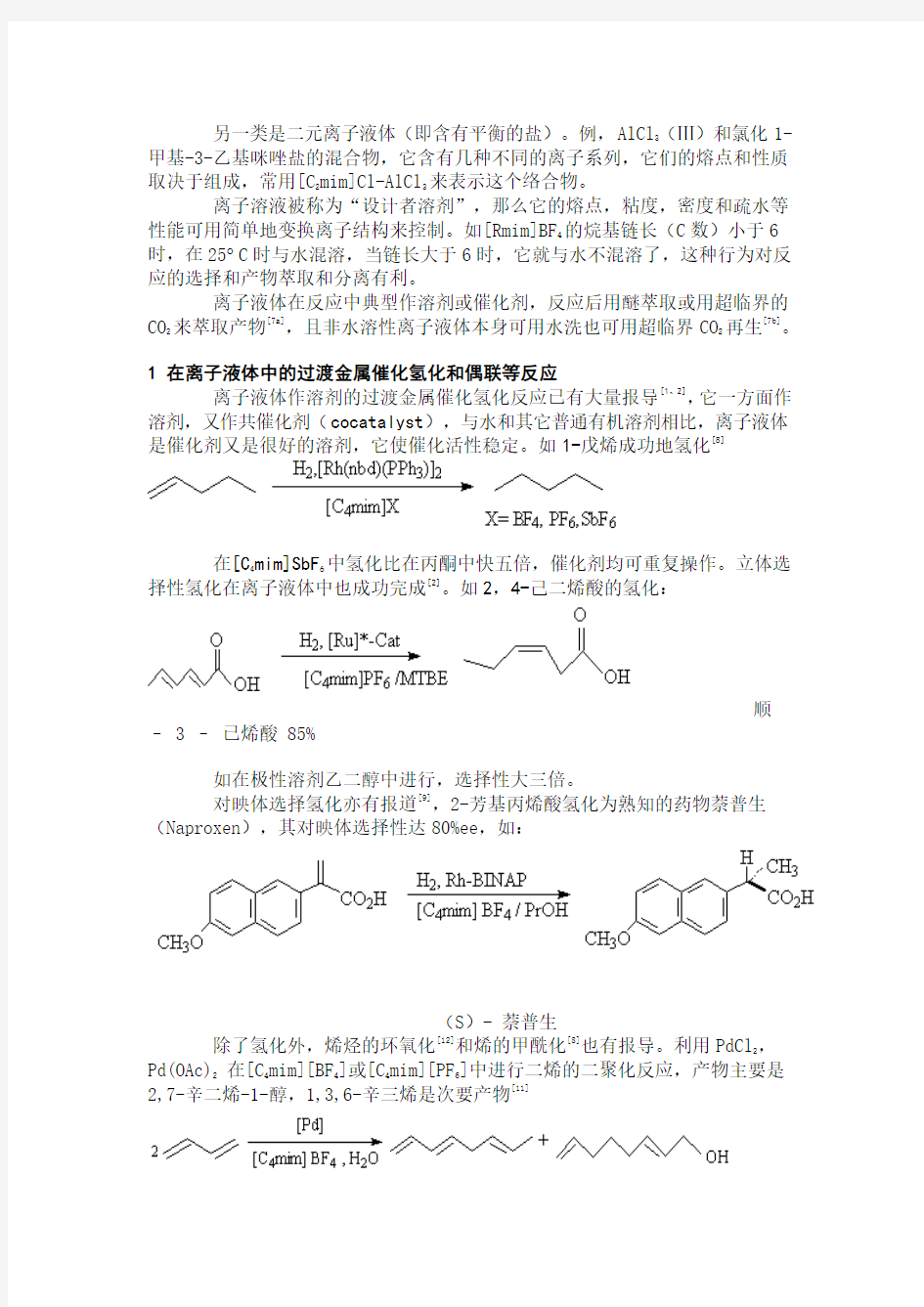
另一类是二元离子液体(即含有平衡的盐)。例,AlCl
3
(Ⅲ)和氯化1-甲基-3-乙基咪唑盐的混合物,它含有几种不同的离子系列,它们的熔点和性质
取决于组成,常用[C
2mim]Cl-AlCl
3
来表示这个络合物。
离子溶液被称为“设计者溶剂”,那么它的熔点,粘度,密度和疏水等性能可用简单地变换离子结构来控制。如[Rmim]BF
4
的烷基链长(C数)小于6时,在25 C时与水混溶,当链长大于6时,它就与水不混溶了,这种行为对反应的选择和产物萃取和分离有利。
离子液体在反应中典型作溶剂或催化剂,反应后用醚萃取或用超临界的
CO
2来萃取产物[7a],且非水溶性离子液体本身可用水洗也可用超临界CO
2
再生[7b]。
1 在离子液体中的过渡金属催化氢化和偶联等反应
离子液体作溶剂的过渡金属催化氢化反应已有大量报导[1、2],它一方面作溶剂,又作共催化剂(cocatalyst),与水和其它普通有机溶剂相比,离子液体是催化剂又是很好的溶剂,它使催化活性稳定。如1-戊烯成功地氢化[8]
在[C
4mim]SbF
6
中氢化比在丙酮中快五倍,催化剂均可重复操作。立体选
择性氢化在离子液体中也成功完成[2]。如2,4-己二烯酸的氢化:
顺– 3 –已烯酸 85%
如在极性溶剂乙二醇中进行,选择性大三倍。
对映体选择氢化亦有报道[9],2-芳基丙烯酸氢化为熟知的药物萘普生(Naproxen),其对映体选择性达80%ee,如:
(S)- 萘普生
除了氢化外,烯烃的环氧化[12]和烯的甲酰化[8]也有报导。利用PdCl
2
,
Pd(OAc)
2在[C
4
mim][BF
4
]或[C
4
mim][PF
6
]中进行二烯的二聚化反应,产物主要是
2,7-辛二烯-1-醇,1,3,6-辛三烯是次要产物[11]
离子液体用于钯催化的Heck反应1996年有所描述[12],溴苯与与丙烯酸丁酯反应得高产率偶联产物反-肉桂酸酯。如反应:
该反应的特点是该离子液体对钯有稳定作用,整个反应中未见钯沉淀出来。钯催化的Suzuki交叉偶联反应是C-C成键反应,也很成功[13]
另外钯催化的烯丙基取代的Trost-Tsuji偶联在离子液体[C
4mim][BF
4
]
中得90%的高产率产物[14],这归于增加了催化活性及底物分子在该离子液体中有较好的溶解度。
2 Friedel-Crafts反应及含氯化铝的离子液体
氯化铝与适量的有机碱在惰性气体中熔融,这个离子液体最好用x(AlCl
3
)
的摩尔分数来描述,一般x(AlCl
3
)<0.5,含过量的Clˉ离子,称为碱性的,
x(AlCl
3)>0.5,含过量的[Al
2
Cl
7
ˉ],称为酸性的,x=0.5称为中性的,如以下含
[C
2
mim]的氯化铝的盐为[2]
经典的Friedel-Crafts反应用路易斯酸所催化,研究发现,许多Friedel-Crafts反应在离子液体中进行反应很顺利[15、16],许多香料分子可高产率地获得,且具选择性,如
99%
89% α位; 2% β位
邓有全等[16]在含HCl的离子液体[C
2mim]AlCl
3
中,用1-十二碳烯对苯的
烷基化反应,得到了较好地产物异构体分配,作者认为HCl的存在,离子液体的超酸性(superacidity)起了作用,二茂铁的酰化也有成功的报导[18]。
含AlCl
3
的离子液体一般见水会分解,故操作一般在无水及惰性气体下进行。
3 亲核取代反应及芳烃取代中的离子液体
脂肪族亲核取代反应利用相转移(PTC)法较好,通常要用到二氯甲烷、甲苯和氯苯作溶剂,由于卤代烃的使用越来越受到限制,离子液体作溶剂及催化亲核取代反应自然受到重视,它一方面能活化阴离子,且离子液体的阳离子部分或许像PTC一样是有效地催化剂,如氯苄与氰化物的反应:
该反应的动力学试验表明有很高的反应速率。[19]
吲哚和萘酚用RX和NaOH反应,可在O上或N上烷基化,在离子液体
[C
4mim][PF
6
]中得到了与在DMF和DMSO中类似的反应速率,萘酚主要是O-烷基
化,吲哚主要是N上烷基化;处理很方便,离子液体可循环再用,克服了使用高沸点的非质子极性溶剂DMF等难从产物中除尽的困难,所以作者认为是清洁的合成方法。[20]
近来,有关其芳香重氮盐被氟取代在离子液体中进行,取得了相当的进展,[21]操作简便,产率几乎定量,离子液体可回收数次。在离子液体中的硝化也是有效地改变经典的硝化方法,克服了传统地要中和反应后强酸性液体的弊病。[3a]
4 在离子液体中的插入反应和Wittig反应
在离子液体[C
4mim][PF
6
]或[C
4
mim][BF
4
]中,卤代烷与硫化物反应,形成
硫叶立德,该反应可将亚甲基转移到芳醛或芳酮中,[4]后者,有好的对映体过量。
Wittig反应是醛或酮与磷叶立德生成烯的反应,该反应用[C
4mim][BF
4
]
作溶剂,产物烯易于与副产物Ph
3
P=O分离,且能有效的回收溶剂,具优良的立体控制。[22]
Y=COMe, CO
2
Me, CN
有机金属试剂与羰基化合物的加成在有机化学中是一重要反应,如烯丙基锡与醛反应生成烯醇的反应,[23]三烷基硼与醛反应,[24]在离子液体中反应良好,且离子液本身可再生循环利用。
5 Diels-Alder反应
环戊二烯和丙烯酸酯的反应在一系列离子液体中反应早有报导。[25]
X=BF
4―,ClO
4
―
CF
3SO
3
―,NO
3
― PF
6
―
实验表明这些反应比在非水溶剂中进行,选择性和反应速率都增加,但
没有在水中那么大,那些对水敏感的底物在离子液体中进行反应,具有优点,如在离子中加入少量的路易斯酸如ZnI
2
,可改善立体选择性[26]
6 在离子液体中的酶催化反应和其它形式的生物转化
最引人注目的是人造甜味剂阿斯巴甜(Aspartame)的酶催化合成[3],产
率91%。
Freemantle[3]表明,像念珠菌(Candida antarctica)和嗜热菌(Thermolysin)等水解酶在离子液体中能有效地催化酰胺、酯和过酸的生成,该工作对药物合成,农药中间体,香料、香精的制造等都很有利。例环己烯由过
辛酸在离子液体[C
4mim][PF
6
]中环氧化的研究,过辛酸是由辛酸在脂肪酶催化下
在离子液体[C
4mim]BF
4
中与水溶液过氧化氢反应得到,收率83%。一种红球菌
(Rodococcus)R312细胞生物催化剂在两相中即离子液体[C
4mim]PF
6
/水中促进
腈转化为酰胺。
同样,利用无水的[C
4mim] PF
6
,丁酸乙酯用正丁醇的转酯化研究效果也很
好,收率81%[3]。
7 其它
离子液体的研究和应用的前景非常广阔,它不仅用于化学合成,精细化工,高聚物如烯的二聚,齐聚,线性烷基苯的合成等方面外,而且在催化,分离技术和蓄电池,太阳能电池的电解质中也有应用[3],例如离子液体可用于核燃料的循环,将废的核燃料溶于加有氧化剂的离子液体中,如1-丁基吡啶硝酸盐中,由于有氧化剂,使燃料金属由不溶变成可溶,因为铀(IV)变成铀(VI),钚(IV)变成钚(VI)。而现有使用的煤油及磷酸三丁酯可由离子液体替代[3]。一特别设计的离子液体,例在咪唑阳离子上,将烷基部分连接一些特殊的官能团[27],或制备一些不同的多胺盐[28]应用于有机反应和萃取分离的研究,如:
这是离子液体新的进展。
Seddon等人[4]完成了在离子液体中一药物(Pravadoline)的全合成,它
包括Friedel-Crafts反应和亲核取代反应两步。第一步反应2-甲吲哚与N-吗啉
-2-氯乙烷在[C
4mim][PF
6
]中反应,产率为95%,
如改用1-丁基-2,3-二甲基咪唑六氟化磷[C
4dmim] [PF
6
]后,产率可达
99%。第二步用含AlCl
3的离子液体在0℃进行,而最好的结果是不用AlCl
3
,用
[C
4mim] [PF
6
]于150℃下反应。第二步无铝盐存在,反应程序简单廉价,且废弃
物大大减少,这显示出“绿色溶剂”强大的生命力。
毋用置疑,离子液体在绿色化学中占有重要的地位,预计在不久将来,离子液体的应用研究会更深入,更广泛,在工业上如化学工业等方面会越来越多地采用离子液体。
REFERENCES
[1] Welton T. Chem . Rev., 1999, 99: 2071.
[2] Wasserscheid P, Keim W. Angew Chem. .Int. Ed. Engl., 2000, 39: 3722.
[3] Freemantle M. (a) Chem . Eng . News, 2000, 78 (May)15: 37-39; (b) Chem . Eng . News, 2001, 79 (Jan)1: 21-25.
[4] Earle M J, Seddon K R. Pure Appl, Chem., 2000, 72 (7): 1391-1398.
[5] Chum H L, Koch V N et al. J. Am. Chem, Soc., 1975, 97: 3264 .
[6] Wilkes JS et al . Inorg . Chem., 1982, 21: 1236.
[7] a) Blanchard L A et al. Nature, 1999, 399: 28; b) Blanchard L A et al. Ind. Egn. Chem. Res., 2001, 40: 287.
[8] Chauvin Y, Mu mann L, Olivier H. Angew. Chem. Int. Engl., 1995, 34: 2698.
[9] Monteiro A L et al. Tetrahedron Asymmetry, 1997, 2: 177-179.
[10] Song C E, Roh E J. Chem. Commun., 2000: 837-838.
[11] Dullins J E L et al. Organometallics, 1998, 17: 815.
[12] Kakfman D E et al. Synlett., 1996: 1091.
[13] Mathews C J, Smith P J, Welton T. Chem. Commun., 2000: 1249-1250.
[14] Bellefon C de et al . J. Mol . Catal., 1999, 145: 121.
[15] Adam C J et al. Chem. Commun., 1998: 2097-2098.
[16] Boon J A et al. J. Org. Chem., 1986, 51: 48.
[17] Kun Qian, Yonquan Deng. J. Mol. Catal. A: Chem., 2001, 171: 81-84.
[18] Surretle J K D, Green L, Singer R D. Chem. Commun., 1996: 2753-2754.
[19] Wheeler C et al . Chem. Commun., 2001: 887.
[20] Earle M J, McCormac P B, Seddon K R. Chem. Commun, 1998: 2245.
[21] Hagiwara R, Ito Y J. Fluorine Chem., 2000, 105: 221.
[22] Boularre V L, Gree R. Chem. Commun., 2000: 2195-2196.
[23] Gordone L M, McClusky A. Chem. Commun., 1999: 1431-1432.
[24] Kanalka G W, Maladi R R. Chem. Commun., 2000: 2191.
[25] Fischer F, Sethi A , Welton T et al. Tetranedron letters, 1999, 40: 793-796.
[26] Earle M J, McCormac P B, Seddon K R. Gree. Chem., 1999, 1:23-25.
[27] Visser A E, Swatloski R P, Reichert W M et al. Chem. Commun., 2001: 135.
[28] Lall S I, Mancheno D, Castro S. Chem. Commun., 2000: 2413.
离子液体的应用前景
离子液体的应用前景 离子液体是指全部由离子组成的液体,如高温下的KCI,KOH呈液体状态,此时它们就是离子液体。在室温或室温附近温度下呈液态的由离子构成的物质,称为室温离子液体、室温熔融盐、有机离子液体等,目前尚无统一的名称,但倾向于简称离子液体。在离子化合物中,阴阳离子之间的作用力为库仑力,其大小与阴阳离子的电荷数量及半径有关,离子半径越大,它们之间的作用力越小,这种离子化合物的熔点就越低。某些离子化合物的阴阳离子体积很大,结构松散,导致它们之间的作用力较低,以至于熔点接近室温。 离子液体的优点 一、离子液体无味、不燃,其蒸汽压极低,因此可用在高真空体系中,同时可减少因挥发而产生的环境污染问题; 二、离子液体对有机和无机物都有良好的溶解性能,可使反应在均相条件下进行,同时可减少设备体积; 三、可操作温度范围宽(-40~300℃),具有良好的热稳定性和化学稳定性,易与其它物质分离,可以循环利用; 四、表现出Lewis、Franklin酸的酸性,且酸强度可调。 上述优点对许多有机化学反应,如聚合反应、烷基化反应、酰基化反应,离子溶液都是良好的溶剂。 离子液体的应用前景 迄今为止,室温离子液体的研究取得了惊人的进展。北大西洋公约组织于2000年召开了有关离子液体的专家会议;欧盟委员会有一个有关离子液体的3年计划;日本、韩国也有相关研究的相继报道。在我国,中国科学院兰州化学物理研究所西部生态绿色化学研究发展中心、北京大学绿色催化实验室、华东师范大学离子液体研究中心等机构也开展专门的研究。兰州化学物理研究所已在该领域取得重大突破,率先制备了多种咪唑类离子液体润滑剂。 世界领先的离子液体开发者—德国SolventInnovation公司即将推出数以吨计的商品。SolventInnovation公司也正在开发一系列的离子液体,以取代对环境极有害的溶剂。其
绿色化学与生活精编版
绿色化学与生活 文件编码(008-TTIG-UTITD-GKBTT-PUUTI-WYTUI-8256)
绿色化学与现代生活学院:经济与管理学院 专业:物流工程 班级: 142 名字:丁文雄 学号: 目录 摘要……………………………………………………………………………………… 3 1.绿色化学的基本内容 (4) 12个基本原理 (4) 2.绿色化学的研究成果 (7)
1 2 3.绿色化学与生活 (12) 绿色化学与生活的联系 (12) 绿色化学面临的挑战 (14) 怎样实行绿色化 学 (14) 摘要 随着21世纪环境污染问题的加重,绿色化学被提出,绿色化学也叫环境友好化学,它是从源头上阻止污染的新兴学科绿色化学又称“环境学”、“”、“清洁化学”,绿色化学是近十年才产生和发展起来的,是一个“新化学婴儿”。它涉及、、、等,内容广泛。绿色化学的最大特点是在始端就采用预防污染的科学手段,因而过程和终端均为或。世界上很多国家已把“化学的绿色化”作为新世纪的主要方向之一。 美国在1996年设立了总统绿色化学挑战奖,以此来奖励那些在减少化学污染方面取得成就的人;1999年英国皇家化学会创办了第一份国际性《绿色化学》杂志,标志着绿色化学的正式产生。绿色化学确实应该提倡,它是我们通向美好生活的必经之路。 1.绿色化学的基本内容
技术原理 它可通过使用,避免给环境造成负担、避免排放.利用太阳能为目的的光触和的制造和储藏技术的开发,并考虑节能、节省资源、减少排放量 传统的给环境带来的污染已十分严重,目前全世界每年产生的有害废物达3亿吨~4亿吨,给环境造成危害,并威胁着人类的生存。化学工业能否生产出对环境无害的化学品甚至开发出不产生废物的工艺有识之士提出了绿色化学的号召,并立即得到了全世界的积极响应。 绿色化学又称环境友好化学、环境无害化学、清洁化学,是用化学的技术和方法去减少或消除有害物质的生产和使用。 12个基本原则 1. 防止污染优于污染治理:防止废物的产生而不是产生后再来处理; 2. 提高原子经济性:合成方法应设计成能将所有的起始物质嵌入到最终产物中; 3. 尽量减少化学合成中的有毒原料、产物:只要可能,反应中使用和生成的物质应对人类健康和环境无毒或毒性很小; 4. 设计安全的化学品:设计的化学产品应在保护原有功效的同时尽量使其无毒或毒性很小; 5. 使用无毒无害的溶剂和助剂:尽量不使用辅助性物质(如溶剂、分离试剂等),如果一定要用,也应使用无毒物质; 6. 合理使用和节省能源,合成过程应在环境温度和压力下进行:能量消耗越小越好,应能为环境和经济方面的考虑所接受;
高考中有关离子交换膜的电化学试题
高考中有关离子交换膜的电化学试题 离子交换膜是一种对溶液里的离子具有选择透过能力的高分子膜。因在应用时主要是利用它的离子选择透过性,又称为离子选择透过性膜.离子交换膜法在电化学工业中应用十分广泛。教材中并未专门介绍,一般是在讲解氯碱工业时介绍阳离子交换膜的应用,但在近年考试中涉及离子交换膜原理的考题屡见不鲜.一、交换膜的功能: 使离子选择性定向迁移(目的是平衡整个溶液的离子浓度或电荷)。 二、交换膜在中学电化学中的作用: 1.防止副反应的发生,避免影响所制取产品的质量;防止引发不安全因素。(如在电解饱和食盐水中,利用阳离子交换膜,防止阳极产生的氯气进入阴极室与氢氧化钠反应,导致所制产品不纯;防止与阴极产生的氢气混合发生爆炸)。 2.用于物质的制备、分离、提纯等。 三、离子交换膜的类型: 常见的离子交换膜为:阳离子交换膜、阴离子交换膜、特殊离子交换膜等。 四、试题赏析: 1.某同学按如图所示装置进行试验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合时,SO42-从右向左通过阴离子交换膜移向A极.下列分析正确的是 A.溶液中c(A2+)减小 B.B极的电极反应:B-2e-= B2+ C.Y电极上有H2产生,发生还原反应
D.反应初期,X电极周围出现白色胶状沉淀,不久沉淀溶解 2.(2014·全国大纲版理综化学卷,T9)右图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法不正确的是 A.放电时正极反应为:NiOOH+H 2O+e-→Ni(OH) 2 +OH- B.电池的电解液可为KOH溶液 C.充电时负极反应为:MH+OH-→M+H 2 O+e- D.MH是一类储氢材料,其氢密度越大,电池的能量密度 越高 3.(2014·福建理综化学卷,T11)某原电池装置如右图所示,电池总反应为 2Ag+Cl 2 =2AgCl。下列说法正确的是 A.正极反应为AgCl +e-=Ag +Cl- B.放电时,交换膜右侧溶液中有大量白色沉淀生成 C.若用NaCl溶液代替盐酸,则电池总反应随之改变 D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子4.(2013·浙江高考·11)电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后, 蓝色逐渐变浅。已知:3I 2+6OH-=I+5I-+3H 2 O 下列说法不正确的是( ) A.右侧发生的电极反应式:2H 2O+2e-=H 2 ↑+2OH-
绿色化学与我们生活
绿色化学与我们的生活 你有没有认真观察过我们身边的人对化学这门学科的态度?你有没有想过身边的人提到化学时头脑中的第一反应是什么?如果有,你 就会发现,这个社会已经出现不少了“谈化学色变”的现象,也许你会觉得这未免太夸大事实了,但这绝不是危言耸听。仔细想想,当人们提到水污染、大气污染时最先想到的罪魁祸首是什么,不正是化工吗?再想想08年的三鹿奶粉事件的主角三聚氰胺,最终导致的是不是对化学用品的越来越不信任?当社会出现越来越多的关于化学危害现象,如广泛使用的塑料袋带来的白色污染,冰箱之氟利昂成为臭氧层空洞的罪魁祸首,引发食品安全问题的瘦肉精、化学农药……当这一切一切的不良现象的出现,带来的后果就是人们越来越不信任化学,更甚者厌恶化学,产生“谈化学色变”的现象,化学似乎成为了污染的代名词。于是,当人们购买食品时,含有食品添加剂的都不受欢迎。一生病,提到吃药打针的立马想到会对身体产生副作用。慢慢地,化学似乎千夫所指。 可是,这样的评价对于化学来说公平吗?当人们更多地关注化学带来的各种各样的环境污染问题的时候,有没有想过,如果没有化学,社会将是怎样的光景?如果没有化学科技的进步,我们现在能穿着这么多漂亮的衣服,能住在高楼大厦里,坐飞机开小车打电话玩电脑?自古便有“是药三分毒”之说,化学药品固然少不了一些副作用,可是它的发展不也治愈了数不清的疾病,延长了我们人类的寿命吗?大家都觉得农药化肥污染环境,可不这是它控制着虫害提高了生产吗?
因此,可以毫不夸张地说,化学在我们的生活中扮演着独一无二的角色。 我们不可否认化学的重要性。但是我们也不得不承认传统的化学工业确实是给我们赖以生存的环境带来了诸多负面影响以及对我们 生活造成了一定危害。我们所熟知的十大危机全球变暖、臭氧层破坏、大气污染、酸雨蔓延、水体污染、海洋污染、垃圾围城,生物多样性减少、森林锐减、土地荒漠化。其中有七项与化学污染密切相关。也正是日益突出的环境污染问题,迫使我们不得不反思传统化学所存在的弊端,由此推动了环境保护运动的兴起。历史发展的必然性最终选择了“绿色化学”,也就是说,“绿色化学”正是为了应对这一系列的挑战而被推出历史舞台的,它的出现是对传统化学工业的革命,为化学的发展注入了新的活力,是可持续发展观建立的必然产物,我们相信21世纪的绿色化学必将发挥其无与伦比的作用。 这里,我觉得有必要说说绿色化学的定义:绿色化学是一种以保护环境为目标来设计、生产化学产品的最新科技成果,是一门从源头上阻止污染的化学。所谓“绿色化学”是指设计对环境没有或者只有尽可能性小的负面作用,并且在技术和经济上又可行的化学品过程。它是在合成、催化、工艺、分离等领域实现污染预防的基本的和重要的科学手段。其研究重点是:设计或重新设计对人类健康和环境更安全的化合物;从研究、变换基本原料和起始化合物以及引入新试剂入手,探求新的、更安全的、对环境更友好的化学合成路线和生产工艺;改善化学反应条件,降低其对人类健康和环境的危害,减少废弃物的
离子液体概述及其应用要点
离子液体概述及其应用 前言:离子液体是仅由阴阳两种离子组成的有机液体,也称之为低温下的熔盐。离子液体具有低蒸汽压,良好的离子导电导热性,液体状态温度范围广和可设计性等优点。离子液体所具备的这些其他液体无法比拟的性质,给大部分传统化工反应提供了新的思路,特别是在绿色化学设计中的应用。本文首先阐述了离子液体的基础知识,而后着重讨论了离子液体在催化及有机合成领域,摩擦领域,生物医药领域中的应用。 主题: 一 离子液体概述 1.1离子液体的发展及性质 20世纪时“离子液体”(IL )仅仅是表示熔融盐或溶盐的一个术语,比如高温盐。现在,术语IL 大部分广泛的用在表示在液态或接近室温条件下存在的熔盐。早在1914年,Walden [1]合成出乙基硝酸铵,熔点为12℃,但当时这一发现并未引起关注。20世纪40年代,Hurley 等人报道了第一个氯铝酸盐离子液体系AlCl3-[EPy]Br 。此后对这一氯铝酸盐离子液体系进行了不断的扩充,包括各种基团修饰,如N-烷基吡啶,1,3-二烷基咪唑等,另外研究了此类离子液体系在电化学,有机合成以及催化领域的应用并有很好的效果[2]。但是由于此类离子液体共同的缺点就是遇水反应生成腐蚀性的HCl ,对水和空气敏感,从而限制了他们的应用。所以直到1992年,Wilkes [3]领导的小组合成了一系列由咪唑阳离子与-4BF ,-6PF 阴离子构成的对水和空气
都很稳定的离子液体。此后在全世界范围内形成了研究离子液体的热潮。这是由于ILs 存在很多优异而特殊的性质。(1)液体状态温度范围广,300℃;(2)蒸汽压低,不易挥发;(3)对有机物,无机物都有很好的溶解性,是许多化学反应能够在均相中完成;(4)密度大,与许多溶剂不溶,当用另一溶剂萃取产物时,通过重力作用,可实现溶剂与产物的分离;(5)较大的可调控性;(6)作为电解质具有较大的电化学窗口,良好的导电性,热稳定性。这些特殊的物理化学性质可以产生许多新应用,同时也会提高现有的科技水平。到目前为止,已经合成并报道了大量的ILs ,图1显示了典型的阳离子结构,阴离子结构和侧基链[4]。我们可以通过选择合适的离子组成从而实现ILs 物理化学性质的设计。比如说咪唑阳离子(1-丁基-3-甲基咪唑阳离子)和-4BF 或-4AlCl 组合,生成的离子液体是亲水性的,而同样的阳离子和 -6PF 或-2NTf 产生的是强憎水性的离子液体。 目前研究较多的是咪唑阳离子和吡啶阳离子与含氟阴离子构成的离子液体。
绿色化学与可持续发展
绿色化学与可持续发展 摘要:绿色化学是一门从源头上阻止污染的化学,又称环境无害化学,环境友好化学或清洁化学。绿色化学吸收了传统化学化工.环境.物理.生物.材料和信息等学科的最新理论和技术,代表了化学化工科学理念的重大变革,具有可持续发展的意义。本文介绍了绿色化学的一般概念及绿色化学与环境保护的关系。从主要研究内容及发展现状和趋势等方面阐明了绿色化学是可持续发展的必由之路。 关键词:绿色化学,可持续发展,环境保护 当今时代,人类的生活与化学息息相关。无论是衣、食、住、行,都离不开化学。同时,对资源的开发利用成为了当今社会面临的制约经济发展、影响环境的重要因素。因此,可循环利用、、可持续发展、绿色化学生产被人们提上了议事议程。 绿色化学简介: 名词解释: 按照美国《绿色化学》(Green Chemistry)杂志的定义,绿色化学是指:在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂和溶剂。而今天的绿色化学是指能够保护环境的化学技术.它可通过使用自然能源,避免给环境造成负担、避免排放有害物质.利用太阳能为目的的光触媒和氢能源的制造和储藏技术的开发,并考虑节能、节省资源、减少废弃物排放量。 绿色化学又称“环境无害化学”、“环境友好化学”、“清洁化学”,绿色化学是近十年才产生和发展起来的,是一个“新化学婴儿”。它涉及有机合成、催化、生物化学、分析化学等学科,内容广泛。绿色化学的最大特点是在始端就采用预防污染的科学手段,因而过程和终端均为零排放或零污染。世界上很多国家已把“化学的绿色化”作为新世纪化学进展的主要方向之一。 重要性: 传统的化学工业给环境带来的污染已十分严重,目前全世界每年产生的有害废物达3亿吨~4亿吨,给环境造成危害,并威胁着人类的生存。化学工业能否生产出对环境无害的化学品?甚至开发出不产生废物的工艺?有识之士提出了绿色化学的号召,并立即得到了全世界的积极响应。绿色化学的核心就是要利用化学原理从源头消除污染。 绿色化学给化学家提出了一项新的挑战,国际上对此很重视。1996年,美国设立了“绿色化学挑战奖”,以表彰那些在绿色化学领域中做出杰出成就的企业和科学家。绿色化学将使化学工业改变面貌,为子孙后代造福。
离子液体及其在化学中的应用
离子液体及其在化学中的应用 随着科技发展和环保意识的增强,清洁、低耗、高效的化学化工反应是发展的必然趋势.由于绝大多数化学反应需要在溶剂中进行,而有机溶剂的用量大、挥发性强是造成化学化工污染的主要原因之一.寻找对环境友好、有利于反应控制的介质和溶剂是目前化学化工需要解决的迫切问题之一.室温离子液体适应这种需要,正在快速为是继超临界CO2之后的新一代绿色溶剂。 一离子液体及其特点 离子液体[1]是指在室温或接近室温呈液态的离子型化合物,也称为低温熔融盐.常见的阳离子有季铵、季、咪唑盐和吡作为离子化合物,离子液体熔点较低的主要原因是:结构的不对称性使离子难以规则紧密地堆积,难以形成晶体或固体. 与传统的溶剂相比,离子液体具有以下3个显著的特性: 1 在室温下,离子液体蒸汽压几乎为零,并且不燃烧、不爆炸、毒性低,溶解性能强,可以较好地溶解多数有机物、无机物和金属配合物.多数离子液体在300e仍能保持液态,因而离子液体液态温度范围大,既可室温使用,也可以高温使用.离子液体作为溶剂,不仅不会造成溶剂损耗和环境污染,而且使用温度范围大,适用范围广.
2) 离子液体具有良好的导电性和较宽的电化学稳定电位窗.离子液体的电化学稳定电位窗比传统溶剂大得多,多数为4V左右,而水在酸性条件下为1.3V,在碱性条件下只有0.4V.因此使离子液体在电化学研究中有着广泛的用途. 3) 离子液体具有可调节的酸碱性,作为反应介质使用极为方便.例如,将Lewis酸AlCl3加入到离子液体氯化1-丁基-3-甲基咪唑中,当AlCl3的摩尔分数x<0.5时,体系呈碱性;当x=0.5时,呈体系呈中性;当x>0.5时,体系表现强酸性[4].同时,还发现离子液体存在/潜酸性0和/超酸性0.例如,把弱碱吡咯或N,N)二甲基苯胺加到中性的离子液体1-丁基 -甲基咪唑四氯铝酸盐中,体系表现出很强的潜酸性[5],如果把无机酸溶于上述离子液体中可观察到超强酸性[6]. 二离子液体在化学中的应用 由于离子液体所具有的独特性能,目前它被广泛应用于化学研究的各个领域中 .1 用作反应溶剂 2.1.1 氢化反应离子液体作为氢化反应的溶剂已有大量的报道[7~9],对于氢化反应,用离子液体替代普通溶剂的优点是:反应速率提高数倍,离子液体和催化剂的混合液可以重复利用.研究表明,离子液体在氢化反应中发挥了溶剂和催化剂的双重
高分子与现代生活
高分子与现代生活 摘要:高分子材料的发展与我们的生活息息相关,从科研军事领域到我们的衣食住行,现在都离不开高分子材料。究竟什么是高分子材料,高分子材料在我们的生活中究竟扮演着一个怎样的角色?在高分子技术高速发展的今天,涌现出了一大批新的材料,这些材料对于经济和科技的发展都起到了巨大的作用,在科学技术高速发展的同时,人们也不能忘记对于材料发展的要求,应当将科技发展与可持续发展理念相结合,开发新的环境能源保护资源,减少对于环境的破坏。 关键词:生活影响新材料环保 很荣幸能选择到这一门高分子与现代生活的课程,作为一个电气学院的学生,我对于高分子的知识了解也仅限于在高中时期化学课的有机化学部分。在这一学期的学习过程中,对于高分子技术也有了一定的了解。作为一门类似与科普的课程,这门课程让我在一种轻松愉快的形式下了解高分子技术与现代社会发展。 所谓高分子材料,顾名思义是由现对分子质量较高的化合物构成的材料。高分子材料按来源分类高分子材料按来源分为天然高分子材料和合成高分子材料。天然高分子是存在于动物、植物及生物体内的高分子物质,可分为天然纤维、天然树脂、天然橡胶、动物胶等。合成高分子材料主要是指塑料、合成橡胶和合成纤维三大合成材料,此外还包括胶黏剂、涂料以及各种功能性高分子材料。合成高分子材料具有天然高分子材料所没有的或较为优越的性能——较小的密度、较高的力学、耐磨性、耐腐蚀性、电绝缘性等。 而高分子是生命存在的形式,天然高分子是生命的起源与进化的基础。从古至今,人类社会就一直利用着高分子材料作为生活资料和生产资料,它已成为我们日常生活中不可缺少的一部分。 在现代这个经济,技术快速发展的社会中,高分子材料以它优秀的特性在国民经济,科技、现代生活中更是起着举足轻重的作用。近年来,随着电气,电子、信息、汽车、航空、航天的发展与创新,高分子材料更是在不断向高功能化、高性能化转变方面日益活跃,并取得了重大突破。 在传统意义上,高分子材料包括塑料、橡胶、纤维、薄膜、胶黏剂和涂料等,其中被称为现代高分子三大合成材料的塑料、合成纤维、合成橡胶,已经成为国民经济建设和人民日常生活中所必不可少的重要材料。尽管高分子材料因普遍具有许多金属和无机材料所无法取代的优点而获得迅速的发展,但目前工业已大规模生产的还只是寻
高考化学复习 专题7-离子交换膜在电化学装置中的应用 (2)
专题7 离子交换膜在电化学装置中的应用 日期:2019年11月10日 学号姓名 1.(2018年11月浙江选考17题)最近,科学家研发了“全氢电池”,其工作原理如图所示。 下列说法不正确 ...的是() A.右边吸附层中发生了还原反应 B.负极的电极反应是H2-2e-+2OH-=2H2O C.电池的总反应是2H2 +O2=2H2O D.电解质溶液中Na+向右移动,ClO4-向左移动 2.(2019年高考天津卷6题)我国科学家研制了一种新型的高比能量锌--碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是 A.放电时,a电极反应为I2Br-+ 2e-=2I-+ Br- B.放电时,溶液中离子的数目增大
C.充电时,b 电极每增重0.65 g ,溶液中有0.02mol I - 被氧化 D.充电时,a 电极接外电源负极 3.(2019 年全国卷 I 12) 利用生物燃料电池原理研究室温下氨的合成,电池工作时MV 2+/MV +在电极与酶之间传递电子,下列说法错误的是 A .相比现有工业合成氨,该方法条件温和,同时还可提供电能 B .阴极区,在氢化酶作用下发生反应H 2 + 2MV 2+ = 2H + + 2MV + C .正极区,固氮酶为催化剂,N 2发生还原反应生成NH 3 D .电池工作时,质子通过交换膜由负极区向正极区移动 4.(2016年全国卷 I 11)三室式电渗析法处理含 Na 2SO 4 废水的原理如图3所示,采用惰性电极,ab 、cd 均为离子交换膜,在直流电场的作用下,两膜中间的Na +和SO 42- 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是(B ) A .通电后中间隔室的SO 42-向正极迁移,正极区溶液pH 增大 B .该法在处理含Na 2SO 4。废水时可以得到NaOH 和H 2SO 4产品 C .负极反应为2H 2O - 4e - = O 2+ 4H +,负极区溶液pH 降低 D .当电路中通过1mol 电子的电量时,会有0.5 mol 的O 2生成 5.(2018年全国卷Ⅰ 27节选)焦亚硫酸钠(Na 2S 2O 5)在医药、橡胶、印染、食品等方面应有广泛,加答下列问题: MV + MV 2+ N 2 NH 3 H 2 H + MV + MV 2+ 电 极 电 极 氢化酶 固氮酶 2SO 4负极区正极区 浓Na 2SO 4溶液a b c d +-
绿色化学的发展与前景
绿色化学的发展与前景 摘要:随着社会的发展,化学产业迅速发展,不断推动着人类社会的进步,同时,也给环境带来了极大的负担,威胁着人们的健康和赖以生存的自然环境。然而污染防治虽卓有成效,但仍以治理为主,效果有限且费用昂贵,因此,绿色化学的出现极好地适应了发展趋势,将为社会的进一步发展和化学学科新的飞跃发挥巨大的作用。 关键词:绿色化学清洁生产环境污染 The development of Green Chemistry and Engineering Abstract: Accompanied with the development of the society, the chemistry industry is also developing quickly. As a result, it pushes forward the advance of society. However, meanwhile, it brings great burdens on the environment, which threat the health of man and the nature. Although the preventions of pollution are fruitful, we still mainly depend on treatments after pollution, it works out to a certain extent, and it really costs a lot. So, that’s why Green Chemistry, which fits the tendency of environmental protection well, is greatly welcomed. It will make efforts for the further development of the society and chemistry. Key words: Green Chemistry, Cleaner Production, Environmental pollution 随着21世纪的到来, 人类生产生活与化学越来越密不可分。化学科学的研究成果和化学知识的应用为推动人类的进步起了决定性的作用。目前, 化学及其制品已经渗透到人类生活、生产和国民经济的各个领域, 达到人人、事事、处处都离不开化学及其制品的程度。 然而,另一方面, 随着化学品的大量生产和广泛应用, 给人类本来绿色平和的生态环境带来了极大的破坏,威胁着人们的健康, 以及人类赖以生存的自然环境的可持续发展。工厂向大气中排放大量酸性物质,造成雨水被大气中存在的酸性气体污染,pH<5.6,达到酸雨的标准,致使许多建筑物、植物、以及人文自然 CO浓度大景观遭到严重破坏;而在生产过程中的大量有机物燃烧,致使空气中 2 幅升高,造成温室效应,使地球生态环境遭威胁;大量氯氟烷烃(如制冷剂、发泡剂、清洗剂等)的生产和使用使臭氧层出现明显的空洞,易使人发生皮肤癌、白内障等疾病,也会削弱人的免疫力,与此同时,对生态环境的影响也显著,会使农作物减产且品质下降,渔业产量下降以及森林被破坏。。。还有黑色的污水、黄色的烟尘、五颜六色的废渣和看不见的无色毒物。
绿色化学答案
思考题 第一章3 1、21世纪人类面临的4大问题是什么? 2、人类面临的几大环境问题及其原因是什么? 3、绿色化学定义的5个内涵是什么? 4、绿色化学的内涵-5个R是什么? 5、原子经济性是什么? 6、绿色化学的5大任务是什么? 7、绿色化学十二原则-Anastas原则的内容是什么? 第二章4 1、简述化学工业与现代社会的关系。 2、化学工业的发展历史阶段及内涵。 3、环境友好的化学技术的含义是什么? 4、生物质化工转化的主要内涵。 5、纤维素制乙醇的主要过程和技术难点。 6、简述催化技术的特点。 7、催化技术的进展主要在哪几个方面? 第三章5 1、设计安全无毒化学品的一般原则是什么? 2、设计安全无毒化学品的外部和内部效应原则是什么? 3、设计安全无毒化学品的外部效应原则主要包括哪几个方面? 4、设计安全无毒化学品的内部效应原则主要包括哪几个方面? 5、设计安全有效化学品的方法主要有哪几种? 6、化学品的致毒途径和根源。 7、化学品的吸收、分散和代谢。 8、含有那些化学结构的物质毒性较大? 9、等电排置换设计。 第四章 9 1、硅-碳等电排置换法设计安全无毒化学品的原理是什么? 2、设计可生物降解的化学品的重要性。 3、生物降解的细菌基础是什么? 4、不易生物降解的化学结构有哪些? 5、水生生物毒性定量构效关系构筑的常用物理性质有哪些? 6、影响水生生物毒性的物理和化学因素有哪些? 7、表面活性剂对水体和水生生物的危害?如何防止?
第六章11 1、绿色化学反应举例。 2、亚氨基二乙酸钠合成的新路线。 3、环氧丙烷生产方法有哪几种?各有何优缺点? 4、合成己二酸和邻苯二酚的传统方法和新方法的原理和优缺点? 5、绿色原料举例。 6、超临界CO2中的反应举例。 7、对比异布洛芬的新、旧合成路线,说明其技术创新的关键。 8、更安全的化学品举例,所得到的启示。 第七章17 1、高效均相和多相催化技术有哪几类? 2、生物催化和仿生催化的优点。 3、酶的分类。 4、固定化酶技术的优点。 5、环境友好的溶剂中的有机反应。 6、固相合成对载体的基本要求。 7、不对称催化合成有哪几种方法?有何优缺点?
浅谈现代生活与化学的关系
浅谈现代生活与化学的联系
初等教育系朱毅 指导教师:李佳琪 摘要 化学作为一门深层次研究的课程,它与人们的现代生活息息相关,尤其是它与人类的健康关系甚是密切。生活中处处有化学,随着生活水平的提高,人们越来越追求健康、高品位的生活。化学与生活的联系也日趋密切,只要你留心观察,用心思考,就会发现生活中的化学知识到处可见。生活中充满着化学的踪影,化学就在我们身边,用化学知识可以解决生活中的实际问题。化学可以服务于社会,服务于其他学科,服务于人类自身。本文主要探讨了现代生活化学与居住健康、使用健康、饮食健康等方面,为化学学科发展促进人类现代生活健康提供有益借鉴。 “关键词”:现代生活化学;现代生活;居住;使用;饮食;健康 引言 化学是一门实用性、创造性的学科,它与能源、材料、信息、环境保护、国防、生物工程、医药卫生、资源的综合利用以及人们的衣、食、住、行密切相关,自有人类以来就开始了对化学的探索,因为有了人类就有了对化学的需求。它与我们的生活息息相关,在我们的日常生活中无处不在。我国著名滑雪前辈杨石先生说:“农、轻、重、吃、穿、用,样样都离不开化学。”没有化学创造的物质文明,就没有人类的现代生活。 化学作为一门庞大的知识体系,能用来解决人类面临的问题,满足社会的需要,对人类社会做出贡献。它的成就已成为社会文明的标志,深刻的影响着人类社会的发展。社会的发展离不开人类的发展,人类的发展离不开人的生存,而人的生存离不开化学。社会的一切发展,生命是基础。一切生命的起源离不开化学变化,一切生命的延续同样离不开化学变化。恩格斯说:“生命的起源必然是通过化学的途径实现的。”没有化学的变化,就没有地球上的生命,也就更不会有人类。是化学创造了人类,创造了美丽的地球。在现代生活化学学习中,有很多内容都联系着我们的生活,渗透到我们的衣、食、住、行中,可以说化学关系着人类的生存与健康。我们要运用好这些知识,真正做到“让生活走进化学,让化学走向社会”,让化学服务人类生活,为当今社会造福! 一.现代生活化学与居住健康 (一)涂料对人类健康的影响
高考化学专项突破 离子交换膜在电化学装置中的应用
高考化学专项突破----离子交换膜在电化学装置中的应用 一、离子交换膜的功能:使离子有选择性的定向迁移(目的是平衡整个溶液的离子浓度或电荷)。 二、离子交换膜在电化学中的作用 (1)能将两极区隔离,阻止两极区产生的物质接触。 防止副反应的发生,避免影响所制取产品的质量; 防止引发不安全因素。(如在电解饱和食盐水中,利用阳离子交换膜,防止阳极产生的Cl2进入阴极室与氢氧化钠反应,导致所制产品不纯;防止与阴极产生的H2混合发生爆炸)。 (2)能选择性地通过离子,起到平衡电荷、形成闭合回路的作用。 (3)用于物质的制备、分离、提纯等。 三、离子交换膜的类型 根据透过的微粒,离子交换膜可以分为多种,在高考试题中主要出现阳离子交换膜、阴离子交换膜和质子交换膜三种。阳离子交换膜,简称阳膜,只允许阳离子通过,阻止阴离子和气体通过;阴离子交换膜,简称阴膜,只允许阴离子通过,质子交换膜只允许质子(H+)通过,不允许其他阳离子和阴离子通过。可见离子交换膜的功能在于选择性地通过某些离子和阻止某些离子来隔离某些物质。 注意:①反应物相同,不同的交换膜,迁移的离子种类不同。②同种交换膜,转移相同的电子数,如果离子所带电荷数不同,迁移离子数不同。③离子迁移依据电荷平衡,而离子数目变化量可能不相等。 四、离子交换膜类型的判断
根据电解质溶液呈中性的原则,判断膜的类型。判断时首先写出阴、阳两极上的电极反应,依据电极反应式确定该电极附近哪种离子剩余,因该电极附近溶液呈电中性,从而判断出离子移动的方向,进而确定离子交换膜的类型,如电解饱和食盐水时,阴极反应式为2H++2e-=H2↑,则阴极区域破坏水的电离平衡,OH-有剩余,阳极区域的Na+穿过离子交换膜进入阴极室,与OH-结合生成NaOH,故电解食盐水中的离子交换膜是阳离子交换膜。 五、真题再现 1、(2019·全国卷Ⅰ)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+ 在电极与酶之间传递电子,示意图如下所示。下列说法错误的是 A.相比现有工业合成氨,该方法条件温和,同时还可提供电能 B.阴极区,在氢化酶作用下发生反应H 2+2MV2+2H++2MV+ C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3 D.电池工作时质子通过交换膜由负极区向正极区移动 【答案】B 【解析】 【分析】由生物燃料电池的示意图可知,左室电极为燃料电池的负极,MV+在负极失电子发生氧化反应生成MV2+,电极反应式为MV+?e?= MV2+,放电生成的MV2+在氢化酶的作用下与H2反应生成H+和MV+,反应的方程式为H2+2MV2+=2H++2MV+;右室电极为燃料电池
绿色化学与健康生活大纲
《绿色化学与健康生活》课程教学大纲 英文名称:Green chemistry and health life 课程号: 一、课程基本情况 学分: 1.5 学时: 24 课程类别:全校公共任意选修课 适用专业:非化学专业本科 先修课程:中学基础化学知识 开课单位:化学与化工学院 二、课程介绍 绿色化学与健康生活.此二者是相互联系,相互影响、互为有机结合的。绿色化学是现代生活高品质的产物,是我们达到健康生活水平的有效途径。然而现代生活中太多的化学未必是绿色的,所以我们要必须了解什么是绿色化学,它能给我们带来怎样的生活,我们需要拥有怎样的绿色意识。生命是绿色的,健康需要绿色,我们课程以拓宽学生知识面、提高学生健康生活意识为指导思想,通过学习日常生活中与健康有关的化学知识,例如:食品与健康;化妆品与健康;环境与健康;药品与健康;现代生活用品与健康等,在培养同学们具有健康理念的同时,学习科学,运用科学,热爱科学。 《绿色化学与健康生活》侧重探讨化学与现代生活的各领域,尤其是与21世纪前沿的领域,如材料、环境以及能源等方面的关系。以“从生活走进化学,从化学走向社会”为理念,内容包括化学与营养、化学与食品加工、化学与健康、化学与材料、化学与日用品、化学与资源、化学与能源、化学与工农业生产和化学与环境保护等多个单元,特点是科学性强,化学味重,生活味浓,资料性全。文理渗透,理工交融,注重化学素养教育。 三、课程主要内容及基本要求 课程目标 一、通过本课程的学习,了解绿色化学与健康生活之间的关系,提高学习化学的兴趣。
二、学习如何将所学知识用于生活,如何在生活中注重环保,培养学生具有绿色意识。 三、通过查找有关化学资料,提高学生收集信息和整理信息的能力。 绪论绿色化学简介(2学时) (一)教学内容: 本单元(章)知识点:化学科学的发展极大地推动了人类社会的进步,同时也带来了一些负面影响,如塑料是人类的重要发明,塑料袋的使用给人们生活带来了许多方便,但如果滥用,则会出现环境难以消除的“白色垃圾”,成为“白色污染”,造成危害,难怪有人说“科学是一把双刃剑”,我们应该扬长避短,在享受现代文明的同时,还要清晰的认识到它可能产生的负面影响。你所了解的由于科学的发展带来的负面影响还有哪些?你知道应采取哪些措施预防它们吗? 绿色化学又称环境友好化学,是21世纪化学发展的主导方向。绿色化学要求从根本上消灭污染,是一门能彻底阻止污染产生的科学。 教学重点:充分利用资源和能源,采用无毒、无害的原料; (1)在无毒、无害的条件下进行反应,以减少向环境排放废物; (2)提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”;(3)生产出有利于环境保护、社区安全和人体健康的环境友好的产品 教学难点:内容涉及一些专业的化学知识,需要通俗讲解。 (二)教学基本要求: 1、识记:绿色化学等基本名词术语、概念等 2、领会:环境友好型化学试剂;了解各国对绿色化学的措施 3、简单应用:要求学生学习后能回答或解决的简单绿色环保相关的知识问题等 4、综合应用:要求学生学习后能回答或解决与实际生活相关的绿色环保以及健康生活 等问题 (三)实践与练习 讨论找出与身边绿色化学相悖的现象和事例,深刻领会绿色化学的重要性 (四)考核要求 课堂发言和课堂讨论形成小组总结 第一章食品与化学(6学时) (一)教学内容:
绿色化学与生活精编WORD版
绿色化学与生活精编 W O R D版 IBM system office room 【A0816H-A0912AAAHH-GX8Q8-GNTHHJ8】
绿色化学与现代生活 学院:经济与管理学院 专业:物流工程 班级: 142 名字:丁文雄 学号: 目录 摘要 (3) 1.绿色化学的基本内容 (4) 1.1 技术原理 (4) 1.2 12个基本原理 (4) 1.3发展历史 (6) 1.4中国历程 (7) 2.绿色化学的研究成果 (7) 2.1开发"原子经济"反应 (8)
2.2采用无毒、无害的原料 (7) 2.3采用无毒无害的催化剂 (9) 2.4采用无毒、无害的溶剂 (10) 2.5利用可再生的资源合成化学品 (11) 2.6环境友好产品 (12) 3.绿色化学与生活 (12) 3.1绿色化学与生活的联系 (12) 3.2绿色化学面临的挑战 (14) 3.3怎样实行绿色化学 ? (14) 摘要 随着21世纪环境污染问题的加重,绿色化学被提出,绿色化学也叫环境友好化学,它是从源头上阻止污染的新兴学科绿色化学又称“环境无害化学”、“环境友好化学”、“清洁化学”,绿色化学是近十年才产生和发展起来的,是一个“新化学婴儿”。它涉及有机合成、催化、生物化学、分析化学等学科,内容广泛。绿色化学的最大特点是在始端就采用预防污染的科学手段,因而过程和终端均为零排放或零污染。世界上很多国家已把“化学的绿色化”作为新世纪化学进展的主要方向之一。
美国在1996年设立了总统绿色化学挑战奖,以此来奖励那些在减少化学污染方面取得成就的人;1999年英国皇家化学会创办了第一份国际性《绿色化学》杂志,标志着绿色化学的正式产生。绿色化学确实应该提倡,它是我们通向美好生活的必经之路。 1.绿色化学的基本内容 1.1 技术原理 它可通过使用自然能源,避免给环境造成负担、避免排放有害物质.利用太阳能为目的的光触媒和氢能源的制造和储藏技术的开发,并考虑节能、节省资源、减少废弃物排放量传统的化学工业给环境带来的污染已十分严重,目前全世界每年产生的有害废物达3亿吨~4亿吨,给环境造成危害,并威胁着人类的生存。化学工业能否生产出对环境无害的化学品?甚至开发出不产生废物的工艺?有识之士提出了绿色化学的号召,并立即得到了全世界的积极响应。 绿色化学又称环境友好化学、环境无害化学、清洁化学,是用化学的技术和方法去减少或消除有害物质的生产和使用。 1.2 12个基本原则 1. 防止污染优于污染治理:防止废物的产生而不是产生后再来处理; 2. 提高原子经济性:合成方法应设计成能将所有的起始物质嵌入到最终产物中; 3. 尽量减少化学合成中的有毒原料、产物:只要可能,反应中使用和生成的物质应对人类健康和环境无毒或毒性很小;
绿色化学作业答案
1简答:绿色化学的目标、化学工作造成的危害、风险试剂、生物质的种类、可再生资源、原子利用率、环境商、环境因子 2为什么要大力发展绿色化学 3绿色化学及其与环境污染治理的异同 4什么是绿色化学品怎样设计安全的化学品 5举例说明原子经济反应是不产生污染的必要条件 6试论计算机辅助绿色化学合成路线设计的必要性和方法 7怎样在反应过程中使化学反应绿色化 8试论分析化学在绿色化学发展中的作为 9简述绿色化学12原则 1、简答:绿色化学的目标、化学工业造成的危害、风险试剂、生物质的种类、可再生资源、原子利用率、环境商、环境因子。 答:绿色化学的目标是:化学过程中不产生污染,即将污染消除与其产生之前。实现这一目标后就不需要治理污染,因其根本就不产生污染,是一种从源头上治理污染的方法,是一种治本的方法。 化学工业造成的危害:由于受传统发展观的影响,化学工业向环境排放了大量的污染物,一些化学品不佳节制地被滥用,给整个生态环境造成了非常严重的影响。当代全球十大环境问题中至少有7项与化学工业和化工产品的化学物质有关,在所有释放有毒有害物质的工业中,与化学工业相关的产业处于第一位,该行业排放的有的有害物质是处于第二位的冶金工业的4倍。许多物质排放到环境后会在环境中残留和积累,对环境造成破坏,另外,化工生产中的偶然事件也会对人类和环境造成突发性的影响。
风险试剂:绿色化学中所指的风险实际指的是氢氰酸 生物质的种类:生物质主要有来年各类,即淀粉和木质纤维素。玉米、小麦、土豆等是淀粉类的代表,农业废料(如玉米杆、麦苗杆等),森林废物和草类等是木质纤维素的典型代表。 可再生资源:指那些通过天然作用或人工活动能再生更新,而为人类反复利用的自然资源叫可再生资源,又称为更新自然资源,如土壤、植物、动物、微生物和各种自然生物群落、森林、草原、水生生物等。 原子利用率:原子利用率微目标产物的量(一般为质量)与按化学计量式多的所有产物的量的和之比,用原子利用率可以衡量在一个化学反应中,生产一定来那个的目标产物到底会生成多少的废物。 环境商(EQ):环境商EQ定义为EQ=E*Q,式中E为环境因子,Q为根据废物在环境中的行为给出的废物对环境的不友好程度,用于评价一种合成方法、一个过程对环境的好坏。 环境因子:环境因子(E因子)定义为E=废物质量/目标产物质量。在这里,对于每一种化工产品而言,目标产物以外的任何物质都是废物。 2、为什么要大力发展绿色化学 答:A. 大力发展绿色化学是人类社会可持续发展的必然要求,一个世纪依赖,为满足人类社会和工业生产的需要,化学取得了十分辉煌的进步,创造了巨大的功绩,但是由于受陈旧的思想禁锢,化学工业给整个自然界带来了巨大的灾难,使地球的生物多样性和生态环境遭受巨大破坏,但是,我们都知道,离开了化学工业,人们的物质生活水平将手机大的限制,我们也不能再像以前一样只是靠转移生产地而解决我们所面临的殊多问题。我们既要为开创更加美好的生活而发展化学和化学工业,又不能让化学品生产过程和化学品破坏我们的环境。这就要求我们大力发展既能支撑经济发展,又能满足环境需要,以保证可持续发展的新的化学——绿色化学。 B. 发展绿色化学是科学技术和经济发展的需要。目前,各化学工业公
离子液体应用及其发展
离子液体应用及其发展 罗树琴生化系化学教育2001541 摘要:离子液体也称为室温离子液体或低温盐,通常是指熔点低 于100℃的有机盐。由于完全有例子组成,离子液体有许多不同于常规有机溶剂的性质。离子液体在各方面都有广泛应用前景,目前离子液体的制备和研究正在快速的发展,其应用前景也是相当广阔的。 关键字:离子液体应用发展及前景 离子液体也称为试问离子液体或低温盐,通常是指熔点低于100℃的有机盐。由于完全有例子组成,离子液体有许多不同于常规有机溶剂的性质。如熔点低,不挥发,液程范围宽,热稳定性好。溶解能力强,性质可调,不易燃,电化学窗口宽等。与传统的有机溶剂,水,超临界流体等相比,起黏度低,比热容大,有的对水对空气均稳定,故易于处理,制造较为容易,不太昂贵。是理想的绿色高效溶剂,研究其性质极其应用成了一项热门课题, 1.离子液体的性质 离子液体大多呈无色,完全由阴阳离子组成,但样离子较大,且是有机物。离子液体 1有酸碱性(主要由阳离子决定,可通过调节阳离子来改变其酸碱性), 2亲水性:含C越多亲水性越弱 3热稳定性:较高的稳定性与杂原子氢键,阴阳离子组成相关,其蒸汽压低(可忽略不计),不易挥发,可去取代有机溶剂。 4熔点低:熔点与阴阳离子组成有关,是随阳离子对称性增大而增大的 5溶解性好:可溶解有机物,无机物,聚合物等 6密度:和阴阳离子组成有关,阳离子增多密度变大 7生物降解性:其一降解,相当环保,是绿色的环保剂 8电化学窗口:其可产生5-7V的高电压, 2.离子液体的合成制备 2.1 常规合成法 2.1.1一步法:采用叔胺与卤代烃或脂类物质发生加成反应,或利用叔胺的碱性和酸性发生中和反应而一步生成目标离子液体的方法 2.1.2两步法:两步法的第一步是通过叔胺和卤代烃反应制备出
