物理化学 复习知识点

第一章 热力学第一定律
1.基本概念 1.1体系和环境
系统(System )-被划定的研究对象称为系统。
环境(surroundings )- 与系统密切相关、有相互作用或影响所能及的部分称为环境。 1.2状态函数
*状态函数——由系统的状态确定的系统的各种热力学性质称为系统的状态函数。 *它具有以下特点:
(1)状态函数是状态的单一函数。
(2)系统的状态发生变化,状态函数的变化值取决于系统始、终态。与所经历的途径无关。 (3)状态函数的微小变化,在数学上是全微分。
(4)不同状态函数的集合(和、差、积、商)也是状态函数。 1.3体积功
功(work )--系统与环境之间传递的除热以外的其它能量都称为功,用符号W 表示。体积功就是体积膨胀或缩小所做的功。
系统对环境作功,W <0 环境对体系作功,W >0 1.4可逆过程(下)
1.5各种热力学函数(U, H, Q,W)
U 和H 是状态函数,Q 和W 不是状态函数。 1.6标准摩尔生成焓概念
在标准压力下,反应温度时,由最稳定的单质合成标准状态下一摩尔物质的焓变,称为该物质的标准摩尔生成焓,用下述符号表示:
(物质,相态,温度)
2 体系和环境 2.1 体系(系统)
*敞开系统(open system )系统与环境之间既有物质交换,又有能量交换。 *封闭系统(closed system )系统与环境之间无物质交换,但有能量交换。
*孤立系统(isolated system )系统与环境之间既无物质交换,又无能量交换。
热力学上有时把系统和环境加在一起的总体看成是孤立系统。
2.2状态函数
体系的一些性质,其数值仅取决于体系所处的状态,而与体系的历史无关;它的变化值仅取决于体系的始态和终态,而与变化的途径无关。具有这种特性的物理量称为状态函数。对于循环过程:所有状态函数的改变值均为零 2.3可逆过程
体系经过某一过程从状态(1)变到状态(2)之后,如果能使体系和环境都恢复到原来的状态而未留下任何永久性的变化,则该过程称为热力学可逆过程。否则为不可逆过程。 2.4热和功 Q ,W
体系吸热,Q >0;体系放热,Q <0 。
体系对环境作功,W <0;环境对体系作功,W >0 。
dV p W e -=δ=p -)(12V V -
2.5焓H (单位是kJ*mol -1)
*定义式:H = U + pV
*焓的物理意义:U Q V ?= 在非体积功为零的条件下,封闭系统经一邓蓉过程,所吸收的热全部用于增加系统的热力学能。
*焓的特点:1.焓是状态函数 定义式中焓由状态函数组成。 2.不能确定焓的绝对值,但可求变化值。 3.焓也是广度性质,并具能量的量纲。 2.6基本理论
1.热力学第一定律 — 宏观上静止且无外立场存在的封闭体系中 ?U = Q + W
2.热力学第一定律的应用
O m
r ΔH
*理想气体的内能和焓:“理想气体的热力学能U 和焓H 仅是温度的函数,而与体积或压力无关。” *理想气体绝热过程特点:Q=0 2.7热化学 *定义式:封闭系统中发生某化学反应,当产物的温度与反应物的温度相同时,体系所吸收或放出的热量,
称为该化学反应的热效应, 亦称为反应热。 *恒压反应的热效应:反应在等压下进行所产生的热效应为p Q ,如果不作非膨胀功W ’=0,则
p Q H =?(W ’=0,恒压)
*恒容反应的热效应:反应在等容下进行所产生的热效应为V Q ,如果不作非膨胀功,
则 U Q V ?=
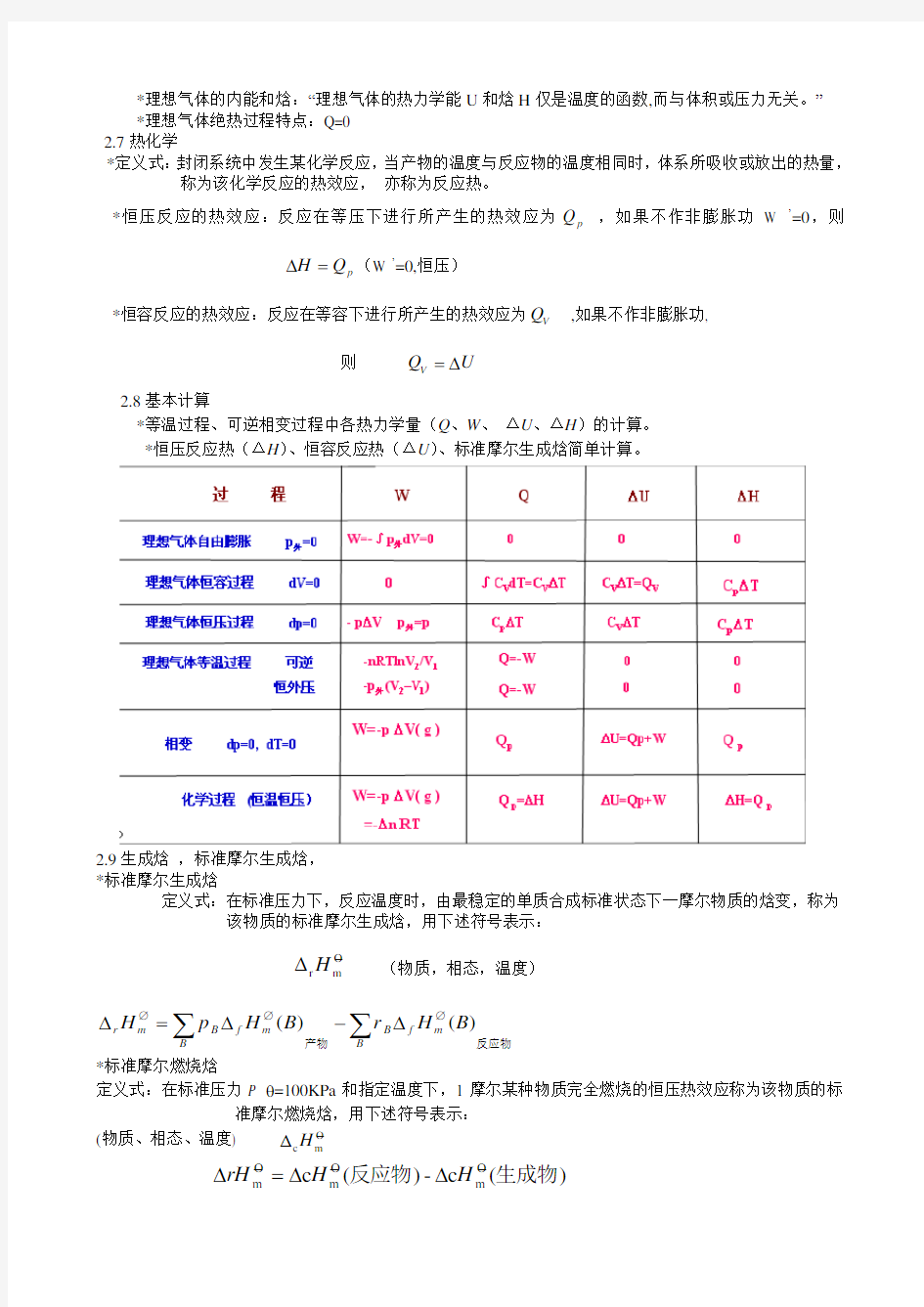
2.8基本计算
*等温过程、可逆相变过程中各热力学量(Q 、W 、 ΔU 、ΔH )的计算。 *恒压反应热(ΔH )、恒容反应热(ΔU )、标准摩尔生成焓简单计算。
2.9生成焓 ,标准摩尔生成焓, *标准摩尔生成焓
定义式:在标准压力下,反应温度时,由最稳定的单质合成标准状态下一摩尔物质的焓变,称为
该物质的标准摩尔生成焓,用下述符号表示:
(物质,相态,温度)
反应物
产物
∑∑?
?
??-?=?B
m f B B
m f B m r B H r B H p H )()
(
*标准摩尔燃烧焓
定义式:在标准压力P θ=100KPa 和指定温度下,1摩尔某种物质完全燃烧的恒压热效应称为该物质的标
准摩尔燃烧焓,用下述符号表示:
(物质、相态、温度) )(c -)(c O
m O m O m 生成物反应物H H rH ??=?
O
m r ΔH O
m
c ΔH
第二章 热力学第二定律
1.基本概念:
热力学函数定义(S,F,G) 自发过程的方向和限度判据 热力学基本关系式
化学势的概念及物理意义 2.几个热力学函数定义: (1)熵:
(2)亥姆霍斯自由能:TS U F -=
(3)吉布斯自由能:
3.自发变化的方向和限度
1 熵判据: ,即?S = ?S
?+S
≥ 0
“>” 号为自发过程
“=” 号为可逆过程
“<” 号为不可能发生的过程
2 亥姆霍兹自由能判据: ,即
3 自发过程
4可逆过程或处于平衡态
不可能自发进行的过程
5 吉布斯自由能判据:
自发过程
可逆过程或处于平衡态 不可能自发进行的过程
4. 基本理论
? 热力学第二定律(自发过程的方向和限度) ? 熵增原理(绝热过程和孤立体系):
1.特点:熵增原理仅能判断一过程是否为不可逆,但不能判断是否为自发
2. 绝热过程:对于绝热系统中所发生的任何过程 δ∑Q 绝热=0
此式说明:对于绝热过程,系统的熵不减少。?熵增原理,即
若为绝热可逆过程,?S =0,(绝热可逆过程为恒熵过程); 若为绝热不可逆过程,?S >0
r
d ()Q
S T =δ def G H TS
-0≥iso dS ',,0
()0T V W F =?<',,0
()0
T V W F =?<',,0()0
T V W F =?=',,0()0T V W F =?>0
)d (0
,,f ≤=W p T G 00',,()T P W G =?<00
',,()T P W G =?=00',,()T P W G =?>0
S ?≥绝热
3.孤立体系:对于孤立体系, ,所以clausius 不等式为: *等号表示可逆过程,不等号表示不可逆过程。
*孤立系统排除了环境对系统以任何方式的干扰,因此,孤立系中的不可逆过程必然是自发过程。
*熵增加原理可表述为:孤立系统中自发过程的方向总是朝着熵值增大的方向进行,直到在该条件下系统熵值达到最大为止,此时孤立系统达平衡态。 5. 基本计算
? 等温过程、相变过程、化学变化过程中各热力学量(ΔS (环境,体系,孤立体系)、ΔF 、ΔG )
的计算。 书上P 52-57
6.各个过程热力学函数的计算
6.1、等温可逆过程——理想气体等温可逆,温度不变
6.2、理想气体等温恒外压膨胀
6.3、理想气体自由膨胀
6.4、可逆相变
0Q δ=0
S ?≥孤立
0=?=?H U 1
2ln V V nRT W -=W Q -=2
112ln ln P P nR V V nR S ==?G F ?=?1
2
ln P P nRT G =?)dV 12V V p P W --=-=?
(外外0=?=?U H S T F G V V
nR S ?=?=?=?1
2ln 21
0,0
ln ,T W Q U H V S nR G A T S V ?=∴==?=?=?=?=?=?理想气体、W Q H p vap +=??U 已知,nRT
V V p W -≈--=)(nRT H W Q vap p -?=+=?U S
T U F ?-?=?
第三章 化学平衡 1.基本概念
? 标准平衡常数的表达式 ? 标准生成吉布斯能
? 有凝聚相参加的气体反应、分解压的概念 2.平衡常数的表达
? 理想气体的标准平衡常数:
标准平衡常数可认为只是温度的函数,有纯态凝聚相参加的理想气体反应的平衡常数只与反应物
和产物中气体物质有关。(分解压力)
3.基本计算
? 化学等温式:
? 标准生成吉布斯自由能:
?
? 最稳定单质的吉布斯能为零。
? 各种因素对化学平衡的影响(外界条件对平衡的影响 ) *温度对平衡的影响:对吸热反应,?
?m r H >0
,升高温度,?
K 增加,对正反应有利。对放热反
应,?
?m r H <0 ,升高温度,?
K 降低,对正反应有利。
*压力对平衡的影响: 对于反应 aD (l)+e E(g) →g G(s)+h H(g)
?v=(g+h )-(a+e )
当?v >0时,若p 增大,则 减少,增加压力对体积变大的反应不利 当?v<0时,若p 增大,则 增大,增加压力对体积变小反应有利
当?v =0时,若p 增大,则 不变,增加压力对平衡没有影响
*惰性气体对平衡的影响:在总压一定的条件下,加入惰性气体实际起到了稀释的作用,它和减少系
反应向右自发进行
?
m r p
G Q K 反应向左自发进行
>?
G Q K 反应达平衡
=?=?
m r p
G Q K 反应向左自发进行 0
>?
G Q K 反应达平衡 0
=?=?
m r p
G Q K D E G H d e g h ++→+
+?
?=???
??e E d D h H G )()()()(eq g eq eq eq p p p p p p p p K p
m r Q
RT K RT G ln ln +-=??
?
?
-=?K
RT G m
r ln )
/exp(RT G K m r ?
??-=
??m
G f ∑∑∑?
??????=?B
f B f B f B r B)(B)(r B)(p m m m m G G G G ν=-反应物
产物)
/exp(RT G K m
r ?
?
?-=?
?-=?K RT G m r ln
统总压的效果相同。
惰性气体:不参与反应的其它气体 (如合成NH 3加入CH 4,SO 2氧化加入N 2 ) 影响:总压一定时,加入惰性气体降低反应气体分压(稀释),其效果相当与降低了总压
即:?V >0反应 加入惰性气体, Kx ↑
?V =0反应 加入惰性气体, 无影响 ?V <0反应 加入惰性气体, Kx ↓
第四章 相平衡
1.基本概念
? 物种数:平衡体系中所含的化学物质数,S 表示;
? 独立组分数:足以表示体系中所有各相组成所需的最少物种数,称独立组分数或组
分数。符号K 表示。独立化学平衡数:R
? 浓度控制条件:R’(注意:浓度限制条件只在同一相中方才能成立,在不同相之间,
浓度限制条件不成立. )
? 自由度: 在一平衡体系中,不发生相变的条件下(无旧相消失和新相生成),在一定范围内可以任
意改变的可变因素(温度、压力、浓度等强度因素)的最多数目. 称 为自由度。用符号f 表示 ? 相(phase ) 体系内部物理和化学性质完全均匀的部分称为相。体系中相的总数称为相数。 ? 组分数=物种数-独立的化学平衡数-独立的浓度限制条件(K=S-R-R’) ? 相点
? 物系点:系统物质的总组成点(不管相的存在状态) 2.基本理论
? 相律的表达及应用:
表达式: f = K -Φ + 2(自由度=组分数-相数+环境因素)
若指定了温度或者压力(只考虑温度和压力):f* = K -Φ + 1
? 完全互溶双液系相图(最低恒沸点,最高恒沸点)
完全互溶双液体系T -x 图的分析(相图上点,线,面的分析,相律的应用等)——书上P 123-125
? 简单低共熔相图在药学中的应用举例P 139
1.利用熔点变化检查样品纯度;
2.药物的配伍及防冻制剂;
3.改良剂型增进药效;
4.结晶与蒸馏的综合利用。
3.基本计算
? 完全互溶双液体系T -x 图的分析(相图上点,线,面的分析,相律的应用等);书上P 123-125 ? 杠杆规则及应用;P 125
简单低共熔相图的分析(相图上点,线,面的分析,相律的应用等)P 136 冷却曲线、最低共熔点的概念
l g CD CE
n n ?=?
第五章 电化学
1.基本概念
? 两类导体(离子导体、电子导体):
第一类导体:依靠电子的定向迁移来导电,又称电子导体,如金属、石墨等。
主要特征:温度升高,导电能力下降
第二类导体:依靠离子的定向迁移来导电,又称离子导体,如电解质溶液或熔融电解质等。
主要特征:温度升高,导电能力增强
? 两类装置(电解池、原电池):
电解池:电能转化为化学能的电化学装置 原电池:化学能转化为电能的电化学装置
电解池和原电池均由电极和电解质溶液组成
? 正极、负极;阳极、阴极定义:
阳极:发生氧化反应的电极 阴极:发生还原反应的电极
正极:电势高的电极
负极:电势低的电极 ? 电导,电导率,摩尔电导率
(1.电导G ——电阻的倒数,G =1/R ,电导的单位:S (西门子 )或Ω-1(姆欧) 均匀导体的电导与导体的截面积A 成正比,与导体的长度成反比。
(2.电导率κ——电阻率的倒数,单位:S ?m -1
物理意义:相距1 m 、截面积为1 m2的两平行电极间放置1 m3电解质溶液时所具有的电导。 (3.摩尔电导率
1. 定义:相距为1 m 的两平行电极间放置含有1 mol 电解质的溶液所具有的电导。
2. 符号:Λm
3. 单位:
4.摩尔电导率与电导率的关系:
注意:1. c 的单位为mol·m -3
2. 用Λm 比较不同类型电解质的导电能力时,必须在荷电量相同的基础上进行。
2.基本理论 法拉第定律:
摩尔电导率和浓度的关系:
电解质溶液的摩尔电导率,随溶液的稀释而增加。对强电解质而言,当浓度达到极稀时,摩尔电导率接近一定值。 Λm 与c 之间符合经验关系: ∞m Λ是电解质的无限稀释摩尔电导率,可由直线外推法求得。弱电解质的Λm 与c 之间不存在上述关系。
? 强电解质理论
? 电极的极化(原电池和电解池的极化曲线)
电化学约定
物理学约定
1
2mol m S -??c
κ
V Λ==m m κQ nzF
=)
1(m
m c ΛΛβ-=∞1+
def =
() a a a νννννν+--
-+±+1def ()νννγγγ+--
+±ννν+-1def ()
νννγγγ+--+±1 def ()
m m m νν
ν+--+
±
B
a a a
a
ννν+--
+
±
==ν
γ)(?±±
=m
m B
m m ννννν/1)(--
++±=
?
3.基本计算
? 可逆电池的热力学:
?
?
?
?
? 电池的书写方式;电极反应,电池反应; ? 各种热力学函数和电动势之间的关系; ?
第六章 化学动力学 1.基本概念
? 反应速率的表达 ? 基元反应
? 总包反应(复杂反应) ? 反应分子数(基元反应) ? 反应速率常数
? 反应级数:在具有反应物浓度幂乘积形式的速率方程中,各反应物浓度幂中的指数,称为反应物的级数,所有反应物的级数之和称为该反应的总级数。 2.基本理论
? 质量作用定律(对基元反应而言) ? 催化反应及催化剂的特点
? 溶液中的反应(离子强度对反应速率的影响) 3.基本计算
? 具有简单级数反应的特点,积分式,微分式 ? 温度对反应速率的影响:(阿仑尼乌斯方程的几种表达及应用,活化能的计算等)
B
m m ννννν/1)(-
-++±=r m p
E H zE
F zFT T ????=-+ ?
???r m
p
E S z
F T ????= ?
???R p
E Q zFT T ???
= ?
???F
zE G zEF G m
r m r ?
?
-=?-=? b
B
a A h H
g G a a a a Ln zF RT E E -=0O
O O -
+-+-=-=????E E
A : 指前因子或频率因子;E a: 实验活化能或表观活化能, 简称活化能。
上式可表达为对数形式:
还可表达为:
或
说明:
(1) 阿仑尼乌斯公式最初是从气相反应中总结出来的, 后来发现它也 适用于液相反应或复相催化反应;
(2) 阿仑尼乌斯公式既适用于基元反应, 也适用于一些具有反应物浓度幂乘积形式的总包反应。
? 活化能
第七章 表面现象
1.基本概念
? 比表面和分散度
? 表面吉布斯能,比表面吉布斯能 ? 表面张力
? 弯曲表面下的附加压力 ? 毛细现象
? 溶液的表面吸附
? 表面张力等温线(表面非活性和表面活性物质) ? 正吸附和负吸附 ? 吉布斯公式: ? 表面活性剂(定义、种类)
?
第八章 胶体
? 溶胶的电学性质:
1.电泳:胶粒在电场中运动
2. 电渗:介质在电场中运动
3. 流动电势:使介质移动,产生电场
4. 沉降电势:使胶粒移动,产生电场
电动现象说明:溶胶质点与介质分别带电,在电场中发生移动,或移动时产生电场 ? 溶胶的电动现象;溶胶粒子表面电荷来源 ? 溶胶的稳定性
? 胶团的结构,稳定剂的影响
? 聚沉,聚沉值和聚沉能力的大小判断
第九章 大分子溶液
? 大分子溶液和小分子溶液及溶胶的区别
???
??-?=RT E A k a exp A RT E k ln ln a
+-=???? ??--=12a 1211ln T T R E k k 2
a d dln RT E T k =a
E
Q ?=T c RT c Γ????
????-=B B σ表面活度 T c ???? ????B σ
大学物理化学公式集
电解质溶液 法拉第定律:Q =nzF m = M zF Q dE r U dl ++ = dE r U dl --= t +=-+I I =-++r r r +=-+U U U ++=∞∞ +Λm ,m λ=() F U U F U ∞∞+∞+-+ r +为离子移动速率,U +( U -)为正(负)离子的电迁移率(亦称淌度)。 近似:+∞+≈,m ,m λλ +∞ +≈,m ,m U U m m Λ≈Λ∞ (浓度不太大的强电解质溶液) 离子迁移数:t B = I I B =Q Q B ∑B t =∑+t +∑-t =1 电导:G =1/R =I/U =kA/l 电导率:k =1/ρ 单位:S ·m -1 莫尔电导率:Λm =kV m =k/c 单位S ·m 2·mol -1 cell l R K A ρ ρ== cell 1K R kR ρ== 科尔劳乌施经验式:Λm =() c 1 m β-∞Λ 离子独立移动定律:∞Λm =()m,m,+U U F λλ∞∞∞∞ +-- +=+ m U F λ∞∞+,+= 奥斯特瓦儿德稀释定律:Φc K =() m m m 2 m c c ΛΛΛΛ∞∞Φ - 平均质量摩尔浓度:±m =() v 1v v m m - - ++ 平均活度系数:±γ=() 1v v -- +γγ+ 平均活度:±a =() v 1v v a a - - ++=m m γ± ± Φ 电解质B 的活度:a B =v a ±=v m m ?? ? ??Φ±±γ +v v v B + a a a a ± -- == m +=v +m B m -=v -m B ( ) 1 v v v B m v v m +±+-- = 离子强度:I = ∑i 2i i z m 21 德拜-休克尔公式:lg ±γ=-A|z +z --|I
北京理工大学物理化学A(南大版)上册知识点总结
物理化学上册公式总结 第一章.气体 一、理想气体适用 ①波义耳定律:定温下,一定量的气体,其体积与压力成反比 pV=C ②盖·吕萨克定律:对定量气体,定压下,体积与T成正比 V t=C`T ③阿伏伽德罗定律:同温同压下,同体积的各种气体所含分子数相同。 ④理想气体状态方程式 pV=nRT 推导:气体体积随压力温度和气体分子数量改变,即: V=f(p,T,N) 对于一定量气体,N为常数dN=0,所以 dV=(?V/?p)T,N dp+(?V/?T)p,N dT 根据波义耳定律,有V=C/P,∴(?V/?p)T,N=-C/p2=-V/p 根据盖·吕萨克定律,V=C`T,有(?V/?T)p,N=C`=V/T 代入上式,得到 dV/V=-dp/p+dT/T 积分得 lnV+lnp=lnT+常数
若所取气体为1mol,则体积为V m,常数记作lnR,即得 pV m=RT 上式两边同时乘以物质的量n,则得 pV=nRT ⑤道尔顿分压定律:混合气体的总压等于各气体分压之和。 ⑥阿马格分体积定律:在一定温度压力下,混合气体的体积等于组成该气体的各组分分体积之和。 ⑦气体分子在重力场的分布 设在高度h处的压力为p,高度h+dh的压力为p-dp,则压力差为 dp=-ρgdh 假定气体符合理想气体状态方程,则ρ=Mp/RT,代入上式, -dp/p=Mgdh/RT 对上式积分,得lnp/p0=-Mgh/RT ∴p=p0exp(-Mgh/RT) ρ=ρ0exp(-Mgh/RT)或n=n0exp(-Mgh/RT) 二、实际气体适用 ①压缩因子Z Z=pV m/RT 对于理想气体,Z=1,对实际气体,当Z大于1,表明同温度同压力下,实际气体体积大于理想气体方程计算所得结果,即实际气体的可压缩性比理想气体小。当Z小于1,情况则相反。 ②范德华方程式
初中物理化学知识点总结.doc
化学知识点的归纳总结。 一、初中化学常见物质的颜色 (一)、固体的颜色 1、红色固体:铜,氧化铁 2、绿色固体:碱式碳酸铜 3、蓝色固体:氢氧化铜,硫酸铜晶体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫磺 6、无色固体:冰,干冰,金刚石 7、银白色固体:银,铁,镁,铝,汞等金属 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭) 9、红褐色固体:氢氧化铁 10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁 (二)、液体的颜色 11、无色液体:水,双氧水 12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 15、紫红色溶液:高锰酸钾溶液 16、紫色溶液:石蕊溶液 (三)、气体的颜色 17、红棕色气体:二氧化氮 18、黄绿色气体:氯气 19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。 二、初中化学之三 1、我国古代三大化学工艺:造纸,制火药,烧瓷器。 2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化。 3、构成物质的三种微粒:分子,原子,离子。 4、不带电的三种微粒:分子,原子,中子。 5、物质组成与构成的三种说法: (1)、二氧化碳是由碳元素和氧元素组成的; (2)、二氧化碳是由二氧化碳分子构成的; (3)、一个二氧化碳分子是由一个碳原子和一个氧原子构成的。 6、构成原子的三种微粒:质子,中子,电子。 7、造成水污染的三种原因: (1)工业“三废”任意排放, (2)生活污水任意排放 (3)农药化肥任意施放 8、收集方法的三种方法:排水法(不容于水的气体),向上排空气法(密度 比空气大的气体),向下排空气法(密度比空气小的气体)。
大学物理化学主要公式
第一章 气体的pVT 关系 主要公式及使用条件 1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 / y B m,B B * =V ?∑* A V y A m ,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩 尔体积。∑*A A m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上 述各式适用于任意的气体混合物。 (3) V V p p n n y ///B B B B * === 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。* B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律
p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体 V RT n p /B B = 4. 阿马加分体积定律 V RT n V /B B =* 此式只适用于理想气体。 5. 范德华方程 RT b V V a p =-+))(/(m 2m nRT nb V V an p =-+))(/(22 式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。 此式适用于最高压力为几个MPa 的中压范围内实际气体p ,V ,T ,n 的相互计算。 6. 维里方程 ......)///1(3m 2m m m ++++=V D V C V B RT pV 及 ......)1(3'2''m ++++=p D p C p B RT pV 上式中的B ,C ,D,…..及B’,C’,D’….分别称为第二、第三、第四…维里系数,它们皆是与气体种类、温度有关的物理量。 适用的最高压力为1MPa 至2MPa ,高压下仍不能使用。 7. 压缩因子的定义 )/()/(m RT pV nRT pV Z == Z 的量纲为一。压缩因子图可用于查找在任意条件下实际气体的压缩因子。但计算结果常产生较大的误差,只适用于近似计算。 第二章 热力学第一定律
物理化学知识点总结(热力学第一定律)
物理化学知识点总结 (热力学第一定律) -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
热力学第一定律 一、基本概念 1.系统与环境 敞开系统:与环境既有能量交换又有物质交换的系统。 封闭系统:与环境只有能量交换而无物质交换的系统。(经典热力学主要研究的系统) 孤立系统:不能以任何方式与环境发生相互作用的系统。 2.状态函数:用于宏观描述热力学系统的宏观参量,例如物质的量n、温度 T、压强p、体积V等。根据状态函数的特点,我们 把状态函数分成:广度性质和强度性质两大类。 广度性质:广度性质的值与系统中所含物质的量成 正比,如体积、质量、熵、热容等,这种性质的函数具 有加和性,是数学函数中的一次函数,即物质的量扩大 a倍,则相应的广度函数便扩大a倍。 强度性质:强度性质的值只与系统自身的特点有关,与物质的量无关,如温度,压力,密度,摩尔体积等。 注:状态函数仅取决于系统所处的平衡状态,而与此状态的历史过程无关,一旦系统的状态确定,其所有的状态函数便都有唯一确定的值。
二、热力学第一定律 热力学第一定律的数学表达式: 对于一个微小的变化状态为: dU= 公式说明:dU表示微小过程的内能变化,而δQ和δW则分别为微小过程的热和功。它们之所以采用不同的符号,是为了区别dU是全微分,而δQ和δW不是微分。或者说dU与过程无关而δQ和δW却与过程有关。这里的W既包括体积功也包括非体积功。 以上两个式子便是热力学第一定律的数学表达式。它们只能适用在非敞开系统,因为敞开系统与环境可以交换物质,物质的进出和外出必然会伴随着能量的增减,我们说热和功是能量的两种传递形式,显然这种说法对于敞开系统没有意义。 三、体积功的计算 1.如果系统与环境之间有界面,系统的体积变化时,便克服外力做功。将一 定量的气体装入一个带有理想活塞的容器中,活塞上部施加外压。当气体膨胀微小体积为dV时,活塞便向上移动微小距离dl,此微小过程中气
大学物理化学公式大全Word版
热力学第一定律 功:δW =δW e +δW f (1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f =xdy 非膨胀功为广义力乘以广义位移。如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。 热 Q :体系吸热为正,放热为负。 热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。 热容 C =δQ/dT (1)等压热容:C p =δQ p /dT = (?H/?T )p (2)等容热容:C v =δQ v /dT = (?U/?T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差: (1)任意体系 C p —C v =[p +(?U/?V )T ](?V/?T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程: pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=1 1 -γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1 nR -δ(T 1—T 2) 热机效率:η= 2 1 2T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β= 1 21 T T T - 焦汤系数: μJ -T =H p T ???? ????=-()p T C p H ?? 实际气体的ΔH 和ΔU : ΔU =dT T U V ??? ????+dV V U T ??? ???? ΔH =dT T H P ??? ????+dp p H T ???? ???? 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑B B γRT 化学反应热效应与温度的关系:()()()dT B C T H T H 2 1 T T m p B 1m r 2m r ? ∑??,+=γ 热力学第二定律
物理化学知识点(全)
第二章 热力学第一定律 内容摘要 ?热力学第一定律表述 ?热力学第一定律在简单变化中的应用 ?热力学第一定律在相变化中的应用 ?热力学第一定律在化学变化中的应用 一、热力学第一定律表述 U Q W ?=+ d U Q W δδ=+ 适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+? 2、U 是状态函数,是广度量 W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 2、基础公式 热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ 理想气体 ? 状态方程 pV=nRT
? 过程方程 恒温:1122p V p V = ? 恒压: 1122//V T V T = ? 恒容: 1122/ / p T p T = ? 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--= 1111 22 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程 1、 可逆相变化 Q p =n Δ 相变 H m W = -p ΔV 无气体存在: W = 0 有气体相,只需考虑气体,且视为理想气体 ΔU = n Δ 相变 H m - p ΔV 2、相变焓基础数据及相互关系 Δ 冷凝H m (T) = -Δ蒸发H m (T) Δ凝固H m (T) = -Δ熔化H m (T) Δ 凝华 H m (T) = -Δ 升华 H m (T) (有关手册提供的通常为可逆相变焓) 3、不可逆相变化 Δ 相变 H m (T 2) = Δ 相变 H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆; 2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤; 3.除可逆相变化,其余步骤均为简单变化计算. 4.逐步计算后加和。 四、热力学第一定律在化学变化中的应用 1、基础数据 标准摩尔生成焓 Δf H θm,B (T) (附录九) 标准摩尔燃烧焓 Δc H θ m.B (T)(附录十) 2、基本公式 ?反应进度 ξ=△ξ= △n B /νB = (n B -n B.0) /νB ?由标准摩尔生成焓计算标准摩尔反应焓 Δr H θm.B (T)= ΣνB Δf H θ m.B (T) ?由标准摩尔燃烧焓计算标准摩尔反应焓 Δr H θ m.B (T)=-Σ νB Δc H θ m.B (T) (摩尔焓---- ξ=1时的相应焓值) ?恒容反应热与恒压反应热的关系 Q p =Δr H Q v =Δr U Δr H =Δr U + RT ΣνB (g) ?Kirchhoff 公式 微分式 d Δr H θ m (T) / dT=Δr C p.m 积分式 Δr H θm (T 2) = Δr H θ m (T 1)+∫Σ(νB C p.m )dT 本章课后作业: 教材p.91-96(3、4、10、11、16、17、38、20、23、24、28、30、33、34)
(完整版)物理化学界面现象知识点
279 界面现象 1. 表面张力、表面功及表面吉布斯函数 表面张力γ:引起液体或固体表面收缩的单位长度上的力,单位为N·m -1。 表面功:'δ/d r s W A ,使系统增加单位表面所需的可逆功,单位为J·m -2。 表面吉布斯函数:B ,,()(/)s T p n G A α??,恒温恒压下系统增加单位表面时所增加的吉布斯 函数,单位为J·m -2。 表面吉布斯函数的广义定义: B()B()B()B(),,,,,,,,( )()()()S V n S p n T V n T p n s s s s U H A G A A A A ααααγ????====???? ',r s T p s W dA dG dA γδ== 表面张力是从力的角度描述系统表面的某强度性质,而表面功及表面吉布斯函数则是从能量角度和热力学角度描述系统表面的某一性质。三者虽为不同的物理量,但它们的数值及量纲等同的,均可化为N·m -1。 在一定温度、压力下,若系统有多个界面,其总界面吉布斯函数: s i i s i G A γ=∑ 2. 弯曲液面的附加压力、拉普拉斯方程 附加压力:Δp =p 内-p 外 拉普拉斯方程:2p r γ?= 规定弯曲液面凹面一侧压力位p 内,凸面一侧压力位p 外;γ为表面张力;r 为弯曲液面的曲率半径,△p 一律取正值;附加压力方向总指向凹面曲率半径中心。 3. 毛细现象 毛细管内液体上升或下降的高度 2cos h r g γθρ= 式中:γ为表面张力;ρ为液体密度;g 为重力加速度;θ为接触角;r 为毛细管半径。当液体不能润湿管壁,θ>90°即0cos θ<时,h 为负值,表示管内凸液体下降的深度。 4. 微小液滴的饱和蒸汽压——开尔文公式
大学物理化学公式大全
热力学第一定律 功:δW=δW e+δWf (1)膨胀功δWe=p 外 dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f =xdy 非膨胀功为广义力乘以广义位移.如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。 热Q:体系吸热为正,放热为负. 热力学第一定律:△U=Q—W 焓H=U+pV 理想气体得内能与焓只就是温度得单值函数. 热容C=δQ/dT (1)等压热容:C p=δQ p/dT= (?H/?T)p (2)等容热容:Cv=δQ v/dT= (?U/?T)v 常温下单原子分子:C v ,m =C v,m t=3R/2 常温下双原子分子:C v,m=C v ,m t+C v,m r=5R/2 等压热容与等容热容之差: (1)任意体系C p -Cv=[p+(?U/?V)T](?V/?T)p (2)理想气体Cp—C v=nR 理想气体绝热可逆过程方程: pVγ=常数TVγ-1=常数p1-γTγ=常数γ=Cp/ C v 理想气体绝热功:W=C v(T1—T2)=(p1V1—p2V2) 理想气体多方可逆过程:W=(T 1 -T2) 热机效率:η= 冷冻系数:β=-Q1/W 可逆制冷机冷冻系数:β= 焦汤系数: μJ- T ==- 实际气体得ΔH与ΔU: ΔU=+ΔH=+ 化学反应得等压热效应与等容热效应得关系:Q p=Q V+ΔnRT 当反应进度ξ=1mol时,Δr H m=ΔrUm+RT 化学反应热效应与温度得关系: 热力学第二定律 Clausius不等式: 熵函数得定义:dS=δQ R /TBoltzman熵定理:S=klnΩ Helmbolz自由能定义:F=U-TS Gibbs自由能定义:G=H-TS 热力学基本公式: (1)组成恒定、不作非膨胀功得封闭体系得热力学基本方程:dU=TdS-pdVdH=TdS+Vdp dF=—SdT-pdV dG=-SdT+Vdp (2)Maxwell关系: ==- (3)热容与T、S、p、V得关系: CV=T C p =T Gibbs自由能与温度得关系:Gibbs-Helmholtz公式=-
(完整版)生物化学知识点重点整理
一、蛋白质化学 蛋白质的特征性元素(N),主要元素:C、H、O、N、S,根据含氮量换算蛋白质含量:样品蛋白质含量=样品含氮量*6.25 (各种蛋白质的含氮量接近,平均值为16%), 组成蛋白质的氨基酸的数量(20种),酸性氨基酸/带负电荷的R基氨基酸:天冬氨酸(D)、谷氨酸(E); 碱性氨基酸/带正电荷的R基氨基酸:赖氨酸(K)、组氨酸(H)、精氨酸(R) 非极性脂肪族R基氨基酸:甘氨酸(G)、丙氨酸(A)、脯氨酸(P)、缬氨酸(V)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M); 极性不带电荷R基氨基酸:丝氨酸(S)、苏氨酸(T)、半胱氨酸(C)、天冬酰胺(N)、谷氨酰胺(Q); 芳香族R基氨基酸:苯丙氨酸(F)、络氨酸(Y)、色氨酸(W) 肽的基本特点 一级结构的定义:通常描述为蛋白质多肽链中氨基酸的连接顺序,简称氨基酸序列(由遗传信息决定)。维持稳定的化学键:肽键(主)、二硫键(可能存在), 二级结构的种类:α螺旋、β折叠、β转角、无规卷曲、超二级结构, 四级结构的特点:肽键数≧2,肽链之间无共价键相连,可独立形成三级结构,是否具有生物活性取决于是否达到其最高级结构 蛋白质的一级结构与功能的关系:1、蛋白质的一级结构决定其构象 2、一级结构相似则其功能也相似3、改变蛋白质的一级结构可以直接影响其功能因基因突变造成蛋白质结构或合成量异常而导致的疾病称分子病,如镰状细胞贫血(溶血性贫血),疯牛病是二级结构改变 等电点(pI)的定义:在某一pH值条件下,蛋白质的净电荷为零,则该pH值为蛋白质的等电点(pI)。 蛋白质在不同pH条件下的带电情况(取决于该蛋白质所带酸碱基团的解离状态):若溶液pH
物理化学重点超强总结归纳
第一章热力学第一定律 1、热力学三大系统: (1)敞开系统:有物质和能量交换; (2)密闭系统:无物质交换,有能量交换; (3)隔绝系统(孤立系统):无物质和能量交换。 2、状态性质(状态函数): (1)容量性质(广度性质):如体积,质量,热容量。 数值与物质的量成正比;具有加和性。 (2)强度性质:如压力,温度,粘度,密度。 数值与物质的量无关;不具有加和性,整个系统的强度性质的数值与各部分的相同。 特征:往往两个容量性质之比成为系统的强度性质。 3、热力学四大平衡: (1)热平衡:没有热隔壁,系统各部分没有温度差。 (2)机械平衡:没有刚壁,系统各部分没有不平衡的力存在,即压力相同 (3)化学平衡:没有化学变化的阻力因素存在,系统组成不随时间而变化。 (4)相平衡:在系统中各个相(包括气、液、固)的数量和组成不随时间而变化。 4、热力学第一定律的数学表达式: ?U = Q + W Q为吸收的热(+),W为得到的功(+)。
12、在通常温度下,对理想气体来说,定容摩尔热容为: 单原子分子系统 ,V m C =32 R 双原子分子(或线型分子)系统 ,V m C =52R 多原子分子(非线型)系统 ,V m C 6 32 R R == 定压摩尔热容: 单原子分子系统 ,52 p m C R = 双原子分子(或线型分子)系统 ,,p m V m C C R -=,72 p m C R = 多原子分子(非线型)系统 ,4p m C R = 可以看出: ,,p m V m C C R -= 13、,p m C 的两种经验公式:,2p m C a bT cT =++ (T 是热力学温度,a,b,c,c ’ 是经 ,2' p m c C a bT T =++ 验常数,与物质和温度范围有关) 14、在发生一绝热过程时,由于0Q δ=,于是dU W δ= 理想气体的绝热可逆过程,有:,V m nC dT pdV =- ? 22 ,11 ln ln V m T V C R T V =- 21,12ln ,ln V m p V C Cp m p V ?= ,,p m V m C pV C γγ=常数 =>1. 15、-焦耳汤姆逊系数:J T T =( )H p μ??- J T μ->0 经节流膨胀后,气体温度降低; J T μ-<0 经节流膨胀后,气体温度升高; J T μ-=0 经节流膨胀后,气体温度不变。 16、气体的节流膨胀为一定焓过程,即0H ?=。 17、化学反应热效应:在定压或定容条件下,当产物的温度与反应物的温度相同而在反应过程中只做体积功不做其他功时,化学反应所 吸收或放出的热,称为此过程的热效应,或“反应热”。 18、化学反应进度:()()() n B n B B ξ ν-= 末初 (对于产物v 取正值,反应物取负值) 1ξ=时,r r m U U ξ ??= ,r r m H H ξ ??= 19、(1)标准摩尔生成焓(0 r m H ?):在标准压力和指定温度下,由最稳定的单质生成单位物质的量某物质的定压反应热,为该物质的 标准摩尔生成焓。 (2)标准摩尔燃烧焓(0 c m H ?):在标准压力和指定温度下,单位物质的量的某种物质被氧完全氧化时的反应焓,为该物质的标 准摩尔燃烧焓。 任意一反应的反应焓0 r m H ?等于反应物燃烧焓之和减去产物燃烧焓之和。 20、反应焓与温度的关系-------基尔霍夫方程
大学物理化学必考公式总结
物理化学期末重点复习资料
热力学第一定律 功:δW =δW e +δW f (1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f =xdy 非膨胀功为广义力乘以广义位移。如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。 热 Q :体系吸热为正,放热为负。 热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。 热容 C =δQ/dT (1)等压热容:C p =δQ p /dT = (?H/?T )p (2)等容热容:C v =δQ v /dT = (?U/?T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差: (1)任意体系 C p —C v =[p +(?U/?V )T ](?V/?T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程: pV γ=常数 TV γ-1=常数 p 1-γT γ =常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=1 1 -γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1 nR -δ(T 1—T 2) 热机效率:η= 2 1 2T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=1 21T T T - 焦汤系数: μ J -T =H p T ???? ????=-()p T C p H ?? 实际气体的ΔH 和ΔU : ΔU =dT T U V ??? ????+dV V U T ??? ???? ΔH =dT T H P ??? ????+dp p H T ???? ? ??? 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑B B γRT 化学反应热效应与温度的关系:()()()dT B C T H T H 2 1 T T m p B 1m r 2m r ? ∑??,+=γ 热力学第二定律
初三物理化学中考知识点
园丁教育培训中心初三物理化学知识手册 姓名_________________ 年级_________________ 园丁教育王老师制作
化学部分 一、物质的学名、俗名及化学式 1、单质:金刚石、石墨、炭黑: C 汞、水银:Hg 硫、硫磺:S 2、氧化物:固体二氧化碳、干冰:CO2 氧化钙、生石灰:CaO 氧化铁、铁锈的主要成份:Fe2O3 3、酸:盐酸:HCI的水溶液碳酸(汽水):H2CO3 4、碱:氢氧化钠、苛性钠、火碱、烧碱:NaOH 氢氧化钙、熟石灰、消石灰:Ca(OH)2 氨水、一水合氨:NH3H2O (为常见的碱,具有碱的通性,是一种不含金属离子的碱) 5、盐:碳酸钠、苏打、纯碱(不是碱,是盐):Na2CO3, 碳酸钠晶体、纯碱晶体N32CO3 1OH2O 碳酸氢钠、小苏打:NaHCO3 大理石,石灰石的主要成份是CaCO3 食盐的主要成分是NaCI 亚硝酸钠、工业用盐:NaNO2 (有毒) 硫酸铜晶体、胆矶、蓝矶:CuSO4 5H2O 碳酸钾、草木灰的主要成份:K2CO3 碱式碳酸铜、铜绿、孔雀石:Cu2(OH)2CO3 (分解生成三种氧化物的物质) 6、有机物:甲烷、CNG、沼气、天然气的主要成份:CH4 乙醇、酒精:C2H5OH 葡萄糖:C6H12O6 甲醇:CH3OH 有毒、致失明、死亡 乙酸、醋酸(16.6 'C冰醋酸)CH3COOH (具有酸的通性) 二、常见物质的颜色和状态 1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH) 2、KCIO 3、KCI、Na2CO3、NaCI、无水 CuSO4、铁、镁为银白色(汞为银白色液态) 2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4 ▲KMnO 4为紫黑色 3、红色固体:Cu、Fe2O3、HgO、红磷▲ Fe(OH)3为红褐色 4、蓝色固体:硫酸铜晶体(胆矶)、氢氧化铜 ▲硫:淡黄色▲ 碱式碳酸铜CU2(OH)2CO3为绿色 5、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,高锰酸钾溶液为紫红色;其余溶液一般无色。 6、沉淀(即不溶于水的盐和碱):
物理化学上册知识点总结
1 第一章:气体 1、掌握理想气体的状态方程( )及分压力、分体积等概念,会进行简单计算 2、理解真实气体与理想气体的偏差及原因,了解压缩因子Z 的定义及数值大小的意义,熟悉范德华方程(理想气体基础上引入压力、体积修正项) 第二章:热力学第二定律;第三章:热力学第三定律 1、系统性质(广度、强度性质) 2、状态函数特性(如:异途同归,值变相等;周而复始,数值还原及在数学上具有全微分的性质等) 3、热力学第一定律:ΔU =Q+W (Q 、W 取号的规定及各种过程对应计算) 4、恒容热、恒压热及之间的关系式,能进行简单计算,掌握焓的定义式,会应用赫斯定律 5、掌握各种不同过程的热力学函数计算(单纯PVT 变化时自由膨胀、等温、等压、等容及绝热可逆或不可逆等过程的U 、H 、A 、G 、S 等函变以及正常、非正常相变过程焓变、吉布斯函变和熵变计算(状态函数法) 6、理解理想气体的一些性质(如U 、H 仅为温度函数、Cp 与Cv 的差值及单原子、双原子理想气体的C V ,m 和绝热可逆过程过程方程式等)、实际气体—节流膨胀过程(等焓过程,了解焦-汤系数等) 7、反应进度 8、如何由标准摩尔生成焓、燃烧焓计算标准摩尔反应焓变以及相关规定 9、反应焓变与温度的关系(基尔霍夫定律) 10、自发过程及其共同特征;热力学第二定律文字描述 11、卡诺循环、卡诺定理、热机效率;熵的定义式及克劳修斯不等式 12、判断过程可逆性及自发变化方向的各种判据 13、了解热力学第三定律,掌握根据规定熵、标准摩尔生成焓、标准摩尔生成吉布斯函变计算化学变化过程中对应函数的变化值 14、热力学函数间的关系及麦克斯韦关系式的应用(应用于各函数间的相互计算以及一些证明),了解各函数特征变量 15、了解Clapeyron 方程,掌握Clausius-Clapeyron 方程各种形式 第四章:多组分系统热力学及其在溶液中的应用 1、 熟悉偏摩尔量、化学势表示,了解偏摩尔量加和公式和吉布斯-杜亥姆公式,掌握相平衡、 化学平衡条件 2、 了解各种不同情况化学势的表达式,假想标准态等概念 3、 掌握稀溶液中两个经验定律:拉乌尔、亨利定律表达式及简单计算 4、 掌握理想液态混合物的通性 5、了解依数性的一些结论 第五章:化学平衡 1、会表示任意化学反应的标准平衡常数、其它各种平衡常数,并能相互换算 2、熟悉化学反应等温方程,并能应用其判断反应方向 3、掌握范特霍夫方程各种形式并进行相关计算 4、了解温度、压力等各种因素对化学平衡影响的相关结论 5、掌握使用标准平衡常数定义式以及热力学相关公式进算平衡组成的计算。 第六章:相平衡(相图分析) 1、掌握相律的形式并会计算其中各个量 2、杠杆规则、对拉乌尔定律发生正负偏差,从而相图上出现最高、最低点、恒沸混合物、蒸馏或精馏基本原理等(完全互溶双液系) 4、、能看懂相图并会使用相律分析相图,并绘制步冷曲线(如较复杂的低共熔二元相图、形成化合物系统及固态部分互溶的二组分相图) pV nRT
大学物理化学公式集[整理版]9页word文档
大学物理化学公式集 热力学第一定律 热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。 热容 C =δQ/dT (1)等压热容:C p =δQ p /dT = (?H/?T )p (2)等容热容:C v =δQ v /dT = (?U/?T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差: (1)任意体系 C p —C v =[p +(?U/?V )T ](?V/?T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程: pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=1 1 -γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1 nR -δ(T 1—T 2) 热机效率:η= 2 1 2T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=1 21 T T T - 实际气体的ΔH 和ΔU : ΔU =dT T U V ??? ????+dV V U T ??? ???? ΔH =dT T H P ??? ????+dp p H T ???? ???? 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑B B γRT 化学反应热效应与温度的关系:()()()dT B C T H T H 2 1 T T m p B 1m r 2m r ? ∑??,+=γ 热力学第二定律 Clausius 不等式:0T Q S B A B A ≥?∑ →δ— 熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:A =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:
物理化学知识点归纳77421
110112班期末物理化学知识点归纳 预祝大家物化期末考试取得好成绩! ——孔祥鑫 2012年5月27日第二章热力学第一定律 一、热力学基本概念 1.状态函数 状态函数,是指状态所持有的、描述系统状态的宏观物理量,也称为状态性质或状态变量.系统有确定的状态,状态函数就有定值;系统始、终态确定后,状态函数的改变为定值;系统恢复原来状态,状态函数亦恢复到原值。 2.热力学平衡态 在指定外界条件下,无论系统与环境是否完全隔离,系统各个相的宏观性质均不随时间发生变化,则称系统处于热力学平衡态。热力学平衡须同时满足平衡(△T=0)、力平衡(△p=0)、相平衡(△μ=0)和化学平衡(△G=0)4个条件。 二、热力学第一定律的数学表达式 1。△U=Q+W 或dU=ΔQ+δW=δQ-p amb dV+δW` 规定系统吸热为正,放热为负。系统得功为正,对环境做功为负。式中p amb为环境的压力,W`为非体积功。上式适用于封闭系统的一切过
程。 2.体积功的定义和计算 系统体积的变化而引起的系统和环境交换的功称为体积功。其定义式为: δW=—p amb dV (1)气体向真空膨胀时体积功所的计算 W=0 (2)恒外压过程体积功 W=p amb(V1—V2)=—p amb△V 对于理想气体恒压变温过程 W=-p△V=—nR△T (3)可逆过程体积功 W r=?2 1p V V dV (4)理想气体恒温可逆过程体积功 W r=?2 1p V V dV=—nRTln(V1/V2)=—nRTln(p1/p2)(5)可逆相变体积功 W=—pdV 三、恒热容、恒压热,焓 1。焓的定义式 H def U + p V 2.焓变
大学物理化学知识整理
第一章 理想气体 1、理想气体:在任何温度、压力下都遵循PV=nRT 状态方程的气体。 2、分压力:混合气体中某一组分的压力。在混合气体中,各种组分的气体分子分别占有相同的体积(即容器的总空间)和具有相同的温度。混合气体的总压力是各种分子对器壁产生撞击的共同作用的结果。每一种组分所产生的压力叫分压力,它可看作在该温度下各组分分子单独存在于容器中时所产生的压力B P 。 P y P B B =,其中∑=B B B B n n y 。 分压定律:∑=B B P P 道尔顿定律:混合气体的总压力等于与混合气体温度、体积相同条件下各组分单独存在时所产生的压力的总和。 ∑=B B V RT n P ) /( 3、压缩因子Z Z=)(/)(理实m m V V 4、范德华状态方程 RT b V V a p m m =-+ ))((2 nRT nb V V an p =-+))((22 5、临界状态(临界状态任何物质的表面张力都等于0) 临界点C ——蒸气与液体两者合二为一,不可区分,气液界面消失; 临界参数: (1)临界温度c T ——气体能够液化的最高温度。高于这个温度,无论如何加压 气体都不可能液化; (2)临界压力c p ——气体在临界温度下液化的最低压力; (3)临界体积c V ——临界温度和临界压力下的摩尔体积。 6、饱和蒸气压:一定条件下,能与液体平衡共存的它的蒸气的压力。取决于状
态,主要取决于温度,温度越高,饱和蒸气压越高。 7、沸点:蒸气压等于外压时的温度。 8、对应状态原理——处在相同对比状态的气体具有相似的物理性质。 对比参数:表示不同气体离开各自临界状态的倍数 (1)对比温度c r T T T /= (2)对比摩尔体积c r V V V /= (3)对比压力c r p p p /= 9、r r r c r r r c c c T V p Z T V p RT V p Z =?= 10、压缩因子图:先查出临界参数,再求出对比参数r T 和r p ,从图中找出对应的Z 。 11、阿玛格定律:B B Vy V = p RT n V B B /= 12、单原子理想气体 R C m p 25,= ,双原子理想气体R C m p 27,= 第二章 热力学第一定律 1、热力学第一定律:自然界一切物体都具有能量,能量有各种不同形式,它能从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转化和传递过程中能量的总和不变,△U=Q+W (适用于非开放系统)。 2、 广度性质(有加和性):U,H,S,G,A,V 系统的某一性质等于各部分该性质之和 强度性质(无加和性):P,T 系统中不具加和关系的性质 3、恒容热:U Q v ?=(dV=0,W ’=0) 恒压热:H Q p ?=(dP=0,W ’=0),非体积功不为0时'W H Q p -?=
硅物化知识点整理
第一章相平衡习题与解答1. 解释下列名词:凝聚系统,介稳平衡,低共熔点,双升点,双降点,马鞍点,连线规则,切线规则,三角形规则,重心规则。 解:凝聚系统:不含气相或气相可以忽略的系统。 介稳平衡:即热力学非平衡态,能量处于较高状态,经常出现于硅酸盐系统中。 低共熔点:是一种无变量点,系统冷却时几种晶相同时从熔液中析出,或加热时同时融化。 双升点:处于交叉位的单转熔点。 双降点:处于共轭位的双转熔点。 马鞍点:三元相图界线上温度最高点,同时又是二元系统温度的最低点。 连线规则:将一界线(或其延长线)与相应的连线(或其延长线)相交,其交点是该界线上的温度最高点。 切线规则:将界线上某一点所作的切线与相应的连线相交,如交点在连线上,则表示界线上该处具有共熔性质;如交点在连线的延长线上,则表示界线上该处具有转熔性质,远离交点的晶相被回吸。 三角形规则:原始熔体组成点所在副三角形的三个顶点表示的物质即为其结晶产物;与这三个物质相应的初初晶区所包围的三元无变量点是其结晶结束点。 重心规则:如无变点处于其相应副三角形的重心位,则该无变点为低共熔点:如无变点处于其相应副三角形的交叉位,则该无变点为单转熔点;如无变点处于其相应副三角形的共轭位,则该无变点为双转熔点。 2、在三元系统的相图分析中,切线规则与连线规则分别是如何在相图中应用的?分析两个规则的应用原理与范围。 解:切线规则用在判断三元系统相图中,各界线的性质即界线上的任一点在析晶过程中发生什么反应,是一致熔过 程还是转熔过程。 过界线上任一点切线,与对应的连线相 交,则是低共熔过程。与延长线相交, 为转熔过程。连线规则用在判断三元系 统相图中,各界线上的温度变化。即连 线与相应界线相交,交点是连线上的温 度最低点,又是界线上的温度最高点。 4. SiO2具有很高的熔点,硅酸盐玻璃的 熔制温度也很高。现要选择一种氧化物 与SiO2在800℃的低温下形成均一的 二元氧化物玻璃,请问,选何种氧化 物?加入量是多少? 解:根据Na2O-SiO2系统相图可知最 低共熔点为799℃。故选择Na2O能与 SiO2在800℃的低温下形成均一的二 元氧化物玻璃。 10.相律应用必须注意哪几点? 答:(1)相律是根据热力学平衡条件推 导而得,因而只能处理真实的热力学平 衡体系。 (2)相律表达式中的“2”是代表外 界条件温度和压强。如果电场、磁场或 重力场对平衡状态有影响,则相律中的 “2”应为“3”、“4”、“5”。如果 研究的体系为固态物质,可以忽略压强 的影响,相律中的“2”应为“1”。 (3)必须正确判断独立组分数、独 立化学反应式、相数以及限制条件数, 才能正确应用相律。 (4)自由度只取“0”以上的正值。 如果出现负值,则说明体系可能处于非 平衡态。 12.淬冷法的最大优点有哪些?适用的 对象是什么? 答:最大优点:准确度高。因为长时间 保温较接近平衡状态,淬冷后在室温下 又可对试样中平衡共存的相数、各相的 组成、形态和数量直接进行测定。 适用对象:适用于相变速度慢的系 统,如果快则在淬冷时发生相变。 14.稳定相与介稳相的区别是什么? 答:(1) 每一个稳定相有一个稳定存在 的温度范围,超过这个范围就变成介稳 相。 (2) 在一定温度下,稳定相具有最 小蒸汽压。 (3) 介稳相有向稳定相转变的趋 势,但从动力学角度讲,转变速度很慢, 能长期保持自己的状态。 15.在耐火材料硅砖的生产中,为什么 鳞石英含量越多越好,而方石英越少越 好? 答:石英、鳞石英和方石英三种变体的 高低温型转变中,方石英?V变化最 大,石英次之,而鳞石英最小。如果制 品中方石英含量大,则在冷却到低温 时,由于α-方石英转变成β -方石英有 较大的体积收缩而难以获得致密的硅 砖制品。 16.三元系统组成的表示方法?在三元 系统组成中有哪些关系? 答:表示方法:在三元系统中用等边三 角形来表示组成。 关系:⑴等含量规则;⑵定比例规 则;⑶杠杆规则;⑷重心规则;⑸交叉 位置规则;⑹共轭位置规则。 17.在三元系统中有哪几条重要规则? 它们的用途和定义分别是什么? 答:⑴连线规则: 用途:用来判断界线的温度走向。 定义:将界线(或延长线)与相应的 连线相交,其交点是该界线上的温度最 高点;温度走向是背离交点。 ⑵切线规则: 用途:用于判断三元相图上界线的性 质。 定义:将界线上的某一点所作的切线 与相应的组成的连线相交,如交点在连 线上,则表示界线上该处具有共熔性 质;如交点在连线的延长线上,则表示 界线上该处具有转熔性质,远离交点的 晶相被回吸。 ⑶重心规则: 用途:用于判断无变量点的性质。
