化学第三章知识点总结
第三章金属及其化合物知识点总结及方程式
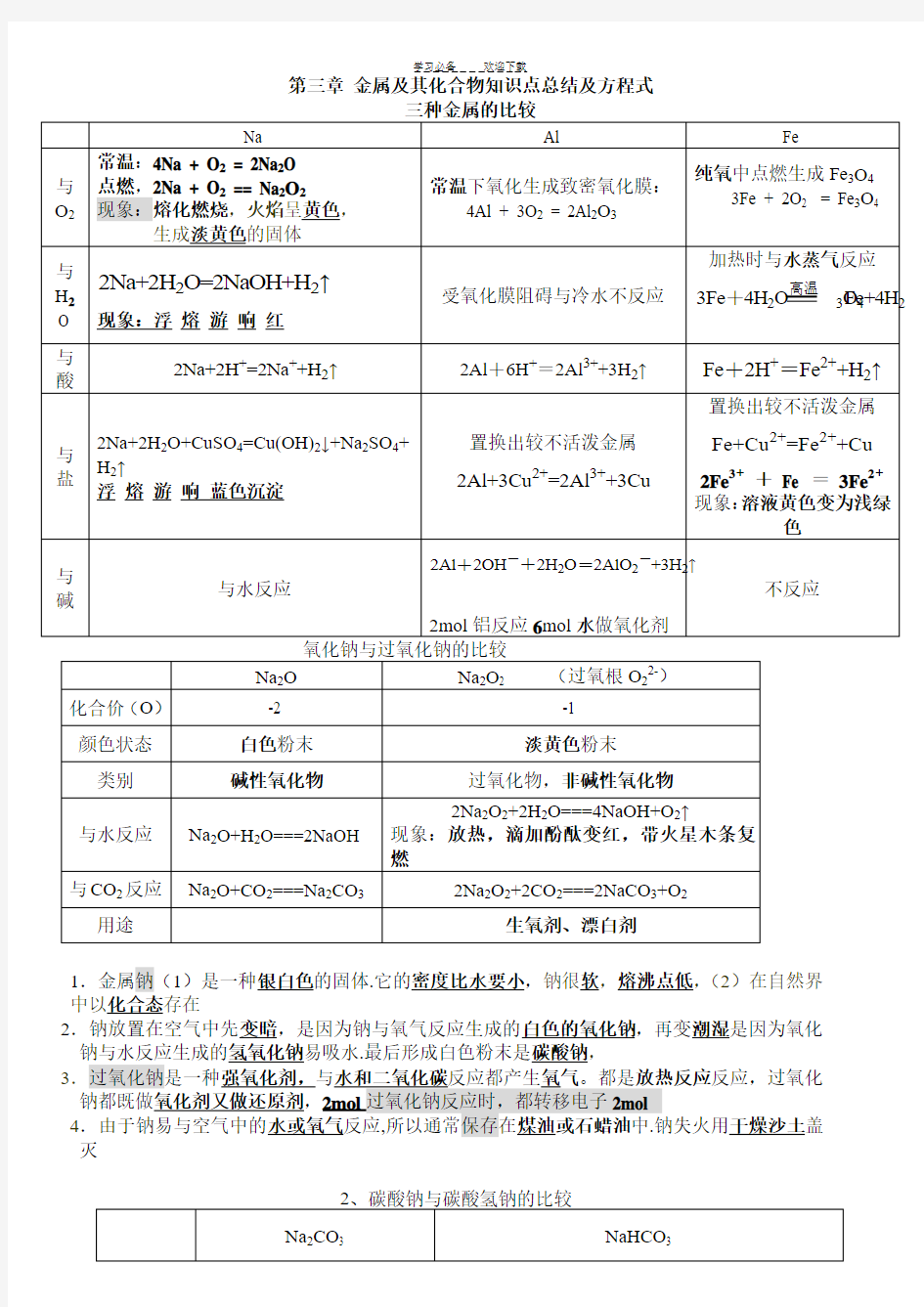
1.金属钠(1)是一种银白色的固体.它的密度比水要小,钠很软,熔沸点低,(2)在自然界中以化合态存在
2.钠放置在空气中先变暗,是因为钠与氧气反应生成的白色的氧化钠,再变潮湿是因为氧化3反应,过氧化4钠失火用干燥沙土盖
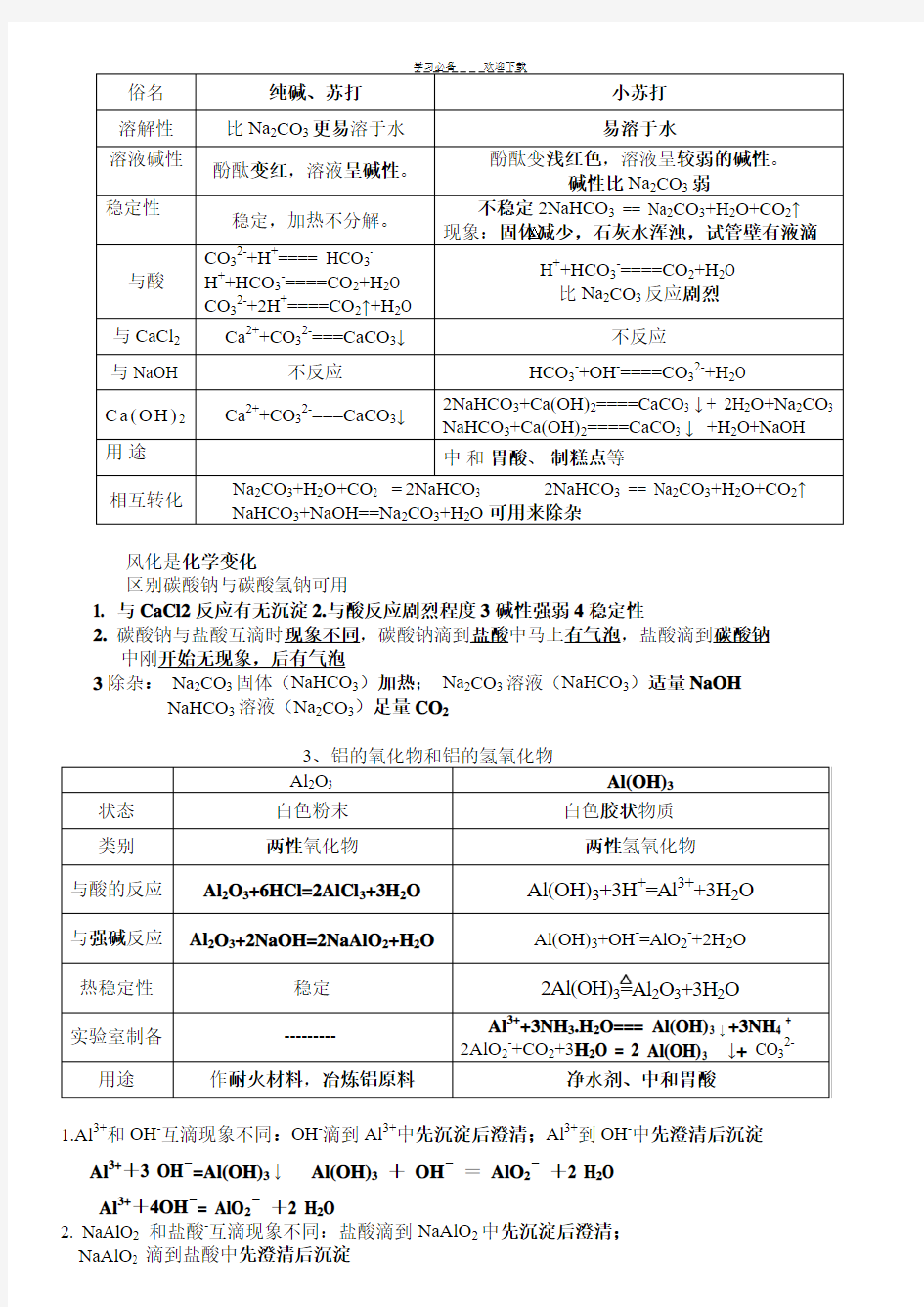
风化是化学变化
区别碳酸钠与碳酸氢钠可用
1. 与CaCl2反应有无沉淀
2.与酸反应剧烈程度3碱性强弱4稳定性
2.碳酸钠与盐酸互滴时现象不同,碳酸钠滴到盐酸中马上有气泡,盐酸滴到碳酸钠
中刚开始无现象,后有气泡
3除杂:Na2CO3固体(NaHCO3)加热;Na2CO3溶液(NaHCO3)适量NaOH NaHCO3溶液(Na2CO3)足量CO2
1.Al3+和OH-互滴现象不同:OH-滴到Al3+中先沉淀后澄清;Al3+到OH-中先澄清后沉淀
Al3++3 OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2 H2O
Al3++4OH-= AlO2-+2 H2O
2. NaAlO2和盐酸-互滴现象不同:盐酸滴到NaAlO2中先沉淀后澄清;
NaAlO2 滴到盐酸中先澄清后沉淀
AlO 2-+H ++H 2O=Al(OH)3 ↓ Al(OH)3 + 3H + = Al 3+ + 3H 2O .AlO 2-+4H + = Al 3+ + 2H 2O 2.实验室制取Al(OH)3碱须用氨水
3.铝,氧化铝,氢氧化铝与碱反应,碱必须是强碱
4.明矾的化学式KAl(SO 4)2·12 H 2O,可做净水剂原因是 Al 3+ + 3 H 2O = Al(OH)3(胶体)+ 3H + 5.焰色反应:是元素的性质,是物理变化;钠的焰色是黄色,钾的焰色是紫色(透过蓝色钴玻璃) 实验中用盐酸洗铂丝;实验步骤:烧,蘸,烧,洗
1制备Fe(OH)2注意:亚铁盐溶液必须新制,保证无氧氛围
2铁盐可做净水剂原因是Fe 3与水反应形成Fe (OH)胶体:Fe 3+ + 3 H 2O = Fe(OH)3(胶体)+ 3H + 3.合金的硬度一般高于各成分金属,熔点一般低于各成分金属;铁合金可分为生铁和钢
第三章化学反应归纳 1、钠在空气中燃烧 2Na + O 2
Na 2O 2 钠块在空气中变暗 4Na +O 2=2Na 2O
2、2Na + 2H 2O = 2 NaOH + H 2 ↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2 ↑
3、2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ 2Na 2O 2 + 2H 2O = 4Na ++4OH -+O 2↑
Na2O+H2O=2NaOH
4、2Na2O2+2CO2=2Na2CO3+O2
5、苏打(纯碱)与盐酸反应
①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl +H2O+CO2↑ CO32-+2H+=H2O+CO2↑
②纯碱溶液中滴加盐酸,至过量
Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O +CO2↑
6、2NaHCO3△Na2CO3+H2O +CO2 ↑
7、NaHCO3+NaOH = Na2CO3+H2O HCO3-+OH -=H2O +CO32-
8.Na2CO3+H2O+CO2 =2NaHCO3
9.2NaHCO3+Ca(OH)2====CaCO3 + 2H2O+Na2CO3
NaHCO3+Ca(OH)2====CaCO3 +H2O+NaOH
10.2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
1、铝箔在氧气中剧烈燃烧4Al +3O2点燃2Al2O3
2. 2Al +6HCl =2AlCl3+3H2↑ 2Al +6H+=2Al3++3H2↑
3. 2Al+2NaOH +2H2O =2NaAlO2+3H2↑2Al +2OH -+2H2O =2AlO2-+3H2↑
4. Al2O3+2NaOH 2NaAlO2+H2O Al2O3+2OH -=2AlO2-+H2O
5. Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+(NH4)2SO4 Al3++3 NH3·H2O =Al(OH)3↓+3NH4+
6.Al(OH)3+3HCl =AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O
7.Al(OH)3+NaOH NaAlO2+2 H2O Al(OH)3+OH-=AlO2-+2 H2O
2Al(OH)3=Al2O3+3H2O
8
9.Al3++3 H2O =Al(OH)3(胶体)+3H+
11.Al3++3 OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2 H2O
Al3++4OH-= AlO2-+2 H2O
12.AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O
.AlO2-+4H+ = Al3++2H2O
13.2AlO2-+CO2+3H2O=2 Al(OH)3+ CO32-
1. 高温下铁与水反应3Fe +4H2O(g) 高温Fe3O4+4H2
2. 铁与盐酸反应Fe +2HCl =FeCl2+H2↑ Fe +2H+=Fe2++H2↑
3. 氧化铁溶于盐酸中Fe2O3+6HCl =2FeCl3+3H2O Fe2O3+6H+=2Fe3++3H2O 4.Fe3O4+8H+=Fe2++2Fe3++4H2O
5.Fe2O3+3CO=2Fe+3CO2
6.FeCl3+3NaOH =Fe(OH)3↓+3NaCl Fe3++3OH -=Fe(OH)3↓
7.FeCl2+2NaOH =Fe(OH)2↓+2NaCl Fe2++2OH -=Fe(OH)2↓
8. 氢氧化亚铁在空气中被氧化4Fe (OH)2+O2+2H2O =4Fe (OH)3
9.Fe(OH)2+2HCl=FeCl2+2H2O
10.Fe(OH)3+3HCl=FeCl3+3H2O
11. 氯化亚铁溶液中通入氯气2FeCl2+Cl2=2FeCl3 2 Fe2++Cl2=2 Fe3++2Cl-
12. 氯化铁溶液中加入铁粉2FeCl3+Fe =3FeCl2 2Fe3++Fe =3Fe2+13.2Fe3++Cu=2Fe2++ Cu2+
14.3SCN- + Fe3+=Fe(SCN)3
